1001026-王_竣弘-BMC短講
advertisement
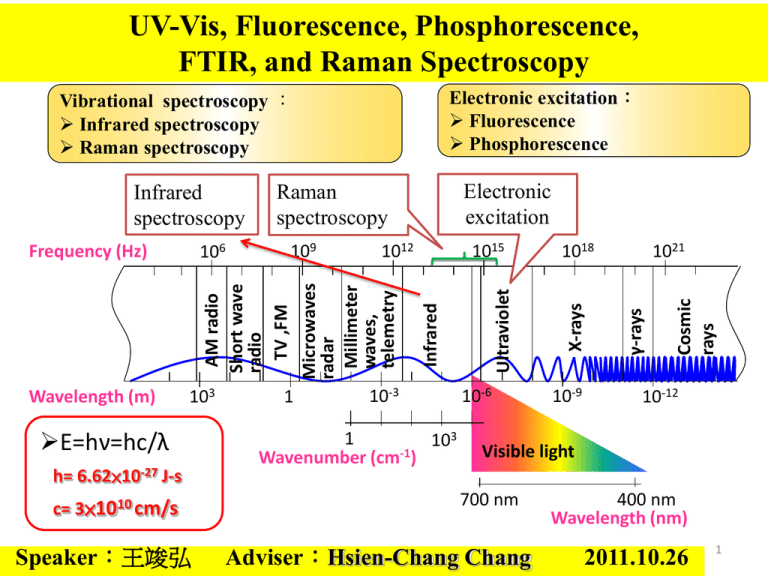
UV-Vis, Fluorescence, Phosphorescence, FTIR, and Raman Spectroscopy Electronic excitation: Fluorescence Phosphorescence Vibrational spectroscopy : Infrared spectroscopy Raman spectroscopy Wavelength (m) 103 E=hν=hc/λ h= 6.62×10-27 J-s c= 3×1010 cm/s Speaker:王竣弘 1 10-3 1 103 Wavenumber (cm-1) 10-6 10-9 1021 Cosmic rays 1018 γ-rays 1015 X-rays 1012 AM radio Short wave radio TV ,FM Microwaves radar Millimeter waves, telemetry 109 Ultraviolet 106 Frequency (Hz) Electronic excitation Raman spectroscopy Infrared Infrared spectroscopy 10-12 Visible light 700 nm Adviser:Hsien-Chang Chang 400 nm Wavelength (nm) 2011.10.26 1 光的特性 光的直進性 光的折射 光的全反射 光的色散現象 光的干涉 光徑的可逆性 光電效應 光的繞射 光子 電子 金屬 2 光譜的分類 紅外光譜 本質 可見光譜 波長 按波長區域 產生方式 紫外光譜 在一些可見光譜的紅端之外,存在著波長更長的紅外線;同樣,在紫端之外, 則存在有波長更短的紫外線。紅外線和紫外線都不能為肉眼所覺察,但可通過 儀器加以記錄。因此,除可見光譜,光譜還包括有紅外光譜與紫外光譜。 按產生本質 按產生本質,光譜可分為分子光譜(帶狀光譜)與原子光譜(線狀光譜)。 在分子中,能量電子態 > 能量振動態> 能量轉動態。因此在分子的電子態之間的 躍遷中,總是伴隨著振動躍遷和轉動躍遷的,因而許多光譜線就密集在一起而 形成分子光譜。因此,分子光譜又叫做帶狀光譜。 在原子中,當原子以某種方式從基態提升到較高的能態時,原子內部的能量增 加了,這些多餘的能量將被以光的形式發射出來,於是產生了原子的發射光 譜,亦即原子光譜。因為這種原子能態的變化是非連續量子性的,所產生的光 譜也由一些不連續的亮線所組成,所以原子光譜又被稱作線狀光譜。 3 Part 1: UV-Vis(紫外-可見分光光度法) 可見光及紫外光之燈管做為光源,通過濾光鏡調整色調後,經聚 焦後通過單色光分光稜鏡,再經過狹縫選擇波長,使成單一且特 定波長之光線,其後射入樣品管中之水樣中,再射入光電管中將 光能轉換為電器訊號。藉由樣本及空白水樣間所吸收之光能量差 與標準液之能量吸收值相比較,便可律定樣本中之待測物濃度 濾光鏡 4 Beer-Lamber Law (also known as Beer's law or the Beer–Lambert–Bouguer law ) 入 射 光 偵 測 器 A a lc A:吸收度 a : 吸收係數 l :厚度 c:濃度 I0 A log I1 I0:入射光強度 I1 :透射光強度 A log I0 a lc I1 5 Nicotinamide adenine dinucleotide (NAD+) • It is a coenzyme found in all living cells. • The compound is a dinucleotide(核苷 酸), since it consists of two nucleotides joined through their phosphate groups(磷 酸基): with one nucleotide containing an adenosine(腺苷) ring, and the other containing nicotinamide. OPO3 NADP 6 Absorbance spectra of NAD+ and NADH • The proton is released into solution, while the reductant RH2 is oxidized and NAD+ reduced to NADH by transfer of the hydride to the nicotinamide ring. RH2 + Oxidoreductase (氧化還原酶) NAD+ → NADH + H+ + R • Both NAD+ and NADH absorb strongly in the ultraviolet due to the adenine base. For example, peak absorption of NAD+ is at a wavelength of 259 nm, with an extinction coefficient of 16,900 M-1cm-1. NADH also absorbs at higher wavelengths, with a second peak in UV absorption at A 340 nm : 6.22 = 0.001 M x 1 cm x 6,220 M-1cm-1 339 nm with an extinction NADH Concentration coefficient of 6,220 M-1cm-1. 7 Direct versus coupled assays • UV light is often used, since the common coenzymes NADH and NADPH absorb UV light in their reduced forms, but do not in their oxidised forms. • An oxidoreductase using NADH as a substrate could therefore be assayed by following the decrease in UV absorbance at a wavelength of 340 nm as it consumes the coenzyme. • the coupled assay for the enzyme hexokinase, which can be assayed by coupling its production of glucose-6-phosphate to NADPH production, using glucose-6-phosphate dehydrogenase. 8 Role in redox metabolism of NAD(H) • The redox reactions catalyzed by oxidoreductases are vital in all parts of metabolism, but one particularly important area where these reactions occur is in the release of energy from nutrients. • Here, reduced compounds such as glucose are oxidized, thereby releasing energy. • This energy is transferred to NAD+ by reduction to NADH, as part of glycolysis and the citric acid cycle. 9 Part 2: 螢光、磷光 螢光: s 0 hv EX s1 s 0 hv vF 吸收光子能量,電子從基態單態激發至激發單態S1,接著以發光的形式 放出能量,電子再度回到基態。螢光態的壽命為10−8至10−5秒。 磷光: s 0 hv EX s1 T1 s 0 hv vF 吸收光子能量,電子從基態單態激發至激發單態S1,接著經由系間跨越 過程躍遷至能量較低的激發三重態T1,最後以發光的形式放出能量, 電子再度回到基態。磷光的壽命為10− 4秒到數分鐘乃至數小時不等。 10 用於對DNA進行自動測序的鏈末端終止法 在原初的方法中,需要對DNA的引子端進行螢光標記, 以便在測序凝膠板上確定DNA色帶的位置。 在改進方法中,對作為鏈終止劑的4種雙脫氧核苷酸(ddTBP) 分別進行螢光標記,電泳結束後不同長度的DNA分子彼此 分開,經紫外線照射,4種被標記的雙脫氧核苷酸發出不同 波長的螢光。通過分析螢光的光譜即可分辨出DNA的序列 採用螢光標記的鏈終止劑所得到的DNA測序圖 11 Part 3: IR system (紅外光譜法) 光譜範圍 Infrared Ultraviolet 分子不是靜的物體,它們不僅相對地在運動著, 即使在單一的分子內,其組成的原子核也隨時在改變著相對的位置。 分子內之原子核相對運動的結果, 便造成振動(vibration)或分子的旋轉(rotation)。 Near-infrared Overtone region 震動 Infrared (mid) Far-infrared vibration-rotation region 震動-旋轉 旋轉 rotation-region 12 分子運動 簡單的雙原子分子只有一種 鍵,那就是伸縮。 對稱伸縮 非對稱伸縮 剪刀式擺動 左右搖擺 上下搖擺 扭擺 更複雜的分子可能會有許多 鍵,且振動可能會共軛出現, 導致某種特徵頻率的紅外吸收 可和化學組聯繫起來。 常在有機化合物中發現的CH2 組,可藉「對稱和非對稱伸 縮」、「剪刀式擺動」、「左 右搖擺」、「上下搖擺」和 「扭擺」六種方式振動。 13 傳統(IR)與傅氏轉換紅外線光譜儀(FTIR)之原理 IR:以光柵分光來取得單頻光,再移動光柵逐步掃瞄頻率的方法。 FTIR:採用Michelson干涉儀取得干涉光譜,再轉換為頻譜。 優點可同步取得全頻光譜縮短掃瞄時間及頻率解析度的提升。 比較對一個400~4000 cm-1範圍的光譜,若解析度為1 cm-1,傳統光柵 分光儀同一時間點平均將只有1/3600的光源強度通過光柵到達偵測器, 99.97%的光都被擋在外。 Michelson interferometer 因FTIR不經過分光,同一時間可測得 所有頻率的光,不需掃瞄,節省時 間,故用傳統光譜測一樣品的時間可 取得多次的干涉光譜,加以平均而獲 得高訊號/雜訊比(S/N)的光譜。 一般傳統光譜儀 傅氏轉換紅外線光譜儀 14 麥克森干涉儀 M1 (Michelson interferometer ) M2 麥克森干涉儀,是用分光鏡(Beam Splitter)使兩光束進行方向完全不同 強度相等之一反射及一透射光束,當其再相遇時便形成干涉條紋。反 射光束從平面鏡M1反射,第二次通過分光鏡時透射而到屏幕。透射光 束從平面鏡M2反射,再由分光鏡反射而至屏幕,從鏡 M2反射之光束 並未穿透分光鏡,這一點使得它與從鏡 M1反射之光束有光程差。麥克 森干涉儀利用光波的干涉,使量測的精度提高到1/2 個波長以內。 15 楊格雙狹縫干涉 其中的d 僅有數公釐,而 r 長達1 meter,故 PS1 、 PA 、PS 2 近似平行。 16 Fourier Transform of Interferogram Multichannel 17 衰減全反射(Attenuated total reflection, ATR) • 光束以一角度由C點進入高折射率n1的介質A,當光束到達A-B介質介面時,如果入射角q大於A-B介 質介面的全反射角,光束能量將在B介質界面以指數函數衰減。若在B介質(折射率n2)上放置可吸收 光子的分子,則當光束在A介質內進行全反射的過程中則可偵測到置於B介質分子的吸收光譜,置於 B介質的分子其吸收強度隨著距離A-B界面越遠而呈指數含數遞減,此現象就稱之衰減全反射。 18 樣品處理 紅外線光譜於材料上的應用相當廣泛,例如高分子聚合物 材料、有機導電材料、清潔劑、介面活性劑等等。此外樣 品依照物理狀態或不同的環境下,所呈現的紅外線光譜也 不一樣,因此必須適當的處理樣品就能獲得正確的光譜。 氣體樣品及低沸點的液體樣品: 將低沸點的液體蒸汽或氣體樣品引入氣體槽中(gas cell)加以測定。 液體樣品: 將純液體滴在鹽片上,再用另一鹽片夾起來,放在樣品架上固定。 固體樣品: 固體樣品磨成細粉分散在液體油膏或固體粉末介質中進行測定。 19 正辛烷紅外線吸收光譜 四個吸收頻帶於:2952、1465、1380、720 cm-1。 2952 cm-1為C-H的伸縮震動。 1465 cm-1為C-H2的變型振動。 1380 cm-1為C-H3的變形振動。 720 cm-1為C-H2的搖擺振動。 20 生物分子之紅外線吸收光譜帶 21 http://mail.ypu.edu.tw/~wnhuang/Biology%20ultrared/Biology%20ultrared.htm Observations of laser scattering from the sample Incident light matter Absorption •Elastic: (Rayleigh scattering) •Inelastic: (Raman scattering) Transmitted light Scattered light 拉曼散射(Raman scattering) 瑞立散射 (Reyleigh scattering) Stokes side 激態 h(v-v’) Vibrational energy 基態 levels anti-Stokes side 激態 激態 hv 基態 拉曼散射 (Raman scattering) hv hv hv h(v + v’) 基態 22 拉曼光譜的極化誘發 μ=αE E E 0 cos 2 0 t a E 0 cos 2 0 t • E:電場 μ:誘發偶極矩 α:極化率 ν0 :電磁波頻率 E0 :電場之振幅 a a 0 ( a ) cos 2 k t • α0:平衡極化率 Δα:極化率最大改變量 則誘發偶極矩為 [a 0 ( a ) cos 2 k t ] E 0 cos 2 0 t a 0 E 0 cos 2 0 t 1 2 ( a ) E 0 [cos 2 ( 0 k ) t cos 2 ( 0 k ) t ] ※此式中的三項分別為 Rayleigh散射(ν0) anti-Stokes線(ν0+νk) Stokes線(ν0-νk) 23 inVia 24 Light Pathway of Raman System Sample 1200, 1800 Lines/mm Notch/Edge Filter 40~45 m Slit Lens 578 pixel × 385 pixel (1 pixel=22 m) Grating CCD Lens Objective 10X, 20X, 40X Prism Lens ND Filter Expander Mirror 擴束至 6 mm Laser 633, 785 nm 25 共振拉曼散射(RR) (Resonance Raman scattering) 若激發光子之波長極接近分析物電子吸收峰的波長, 其所引起的散射會使拉曼譜線強度增強,稱為共振拉 曼散射(resonance Raman scattering) 優點: 1.訊號放大,易於辨別 2.對於取得不易的試樣,即使低濃度亦可偵測 3.針對部份結構激發,突顯少數譜線,易於分析 26 表面增顯拉曼光譜 SERS(Surface-Enhanced Raman Spectroscopy) 將樣品吸附在膠態金屬顆粒(通常是金、銀或銅材質) 的表面,或著吸附在這些金屬薄片的粗糙表面上。 吸附分子的拉曼圖普通常會增強103到106。 SERS effect arises from two mechanisms: Surface Plasma Resonance EM (electromagnetic) enhancement mechanism Charge Transfer CHEM (chemical) enhancement mechanism 27 EM (electromagnetic) enhancement mechanism Surface Plasma Resonance a: radius of the metal sphere λ: wavelength of incident light Er: total electric field at a distance r from the sphere surface θ: the angle relative to the direction of the electric field Exciting laser a3 E r E 0 cos g 3 E 0 cos r a 0 . 05 r CHEM (chemical) enhancement mechanism Charge Transfer An electron transfers to the metal from HOMO. The hot electron transfers to LUMO via the metal. The electron return to its initial state and Stokes photon creation. 28 CCl4 spectrum doubly degenerate triply degenerate 218 314 fully symmetric 459 triply degenerate 758 & 786 29 紅外光譜和拉曼光譜比較 紅外光譜 拉曼光譜 產生模式 吸收光譜 散射光譜 激發光源 紅外線 紫外光~近紅外光 振動活化 偶極矩轉動 極化改變 檢測水溶液樣本 水的紅外吸收 很強,干擾大 水的拉曼散射 很弱,干擾小 30 紅外光譜 拉曼光譜 粉末 容易 容易 單晶 很難 很容易 純液體 很容易 很容易 水溶液 難 很容易 氣體 容易 難 聚合物纖維 很難 容易 化合物部分特徵 優良 優良 訊號取難易 容易 較難 31 Investigation of the Interaction between Amino Acids and Au by Surface-Enhanced Infrared Spectroscopy Reference electrode Purge gas H H Counter electrode N C O C O H H R Glycine Working electrode (Au film) Si prism Gold film on silicon film IR beam Li-Chia Chen1, Taro Uchida2, Hsien-Chang Chang1, Masatoshi Osawa2 1Institute of Biomedical Engineering, National Cheng Kung University, Tainan, Taiwan 2Catalysis Research Center, Hokkaido University, Sapporo 001-0021, Japan 32