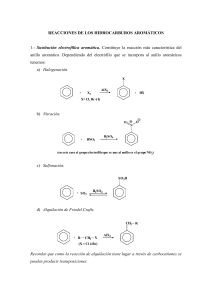
13C RMN 12C → I = 0 No observable en RMN 13C → I = ½ OBSERVABLE EN RMN Abundancia natural del 13C = 1.1% ↓ Sensibilidad ↓ INTENSIDAD DE LAS SEÑALES 13C RMN se basa en los mismos principios que 1H RMN: “utilizando una RF adecuada (o un pulso de RF) se provocan transiciones entre distintos niveles energéticos, de los núcleos de 13 C, creados al someter la muestra a un HO externo” γ ν = 2π Ho γ 13C 1H = 6.7283 = 26.7519 Las frecuencias necesarias para provocar transiciones en 13C RMN son menores que las utilizadas en 1H RMN (∼ 1/4) H0 (T) ν 1H RMN (MHz)* ν 13C RMN (MHz) 2.35 100 25.15 7.05 300 75.4 11.74 500 125.7 *Valor utilizado para referirnos al tipo de espectrómetro INFORMACIÓN FUNDAMENTAL DE LA 13C RMN: • Número de C en base al número de señales (los C químicamente equivalentes tienen el mismo desplazamiento químico) • Entorno magnético en base a los desplazamientos químicos • Número de H a los que está unido cada C (CH3, CH2, CH, C) La mayoría de las señales en 13 C RMN se encuentran entre 0 y 250 ppm a campo más bajo (↑ ↑δ) que en el TMS • Se usa el TMS como referencia • Menor probabilidad de solapamiento de señales en 13 C RMN que en H RMN (el intervalo de δ es ∼ 25 veces mayor en 13C RMN) 1 Debido a la baja abundancia del 13C: Inconveniente: se necesita más muestra y/o más tiempo para hacer un 13C RMN que para un 1H RMN Ventaja: no se observan acoplamientos 13 C-13C (↓ probabilidad de encontrar a dos 13C contiguos) y esto simplifica mucho los espectros En 13C RMN se observan: • Acoplamientos 13 C-1H a un enlace (1J) de gran magnitud 125-200Hz que complican bastante los espectros pero que permiten distinguir entre C primarios, secundarios, terciarios y cuaternarios: H c • C H H Acoplamientos t C H H d 13 C s C H C-1H a dos y tres enlaces (2J y 3J) de menor magnitud 0-20Hz (J decae rápidamente con la distancia) 1H Metilciclohexano RMN A 90MHz (CCl4) OCH 3 G M M * * I 5 líneas en 13C RMN 1H 13C RMN A 100.59MHz (CCl4) 5 Líneas: δ = 35.8, 33.1, 26.8, 26.7 y 23.1 ppm ppm RMN A 400MHz (CCl4) Desacoplamiento de hidrógeno de banda ancha (BB decoupling) Es una técnica de DR que consiste en: “irradiar la muestra con una RF intensa que cubra la ν de resonancia de todos los hidrógenos, a la vez que con otra RF se produce la resonancia de los carbonos de la muestra” Así, los H están en constante cambio entre sus estados (α α y β) y los C solo “ven” un promedio de los campos locales inducidos por los H. Resultado: • En Desaparecen los acoplamientos 13C-1H Señales de 13C singletes 13 C RMN la integral generalmente no se utiliza. La intensidad de las señales no es proporcional al número de carbonos a que corresponden en la molécula. • Cada tipo de 13 C presenta un tiempo de relajación diferente (generalmente al ↑sustitución → ↑ tR). En los 13 C RMN rutinarios algunos núcleos tienen tiempo entre pulso y pulso para relajarse (por ejemplo CH3, ↑intensidad) y otros no (por ejemplo C=O, ↓intensidad) ≠ Intensidad relativa de señales en 13C RMN Poniendo un tiempo de espera entre pulsos se soslaya este inconveniente en muchos casos, pero aumenta considerablemente el tiempo necesario para realizar un espectro. • En espectros 13 C RMN desacoplados de 1H se produce un efecto NOE sobre los C de gran intensidad (hasta 200%) pero distinto en cada tipo de Carbonos ≠ Intensidad relativa de señales en 13C RMN CH2 (tc) CH3 CH2 Br CH3 (ct) CH2 CH3 13C RMN acoplado y ampliaciones TMS ppm CH2 13C RMN desacoplado CH3 TMS ppm Ftalato de dietilo 3 4 13C O 2 5 1 C 6 C 3 O CH2 CH3 CH3 CH2 O *C3(4) RMN (CDCl , 25.2 MHz) * Acoplado O C2(5) G G CH2 CH3 CO L C1(6) ppm * G C3(4) C2(5) 13C RMN (CDCl3, 25.2 MHz) Desacoplado CH2 CH3 CO C1(6) ppm Ftalato de dietilo 3 4 2 5 O 1 C 6 C O O CH2 CH3 CH3 CH2 O 13C RMN (CDCl3, 25.2 MHz) Desacoplado con un tiempo de espera entre pulsos G * C2(5) CH2 CH3 C3(4) C1(6) CO ppm * C3(4) G 13C RMN (CDCl3, 25.2 MHz “Off Resonance” G *C2(5) CH2 CH3 CO C1(6) L ppm Este “inconveniente” de la no proporcionalidad entre el número de C y la intensidad de la señal a que dan lugar es a veces una ventaja: De la inspección de un espectro 13C RMN se pueden reconocer los C cuaternarios por su baja intensidad. Ejemplo: Ftalato de dietilo (acoplado, desacoplado, desacoplado con mayor tiempo de espera entre pulsos y “off-resonance”) Desacoplamiento “Off-Resonance” Es una experiencia de DR en la que se utiliza una ν de irradiación “fuera del rango de la resonancia del 1H (off-resonance) y con una menor intensidad de RF” De esta forma, el desacoplamiento con los H no es total, queda una “acoplamiento residual” que permite ver la multiplicidad de cada señal y por lo tanto saber cuantos H hay unidos a cada Carbono. Ejemplos: Ftalato de dietilo y 2-butanol Jresidual < Jreal espectro más sencillo que el totalmente acoplado pues, en general, existe menos solapamiento entre multipletes de distintos C El valor de la Jresidual depende de la proximidad de la señal observada a la frecuencia de irradiación Jresidual = 2πJ∆ν 2π ∆ν γH2 ∆ν = ν2−ν1 J = constante real H2= intensidad de la RF del desacoplador ν1 = ν de resonancia del protón desacoplado ν2 = ν del desacoplador CH3 CH2 CH CH3 OH CDCl3, 50MHz CH2 CH3 CH CDCl3 CH3 “Off Resonance” CH2 CH3 CH CH3 CDCl3 Acoplado CH3 CH CH3 DEPT CH2 CH3 CH CH2 CH CDCl3 Desacoplado CH3 CH3 DEPT: DISTORTIONLESS ENHANCEMENT BY POLARIZATION TRANSFER Utilizando diferentes condiciones (≠ ≠ secuencias de pulsos, con ≠ ángulos de pulso, θ) se pueden obtener: Espectros en los que solo se observan: CH ó CH2 ó CH3 Espectros en los que aparecen los tres tipos de carbonos simultáneamente pero con distinta fase: • Positivos: CH3 y CH • Negativos: CH2 En los espectros DEPT siempre están ausentes los C cuaternarios El DEPT sustituye actualmente al off resonance, generalmente se hacen: • 13 • Cuando interesa el valor de J (C,H) el totalmente acoplado C RMN totalmente desacoplado (“BB decoupling”) y DEPT Ejemplos: 2-butanol, Ipsenol y ácido neuramínico Desplazamiento químico C químicamente equivalentes Igual desplamiento químico (=δ δ) Los C diastereotópicos no son químicamente equivalentes señales ≠ CH2 Ejemplo: Ipsenol HO * H3C CH2 CH3 Diastereotópicos ≠ δ 9 IPSENOL CH2 5 6 4 HO 1 H3C 7 CH 3 8 2 2 1' CH3 Diastereotópicos ≠ δ C4 Espectro DEPT del Ipsenol CDCl3, 75.6MHz C2 C7 CH C1(1’) C2 C1(1’) C4 C7 CH3 y CH CH2 C9 C8 C6 Desacoplado C3 C5 OCH3 CH3OCO CH3 C8 C2 CH2 C3, 5, 6 y 7 CH C1 Desacoplado 8 HO 7 OH 6 5 O CH3 HO 3 O 1 C-O-CH 3 H3C-C-N 4 H O 2 OH O ÁCIDO NEURAMÍNICO. 13C RMN, D2O, 100.6MHz , δ = 10-110 ppm solamente. EXPERIMENTOS DEPT CH3 + CH CH2 C4 CH3CONH Rotación restringida Igual que en 1H RMN: H3CM O * H H3C N C 2 señales a T ambiente en 1H y 13C RMN 1 señal al aumentar T ( 125ºC) *CHCH 3 1H RMN, 90MHz t ambiente M 3 CHO *CH CHO 3 M CH3 13C RMN, desacoplado 22.6MHz, t ambiente Equilibrios ACETILACETONA, CDCl3 a temperatura ambiente O O C b C H3C c C c CH3 a a H2 lento O H O C b' C H3C c' C c' CH3 a' a' H rápido ó O H O C b' C H3C c' C c' CH3 a' a' H a’ 1H RMN a b’ b OH TMS a’ c’ c 13C RMN b’ b δC a Disolventes Se emplean los mismos disolventes deuterados que en 1H RMN. Tablas: C250-255 ó pág. 157-158 La multiplicidad que en ellos se observa se debe a acoplamientos 1J (C,D) 3 líneas ( M = 2 n I +1 = 2 x 1 x 1 + 1 = 3 ) 7 líneas Cl Cl C D O OD Cl D3C C D D S CD3 D cuadruplete con (C,F) ( M = 2 x 3 x 1/2 + 1 = 4) 1J D3C C CD3 7 líneas O F F singlete O cuadruplete con 2J (C,F) [< 1J (C,F)] C C O D F El número de señales que se observan en un espectro de 13 C RMN totalmente desacoplado nos puede indicar el tipo de sustitución en sistemas bencénicos: R 1 R 4 3 R' 6 R R R R' 6 4 R R R R 2 R' R 4 DESPLAZAMIENTO QUIMICO EN 13C RMN DE LOS COMPUESTOS ORGANICOS El orden en que aparecen los distintos carbonos en13 C RMN es similar al de aparición de los correspondientes hidrógenos en1 H RMN: ­ TMS ­ Alcanos ­ Cicloalcanos ­ Alquinos ­ Alquenos ­ Hc. Aromáticos ­ C=O Compuestos Carbonílicos δ FACTORES QUE INFLUYEN EN LOS DESPLAZAMIENTOS QUÍMICOS DE13 C Hibridación del átomo de carbono Efectos electrónicos Efectos estéricos En general la racionalización de los desplazamientos químicos de 13 C en función de efectos estructurales es más problemática que en el caso de1 H Hibridación del átomo de C δ Csp3 < Csp < Csp2 H3C CH3 7.3 HC CH 71.9 H2C CH2 123.3 128.5 Sustituyentes en posición α ejercen un efecto desapantallante independientemente de su naturaleza Excepción: átomos pesados (I y en algunos casos Br apantallamiento) Relación entre δ y la densidad de carga del C considerado ↑ en Cα α) y conjugativos Influenciada por efectos inductivos (↑ En compuestos alifáticos: • Sustituyentes en β ejercen también un efecto desapantallante, generalmente menor que cuando se encuentran en α • Sustitutyentes en γ ejercen un efecto apantallante (Efecto γ − origen estérico) Ejemplos en los que se ponen de manifiesto los efectos mencionados en distintos tipos de compuestos: Sistemas saturados: γ CH4 -2.3 β α CH3 CH2 CH2 H 15.4 15.9 15.4 CH3 CH3 7.3 CH3 CH2 CH2 CH3 13.0 24.8 24.8 CH3 CH2 CH3 15.4 15.9 CH3 CH2 CH2 NH2 11.5 27.4 44.6 CH3 CH3 CH3 CH CH CH3 19.5 35.3 CH3 CH2 CH2 OH 10.3 25.9 64.2 CH4 -2.3 CH3Cl 25.6 CH3Br 9.6 CH3I -24.0 CH2Cl2 54.0 CH2Br2 21.4 CH2I2 -54.0 CHCl3 77.2 CHBr3 12.1 CHI3 -139.9 CCl4 96.1 CBr4 -28.7 CI4 -292.5 -2.8 22.9 25.6 27.1 Alquinos y derivados HC 80.4 HC C CH3 CH 71.9 CH3 68.3 10.6 10.8 Alquenos y derivados 136.2 115.9 126.1 CH3 18.7 152.7(-I) H2C CH2 O ¨ (+K)84.4 123.3 120.8 CH2 C N 137.1 (-K)128.0 117.2 114.7 CH3 52.5 122.4 ¨ C Br 85.2 CH3 25.7 O Cl 130.3 197.5 I 196.9 Compuestos aromáticos O 159.9 O CH3 54.7 C CH3 27.6 137.4 114.1 128.6 128.4 129.5 128.5 120.8 Cl 133.8 132.9 I 97.3 128.9 130.1 129.9 127.4 126.6 107.7 109.9 135.9 123.7 N 137.4 149.8 O 143.0 126.4 S 124.9 N H 118.0 CORRELACIONES EMPÍRICAS ALCANOS (Tablas: C5-C46 ó pág. 71-81) En 1H RMN los distintos H de un hidrocarburo saturado aparecen en un rango de desplazamiento químico muy pequeño (0.8-2.0ppm) espectros complejos con señales solapadas que no son de 1er orden (↓ ↓ ∆ν) ∆ν En 13 C RMN es más raro que se produzca solapamiento de señales, suelen aparecer bien definidas las señales correspondientes a cada tipo de carbono Ejemplos: 1H RMN y 13C RMN del metilciclohexano y del octano El desplazamiento químico en 13 C RMN de alcanos depende del número de átomos de C que hay en las posiciones α, β, γ, δ, ε,... y del grado de ramificación en la posición contigua al C considerado. Los δ de estos compuestos se pueden predecir con reglas empíricas. Para un Ci en un alcano, el desplazamiento químico en unidades de δ se calcula según: δCi = - 2.3 + 9.1nα + 9.4nβ - 2.5nγ + 0.3nδ + 0.1nε + Σ Sij n nº de C en α , β, γ, δ, ε respecto a Ci S ij corrección estérica (tiene en cuenta la ramificación) (Tabla C15 ó pág. 79) Ejemplo: 1 H3C 1 H3C 2 CH 3 CH2 4 CH3 δC1 = – 2.3 + 9.1 x 1 + 9.4 x 2 – 2.5 – 1.1 = 22.0ppm (δ δexp = 22.3) S: 1ario con Cα 3ario δC2 = – 2.3 + 9.1 x 3 + 9.4 x 1 – 3.7 = 30.7ppm (δ δexp = 30.1) S: 3ario con Cα 2ario δC3 = – 2.3 + 9.1 x 2 + 9.4 x 2 – 2.5 = 32.2ppm (δ δexp = 32.0) S: 2ario con Cα 3ario δC4 = – 2.3 + 9.1 x 1 + 9.4 x 1 – 2.5 x 2 + 0 = 11.2ppm (δ δexp = 11.8) S: 1ario con Cα 2ario Alcanos sustituidos (Tabla C10-C15 ó pág. 78-79) δCi = -2.3 + Σ Zi + Σ Sj + Σ Kk j i k Zi correcciones para sustituyentes en distintas posiciones α, β, γ, δ S corrección estérica K corrección de conformación para sustituyentes en γ d Ejemplo: N-terc-butoxicarbonilalanina H3C H3C CH3 Cc O O C b CH3 aCH NH C O OH δCa = – 2.3 + 9.1 + 20.1 + 28.3 + 2.0 + 0.3 – 3.7 + 0.0 = 53.8ppm (δ δexp = 49.0) S: 3ario con Cα 1ario y Nα 2ario δCb = – 2.3 + 9.1 + 2.0 + 11.3 – 2.8 – 1.1 = 16.2ppm (δ δexp = 17.3) S: 1ario con Cα 3ario δCc = – 2.3 + 3 x 9.1 + 56.5 – 5.1 + 0.3 – 3 x 1.5 = 72.2ppm (δ δexp = 78.1) S: 4ario con 3Cα 1ario δCd = – 2.3 + 9.1 + 2 x 9.4 + 6.5 + 0.0 – 3.4 = 28.7ppm (δ δexp = 28.1) S: 1ario con Cα 4ario 13C RMN CH2 CH2 CH2 CH3 CH2 CH2 CH2 CH2 CH2 CH2 CH3 CH3 OCTANO 1H 6 CH2 RMN 2 CH3 13C CH3 RMN CH3 CH3 CH CH2 CH3 2-METILBUTANO CH CH2 CH3 ALQUENOS δC=C 80-160ppm (Tablas C80-C96 o pág. 82-87) Alquenos alquilsustituidos (C85 ó pág. 82-83) Cγγ − Cβ β − Cα α − C1 = C2 − Cα α’ − Cβ β ’ − Cγγ’ δCsp2 = 123.3 + 10.6nα α + 4.9nβ β - 1.5nγγ - 7.9nα α’- 1.8nβ β ’ + 1.5nγγ’ + Σ S H3C Ejemplo: cis-4-metil-2-penteno H3C a b CH CH3 C C H H δCa = 123.3 + 10.6 x 1 – 7.9 x 1 – 1.8 x 2 – 1.1 = 121.3ppm (δ δexp = 121.8) α y α’ en cis δCb = 123.3 + 10.6 x 1 + 4.9 x 2 – 7.9 x 1 – 1.1 + 2.3 = 137.0ppm (δ δexp = 138.8) 2R en β Alquenos sustituidos (C90 ó pág. 83-84) X 1 CH 2 CH δCi = 123.3 + Σ Zi Y Ejemplo: 1-Bromo-1-propeno b a Br CH CH CH3 δCa = 123.3 + (– 8.6) + (– 7.4) = 107.3ppm (δ δexp = 108.9 cis, 104.7 trans) δCb = 123.3 + (– 0.9) + 12.9 = 135.3ppm (δ δexp = 129.4 cis, 132.7 trans) ALQUINOS (Tablas C110 ó pág. 88) Ejemplo: But-2-in-1-ol X a CH2 C b C a C b C Y CH3 OH δCa = 71.9 + 11.1 + (– 3.6) = 79.4ppm δCb = 71.9 + 1.9 + 8.5 = 82.3ppm COMPUESTOS ALICICLICOS (Tablas C47-C75, C100-C105 ó pág. 90-95) H Br C C H H3C CH CH3 CH Trans-1-bromo-1-propeno H H C C Br H3C CH Cis-1-bromo-1-propeno CH3 CH CH H2 H3C C C CH2 OH 2-Butin-1-ol CH H3 C C HIDROCARBUROS AROMÁTICOS (Tablas C115-C130 ó pág. 96-103) 3 δCi = 128.5 + ΣZi 2 1 4 i 5 X 6 Ejemplo: 3,5-Dimetilnitrobenceno NO2 (C120-125 ó pág. 97-99) 1 6 2 5 3 H3C CH3 4 δC1 = 128.5 + 19.9 + 2 (– 0.1) = 148.2ppm (δ δexp = 148.5) δC2 = δC6 = 128.5 + (– 4.9) + 0.7 + (– 3.0) = 121.3ppm (δ δexp = 121.7) δC3 = δC5 = 128.5 + 0.9 + 9.2 + (– 0.1) = 138.5ppm (δ δexp = 139.6) δexp = 136.2) δC4 = 128.5 + 6.1 + 2 x 0.7 = 136.0ppm (δ Ejemplo: 1-Metil-2-naftol (C126-127 ó pág. 100-101) 8 7 6 5 CH3 9 10 1 2 OH 3 4 δC1 = 128.0 + (– 18.6) + 6.0 = 115.4ppm δC6 = 125.9 + (– 2.4) + (– 0.7) = 122.8ppm δC2 = 125.9 + 27.3 + 0.5 = 153.7ppm δC7 = 125.9 + 0.5 + (– 0.5) = 125.9ppm δC3 = 125.9 + (– 8.3) + 0.6 = 118.2ppm δC8 = 128.0 + (– 1.7) + (– 4.1) = 122.2ppm δC4 = 128.0 + 1.8 + (– 1.8) = 128.0ppm δC9 = 133.6 + 0.9 + (– 1.1) = 133.4ppm δC5 = 128.0 + (– 0.3) + 0.3 = 128.0ppm δC10 = 133.6 + (– 4.7) + (– 0.2) = 128.7ppm NO2 6 1 5 H3C C2(6) 2 3 4 CH3 C3(5) C4 CH3 5-Nitrometaxileno C1 COMPUESTOS HETEROAROMÁTICOS (Tablas C135-C166 ó pág. 104-111) δC2 = 149.8 + Σ Zi2 δC3 = 123.7 + Σ Zi3 δC4 = 135.9 + Σ Zi4 δC5 = 123.7 + Σ Zi5 δC6 = 149.8 + Σ Zi6 4 Piridinas 5 (C140-145* ó pág. 105-107) 6 3 N 2 Ejemplo: 2,5-Dimetilpiridina H3C 5 6 4 2 N δC2 = 149.8 + 8.6 + (– 2.3) = 156.1ppm ( δexp = 155.2) 156.3* δC3 = 123.7 + (– 0.5) + (– 0.9) = 123.2ppm ( δexp = 122.3) 122.2* δC4 = 135.9 + 0.3 + 0.0 = 136.2ppm ( δexp = 136.7) 136.1* δC5 = 123.7 + (– 3.0) + 8.9 = 129.6ppm ( δexp = 129.6) 129.6* δC6 = 149.8 + (– 0.7) + 1.3 = 150.4ppm ( δexp = 149.4) 150.7* H3C C6 C C3 4 5 6 4 3 2 N CH3 2,5-dimetilpiridina C2 C5 3 H3C CH3 CH3 Ejemplo: 2-Amino-5-metilpiridina H3C 5 6 4 3 2 N NH2 δC2 = 149.8 + 8.4 + (– 2.3) = 155.9ppm (δ δexp = 156.9) 158.8* δC3 = 123.7 + (– 15.1) + (– 0.9) = 107.7ppm (δ δexp = 108.4) 108.1* δC4 = 135.9 + 1.8 + 0.0 = 137.7ppm (δ δ exp = 138.6) 138.2* δC5 = 123.7 + (– 9.7) + 8.9 = 122.9ppm (δ δexp = 122.5) 122.0* δC6 = 149.8 + (– 1.6) + 1.3 = 149.5ppm (δ δexp = 147.6) 150.2* C6 C3 C4 C5 H3C 5 6 4 3 2 N NH2 2-amino-5-metilpiridina CH3 C2 DERIVADOS HALOGENADOS (Tablas C167-C169 ó pág. 112-116) ALCOHOLES, ÉTERES Y COMPUESTOS RELACIONADOS (Tablas C170-C173 ó pág. 117-120) COMPUESTOS NITROGENADOS (Tablas C174-C179 ó pág. 121-127) COMPUESTOS CON AZUFRE (Tablas C179-C182 ó pág. 128-132) COMPUESTOS CARBONÍLICOS (Tablas C183-C204 ó pág. 9 y 133-143) OTROS COMPUESTOS (Tablas C215 ó pág. 144-147) PRODUCTOS NATURALES (Tablas C205-C212 ó pág. 148-156) DISOLVENTES Y COMPUESTOS DE REFERENCIA (Tablas C250-C265 ó pág. 157-160) ACOPLAMIENTOS EN 13C RMN ACOPLAMIENTO 13C-1H (Tablas C220-C225-C230-C235-C240 ó pág. 80-81, 86-87, 89, 95, 102-103,111) 13 H C 1 J (C,H) Su valor es siempre positivo y tanto mayor cuanto mayor es el carácter s del átomo de C involucrado. H3C CH3 H2C CH2 C6H6 HC CH 1J(C,H)[Hz] 129.4 156.5 158.5 249.0 Hibridación sp3 sp2 sp2 sp Los sustituyentes electronegativos aumentan el valor de 1 J(C,H) electropositivos lo disminuyen X 13CH -X 3 F OH CH3 Li H C C 1J(C,H)[Hz] H 149.1 141.0 124.9 98.0 1J(C ,H)[Hz] 1 H H 156.5 F 200.2 En bencenos monosustituidos hay 3 1J(C,H) distintas: J(C2,H2) = 1J(C6,H6) 2 1 1 J(C3,H3) = 1J(C5,H5) 1 J(C4,H4) X 3 1 4 6 5 y el efecto del sustituyente R sobre la 1J(C,H) disminuye con la distancia y los 2J (C,H) (Jgeminal) 13 H C C Su valor depende, entre otros, de los siguientes factores: • La sustitución en los carbonos • La incorporación, o no, de los carbonos a cadenas o anillos • El tipo de enlace (sencillo, doble o triple) entre los dos carbonos : 1 - 20Hz Valores más frecuentes: 2J O 3J (C,H) (Jvecinal) H C C H 40-60Hz 20-50Hz C 13 H C C C Varían en el rango: 0 → 10Hz En cada caso su valor depende, entre otros, de los siguientes factores: • Ángulo diedro, igual que 3J(H,H) Para φ = 0º y 180º se dan los valores mayores de 3J(C,H) = 7-9Hz Para φ = 90º → 3J(C,H) = 0Hz Se sigue cumpliendo 3J(C,H) 180º > 3J(C,H) 0º • Longitud de enlace • Electronegatividad de los sustituyentes 7.6Hz Ejemplo: en derivados etilénicos: Jtrans > Jcis H3C 5.0Hz H C C H H 12.4Hz J (C,H) en derivados bencénicos (No suelen detectarse acoplamientos C,H a más de 3 enlaces salvo en sistemas con enlaces π conjugados) • En el benceno hay cuatro tipos de J(C,H): 1J(C,H), 2J(C,H), 3J(C,H) y 4J(C,H) • En un benceno monosustituido hay 16 tipos de J(C,H) (excluyendo acoplamientos con sustituyentes): • 3 1 5 2 5 3 5.0 → 11.1Hz 3 4 - 0.9 → - 2.0Hz J(C,H) J(C,H) 3 H 2J - 3.4 → 1.6Hz J(C,H) J(C,H) 1J 161.4 → 164.9Hz 4J H 3J H H 2 Siempre se cumple: J(C,H) > J(C,H) ACOPLAMIENTOS 13C-13C En compuestos con 1.1% de 13C (abundancia natural) solo se observan: Con grandes cantidades de muestra y tiempos de acumulación prolongados En muestras enriquecidas con 80-90% de 13 C se pueden medir J(C,C). Las 1J(C,C) son las de mayor magnitud, su valor aumenta con el carácter s de los carbonos: Compuesto Etano Etileno Acetileno 1J(C,C)[Hz] 34.6 67.6 171.5 ACOPLAMIENTOS CON OTROS NÚCLEOS Los más importantes son: • Con 19 F y 31 P por su gran abundancia natural. (Tablas C245 ó pág. 112-113 y 145- 147) Ejemplos: F 1J(C1,F) 2 F 1 3 3 4 = 163.3Hz 2J(C2,F) = 19.5Hz 3J(C3,F) = 6.7Hz 1 6 2 5 3 1J(C1,F) = 245.1Hz 2J(C2,F) = 21.0Hz 3J(C3,F) = 7.8Hz 4J(C4,F) = 3.2Hz 4 1 P 2 1J(C1,P) = 10.9Hz 2J(C2,P) = 15Hz P O 1 3J(C3,P) = 12.5 6 4J(C4,P) = 0.0Hz 5 2 3 4 • Acoplamientos con D en compuestos deuterados Ejemplos: O CDCl3 2J (C,D) Hz 31.5 D3C C O CD3 19.5 D3C S CD3 22.0 1J(C1,P) = 104Hz 2J(C2,P) = 10Hz 3J(C3,P) = 12Hz 4J(C4,P) = 3Hz EJEMPLO DE ASIGNACION EN UN ESPECTRO DE 13C RMN H C 1 p-Metoxibenzaldehído O 2 6 3 5 4 H3C O En el espectro totalmente desacoplado (“BB decoupled spectra”) hay 6 señales: • El C del CHO a campo bajo ( ↑δ ) • El C del CH3O a campo alto (↓δ ) • Dos picos pequeños de los 2C cuaternarios aromáticos C1 y C4 • Dos picos grandes que corresponden cada uno a dos C aromáticos C2+C6 y C3+C5 C3(5) C2(6) CH3O CHO C4 C1 d El espectro “Off-resonance” confirma lo anterior H O s C 1 C2(6) (d) 6 C3(5) (d) CH3 (c) 2 3 5 4 H3C CHO (d) d O s d c C4 (s) C1 (s) Las tablas permiten calcular los valores teóricos de δ y correlacionar los picos del espectro con los distintos C de la molécula δC1 = 128.5 + 8.2 + (-7.7) = 129.0ppm δexp ≈ 130ppm δC2 = δC6 = 128.5 + 1.2 + 1.0 = 130.7ppm δexp ≈ 133ppm δC3 = δC5 = 128.5 + 0.5 + (-14.4) = 114.6ppm δexp ≈ 115ppm δC4 = 128.5 + 5.8 + 31.4 = 165.7ppm (167.8)n δexp ≈ 165ppm δC* = 192.0ppm δexp ≈ 191ppm • δC = 56.0ppm (54.8) Tablas utilizadas: δexp ≈ 56ppm C10-C15 ó pág. 78-79 para Csp3 (C30-C35 ó pág. 72-73 para CH3) C120-C125 ó pág.97-99 para Carom. C186 ó pág. 9 para C Volver a página docente