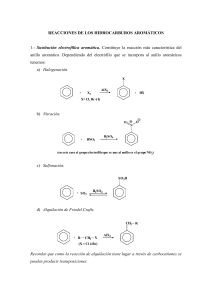
Química Orgánica: Introducción, Hidrocarburos, Isomería
advertisement

Tema 10: Química Orgánica Ñ Introducción Ñ Hidrocarburos Ñ Isomería Ñ Grupos funcionales Ñ Principales reacciones orgánicas Ñ Bioquímica (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Introducción Ñ La Química Orgánica o Química del carbono es la rama de la Química q que estudia los compuestos p orgánicos. g Ñ Compuestos orgánicos: sustancias químicas que contienen carbono formando enlaces covalentes C-C o C-H, excepto los carburos, carbonatos y óxidos de carbono. Ñ En muchos casos contienen oxígeno, g , nitrógeno, g , azufre,, fósforo,, boro, halógenos y otros elementos. Ñ Átomo de carbono: 4 electrones en su capa de valencia → gran cantidad de compuestos orgánicos. Ñ Las energías g de los enlaces C-C y C-H son superiores p a la mayor y parte de energías de enlace C-X (salvo C-O y C-F), lo cual explica la estabilidad de las cadenas carbonatadas y de los enlaces C-H. (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Hidrocarburos Ñ La molécula orgánica más sencilla es el metano (CH4), pero también puede darse la unión C-C C C, formando cadenas de distintos tipos, con enlaces simples, dobles o triples. Ñ Ejemplos: H H C H CH2 H3C CH2 CH2 CH3 (Fundamentos de Química, Grado en Física) C C H H H C H3C CH2 H C C H CH2 HC C CH3 C H Química Orgánica 2010/2011 Hidrocarburos Ñ Los hidrocarburos son compuestos que contienen únicamente enlaces C-C, C=C, C≡C o C-H, y pueden ser: Alifáticos: • Saturados: enlaces covalentes simples → alcanos • Insaturados enlaces covalentes dobles → alquenos enlaces covalentes triples → alquinos Aromáticos: contienen anillos aromáticos (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Hidrocarburos Nomenclatura Ñ Las “reglas reglas de la IUPAC IUPAC” (International Union of Pure and Applied Chemistry), que sistematizan la nomenclatura de los compuestos orgánicos, se basan en los nombres dados a los alcanos. Alcanos no ramificados: cadena lineal de átomos de carbono • El número de átomos de carbono de la cadena se indica con los prefijos: met- (1) , et- (2), prop- (3), but- (4), pent- (5), hex- (6), hept(7), oct- (8), non- (9), dec- (10), … • Terminación: -ano CH2 CH2 H3C CH2 (Fundamentos de Química, Grado en Física) CH3 CH2 hexano o n-hexano Química Orgánica 2010/2011 Hidrocarburos Nomenclatura Al Alcanos ramificados: ifi d tienen, ti además, d á cadenas d llaterales t l • Las cadenas laterales se tratan como sustituyentes (átomos o grupos que han sustituido a átomos de hidrógeno) unidos a esqueletos carbonados no ramificados. • El esqueleto q carbonado está constituido p por la cadena de átomos de carbono no ramificada más larga, y se nombra según las reglas de alcanos no ramificados. CH3 CH3 CH2 CH3 C CH CH2 CH3 pentano CH3 (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Hidrocarburos Nomenclatura • Los L sustituyentes tit t se nombran, b en orden d alfabético, lf béti como ell alcano l d dell que derivan, cambiando la terminación -ano por -il. CH3 metilo CH3 metilo etilo CH3 CH2 C CH CH2 CH3 CH3 • La posición de cada sustituyente se indica, si es necesario, mediante el número correspondiente p al carbono al q que está unido. La numeración de los carbonos del esqueleto se hace empezando por el extremo que produzca una numeración más baja. (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Hidrocarburos Nomenclatura • Si h hay varios i sustituyentes tit t d de lla misma i clase, l se utilizan tili llos prefijos fij didi (2), (2) tri- (3), tetra- (4), etc. CH3 CH3 CH2 CH3 1 C 2 CH CH2 CH3 3 4 2,2-dimetil-3-etilpentano 5 CH3 (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Hidrocarburos Nomenclatura Ci l l Cicloalcanos: l át los átomos d de carbono b fforman uno o varios i anillos. ill • Se nombran como los alcanos no cíclicos, anteponiendo el prefijo ciclo-. ciclopentano 1,1-dimetil-3-etilciclooctano (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Hidrocarburos Nomenclatura Alquenos y alquinos: • Se nombran como el alcano correspondiente, cambiando la terminación -ano por -eno o -ino, respectivamente. • Cuando sea necesario, se indicará la posición de los dobles o triples enlaces. • Si hay más de un doble o triple enlace, la terminación será -dieno (2 =), -diino (2 ≡), -trieno (3 =), -triino (3 ≡), -dienino (2 = y 1 ≡), -enodiino (1 = y 2 ≡), etc. H3C H C H C CH2CH3 1-buten-3-ino 2-penteno (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Hidrocarburos Nomenclatura Hid Hidrocarburos b aromáticos: áti • Muchos tienen nombres comunes derivados de su origen natural. • El nombre sistemático se obtiene considerando los compuestos como bencenos sustituidos. 1,2-dimetilbenceno 1 2 dimetilbenceno o o-dimetilbenceno 1,3-dimetilbenceno 1 3 dimetilbenceno o m-dimetilbenceno (Fundamentos de Química, Grado en Física) 1,4-dimetilbenceno 1 4 di ilb o p-dimetilbenceno Química Orgánica 2010/2011 Isomería Ñ Isómeros: moléculas con la misma fórmula química pero con distinta estr estructura ct ra molec molecular lar y, por tanto, t t con diferentes dif t propiedades. Ñ Por ejemplo, el etanol y el éter dimetílico son isómeros cuya fórmula molecular es C2H6O. O CH2 OH H3C H3C F H F H H H3C H H3C CH3 Ñ Ejemplo: (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Isomería ÑTipos de isómeros: ¾ Isómeros estructurales: diferente distribución de los enlaces entre sus átomos. O CH2 H3C ¾ OH H3C CH3 (C2H6O) Isómeros espaciales o estereoisómeros: sus átomos presentan la misma distribución, pero su disposición en el espacio es distinta. • Diastereoisómeros • Enantiómeros o isómeros ópticos (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Isomería ÑDiastereoisómeros: los isómeros no son superponibles pero tampoco p son imagen g especular p uno del otro. • Isómeros cis-trans H3C F H F H H H3C H cis-1-fluoro-1-propeno trans-1-fluoro-1-propeno • Isómeros conformacionales: presentan distintas conformaciones, es decir, diferentes disposiciones espaciales de los átomos como consecuencia de la rotación en torno al enlace (simple). H3C • Etc. CH3 CH3 H3C CH3 CH3 (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Isomería ÑEnantiómeros o isómeros ópticos: los isómeros son imagen especular p uno de otro. COOH H F NH2 COOH F H2N H Pueden darse cuando hay al menos un átomo de carbono asimétrico o quiral (con cuatro sustituyentes diferentes). Presentan las mismas propiedades físicas y químicas pero se diferencian en que desvían el plano de la luz polarizada en diferente dirección (isómeros R y L). L) Mezcla racémica: contiene cantidades iguales de los dos enantiómeros y es, por tanto, ópticamente inactiva. (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Grupos funcionales Ñ Los compuestos orgánicos pueden contener grupos funcionales: estructuras submoleculares, caracterizadas por una conectividad y composición elemental específica que confiere cierta reactividad a la molécula que los contiene. H3C HOOC O OH O CH CH CH2 C NH2 O O C CH2-CH2 H (Fundamentos de Química, Grado en Física) C OCH2CH3 Química Orgánica 2010/2011 Grupos funcionales Grupo funcional Serie homóloga Fórmula Grupo hidroxilo Alcohol -OH Grupo alcoxi (o ariloxi) Éter R-O-R’ Estructura O R H O R R' Prefijo Sufijo hidroxi- -ol oxi- R-il R'-il éter formil- -al -carbaldehído oxo- -ona carboxi- ácido -ico O Grupo carbonilo Aldehído R-C(=O)H C R H O Grupo carbonilo Cetona R-C(=O)-R' C R R' R O Grupo carboxilo Ácido carboxílico R-COOH C R (Fundamentos de Química, Grado en Física) OH Química Orgánica 2010/2011 Grupos funcionales Grupo funcional Serie homóloga Fórmula Estructura Prefijo Sufijo -iloxicarbonil- R-ato de R'-ilo amino- -amina carbamoil- -amida ciano- -nitrilo O Grupo acilo Éster R-COO-R' C R OR' R Grupo amino Amina R-NR2 N R' R'' O Grupos amino y carbonilo Amida R-C(=O)N(R R')-R" C N R'' R' Grupo nitrilo Nitrilo o cianuro R-CN (Fundamentos de Química, Grado en Física) R C N Química Orgánica 2010/2011 Grupos funcionales Ñ Si hay varios grupos funcionales, el primero que aparezca en la siguiente lista es el grupo principal: ácido > éster > amida > nitrilo > aldehído > cetona > alcohol > amina > éter Ñ El grupo principal fija la terminación del nombre (-oico, -ona, -ol, etc.)) y los demás grupos no principales se nombran como etc sustituyentes, mediante el prefijo correspondiente (amino-, hidroxi-, etc.). H3CH2C H3C HOOC O OH CH CH OOC (CH2)2 COO CH2CH3 butanodiato de dietilo CH2 CH2 COOH ácido 3-hidroxi-2-metiloxihexanodioico (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Reacciones orgánicas Ñ Los tres tipos principales de reacciones orgánicas son: ADICIÓN • Adición a alquenos (C=C) y alquinos (C≡C) - Adición electrófila - Polimerización (autoadición) - Cicloadición • Adición a grupos carbonilo (C=O) ELIMINACIÓN SUSTITUCIÓN • Sustitución por radicales libres • Sustitución nucleófila • Sustitución electrófila (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Reacciones orgánicas REACCIONES DE ADICIÓN Ñ Reacciones R i en las l que se transforman t f enlaces l múltiples últi l en sencillos. Ñ Principales reacciones de adición: Adición a alquenos (C=C) y alquinos (C≡C) • Adición electrófila • Polimerización (autoadición) • Cicloadición Adición a grupos carbonilo (C=O) (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Reacciones orgánicas Adición a alquenos y alquinos Adición electrófila: se produce por ataque de un electrófilo (H+, NO+, etc.) al enlace múltiple. H H C H + C HBr H H (Fundamentos de Química, Grado en Física) H H C C H + Br− H Química Orgánica H H H C C Br H H 2010/2011 Reacciones orgánicas Adición a alquenos y alquinos Si el alqueno no es simétrico, simétrico la reacción puede dar lugar a dos isómeros. Normalmente se cumple la regla de Markovnikoff: en la adición de un reactivo del tipo H-X a un alqueno o alquino, el hidrógeno se une al carbono con mayor número de átomos de hidrógeno hidrógeno, y el grupo X se une al carbono con el menor número de átomos de hidrógeno. H C H3C Br H H + C HBr H (Fundamentos de Química, Grado en Física) H C C H + H H Br C C CH3 H CH3 H 90% 10% Química Orgánica H 2010/2011 Reacciones orgánicas Adición a alquenos y alquinos Polimerización de alquenos: pueden ser consideradas como reacciones de autoadición: Cicloadición: formación de un ciclo por adición a enlaces múltiples. (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Reacciones orgánicas Adición a grupos carbonilo El electrófilo se une al oxígeno y el nucleófilo al carbono: OH R C O + R'−OH R R C OR' R CN H C O + HCN H3C (Fundamentos de Química, Grado en Física) H C OH CH3 Química Orgánica 2010/2011 Reacciones orgánicas REACCIONES DE ELIMINACIÓN Ñ Son S reacciones i iinversas a llas d de adición: di ió dos d sustituyentes tit t son eliminados de una molécula, creándose una insaturación (doble o triple enlace) o un anillo. (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Reacciones orgánicas REACCIONES DE SUSTITUCIÓN Ñ Se S sustituye tit un átomo át o grupo por otro. t Ñ Dependiendo del tipo de reactivo que lleva a cabo la sustitución, se clasifican en: Sustitución por radicales libres Sustitución nucleófila Sustitución electrófila (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Reacciones orgánicas Sustitución por radicales Ñ Reacción de sustitución que involucra radicales como intermedios de reacción. Ñ Tienen lugar en varios procesos elementales, que se pueden englobar en tres etapas: iniciación, propagación y terminación. (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Reacciones orgánicas Sustitución por radicales CH4 + Cl2 → CH3Cl + HCl Cl iniciación Cl 2 Cl H H C H H + Cl H C + HCl propagación H H H H H C + Cl H (Fundamentos de Química, Grado en Física) Cl H C Cl + Cl H Química Orgánica 2010/2011 Reacciones orgánicas Sustitución por radicales 2 Cl Cl H C H terminación H + Cl H H H C H + C Cl H H H Cl C H (Fundamentos de Química, Grado en Física) H H H H C C H H Química Orgánica H 2010/2011 Reacciones orgánicas Sustitución nucleófila R-L + Nu: → R-Nu + L: Ñ Un nucleófilo reemplaza a un átomo o grupo (grupo saliente) unido a un carbono electrófilo. Ñ En el caso de haluros de alquilo, pueden darse dos posibles mecanismos de reacción: • SN1: sustitución nucleófila unimolecular • SN2: sustitución nucleófila bimolecular (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Reacciones orgánicas Sustitución nucleófila Ñ Ejemplo : CH3Cl + NaOH → CH3OH + NaCl SN1 SN2 En este caso, la cinética de reacción es de segundo orden, por lo que se puede concluir que el mecanismo es SN2. (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Reacciones orgánicas Sustitución electrófila Ñ La más importante p es la sustitución electrófila aromática: un átomo,, normalmente hidrógeno, unido a un sistema aromático es sustituido por un grupo electrófilo. 1. El electrófilo (E) reacciona con un par de electrones del sistema aromático, lo que conduce a la formación de un carbocatión ciclohexadienilo. X 2. La base conjugada del ácido de Lewis (X−), arranca el protón del carbono que sufre el ataque electrófilico, y se recupera la aromaticidad. (Fundamentos de Química, Grado en Física) Y Química Orgánica 2010/2011 Bioquímica Ñ La Bioquímica estudia la composición química de los seres vivos, y las reacciones químicas que se producen en las biomoléculas (metabolismo), que les permiten obtener energía (catabolismo) y generar biomoléculas propias (anabolismo). Ñ Las biomoléculas están compuestas por seis elementos que constituyen del 95 al 99% de los tejidos vivos (C, H, O, N, S, y P) y se clasifican en cuatro grandes grupos: Lípidos Glúcidos Proteínas Ácidos nucleicos (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Bioquímica LÍPIDOS Ñ Compuestos p p principalmente p p por C e H y en menor medida O, aunque también pueden contener P, S y N. Ñ Característica principal: carácter anfipático. Ñ Cumplen p funciones diversas en los organismos vivos, entre ellas la de reserva energética (triglicéridos), la estructural (fosfolípidos de las bicapas) y la reguladora (esteroides), y también participan en el desarrollo de la materia gris, gris el metabolismo y el crecimiento. (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Bioquímica LÍPIDOS Ñ Ejemplos: j p colesterol testosterona (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Bioquímica GLÚCIDOS Ñ Los glúcidos, glúcidos carbohidratos, carbohidratos hidratos de carbono, carbono sacáridos o azúcares son moléculas orgánicas compuestas por C, H y O. Ñ En la naturaleza se encuentran en los seres vivos, formando parte de biomoléculas aisladas o asociadas a otras como las proteínas y los lípidos. Ñ Son la forma biológica primaria de almacenamiento y consumo de energía. Ñ Son solubles en agua. Ñ Se clasifican en: monosacáridos, monosacáridos disacáridos disacáridos, oligosacáridos y polisacáridos. (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Bioquímica Monosacáridos Poseen un grupo carbonilo en uno de sus átomos de C y grupos hidroxilo en el resto. Son la principal fuente de combustible para el metabolismo, tanto como fuente de energía directa (la glucosa es la más importante) y también en biosíntesis. Cuando no se necesitan para aplicación directa, se almacenan en otra forma, como los polisacáridos. Ejemplos: glucosa, fructosa, … fructosa (Fundamentos de Química, Grado en Física) glucosa Química Orgánica 2010/2011 Bioquímica Disacáridos Glúcidos formados por dos moléculas de monosacáridos unidos mediante un enlace glucosídico: reacción de deshidratación que implica la pérdida de un átomo de H de un monosacárido y un grupo hidroxilo hid il d dell otro, t con formación de una molécula de H2O. Ejemplos: sacarosa, lactosa, … La sacarosa es el disacárido más abundante Está compuesto de una abundante. molécula de glucosa y una molécula de fructosa. (Fundamentos de Química, Grado en Física) hidrólisis de la lactosa (1 = galactosa, 2 = glucosa) Química Orgánica 2010/2011 Bioquímica Oligosacáridos Están compuestos p p por entre 3 y 10 moléculas de monosacáridos. Se encuentran con frecuencia unidos a proteínas, formando las glucoproteínas, como una forma común de modificación tras la síntesis proteica. Estaquiosa (dos galactosas, una glucosa y una fructosa) (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Bioquímica Polisacáridos Cadenas, Cadenas ramificadas o no no, de más de 10 monosacáridos monosacáridos. Su función en los organismos vivos está relacionada con estructura o almacenamiento. El glucógeno es una reserva energética de los animales, formado por cadenas ramificadas de glucosa. Glucógeno (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Bioquímica PROTEÍNAS Ñ Los prótidos o proteínas son biopolímeros, es decir, están constituidas por gran número de unidades estructurales simples repetitivas, denominadas aminoácidos. Ñ Desempeñan un papel fundamental para la vida ya que son imprescindibles para el crecimiento del organismo. Ñ Realizan una enorme cantidad de funciones diferentes, entre las que destacan: • • • • • • • Estructural Inmunológica (anticuerpos) Enzimática (sacarasa y pepsina) Contráctil (actina y miosina) Homeostática: mantenimiento del pH Protectora o defensiva (trombina y fibrinógeno) Hemoglobina Etc. (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Bioquímica PROTEÍNAS Ñ Todas las proteínas tienen C C, H H, O y N N, y muchas poseen también SS. Ñ Son largas cadenas de aminoácidos unidas por enlaces peptídicos. Ñ La secuencia de aminoácidos de una proteína está codificada en su gen (una porción de ADN) mediante el código genético. Ñ Estructura de la proteína: presentan una disposición espacial característica en condiciones fisiológicas, pero si se cambian estas condiciones (temperatura, pH, etc.) pierde la conformación y su función, proceso denominado desnaturalización. (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Bioquímica PROTEÍNAS Ñ Existen 20 aminoácidos diferentes: (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Bioquímica PROTEÍNAS Ñ Un aminoácido es una molécula orgánica g con un grupo g p amino (-NH ( 2) y un grupo carboxílico (-COOH). Ñ Dos aminoácidos se combinan en una reacción d condensación de d ó que llibera b agua formando un enlace peptídico: enlace entre el grupo carboxilo (-COOH) y el ggrupo p amino ((-NH2) de residuos de aminoácido adyacentes. aminoácido 1 aminoácido 2 enlace peptídico dipéptido (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Bioquímica PROTEÍNAS Estructura primaria EEstructura t t de d las proteínas secuencia de la cadena de aminoácidos aminoácidos hoja plegada hélice alfa Estructura secundaria debida a la interacción por puentes d hid de hidrógeno ó entre aminoácidos i á id hoja plegada hélice alfa Estructura terciaria debida a atracciones entre hélices y hojas Estructura cuaternaria debida a interacciones entre cadenas (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Bioquímica ÁCIDOS NUCLEICOS Ñ Los ácidos nucleicos son macromoléculas formadas p por la repetición de monómeros llamados nucleótidos, unidos mediante enlaces fosfodiéster. Se forman así, largas cadenas de polinucleótidos, que pueden alcanzar tamaños gigantes (de millones de nucleótidos de largo). Ñ De acuerdo d a lla composición ó química, í llos áácidos d nucleicos l se clasifican en ácidos desoxirribonucleicos (ADN) y en ácidos ribonucleicos (ARN). (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Bioquímica ÁCIDOS NUCLEICOS NH2 Ñ Los nucleótidos son moléculas formadas p por: N 1. Un monosacárido de 5 carbonos, es decir, N una pentosa (ribosa en el ARN y desoxirribosa en el ADN). HO O H H O H H 2 Uno o varios grupos fosfato: 2. O 3. Una base nitrogenada. H P O- O- Adenina Guanina Citosina Timina Uracilo (ADN y ARN) (ADN y ARN) (ADN y ARN) (ADN) (ARN) (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 O Bioquímica ÁCIDOS NUCLEICOS Ñ Enlace fosfodiéster: (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Bioquímica ÁCIDOS NUCLEICOS Ñ El ADN es bicatenario, está constituido por dos cadenas polinucleotídicas unidas entre sí en toda su longitud. Ñ La molécula de ADN porta la información necesaria para el desarrollo de las características biológicas de un individuo y contiene los mensajes e instrucciones para que las células realicen sus funciones ADN (Fundamentos de Química, Grado en Física) Química Orgánica 2010/2011 Bioquímica ÁCIDOS NUCLEICOS Ñ El ARN expresa p la información q que contiene el ADN, pasando de una secuencia de nucleótidos, a una secuencia de aminoácidos en una proteína. Ñ Para expresar dicha información, se necesitan varias etapas y, en consecuencia, existen varios tipos de ARN (mensajero, de transferencia, ribosómico). Ñ El ARN está constituido casi siempre por una única cadena cadena, aunque en ciertas situaciones, puede formar estructuras plegadas complejas. (Fundamentos de Química, Grado en Física) ARN mensajero Química Orgánica 2010/2011