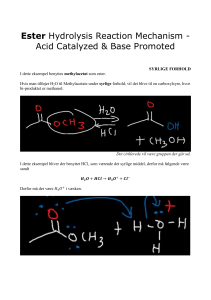
Lektion 1: Kemisk regning, periodisk system, navngivning Symbol m n N M V r Vm T c NA R Betegnelse Masse Stofmængde Antal partikler Molarmasse (molare masse) Volumen (=rumfang) densitet rumfanget af et mol ideal gas (ved 298 K og 1 bar) den absolutte temperatur, ºC temperatur + 273,15 stofkoncentration Avogadro konstanten Gaskonstanten 1 Hyppigste enhed g mol g/mol m3 (1 m3=1000 L; 1 cm3=1 mL) kg/dm3, kg/L, g/L ca 24,8 L K mol/L 6,022*1023 mol-1 8,3144626 m3⋅Pa⋅K−1⋅mol−1 8314,4626 L⋅Pa⋅K−1⋅mol−1 0,083144626 L⋅bar⋅K−1⋅mol−1 0,082057366 L⋅atm⋅K−1⋅mol−1 Lektion 2: Reaktionsligninger 1.Støkiometrisk beregning med molmasse og koefficienterne i en afstemt reaktion (med kendt masse A og søgt masse B) 2.Procent-udbytte i en reel proces: 3. Masse-% for opløst stof i en opløsning eller for et atom i et molekyle 4. Molalitet c =stofmængde per liter opløsning (et koncentrations- mål); kan bestemmes med masse og molmasse af opløst stof 5. Fortynding fra c1, V1 i starten til slut-volumen V2 og lavere koncentration c2 (Vadded er tilføjet volumen) 2 Lektion 3: Elektroner, orbitaler og periodiske trends Symbol Betegnelse Energi E for en Formel//hyppigste enhed E=h·n = h·(c/l) elektromagnetisk bølge h c R¥ Plancks konstante Lysets hastighed Bølgelængde for overgang mellem skal n og m i hydrogenatomet Rydberg konstant 6,626·10-34 J·s 3·108 m/s 1ö æ 1 = R¥ ç 2 - 2 ÷ l n ø èm 1 1,097·10-2 nm-1 • kvantental: n= 0, 1, … l=0, 1,…n-1 ml=-l, …, 0, …+l ms=+/-½ • Antal orbitaler i hver skal n: n2 orbitaler med plads til 2n2 elektroner • Effektiv kerneladning Zeff Zeff = Z −Elektronafskærmning Elektronens energi i skal n: Eelektron=-const·(Zeff/n)2 • 3 Lektion 4: Bidninger bindingsorden ( # bonding e Bond order = - - # antibonding e - ) 2 Lektion 5: Energi Reaktionsentalpi fra bindings-dissociations energi: ΔH = D(reaktant bindinger) − D(produkt bindinger) Reaktionsentalpi fra entalpi for at danne molekylet fra ”standard-stoffer”: Forandring i Gibbs fri energi: ΔG = ΔH − T ΔS ΔG < 0 for spontane processer Hastighed for gasmolekyler: proportional til1/√(m ) Idealgasligningen: PV=nRT R=0,0831 L⋅bar⋅K−1⋅mol−1 R=0,0820 L⋅atm⋅ K−1⋅mol−1 4 Lektion 6: Faste stoffer og opløsninger 1. Koncentrationsmål: Molalitet =(mol opløst stof)/kg opløsningsmiddel; mol/kg skrives som m Stofmængdekoncentration eller molaritet c=(mol opløst stof)/liter opløsning (mol/l=M) Molbrøk(A) = XA =(antal mol A)/totalt antal mol Masse%(A) = (masse af A)/totalmasse*100% ppm (A) = (masse af A)/totalmasse*106 ppm (ppm står for parts per million) ppb (A) = (masse af A)/totalmasse*109 ppb (ppb står for parts per billion) 2. Henry’s lov: Opløselighed = k P k= Henry konstant for den specifikke gas i vand ved 25 oC: O2: 1.3 mM/atm CO2: 32 mM/atm N2: 0.6 mM/atm 3. Forandring i frysepunkt (=smeltepunkt; ΔTf) og kogepunkt (ΔTb) ΔTf = Kf´m´i ΔTb=Kb´m´i Van’t Hoff Factor : i= 4. Osmotisk tryk P 5 Lektion 7: Reaktionskinetik 6 Lektion 8: Ligevægt A. Ligevægtskonstanten beskriver ligevægtsfordelingen: aA+bB cC+dD Under ligevægt gælder [𝑪]𝒄𝒆𝒒 [𝑫]𝒅𝒆𝒒 𝑲𝒄 = [𝑨]𝒂𝒆𝒒 [𝑩]𝒃𝒆𝒒 for gasformige reaktanter kan man også definere ligevægtsfordelingen af partialtryk 𝒑𝒄𝒆𝒒 𝒑𝒅𝒆𝒒 𝑲𝒑 = 𝒂 𝒃 𝒑𝒆𝒒 𝒑𝒆𝒒 B. Ligevægtskonstanten for inverse reaktioner: Hvis reaktant og produkt bytter plads, gælder K’=1/K C. Ligevægtskonstanten for sumreaktioner (individuelle ligevægtsreaktioner med ligevægtskonstanter K1 og K2) Ktotal=K1*K2 D. Reaktionskvotient [ 𝑪 ] 𝒄 [𝑫 ] 𝒅 𝑸𝒄 = [𝑨]𝒂 [𝑩]𝒃 Hvis Q<K: reaktionen er spontan fra venstre til højre Hvis Q>K: reaktionen er spontan i den omvendte retning Hvis Q=K: reaktionen er i ligevægt E. I vand ved 25ºC gælder K w = [H3O+ ][OH- ] = 1.0 ´ 10-14 éëH3O+ ùû = 1.0 ´ 10 -14 éëOH- ùû pH=-log [H3O+]; pOH=-log [OH-]; pH+pOH=14 7 Lektion 9: Ligevægtsberegninger 1. Ligevægtskonstanter for syrer og baser: pKa+pKb=14 for et konjugeret syre-base par 2. Omregning mellem [H3O+], Kaog c0 for en syre 3. Omregning [OH-], Kb, c0 for en base [𝑶𝑯! ] = [−𝑲𝒃 + )(𝑲𝒃 ² + 𝟒𝒄0𝑲𝒃 )]/𝟐 husk at pH+pOH=14 4. Titrering af stærk syre med stærk base (for pH<7) [𝐻! ]"#$%&' 𝑐()"# 𝑉()"# − 𝑐*%(# 𝑉*%(# = 𝑉()"# + 𝑉*%(# 8 5. Titrering af svag syre med stærk base: Ved Halv-ækvivalenspunkt er pH= pKa 6. Henderson-Hasselbalch ligning, omregning mellem pKa, pH, syreform og baseform: æ - ö [A ] ÷ pH = pK a + log ç ç [HA] ÷ è ø Ligningen fungerer også med stofmængdeforholdet 7. Pufferblænding ud fra stock-opløsninger af base- og syreform 8. Hvis man regner ud fra faststofferne, beregner stofmængdeforholdet og ved, hvilken sammenlagte koncentration af HA og A- der skal være; ud fra det kendte forhold nA-/nHA og det kendte og nHA+nA- kan man løse for stofmængden og regne om til massen af pufferkomponenterne 9. Opløselighedsproduktet Ksp er ligevægtskonstanten for en ligevægt mellem faststof og opløste stoffer. Stofmængden af faststof der er gået i opløsning per volumen opløsningsmiddel er opløselighed s (i mol/L). 9 Lektion 10: Drivkraften af kemiske reaktioner • Sammenhæng mellem forandring i fri energi og reaktionskvotienten (de to størrelser der beskriver spontant forløb af en reaktion): ∆G=RTln(Q/K) • Sammenhæng mellem forandring i fri energi under standardbetingelser og ligevægtskonstanten: 𝟎 ∆𝑮𝟎 = −𝑹𝑻𝒍𝒏(𝑲); 𝑲 = 𝒆!∆𝑮 /𝑹𝑻 • For koblede reaktioner gælder: ∆𝑮𝟎𝒕𝒐𝒕𝒂𝒍 = ∆𝑮𝟎𝟏+ ∆𝑮𝟎𝟐 𝑲𝒕𝒐𝒕𝒂𝒍 = 𝑲𝟏 ∙ 𝑲𝟐 • For elektronoverførelse (redox reaktioner): Elektromotorisk kraft E=E(reduktion)-E(oxidation) E er positiv i en spontan elektronoverførelse F=Faraday constant =96485 J/(V*mol); n= antal overførte elektroner • Under standardbetingelser: • Beregning af ligevægtskonstanten ud fra tabelværdien E0 • Nernst Ligningen: Koncentrationsafhængig spænding E: 10 Lektion 11: Kernekemi Kernemagnetisme µ er proportional til kernespin S µ∝S (begge har en direktionalitet, er vektorer; kernen kan have spin fordi proton og neutron har spin) MRI bruger kernemagnetisme til klinisk billeddannelse; NMR spektroskopi til kemisk strukturopklaring, 3D strukturopklaring mm 13 C er stabil og magnetisk; 14C er instabil (radioaktiv) og ikke-magnetisk Hyppige slags radioaktive henfald: Enheder for radioaktivitet: Datering med 14C Datering med 40K Massedefekt: DE = Dm×c2 1eV=1.6*10-19 J=96,48 kJ/mol 11 Lektion 12: Overgangsmetaller og Komplekser Spektrokemisk serie: I- < Br- < Cl- < OH- < F- < H2O < NH3 < en < CN- < CO (en = 1,2-ethandiamin; kaldes også ethylendiamin) Husk: E=h·n = h·(c/l) Farve på overgangsmetalkomplekser: 12 Lektion 13: Organisk kemi Funktionelle grupper: 13 Appendix: Reaktionsligninger Eksempler fra medicin og natur Uskadeliggørelse af cyanid: CN-(aq) + HO2- → OCN-(aq) + OHOpløsning af kalksten med sur regn: CaCO3(s) + 2 SO2(aq) + H2O ® CO2(g) + Ca2+(aq) + 2 HSO3–(aq) Aerob stofskifte: C6H12O6 (aq) + 6 O2 (g) ® 6 CO2 (g) + 6 H2O (l) Fotosyntese: 6 CO2 (g) + 6 H2O(l) ® 6 O2 (g)+ C6H12O6 (aq) Forskellige tekniske anvendelser Haber-Bosch og Ostwald proces (giver i summen nitrat fra nitrogen): Haber-Bosch: N2(g) + 3 H2(g) ® 2 NH3(g) Ostwald: NH3(g) + 2 O2(g) ® HNO3(aq) + H2O(g) Kontaktprocessen: S ( s ) + O2 ( g ) ® SO2 ( g ) Heat 2 SO2 ( g ) + O2 ( g ) ¾¾¾¾¾ ® 2 SO3 ( g ) V2O5 catalyst SO3 ( g ) + H2O ® H2SO 4 Oxidation af ædelmetaller med “Kongevand” (HCl/HNO3): Au ( s ) + 3 NO3 - ( aq ) + 6 H+ ( aq ) + 4Cl- ( aq ) ® AuCl4 - ( aq ) + 3 NO2 ( g ) + 3 H2O (I ) 14 Oxider og hydrider med vand Oxider med vand: Basisk: Na2O(s) + H2O(l) ® 2 Na+(aq) + 2 OH-(aq) CaO(s) + H2O(l) ® Ca2+(aq) + 2 OH-(aq) Sur: CO2(aq) + H2O(l) ® HCO3–(aq) + H3O+(aq) SO2(aq) + H2O(l) ® HSO3–(aq) + H3O+(aq) SO3(aq) + H2O(l) ® HSO4–(aq) + H3O+(aq) P4O6(aq) + 10 H2O(l) ® 4 H2PO3–(aq) + 4 H3O+(aq) P4O10(aq) + 10 H2O(l) ® 4 H2PO4–(aq) + 4 H3O+(aq) Alkalimetaller med vand: 2 Na(s) + 2 H2O(l) ® 2 NaOH(aq) + H2 = 2 Na(s) + 2 H2O(l) ® 2 Na+ + 2 OH-(aq) + H2 Jordalkalimetaller med vand: Ca (s) + 2 H2O(l) ® Ca(OH)2 + H2 (s eller aq) Ioniske hydrider med vand: CaH2(s) + 2H2O(l) ® Ca2+(aq) + 2 OH-(aq) + 2 H2(g) NaH(s) + H2O(l) ® Na+(aq) + OH-(aq) + H2(g) Fremstilling af hydrogen: CH4(g) + H2O(g) ® CO(g) + 3 H2(g) CO(g) + H2O(g) ® CO2(g) + H2(g) 15 M(s) + 2 H+(aq) ® M2+(aq) + H2(g) Forbrænding og relaterede redox reaktioner Alkalimetaller med oxygen i overskud: 4 Li(s) + O2(g) ® 2 Li2O(s) Lithiumoxid O22 Na(s) + O2(g) ® Na2O2(s) Natriumperoxid O22K(s) + O2(g) ® KO2(s) Kaliumsuperoxid O2Forbrændning af C med ilt: 2 C(s) + O2(g) → 2 CO(g) (begrænsende ilt) 2 CO(g) + O2(g) → 2 CO2(g) Forbrænding af Phosphor Begrænsende ilt: ount of O 2: P4 ( s ) + 3 O 2 ( g ) ® P4O 6 ( s ) ount of O : P4 ( s ) + 3 Oilt: ( g ) ® P O (s ) ount of O 22: Overskud P4 ( s ) + 5 O 22 ( g ) ® P44O610 ( s ) ount of O 2 : P4 ( s ) + 5 O 2 ( g ) ® P4O10 ( s ) Forbrænding af hydrogen: 2 H2(g) + O2(g) ® 2H2O (g) (omvendt: elektrolyse) Disproportionering af Hydrogenperoxid: 2 H2O2(l) ® 2 H2O(l) + O2(g) “Selective catalytic reduction” af NOx (bilkatalysator): 4 NH3(g) + 4 NO(g) + O2(g) ® 4 N2(g) + 6 H2O(g) (en komproportionering) 16