normopresan 07-2010
advertisement

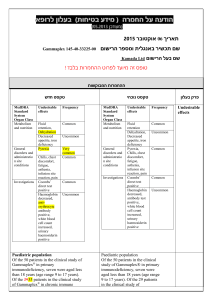
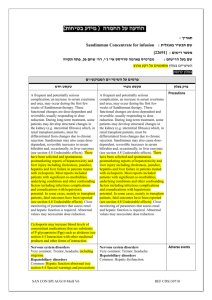
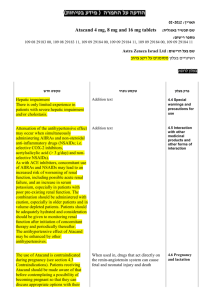
בטיחות) מידע בטיחות) החמרה (( מידע על החמרה הודעה על הודעה (לשלוח ל(alonim.urgent@moh.health.gov.il : תאריך 17 :ביוני __________________________0010 שם תכשיר באנגלית___ֹֹ___________NORMOPRESAN מספר רישום ___________________________ 043-98-22680-00 שם בעל הרישום___מעבדות רפא בע"מ________________ השינויים בעלון מסומנים על רקע צהוב לצרכן בעלון לצרכן בעלון פרטים על השינוי/ים המבוקש/ים פרק בעלון הרכב המרכיבים הבלתי פעילים טקסט חדש טקסט נוכחי הרכב: הרכב החומר המרכיב הפעיל: כל טבליה של נורמופרסאן מכילהClonidine HCl : 0.15 mg הרכב החומרים ה מרכיבים בלתי פעילים: Corn starch, silicon dioxide collodial, povidone, soluble starch, stearic acid, lactose, and dibasic calcium phosphate כל טבליה מכילה 63מ"ג לקטוז מתי אין להשתמש בתכשיר אין להשתמש בתכשיר אם ידועה רגישות לתרופה או לאחד ממרכיביוה. אין להשתמש בתכשיר אם הינך בהריון או מניקה. אין להשתמש בתרופה אם הינך סובל/ת מקצב לב איטי (ברדיקרדיה) (קצב לב איטי). אין להשתמש בתרופה מבלי להיוועץ ברופא אין להשתמש בתרופה מבלי להיוועץ ברופא לפני התחלת הטיפול במקרים הבאים: אם הינך בהריון או מיניקה ,או אם הינך סובל/ת או סבלת בעבר מליקוי בתפקוד :הלב ו/או כלי דם, הכליה/מערכת השתן ,וכן אם הינך סובל/ת או סבלת בעבר מבעיות באספקת דם למוח ,פולינוירופתיה, פאוכרומוציטומה או דיכאון. איך תשפיע התרופה על חיי היום יום שלך? השימוש בתרופה זו עלול לפגום בערנות ועל-כן מחייב זהירות בנהיגה ברכב ,בהפעלת מכונות מסוכנות ובכל פעילות המחייבת עירנות .באשר לילדים ,יש להזהירם מרכיבה על אופניים או ממשחקים בקרבת הכביש וכדומה. אין לשתות יינות או משקאות חריפים בתקופת הטיפול עם הבתרופה זו. נורמופרסאן – דף מס' 1 אזהרות אם הינך רגיש/ה למזון כלשהו או לתרופה כלשהי ,עליך להודיע על-כך לרופא לפני נטילת התרופה. בתקופת הטיפול בתרופה זו עליך להיות במעקב של לחץ דם. בתקופת הבטיפול ממושך בתרופה זו יש לערוך בדיקות עיניים תקופתיות. אם הינך נוטל תרופות נוספות המשפיעות על קצב הלב כגון דיגוקסין ,חוסמי תעלת סידן או חוסמי בטה ,עליך להיות במעקב של קצב לב. במטופלים המרכיבים עדשות מגע -שימוש בתרופה עלול לגרום ליובש בעיניים. אם הינך רגיש/ה למזון כלשהו או לתרופה כלשהי ,עליך להודיע על-כך לרופא לפני נטילת התרופה. אין להפסיק ליטול תרופה זו בצורה פתאומית בלי להיוועץ ברופא. יש לדווח לרופא על טיפול בתרופה זו אם הינך עומד/ת לעבור ניתוח כלשהו (כולל ניתוח דנטלי). סחרחורת או עלפון עלולים להופיע בזמן נטילת תרופה זו ,במיוחד בעת קימה ממצב של שכיבה או ישיבה ,או בזמן עמידה ממושכת ,בעת פעילות גופנית או במזג אוויר חם. קשישים עלולים להיות רגישים יותר להשפעת התרופה. תגובות בין- תרופתיות אם הינך נוטל/ת תרופה נוספת ,או אם גמרת זה עתה הטיפול בתרופה אחרת עליך לדווח לרופא המטפל כדי למנוע סיכונים או אי-יעילות הנובעים מתגובות בין- תרופתיות ,במיוחד לגבי תרופות מהקבוצות הבאות: תרופות המשפיעות על מערכת העצבים המרכזית (כגון: תרופות להרגעה ,לשינה ,לטיפול בפרקינסון ,אפילפסיה או סכיזופרניה ,משככי כאב אופיואידים ,אנטי- היסטמינים וחומרים מרדימים לניתוח) ,תרופות נגד לטיפול בדיכאון (כגון טריציקליים ובולמימעכבי ,)MAO תרופות אחרות להורדת לחץ דם (כגון :משתנים ,חוסמי תעלות סידן וחוסמי בטה או אלפא ,)betaדיגוקסין, תרופות לטיפול בסוכרת ,נוגדי דלקת אלא-סטרואידיים, או תכשירים המכילים אסטרוגן (כולל גלולות למניעת הריון). תופעות לוואי בנוסף לפעילות הרצויה של התרופה ,בזמן השימוש בה עלולות להופיע השפתופעות לוואי כגון :יובש בפה, עצירות ,נמנום ,טשטוש ,סחרחורת ,כאב ראש ,עייפות או חולשה ,חום ,חיוורון. תופעות אלה חולפות בדרך כלל תוך זמן קצר לאחר תקופת ההסתגלות לתכשיר. אם תופעות הלוואי אינן חולפות או שהן מטרידות ,יש להתייעץ עם הרופא. נורמופרסאן – דף מס' 2 תופעות לוואי הדורשות התייחסות מיוחדת בהופיע פריחה או גירוי בעור ,דיכאון ,נפיחות של הרגליים ,שינויים בקצב לב ,עליה חדה בלחץ דם, שינויים בהתנהגות (כגון :בלבול ,הזיות ,חרדה ,אי שקט ,דיכאון) ,קשיים במתן שתן ,טשטוש ראיה ,כאב שרירים ,הפרעה בזרימת הדם לאצבעות ,הזעה (נדיר): המשך/י בטיפול ופנה/י לרופא מיד! בכל מקרה שבו הינך מרגיש/ה תופעות לוואי שלא צוינו בעלון זה ,או אם חל שינוי בהרגשתך הכללית עליך להתייעץ עם הרופא מייד. מינון מינון לפי הוראות הרופא בלבד .אין לעבור על המנה המומלצת. תרופה זו אינה מיועדת בדרך כלל לילדים. יש להשתמש בתרופה זו בזמנים קצובים כפי שנקבע על ידי הרופא המטפל .אם שכחת ליטול תרופה זו בזמן קצוב יש ליטול מנה מיד כשנזכרת ,אך בשום אופן אין ליטול שתי מנות ביחד! עליך להקפיד לא להפסיד אף מנה וכן ודא/י שברשותך כמות מספקת של התרופה לסופי שבוע ,חגים ,או חופשות. כיצד תוכל/י לסייע להצלחת הטיפול? עלייך להשלים את הטיפול שהומלץ על ידי הרופא. גם אם חל שיפור במצב בריאותך אין להפסיק הטיפול בתרופה ללא התייעצות עם הרופא .הוראה זו חשובה במיוחד לתרופה כמו נורמופרסאן .חיוני להקטין את המינון בהדרגתיות ,כדי להימנע מעליה חוזרת של לחץ הדם. בנוסף לנטילת תרופה זו ,רצוי שהטיפול בלחץ דם גבוה ליכלול גם שמירה על המשקל והקפדה על צריכת מזון, במיוחד הימנעות ממזון בעל תכולה גבוהה של נתרן (מלח). מנע/י הרעלה! תרופה זו וכל תרופה אחרת יש לשמור במקום סגור מחוץ להישג ידם של ילדים ו/או תינוקות ועל-ידי כך תמנע הרעלה. אם נטלת מנת יתר או עאם בטעות בלע ילד מן התרופה, פנה מיד לחדר מיון של בית-חולים ,והבא אריזהת התרופה אתך. אל תגרום להקאה ללא הוראה מפורשת מרופא! תרופה זו נרשמה לטיפול במחלתך; בחולה אחר/ת היא עלולה להזיק .אל תיתן תרופה זו לקרוביך ,שכניך או מכריך. אין ליטול תרופות בחושך! בדוק התווית והמנה בכל פעם שהינך נוטל תרופה. הרכב/י משקפיים אם הינך זקוק/ה להם. אחסנה יש לאחסן מתחת .52°C גם לפי תנאי האריזה/אחסנה המומלצים ,תרופות נשמרות לתקופה מוגבלת בלבד .נא לשים לב לתאריך התפוגה של התכשיר! בכל מקרה של ספק ,עליך להיוועץ נורמופרסאן – דף מס' 3 .ברוקח שסיפק לך את התרופה אין לאחסן תרופות שונות באותה אריזה 30006 ירושלים,502 .ד. ת,מעבדות רפא בע"מ רופא בעלון ללרופא בעלון ים/ים המבוקש/פרטים על השינוי טקסט חדש פרק בעלון Clonidine should be used with caution in patients with severe coronary insufficiency, recent myocardial infarction, mild to moderate bradycardia, cerebrovascular disease, chronic renal function impairment, or polyneuropathy. Tolerance to clonidine may develop in some patients, necessitating a re-evaluation of therapy. Concomitant use of a diuretic may aid in overcoming tolerance to clonidine and may permit a reduction in dosage of clonidine. Perioperative Use Administration of clonidine should be continued to within four hours of surgery and resumed as soon as possible thereafter. Blood pressure should be carefully monitored during surgery and additional measures to control blood pressure should be available if required. Warnings Information for Patients Patients should be cautioned against interruption of clonidine therapy without their physician's advice. Patients who engage in potentially hazardous activities, such as operating machinery or driving, should be advised of a possible sedative effect of clonidine. They should also be informed that this sedative effect may be increased by concomitant use of alcohol, barbiturates, or other sedating drugs. Patients who wear contact lenses should be cautioned that treatment with clonidine may cause dryness of eyes. Use in Pregnancy Since embryotoxicity has been reported in animals who prior to mating received an extremely low dose of clonidine (0.015 mg/kg body weight; one-third of the maximum recommended human dose), the use of clonidine is not recommended in women 4 'נורמופרסאן – דף מס who are or who may become pregnant, unless the potential benefits outweigh the possible hazards to mother and fetus. Use in Breastfeeding Safety of use in nursing mothers has not been established. Clonidine hydrochloride is excreted in human milk. Use in Pediatrics Safety and efficacy of clonidine in the treatment of hypertension in children has not been established. The most common adverse reactions associated with clonidine therapy are dry mouth (40%), drowsiness (33%) and sedation (10%), constipation (10%), dizziness (16%), fever, pallor, weakness, headache and fatigue have also been reported. In general, these effects tend to diminish with continued therapy. The following adverse reactions have also been associated with the use of clonidine, some of them rarely. In some instances, an exact causal relationship has not been established. Gastrointestinal Anorexia, malaise, nausea, vomiting, parotid pain, and mild transient abnormalities in liver function tests, abdominal pain, constipation, parotitis, pseudo-obstruction (including colonic pseudo-obstruction), salivary gland pain. There has been one report of possible drug-induced hepatitis in a patient receiving clonidine along with chlorthalidone and papaverine hydrochloride. Metabolic Weight gain, transient elevation of blood glucose or serum creatinine phosphokinase and gynecomastia. Cardiovascular Bradycardia, congestive heart failure, orthostatic symptoms, paresthesia of the extremities, Raynaud’s phenomenon and electrocardiographic abnormalities manifested as (i.e., sinus node arrest, junctional bradycardia, high degree AV block and arrhythmias) , orthostatic symptoms, palpitations, syncope, and tachycardia.. Cases of sinus bradycardia and atrioventricular block have been reported, both with and without the use of concomitant digitalis. Central Nervous System Vivid dreams or nightmares, insomnia, other behavioral changes, restlessness, anxiety and mental depression, delirium, delusional perception, hallucinations (including visual and auditory), confusion, disturbances of accomodation, nervousness and agitation, paresthesia. Dermatological 5 'נורמופרסאן – דף מס Adverse events Rash, angioneurotic edema, hives, urticaria, thinning of the hair and pruritus , alopecia, rash. Genitourinary Occasional impotence, decreased libido, urinary retention, nocturia. Other Increased sensitivity to alcohol, dryness, itching or burning of the eyes (wearers of contact lenses should be particularly careful), accommodation disorder, blurred vision, dryness of the nasal mucosa, pallor or a weakly positive Coomb’s test, thrombocytopenia, leg cramps and muscle or joint pain. Abrupt withdrawal of clonidine may result in a rapid increase of systolic and diastolic blood pressures, with associated symptoms such as nervousness, agitation, restlessness, anxiety, insomnia, headache, sweating, palpitation, increased heart rate, tremor, hiccups, stomach pain, nausea, muscle pains and increased salivation. This syndrome is more pronounced after abrupt cessation of long-term therapy, rather than after short-term (1-2 months) therapy. Clonidine/Alcohol/Other CNS Depressants The concurrent use of clonidine and alcohol or CNS depressants may enhance the CNS depressant effects of any of these medications. Clonidine/Antihypertensives or Diuretics The antihypertensive effect of clonidine may be potentiated when used concurrently with other anti-hypertensives such as diuretics, vasodilators, beta-receptor blockers, calcium antagonists, and ACE-inhibitors, but not α1-blocking agents. Although some combinations are frequently used for therapeutic advantage, dosage adjustment may be necessary. Discontinuation of therapy following concurrent use with -adrenergic blocking agents may Drug Interactions increase the risk of a clonidine withdrawal hypertensive crisis. Therefore, ideally, the -blocker should be discontinued before clonidine is discontinued. Clonidine/Tricyclic Antidepressants/Monoamine Oxidase Inhibitors/Sympathomimetic Amines/Levodopa/Tolazoline/General Anesthetics/Phentolamine Concurrent use with any of the above may decrease the antihypertensive effects of clonidine. Clonidine/Antidiabetic Agents Patients receiving antidiabetic drugs and clonidine should be 6 'נורמופרסאן – דף מס aware that clonidine may suppress the signs and symptoms of hypoglycemia. Clonidine/Fluphenazine Combinations with fluphenazine may produce a toxic effect (acute organic brain syndrome) not expected from either drug alone. Clonidine/Guanethedine/β-blockers/Digitalis Glycosides Because clonidine may produce bradycardia, the possibility of additive effects should be considered when clonidine is administered with other drugs that decrease the heart rate. Monitor heart rate in patients receiving clonidine concomitantly with agents known to affect sinus node function of AV nodal conduction, e.g., digitalis, calcium channel blockers, and betablockers. Sinus bradycardia resulting in hospitalization and pacemaker insertion has been reported in association with the use of clonidine concomitantly with diltiazem or verapamil. Clonidine/Propranolol Potentiation of peripheral vascular disorders and paradoxical hypertension has been reported with the concomitant use of clonidine and propranolol. Clonidine/Levodopa The antiparkinsonism effectiveness of levodopa may be decreased. Clonidine and levodopa combination therapy should be avoided if possible. Clonidine/Drugs affecting Catecholamine Metabolism Since clonidine withdrawal may result in an excess of circulating catecholamines, caution should be exercised when clonidine is used concomitantly with other drugs which affect the metabolism or tissue uptake of these amines (monoamine oxidase inhibitors, tricyclic antidepressants). Clonidine/Non-steroidal anti-inflamatory drugs/Estrogens Substances which raise blood pressure or induce a sodium and water- retaining effect such as NSAIDS or estrogens can reduce the antihypertensive effect of clonidine. Clonidine/Amitriptyline Amitriptyline in combination with clonidine enhances the manifestation of corneal lesions in rats (see Toxicology). Clonidine/ Methylphenidate Serious adverse events, including death, have been reported in 7 'נורמופרסאן – דף מס concomitant use with methylphenidate in patients with underlying cardiovascular conditions, although no association for the combination has been established. The safety of using clonidine in combination with methylphenidate has not been systematically evaluated Diagnostic Interference The Coomb’s test may produce positive results. Urinary catecholamine levels and urinary vanillylmandelic acid (VMA) excretion may be decreased, but may increase on abrupt withdrawal of clonidine. Each tablet contains: clonidine hydrochloride 150 mg. Inactive ingredients: Corn starch, silicon dioxide, povidone, soluble starch, stearic acid, and trace quantities of lactose, and dibasic calcium phosphate Treatment of hypertension requires regular medical supervision. The dose of Normopresan must be individualized according to the patient's blood pressure response. Composition As an initial daily dose in mild to moderate forms of hypertension, 0.075 mg (half a tablet) to 0.150 mg (one tablet) twice daily are sufficient in most cases. After a period of 2-4 weeks the dose may be increased if necessary until the desired response is achieved. Usually doses above 0.6mg per day do not result in a further marked drop in blood pressure. In severe hypertension it might be necessary to increase the single dose further to 0.3mg; this could be repeated up to three times daily (0.9mg). In patients with renal insufficiency careful monitoring is required and the dosage must be adjusted appropriately, according to the individual antihypertensive response. In patients with renal failure, with a glomerular filtration rate of less than 10 ml/min, the usual dosage should be reduced by 50-75%. Since only a minimal amount of clonidine is removed during routine hemodialysis there is no need to give supplemental clonidine following dialysis. Dosage Administration Patients changing to treatment with Normopresan should have their existing therapy reduced gradually, while Normopresan is added to the regimen. Although concurrent use of a thiazide diuretic may be a valuable adjuvant in many hypertensive patients, when administered alone, Normopresan will, in many cases, provide full control of blood pressure. Nevertheless, the use of a diuretic may aid in overcoming tolerance to clonidine and permit reduction of clonidine dosage (see Warnings). Manifestations Overdosage 8 'נורמופרסאן – דף מס & Hypertension may develop early and may be followed by hypotension, drowsiness, bradycardia, , CNS depression, respiratory depression, apnea, hypothermia, miosis, seizures, lethargy, agitation, irritability, diarrhea, arrhythmias and transient hypertension have been reported. Profound hypotension, weakness, somnolence, diminished or absent reflexes and vomiting followed accidental ingestion by several children aged 19 months to 5 years of age. Signs and symptoms of clonidine overdosage usually occur within 30-60 minutes after ingestion and may persist for 36-48 hours. Treatment Perform gastric lavage, administered activated charcoal and establish artificial respiration if necessary. A saline cathartic (magnesium sulfate) will increase the rate of transport through the gastrointestinal tract. Dopamine 200 mg in 500 ml of dextrose in water, infused at a rate of 10 mcg/kg body weight/min, has been used. Atropine sulfate (0.6 mg for adults, 0.01 mg/kg body weight in children) administered I.V., may be useful for the treatment of persistent bradycardia. If seizures occur, they can be managed by the I.V. administration of diazepam. Toxicology In several studies with oral clonidine hydrochloride, a dosedependent increase in the incidence and severity of spontaneous retinal degeneration was seen in albino rats treated for six months or longer. Tissue distribution studies in dogs and monkeys showed a concentration of clonidine in the choroid. In view of the retinal degeneration seen in rats, eye examinations were performed during clinical trials in 908 patients before, and periodically after, the start of clonidine therapy. In 353 of these 908 patients, the eye examinations were carried out over periods of 24 months or longer. Except for some dryness of the eyes, no drug-related abnormal ophthalmological findings were recorded and, according to specialized tests such as electroretinography and macular dazzle, retinal function was unchanged. In combination with amitriptyline, clonidine hydrochloride administration led to the development of corneal lesions in rats within 5 days. Carcinogenesis, Mutagenesis, Impairment of Fertility 9 'נורמופרסאן – דף מס Toxicology Chronic dietary administration of clonidine was not carcinogenic to rats (132 weeks) or mice (78 weeks) dosed, respectively, at up to 46 or 70 times the maximum recommended daily human dose as mg/kg (9 or 6 times the MRDHD on a mg/m2 basis). There was no evidence of genotoxicity in the Ames test for mutagenicity or mouse micronucleus test for clastogenicity. Fertility of male or female rats was unaffected by clonidine doses as high as 150 mcg/kg (approximately 3 times MRDHD). In a separate experiment, fertility of female rats appeared to be affected at dose levels of 500 to 2000 mcg/kg (10 to 40 times the oral MRDHD on a mg/kg basis; 2 to 8 times the MRDHD on a mg/m2 basis.) 10 'נורמופרסאן – דף מס