החמרה לעלון
advertisement

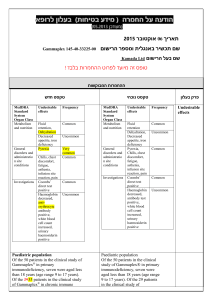
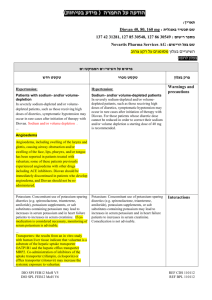
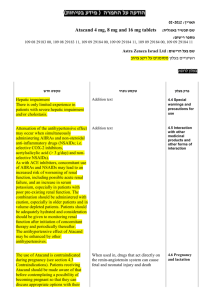
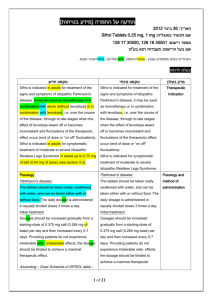
הודעה על החמרה ( מידע בטיחות) בעלון לרופא ).102.50 (מעודכן ..02.60.1 :תאריך Emadine-115-37-29747-00 : שם תכשיר באנגלית ומספר הרישום Lapidot medical import and marketing : שם בעל הרישום ! טופס זה מפרט ההחמרות בלבד ההחמרות המבוקשות טקסט חדש טקסט נוכחי פרק בעלון Hypersensitivity to emedastine or to any of the excipients EMADINE is contraindicated in persons with a known hypersensitivity to emedastine difumarate or any of its components Contraindications EMADINE has not been studied in clinical trials beyond six weeks. DOSAGE AND ADMINISTRATION The recommended dose is one drop in the affected eye twice per day, and if needed, up to four times daily. Posology , dosage & administration Posology The dose is one drop of EMADINE to be applied to the affected eye(s) twice daily. When used with other ophthalmic medicines, an interval of ten minutes should be allowed between applications of each medicinal product.Eye ointments should be administered last. Elderly population EMADINE has not been studied in elderly patients older than 65 years, and therefore its use is not .recommended in this population Paediatric population EMADINE may be used in paediatric patients (3 years of age and older) at the same posology as in adults. Hepatic and Renal impairement Use EMADINE has not been studied in these patients and therefore, its use is not recommended in this population. Method of administration For ocular use: To prevent contaminating the dropper tip and solution, care should be taken not to touch the eyelids or surrounding areas with the dropper tip of the bottle. Keep the bottle tightly closed when not in use. Do not use if the solution has become discolored. WARNINGS Ocular corneal infiltrates: Ocular corneal infiltrates were reported in conjunction with the use of EMADINE. In case of comeal infiltrates, the product should be discontinued and appropriate management should be implemented. Excipients Benzalkonium chloride ,which is commonly used as a preservative in ophthalmic products,has been reported to cause punctate keratopathy and /or toxic ulcerative keratopathy. Since EMADINE contains Benzalkonium chloride, close monitoring is required with frequent or prolonged use. In addition benzalkonium chloride may cause eye irritation and is known to discolour soft contact lenses. . Contact with soft contact lenses is to be avoided. Patients must be instructed to remove contact lenses prior to the application of EMADINE and wait 15 minutes after instillation of the dose before reinsertion. EMADINE is for topical use only and not for injection or oral use. PRECAUTIONS Information for Patients: To prevent contaminating the dropper tip and solution, care should be taken not to touch the eyelids or surrounding areas with the dropper tip of the bottle. Keep the bottle tightly closed when not in use. Do not use if the solution has become discolored. Patients should be advised not to wear a contact lens if their eye is red. EMADINE should not be used to treat contact lens related irritation. The preservative in EMADINE, benzalkonium chloride, may be absorbed by soft contact lenses. Patients who wear soft contact lenses and whose eyes are not red, should be instructed to wait at least ten minutes after instilling EMADINE before they insert their contact lenses. Carcinogenesis, Mutagenesis, Impairment of Fertility: Emedastine difumarate demonstrated no carcinogenicity effects in lifetime studies in mice and rats at dietary doses more than 80,000 times and more than 26,000 times the maximum recommended ocular human use level of 0.002 mg/kg/day for a 50 kg adult, respectively. Higher dose levels were not tested. Emedastine difumarate was determined to be nonmutagenic in an in vitro bacterial reverse mutation (Ames) test, an in vitro modification of the Ames test, an in vitro mammalian chromosome aberration test, an in vitro mammalian forward mutation test, an in vitro mammalian DNA repair synthesis test, an in vivo mammalian sister chromatid Special warnings and special precautions for use exchange test and an in vivo mouse micronucleus test. There was no evidence of impaired fertility or reproductive capacity in rats at 15,000 times the maximum recommended ocular human use level. No interaction studies have been performed . Pregnancy There are no adequate data from the use of emedastine in pregnant women. Studies in animals have shown reproductive toxicity (see section 5.3). The potential risk for humans is unknown. Nevertheless, considering the absence of effects of emedastine on adrenergic, dopaminergic and serotonin receptors, EMADINE can be used during pregnancy if the dosage recommendation in section 4.2 is respected. Lactation Emedastine has been identified in the milk of rats following oral administration. It is not known whether topical administration to humans could result in sufficient systemic absorption to produce detectable quantities in breast milk. Caution should be exercised if EMADINE is administered during breast-feeding. Fertility Studies in animals have shown no evidence of impaired fertility (see section 5.3)/ No human fertility data are available. 4.7 Effects on ability to drive and use machines Emadine has no or negligible influence on the ability to drive and use machines, however as with any ocular medication, if transient blurred vision or other visual disturbance occurs at instillation, Pregnancy: Pregnancy Category B. Teratology and periand post-natal studies have been conducted with emedastine difumarate in rats and rabbits. At 15,000 times the maximum recommended ocular human use level, emedastine difumarate was shown not to be teratogenic in rats and rabbits and no effects on peri/post-natal development were observed in rats. However, at 70,000 times the maximum recommended ocular human use level, emedastine difumarate was shown to increase the incidence of external, visceral and skeletal anomalies in rats. There are, however, no adequate and well controlled studies in pregnant women. Because animal studies are not always predictive of human response, this drug should be used during pregnancy only if clearly needed. Nursing Mothers: Emedastine has been identified in breast milk in rats following oral administration. It is not known whether topical ocular administration could result in sufficient systemic absorption to produce detectable quantities in breast milk. Nevertheless, caution should be exercised when EMADINE® (emedastine difumarate ophthalmic solution) 0.05% is administered to a nursing mother. Interaction with other medicaments and other forms of interaction Pregnancy and fertility ,lactation the patient should wait until the vision clears before driving or using machinery. 4.8 Undesirable effects Summary of safety profile In 13 clinical studies involving 696 patients, Emadine was administered one to four times daily in both eyes for up to 42 days. In clinical trials, approximately 7% of patients experienced an adverse drug reaction associated with the use of Emadine,however,less than 1% of these patients discontinued therapy due to these adverse drug reactions. No serious ophthalmic or systemic adverse drug reactions were reported in the clinical trials Adverse events In controlled clinical studies of EMADINE lasting for 42 days, the most frequent adverse reaction was headache 11%. The following adverse experiences were reported in less than 5% of patients: abnormal dreams, asthenia, bad taste, blurred vision, burning or stinging, corneal infiltrates, corneal staining, dermatitis, discomfort, dry eye, foreign body sensation, hyperemia, keratitis, pruritus, rhinitis, sinusitis and tearing. Some of these events were similar to the underlying disease being studied. The most common adverse drug reactions were eye pain and eye pruritis occurring in 1% to 2.0% of patients. Tabulated list of adverse reactions The following adverse reactions listed below were observed in clinical studies or with post marketing experience.They are ranked according to system organ class and classified according to the following convention: very common (≥1/10), common (≥1/100 to <1/10), uncommon (≥1/1000 to <1/100), rare (≥1/10,000 to <1/1000),very rare (<1/10,000), or not known (cannot be estimated from the available data ). Within each frequency grouping, adverse reactions are presented in decreasing order of seriousness. Please see table below System organ Frequency Adverse reactions Psychiatric disorders Uncommon abnormal dreams Nervous system disorders Uncommon Headache, sinus headache,dysguesia eye pain, ,eye pruritus,eye , conjunctival hyperaemia classification Eye disorders Common corneal infiltrates, corneal staining, blurred vision, eye irritation,dry eye , foreign body sensation in eyes lacrimation increased, asthenopia,ocular hyperaemia Uncommon tachycardia rash Not known Uncommon Cardiac disorders Skin and subcutaneous tissue disorders מצ"ב העלון ,שבו מסומנות ההחמרות המבוקשות על רקע צהוב. שינויים שאינם בגדר החמרות סומנו (בעלון) בצבע שונה(ירוק) .יש לסמן רק תוכן מהותי ולא שינויים במיקום הטקסט הועבר בדואר אלקטרוני בתאריך 2.1.102. כל השינויים עולים בקנה אחד עם תנאי הרישום (תעודת הרישום ,תעודת האיכות וטופס פרטי התכשיר העדכני). כל הכתוב בהצעת העלון ,תואם את תנאי הרישום. קיים עלון לצרכן והוא מעודכן בהתאם. אסמכתא לבקשה :עלון לרופא שאושר ב EMA האסמכתא מצ"ב. השינוי הנ"ל אושר על ידי רשויות הבריאות ב . EMA אני ,הרוקח הממונה של חברת :לפידות מדיקל יבוא ושיווק בע"מ מצהיר בזה כי אין שינויים נוספים ,מלבד אלה שסומנו בהצעת העלון. אני מצהיר כי השינויים אינם יוצרים סתירה פנימית במידע בעלון0 עלון זה לא מטופל במקביל במסגרת אחרת (כגון :עדכון עלון במסגרת בקשה לתוספת התוויה ,החמרה וכו') . במידה וקיים טיפול מקביל במסגרת אחרת -יש לציין זאת. חתימת הרוקח הממונה (שם וחתימה)___________________________ הודעה על החמרה ( מידע בטיחות) בעלון לצרכן (מעודכן ).102.50 תאריך ..2.60.1: שם תכשיר באנגלית ומספר הרישום Emadine-115-37-29747-00: שם בעל הרישום Lapidot medical import and marketing LTD : טופס זה מפרט ההחמרות בלבד ! ההחמרות המבוקשות פרק בעלון אזהרות טקסט נוכחי אם הינך רגיש/ה למזון כלשהו או לתרופה כלשהי ,עליך להודיע על כך לרופא לפני נטילת התרופה. למרכיבי עדשות מגע :אין להרכיב עדשות מגע כאשר העיניים אדומות,ואין לטפל בתכשיר זה בעיניים המגורות עקב הרכבת עדשות מגע. התכשיר מכיל חומר משמר בנזלקוניום כלוריד ,העלול להיספג על ידי עדשות מגע רכות .אין להשתמש בתכשיר זה כאשר אתה מרכיב/ה עדשות מגע רכות .יש להסיר העדשות לפני השימוש בתכשיר ,וניתן להחזירן כעבור לא פחות מ 51 -דקות מהזלפת התרופה לעין. טקסט חדש אם הינך רגיש/ה למזון כלשהו או לתרופה כלשהי ,עליך להודיע על כך לרופא לפני נטילת התרופה. למרכיבי עדשות מגע :אין להרכיב עדשות מגע כאשר העיניים אדומות,ואין לטפל בתכשיר זה בעיניים המגורות עקב הרכבת עדשות מגע. שימוש באמדין לא מומלץ למבוגרים מעל גיל .51 שימוש באמדין לא מומלץ אצל אנשים עם בעיות בכבד או בכליות. הריון והנקה יש להיוועץ ברופא לפני התחלת הטיפול אם הינך מניקה בהריון או מתכננת הריון. נהיגה ושימוש במכונות השימוש בתרופה זו עלול לגרום לטשטוש ראייה ועל כן מחייב זהירות בנהיגה ברכב ,בהפעלת מכונות, וכדומה. תופעות לוואי: בנוסף לפעילות הרצויה של התרופה, בזמן השימוש בה עלולות להופיע תופעות לוואי כגון :כאב ראש. בכל מקרה שבו הינך מרגיש/ה תופעות לוואי שלא צויינו בעלון זה, או אם חל שינוי בהרגשתך הכללית עליך להתייעץ עם הרופא מיד. תופעות לוואי שכיחות: תופעות לוואי הקשורות לעין :כאב בעיניים ,גירוד בעיניים ,אדמומיות בעיניים. תופעות לוואי שאינן שכיחות: תופעות לוואי הקשורות לעין :הפרעות בקרנית, תחושה חריגה בעין ,יצור מוגבר של דמעות ,עיניים עייפות,גירוי בעיניים ,טשטוש בראייה ,צביעת הקרנית ,יובש בעיניים. תופעות לוואי הקשורות לאיברי גוף נוספים :כאב ראש ,קשיי שינה ,כאב ראש בסינוסים ,טעם רע, פריחה. תופעות לוואי ששכיחותן לא ידועה :קצב לב מוגבר. מצ"ב העלון ,שבו מסומנות ההחמרות המבוקשות על רקע צהוב. שינויים שאינם בגדר החמרות סומנו (בעלון) בצבע שונה(ירוק) .יש לסמן רק תוכן מהותי ולא שינויים במיקום הטקסט. הועבר בדואר אלקטרוני בתאריך 2.1.102. :