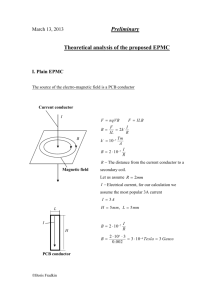
蛋白质分子中某一段肽链的局部空间结构
advertisement

Chapter 5 The Three Dimensional Structure of Proteins 2010.09.07 稳定蛋白质三维结构的力 • • • • • Hydrogen bond (氢键) van der Waals force (范德华氏力) Hydropholic interaction (疏水作用) Salt bridge (盐桥) Di-sulfide bond (二硫键) 多肽主链折叠的空间限制 y f 相邻肽单元的静电排斥 允许区,成对二面角(f,j) 都是立体化学所允许的 不完全允许区,成对二面 角(f,j)是立体化学所允 许的,但不够稳定 在某些特殊的情况下是允 许的 Protein Secondary Structure 定义: 蛋白质分子中某一段肽链的局部空间 结构,即该段肽链主链骨架原子的相对空 间位置,并不涉及氨基酸残基侧链的构象 。 主要的化学键:氢键 蛋白质二级结构 -螺旋 ( -helix) -折叠 (-pleated sheet) -转角 (-turn) 无规卷曲 (random coil) -螺旋(-helix)结构是常见的蛋白质二级结构 每圈螺旋含3.6个氨基酸 沿螺旋轴上升0.54nm 偶极矩 形成螺旋的限制 • R基团的电荷 • R基团的大小 • G和P的出现 -折叠(-sheet)使多肽链形成片层结构 折叠的纸片侧向并排形成,多肽主链沿纸条形成锯 齿状,C位于折叠线上,侧链垂直于折叠平面, 交替从平面上下两侧伸出,纸条间形成的氢键象折 叠平面间的拉链一样 -转角(-turn)和无规卷曲(random coil) 在蛋白质分子中普遍存在 -转角 无规卷曲是用来阐述没有确定规律性的那部 分肽链结构。 纤维状蛋白质 • 纤维状蛋白质(fibrous protein) :单一类型的二级结构 • 球状蛋白质(globular protein):丰富的三级结构 -角蛋白(keratin): 亚基:富含-螺旋的中央棒状结构区域和C端、N端 两个非螺旋帽状结构区域组成 亚基缔合形成纤维状蛋白聚集体 相邻多肽链间由二硫键交联 -角蛋白的结构 丝心蛋白(fibroin)的结构 胶原蛋白(collagen)的结构 原胶原分子(protocollagen) Gly 非-螺旋 Gly-x-y x: Pro y: Hyp 原胶原分子头-尾端通过 分子间交联形成胶原原纤 维(collagen fibril) (Lys—5-OH-Lys) 随年龄增长,分子内和分 子间交联越来越多 Biochemistry in life Permanent waving is biochemical engineering (烫发是一项生物工程) heat Super-secondary structures • 在许多蛋白质分子中,可发现二个或三个具有二级结构的肽 段,在空间上相互接近,形成一个有规则的二级结构组合, 被称为超二级结构 • 一些已经得到鉴定的超二级结构包括 motif, motif, 等等 (a helix bundle) 通常由两股平行或反平行的右手螺旋互相缠绕而成左手超 螺旋(coiled coil, or super coil),如-角蛋白 球状蛋白质中螺旋束由同一条链的临近的螺旋区段组成 ( unit) 由两段平行股和一段作为连接链(connector)的螺旋组 成, 股之间有氢键相连 连接链凡平行地交叉在股的一侧,股的疏水侧链面向 螺旋的疏水面 除a螺旋外,连接链还可以是无规则卷曲 在球状蛋白质中由一条多肽链的若干区域的股反平行组 合而成,两个股间通过一个短回环连接起来 发夹( hairpin),曲折( meander) 结构域(domain) 含数百个氨基酸残基的多肽链经常折叠成两个或多个稳定的、 相对独立的球状实体,称为结构域(structural domain) 常见的结构域一般含有100~200个残基 蛋白质分子中能独立存在、实施特定功能的单位,称功能域 (functional domain) 功能域可以是一个结构域,也可以是多个结构域组成 在二级结构基础上多肽链进一步折叠形成蛋白 质三级结构 三级结构是指整条肽链中全部氨基酸残基的 相对空间位置 定义: 整条肽链中全部氨基酸残基的相对空间位置。 即肽链中所有原子在三维空间的排布位置。 主要的化学键: 疏水键、离子键、氢键和 Van der Waals力等。 球状蛋白质与三级结构 • 球状蛋白质及起亚基的分类 1.全结构(反平行螺旋):螺旋一上一下地反平 行排列,相邻螺旋之间以回环(无规则卷曲或转 角)相连,形成类似筒形的螺旋束 2.,结构(平行片) 1) 单绕平行桶(singly wound parallel -barrel)或 平行桶,呈闭合式圆筒,高度对称;片组成 内桶,螺旋组成外桶 2) 双绕平行片(double wound parallel -sheet)或马 鞍形扭曲片,由4-9个平行的股构成开放式的片, 片的两侧由螺旋和回环保护 3.全结构(反平行片) 疏水残基和亲水残基分别在片层的两侧,两层 片的疏水面对合形成疏水区,相背的两面暴露 于溶剂。 1) 反平行桶 和单绕平行桶相似,但对称性差 2)反平行片(露面夹心,open-face sandwich) 含3-15个股的单层反平行片,不闭合成桶; 片的一侧有一层螺旋和回环,片的另一侧暴 露于溶剂 4.富含金属或二硫键的小蛋白质结构 小蛋白质(或结构域),含少量有规则的二级 结构,但富含金属或二硫键 球状蛋白质三维结构的特征 • 球状蛋白质同时含有几种类型的二级结构元件 • 球状蛋白质三维结构具有明显的折叠层次(二级 结构——超二级结构——三级结构——四级结构) • 球状蛋白质分子是致密的球状或椭圆状实体 • 球状蛋白质疏水残基埋藏在分子内部,亲水残基 暴露在分子表面 • 球状蛋白质分子的表面有一个空穴或裂沟,提供 结合配体的功能 Human serum albumin (Mr 64,500) has 585 residues in a single chain. Given here are the approximate dimensions its single polypeptide chain would have if it occurred entirely in extended conformation or as an helix. 亚基缔合与四级结构 含有二条以上多肽链的蛋白质具有四级结构 有些蛋白质分子含有二条或多条多肽链, 每一条多肽链都有完整的三级结构,称为蛋白 质的亚基 (subunit)。 蛋白质分子中各亚基的空间排布及亚基接 触部位的布局和相互作用,称为蛋白质的四级 结构。 亚基缔合的驱动力主要是疏水作用,亚基 之间的结合主要是氢键和离子键。 由2个亚基组成的蛋白质四级结构中,若亚基分子 结构相同,称之为同二聚体(homodimer),若亚基分子 结构不同,则称之为异二聚体(heterodimer)。 血红蛋白的 四级结构 亚基缔合的优越性 结构更稳定:蛋白质的表面积与体积之比降低 提高遗传经济性和效率:编码单体所需的DNA比编码和完整蛋 白相同分子质量的多肽所需的DNA要少 使生化反应效率提高:催化部位集中 具有别构效应 别构效应(allosteric effect):配体与寡聚蛋白质上 的一个部位结合将通过构象变化影响同一蛋白质分子上其他部 位的结合亲和力 蛋白质的变性和折叠 天然蛋白质(native protein): 在生物学条件下,一种蛋白质 占优势的构象只有一种或少数几种,它们在热力学上是最稳定 的,并具有生物活性 变性(denaturation):在和生理环境不同的条件下,蛋白质的 构象发生或大或小的变化,导致蛋白质丧失生物功能 引起蛋白质变性的因素:温度、pH、溶剂、变性剂 温度:主要影响氢键 pH: 改变蛋白质的电荷,从而引起基团间的静电排斥和 破坏某些氢键 溶剂和变性剂:主要影响了氢键或破坏球状蛋白质内核 的疏水相互作用 蛋白质的变性过程存在协同效应:局部结构的丧失立即降低 其余部分的稳定性 蛋白质的复性 在变性因素除去后,变性的蛋白质又可重新回复到天然构象, 这个过程叫复性(renaturation) 是否所有的蛋白质的变性都是可逆的? 经典的可逆变性试验:RNase A二硫键 的破坏和修复 •Ribonuclease A became reduced and randomly coiled (denatured) in 8 M urea plus -mercaptoethanol, with a loss of the enzymatic activity. • When urea and -mercaptoethanol were removed, the enzymatic activity was slowly regained until fully recovered • All the physical and chemical properties of the refolded enzyme were virtually identical with those of the native enzyme. Q: 复性过程中,肽链是如何能折叠到“正确” 的构象的?链内“二硫键”的形成如何保 证处于正确的位置? 蛋白质复性的途径 1. 对所有构象都逐一尝试? The Levinthal’s paradox(Levinthal矛盾) 2. 累计选择(culmulative selection) 每次尝试时都把正确折叠的那部分结构保留下来, 因此蛋白质折叠的实质就是保留正确折叠的中间 体 球状蛋白质的折叠步骤:①由完全的伸展状态形成局部 的二级结构,即成核 ②通过折叠核的协同聚集形成初始 的结构域 ③由结构域装配成中间体 ④对结构域的构象进 行调整 ⑤最后形成具有完整三级结构的天然蛋白质 分子伴侣参与蛋白质折叠 分子伴侣(chaperon):和部分折叠或折叠不正 确的多肽相结合,以简化正确折叠途径并提供折叠 微环境的蛋白质。 分子伴侣可逆地与未折叠肽段的疏水部分结合随 后松开,如此重复进行可防止错误的聚集发生, 使肽链正确折叠。 分子伴侣也可与错误聚集的肽段结合,使之解聚 后,再诱导其正确折叠。 分子伴侣在蛋白质分子折叠过程中二硫键的正确 形成起了重要的作用。 两种重要的分子伴侣 Hsp70(热休克蛋白,heat shock protein): 与伸展多肽的富 含疏水残基区域相结合,防止肽链的聚集,特别是保护热变 性蛋白和正在合成的蛋白质 陪伴蛋白(chaperonin):也是一种热休克蛋白,是许多不 自发折叠的蛋白质折叠所必需的 异构酶(isomerase) 蛋白质二硫键异构酶(protein disulfide isomerase, PDI):催 化二硫键的互换和改组,直至达到天然构象 肽脯氨酰异构酶(peptide prolyl isomerase, PPI) Biochemistry in life Death by misfolding Cystic fibrosis (囊性纤维化) 编码细胞膜上Cl-通道蛋白(CFTR)的基因突变,导致该蛋白序列错 误,因此折叠错误,无法执行离子通道的能力。 该通道蛋白位于呼吸道、消化道、分泌腺体的表皮细胞上。拥有 正常蛋白的肺部表皮细胞能有效清除细菌;错误折叠的蛋白造成 肺部无法清除细菌,细菌感染导致肺部功能的破坏以及呼吸系统 的衰竭 Prion diseases(朊病毒疾病) “疯牛病”,海绵状脑组织,大脑呈现空洞 “朊病毒”实际上是一种折叠错误的蛋白质PrP(Mr 28 000) 正确折叠形式:PrPc α-螺旋 错误折叠形式:PrPSc β-折叠 小结 1) 蛋白质序列决定蛋白质的三维结构。 2) 蛋白质的功能取决于它的结构. 3) 不同蛋白质具有其独特的结构。 4) 稳定蛋白质结构最主要的力来自于非共价作用。 5) 在众多的蛋白质结构类型中,有一些常见的、通用 的蛋白质结构模式。