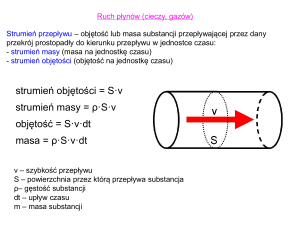
Masa molowa polimerów - obliczanie i wyznaczanie 2022 Spis treści Masa molowa polimerów - definicje Metoda wiskozymetryczna Metoda sedymentacji i ultrawirowania Metody osmotyczne Metody wykorzystujące efekty termiczne Metody chromatograficzne 2 Masa molowa polimerów - definicje Podczas reakcji polimeryzacji powstają cząsteczki – makromolekuły o różnej długości łańcucha czy też wielkości. Teoretycznie każda makrocząsteczka polimeru może mieć inną wielkość, czyli inną masę. Brak ściśle zdefiniowanej masy molowej jest zatem cechą charakterystyczną polimerów. Dla polimerów stosuje się zatem pojęcie średniej masy cząsteczkowej lub średniej masy molowej. Masa molowa i cząsteczkowa, tak jak dla małych cząsteczek związków chemicznych są liczbowo równe, różnią się jedynie jednostką. DEFINICJA Definicja 1: Masa cząsteczkowa polimeru Masa cząsteczkowa polimeru jest to masa pojedynczej cząsteczki wyrażona jest w jednostkach masy atomowej (u) (ang. unit) równych 1/12 masy izotopu węgla 12 C (1,66· 10−27 kg). DEFINICJA Definicja 2: Masa molowa polimeru Masa molowa polimeru jest równa masie cząsteczkowej wyrażonej w g/mol. Określenie średniej masy molowej polimeru jest bardzo istotne, ponieważ wielkość makrocząsteczek i rozrzut ich wielkości wpływa znacząco na właściwości fizykochemiczne, mechaniczne i przetwórcze danego polimeru. Rys. 1 przedstawia przykłady rozkładów mas cząsteczkowych polimerów. Rozkład może być symetryczny (krzywa niebieska), co oznacza, że ilość cząsteczek o dużej masie jest porównywalna z ilością cząsteczek o małej masie. Rozkład niesymetryczny (krzywa czarna) oznacza, że więcej jest cząsteczek o małej masie. Rysunek 1: Przykładowe krzywe rozkładu mas cząsteczkowych polimerów. Istnieje kilka sposobów wyrażania średniej masy molowej polimerów, wielkości rekomendowane przez UPAC [1]. Są to: liczbowo średnia masa molowa, wagowo średnia masa cząsteczkowa, Z - średnia masa cząsteczkowa, lepkościowo średnia masa cząsteczkowa. 3 DEFINICJA Definicja 3: Liczbowo średnia masa molowa czyli stosunek masy próbki polimeru do liczby moli zawartych w niej cząsteczek: ¯¯¯¯¯¯¯ Mn = ∑ ni M i ∑ ni i i (1) gdzie: ni – liczba makrocząstek o masie molowej Mi . DEFINICJA Definicja 4: Wagowo średnia masa cząsteczkowa określa udział wagowy frakcji cząsteczek o określonej masie molowej Mi w całej masie próbki polimeru ¯¯¯¯¯¯¯¯ Mw = ∑ mi M i ∑ mi i i (2) gdzie: mi – oznacza masę frakcji makrocząsteczek o masie molowej Mi , wiedząc, że: mi = ni Mi wyrażenie na średnią wagowo masę cząsteczkową i można ją zapisać jako: ∑ ¯¯¯¯¯¯¯¯ i Mw = ∑ i ni M i2 (3) ni M i Stosunek wagowo średniej masy cząsteczkowej do liczbowo średniej masy cząsteczkowej nazywany jest polidyspersyjnością. ¯¯¯¯¯¯¯¯ M I = ¯¯¯¯¯¯w¯¯ (4) Mn Polidyspersyjność jest miarą rozrzutu mas cząsteczkowych w próbce tego samego polimeru, określa niejednorodność masy molowej polimeru. Jeżeli I=1, wówczas polimer nazywamy monodyspersyjnym, co oznacza, że wszystkie łańcuchy mają tę samą długość. Taka sytuacja występuje tylko w przypadku niektórych polimerów naturalnych. Dla polimerów syntetycznych wytwarzanych przemysłowo wskaźnik ten zawiera się w zakresie od 1,5 do 2. Reakcje polimeryzacji te przebiegają różnie, zależnie od warunków i mechanizmu, co powoduje, że populacje polimerów posiadają losowy rozrzut mas cząsteczkowych. 4 DEFINICJA Definicja 5: Z-średnia masa cząsteczkowa Analogicznie do wyrażenia na wagowo średnią masę cząsteczkową można wprowadzić wyższe stopnie średniej masy cząsteczkowej definiując nową wielkość Zi Zi = mi Mi = ni Mi2 ∑ ¯¯¯¯¯¯¯ Mz = i ∑ i (5) ni M i3 (6) ni M i2 Można wprowadzić jeszcze wyższe stopnie średniej masy cząsteczkowej definiując nową wielkość Zi +1, etc. Masę cząsteczkową polimerów polidyspersyjnych można zatem wyrażać nieskończoną liczbą wartości liczbowych. DEFINICJA Definicja 6: Lepkościowo średnia masa cząsteczkowa czyli średnia masa cząsteczkowa wyznaczona metodą wiskozymetryczną. ¯¯¯¯¯¯¯ Mν = ( i ∑ ∑ i ni M i(1+α) ni M i ) ( α1 ) (7) gdzie: α – stała charakterystyczna dla układu polimer-rozpuszczalnik, przyjmuje wartości od 0,5 do 1,0. Dla polimerów monodyspersyjnych wartości średnich mas cząsteczkowych są sobie równe. Dla polimerów wykazujących polidyspersyjność, rozkład ciężarów cząsteczkowych jest bardziej płaski niż dla polimerów monodyspersyjnych, a poszczególne średnie masy cząsteczkowe różnią się od siebie. Ogólnie relacja pomiędzy poszczególnymi wielkościami jest następująca: ¯¯¯¯¯¯¯ ¯¯¯¯¯¯ ¯¯¯¯¯¯¯¯ ¯¯¯¯¯¯¯ Mn < ¯M ν < Mw < Mz Rys. 2 przedstawia różnice pomiędzy średnimi masami cząsteczkowymi polimeru na tle krzywej rozkładu mas cząsteczkowych. Rysunek 2: Różnice pomiędzy średnimi masami cząsteczkowymi. 5 Do wyznaczania średnich mas molowych polimerów stosuje się różne techniki pomiarowe. Mogą to być metody bezpośrednie (absolutne) – wartość średniej masy cząsteczkowej wynika wprost z pomiaru określonej wielkości fizycznej, metody równoważnikowe, polegające na wyznaczaniu liczby grup końcowych oraz metody pośrednie (względne), które wymagają kalibrowania układu pomiarowego przy pomocy polimerów o znanej masie cząsteczkowej ( Rys. 3 ). Rysunek 3: Podział metod wyznaczania średnich mas cząsteczkowych polimerów. Tabela 1 przedstawia rodzaj wyznaczanej średniej masy cząsteczkowej, zakres pomiary oraz charakterystykę pomiaru w zależności od metody pomiarowej [2]. Tabela 1: Tabela metody pomiaru mas. Metoda wiskozymetryczna Wiskozymetria to metoda polegająca na pomiarze lepkości roztworu polimeru (lepkość – ang. viscosity). Wielkocząsteczkowe polimery wykazują dużo wyższą lepkość niż rozpuszczalniki. W związku z tym, już niewielka zawartość polimeru powoduje wyższą lepkość roztworu. Jest to spowodowane oddziaływaniem makrocząsteczek polimeru z cząsteczkami rozpuszczalnika oraz z innymi makrocząsteczkami. Pojęcie lepkości zostało przedstawione w podręczniku "Chemia ogólna" (zob. Lepkość cieczy ). W pomiarach wiskozymetrycznych porównuje się lepkości czystego rozpuszczalnika i rozcieńczonych roztworów polimeru w tym rozpuszczalniku. Najczęściej dokonuje się pomiarów wiskozymetrycznych względnych, w których porównuje się lepkości czystego rozpuszczalnika i rozcieńczonych roztworów polimeru. Dlatego też wprowadzono następujące pojęcia: 6 DEFINICJA Definicja 7: Lepkość względna obrazuje ona zmianę lepkości pod wpływem dodania polimeru do rozpuszczalnika, jest stosunkiem lepkości dynamicznej danego roztworu do lepkości dynamicznej rozpuszczalnika (cieczy wzorcowej) i wyraża się wzorem η ηr = η (8) 0 gdzie η – lepkość roztworu badanego, η0 – lepkość rozpuszczalnika. DEFINICJA Definicja 8: Lepkość właściwa jest miarą wzrostu lepkości roztworu w stosunku do lepkości rozpuszczalnika; jest wyrażona wzorem ηsp = η−η0 η0 (9) DEFINICJA Definicja 9: Lepkość zredukowana jest stosunkiem lepkości właściwej do stężenia roztworu polimeru ηred = ηsp (10) c DEFINICJA Definicja 10: Graniczna liczba lepkościowa jest parametrem lepkości roztworu o nieskończenie małym stężeniu η [η] = lim csp (11) c→0 Związek między graniczną liczbą lepkościową polimeru i jego średnią masą molową określa wzór Marka-Houwinka: [η] = KM α (12) Który to wzór po przekształceniu pozwala na obliczenie lepkościowo średniej masy molowej: −− ¯¯¯¯¯¯¯ α [η] Mν = √ K (13) gdzie K, α – stałe empiryczne, zależne od temperatury i charakterystyczne dla danego układu rozpuszczalnik – polimer. ¯¯¯¯¯ ¯¯¯¯¯ Wartości K i α wyznacza się je doświadczalnie z krzywej kalibracyjnej zależności ln[η] od ln M n lub ln M w . Do sporządzenia krzywej kalibracyjnej wykorzystuje się frakcje danego polimeru o wąskim rozkładzie mas cząsteczkowych, wyznaczonych 7 wcześniej jedną z metod absolutnych, na przykład metodą chromatografii żelowej. Lepkość roztworów polimeru wyznacza się przy użyciu wiskozymetru Ostwalda , w którym mierzy się czas przepływu cieczy badanej pomiędzy dwoma poziomami w odniesieniu do czasu dla cieczy wzorcowej, lub za pomocą wiskozymetru Ubehlod'a , będącego odmianą metody Ostwalda, bądź lub wiskozymetru Höpplera, w którym mierzy się czas opadania kulki o określonych wymiarach i gęstości w roztworze badanym, względem czasu opadania tej samej kulki w cieczy wzorcowej. Rys. 4 przedstawia schemat wiskozymetru kulkowego. Rysunek 4: Schemat wiskozymetru kulkowego Höpplera. Po zmierzeniu wartości lepkości dla różnych stężeń polimeru w rozpuszczalniku wyrażonych w g/100 cm3 sporządza się wykres η zależności c , czyli ηred = f (c). Graniczną liczbę lepkościową [η] wyznacza przez ekstrapolację tak uzyskanej prostej do c = 0 ( Rys. 5 ). Rysunek 5: Sposób wyznaczania lepkości granicznej metodą ekstrapolacji. Z tak uzyskanej wartości wylicza się na podstawie wzoru ( 13 ) średnią lepkościową masę cząsteczkową badanego polimeru. Metoda sedymentacji i ultrawirowania Sedymentacja jest to proces opadania większych cząstek w rozpuszczalniku pod wpływem siły grawitacji. Makrocząsteczki polimerów trudno sedymentują z roztworów. W takich przypadkach można wymusić sedymentację, np. przez zastosowanie szybkoobrotowej wirówki (ultrawirówki). Ultrawirówka została zastosowana po raz pierwszy przez Svedberga . Za pomocą ultrawirówki można śledzić szybkość sedymentacji lub ustalanie się równowagi sedymentacyjnej. Ultrawirowanie Podczas wirowania z prędkością kątową ω na cząsteczkę o masie m działają trzy rodzaje sił: siła odśrodkowa F = mω2r = ma = V ρa (14) gdzie: ω – prędkość kątowa, r – odległość od osi obrotu, a – przyspieszenie odśrodkowe, V – objętość cząsteczki, ρ – gęstość 8 cząsteczki; tarcie dynamiczne T = f( dr ) dt (15) gdzie: f – współczynnik tarcia, zależny od właściwości cząsteczki oraz lepkości roztworu; siła wyporu W = V ρs ω2r = V ρs a = maρs ρ (16) gdzie: ρs – gęstość cieczy. Cząsteczka porusza się ruchem jednostajnym jeśli siła tarcia i siła wyporu równoważą siłę odśrodkową: F +W +T =0 (17) Podstawiając za odpowiednie siły powyższe wzory otrzymujemy: V (ρ − ρs )ω2 r = f dr −W dt (18) oraz ρ V ρ(1 − ρs ) = f ω12 r dr dt (19) Można zdefiniować stałą sedymentacji S – wielkość charakteryzującą ruch cząsteczki w rozpuszczalniku, która określa prędkość sedymentacji na jednostkę przyspieszenia odśrodkowego: S = ω12 r dr dt (20) Jednostką stałej sedymentacji jest swedberg 1S = 10−13 s Równanie (6) przyjmuje wtedy postać: ρ V ρ(1 − ρs ) = fS (21) Wiedząc, że objętość cząsteczki związana jest z jej masą zależnością: m = V ρ = NM (22) A Korzystając ze wzoru Einsteina na współczynnik dyfuzji: RT D = fN (23) A gdzie: R – stała gazowa, T – temperatura K, otrzymujemy ostatecznie Równania Svedberga: M= RTS (24) D(1− ρs ) ρ Metoda ultrawirowania jest metodą absolutną – mierząc wartości stałej sedymentacji S i współczynnika dyfuzji D oraz znając gęstość rozpuszczalnika ρs i gęstość polimeru ρ wyliczamy z nich wprost masę cząsteczkową M. Metoda równowagi sedymentacyjnej Sedymentacja makrocząsteczek powoduje powstanie gradientu stężenia w roztworze. Po pewnym czasie wirowania ustala się stan równowagi pomiędzy przeciwnie skierowanymi procesami sedymentacji i dyfuzji, zwany równowagą sedymentacyjną. W stanie równowagi sedymentacyjnej substancja rozpuszczona wypełnia całą kuwetę, a jej stężenie zwiększa się od menisku do dna kuwety. Znając stężenia polimeru c1 i c2 w odległości r1 i r2 od osi obrotu w stanie równowagi sedymentacyjnej można wyznaczyć masę cząsteczkową polimeru z równania: c 2RTln c1 M = N (1–V ρ )ω22(r2 –r2 ) A s s 2 (25) 1 Równowaga sedymentacyjna uzyskiwana jest zwykle po kilkudziesięciu godzinach wirowania. Znacznie szybszą wersję omawianej metody zaproponował Archibald [3]. 9 Metoda Archibalda W metodzie Archibalda nie jest niezbędne osiągniecie stanu równowagi. W układzie kuweta - roztwór istnieją dwie płaszczyzny, przez które sedymentujące cząsteczki się nie przemieszczają. Jest to powierzchnia menisku (oznaczona jako a) na styku roztwór/powietrze i dno kuwety ( oznaczone jako b). Zachodzi wtedy warunek: 2 1 dc ( dc ) = r 1c ( dr )b = Sω ra ca dr a D b b (26) Masę cząsteczkową polimeru możemy zatem wyznaczyć przy dnie kuwety, znając jej promień oraz stężenie polimeru: M= RT( dc ) dr (27) ρ (1− ρs )ω2 rc Roztwór polimeru umieszcza się w specjalnej kuwecie, która obraca się w rotorze z częstością powyżej 103 s-1. Kuweta jest umieszczona na drodze wiązki światła, które wpada następnie do detektora. Mierzy się współczynnik załamania światła, który jest proporcjonalny do stężenia substancji rozpuszczonej ( Rys. 6 ). Rysunek 6: Schemat kuwety z sedymentującym roztworem polimeru w ultrawirówce. Metody osmotyczne Osmometria ¯¯¯¯¯¯¯ Osmometria jest wykorzystywana do oznaczania liczbowo średniej masy cząsteczkowej Mn . Wykorzystywane są dwie techniki pomiarowe: osmometria parowa oraz pomiar ciśnienia osmotycznego. Zjawisko osmozy zostało opisane w e-podręczniki "Chemia ogólna" (zob. Zjawisko osmozy ). Osmometria parowa Zgodnie z prawem Raoulta prężność pary nasyconej nad roztworem jest mniejsza od prężności pary nasyconej nad rozpuszczalnikiem. Teoretycznie z różnicy tych ciśnień można obliczyć ułamek molowy substancji rozpuszczonej, a z niego – masę molową. W praktyce różnica prężności jest tak mała, że trudno ją zmierzyć. Znacznie łatwiej zmierzyć różnicę temperatury przy pomocy termistorów – bardzo dokładnych mierników temperatury. Na dwóch termistorach umieszcza się kolejno krople rozpuszczalnika oraz kroplę roztworu polimeru, naczynie pomiarowe wypełnione jest parami rozpuszczalnika, a temperatura obydwu kropel jest taka sama. Z powodu różnicy stężeń polimeru roztworze i rozpuszczalniku (stężenie równe zero) szybkość kondensacji rozpuszczalnika na kropli roztworu jest większa niż na kropli rozpuszczalnika, kondensująca się para oddaje ciepło kropli roztworu i notujemy wzrost różnicy temperatur do momentu wyrównania potencjałów obydwu kropel. Z połączenia praw Raoulta oraz Clausiusa-Clapeyrona otrzymujemy zależność: ¯¯¯¯¯¯¯ X Mn = Ke Δt (28) 10 e Δt gdzie: Ke – stała ebulioskopowa, X – stężenie wyrażone w g/kg rozpuszczalnika. Różnicę temperatur mierzy się dla serii stężeń i ekstrapoluje do stężenia zerowego. Po dokonaniu kalibracji przy użyciu próbek o znanej masie cząsteczkowej [4], na podstawie różnicy temperatur między dwoma termistorami można wyznaczyć masę molową badanego polimeru. Rys. 7 przedstawia schemat układu pomiarowego do osmometrii parowej. Rysunek 7: Schemat układu pomiarowego do osmometrii parowej. Osmometria membranowa Podczas migracji cząsteczek rozpuszczalnika w wyniku różnicy stężeń pomiędzy rozpuszczalnikiem, a roztworem polimeru wytwarza się ciśnienie osmotyczne π, jak pokazano na Rys. 8. Rysunek 8: Ciśnienie osmotyczne powstające w wyniku przenikania cząsteczek rozpuszczalnika do roztworu przez memebranę. Zgodnie z prawem van’t Hoffa wartość tego ciśnienia można wyznaczyć ze wzoru: πv = nRT (29) π = nv RT (30) π = Mc RT (31) π = RT c M (32) Wyznacza się ciśnienie osmotyczne dla różnych stężeń danego polimeru iż wykresu πc = f(c) wyznacza się wartość liczbowo średniej mamy cząsteczkowej. 11 Rysunek 9: Sposób wyznaczania liczbowo średniej masy cząsteczkowej polimeru z pomiarów ciśnienia osmotycznego. Metody wykorzystujące efekty termiczne Metody wykorzystujące efekty termiczne, które są stosowane do wyznaczania średniej masy cząsteczkowej polimerów wykorzystują zjawisko efektu krioskopowego oraz ebuliskopowego. Są to efekty związane ze zmianą temperatury krzepnięcia lub wrzenia roztworu w stosunku do temperatur charakterystycznych dla czystego rozpuszczalnika. Ebuliometria Ciecz zaczyna wrzeć w momencie, kiedy prężność par nad roztworem osiąga wartość równą ciśnieniu zewnętrznemu. Obecność cząsteczek polimeru będzie utrudniała cząsteczkom rozpuszczalnika przechodzenie w stan pary [5], w związku z tym ciśnienie par nad roztworem będzie mniejsze, niż w przypadku czystego rozpuszczalnika. Rysunek 10: Równowaga para-ciecz nad rozpuszczalnikiem oraz roztworem. Prężność par nad roztworem jest sumą prężności par cząstkowych poszczególnych składników roztworu: p=∑ i poi (33) Zgodnie z prawem Raoulta prężność cząstkowa każdego ze składników roztworu związana z ułamkiem molowym tego składnika w roztworze można wyrazić jako: poi = po xi (34) p = por xr + pop xp (35) Ciśnienie całkowite będzie zatem równe: gdzie: r – oznacza rozpuszczalnik, p – rozpuszczony polimer. Ponieważ polimer, jako związek wielkocząsteczkowy jest substancją nielotną, więc prężność jego par będzie równa zero, zatem wyrażenie na ciśnienie całkowite przyjmie formę: 12 p = por xr (36) Δp = por − por xr (37) Δp = por (1 − xr ) (38) Δp = por xp (39) Zaś obniżenie prężności par nad roztworem wyniesie: Z równania tego wynika, że zmiana prężności pary nad roztworem jest zależna od ilości rozpuszczonego polimeru. Zależność temperatury wrzenia od prężności par nad cieczą wyrażona jest równaniem Clausiusa-Clapeyrona: ΔH lnp = − RTpar + C (40) gdzie: ∆Hpar – ciepło parowania rozpuszczalnika J/mol, R – uniwersalna stała gazowa (8,314 J/mol K), C – stała, charakterystyczna dla cieczy. Po wstawieniu wyrażenia na zmianę ciśnienia do tego równania ostateczny wzór na zmianę temperatury wrzenia przyjmuje postać: ΔTb = Ke xp Ke = (41) o )2 R(Twrz ΔH par (42) o – temperatura wrzenia rozpuszczalnika wyrażona w K, gdzie: Twrz Rys. 11 ilustruje związek zmiany prężności pary nad roztworem ze zmianą temperatury wrzenia roztworu w stosunku do czystego rozpuszczalnika. Rysunek 11: Wpływ prężności par nad roztworem na zmianę temperatury wrzenia w stosunku do czystego rozpuszczalnika. Zgodnie z definicją ułamek molowy dla rozpuszczonego polimeru można zapisać: n n xp = n +pn ≅ np p r (43) r gdzie: np – liczba moli polimeru, nr – liczba moli rozpuszczalnika. Wprowadzając zgodnie z definicją liczby moli n do wzoru na ułamek molowy masę polimeru i masę molową otrzymujemy: m xp = M pn (44) p r wyrażenie na zmianę temperatury wrzenia roztworu można przedstawić jako liniową zależność od masy dodanego polimeru. Δ b= e p = Ke p 13 ΔTb = Ke xp = MKen mp (45) p r Wyznaczając zmianę temperatury wrzenia w funkcji masy rozpuszczonego polimeru otrzymuje się prostą, znając współczynnik nachylenia prostej można z niego wyliczyć wprost masę molową badanego polimeru: Ke Mp = an (46) r gdzie: a – współczynnik nachylenia z wykresu ΔT = f(mp ) Pomiar zmiany temperatury wrzenia wykonuje się w ebuliometrze (zob. Ebuliometr ). Krioskopia Analogicznie do metody ebuliometrycznej można wyprowadzić zależność zmiany temperatury topnienia od masy molowej rozpuszczonego polimeru: ΔTk = Kk xp Kk = o R(Tkrzep )2 ΔH top (47) (48) o – ciepło topnienia/krzepnięcia gdzie: ΔHtop Obniżenie temperatury krzepnięcia ilustruje Rys. 12. Rysunek 12: Obniżenie temperatury krzepnięcia roztworu w porównaniu z czystym rozpuszczalnikiem. ΔTk = Kk xp = MKkn mp (49) p r Wyznaczając zmianę temperatury topnienia/krzepnięcia w funkcji masy rozpuszczonego polimeru otrzymuje się prostą, znając współczynnik nachylenia prostej można z niego wyliczyć masę molową badanego polimeru: Kk Mp = an r (50) gdzie: a – współczynnik nachylenia prostej ΔT = f(mp ) Pomiaru dokonuje się w kriometrze. 14 Metody chromatograficzne Chromatografia wykluczania zależnego od wielkości cząsteczek Jedną z najczęściej stosowanych metod wyznaczania mas cząsteczkowych polimerów jest chromatografia żelowo-permeacyjna, zwana częściej chromatografią wykluczania zależnego od wielkości cząsteczek GPC/SEC(GPC – Gel Permeation /SEC – Size Exclusion Column Chromatography. Metoda ta została szerzej opisana w module Chromatografia wykluczenia zależnego od wielkości cząsteczek. Rys. 13 prezentuje sposób wyznaczania masy cząsteczkowej badanego polimeru na podstawie krzywej kalibracyjnej logM = f(Ve ) dla wzorcowych polimerów. Rysunek 13: Sposób odczytywania masy cząsteczkowej badanego polimeru na podstawie krzywej kalibracyjnej. Bibliografia 1. Jones R. G. (reviewed by): Compendium of Polymer Terminology and Nomenclature. IUPAC Recommendations 2008 : Jones R. G., Kahovec J., Stepto R., Wilks E. S., Hess M., Kitayama T., Val Metanomski W. (Eds.), Chemistry International 2009, Vol. 31, Iss. 4, pp. 32-33, dostęp:10.08.2020 2. Bortel E.: Wprowadzenie do chemii polimerów, Nakł. Uniwersytetu Jagiellońskiego, Kraków 1994. 3. Kotaka T., Inagaki H.: The Archibald Ultracentrifugation Method in the Study of Macromolecules, Bulletin of the Institute for Chemical Research, Kioto University 1964, 42(2-3), pp. 176-203, dostęp:02.06.2020 4. Bersted B. H.: Molecular weight determination of high polymers by means of vapor pressure osmometry and the solute dependence of the constant of calibration, Journal of Applied Polymer Science 1973, Vol. 17, Iss. 5, pp. 1415-1430, dostęp:26.05.2020 5. Banaś J., Solarski W. (Red.): Chemia dla inżynierów : materiały do kształcenia w systemie otwartym, AGH Uczelniane Wydawnictwa Naukowo-Dydaktyczne, Kraków 2008. Publikacja udostępniona jest na licencji Creative Commons Uznanie Autorstwa - Na tych samych warunkach 4.0. Pewne prawa zastrzeżone na rzecz autorów i Akademii Górniczo-Hutniczej. Zezwala się na dowolne wykorzystanie treści publikacji pod warunkiem wskazania autorów i Akademii Górniczo-Hutniczej jako autorów oraz podania informacji o licencji tak długo, jak tylko na utwory zależne będzie udzielona taka licencja. Pełny tekst licencji dostępny na stronie https://creativecommons.org/licenses/by-sa/4.0/deed.pl. Data generacji dokumentu: 2022-07-26 11:38:28 15 16