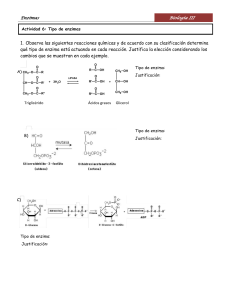
3 Coordinación: Jorge Baldoni Diseño y compaginación: Julio Mendez © Editorial CCC Educando Av. Warnes 2361/5 (1417) Capital Federal Con una tirada 500 ejemplares Impreso en Argentina Queda hecho el deposito que previene la ley 11.723 Autores: Guillermo Alonso Jorge Baldoni Carlos Belluscio Claudio Jensen Mónica Rodríguez ISBN: 978-987-3665-33-2 Biología celular : bionergética y enzimas / Jorge Baldoni ... [et al.] ; coordinación general de Jorge Baldoni. - 1a edición para el alumno. Ciudad Autónoma de Buenos Aires : C.C.C. Educando, 2017. 44 p. ; 20 x 15 cm. ISBN 978-987-3665-33-2 1. Biología Celular. I. Baldoni, Jorge II. Baldoni, Jorge, coord. CDD 571.6 No se permite la reproduccion total o parcial de este libro, ni su almacenamiento en un Índice sistema informatico, ni su transmision en cualquier forma o por cualquier medio, electronico, mecanico, fotocopia, u otros metodos, sin el permiso previo del editor. Presentación La presente colección de “Introducción a la Biología celular y molecular” ha sido elaborada por cada uno de los profesores coordinadores del Departamento de Ciencias Biológicas, con sus respectivos equipos docentes. Sobre la base de un grupo de trabajo interdisciplinario, con amplia experiencia en la enseñanza, en la investigación científica y educativa y, en la particular intersección entre la Escuela Secundaria y la Universidad, se genera la necesidad de brindar un material de lectura adaptado al perfil de los estudiantes que ingresan al CBC, con una mirada puesta en los conocimientos y habilidades intelectuales, necesarios para afrontar la demanda de las futuras carreras, en cada una de las facultades. La Biología celular y molecular contemporánea se caracteriza por atravesar un período de enorme crecimiento tanto en los métodos, como en las técnicas y resultados que requieren de una actualización adecuada, que permita ese tránsito entre la formación recibida en la escuela secundaria y los primeros tramos del ciclo profesional. Por ello, presentamos esta segunda edición que recoge la experiencia obtenida con la edición anterior, las sugerencias de alumnos y colegas, y que ofrece la posibilidad de despertar en el alumno el interés por saber y de impulsarlo a esforzarse para lograr un aprendizaje profundo. En esta oportunidad, contamos con la invalorable colaboración de la Lic. Adriana Schnek que con mucha habilidad y profesionalismo asumió el rol de revisora y editora. También nuestro agradecimiento a Adriana García que coordinó las ilustraciones efectuadas por Eduardo de Navarrete y David Gonzalez Marquez, que tanto ayudan a la comprensión de los distintos temas. Índice Bioenergética y Enzimas Energía 1. El concepto de energía 1.1 La energía no puede ser creada ni destruida 1.2 Cambio de estado de un sistema y variación de energía 1.3 ¿Cómo puede ganar o perder energía un sistema? Trabajo (W) y Calor (Q) 1.4 Energía, calor y trabajo: Entalpía (H) 1.5 La energía es la capacidad de realizar trabajo 1.6. ¿Qué ocurre con la porción de energía “inútil”? Entropía (S) 1.7. ¿Cómo relaciona la termodinámica estos cambios de energía? 1.8 ¿Es posible revertir un proceso espontáneo? El individuo como sistema termodinámico- leyes de la termodinámica 2. Bioenergética 2.1 La célula y la energía química 2.2 El ATP es un intermediario energético 3. Metabolismo celular 3.1 Catabolismo y anabolismo 3.2 El ATP como molécula integradora 4.Enzimas 5. Inhibición de la actividad enzimática 5.1 Inhibición reversible 5.2 Inhibición competitiva 5.3. Inhibición no competitiva 5.4 Inhibición irreversible 6. Regulación de la actividad enzimática 6. 1. Regulación de la actividad catalítica 6.2. Regulación de la síntesis de enzimas 6.3. Regulación de la degradación de enzimas 6.4 Multimodulación 3 3 4 4 5 5 7 7 7 8 9 9 10 10 12 13 13 15 17 19 19 21 21 22 25 26 28 28 29 30 31 33 34 40 40 41 Biología Celular ENERGÍA Al caracterizar a un ser vivo tenemos en cuenta sus funciones vitales básicas: autoconservación, autorregulación y autoperpetuación. La autoconservación se lleva a cabo mediante un conjunto de procesos complejos en los que se obtiene y transforma energía. En este fascículo analizaremos las bases de estos procesos y cómo se regulan, lo que permite la continuidad de la vida. De este modo, analizaremos los conceptos fundamentales sobre energía, las leyes que permiten interpretar sus transformaciones y cómo éstas operan en los seres vivos. 1. El concepto de energía El concepto de energía es fundamental en las ciencias naturales. Sin embargo, no es de fácil defin ción. Es de uso frecuente, no sólo en las distintas ramas de la ciencia, sino en los distintos aspectos de la sociedad humana. Por ejemplo, todos tenemos “conciencia” de la necesidad de la energía: un automóvil requiere energía para circular, requerimos energía para caminar, etc. También sabemos que la nafta suministra la energía para que el automóvil funcione o que los alimentos son indispensables pues proporcionan la energía necesaria para mantener nuestras funciones; o que el sol nos da energía en forma de luz y calor. La física define a la energía como la causa capaz de producir un trabajo. Esta energía puede ser potencial, cuando un objeto almacena energía por su posición (un coche parado, una célula nerviosa en reposo); cinética, cuando existe movimiento (el automóvil en movimiento, el espermatozoide en movimiento), calórica (por ejemplo, desprendimiento de calor durante el trabajo muscular), eléctrica (por ejemplo, el pasaje de iones a través de una membrana) o química (por ejemplo, la existente en las uniones de átomos y moléculas). La rama de la ciencia que estudia los cambios energéticos del universo es la termodinámica, término griego que significa “movimiento del calor”. Este campo de estudio se ocupa solo de los aspectos macroscópicos de un sistema: temperatura, presión, volumen, trabajo, calor, desorden, etc. A partir de este marco, se analizan fundamentalmente los cambios de energía que acompañan a un proceso en particular, en un sistema determinado. No requiere del conocimiento acerca del contenido de energía del sistema sino de la variación que se produce entre un estado inicial, antes del cambio, y un estado final, luego del cambio; lo que se designa mediante la letra griega Δ (delta). Debe considerarse, además, que la termodinámica puede suponer que un sistema es todo el universo o bien una parte de él, que se separa en forma teórica para su estudio del entorno que lo rodea. En relación con el entorno, el sistema en estudio puede ser: aislado, si no permite intercambio alguno con ese entorno (por ej. un termo) cerrado, permite el intercambio de energía pero no de materia (por ej. una pila electroquímica) abierto, si permite el intercambio energía y materia (por ej. el cuerpo humano) 3 Bioenergética y Enzimas 1.1 La energía no puede ser creada ni destruida La Ley de Conservación de la Energía, conocida como 1ª Ley de la Termodinámica, establece que la energía no puede ser creada ni destruida. Si bien puede convertirse de una forma a otra, (es decir, cualquiera sea el proceso considerado, la energía podrá cambiar de forma o transferirse de un lugar a otro), la energía total (energía del sistema + energía del entorno) permanece constante. Los ejemplos de transformaciones de energía son tantos como los procesos que existen en el universo. No hay proceso de cambio sin transformación energética. Así, al quemar gas, la energía química que contienen las moléculas que lo componen se transforma en energía térmica produciendo calor, capaz de calentar agua. De forma análoga, la energía química presente en las moléculas de los hidratos de carbono y lípidos almacenados en las células es utilizada en reacciones químicas permitiendo que se lleven a cabo sus funciones vitales. En dichos procesos también se libera energía térmica. Los átomos mismos son paquetes de energía transformable. La fusión de los núcleos de átomos de hidrógeno forma átomos de helio, producidos en el interior de ese gran reactor nuclear que es el sol. Este proceso genera energía radiante, la que al llegar a la Tierra es, en parte, absorbida por las plantas mediante el proceso de fotosíntesis, convertida en energía eléctrica y posteriormente en energía química, como se verá más adelante. 1.2 Cambio de estado de un sistema y variación de energía Cualquiera sea el sistema que se considere –gaseoso, líquido o sólido– la cantidad total de energía que gana o pierde al cambiar de un estado definido a otro estado definido es la misma, independientemente del camino seguido. Si por ejemplo se considera un sistema y se produce un cambio del estado A al estado B, al invertirse el cambio del estado B al A, independientemente del camino seguido, la variación de energía debe ser la misma. Si llamamos EA y EB a los respectivos valores de la energía del sistema en los dos estados considerados, la variación de energía cuando se pasa del estado A al B será: Δ E = EB – EA De acuerdo con lo expresado, si una piedra cae de la cima de una montaña desde una cierta altura, liberando energía, se requerirá de una cantidad de energía equivalente para volverla a poner en la cima, lo que será independiente de si se la lleva rodando por un camino o se la levanta mediante una grúa. Análogamente, si se quema glucosa mediante una llama hasta convertirla en dióxido de carbono y agua, liberará la misma cantidad de energía que cuando el proceso se realiza en una célula. De igual manera, la cantidad de energía necesaria para formar glucosa por medios químicos, será idéntica a la que requiere una célula vegetal para fabricarla. Esto último es una ventaja para el experimentador, pues permitirá, por ejemplo, medir la energía que se produce al quemar glucosa, externamente, mediante el uso de un dispositivo adecuado, y ésta será la misma que se libera cuando la célula la degrada. Por supuesto, no será lo mismo quemar o fabricar una sola molécula de glucosa que muchas; la energía del sistema dependerá de la cantidad de sustancia que contiene y si la cantidad de sustancia cambia, la energía del sistema variará también proporcionalmente. 4 Biología Celular 1.3 ¿Cómo puede ganar o perder energía un sistema? Trabajo (W) y Calor (Q) Cuando un sistema cambia de un estado a otro puede perder o ganar energía bajo dos formas: calor y trabajo. Esa ganancia o pérdida de energía la hará a expensas del entorno. La física define el trabajo mecánico, simbolizado por la letra W, como una magnitud (con unidades de energía) resultante de la aplicación de una fuerza a través de una distancia dada. Matemáticamente, esto se expresa como el producto de la fuerza por el desplazamiento. A su vez, este producto tiene un signo (positivo o negativo) dependiendo de la coincidencia o no entre el sentido de aplicación de la fuerza y el sentido del desplazamiento. Por ejemplo, cuando empujamos un objeto pesado el sentido de aplicación de la fuerza coincide con el sentido del movimiento del objeto. Más generalmente, en un sistema determinado el trabajo, por convención, se considera positivo si es realizado por el sistema y negativo si es realizado por el entorno sobre el sistema. El calor, una de las formas de energía, se transmite de un cuerpo a otro cuando existe una diferencia de temperaturas entre ambos. El calor se designa con la letra Q, siendo positivo cuando es absorbido desde entorno y negativo (-Q), si se desprende del sistema hacia el entorno. ¿Qué ocurre con la energía total de un sistema (también llamada energía interna del sistema) cuando éste sufre un cambio de estado? Una consecuencia natural de la Primera Ley de la Termodinámica es que, si el sistema está aislado, la energía interna que contiene debe permanecer constante. Si por el contrario el sistema no está aislado, y puede intercambiar energía con su entorno, deberá cumplirse que la variación de energía del sistema al pasar de un estado a otro sea idénticamente igual al intercambio de energía entre el sistema y su entorno. Aceptando que las únicas formas de producir ese intercambio son el calor y el trabajo, resulta: ΔE=Q-W de manera tal que la energía total del sistema más su entorno permanezca sin variación alguna. La expresión anterior suele presentarse como la formulación matemática de la Primera Ley de la Termodinámica. 1.4 Energía, calor y trabajo: Entalpía (H) Los sistemas materiales en cualquiera de sus estados (gaseoso, líquido o sólido) están constituidos por átomos y moléculas en continuo movimiento. Según el estado en que se encuentren los átomos y moléculas el movimiento será mayor o menor; es decir tendrán distinta energía cinética, la que podemos sentir de una forma que llamamos calor. Es necesario destacar que la materia no contiene calor propiamente dicho sino que tiene energía en distintas formas, y esta energía puede transferirse de un sistema a otro en forma de calor. La transferencia de calor será de un cuerpo a otro y se realizará siempre en forma espontánea del cuerpo más caliente al más frío. Si se entrega calor, los átomos y moléculas que constituyen el sistema en estudio tienden a separarse produciendo una expansión, es decir, un aumento de volumen. Esto ocurre con la mayoría de los sistemas materiales los que al calentarse tienden a expandirse y al enfriarse se contraen. En la construcción de viviendas, por ejemplo, al realizarse una estructura de concreto, se deja un espacio libre para permitir la expansión, de lo contrario se produce un resquebrajamiento o rajadura. 5 Bioenergética y Enzimas Cuando la expansión (es decir, el aumento de volumen) se realiza contra una fuerza exterior que se opone a la misma (como por ejemplo la presión exterior), y si consideramos que la presión exterior es constante, el sistema, al recibir calor y expandirse, efectuará un trabajo que será igual al producto de la fuerza (que, expresada por unidad de superficie, es la presión P) multiplicada por la distancia (la variación de volumen ΔV) y según la Primera Ley de la Termodinámica: ΔE = QP - W ó ΔE = QP - P ΔV Estas expresiones indican que la variación de energía producida en el sistema al absorber una determinada cantidad de calor del entorno estará equilibrada por el trabajo efectuado por el sistema el entorno. Otra forma de expresarlo es que la cantidad de calor absorbido por el sistema es: QP = ΔE + P ΔV (1) Si por otro lado el sistema absorbe calor, pero sin que exista variación de volumen, no efectuará trabajo alguno. ΔV = 0 y por lo tanto Δ E = QV Es decir que el sistema incrementará su energía en una magnitud proporcional al calor que absorba. Si por el contrario el sistema perdiera calor hacia el entorno, disminuiría la energía del mismo en forma proporcional. Cuando un sistema absorbe calor se dice que el proceso es endotérmico y si por el contrario libera calor es exotérmico. La variación de energía de un sistema depende, segn vimos, del estado inicial y final del mismo y no de la condición previa ni del camino por el cual se realizó el proceso; si reemplazamos en la ecuación (1) ΔE por E2 – E1 y ΔV por V2 –V1 (donde 1 y 2 indican los estados inicial y final, respectivamente, de nuestro sistema, siempre considerando la presión como constante): QP = ΔE + P ΔV QP = (E2 – E1) + P (V2 –V1) y QP = (E2 + PV2) – (E1 + PV1) donde el término E + PV representa el contenido calorífico, o entalpía, del sistema y se designa con la letra H; de ello se desprende que: QP = H2 – H1 = ΔH Esto significa que el aumento o disminución del contenido calorífico de un sistema será igual al calor absorbido a presión constante: ΔH = ΔE + P ΔV y si no se efectúa trabajo alguno ΔH = ΔE El término ΔH se utiliza generalmente para expresar la variación de calor en las transformaciones de energía. Así una ΔH positiva (+) indicaría un cambio exotérmico y una ΔH negativa (–) un cambio endotérmico. 6 Biología Celular 1.5 La energía es la capacidad de realizar trabajo: ¿toda la energía puede convertirse en trabajo? Energía libre (G) Retomando un ejemplo anterior, en un automóvil, al quemar un combustible como el gas, la presencia de un dispositivo mecánico como un motor permite que se mueva. Parte de la energía del combustible, mediante el calor que se genera en la combustión dentro del cilindro, se transforma en energía mecánica pero una porción de energía es expulsada por el caño de escape. Parte de la energía que contenía el combustible produjo un trabajo pero existe una cantidad no recuperable que es expulsada. Se ha determinado que esto no solo ocurre con un motor de combustión interna sino con cualquier tipo de maquina térmica. Es decir que solo una parte de la energía producida por el combustible es “útil” o capaz de realizar trabajo. Esta cantidad de energía “útil” se llama energía libre y se designa con la letra G. Así como cuando nos referimos a los intercambios de calor, expresamos que si un sistema absorbe calor el proceso es endotérmico y si libera calor es exotérmico, en forma análoga, diremos que el proceso es endergónico si requiere el aporte de energía útil desde el entorno y es exergónico si libera energía útil al entorno. 1.6 ¿Qué ocurre con la porción de energía “inútil”? Entropía (S) De acuerdo con la teoría del big-bang, el universo está en constante expansión. Al expandirse, aumenta el desorden y tiende, en miles de millones de años, al caos. Toda organización, desde la estructura interna de un átomo, la asociación de los mismos en moléculas, y de allí a las estructuras celulares, requerirá de energía pues deberá de alguna manera oponerse a la tendencia al desorden. Como la energía total del universo es constante, es la porción de energía disipada como calor (“inútil”) la que aumenta el desorden. Ese desorden se conoce con el nombre de entropía y se designa con la letra S. 1.7 ¿Cómo relaciona la termodinámica estos cambios de energía? La Segunda Ley de la Termodinámica explica la relación entre energía libre y entropía. Se ha observado que siempre que se produce una transformación de energía capaz de generar trabajo, parte de la misma se pierde en forma irrecuperable aumentando el desorden del entorno. La termodinámica expresa en su segunda ley: “todo cambio energético se produce desde estados de mayor energía a menor energía”. Esto trae como consecuencia que durante los cambios energéticos la tendencia natural, que llamaremos espontánea, será la que permita la realización de un trabajo pero aumentando la entropía, el desorden del universo. Es necesario aclarar que la característica de espontaneidad estará dada para todo proceso que no requiere energía externa, por lo que se dice que está termodinámicamente favorecido. Como consecuencia de esto, todo proceso espontáneo sin aporte de energía externa será irreversible. Si, por ejemplo, consideramos un gas, éste tendrá la tendencia natural, espontánea, de expandirse en el vacío. En toda reacción química espontánea, los productos tendrán un contenido energético menor que el de las sustancias que reaccionan. 7 Bioenergética y Enzimas 1.8 ¿Es posible revertir un proceso espontáneo? En los ejemplos anteriores, para revertir la situación del gas, será necesario el aporte de energía externa, es decir del entorno, de manera tal que mediante la ejecución de un trabajo se pueda comprimir el gas. Al mismo tiempo, se producirá una cantidad equivalente de calor, con el consiguiente aumento de temperatura. Tercera Ley de la Termodinámica Todo sistema tiende a aumentar su entropía, es decir su desorden. Cuanto más ordenado es un sistema mayor cantidad de energía requiere para mantener dicho orden. En consecuencia, la entropía disminuye en los estados desde el gaseso, al líquido, al sólido. Se ha podido determinar que en el cero absoluto, que corresponde a 0 grados Kelvin, aproximadamente 273,16 ºC, se está en presencia de lo que se llama el “cristal perfecto”, temperatura por debajo de la cual no puede existir un orden mayor. Sobre esta base, se ha enunciado la Tercera Ley de la Termodinámica que expresa que la entropía de una sustancia disminuye al descender la temperatura llegando a tener valor 0 en el 0 absoluto. Esta cantidad de calor no podrá ser convertida en trabajo, sino que será liberada al entorno y contribuirá a aumentar el desorden. Durante mucho tiempo se intentó convertir este excedente de energía calórica en trabajo construyendo una máquina adecuada a tal fin, con lo cual se tendría una máquina perfecta. Ahora se sabe que es imposible; el primer intento fue la máquina a vapor, en la que una parte de la energía térmica obtenida a partir de un combustible adecuado se transformaba en energía mecánica capaz de mover unas paletas en el agua, pero parte de dicha energía se perdía irremediablemente como calor. En toda máquina construida, ya sea a vapor, térmica, eléctrica, etc., siempre existe una porción de calor irrecuperable que se pierde en el entorno. Los conceptos termodinámicos expresados hasta aquí (energía, entropía, entalpía, endotérmico, exotérmico, endergónico, exergónico) permitirán al lector comprender con mayor claridad su aplicación a los procesos biológicos que se desarrollarán a lo largo del curso. ______________________________________________________________________ 8 Biología Celular EL INDIVIDUO COMO SISTEMA TERMODINÁMICO- LEYES DE LA TERMODINÁMICA 2. Bioenergética Los seres vivos tienen un elevado grado de orden molecular que se sostiene por un necesario aporte de energía cuya fuente primordial es el Sol. Las transformaciones y cambios que sufre esa energía en los organismos vivos son estudiados por una rama de la Biología que se denomina Bioenergética. Ésta se basa en lo establecido por las Leyes de la Termodinámica. Las Leyes de la Termodinámica se aplican a todos los sistemas, incluidos los sistemas vivientes. Según la 1º Ley de la Termodinámica, la energía total del sistema (por ej. una célula) y de su entorno permanecen constantes. Esto signi ica que el sistema no puede crear energía, sino que solamente puede transformarla de un tipo a otro. Es decir que los seres vivos absorben de su entorno un tipo de energía, parte de la cual resulta “útil”, y devuelven al entorno una cantidad equivalente de energía en una forma menos utilizable para el sistema. El tipo de energía útil para la célula se denomina energía libre, como de inimos anteriormente, y será aquella capaz de realizar un trabajo en la célula (por ejemplo, transportar moléculas, contraer músculos o sintetizar proteínas), mientras que la energía no utilizable para la célula consiste principalmente en energía calórica, que devuelve a su entorno y que en él se distribuye azarosa-mente. La 2º Ley de la Termodinámica permite explicar qué ocurre con la energía devuelta por la célula a su entorno. Esta ley establece que los procesos químicos y físicos tienden a aumentar la entropía del sistema más su entorno. Es decir que en todo proceso aumenta el desorden del universo, tendiendo a alcanzar un valor máximo. Pero anteriormente caracterizamos a la célula como un sistema que posee un elevado grado de orden molecular ¿y entonces? Lo que ocurre es que la energía disipada hacia el entorno, aumentan la entropía o desorden del mismo. Dicho de otro modo, las células mantienen su orden a expensas de aumentar el desorden o caos de su entorno. ¿Podemos considerar a la célula como un sistema que extrae energía libre del medio? Sí, y además es un sistema muy eficaz, ya que la eficacia con que convierte esa energía en trabajo es superior al de las máquinas construidas por los humanos. Las estructuras de transformación de la energía que posee la célula están constituida por moléculas orgánicas relativamente frágiles e incapaces de resistir temperaturas elevadas o corrientes eléctricas intensas. La energía que la célula toma de su entorno se acumula en forma de energía química (energía contenida en los enlaces químicos entre los átomos que constituyen las moléculas), o un trabajo osmótico como ocurre en el transporte de materiales hacia el interior de la célula, o un trabajo mecánico como ocurre en la contracción muscular o en la locomoción. Estos conceptos nos permiten afirmar que la célula es un sistema químico isotérmico y constituye un sistema abierto. 9 Bioenergética y Enzimas 2.1 La célula y la energía química La energía libre que utiliza la célula para los distintos tipos de trabajo celular, independientemente de la forma en que la obtiene, se almacena en forma de energía química. Como vimos antes, la energía química es aquella contenida en los enlaces que unen a los átomos al constituir moléculas. Al romperse un enlace químico, la forma de energía que se libera es también energía química. ¿Todas las células obtienen del entorno el mismo tipo de energía? La respuesta es no. Teniendo en cuenta el tipo de energía que las células obtienen de su entorno, las podemos clasificar básicamente en dos grandes grupos. El primer grupo lo constituyen las células autotróficas fotosintéticas, que fabrican compuestos químicos (su alimento) a partir de la energía lumínica. Estas células se caracterizan por utilizar como principal fuente de energía a la luz solar. La energía lumínica es absorbida por un pigmento denominado clorofila y es transformada en energía química, que es utilizada en distintos trabajos dentro de la célula. El segundo grupo lo conforman las células heterotróficas (aquellas que no sintetizan directamente sus alimentos), que aprovechan del entorno la energía química contenida en diferentes moléculas orgánicas ricas en energía, como la glucosa. La energía contenida en estas moléculas es utilizada posteriormente en diversos tipos de trabajo celular. Si bien estos dos grupos celulares difieren en la forma de energía tomada del entorno, ambos la acumulan en forma de energía química en un compuesto químico denominado ATP. El ATP actúa como el transportador de energía química más importante en las células de todas las especies vivientes. 2.2 El ATP es un intermediario energético El ATP tiene un papel central en el metabolismo de las células. Su estructura y características se han desarrollado en el fascículo 2. GRUPOS FOSFATO RIBOSA PURINA Fig. 1. Representación esquemática de la estructura de una molécula de ATP. 10 Biología Celular Como vimos, el enlace entre el segundo y el tercer grupo fosfato es un enlace rico en energía, lo que significa que necesita el aporte de mucha energía para establecerse y que al romperse libera a su vez gran cantidad de energía. El aporte energético para la formación del ATP proviene de la energía libre obtenida por la célula de su entorno, la que entonces queda recuperada como energía química en este tercer enlace fosfato del ATP. La energía liberada al producirse la ruptura de este enlace se utiliza en los distintos tipos de trabajos celulares. Esto explica el concepto de intermediario energético del ATP, ya que lo podemos considerar como un transportador de energía hacia los distintos puntos celulares en donde es requerida para realizar algún tipo de trabajo celular. ¿Qué ocurre con el ATP cuando se rompe su tercer enlace fosfato? Lo primero que debemos recordar es que se libera una buena cantidad de energía que será utilizada convenientemente por la célula en distintos trabajos. El otro producto de esta ruptura química es el ADP (adenosina difosfato), que es la molécula en que se convierte el ATP al perder su tercer grupo fosfato. La regeneración del ATP se consigue con la fosforilación del ADP, la que requiere una molécula de ácido fosfórico y energía suficiente para formar el enlace. NH2 NH2 N O- O- O P O P - O O HC OO P O N CH2 O O H H OH OH C C C N N N CH O- HC O- O P O P O O O N CH2 O H H C C C N N CH + OO P - O O + ENERGÍA OH OH Fig. 2. Esquema de la ruptura del ATP y su conversión en ADP más fosfato, con la consecuente liberación de energía. La doble flecha indica la bidireccionalidad de esta reacción química. Se ha demostrado que dentro de todas las células existe una concentración relativamente constante de ATP, ADP y AMP (adenosina monofosfato). Asimismo se observa que en una célula con un metabolismo muy activo, la concentración de ATP supera ampliamente la de ADP. Si repasamos lo explicado anteriormente, nos daremos cuenta que cuando la célula consume ATP, se genera ADP, y que al tomar del entorno energía libre, ese ADP es fosforilado a ATP, y así sucesivamente. Es decir que se genera un ciclo, denominado ciclo del ATP, en donde se entiende claramente su papel de intermediario energético. 11 Bioenergética y Enzimas ´ ´ ´ ´ Fig. 3. Esquema que representa el ciclo del ATP. La energía contenida en el ATP es utilizada para distintos trabajos celulares como los indicados en la figura, generándose ADP. Este es fosforilado y forma ATP a partir de la energía útil obtenida por la célula del entorno. 3. Metabolismo celular El metabolismo intermediario, o metabolismo celular, puede definirse como el conjunto de reacciones bioquímicas que ocurren en el interior de una célula. Estas reacciones ocurren de manera ordenada, eficaz y específica debido a que cada una de ellas está catalizada por enzimas El metabolismo celular se puede resumir en los siguientes procesos: a) obtención de energía química a partir de moléculas orgánicas combustibles o de la luz solar, en ambos casos provenientes del entorno (exógenos), b) conversión de los principios nutritivos exógenos en precursores de las macromoléculas de la célula, c) ensamblaje de estos precursores en proteínas, ácidos nucleicos, lípidos y otros componentes de la célula, y d) formación y degradación de las biomoléculas que cumplen funciones especializadas de la célula. Como vimos anteriormente, las reacciones endergónicas son aquellas que necesitan el aporte de energía química, mientras que las reacciones exergónicas son aquellas que liberan energía química. ¿De dónde proviene la energía necesaria para que ocurran procesos endergónicos en las células?: Proviene del ATP, transformándose en ADP. ¿Qué compuesto capta la energía libre producida en una reacción exergónica?: El ADP, transformándose en ATP. 12 Biología Celular De estas dos respuestas surge el papel de intermediario común del ATP, ya que brinda la energía contenida en su enlace fosfato rico en energía que se utiliza en los procesos endergónicos, y es regenerado a partir de la energía liberada de los procesos exergónicos, la que se utiliza en la fosforilación del ADP. De esta manera, el ATP realiza el acoplamiento energético de estos dos tipos de reacciones que ocurren en el metabolismo celular. 3.1 Catabolismo y anabolismo El metabolismo celular se divide en dos fases principales denominadas catabolismo y anabolismo. El catabolismo constituye la fase de degradación, en la cual las moléculas complejas y relativamente grandes (glúcidos, lípidos y proteínas) que obtiene la célula del entorno o que tiene reservadas, son degra-dadas a moléculas más sencillas (ácido láctico, CO2, urea, etc.). En esta degradación se extrae la energía contenida en sus enlaces, que será utilizada en los distintos trabajos celulares, y conservada en la célula en forma de ATP a partir de la fosforilación del ADP. Es decir que los procesos catabólicos están siempre acompañados de liberación de energía, con la cual se forma ATP. El anabolismo constituye, en cambio, la fase constructiva o biosintética del metabolismo, en la cual se produce la biosíntesis de todos los componentes moleculares de la célula a partir de precursores sencillos. Al partir de moléculas sencillas y construir moléculas complejas, en los procesos anabólicos se deben formar nuevos enlaces químicos que requieren energía. El ATP es el encargado de aportar esta energía en todos los procesos biosintéticos de la célula. El catabolismo y el anabolismo ocurren en la célula de forma simultánea, y el nexo entre ambos tipos de procesos lo realiza el intermediario energético ATP, encargado de transferir la energía obtenida en los procesos catabólicos hacia los que requieren energía, es decir los anabólicos. 3.2 El ATP como molécula integradora Si repasamos lo que vimos sobre el metabolismo, veremos que conceptualmente hablamos de cuatro tipos de procesos: 1) aquellos que liberan energía o exergónicos, 2) aquellos que consumen energía o endergónicos, 3) aquellos que degradan moléculas complejas o catabólicos, y 4) aquellos que sintetizan moléculas complejas o anabólicos. El ATP, como intermediario energético y molécula de transferencia de energía, permite la conexión de todas las reacciones que ocurren en el metabolismo celular de la siguiente manera: la energía liberada por los procesos exergónicos es recuperada en forma de ATP a partir de la biosíntesis del mismo al fosforilarse el ADP con este aporte energético; mientras que la energía consumida por los procesos endergónicos es aportada por la ruptura del ATP al transformarse en ADP. De la misma manera, la energía liberada al degradar moléculas complejas en los procesos catabólicos es utilizada en la fosforilación del ATP; mientras que la energía requerida para la biosíntesis de moléculas complejas en los procesos anabólicos es aportada por la ruptura del ATP. 13 Bioenergética y Enzimas Esto nos permite sacar dos conclusiones: 1) el ATP conecta todas las reacciones del metabolismo celular a modo de intermediario energético, 2) los procesos catabólicos son exergónicos (es decir, liberan energía) mientras que los anabólicos son endergónicos (es decir, requieren energía). Fig. 4. Esquema que relaciona los procesos anabólicos y endergónicos con los catabólicos y exergónicos en el metabolismo celular. 14 Biología Celular 4. Enzimas Las enzimas tienen en su mayoría composición proteica, aunque también se han encontrado moléculas de ARN, conocidas como ribozimas, con capacidad catalítica. Actúan como catalizadores biológicos aumentando la velocidad con que ocurren ciertas reacciones químicas e intervienen en la interconversión de distintos tipos de energía. En el inicio de todos los procesos químicos –ya sea endergónicos o exergónicos–,se requiere cierta energía de activación, que es la cantidad mínima de energía necesaria para que se lleve a cabo una determinada reacción química. A medida que la temperatura aumentase acelera la velocidad de las reacciones químicas por incremento del número de choques entre las moléculas implicadas. Pero en los seres vivos este aumento no puede ser indefinido, debido a que las proteínas en general son funcionales en un rang de temperatura óptimo. Las enzimas disminuyen la energía de activación de las reacciones químicas. Ribozimas En los años ochenta, Thomas Cech y Sidney Altman, de la Universidad de Yale, describieron la existencia de moléculas de ARN con capacidad catalítica: se las denominó ribozimas. Desde entonces se han encontrado ribozimas participando en los procesos de maduración del ARN y la síntesis de proteínas. Este descubrimiento echó por tierra el dogma de que todas las enzimas son proteínas. Por lo tanto, podríamos concluir que los catalizadores aceleran las reacciones químicas al disminuir la energía de activación (Figura 5). Aquellas moléculas sobre las que actúan las enzimas reciben el nombre de sustratos y aquellas que resultan de dicha acción reciben el nombre de productos; esto se puede esquematizar por la ecuación que se describe a continuación: S E P Donde “S” es el sustrato, “P” el producto y “E” representa a la enzima. ¿Cómo se nombran las enzimas? En un principio los enzimas fueron designadas añadiendo el sufijo -asa a continuación del nombre de su sustrato, por ejemplo la enzima arginasa cataliza la hidrólisis de la arginina a ornitina y urea, pero con el paso del tiempo este sistema resultó insuficiente. En la actualidad, se utiliza un sistema que divide a las enzimas en seis clases principales (óxido-reductasas, transferasas, hidrolasas, liasas, isomerasas, y ligasas) que a su vez se ramifican en subclases de acuerdo al tipo de reacción en el que participan. 15 Bioenergética y Enzimas Nivel energético de los estados de transición sin catalizador (A) y con catalizador (B) Fig. 5. Valores relativos de energía de activación en una reacción que transcurre en presencia (1) o ausencia (2) de un catalizador. Observar también el cambio total de energía al pasar de sustratos a productos (3). 16 Biología Celular 4.1 Características de las enzimas Las enzimas son catalizadores producidos por los seres vivos, que logran acelerar más de un millón de veces las reacciones químicas en los sistemas biológicos. La enzima más difundida en los sistemas biológicos por su gran capacidad catalítica es la anhidrasa carbónica que participa en la hidratación del dióxido de carbono (CO2). Cada una de estas enzimas puede hidratar 105 moléculas de CO2 por segundo y de esta manera esta reacción es 107 veces más rápida que la misma reacción en ausencia de catalizador. Además de incrementar la velocidad de las reacciones químicas, las enzimas son altamente específicas, esto quiere decir que participan de una determinada reacción química reconociendo y actuando sobre un sustrato en particular, por lo que es necesaria la existencia de una gran variedad de enzimas en un ser vivo de modo que catalicen los procesos bioquímicos propios de los procesos vitales. Peroxisomas y enzimas oxidativas Los peroxisomas son organelas que tienen una función importante en la detoxificación. Su nombre se debe a que son capaces de formar y descomponer peróxido de hidrogeno (H2O2 ), para lo cual contienen en su interior diversas enzimas oxidativas. El H2O2 es tóxico para la célula y los peroxisomas poseen entre sus enzimas a la catalasa que convierte H2O2 en O2 y H2O. Este proceso se evidencia al agregar agua oxigenada en una herida. Se observa rápidamente un burbujeo debido al oxígeno liberado por acción de la catalasa. Se genera de esta manera un ambiente rico en O2 que es hostil para bacterias anaerobias que podrían causar infecciones. Al igual que otros catalizadores no biológicos, las enzimas poseen las siguientes propiedades: - Son eficientes en pequeñas cantidades. - Se recuperan luego de la reacción, o sea, una molécula de enzima puede actuar sobre numerosas moléculas de sustrato. - No alteran el equilibrio de las reacciones que catalizan. Los estados inicial y final de la reacción en que participan permanecen inalterados, solo permiten que se alcance el equilibrio en un tiempo mucho menor. Las enzimas más comunes son de naturaleza proteica por lo que sus estructuras se verán afectadas por la temperatura y el pH y, si estas variables no se encuentran en el rango óptimo, se verá afectada su capacidad catalítica. Además, por formar parte de un sistema biológico, se verán sujetas a un gran número de controles celulares que serán capaces de afectar tanto la actividad enzimática (activación/inhibición) como así también la cantidad de enzima presente en la célula, a través de la regulación de la expresión genética (inducción/represión). (Estos temas serán tratados más adelante). 17 Bioenergética y Enzimas Un poco de historia Hace miles de años, en el antiguo Egipto, en Troya y Babilonia, se utilizaban procesos de fermentación para la fabricación de pan, quesos, vino y cerveza. En todos ellos participan enzimas. Por otra parte, las palabras en alemán e inglés para pan (Brot-bread) y cerveza (Bier-beer), derivan de una misma antigua raíz germánica, que tendría su origen en el proceso de fermentación. En nuestro continente una primera información sobre la aplicación de enzimas proviene de Hernán Cortés, al señalar que las poblaciones mesoamericanas tiernizaban sus carnes dejándolas envueltas durante la noche en hojas de papaya (ricas en la enzima papaína). A partir del siglo XIX, el conocimiento se sistematizó a través de investigaciones científicas - En 1857 Louis Pasteur comunicó que las células de levadura contenían un principio, al que se llamó fermento, que les permitía transformar azúcar en alcohol. - En 1876 Wilhelm Kûhne propuso la denominación enzima, término derivado de las palabras griegas “en” y “zyme” (en levadura). - En 1897, el químico alemán Eduard Buchner, comprobó que las enzimas podían ser extraídas de las células de levadura y ser usadas independientemente de las células. - En 1912, el científico alemán Leonor Michaelis y la primera médica canadiense Maud Menten estudiaron los procesos de cinética enzimática. Con ello dieron el puntapié inicial para el análisis matemático de las reacciones en donde intervienen las enzimas. - La naturaleza proteica de las enzimas recién se pudo confirmar en 1926 cuando el bioquímico estadounidense, James B. Sumner aisló la ureasa. Pocos años después, John Howard Northop, concluyó que las enzimas actuaban como catalizadores, facilitando la ocurrencia de las reacciones químicas. - La ribonucleasa, una enzima descubierta en 1938 por el bacteriólogo estadounidense René Jules Dubos, fue sintetizada por científicos estadounidenses en 1969. Dicha síntesis permitió identificar aquellas áreas de la molécula que son responsables de sus funciones químicas, e hizo posible sintetizar enzimas especializadas con propiedades de las que carecen las sustancias naturales. A partir de todas estas investigaciones se empezaron a extraer y obtener enzimas diversas, lo que hizo posible su empleo en varias ramas de la industria (fabricación del papel, industria textil, alimenticia, farmacéutica). Por otro lado, el conocimiento del mecanismo de acción de las enzimas ha permitido estudiar complejos procesos celulares. El diagnóstico, tratamiento y pronóstico de enfermedades diversas se ha favorecido con el desarrollo de métodos para determinar la presencia y actividad de las enzimas presentes en muestras biológicas diversas. Asimismo muchos de esos métodos emplean enzimas, como las técnicas de Enzimoinmunoensayo (ELISA) para diagnóstico de HIV, Hepatitis, etc., lo que asegura alta especificidad y sensibilidad en las determinaciones Todo este potencial se ha visto ampliado por las técnicas de ingeniería genética que han hecho posible la producción de algunas enzimas en grandes cantidades. En este último tiempo, la biotecnología enzimática ha adquirido un interés considerable. Así, por ejemplo, ha permitido el uso de enzimas para degradar derrames de sustancias contaminantes. 18 Biología Celular 4.2 Clasificación de las enzimas En algunas enzimas, la parte proteica por sí sola posee actividad catalítica y por esta característica se las clasifica como enzimas simples. Otras enzimas están asociadas a sustancias de naturaleza no proteica, y la parte proteica no es activa en la actividad catalítica; son enzimas conjugadas. La parte proteica recibe el nombre de apoenzima y los otros componentes no proteicos, que en la mayoría de los casos interaccionan con la apoenzima de modo transitorio, reciben el nombre de cofactores enzimáticos y pueden ser de distintos tipos: Iones inorgánicos: Mg2+, Mn2+, Cu2+, Zn2+, Na+, Cl-, etc. Coenzima (molécula orgánica pequeña): NAD (Nicotinamida-Adenina Dinucleótido), FAD (Flavina-Adenina-Dinucleótido), NADP (Nicotinamida-Adenina-Dinucleótido-fosfato), CoA (Coenzima A). En aquellos casos en los que las coenzimas se encuentran unidas fuertemente a la parte proteica, se las denomina grupos prostéticos (por ejemplo: la enzima succinato deshidrogenasa está constituida por una porción proteica –apoproteína– y un grupo prostético unido en forma covalente, FAD –flavin- adenin-dinucleótido–). Una vez unida la apoenzima a su correspondiente cofactor se obtiene la forma activa que recibe el nombre de holoenzima. Simples = Parte proteica activa Enzimas Conjugadas = Parte proteica + Parte no proteica (Cofactor) * Ion inorgánico Apoenzima (Inactiva) Coenzima Holoenzima (forma activa) Fig. 6. Esquema que sintetiza la clasificación de las enzimas 4.3 Reconocimiento del sustrato El primer paso en el proceso catalítico es la unión entre la enzima y el sustrato, con la consiguiente formación de un complejo enzima-sustrato. En todos los casos, la región de aminoácidos de la enzima que interacciona con el sustrato recibe el nombre de sitio activo y es allí donde se produce el proceso catalítico, generando o rompiendo enlaces según sea el caso. 19 Bioenergética y Enzimas Es indispensable que se mantenga la estructura tridimensional terciaria de la enzima para que sea catalíticamente activa. Los aminoácidos que forman el sitio activo no son una porción consecutiva y lineal de la estructura primaria sino que generalmente se encuentran alejados unos de otros y representan una pequeña porción del total de aminoácidos. Las uniones que se forman entre las enzimas y los sustratos son débiles y se realizan por enlaces electrostáticos, enlaces de hidrógeno, fuerzas de van der Waals e interacciones hidrofóbicas. Esto determina que la unión enzima-sustrato sea reversible y que la enzima se recupere al final de la reacción . La disposición espacial de los aminoácidos del sito activo de cada enzima permitirá la interacción con el sustrato. Se han planteado dos modelos que describen el modo de interacción entre la enzima y el sustrato. Modelo de llave-cerradura: es ejemplificado con una metáfora que fue establecida en el año 1890 por Emil Fischer, la cual compara el reconocimiento entre la enzima y el sustrato con una llave y su cerradura. Este modelo establece la existencia de una total complementariedad entre el sitio activo de la enzima y el sustrato sobre el cual actúa. (Figura 7 a). Modelo de ajuste inducido: en este caso se postula que la complementariedad entre el sitio activo de la enzima y el sustrato se alcanza solo luego de la interacción entre ellos, o sea, hay un reconocimiento dinámico que involucra una modificación apreciable de los sitios activos de algunas enzimas al unirse con sus sustratos. Esto puede compararse con los cambios que sufre un guante al ponerle la mano en su interior. (Figura 7 b). En la actualidad se han encontrado ejemplos que apoyan tanto a uno como al otro modelo indicando que distintas enzimas pueden actuar a través de distintos mecanismos. E S Fig. 7 a). Modelo de llave-cerradura. Fig. 7 b). Modelo de ajuste inducido. 20 E S Biología Celular 4.4 Cinética enzimática Producto La cinética enzimática es un área de estudio de la química que estudia la velocidad de las reacciones catalizadas por enzimas. En estas reacciones químicas se puede medir la cantidad de moléculas de producto formadas por unidad de tiempo como así también la cantidad de moléculas de sustrato que se transforman en un tiempo determinado. Entonces, si en una reacción en la que a partir de un determinado sustrato “S” se está formando un producto “P”, se mide la aparición de “P” en cada minuto y con estos datos se realiza un gráfico, se observará que en la primera parte de la curva aumenta la velocidad de la reacción de modo lineal. Esto se debe a que en estas condiciones iniciales, la cantidad de sustrato es suficiente y no es un factor limitante; por lo tanto la enzima puede trabajar a su mayor capacidad. La velocidad obtenida en esta parte de la curva, expresada como la variación de sustrato en función del tiempo, se denomina velocidad inicial. ∆P ∆P/∆t = velocidad ∆t Tiempo (minutos) Fig. 8. Curva de actividad enzimática en función del tiempo. La velocidad (V) de la reacción se calcula por (∆P) es decir, el número de moléculas de sustrato (S) que se convierten en producto (P) por unidad de tiempo (∆t). Luego de un tiempo, la velocidad va disminuyendo ya que cada vez hay menos sustrato y, por lo tanto, es menos probable su interacción con la enzima. Esta tendencia termina por alcanzar un estado de equilibrio en el cual la velocidad de formación de producto es cero y la curva se mantiene constante. 4.4.1. Factores que afectan la cinética enzimática La velocidad de las reacciones químicas catalizadas por enzimas pueden ser afectadas por distintos factores, tales como: concentración de sustrato, concentración de enzima, temperatura y pH, además de la presencia de inhibidores. Es por esta razón que al estudiar el efecto de uno de estos factores los demás deben permanecer constantes. 21 Bioenergética y Enzimas 4.4.2 Efecto de la concentración de sustrato sobre la cinética enzimática En este caso, sólo se varía la concentración de sustrato y se mantienen constantes los demás factores enumerados en el párrafo anterior. Para la mayoría de las enzimas, la velocidad “V” varía con la concentración de sustrato “S”, en la forma que se muestra en la Figura 9. Por lo tanto, usando una determinada concentración de enzima se observa que a bajas concentraciones de sustrato, la velocidad aumenta de modo proporcional al aumento de la concentración de sustrato; pero cuando la concentración de sustrato es alta, tiende a alcanzarse una velocidad máxima, que solo podrá ser aumentada, aumentando la concentración de enzima. En 1913, el bioquímico alemán Leonor Michaelis (1875-1949) y la investigadora canadiense Maud Menten (1879-1969) propusieron un modelo para explicar esta cinética postulando la existencia de un complejo enzima-sustrato (ES). Sobre la base de esta consideración, a altas concentraciones de sustrato, todos los sitios activos de las enzimas están ocupados y por lo tanto la velocidad alcanza un máximo. Ese estado en el cual todos los sitios activos están ocupados y se ha alcanzado la velocidad máxima se conoce como saturación. La constante o coeficiente de velocidad denominada k caracteriza la afinidad de la enzima (E) por el sustrato (S). Es una constante de proporcionalidad entre la velocidad de reacción y la concentración de los reactivos. k1 k3 E+S ES E+P k2 Una enzima “E”, se combina con el sustrato “S” formando el complejo “ES”, con una constante de velocidad k1. Este complejo “ES” puede seguir dos caminos: se puede disociar, generando nuevamente “E” y “S”, con una constante de velocidad k2 o puede formar el producto con la consiguiente recuperación de la enzima con una constante de velocidad k3. Teniendo en cuenta este modelo, la velocidad de la reacción catalizada enzimáticamente será igual al producto entre la concentración del complejo “ES” y k3. V = k3 [ES] Sin embargo, la concentración del complejo “ES” no se conoce, de modo que debe ser reemplazado por expresiones formadas por variables conocidas. Mediante un desarrollo matemático, Michaelis y Menten dedujeron una ecuación que relaciona la velocidad de la reacción “V”, con la concentración de sustrato “S” y que concuerda con los datos experimentales: V= V [S] (1) max [S] + Km La constante Km es el valor de la concentración de S para el cual la velocidad Vo alcanza un valor igual a la mitad de su valor máximo Vmax. La representación gráfica de dicha ecuación es la hipérbola que se muestra en la Figura 9. 22 Biología Celular Velocidad Velocidad máxima (Vmax.) Vmax./2 Km [Sustrato] Fig. 9. Efecto de la concentración de sustrato sobre la cinética enzimática. Observar cómo se pueden obtener los valores de Km y Vmax a partir del gráfico. El valor máximo Vmax corresponde a la saturación, cuando todas las enzimas estarían unidas al sustrato. Además de la ecuación de Michaelis-Menten se deduce una relación numérica importante para el caso particular en el cual la velocidad de la reacción sea la mitad de la velocidad máxima: Simplificando Vmax.: Vmax = Vmax [S] 2 [S] + Km 1 = [S] 2 [S] + Km Vmax = Vmax [S] Reordenando: Simplificando Entonces: [S] + Km = 2 [S] Km = 2 [S] - [S] Km = [S] 23 Bioenergética y Enzimas Fosforilación Como veremos más adelante, la fosforilación (adición de un grupo fosfato) es la primera transformación que la glucosa experimenta, cualquiera sea su destino metabólico ulterior. la fosforilación de la glucosa es catalizada también por otra enzima denominada glucoquinasa. La glucoquinasa posee una a inidad mucho menor por la glucosa (Km= 2.10-2 M) que la hexoquinasa, de manera que sólo actúa cuando la glucosa es abundante. A las concentraciones normales de glucosa sanguínea la hexoquinasa está completamente saturada. En situaciones de emergencia, cuando la concentración de glucosa sanguínea se eleva mucho, como en la diabetes, la glucoquinasa se manifiesta activa de modo significativo. Cuando una enzima no tiene una especificidad estricta, es decir que puede actuar sobre más de un sustrato, el valor de Km permite indicar sobre cuál de ellos tendrá mayor afinidad y actuar en forma preferencial. Así por ejemplo la hexoquinasa, enzima que cataliza la fosforiliación de glúcidos de 6 átomos de carbono (hexosas) a partir de ATP tiene diferentes valores de Km para diferentes sustratos: HEXOSA Km (M) Glucosa 1.0 x 10-5 sentido en que aumenta Fructosa -3 1.6 x 10 la afinidad por el Galactosa 1.0 x 10 -1 sustrato Esto significa que la concentración de sustrato necesaria para alcanzar la mitad de la velocidad máxima, es igual a la Km de la enzima. Por lo general, las Km de las enzimas varían en un amplio rango que va desde concentraciones de 10-6 hasta 10-1 en unidades de molaridad (M) pero ¿cuál es el significado bioquímico de la Km? En realidad la importancia fisiológica es enorme ya que cuando una enzima tiene un valor muy pequeño de Km para un determinado sustrato significa que con una concentración muy baja de dicho sustrato se puede alcanzar la saturación de la enzima. Es decir, cuanto menor sea el valor de la Km mayor será la afinidad de la enzima por su sustrato y viceversa. El estudio de los valores de Km puede aportar datos de suma utilidad para la evaluación de la importancia fisiológica de una enzima y el funcionamiento celular. 24 Biología Celular Velocidad Velocidad máxima (Vmax.) Vmax./2 Km [Sustrato] Fig. 10. Efecto de la concentración de sustrato sobre la cinética enzimática. Observar cómo se pueden obtener los valores de Km y Vmax a partir del gráfico. 4.4.3 Efecto de la temperatura sobre la cinética enzimática Como es común para todas las reacciones químicas, a bajas temperaturas, la velocidad de reacción también es baja, pero se incrementa a medida que la temperatura se eleva ya que se favorece la probabilidad de choques entre las sustancias involucradas. Pero para las reacciones en las que participan enzimas, luego de una determinada temperatura en la cual se alcanza la mayor actividad (temperatura óptima) la actividad va disminuyendo ya que se ven afectadas uniones entre aminoácidos que mantienen la estructura terciaria de esa proteína (enzima) y, como vimos, esta estructura juega un rol crítico en la actividad biológica de la enzima. De esta manera, podemos concluir que a bajas temperaturas las enzimas se encuentran inactivas y a altas temperaturas se desnaturalizan. Cada enzima tendrá una temperatura óptima que en la mayoría de los casos será coincidente con la fisiológica (Figura 10). La mayoría de las enzimas pierde su actividad a temperaturas cercanas a los 60 °C, aunque existen otras que tienen temperaturas óptimas cercanas a los 72 °C, como el caso de las enzimas de ciertas bacterias termófilas que viven en aguas termales de temperaturas superiores a los 70 °C. 25 Bioenergética y Enzimas Fig. 11. Efecto de la temperatura sobre la actividad enzimática. La temperatura óptima indicada puede variar según el organismo en estudio. 4.4.4 Efecto del pH sobre la cinética enzimática Recordemos que las enzimas son proteínas; los monómeros que las constituyen son los aminoácidos y estos últimos poseen la capacidad de actuar captando o liberando protones de acuerdo al pH del medio en el que se encuentren (comportamiento anfotérico). Al tomar o ceder protones se afecta la carga neta del aminoácido y esto produce atracciones y repulsiones que modifican la estructura terciaria de la enzima, incluyendo la estructura tridimensional del sitio activo. Esto lleva a que la actividad enzimática se encuentre modulada por el pH y en muchos casos puede considerarse como un mecanismo de control ejercido por la célula. Además debemos considerar que cada enzima tendrá una estructura primaria característica, la cual determina su especificidad biológica, y es por esta razón que la sensibilidad al pH varía según la composición de aminoácidos de la proteína en estudio (Figura 11). Otro punto a tener en cuenta son las posibles variaciones de cargas producidas en el sustrato como consecuencia de la modificación del pH del medio. En muchos casos, en la interacción entre el sitio activo de la enzima y el sustrato participan grupos con carga neta positiva o negativa que son importantes tanto en el reconocimiento como en la estabilización de la unión. Si estas cargas son modificadas, se verá afectada la capacidad de unión entre la enzima y el sustrato. 26 Biología Celular c) Colinesterasa Actividad enzimática Actividad enzimática a) Tripsina 6 8 pH 10 b) Pepsina 4 6 8 pH 12 Actividad enzimática Actividad enzimática d) Papaína 2 4 pH 6 4 6 pH 8 Fig. 12. Efecto del pH sobre la actividad enzimática. a) La tripsina muestra su mayor actividad (pH óptimo) a valores cercanos a 8, y al modificar ese pH la actividad disminuye. b) La pepsina tiene un pH óptimo de 2 y al ir hacia valores más básicos, la actividad enzimática va disminuyendo. c) La colinesterasa no tiene un único valor de pH en el cual alcance su máxima actividad. Esta enzima es altamente estable a valores de pH mayores que 7 y su actividad disminuye al pasar a medios ácidos. d) La papaína sin embargo, muestra una total insensibilidad a las variaciones de pH. Enzimas en lisosomas Los lisosomas son organelas que digieren los materiales incorporados por endocitosis ya que poseen en su interior alrededor de 50 enzimas hidrolíticas diferentes. Estas últimas son un ejemplo de enzimas que actúan a pH ácido ya que el interior del lisosoma posee un pH de 5,0. Esta acidez es posible mediante el funcionamiento de una bomba de protones presente en la membrana del lisosoma. Si la membrana del lisosoma se rompiera, las enzimas escapadas no afectarían a los demás componentes celulares, debido a que se inactivarían al tomar contacto con el citosol, cuyo pH es 7,2. 27 Bioenergética y Enzimas 5. Inhibición de la actividad enzimática La actividad de una enzima puede ser disminuida o suprimida completamente por la acción de diversas sustancias denominadas inhibidores enzimáticos. Hay antibióticos, venenos y diversos medicamentos que comparten esta capacidad y son de gran utilidad para estudiar algunos aspectos de la acción enzimática. El proceso de inhibición también ocurre en forma natural, constituyendo uno de los patrones normales de la biorregulación. La inhibición de las enzimas puede ser de dos tipos: reversible (competitiva o no competitiva) e irreversible. Fig. 13. Esquema que sintetiza la inhibición de la actividad enzimática. 5.1 Inhibición reversible En este caso, el inhibidor se fija a la enzima dando por resultado una pérdida de la actividad que puede ser analizada utilizando la relación de Michaelis-Menten. La inhibición reversible puede ser de dos tipos: competitiva y no competitiva. Fig. 14. Esquemas que representan las inhibiciones reversibles (competitiva y no competitiva). 28 Biología Celular 5.2 Inhibición competitiva El inhibidor competitivo tiene similitud estructural con el sustrato y se combina reversiblemente en el sitio activo tal como lo hace el propio sustrato. Así, cuando están presentes “S” e “I”, la enzima puede fijarse a “S” formando “ES” o a “I” formando “EI”. La fijación de “S” y de “I” son acontecimientos mutuamente excluyentes. Como la formación de “EI” reduce la concentración de enzima disponible para interactuar con el sustrato, la velocidad de reacción disminuye. Sin embargo, debido a que los inhibidores competitivos se fijan de modo reversible a la enzima, este tipo de inhibición puede contrarrestarse incrementando la concentración de sustrato. Un ejemplo clásico de este tipo de inhibición se encuentra en el ciclo de Krebs, que ocurre durante la respiración celular. Otro ejemplo característico lo constituye la sulfonilamida (“sulfas”) inhibiendo la síntesis de ácido fólico en la célula bacteriana. Fig. 15. Un inhibidor competitivo disminuye la afinidad de la enzima por su sustrato (>Km) pero no altera la Vmáx, ya que ésta se alcanza de todos modos a concentraciones elevadas de sustrato. 29 Bioenergética y Enzimas 5.3 Inhibición no competitiva El inhibidor no competitivo y el sustrato pueden unirse simultáneamente a una molécula de enzima. Esto significa que sus sitios de unión son diferentes y se puede formar un complejo “ESI”. Éste es catalíticamente inactivo e incapaz de generar los productos de esta reacción. Pertenecen a este tipo de inhibición ciertas sustancias capaces de unirse reversiblemente a los grupos sulfhidrilo libres (-SH) de algunos aminoácidos de la enzima, como los iones Cu2+, Hg2+ y Ag+. Su unión provocaría cambios conformacionales que inactivan la enzima. Por lo tanto este tipo de inhibición no puede revertirse por aumento de la concentración de sustrato. Fig. 16. En la inhibición no competitiva, no se modifica la afinidad de la enzima por el sustrato (Km no varía), pero la Vmáx disminuye notablemente. 30 Biología Celular 5.4 Inhibición irreversible Es provocada por sustancias que producen un cambio permanente en la molécula de enzima, lo que resulta en una pérdida definitiva de su actividad. En estos casos, la ecuación de Michaelis-Menten resulta inaplicable. Enzimas bacterianas vs. antibióticos Hay bacterias que secretan enzimas que son capaces de romper la estructura química de diversos antibióticos dejándolos sin efecto. De esta manera estas bacterias se convierten en resistentes a estos antibióticos y se deben buscar alternativas de tratamiento. Un ejemplo son las betalactamasas que hidrolizan a las penicilinas. Hoy en día hay microorganismos que sintetizan enzimas que inactivan a casi todos los antibióticos generando un problema serio en el sistema de salud. Como ejemplo de este tipo de inhibidores podemos citar al plomo (Pb) y varios compuestos de mercurio (Hg) y arsénico (As), altamente tóxicos para la célula humana. Los venenos órgano-fosforados, muy utilizados como insecticidas, producen inhibición irreversible de la acetilcolinesterasa, enzima fundamental para la función del sistema nervioso. La molécula alterada no vuelve a recuperar su actividad normal. Otro ejemplo notable es el de la penicilina, el antibiótico de uso más generalizado, que inhibe en forma irreversible a enzimas del ensamblaje de la pared de la célula bacteriana. Como las células humanas son de tipo eucarionte y carecen de pared, no se ven afectadas. 31 Bioenergética y Enzimas Aplicaciones de las enzimas Las enzimas son una herramienta molecular altamente especializada con diversas aplicaciones en las que se explota su especificidad y efectos catalíticos. - Usos científico Son utilizadas para el análisis secuencial de ARN y ADN. También en la síntesis de materiales biológicos y no biológicos para investigación. - Usos industriales Los procesos industriales las emplean para la síntesis de productos en gran escala y bajo costo. En fechas recientes han despertado gran interés para el tratamiento de residuos. - Usos médicos El tratamiento de las enfermedades ocasionadas por defecto de una enzima mediante la aplicación de la misma, todavía se halla en estudio. Se las utiliza por ejemplo para la disolución de coágulos sanguíneos (estreptoquinasa). Un tema de relevante interés es la determinación de enzimas en el laboratorio clínico con fines diagnósticos. Las determinaciones se pueden realizar en diversos materiales biológicos, pero más frecuentemente en el plasma sanguíneo. Las enzimas pueden ser específicas del plasma o no específicas. Entre las primeras se encuentran las que participan en el proceso de coagulación de la sangre, y son de interés clínico especialmente cuando su actividad está disminuida. Las no específicas del plasma son las que no tienen una función definida en él. Se encuentran en concentraciones un millón de veces menor que en los tejidos, sus sustratos no están en la sangre. Pueden ser extracelulares o de secreción (amilasa, lipasa, pepsinógeno). Aparecen en el plasma por pasaje desde la glándula productora hacia el intersticio, o cuando su producción está muy aumentada. Por ejemplo, en procesos obstructivos e inflamatorios del pánc eas. Otro grupo lo forman las enzimas intracelulares, cuyo aumento en la sangre es índice de daño tisular. Por ejemplo: CPK, GOT y LDH: la magnitud y persistencia de su incremento en el suero son de valor diagnóstico y pronóstico de infarto de miocardio. Fosfatasa alcalina: de interés para el diagnóstico de enfermedades óseas (raquitismo, sarcoma osteoblástico, enfermedad de Paget) y hepáticas (procesos obstructivos, hepatoma). Fosfatasa ácida: elevada en casos de carcinoma prostático. GOT y GPT: además de su utilidad para evaluar daño cardíaco, por estar ampliamente distribuidas en el tejido hepático son indicadoras de la funcionalidad de este órgano (se elevan en el suero de pacientes con hepatitis) así como también las enzimas GGT y 5’Nu. La investigación de isoenzimas puede ser de gran utilidad para localizar el proceso patológico identificando el ó gano dañado. La forma H4 de LDH es específica de músculo cardíaco y por lo tanto índice de necrosis del miocardio. Lo mismo ocurre con la fracción MB de CPK (que tiene tres isoenzimas diméricas BB en cerebro, MB en corazón y MM en músculo esquelético). 32 Biología Celular Enzimas cuyo aumento en el plasma sanguíneo permite caracterizar ciertas patologías: ENZIMAS PATOLOGÍAS Adenosina Deaminasa (ADA) Infecciones (Tuberculosis) Alanina aminotransferasa (GPT o ALT) Enfermedades hepáticas y cardíacas Aldolasa Enfermedades musculares Amilasa Enfermedades pancreáticas Aspartato aminotransferasa (GOT o AST) Enfermedades hepáticas y cardíacas Colinestarasa (pseudocolinestarasa) Intoxicación organofosforada aguda Creatin Kinasa (CK o CPK) Enfermedades cardíacas y musculares Enzima Convertidora de Angiotensina Sarcoidosis Fosfatasa ácida Enfermedades prostáticas Fosfatasa alcalina Enfermedades hepáticas y óseas Gamma-Glutamyltransferase (GGT) Enfermedades hepáticas, monitoreo de rehabilitación alcohólica Lactato Deshidrogenasa (LDH) Enfermedades hepáticas, cardíacas y daño cerebral Lipasa Pancreatitis 5’ Nucleotidasa Enfermedades hepáticas 6. Regulación de la actividad enzimática Las características de la vida que hemos estudiado se deben en gran medida a la existencia de mecanismos de regulación de las enzimas, que contribuyen en forma fundamental a la homeostasis. De esta manera, se controla la gran cantidad de vías metabólicas que ocurren simultáneamente en la célula. Pensemos que en ellas participan más de un millar de enzimas distintas. La afinidad (valor de Km) de cada enzima por su sustrato parece permitir una eficaz integración metabólica. La sensibilidad a algunos factores ambientales como el pH y la temperatura tienen un potencial regulador importante así como también las concentraciones locales de sustrato y cofactores, y las inhibiciones reversibles clásicas. Sobreañadidos a estas propiedades catalíticas comunes a las enzimas en general, existen otros mecanismos más específicos de regulación. 33 Bioenergética y Enzimas Se pueden definir tres niveles básicos de regulación de las enzimas: 1. Regulación de la actividad catalítica (activación-inhibición), 2. Regulación de la síntesis de enzimas (inducción-represión) y 3. Regulación de la degradación de las enzimas. 6. 1 Regulación de la actividad catalítica La regulación de la actividad catalítica puede consistir en la modificación de la actividad de las unidades de moléculas de enzimas preformadas, sin que varíe la cantidad de enzima ya sintetizada por la célula. Esto constituye un ahorro de energía importante para el metabolismo celular. Veremos diversos factores que contribuyen en este proceso: Fig. 17. Esquema que sintetiza la regulación de la actividad catalítica. 34 Biología Celular • Sistemas multienzimáticos Las transformaciones que sufre un determinado compuesto en el organismo se producen generalmente en una serie de etapas, cada una de ellas catalizada por una enzima diferente. En cada paso, el producto formado será utilizado como sustrato por la enzima de la siguiente etapa. Estas secuencias se llaman vías metabólicas en las que las enzimas parecen estar alineadas en la forma apropiada facilitando la transferencia de los productos. Estas secuencias constituyen sistemas multienzimáticos. Estos sistemas poseen capacidad de autorregulación de su velocidad global de reacción. Es común que la enzima que cataliza la primera etapa actúe como reguladora del proceso, modificando su actividad frente a estímulos específicos. Así es que puede ser inhibida por el producto final. Este tipo de control se denomina retroinhibición o inhibición feed-back (Figura 17). La primera enzima se inhibe cuando la concentración del producto final ha alcanzado un nivel suficientemente alto. La secuencia metabólica entra en reposo y se evita la acumulación inútil de metabolitos. Cuando la concentración del producto desciende, la enzima se vuelve a activar. La inhibición de una enzima es más habitual que su activación. Por ello es frecuente que la activación consista en suprimir una inhibición previa. No obstante, se postula una activación por precursor, en donde el primer sustrato actúa como activador, ya sea de la primera o la última enzima de la secuencia. El mecanismo específico de estos procesos se verá mas adelante. E1 A E2 B Ei C Y Z (-) Fig. 18. Los sistemas multienzimáticos constituyen una de las principales estrategias de biorregulación de todas las células. A = primer sustrato; Z = producto final; B, C, Y = sustratos / productos intermedios; E1, E2, Ei = enzimas. • Efectos alostéricos Las propiedades cinéticas de muchas enzimas no pueden explicarse por el modelo de Michaelis-Menten. Así ocurre con las llamadas enzimas alostéricas o reguladoras, cuya velocidad de reacción puede representarse en una gráfica sigmoidea. A bajas concentraciones de sustrato la velocidad es baja, cuando la concentración de sustrato aumenta, la velocidad aumenta en forma marcada. Esta cinética es congruente con la presencia de dos o más subunidades polipeptídicas (proteína oligomérica) y en consecuencia dos o más sitios de unión del sustrato. Entre las subunidades existe una relación tal que hace que la unión de una molécula de sustrato 35 Bioenergética y Enzimas en un sitio activo produzca un cambio conformacional de la enzima. Este cambio se transmite a las otras subunidades facilitando la aptitud para recibir más sustrato. Este efecto se denomina cooperatividad respecto de la concentración del sustrato. La molécula de sustrato no actúa solamente como tal, sino también como modulador que acelera la actividad catalítica. Estas enzimas también pueden ser reguladas por otros modificadores diferentes del sustrato capaces de activarlas (modulador positivo, disminuye Km ó aumenta Vmáx) o inhibirlas (modulador negativo, aumenta Km ó disminuye Vmáx) Cuando el modulador es el sustrato, el efecto se llama homotrópico, si el agente modificador es distinto del sustrato, se dice que es heterotrópico. Estos efectos pueden coexistir para una misma enzima y se explican por la existencia de otros sitios, además del sitio activo, a los cuales se unen específicamente moléculas capaces de modificar la actividad. En resumen: Para estas enzimas, el fenómeno de fijación de ciertas sustancias en un sitio puede ocasionar cambios en la conformación y actividad de otro sitio. Este fenómeno se denomina alosterismo (allo = otro o varios, stereos = conformación). Las enzimas que presentan este comportamiento se denominan alostéricas, y las sustancias que causan el efecto se llaman efectores alostéricos, ya sea que se trate de inhibidores, aceleradores o de los propios sustratos. Se han formulado dos modelos para explicar el alosterismo: modelo concertado y modelo secuencial. Posiblemente ocurre un modelo intermedio. Ambos se basan en considerar un cambio conformacional producido por el sustrato (Figura 19). Modelo concertado: inicialmente las distintas subunidades de la proteína existen en dos conformaciones distintas que están en equilibrio entre sí, antes de unirse con el sustrato. Modelo secuencial: la fijación inicial de una molécula de sustrato a un sitio activo de cierta subunidad induce cambios de conformación en ésta, los cuales provocan, a su vez, cambios de conformación en la otra subunidad. Es común que en una vía metabólica la enzima que cataliza la primera etapa sea alostérica. Actividad enzimática + activador + inhibidor [Sustrato] Fig. 19. Las curvas representan la actividad enzimática en presencia de activador (modulador positivo) o de inhibidor (modulador negativo). 36 Biología Celular Fig. 20. Esquema que representa el cambio de conformación de la enzima ante un modulador negativo (M-) o un modulador positivo (M+). • Modificación covalente - Reversible Algunas enzimas son reguladas por adición o sustracción de grupos unidos covalentemente. La modificación ás frecuente consiste en la fosforilación y desfosforilación (proceso de unión o eliminación de fosfatos) ejercida a su vez por otras enzimas (quinasas y fosfatasas) en presencia de ATP (Figura 20). El ejemplo clásico lo constituye la enzima fosforilasa, involucrada en la degradación del glucógeno. Esta enzima se encuentra con baja actividad en el músculo en estado de reposo. Se activa por adición de fosfato, que se une al hidroxilo de las moléculas de serina de la enzima. Así se promueve la glucógenolisis y consecuente liberación de glucosa que proporciona la energía que requiere el trabajo muscular. La forma activa, a su vez, se desactiva por eliminación de los grupos fosfato. La ventaja de este tipo de regulación por enzimas interconvertibles radica en el hecho de que se puede ejercer a corto plazo, variando la proporción de enzima activa, sin necesidad de remover la estructura proteica total. 37 Bioenergética y Enzimas (según la enzima) (según la enzima) Fig. 21. Representación de la fosforilación y desfosforilación catalizada por otras enzimas (quinasas y fosfatasas) en presencia de ATP. - Irreversible Algunas enzimas se sintetizan en forma de precursores inactivos y son activadas a un tiempo y en un lugar fisiológicamente apropiado. Las enzimas digestivas muestran este control (pepsina, tripsina, quimotripsina). Por ejemplo, el tripsinógeno se sintetiza en el páncreas y es activado por la rupura irreversible de un enlace peptídico en el intestino delgado formando la enzima activa tripsina, que participa en la degradación de las proteínas ingeridas. Si este tipo de enzima fuera sintetizada en una forma activa dentro de la célula, sería potencialmente autodestructora, desencadenando su acción proteolítica contra cualquiera de las otras proteínas. De hecho, la enfermedad pancreatitis (en ocasiones mortal) tiene por causa la liberación prematura de tripsina y quimotripsina en el páncreas. Los precursores enzimáticamente inactivos de las enzimas proteolíticas se denominan zimógenos. Carecen de sitio activo y la ruptura irreversible de uno o más enlaces peptídicos se traduce en una nueva conformación mediante la cual los residuos del sitio activo adoptan nuevas posiciones óptimas para la catálisis (Figura 21). Este tipo de control se encuentra también en la secuencia de reacciones enzimáticas que llevan a la coagulación de la sangre. 38 Biología Celular Fig. 22. Esquema que representa el pasaje de la forma inactiva de una enzima (zimógeno) a la forma activa por pérdida de una secuencia de aminoácidos. Compartimentalización Las células eucariontes alojan en su interior una gran variedad de enzimas. Éstas catalizan un número extremadamente elevado de reacciones pertenecientes a diferentes vías metabólicas. Es evidente entonces que el funcionamiento coordinado requiere de algún modo la distribución de diferentes enzimas. La localización de los procesos metabólicos en el citosol o en organelas, facilita su regulación. Así, por ejemplo, muchas de las enzimas asociadas al núcleo, están involucradas en el mantenimiento, renovación y utilización del material genético. La mayoría de las enzimas de la mitocondria forman parte de las vías que promueven la obtención de energía. Enzimas asociadas a ribosomas, promueven la síntesis proteica. Los lisosomas contienen enzimas que catalizan la destrucción hidrolítica de materiales de desecho. Por último, las enzimas microsomales son responsables de la biosíntesis de hormonas y del metabolismo de ciertas drogas. Isoenzimas En un organismo pluricelular, y también en cada una de sus células, pueden existir distintas variedades de una misma enzima con la misma actividad catalítica. Estas diferentes formas estructurales de una enzima se denominan isoenzimas. Una de las mejor estudiadas es la lacticodeshidrogenasa (LDH) que participa en el metabolismo energético y posee cinco isoenzimas. 39 Bioenergética y Enzimas La distribución de las cinco formas es característica en cada tejido, y sus proporciones relativas cambian en ciertos estados patológicos. Las moléculas de LDH son tetrámeros formados por las asociaciones posibles de dos cadenas polipeptídicas (M y H): M4 (predomina en músculo); M3H1; M2H2; M1H3 y H4 (predomina en corazón). Aunque las cinco variedades catalizan la misma reacción global, poseen distinto valor de Km, adaptándose a los requerimientos específicos de la célula que las produce. El descubrimiento de las isoenzimas ha abierto un importante capítulo de la bioquímica, con implicaciones en enzimología básica, genética y clínica médica. Otras enzimas como la creatinfosfoquinasa (CPK) y la fosfatasa alcalina (FOH) comparten esta propiedad. 6.2 Regulación de la síntesis de enzimas Este tipo de regulación implica un cambio en la cantidad de moléculas de enzima. La síntesis de algunas enzimas puede ser inducida por sus propios sustratos y reprimida por sus productos durante el proceso de transcripción. En ambos casos, el resultado final es que las enzimas se sinteticen únicamente cuando sean necesarias. Este proceso es especialmente evidente en el hígado y en el intestino delgado de los mamíferos, que deben adaptarse a las fluctuaciones de la ingesta . Ha sido ampliamente estudiado en las células de Escherichia coli para el metabolismo de la lactosa (Operón-lac)*. Allí se vio que la expresión genética que lleva a la síntesis de ciertas enzimas está regulada por proteínas llamadas represoras, y que moléculas pequeñas, como algunos sustratos y productos de las rutas metabólicas, pueden afectar la actividad genética uniéndose a estos represores. El resultado consiste en un equilibrio entre el aumento en la síntesis del número de moléculas de enzima y la neutralización de este efecto. Este tipo de regulación es considerado relativamente lento frente a la regulación de la catálisis que es una forma más rápida de adecuar la actividad enzimática a los requerimientos celulares. * Se verá en clases posteriores. 6.3 Regulación de la degradación de enzimas El recambio enzimático provocado por la degradación de las enzimas no ha sido muy estudiado. Sin embargo, el recambio proteico de las células es una característica reconocida en varios experimentos nutricionales y hormonales. La presencia o ausencia de sustratos y cofactores puede alterar la conformación de las enzimas haciéndolas más o menos susceptibles a su degradación. Esto ha sido comprobado para ciertas enzimas como la triptofano-oxidasa, cuya velocidad de degradación se ve marcadamente disminuida en presencia de sustrato, siendo éste un efecto de mucha mayor significación que el de una probable inducción. 40 Biología Celular 6.4 Multimodulación Los distintos tipos de regulación pueden coexistir en una enzima dada, lo que ha originado el concepto de multimodulación. Los procesos de regulación catalítica y genética (que veremos más adelante) se pueden integrar en una misma vía metabólica. Recordemos que la regulación catalítica modifica la velocidad a la que actúan las enzimas preformadas, activándolas o inhibiéndolas. Por lo tanto, es un mecanismo rápido, a corto plazo. Son ejemplo de este proceso la inhibición por producto final y la activación por sustrato En cambio la regulación genética es un mecanismo más lento ya que promueve una variación en la cantidad de las enzimas que contiene la célula. Esto ocurre por modificación de la expresión de los genes que las codifican. Así aumenta el número de moléculas de enzima por inducción de su síntesis o disminuye por represión de la misma. La enzima multimodulada con más mecanismos es la fosfofructoquinasa animal, enzima alostérica que cataliza uno de los primeros pasos de la ruta de la glucólisis, en la respiración celular. En ella están descritos unos diez sitios específicos de unión de efectores positivos que la activan y negativos que la inhiben. Pensemos que esta enzima se ubica en un punto clave de las vías de obtención de la energía contenida en las moléculas de glucosa, energía que será luego transportada por el ATP. Por lo tanto, su regulación es crucial ya que, en gran medida, de ella dependen los niveles de ATP que aseguran la vida celular. INHIBICIÓN (-) ACTIVACIÓN (+) (+) A (+) (-) E1 B E2 C Y Ei Z Proteínas (Enzimas) ARNm INDUCCIÓN (+) ADN REPRESIÓN (-) Fig. 23. Esquema que representa los dos tipos de regulación, catalítica y genética, que pueden coexistir en una misma enzima. 41 Bioenergética y Enzimas BIBLIOGRAFÍA Blanco, A. Química Biológica; El Ateneo (2012). Bohinsky, R. Bioquímica; Addison Wesley Iberoamericana (1991). Castro, Handl y Rivolta, Actualizaciones en Biología, Eudeba (1994). Curtis, H. Biología; Panamericana (2007). De Robertis-Hib, Fundamentos de Biología Celular y Molecular; El Ateneo (2012). Glasstone, S. Tratado de Química Física; Aguilar (1976). Hewitt, P. G. Física conceptual; Addison Wesley Iberoamericana (1995). Karp, G. Biología Celular y Molecular; Mc Graw-Hill Interamericana (2005). Lehninger, A. y col. Principios de Bioquímica; Omega (2005). Murray, Granner, Mayes y Rodwell, Bioquímica de Harper; Manual Moderno (2009). Ochoa, Leloir, Oró y Sols, Bioquímica y Biología Molecular; Salvat (1986). Stryer, L, Bioquímica; Reverté (2004). Vita, N. y Fabrizio, S. Química Biológica; Biblioteca del CBC, Eudeba (1985). 42