VSEPR Background - โรงเรียนมหิดลวิทยานุสรณ์
advertisement

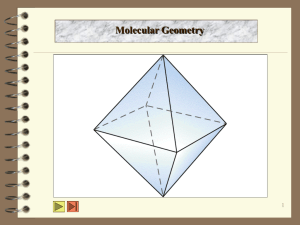
1 ว 30131 เคมีพืน้ ฐาน พันธะเคมี (ต่อ) นายศราวุทธ แสงอุไร ครูวิชาการสาขาเคมี โรงเรียนมหิดลวิทยานุสรณ์ พันธะเคมี อ.ศราวุทธ แสงอุไร 2 VSEPR Background • The Lewis Dot Structure สามารถบอกเราถึงพันธะภายใน โมเลกุล แต่ไม่ได้บอกถึงลักษณะโรงสร้างทาง geometry? • ความรูเ้ ดิมทีเ่ ราทราบคือลักษณะของอิเล็กตรอนคูใ่ นโครงสร้างลิว อิสสามารถแบ่งได้เป็ นสองลักษณะคือ electron pairs: bonding and lone. • Valence Shell Electron Pair Repulsion (VSEPR). 3D structure is determined by minimizing repulsion of electron pairs. พันธะเคมี อ.ศราวุทธ แสงอุไร 3 VSEPR Background • Must consider both bonding and lone pairs in minimizing repulsion. Example: CH4 H H C H H Lewis Structure พันธะเคมี อ.ศราวุทธ แสงอุไร VESPR Structure 4 VSEPR Background • Example: NH3 (both bonding and lone pairs). H H N H Lewis Structure พันธะเคมี อ.ศราวุทธ แสงอุไร VSEPR Structure 5 VSEPR Background • The previous examples illustrate the strategy for applying VSEPR to predict molecular structure: 1. Construct the Lewis Dot Structure 2. Arranging bonding/lone electron pairs in space such that repulsions are minimized. พันธะเคมี อ.ศราวุทธ แสงอุไร 6 VSEPR Background • Linear Structures: angle between bonds is 180° • Example: BeF2 F Be F F Be F พันธะเคมี อ.ศราวุทธ แสงอุไร 180° 7 VSEPR Background • Trigonal Planar Structures: angle between bonds is 120° • Example: BF3 120° F F B F F พันธะเคมี อ.ศราวุทธ แสงอุไร F B F 8 VSEPR Background • Pyramidal: Bond angles are <120°, and structure is nonplanar: • Example: NH3 H H N H พันธะเคมี อ.ศราวุทธ แสงอุไร 107° 9 VSEPR Background • Tetrahedral: Any (and every) HCH angle between bonds is ~109.5° • Example: CH4 H H C H H พันธะเคมี อ.ศราวุทธ แสงอุไร 109.5° 10 VSEPR Background • Tetrahedral: angle may vary from 109.5° (exactly) due to size differences between bonding and lone pair electron densities (implies orbitals). bonding pair lone pair พันธะเคมี อ.ศราวุทธ แสงอุไร Takes up more space than a bonding pair. VSEPR : Tetrahedral • Classic example of tetrahedral angle shift: from perfect tetrahedral (109.5°) to real water: พันธะเคมี อ.ศราวุทธ แสงอุไร 11 VSEPR Comparison of CH4, NH3, and H2O Tetrahedral (trigonal) pyramidal bent The molecules are not tetrahedral (only CH4 is); However, in all cases the electrons (octet) are ~tetrahedrally arranged about the central atom พันธะเคมี อ.ศราวุทธ แสงอุไร 12 VSEPR shape (PCl5) 13 • Trigonal Bipyramidal, 120° in plane, and two orbitals at 90° to plane: • Example, PCl5: 90° Cl Cl Cl P Cl Cl พันธะเคมี อ.ศราวุทธ แสงอุไร 120° VSEPR and Octahedral Shape • Octahedral: all angles are 90°: • Example, SCl6: 90° พันธะเคมี อ.ศราวุทธ แสงอุไร 14 Advanced VSEPR 15 • Square Planar versus “See Saw” See Saw Square Planar No dipole moment พันธะเคมี อ.ศราวุทธ แสงอุไร Advanced VSEPR • Driving force for last structure was to maximize the angular separation of the lone pairs. Lone Pairs need to have more room and be further from other pairs than bonding pairs. พันธะเคมี อ.ศราวุทธ แสงอุไร 16 17 Advanced VSEPR • VESPR and resonance structures. Must look at VESPR structures for all resonance species to predict molecular properties. O O O O O พันธะเคมี อ.ศราวุทธ แสงอุไร O O 18 VSEPR Provide the Lewis dot and VESPR structures for CF2Cl2. Does it have a dipole moment? F F 32 e- Cl C Cl F F Cl Cl Tetrahedral พันธะเคมี อ.ศราวุทธ แสงอุไร VSEPR and more molecules 4 19 SO SF4 PF3 2 NO 2 IF พันธะเคมี อ.ศราวุทธ แสงอุไร cf . SF6 cf . PF5 NO2 NO 4 IF IF5 2 O3 IF7 แหล่งอ้างอิง • Martin S. Silberberg, Chemistry: The Molecular Nature of Matter and Change, McGraw-Hill Higher Education, 2004 • Raymond Chang, Chemistry, Williams College, McGraw-Hill Higher Education, 2002 พันธะเคมี อ.ศราวุทธ แสงอุไร 20