Glucolisis
advertisement

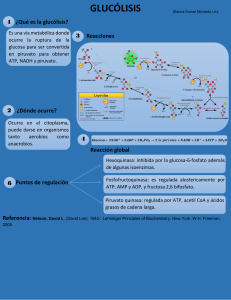
Glucólisis Carlos I. González, Ph.D. Catedrático Asociado Departamento de Biología Universidad de Puerto Rico – Río Piedras Oficina: Julio García Díaz #106 Tel: 787-764-0000 ext. 2482 e-mail: cigonzal@gmail.com Hrs. Oficina: L y W 11:30am – 12:30pm 14| Glucose Utilization and Biosynthesis © 2013 W. H. Freeman and Company Central Importance of Glucose • Glucose is an excellent fuel – Yields good amount of energy upon oxidation – Can be efficiently stored in the polymeric form – Many organisms and tissues can meet their energy needs on glucose only • Glucose is a versatile biochemical precursor – Bacteria can use glucose to build the carbon skeletons of: • All the amino acids • Membrane lipids • Nucleotides in DNA and RNA • Cofactors needed for the metabolism Four Major Pathways of Glucose Utilization Oxidación de glucosa a CO2 y H2O ΔG’o = -2,840 KJ/mol Four Major Pathways of Glucose Utilization • Storage – Can be stored in the polymeric form (starch, glycogen) – When there’s plenty of excess energy • Glycolysis – Generates energy via oxidation of glucose – Short-term energy needs • Pentose Phosphate Pathway – Generates NADPH via oxidation of glucose – For detoxification and the biosynthesis of lipids and nucleotides • Synthesis of Structural Polysaccharides – For example, in cell walls of bacteria, fungi, and plants GLUCÓLISIS La oxidación de glucosa libera mucha energía y es un precursor excelente (a.a, ácidos grasos, nucleótidos, coenzimas.) C6H12O6 + 6O2 –> 6CO2 + 6H2O ΔG’o = -2840 kJ/mol GLUCÓLISIS Glucólisis - Nacimiento de Bioquímica, proceso universal, único proceso para generar energía en algunos tejidos. Glucosa (6C) –> 2Triosas (3C) Energía se utiliza para sintetizar ATP y NADH, o se almacena (glucógeno, almidón). Glycolysis: Importance • Sequence of enzyme-catalyzed reactions by which glucose is converted into pyruvate • Pyruvate can be further aerobically oxidized • Pyruvate can be used as a precursor in biosynthesis • Some of the oxidation-free energy is captured by the synthesis of ATP and NADH • Research of glycolysis played a large role in the development of modern biochemistry – – – – Understanding the role of coenzymes Discovery of the pivotal role of ATP Development of methods for enzyme purification Inspiration for the next generations of biochemists Feeder Pathways for Glycolysis Feeder Pathways for Glycolysis • Glucose molecules are cleaved from glycogen and starch by glycogen phosphorylase – Yielding glucose-1-phosphate • Disaccharides are hydrolyzed – Lactose: glucose and galactose – Sucrose: glucose and fructose – Fructose, galactose, and mannose enter glycolysis at different points Glycolysis: Overview • In the evolution of life, glycolysis probably was one of the earliest energy-yielding pathways • It developed before photosynthesis, when the atmosphere was still anaerobic • Thus, the task upon early organisms was: How to extract free energy from glucose anaerobically? • The solution: – First: Activate it by phosphorylation – Second: Collect energy from the high-energy metabolites GLUCÓLISIS 10 pasos - 2 etapas (todo citoplasma) 1) preparativa- rxns. endergónicas, se utilizan 2 ATP para activar glucosa (aumenta energía libre de reactante) y se degrada en 2 moléculas de 3C. P-C6 –> Fructosa 6P –> P-C1–> lísis en 2-3C–> dihidroxiacetona –> isomeriza a gliceraldehído 3P. GLUCÓLISIS 2) “payoff” - rxns. exergónicas, se recobra ATP invertidos, produce 2 ATP, 4 e- se almacenan en 2 NADH, y se forman 2 moléculas de piruvato. 2 glyc.3P (oxida y fosforila por Pi, no ATP)–> 1,3 BiP-glyc. –> 2piruvato GLUCÓLISIS Tres Rxns. Imp. en Glucólisis: a)degradación 1 glucosa (6C) a 2 piruvatos (3C) b) fosforilación de ADP a ATP por compuestos ricos en energía. c) transferencia de ión de hidruro (2e- y 1 protón) para formar NADH. Glycolysis: Overview Glycolysis: The Preparatory Phase Glycolysis: The Payoff Phase GLUCÓLISIS Glucólisis - alguna energía acumulada en ATP, mayoría en piruvato. Glucosa + 2NAD+ +2ADP+2Pi –> 2piruvato + 2NADH + 2H+ + 2ATP + 2H2O GLUCÓLISIS Se puede dividir ecuación en: 1)glucosa a piruvato Glucosa+2NAD+–> 2piruvato + 2NADH + 2H+ ΔG’o = -146 kJ/ mol exergónica GLUCÓLISIS 2) Formación de ATP 2ADP + 2Pi –> 2ATP + 2 H2O ΔG’o = 61 kJ/mol endergónica ΔG’os = -146+61 =-85 kJ/mol IRREVERSIBLE! (5% energía total potencial en glucosa) Si piruvato –> CO2 + H2O ΔG’o = -2840KJ/mol 9 intermediarios en glucólisis son compuestos fosforilados. Por qué? Funciones de estos compuestos fosforilados: 1)A pH 7, tienen carga -, no pueden salir de la cel. 2) Almacenan energía, donan grupos P para formar ATP de ADP. 3) Enzimas los reconocen y dan especificidad a las Rxns. Chemical Logic of Glycolysis Error libro-nueva ediciόn: Movimiento es de C-3 a C-2 1) Activación de Glucosa - Glucosa se fosforila en C6, fosforilación imparte carga – - Requiere ATP -Mg2+ parte del sustrato de la enzima (ATP + Mg2+ ) - Enzima – Hexokinasa, hígado (glucokinasa o hexokinasa IV), soluble, como todas las otras de glucólisis Step 1: Phosphorylation of Glucose Step 1: Phosphorylation of Glucose • Rationale • • • • – Traps glucose inside the cell – Lowers intracellular glucose concentration to allow further uptake This process uses the energy of ATP Hexokinase in eukaryotes, and glucokinase in prokaryotes Nucleophilic oxygen at C6 of glucose attacks the last () phosphate of ATP ATP-bound Mg++ facilitates this process by shielding the negative charges on ATP • Highly thermodynamically favorable/irreversible – Regulated mainly by substrate inhibition 1) Activación de Glucosa Mg2+ es esencial para la actividad de la enzima ya que escuda las cargas negativas de los átomos de O2 y hace que el fósforo γ (gamma) sea más accesible para el ataque nucleofílico del C6-OH de la glucosa. 2) Isomerización de Glucosa 6P a Fructosa 6P - Enzima – isomerasa, cambia de aldosa a cetosa - Rx reversible - requiere Mg2+ Step 2: Phosphohexose Isomerization Step 2: Phosphohexose Isomerization • Rationale – C1 of fructose is easier to phosphorylate by PFK – Allows for symmetrical cleave by aldolase • An aldose (glucose) can isomerize into a ketose (fructose) via an enediol intermediate • The isomerization is catalyzed by the active-site glutamate, via general acid/base catalysis • Slightly thermodynamically unfavorable/reversible – Product concentration kept low to drive forward Mechanism of Phosphohexose Isomerase His residue in active site, imp. for ring opening and closing. Mechanism of Phosphohexose Isomerase: Base Catalysis Mechanism of Phosphohexose Isomerase: Acid Catalysis Enediol – alkene with an –OH group on both sides of the C=C double bond! Mechanism of Phosphohexose Isomerase 3) Fosforilación de Fructosa 6P a Fructosa 1,6 BiP Irreversible -Enzima – Fosfofructocinasa I (PFK-1), imp. en regulación, alosterismo por AMP, ATP y citrato. -segunda fosforilación - Requiere ATP y Mg2+ Destinado a glucólisis, Ahora no hay vuelta atrás… Step 3: 2nd Priming Phosphorylation Step 3: 2nd Priming Phosphorylation • Rationale – Further activation of glucose – Allows for 1 phosphate/3-carbon sugar after step 4 • First Committed Step of Glycolysis – fructose 1,6-bisphosphate is committed to become pyruvate and yield energy • This process uses the energy of ATP • Highly thermodynamically favorable/irreversible • Phosphofructokinase-1 is highly regulated – By ATP, fructose-2,6-bisphosphate, and other metabolites – Do not burn glucose if there is plenty of ATP 3) Fosforilación de Fructosa 6P a Fructosa 1,6 BiP Mg2+ es esencial para la actividad de la enzima PFK. Escuda las cargas negativas de los átomos de O2 y hace que el fósforo γ (gamma) sea más accesible para el ataque nucleofílico del C1-OH de la F6P sobre el átomo de fósforo γ (gamma) del complejo Mg2+ -ATP. 4) Lísis de Fructosa 1,6BiP - Enzima – Aldolasa, rompe molécula de 6C en 2 de 3C (triosas) -ΔG’o = positivo pero en cels. Rx. reversible - Los productos son removidos rápidamente por pasos subsiguientes, Rx. procede Step 4: Aldol Cleavage of F-1,6-bP Step 4: Aldol Cleavage of F-1,6-bP • Rationale – Cleavage of a six-carbon sugar into two three-carbon sugars – High-energy phosphate sugars are three-carbon sugars • The reverse process is the familiar aldol condensation • Animal and plant aldolases employ covalent catalysis • Fungal and bacterial aldolases employ metal ion catalysis • Thermodynamically unfavorable/reversible – GAP concentration kept low to pull reaction forward Mechanism of Class I Aldolases 4) Lísis de Fructosa 1,6BiP (Ruptura Aldólica) Nota: Se revierte el sistema de numeración de los átomos Rxn. catalizada por una base, el intermediario enolato es estabilizado por resonancia al removerse los e- de O del grupo carbonilo. Ruptura de aldol entre C3 y C4 requiere carbonilo en el C2 y OH en el C4. Imp. isomerizar G6P a F6P (paso 2). 4) Lísis de Fructosa 1,6BiP (Ruptura Aldólica) 5) Conversión de Triosas - Enzima – isomerasa - Rx. Procede siempre hacia Glyc 3P, el único degradado en los pasos subsiguientes. Step 5: Triose Phosphate Interconversion Step 5: Triose Phosphate Interconversion • Rationale: – Allows glycolysis to proceed by one pathway • Aldolase creates two triose phosphates: – Dihydroxyacetone Phosphate (DHAP) – Glyceraldehyde-3-Phosphate (GAP) • Only GAP is the substrate for the next enzyme • DHAP must be converted to GAP • Completes preparatory phase • Thermodynamically unfavorable/reversible – GAP concentration kept low to pull reaction forward Isomerización a Gliceraldehído-3P Isomerización a Gliceraldehído-3P Similar al Paso 2 catalizado por… Segunda Etapa 6) Oxidación de Gliceraldehido-3P - Enzima – dehidrogenasa de Glyc-3P - Se añade Pi a cada molécula de Glyc-3P y se remueve H+ por NAD+. Electrones son transportados a NAD+ como “hydride” ion (2 e- + 1 H+, el otro H+ va al medio). - Producto 1,3 Bifosfoglicerato (1er intermediario de glucólisis) que contiene mucha energía Step 6: Oxidation of GAP Step 6: Oxidation of GAP • Rationale: – Generation of a high-energy phosphate compound – Incorporates inorganic phosphate – Which allows for net production of ATP via glycolysis! • First energy-yielding step in glycolysis • Oxidation of aldehyde with NAD+ gives NADH • Active site cysteine – Forms high-energy thioester intermediate – Subject to inactivation by oxidative stress • Thermodynamically unfavorable/reversible – Coupled to next reaction to pull forward Mechanism of GAPDH IMP. Regenerar NAD+ Segunda Etapa 6) Oxidación de Gliceraldehido-3P 7) Transferencia de grupo fosfato a ADP Enzima – cinasa de fosfoglicerato (cinasa por paso a la inversa, en gluconeogenesis y fijación de CO2 en fotosíntesis) 1,3BiP fosfoglicerato dona energía a ADP y forma ATP, se requiere complejo Mg2+-ADP. Pasos 6 y 7 unidos para tener un ΔG = negativo. Step 7: 1st Production of ATP Step 7: 1st Production of ATP • Rationale: – Substrate-level phosphorylation to make ATP • 1,3-bisphosphoglycerate is a high-energy compound – can donate the phosphate group to ADP to make ATP • Kinases are enzymes that transfer phosphate groups from ATP to various substrates • Highly thermodynamically favorable/reversible – Is reversible because of coupling to GAPDH reaction 6) Oxidación de Gliceraldehido-3P y 7) Transferencia de grupo fosfato a ADP ln Q (mass-action ratio) ΔG = ΔG’o + RT ln [1,3BiP glyc] [NADH] [glyc 3P] [Pi] [NAD+] El paso 7 va consumiendo 1,3 BiP, [C][D]/[A][B] < 1, ΔG es negativo. Formación de ATP por transferencia de grupo fosfato de 1,3BiP a ADP =fosforilación a nivel de sustrato, ocurre en citoplasma y envuelve enzimas solubles, distinta a fosforilación oxidativa (enzimas en la membrana y gradiente de protones). 8) Conversión de 3-fosfoglicerato a 2-fosfoglicerato - Enzima – mutasa, transfiere fosfato deC-3 a C-2 - Rx. reversible, Mg2+ Step 8: Migration of the Phosphate Step 8: Migration of the Phosphate • Rationale: – Be able to form high-energy phosphate compound • Mutases catalyze the (apparent) migration of functional groups • One of the active site histidines is post-translationally modified to phosphohistidine • Phosphohistidine donates its phosphate to O2 before retrieving another phosphate from O3 – 2,3-bisphosphoglycerate intermediate – Note that the phosphate from the substrate ends up bound to the enzyme at the end of the reaction • Thermodynamically unfavorable/reversible – Reactant concentration kept high by PGK to push forward Mechanism of Phosphoglycerate Mutase: Base Catalyzed Phosphoryl Transfer 9) Remoción de H2O -Enzima enolasa, remueve H2O -Rx. reversible -PEP compuesto rico en energía Step 9: Dehydration of 2-PG to PEP • Rationale – Generate a high-energy phosphate compound • 2-Phosphoglycerate is not a good enough phosphate donor – Two negative charges in 2-PG are fairly close – But loss of phosphate from 2-PG would give a secondary alcohol with no further stabilization • Slightly thermodynamically unfavorable/reversible – Product concentration kept low to pull forward 10) Transferencia de grupo fosfato de PEP a ADP -Enzima – cinasa de piruvato, requiere Mg2+ y K+ - Imp. Regulación - Formación de 2 ATP - Rx. Irreversible Step 10: 2nd Production of ATP Step 10: 2nd Production of ATP • Rationale – Substrate-level phosphorylation to make ATP – Net production of 2 ATP/glucose • Loss of phosphate from PEP yields an enol that tautomerizes into ketone • Tautomerization – effectively lowers the concentration of the reaction product – drives the reaction toward ATP formation • Pyruvate kinase requires divalent metals (Mg++ or Mn++) for activity • Highly thermodynamically favorable/irreversible – Regulated by ATP, divalent metals, and other metabolites 10) Transferencia de grupo fosfato de PEP a ADP Pyruvate Tautomerization Drives ATP Production Glycolysis: The Preparatory Phase Glycolysis: The Payoff Phase Ecuación Final: Glucosa + 2ATP +2NAD+ + 4ADP + 2Pi –> 2 piruvato + 2ADP + 2 NADH + 2H+ + 4ATP + 2H2O Glucosa + 2NAD+ + 2ADP + 2Pi –> 2 piruvato + 2 NADH + 2H+ + 2ATP + 2H2O 2 piruvato, 2 ATP neto, 2 NADH En presencia de O2, NADH se reoxida a NAD+ por transferencia de electrones en la cadena de transporte (mitocondrio). Se transforma energía para síntesis de ATP por fosforilación oxidativa. RESUMEN DE GLUCÓLISIS 1 glucosa –> 2 piruvato 2 ADP + Pi –> 2ATP 4e- transferidos de glyc-3P a NAD+ Enzimas de glucólisis - solubles pero forman complejos y los metabolitos son transferidos de una enzima a otra en una forma más eficiente. Algunas asociadas a filamentos de actina en “citoesqueleto”. (Channeling of intermediates) Cáncer- glucólisis mucho más rápido (10-fold) que en tejidos normales. Cels. cancerosas- hypoxia (low O2), carecen de red de capilares para suplir O2 al tumor. Dependen de glucólisis para producción de ATP. Positron Emission Tomography (PET) Scan - detecta cáncer con 18F-labeled 2-fluoro-2deoxyglucose. Análogo para hexokinasa pero no es convertido al intermediario de enediol en la reacción de fosfohexosa isomerasa. Catabolismo de carbohidratos Catabolismo de Carbohidratos Glucógeno y almidón - fosforilasa, enlace α1,4 glicosídico es atacado por Pi y se remueve el monosacárido terminal como Glucosa 1P. Mutasa cambia el P de C-1 a C-6, entra a glucólisis (similar a 3P-glicerato convertido a 2P-glicerato) Sucrosa - Fructosa + Glucosa, Fructosa es convertida a Fructosa 6P por hexokinasa (músculos y riñones) En el hígado, fructokinasa produce Fructosa 1P, entra como glyceraldehido-3P Galactosa - varias conversiones hasta glucosa-1P Rutas metabólicas alternas del piruvato (2 anaeróbicas y 1 aeróbica) No ATP por O2, no NAD+, piruvato se reduce a lactato, acepta e- de NADH y se regenera NAD+ para continuar glucólisis. Anaerobic Glycolysis: Fermentation • Generation of energy (ATP) without consuming oxygen or NAD+ • No net change in oxidation state of the sugars • Reduction of pyruvate to another product • Regenerates NAD+ for further glycolysis under anaerobic conditions • The process is used in the production of food from beer to yogurt to soy sauce Animals undergo lactic acid fermentation • Reduction of pyruvate to lactate, reversible • During strenuous exercise, lactate builds up in the muscle – Generally less than 1 minute • The acidification of muscle prevents its continuous strenuous work • The lactate can be transported to the liver and converted to glucose there • Requires a recovery time – High amount of oxygen consumption to fuel gluconeogenesis – Restores muscle glycogen stores Reducción de piruvato a ácido láctico en ausencia de O2 Enzima- dehidrogenasa de lactato Se regenera NAD+ y es utilizado en glucólisis, 2ATP. Músculo, acumulación de ácido láctico, acidez (H+) causa dolor y calambre. Microorg.- Industria de queso y yogurt, lactosa se fermenta a ácido láctico, éste se disocia en lactato y H+, pH bajo – precipita proteínas = queso y yogurt Lactic Acid Fermentation Reducción de piruvato a ácido láctico (Fermentacion Homoláctica) Transferencia de ión de hidruro desde el C4 del NADH al C2 del piruvato con transferencia simultánea de un protón del imidazol de His195 The Cori Cycle Yeast undergo Ethanol Fermentation • Two-step reduction of pyruvate to ethanol, irreversible • Humans do not have pyruvate decarboxylase • We do express alcohol dehydrogenase for ethanol metabolism • CO2 produced in the first step is responsible for: – carbonation in beer – dough rising when baking bread • Both steps require cofactors – Pyruvate decarboxylase: Mg++ and thiamine pyrophosphate – Alcohol dehydrogenase: Zn++ and NAD+ Fermentación Alcohólica Carbonación de la cerveza, eleva el pan Otros productos-butanol, acetona, methanol, acido acético, fórmico, propiónico,butírico - Enzimas -decarboxilasa de piruvato (ausente en vertebrados) y dehidrogenasa de alcohol -2 pasos, se regenera el NAD+, 2ATP -levaduras, industria de vinos y cervezas Ethanol Fermentation TPP is a common acetaldehyde carrier TPP is a common acetaldehyde carrier Fermentación Alcohólica Fermentación Alcohólica Decarboxilasa de Piruvato Fermentación Alcohólica Alcohol Deshidrogenasa Reducción de acetaldehído y regeneración de NAD Ethanol Fermentation SPLENDA® is the brand name for the ingredient sucralose. It is made through a patented, multi-step process that starts with sugar and converts it to a no calorie, non-carbohydrate sweetener. The process selectively replaces three hydrogen-oxygen groups on the sugar molecule with three chlorine atoms. Chlorine is present naturally in many of the foods and beverages that we eat and drink every day ranging from lettuce, mushrooms and table salt. In the case of sucralose, its addition converts sucrose to sucralose, which is essentially inert. The result is an exceptionally stable sweetener that tastes like sugar, but without sugar's calories. After consumption, sucralose passes through the body without being broken down for energy, so it has no calories, and the body does not recognize it as a carbohydrate. It is 600 times sweeter than sucrose!!! sucrose Chlorocarbons: DDT Zoloft Vancomycin sucralose Aspartame Upon ingestion, aspartame breaks down into natural residual components, including aspartic acid, phenylalanine, methanol, and further breakdown products including formaldehyde, formic acid, and a diketopiperazine (results from peptide bond between two amino acids to form a lactam or cyclic peptide) . Aspartame Aspartame is an artificial sweetener. It is 180 times sweeter than sugar in typical concentrations, without the high energy value of sugar. While aspartame, like other peptides, has a caloric value of 4 kilocalories (17 kilojoules) per gram, the quantity of aspartame needed to produce a sweet taste is so small that its caloric contribution is negligible. Sugar Substitute Common Name Saccharin Sweet’N Low (1958) Nutrasweet, Equal (1981) Splenda (1998) Aspartame Sucralose Neotame Stevia (Natural) Nutrasweet (2002) Purevia, Only Sweet (2008) 11,450 Sweetness compared to Sucrose 300X 160-200X 600X 8,000X 250X Regulación de Glucólisis Produce ATP y precursores de Rxns. Anabólicas Enzimas claves en la vía son reguladas. La mayoría son reguladas a nivel de [sustrato]. (la actividad de la enzima siempre está alta) Por lo menos una enzima no responde a [sustrato], su actividad es baja, controlada de forma alostérica. Determina la velocidad del proceso. Normalmente son Rx. exergónicas >proceden espontáneamente pero son reguladas por regulación alostérica (válvula). Glucólisis y Gluconeogénesis (piruvato > glucosa). Muchas enzimas compartidas (mutasa de fosfoglicerato), otras específicas. Previene pérdida de energía si ambos procesos ocurrieran al mismo tiempo. Gluconeogénesis - utiliza 7 enzimas de glucólisis 3 Rxns. Glucólisis - Irreversibles Gluconeogénesis- otras vías para la síntesis de estos precursores. Gluconeogenesis a)Hexocinasa- entrada de glucosa a glucólisis Regulación alostérica por su producto glucosa-6P; varias isozimas diferentes en el músculo vs. hígado. En el hígado, glucocinasa responde a diferentes [glucosa]. b) Fosfofructocinasa (PFK-1) - alostérica Fructosa-6P–> Fructosa 1,6-BiP Fructosa 1,6-BiP –> Fructosa-6P (fructosa 1,6 bifosfatasa) Fructosa 2,6 BiP –> animales, hongos y plantas; activa PFK-1 y glucólisis; inhibe FBPasa y gluconeogénesis (reg. alostérico) “Glucagón” -hormona del pancreas señala a hígado nivel bajo glucosa, baja nivel de Fructosa 2,6 BiP. Activa gluconeogénesis. Regulación de PFK-1 [ATP] altas - sustrato de PFK-1 y producto de glucólisis, regulador alostérico que reduce afinidad de PFK-1 por fructosa 6P ADP y AMP - eliminan inhibición de ATP [Citrato]-altas - inhibe PFK-1, Intermediario Ciclo de Krebs, señala buen estado de energía celular. c) Cinasa de Piruvato – [ATP] altas inhibe - disminuye afinidad por sustrato PEP, [ATP] bajas activa. Acetil CoA y Ácidos grasos – inhiben, Ciclo de Krebs activo = [ATP] alto reduce actividad de glucólisis The flux of glucose through the glycolytic pathway is regulated to maintain nearly constant ATP levels (as well as adequate supplies of glycolytic intermediates that serve biosynthetic roles). The required adjustment in the rate of glycolysis is achieved by a complex interplay among ATP consumption, NADH regeneration, and allosteric regulation of several glycolytic enzymes—including hexokinase, PFK-1, and pyruvate kinase—and by second-to-second fluctuations in the concentration of key metabolites that reflect the cellular balance between ATP production and consumption. On a slightly longer time scale, glycolysis is regulated by the hormones glucagon, epinephrine, and insulin, and by changes in the expression of the genes for several glycolytic enzymes.