Day 008- Single Displacement and Metal Activity Series Lab

Day 008 Single Displacement and Metal Activity Series Lab
Single Displacement Reactions
Define a single displacement reaction:
one element in a compound is replaced by another element.
Describe the two types of single displacement reactions and give and example of each.
Type 1: metal replaces metal cation
A + BC à AC + B
Eg. Zn
(s)
+ FeNO
3 (aq)
à Zn(NO
3
)
2(aq)
+ Fe
(s)
Type 2: non‐metal (usually a halogen) replaces an anion
D + EF à ED + F
Eg. Cl
2 (g)
+ CaBr
2 (aq)
à CaCl
2 (aq)
+ Br
2 (s)
Type 1: Single Displacement and the Metal Activity Series one metal replaces ANOTHER METAL in an ionic compound.
*Treat hydrogen as a metal
*Treat acids as ionic (H
+
Cl
) (H
+
*Treat water as ionic (H
+
OH
)
H
+
SO
4
2
)
Eg. Cu
(s)
+ 2 AgNO
3 (aq)
à Cu(NO
3
)
2(aq)
+ 2 Ag
(s)
Eg. Mg
(s)
+ 2 HCl
(aq)
à MgCl
2 (aq)
+ H
2 (g)
Eg. 2Na
(s)
+ 2 HOH
(l)
à 2NaOH
(aq)
+ H
2 (g)
1
Day 008 Single Displacement and Metal Activity Series Lab
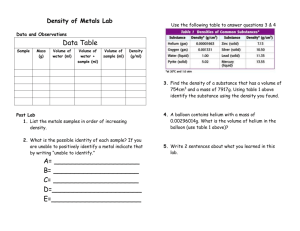
Lab Investigation Part 1:
Creating An Activity Series of Metals
Using your observation chart from the lab, order the metals from most to least reactive.
Most _____ _____ _____ _____ _____ Least
2
Day 008 Single Displacement and Metal Activity Series Lab
Activity Series of Metals See p.140
Although most metals lose electrons in a chemical reaction they do not do it with the same speed and vigor. Metals react differently with different substances.
The more easily a metal atom can lose its electron, the greater is its reactivity, and the more easily oxidized it is.
The activity series of metals organizes metals from the most reactive to the least reactive.
The higher the metal in the series, the more reactive it is i.e., its reaction is fast and more exothermic. Remember, exothermic reactions are those that produce energy like heat and light. Metals like gold and platinum are unreactive even in very strong acids.
We can use the activity series to predict the products of single displacement reactions. In general, an element that is higher in the activity series will displace an element that is lower.
Hydrogen is included in the series because, like metals, it can be oxidized to form positive ions.
Lab Investigation Part 2:
Using An Activity Series of Metals
Use your Metal Activity Series to predict the products of the reactions. If no reaction occurs write NR.
3
Day 008 Single Displacement and Metal Activity Series Lab
Using your observation chart from the lab, order the metals from most to least reactive.
Most _____ _____ _____ _____ _____ Least
Use your Metal Activity Series to predict the products for your reactions.
Most _____ _____ _____ _____ _____ Least
How do your lab results compare to the predictions made using the metal activity series?
Type 2: Single Displacement and the Halogen Activity Series
Read the section in your text about Single Displacement
What is the activity series for halogens?
Describe how to use it and give two examples.
Activity series for Halogens is in the same order as the Periodic
Table
So F > Cl > Br > I
Eg 1: F
2 (g)
+ 2NaCl
(aq)
à 2NaF
(aq)
+ Cl
2 (g)
Eg 2: I
2 (g)
+ CaBr
2 (aq)
à No Rxn
Homework:
Single Displacement: p. 127 # 21 p. 131 # 22, 23, 24
4