Physical Pharmacy Lecture 3
advertisement

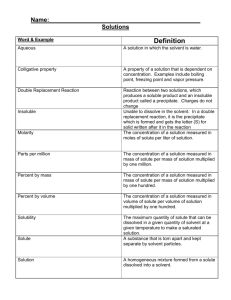
[Year] PHYSICAL PHARMACY TEAM Lecture 3 Clinical Pharmacy Cairo University 2014/2015 /Clinical2020CU Physical Pharmacy Lecture 3 Solvent فالsoluteو قلنا انها معدل دوبان الdissolutionعرفنا المرة اللي فاتت ال ازاي,solvent بيدوب فالSolute ازاي ال.. بيحصلdissolution هنتكلم عن ازاي ال, ده بقاlectureطيب فال :هنتكلم عن.. اللي محطوط فيهsolvent بيختفي مرة واحدة فالsoluteال Process of Dissolution: 1. Separation of solute from similar molecules and become surrounded by solvent molecules. 2. Separation of solvent from similar molecules to create space (cavity) to accommodate the solute. 3. Placing the solute molecule in the solvent cavity requires a number of solute-solvent contacts (Solvation process. In case the solvent is water, it is called hydration process) Dissolution occurs if solute-solvent attraction overcomes: a) solute-solute interaction b) solvent-solvent interaction When the adhesive forces (i.e. solute-solvent molecules) are more than the cohesive forces (solvent-solvent molecules or solute-solute molecules), the solubility of a solute in a solvent is generally enhanced and vice versa. ف عشانtightly packed بتبقىsolid molecules و عارفين ان ال,solid عنديsolute فالنفترض ان ال,طيب .Solute تحاوطها و بالتالي يدوب الSolvent molecules من بعضها عشان الsolid moleculesادوبها الزم افكك ال ازاي هيحصل كده بقا؟ crystal بتتفرق من بعضها و تحاول تسيب الsolute molecules ان ال,اول خطوة هعملها او بتحصل يعني molecules واحدة من بقيت الmolecule مش صح؟ بكسر مثالbonds يبقى انا كده بكسر. اللي هي فيهlattice مش هتاج, bond-breaking طيب انا عشان بعمل.. و بعدين اكسر اللي بعدها و اللي بعدها و هكذاlatticeاللي فال طيب هجيب. +W22 دهWork تعالوا نسمي ال.work او بمسمى تاني بحتاج اعملenergy طاقة؟ اكيد هحتاج Absorption of energy هعمل.surrounding ده منين؟ من الWork اللي محتاجاها عشان اعمل الEnergyال عشان كده حطينا. من برهenergy هتزيد عشان اخدتpotential energy و بالتالي الfrom the surrounding . زادتP.E الن الpositive signال Clinical 2020 Page 1 : اللي هما2 types of forces عندك..نطلع شوية بره الموضوع و نرجعله تاني Cohesive forces: between similar/like molecules Adhesive forces: between different/unlike molecules bonds between الني بكسرcohesive forces عن بعضها بكسر ايه؟ بكسر الSolute moleculesطيب انا لما بفرق ال .similar molecules عشان يكونوليSolvent molecules هنفرقsolute molecules ده مشابهة للقبليها بس بدل ما احنا بنفرق..الخطوةالتانية الليbonds هنا بردو بنكسر.surround the solute molecules عشان تحاوط اوCavity حاجة زي الدايرة بنسميها هنجيبها, و ده هيحتاج طاقةbond breaking عشان اعملwork بالتالي بردوهبذلby cohesive forcesماسكة ف بعضها هيبقىWorkهتزيد عشان كده الpotential energy of system ال,)absorption of energy( surroundingمن ال هي هي قصة الخطوة االولى. +W11 بس هنا هنرمزله بpositive breakage of من خاللهم بيحصل. association process اللي فاتوا بيشبهوا بعض لحد كبير و بنسميهم2 stepsطيب ال cohesive forces between solute molecules and solvent molecules. هنا بقا. كونتهاSolvent molecules اللي شبه الدايرة اللي الCavity بيدخل جوا الSolute بيحصل هنا ان ال..تاخطوة التالتة هنحتاج طاقة؟ ال احنا مشFormation ما دام.solute and solvent molecules ما بين الbond formation بيحصل طبعا,Surrounding لما اطلع طاقة لل.)liberation of energy( بنكسر حاجة بالعكس ده في طاقة هتطلع او هتتحر خسر جزءSystem– عشان الve sign هيبقى فيه+ve sign فبالتالي بدل ما الdecrease in potential energy هيحصل طيب.solute AND solvent ما بين الinteraction؟ الن الخطوة ده12 اشمعنى.-2W12 هنا بـWork هنرمز لل.من طاقته bond و يبتدي يعملCavityيدخل جوا الSolute اولهم ان ال. ده مقسمة لخظوتين تانيينstep؟ الن فعليا ال2ليه ال (closing of cavity) ..Solute molecule تقفل على الCavity و التانية ان الsolvent مع الformation Force between solvent and solute molecules طبعا هيتكونلي. اللي بتتكون هناtype of forceطيب نسينا نقول ال .. و بكده عرفنا ازاي الدوبان بيحصل.adhesive forces ف النوع هنا.different molecules يعني بين When does dissolution occur?.. باالنجلش كده. دهsolvent ده هيدوب فالsoluteاعرف بقا امتى ال solute and بين الcohesive forces ف اخر خطوة اكبر من الSolute and solvent بين الadhesive forcesلو ال بتكون احسن و احسن و المادة بتدوب بسهولة وsolubility اللي ف اول خكوتين الsolute OR solvent and solvent العكس صحيح .. شويةmathematically تعالوا نتكلم The free energy change of solution = W11 + W22 – 2W12 1. W11 + W22 > W12 Endothermic (+ve value) 2. W11 + W22 < W12 Exothermic (-ve value) Clinical 2020 Page 1 :ف أول حالة Energy absorbed from surrounding (w11 + w22) > energy released (w12) cohesive forces > adhesive forces +ve value > -ve value (endothermic) :ف تاني حالة Energy absorbed from surrounding (w11 + w22) < energy released (w12) cohesive forces < adhesive forces +ve value < -ve value (exothermic) Dissolution in this case is better than in the first. , اكبر يعنيadhesive forces طب ليه؟ عشان قلنا ان ال.نستنتج من كده ان كل ما مادة بتطلع حرارة اكتر يبقى بتدوب اسرع . اقوى كل ما هيطلع حرارة اكترAdhesive forces بالتالي كل ما الEnergy absorbed اكبر من الEnergy releasedال Clinical 2020 Page 1 )Prediction of solubility in aqueous medium (Dilute solution Depends on: 1. Molecular surface area: It is the solvent accessible area (S.A.A.) and solvent excludable area (S.E.A). Solubility decreases with increase of molecular surface area. The larger the solute molecule: a) the larger the cavity required. b) the greater the number of contacts created. 2. Nature of the key chemical groups: Polar or non-polar in the parent structure. طيب فنجلوا عيونكم معايا كده عشان الحتة ده غبية حبتين.. البراجراف اللي فوق ده بيتلكم عن ازاي اقدر اتنبأ اذا كان ال Soluteده هيدوب حلو فال liquid solventاللي معايا و ال ال ..بس هل اقدر اتنبا ب اي نوع solutionكده؟ ال ,ده انا هتنبأ بال Solubilityفال dilute solutionبسسسس! يعني مقدرش اتنبا فال concentrated solutionمثال. طيب ,التنبؤ ده بيعتمد علي ايه؟ اول حاجة الM.S.A = S.A.A + S.E.A :M.S.A يعني ايه الكالكيع ده؟ يعني مساحة سطح ال solute moleculeمتقسمة لجزئين ..جزء من المساحة ده الSolvent molecule بيقدر يوصله اللي هو solvent accessibleو جزء التاني ال Solventمش بيقدر يوصله اللي هو .solvent excludableو المساحة ده بتتحسب ازاي؟ ببرامج عالكمبيوتر .فالبرنامج ده انا بيمشي حاجة كروية كده كانها ال Solvent moleculeعلى ال solute moleculeعشان اشوف المساحة ال Accessibleو المساحة ال ,excludableاجمعهم مع بعض و يجيبلي ال.M.S.A شايفين مثال المثلثين الصغيرين المحصورين بين الكورتين دول مستحيل ال ]solventوصلهم ف بنسميهم excludable.الباقي بقا ,ال Solventبيقدر يوصله عادي ف بنسميه. accessible زاد كل ما .M.S.Aبيقولك ان كل ما ال .Solubilityبردو معرفتش هعمل بيها ايه عشان اتنبأ بالM.S.Aكده انا قدرت اجيب ال solute؟ بالمنطق كده ,اكيد لما ال Soluteعشان يحاوط ال Solvent,اللي بيعملها ال Cavityقلت .ليه؟ فاكرين الSolubilityال Solventده قلنا بيتعمل ازاي؟ افكركم ..بال Cavityاكبر عشان احاوط بيها و ال Cavityيكون كبير هحتاج molecule اكتر .طب و فيها ايه بردو؟ فيها ان هحتاج طاقة اكتر من .Solvent moleculesكده هضطر يكون عندي molecules اللي bondsزادت بالتالي ال Solvent moleculesعشان ال 2ف خطوة Surroundingال محتاجة اكسرها زادت ف الطاقة اللي همتصها من بره هتزيد بردو .و قلنا كل ما الطاقة اللي بمتصها من بره كترت كل ما ال dissolutionكان اصعب و ال solubilityكان اقل. Page 1 Clinical 2020 like dissolves طبعا عارفين مبدأ.non-polar و الpolar هنا هنتكلم عال..nature of chemical group ال..تاني نقطة بقى benzene لكن ال.highly polar زي البنزين مش هتقدر ندوب ف المية مثال اللي تعتبرnon-polar طبيعي ان مثال حاجة.like كل ما الدوبانpolar groups ف كل ما زودت ال.non-polar االتنين,nature عشان االتنين عندهم نفس الCCl4 يقدر يدوب ف (للي مش مذاكر اورجانك) هيدوبbenzene ring with OH group اللي هو عبارة عنphenol مثال ال.فالمية كان احسن OH polar group ليه؟ الن ال. وحدهbenzeneاحسن فالمية من ال Solvation and Hydration Solvation: The process of binding of solvent to solute molecules (Step3) If the solvent is water, the process is called hydration. A. Non-electrolytes changed the structure of water e.g. phenols, alcohols, aldehydes, ketones, amines, and other oxygen and nitrogen containing compounds that can form hydrogen bonds with water. B. Ionic groups (electrolytes) and weak electrolytes interact with the polar water molecules. :Solvents انواع من ال3 طيب انا عندي solvents according to polarity : طيب لو جينا و قسمنا دى حاجةdielectron constant (DEC) ليهم حاجة اسمهاpolar solvents بصوا بقىPolar solvent water . دىDEC بس ايه بقى- لسه هناخدها قدام شوية Dielectron constant(DEC) : it is value given to polar solvents according to polarity يعني ايه بردو80 عاليه جدا توصل لDEC فليهاHIGH POLAR SOLVENT تعالوا بقي نفهم بيقولك بقى بما ان الميه دلوقتى احنا عارفين عشانstrong electrolyte و دهNacl و حطيت عليهwater فيهbeaker لو جيت و جبت اللى بين الصوديوم وionic bond دلوقتىsolute molecules تحاطsolvent molecules المادة تدوب الزم عشان يعملhigh dielectron constant وليهhigh polar solvent اللى عندىsolvent الكلوريد قويه لو مكنش و يحاوط ايوناتCl عن ايوناتNa يعنى بمعني اصح يفصل ايوناتovercoming of attraction between ions ذاب في الميه اصالNacl الصوديوم لوحدها و ايونات الكلوريد لوحدها مكنش Clinical 2020 Page 1 nonpolar or يعني لو جينا و ذوبناه فىpolar solvents ميقدرش يدوب اال فيionic بما انهNacl يبقى زى الجلسرين هنالقي ان دوبانه اقل من دوبانه فى الميهsemipolar nonpolar ( وpolar dissolve in polar) يعنيlike dissolve like فى حاجة تانيه بردو احنا عارفينها وهى )dissolve in nonpolar) : حاجات3 يبقى كدة الميه ممكن تتدوب فى و فهمنا فوق بيدوب ازاى: Strong electrolytes -1 : Weak electrolytes -2 بس هوweak ionization not complete ionization ( بما انه ويك فبيحصلهweak acid) benzoic acid زى يعني ايه يعني بتفصل االيونات عن بعضهاionization الن الميه بتعملهcertain solubility in water ليه عنده . محاطة بايونات – و العكس فيدوب في الميه+ بحيث االيونات : Non-electrolyes -3 orientation of solvent و اذوبه في ميه هالقيه بيدوب بس ايه المشكله ؟ المشكله فيsucrose لما اجى اجيب يعنى ايه ؟ يعني الميه بتحيط بجزيئات من السكروز مش ايونات ف هنالقي ذوبانه قليلmolecules In a solution of sucrose, six water molecules are bound to each sucrose molecule with such way that water and sucrose move as a unit in solution Clinical 2020 Page 1 طيب تعالوا نشوف بتدوب فى الميه ؟non-electrolytes ازاى ؟ ال مش بيحصله امال بيدوب ازاى ؟ionization بيحصلهsucrose هو عنhydrogen bonds with water هالقيه بيدوب النه بيكونSTRUCTURE OF Sucrose هاجى ابص على 6 هالقيه متصل6 groups of OH اللى فى جزئ الميه والن السكروز عندهH اللى عنده و الOH طريق GROUPS OF WATER SO the interaction between sucrose molecule and water occur by dipole dipole interaction ( hydrogen bond ) Mannitol and Sorbitol are sugar alcohols have very different affinities for water. The solubility of Sorbitol in water is about 3.5 times that of Mannitol. Favourable hydration with an equatorial –OH group Equatorial OH forms two hydrogen bonds, while axial OH forms only one hydrogen bond Compatibility of the equatorial –OH with the organised structure of water in bulk. — Axial hydroxyl -OH groups cannot bond onto the water ‘lattice’ without causing it to change considerably. Clinical 2020 Page 1 Mannitol sorbitol polyhydricalcohol دول بسميهمsorbitol and maanitol هنا بقي نجي نشوف جزء تانى و هو اللىOH مبدئيا كدة نتفق ان الmore than 1 OH group من اسمهم كدة عندهمsugar alcohol او axial اسمهاmannitol اللى فيOH وequatorial اسمهاsorbitol في Clinical 2020 Page 1 Hydrogen atoms in axial positions are shown in red. Hydrogen atoms in equatorial positions are in blue. solubility of مرات و نص3 بتساوىsolubility of sorbitol طيب هاجى اشوف هالقي ان طيب ايه السبب في كدة ؟mannitol axial OH لكن2 hydrogen bonds with water بتعملequatorial OH of sorbitol السبب ان 1 hydrogen bond with water بتعملof mannitol equatorial OH on the same لقينا انcyclohexane طيب براحة كدة لو جيت و شوفت مركب زى فى حين ان, 2 bonds with water () فبيقدر يعمل150-200 angle و الزاوية اللى بيعملهاplane stability and steric effect و ده بسببaxial OH (30-90) الزاوية ف بيقولك عشان طيب يعني ايه كل الرغي ده Clinical 2020 Page 1 equatorial OH of sorbitol is on the same plane so it more stable and can form 2 hydrogen bonds with water axial OH of mannitol is not on the same plane so it unstable and can form only لكن one hydrogen bond with water معاهم النهاhydrogen bond حولها و تعمل2 molecules of water بمعني اصح مبتقدرش تجيب unstable Hydration of ionic species All ions in water possess a layer of “tightly bound water” “Four “ water molecules are in the bound layer of most monovalent, monatomic ions. The firmly held layer can be regarded as being in a ‘frozen’ condition around a positive ion. electrolytes زىionic species طيب نجى نشوف هنا هنالقي ان و الميه هتعملcomplete ionization for Nacl فى الميه هالقي الميه بتعملNacl لو جيت و حطيت عشان تحاوط كل ايون لوحدهOvercoming of attraction between Na and CL (LI , Na , K اللى هما+charge بيبقي عليهمgroup A1 (alkali metals) معروف ان ايون الصوديوم و اللى زيه في positive ion surrounded by 4 molecules of water فى ميه هالقي الNa ion لو جينا و حطينا, Ci , Rb ) negative ion is surrounded by 2 molecules of water and this هالقىgroup 7 و مجموعو الهاوجينات is due to stabilization of reaction and steric effect جزيئات الميه او جزيئين الميه اللى ماسكين4 دي اللى هى الطبقة االولى اللى هى عبارة عنfirmly held layer بيقولك frozen layer اسمهاions مع Clinical 2020 Page 1 : تعالوا االول نشوف النقطة دى في شكل غريب كدة ف الساليدز يبقيion size increase and charge density decrease بيقولك انى كل ما انا نازلة من فوق ل تحت هالقي LI more dense than Na and Na is more dense than K نستنتج ان اللى بين الليثيوم وATTRACTION جزيئات الميه اللى حوليه هى هى ال4 بتاع الصوديوم وATTRACTION هل كدة جزيئين الميه اللى حوليه ؟ ال attraction force between its بيبقىSMALL size and high density of charge ليه الن االيون اللى هى ليها ion and water is high 2 molecules of water with halide نفس الكالم بردو في حالة Orientation of water molecules around the ion Primary solvent sheath in which the water molecules could be oriented with all the hydrogen atoms of the water molecules pointing outwards. (tightly bound layer) An intermediate layer of water around the bound layer which is less ordered than bulk water with the hydrogen atoms of the water molecules pointing inwards (towards the ion). Bulk water layer usually having the structure that H atoms are directed to the outside. all positive ions in group A1 is surrounded by 3 layers : 4 molecules of اللى هىtightly bound layer ( primary solvent sheath ) اول طبقة اللى هى-1 water which orientated as oxygen atom is oriented inward and hydrogen atom is oriented outward هاجى االقى طبقة تانيةsteric effect بما انه مينفعش الهيدروجين اللى بره دى تكمل كدة على طول عشان-2 2 molecules of water but its اللى هى عبارة عنintermediate layer بعدها اللى هى هى اللى برهO هى اللى جوه و الH عكس الطبقة االوالنية يعني ايه يعني هاجى االقىorientation bulk لالوالنيه طب ليه ؟ عشان تقدر تستوعب اخر الير جايه و هىless ordered بتبقى تانى الير دى-3 water layer : اللى هم3 layers يبقي انا عندى كدة Clinical 2020 Page 1 primary solvent sheath = tightly bound layer-1 intermediate layer -2 bulk water layer-3 Water Structure Breakers and Structure Makers Ions, which include all the alkali and halide ions except Li+ and F-, are called structure breakers. Li < Na < K < Rb < Cs in size (Monovalent alkali metals) Li+ and F-, and many polyvalent ions, for example Al3+, increase the structured nature of water beyond the immediate hydration layer, and are therefore structure makers. Na+ is considered as weak structure maker يعني ايه؟structure maker بما ان الليثيوم و الفلور اصغر االيونات اقدر اقول عليهم اللى احنا اتكلمنا عليهم بس بيختلفوا االيونات عن بعضها في حاجة3 layers مبدائيا كدة كل االيونات عندهم types of forces of attraction between water molecules and ions and between بيختلفوا فى ايه بقي اللى بيحصل ؟water molecules themselves لو جيت و حطيته فى ميه هالقيه بيعملsmall ion and has high density of charge الليثيوم ده structure maker because attraction force حوليه و بسميهorientation of water molecules between its ion and water molecule in primary layer is higher than attraction force between water molecules in bulk layer attraction force between واحنا فهمنا ليه عشانstructure breaker بيبقواLi , Na , F اما بقي ما بعد its ion and water molecule in primary layer is not higher than attraction force between water molecules in bulk layer Al+3 is considered structure maker or breaker ? لو جيه و قولك Clinical 2020 Page 1 بس هنا حصلهmonovalent طيب ليه ؟ بص هو االيون هنا مش صغير زىstructure maker هنالقيه انه density of charge تعويض بال ion size decrease , charge density increase and attraction force يعنى من االخر كدة كل لما increase and be structure maker ion size increase , charge density decrease and attraction force decrease and be و كل لما structure breaker Hydration number the number of water molecules in the primary hydration layer. Solvation number the number of solvent molecules in the primary layer. The solvation numbers decrease with increase of ion size (ionic radius) because the ionic force field diminishes with increasing radius. :يبقي hydration number of Na ion=4 F ion =2 cl ion = 2 as ion size decrease , charge density increase and attraction force increase and solvation number increase ion size increase , charge density decrease and attraction force decrease and و كل لما solvation number decrease Nonpolar solvents divided into: )I Induced dipole-induced dipole They are able to dissolve other non-polar in which bonds are weak. e.g. hydrocarbon in hydrocarbon- oil, fat in petroleum ether. II) Dimerization: e.g. acetic acid in CCl4 (consumption of dipole ) Clinical 2020 Page 1 مين بقي ال non polar solventsدول اللى DECبتاعتهم اقل من 15زى oil , ccl3 , ccl4 1-induced dipole induced dipole من االسم كدة يعني ايه ؟ يعنى حاجة عملت inductionل moleculeو بعدين رجعت عملت inductionتانى ل moleculeتانى يعنى ايه يعنى لو جيت و ذوبت oilفي oilال oilده بيتكون من H and Cبيقولك بقي نتيجة Motion of electrons حصل حاجة اسمها temporary polarizationيعنى ايه ؟ يعنى الكربون اخدت partial negativeو الهيدروجين اخدت , partial positiveطيب لما اجى احط هيدروكربون فى هيدروكربون تانى اصال الهيدروكربون ده او oilمعندهوش dipoleزى الميه هنالقي الميه عندها +dipole and – dipoleامال ايه اللى بيحصل ؟هالقى الهيدروكربون ده بيعملى induction of polarity of the second hydrocarbonفهالقي الهيدروجين اللى عندها partial positiveفى الهيدروكربون االوالنى هتخلى الكربون اللى في الهيدروكربون التانى عندها partial negativeو الكربون اللى في المركب االوالني هتخلى الهيدروجين اللى في الهيدروكربون التاني عندها partial positiveفبالتالى هالقي ال 2 oilsدابوا في بعض . 2-dimerization : بصوا بقي acetic acidده weak electrolyteو ليه certain solubilityفي الميه /طيب لو جيت حطيت ال acetic acidده مع CCL4اللى هو يعتبر NONPOLAR solventهالقي ان جزء من ال acetic acidساب الميه و راح عند CCL4طيب ازاى حاجة weak electrolyteتدوب في حاجة nonpolarو احنا بنقول اصال like dissolve like بص براحة كدة 2 molecules of acetic acidعملوا dimer through hydrogen bondفهنالقي ان polarityقلت فبقي nonpolar يعني لما عمل dimerال polarityقلت و بقى nonpolarفقدر يدوب في ccl4اللى هو nonpolar Semi-polar solvents is divided into : 1-permenant dipole – induced dipole ) 2-intermediate solvent (cosolvency Page 1 Clinical 2020 I) Permanent dipole-induced dipole: e.g. alcohol (semi-polar) dissolves in benzene (non-polar) through induction of temporary dipole in benzene molecule. II) Intermediate solvent (Cosolvency): e.g. acetone increases the miscibility of ether (non-polar) in water (polar). This co-solvency mechanism acts by decreasing the DEC of water, being polar solvent, thus enhancing the miscibility of non-polar solutes as ether. Examples of semi-polar solvents are: alcohols and ketones يعني بينintermediate بتاعهم بيكونdielectron constant دول ؟ دول اللى هد الsemi-polar مين بقي اللى )60-50( لما اجى احط بنزين على الكحول هالقي البنزين بيدوب ف الكحول طيب ليه يا تراه ؟ positive و الهيدروجين عندهاpermanent dipole negative ( االوكسجين عندهاR-OH)الكحول ده يعنى االوكسجين راحتInduction of polarity for benzene بتعملOH GROUP فهالقيdipole – ve و الهيدروجين راحت للكربون و اديتها+ ve للهيدروجين و اديتها : عن طريقmechanism of solubility benzene in alcohol يبقي عندى اللى موجود في جزيئات الكحول اصالPermanent dipole اللى حصل لحلقة البنزينinduction اللى هو الinduced dipole و cosolvency ندخل على نقطة تانية و هى ال عمره ما بيدوب ف الميه يبقي الزم عشان يدوب في الميهether احنا عارفين ان الether in water لو حطيت بينهم هما االتنين زى االسيتون فلو جيت و حطيت اسيتون في ميه وintermediate solvent الزم يكون في ايه اللى حصل هنا بقي ؟miscibility of ether in water increase بعدين حطيت ايثر هالقي ان بتاعت الميه فبدل ما كانتpolarity لو جيت و حطيته مع الميه هالقيه بيقلل فsemi-polar االسيتون ده يبقي من خاللpolarity of mixture between water and acetone in range (60) خلى80 بتاعتهDEC اللى قلت هالقي انpolarity وlike dissolve like Clinical 2020 Page 1 semi هالقي ان درجة دوبانها في الميه زادت لما ضفتpure compound لو حاجة مش دايبة في الميه و هى بتاعت الميه قلت فدابت في الميه بسهولةpolarity و اللى خلىpolar this process is called cosolvency. the semi-polar is called cosolvent. Clinical 2020 Page 1