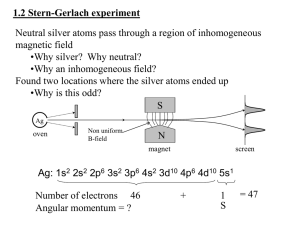
Nuclear Magnetic Resonance
advertisement
Nuclear Magnetic Resonance Quantum Numbers Principal quantum number (n) : the potential energy of electron Azimuthal quantum number (l) : orbital angular momentum, the shape of orbital Magnetic quantum number (m) : the direction of the angular momentum vector Spin quantum number (s) : intrinsic angular momentum of given particle The Introduction of SPIN • Failure ⅰ. Fine structure in spectral lines The Bohr model of the hydrogen atom ⅰ. Fine structure in spectral lines 656.3nm : Theoretical : Experimental 0.14nm • Failure ⅱ. Fine structure in the anomalous Zeeman effect The nomal Zeeman effect The anomalous Zeeman effect The Introduction of SPIN Samuel Goudsmit & George Uhlenbeck proposed in 1925; Every electron has an intrinsic angular momentum, called spin, whose magnitude is the same for all electrons. Associated with this angular momentum is a magnetic moment. The Introduction of SPIN • Charged sphere spinning on its axis?? ⇒ so small, many times greater than the velocity of light Failure ⅰ. Fine structure in spectral lines The Bohr model of the hydrogen atom ⅰ. Fine structure in spectral lines 656.3nm : Theoretical : Experimental 0.14nm Failure ⅱ. Fine structure in the anomalous Zeeman effect Anomalous Zeeman effect을 설명하기 위해서 새롭게 spin 개념을 도임해서 에너지 준위의 차이 (splitting)를 설명하게 됨 Samuel Goudsmit & George Uhlenbeck proposed in 1925; Every electron has an intrinsic angular momentum, called spin, whose magnitude is the same for all electrons. Associated with this angular momentum is a magnetic moment. Charged sphere spinning on its axis?? ⇒ so small, many times greater than the velocity of light Magnetic moment Usually, the net spin quantum number is 0. However, in the nuclei with odd mass number, net spin quantum number is half intiger. Then, they produce magnetic momentum. Spin angular momentum Spin magnetic moment In Large external magnet In Large external magnet Lamor Precession 자기장 H 자기모멘트 μ의 시간변화 dμ/dt = ϒ(μ X H) (ϒ는 자기모멘트에 의해 결정되는 자기각운동량비) μ 이 때, 이 운동을 각속도 Ω의 회전좌표계에서 관측하면, dμ/dt = μ (ϒH + Ω) 라는 식으로 나타난다. 회전좌표계의 각속도 Ω = ϒH 일 때, dμ/dt = 0 이다. 따라서, 자기장 H가 가해졌을 때, 자기모멘트 μ는 ϒH의 속도로 세차운동 한다. 각속도 공식 2π n(rad/sec) = ν 이 때, 라머 세차운동의 주파수를 υ라고 하면, 2π υ = ϒH 따라서, υ = ϒH / 2π Spin에 따른 에너지 준위가 형성 Energy Net magnetization rotates down to xy plane. It will precess in xy plane. Faraday’s Law of Induction Fourier transform • Magnetic resonance by nuclei • Resonant absorption by nuclear spins will occur only when electromagnetic radiation of the correct frequency (e.g., equaling the Larmor precession rate) is being applied to match the energy difference between the nuclear spin levels in a constant magnetic field of the appropriate strength. The energy of an absorbed photon is then E = hν0, where ν0 is the resonance radiofrequency that has to match (that is, it has to be equal to) the Larmor precession frequency νL of the nuclear magnetization in the constant magnetic field B0 Magnetic resonance by nuclei Resonant absorption by nuclear spins will occur only when electromagnetic radiation of the correct frequency (e.g., equaling the Larmor precession rate) is being applied to match the energy difference between the nuclear spin levels in a constant magnetic field of the appropriate strength. The energy of an absorbed photon is then E = hν0, where ν0 is the resonance radiofrequency that has to match (that is, it has to be equal to) the Larmor precession frequency νL of the nuclear magnetization in the constant magnetic field B0 Chemical Shift Chemical Shifts NMR 흡수는 TMS라는 물질에 포함된 수소가 흡수하는 봉우리를 기준값으로 하여 NMR 스펙트럼을 얻고자 하는 분자에 포함된 각 수소 원자가 상대적으로 흡수하는 주파수 를 ppm단위로 표시(δ scale)한다. *TMS(tetramethylsilane)는 휘발성이 큰 비활성 화합물로 NMR spectrum의 가장 오른쪽(0ppm)에 나타난다. Chemical Shift The surrounding electron shield the nuclear spins from the larger magnetic field. This result in a reduction in the energy spacing and a lower Lamor frequency. Spin-Spin coupling Spin-Spin Splitings • Spin-spin spliting 현상은 같은 탄소 또는 이웃한 탄소에 결합한 서로 다른 종류의 수소 사이에서만 일어난다. • BrCH2CHBr2는 서로 다른 두 종류의 수소가 있다. 이 때 1번 탄소에 결합한 수소 원자는 외부 자기장 (B0)이 걸리는 방향과 같은 방향(↑) 혹은 반대 방 향(↓)을 향할 수 있다. • 따라서 2번 탄소에 결합한 두 수소 원자는 B0 보다 조금 세거나 조금 약한 다른 자기장 효과를 느끼게 되므로 공명을 위해 필요한 라디오 파의 주파수가 동일한 수소임에도 불구하고 약간의 차이를 갖게 되면 이를 spin-spin spliting이라 한다. Spin-Spin Splitings Spin-Spin Splitings Spin-Spin Splitings • Intensity One proton 1:1 Two equivalent protons 1:2:1 Three equivalent protons 1:3:3:1 Spin-spin spliting 현상은 같은 탄소 또는 이웃한 탄소에 결합한 서로 다른 종류의 수소 사이에서만 일어난다. BrCH2CHBr2는 서로 다른 두 종류의 수소가 있다. 이 때 1번 탄소에 결합한 수소 원자는 외부 자기장 (B0)이 걸리는 방향과 같은 방향(↑) 혹은 반대 방향 (↓)을 향할 수 있다. 따라서 2번 탄소에 결합한 두 수소 원자는 B0 보다 조금 세거나 조금 약한 다른 자기장 효과를 느끼게 되므로 공명을 위해 필요한 라디오 파의 주파수가 동일한 수소임에도 불구하고 약간의 차이를 갖게 되면 이를 spin-spin spliting이라 한다. Intensity One proton 1:1 Two equivalent protons 1:2:1 Three equivalent protons 1:3:3:1 Signal Number – Chemical 내 서로 다른 위상의 Proton 수 Signal Location – Proton 주변 환경에 의한 Chemical Shift 반영 Signal Height – 각 signal을 만드는 Proton들의 상대적 Ratio Signal의 Splitting – 이웃한 Proton과의 관계 NMR signal의 개수는 화합물에 존재하는 서로 다 른 위상의 Proton의 수를 나타낸다. 서로 다른 환경에 있는 Proton은 서로 다른 NMR Signal을 보인다. (Ex : Diastereotopic) 동일한 준위를 갖는 Proton은 동일한 NMR Signal 로 나타난다. (Ex : Enantiotopic) Signal은 공명에 필요한 주파수가 낮을수록 오른 쪽에 위치하고, Chemical shift가 작다. 전자 밀도가 높을수록 NMR signal은 스펙트럼의 오른쪽에 위치한다. 전자에 의해 shielding되어 있는 Proton일수록 자 기장의 영향을 적게 받는다. 전기음성도가 큰 원자 근처에 있는 Proton은 상대 적으로 덜 shielding되므로 downfield에 나타나 게 된다. 해당 Signal을 나타내는 Proton의 수에 비례하여 면적이 증가한다. 동일 C나 이웃한 C에 동일하지 않은 Proton이 존 재할 때 나타난다. 시그마결합 4개를 넘어가면 나타나지 않는다. 전기 음성도가 큰 원자에 결합한 Proton은 일반적 으로 갈라짐 현상이 나타나지 않는다. Ex : -NH, -OH Benzen은 단 하나의 Signal이 나타난다. (치환기가 있으면 세 종류의 Signal을 보임) How to improve sensitivity