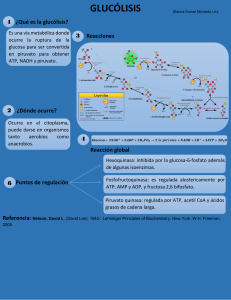
Andrés Queupumil Rodríguez Segundo Departamental Bioquímica Metabolismo -­‐Conjunto de todas las reacciones químicas (transformaciones), catalizadas enzimáticamente, en un organismo; constituyendo rutas metabólicas (comprende todas las reacciones involucradas con el almacenamiento y generación de energía) -­‐Conjunto de procesos “catabólicos” (oxidación) y “anabólicos” (reducción) Catabolismo Conversión de sustancias complejas en simples (inorgánicas) Genera/Libera energía (ATP) Convergente Vía Biodegradativa Oxidativa (pierde ē) Dependiente de NaD+ y FAD+ Variedad de productos iniciales, pero productos finales bien definidos (varios productos, 1 precursor) Exergónico Anabolismo Conversión de sustancias simples a complejas (macromoléculas: biomoléculas) Consume energía (ADP) Divergente Vía Biosintética Reductora (gana ē) Dependiente de NADPH Materiales iniciales bien definidos y variedad en los productos (varios precursores, 1 producto) Endergónico Funciones: • • • • Obtener energía química degradando nutrientes Convertir moléculas nutrientes en moléculas de la célula Polimerizar precursores en biomoléculas Síntesis y degradación de biomoléculas requeridas (funciones celulares) Metabolito: intermediario químico en las reacciones del metabolismo, catalizadas por enzimas Anfibólico: tanto catabólico, como anabólico Conceptos básicos: Nombre Carbono asimétrico (centro quiral) Enantiómeros Epímero Definición Carbono enlazado con 4 sustituyentes diferentes Esteroisómeros ópticos (imágenes especulares) Esteroisómeros de otro compuesto que difiere en 1 C Ejemplos Esteroisomeros D y L Gliceraldehido D Glucosa, D Manosa, D Galactosa Anómero Esterosiómeros que han desarrollado una unión cíclica (hemiacetal) y difieren alrdedor de ese C α-­‐D Ribo piranosa y β-­‐D Ribopiranosa Carbohidratos (Glúcidos/Hidratos de Carbono/Sacaridos) Polihidroxialdehidos/cetonas (grupos funcionales: aldosas y cetosas) Funciones: • • • • • Almacén de nergía Intermediarios metabólicos Parte de la estructura de los ácidos nucleicos Conforman las paredes celulares de bacterias, plantas y el exoesqueleto de insectos Forman moléculas de reconocimiento celular Maltosa Lactosa Sacarosa Celobiosa Isomaltosa Carbohidrato/ Lípido Sacarosa Función Reserva de energía en plantas Glucógeno Rserva de energía en vertebrados Celulosa Estructura de plantas TAG Reserva energética Fosfogliceridos Agente emulsificante Glucosa-­‐Glucosa Galactosa-­‐Glucosa Glucosa-­‐Fructosa Glucosa-­‐Glucosa Enlace α (1-­‐4) Enlace β (1-­‐4) Enlace α (1-­‐2) / β (2-­‐1) Enlace β (1-­‐4) Enlace α (1-­‐6) Producto hidrolisis Glucosa + Fructosa Enzima que degrada Sacarasa Tipo Oligosacáridos α (1-­‐4) y α (1-­‐ 6) Amilasa pancreática Polisacárido homoglucano No se digiere β (1-­‐4) Celulasa MAG + Acidos grasos Ac graso + Lisofosfolip Éster Lipasa pancreática Fosfolipasa Polisacárido homoglucano Lípido compuesto Lípido mixto Enlace α (1-­‐2) Fosfoéster Disacárido Glucólisis (aerobia) Es la vía (catabólica) mas importante del metabolismo de la Glucosa (de la Fructosa, Galactosa y otros carbohidratos de la dieta). Sus reacciones tienen lugar en el citoplasma. Puede producir ATP en ausencia de oxígeno (vía anaerobia). (⇒: Irreversible ⇔:Reversible) 1era fase: Inversión energética/Preparatoria/De activación Pasos Sustratos Enzima Productos Regulación enz 1 Fosforilación (en Glucosa (6C) + Hexocinasa (HK) Glucosa 6P + (−) Glucosa 6P ATP (o Glucinasa) ADP y Pi (+) Insulina ⇒ C-­‐6) (para activar y rtener) (Mg2 +) (REG) 2 Conversión (de Glucosa 6P Fosfohexosa Fructosa 6P (glucosa) ⇔ ald-­‐pirano a cet-­‐ (met de furano) encruz) isomerasa 3 Fosforilación Fructosa 6P + FosfoFructo Fructosa 1, 6 (−) Citrato, ATP ATP Cinasa-­‐1 (PFK1) BP + ADP y Pi (+) AMP, F 2, ⇒ (paso comprometido) (REG) (Mg2 +) 6BP 4 Rotura (aldosa y F 1, 6 BP Aldolasa (liasa) G3P (sigue) cetosa) DHCP (no ⇔ sigue) 5 Interconversión DHCP TriosaFosfato (2) G3P Isomerasa ⇔ 2nda fase: Recuperación energética/De beneficios/ Oxidativa 6 Oxidación (y G3P (2) + 2Pi G3P 1, 3 Deshidrogenasa BPGlicerato (2) ⇔ Fosforilación no x ATP) (reac + (2) NADH + conserv d energ) H+ 7 Transferencia 1, 3 FosfoGlicerato 3-­‐ BPGlicerato (2) cinasa (Mg2 +) FosfoGlicerato ⇔ (pierde enlace tioester) (met de alta (2) + (2) ATP energía) + ADP 8 Conversión (en 3-­‐ Fosfoglicerato 2-­‐ FosfoGlicerato mutasa (Mg2 +) FosfoGlicerato ⇔ la misma mol) (2) (2) 9 Deshidratación 2-­‐ Enolasa Fosfoenol (hidrólisis) FosfoGlicerato (deshidratasa) piruvato ( 2) ⇔ (2) (PEP) + (2) H2O 10 Transferencia PEP (2) (met Piruvatocinasa Piruvato (2) + (−) Alanina, Fosf de alta (PK) (REG) (2) ATP d AMPc ⇒ (Fosforilación) energía) (Mg2 +) (+) F1, 6 BP *La Km de la Hexocinasa es más baja que la de la Glucinasa (sólo en hígado; muy activa después de comer). El citrato es el modularo alostérico más potente de la glucólisis *F2, 6BP (mecanismo regulador en hígado): Después de 1 comida se forma F2, 6BP (a partir de F6P, por acción de PFK2; no es sustrato de la glucólisis) activa (+) a la PFK1 y estimula la glucólisis: Ayuno (Glucagón) PFK2 (activa) (DP) Posprandial (Insulina) PFK2 (inactiva) (P) PKA (Protein cinasa a) (+: x AMPc) èP Fosfatasas èDP PFK2 (inactiva) (P) PFK2 (activa) (DP) No hay producción de F2, 6BP Producción de F2, 6BP PFK1 menos activa PFK1 más activa Las enzimas de la vía son estero-­‐específicas para “formas D”. El ATP puede hacer irreversibles (o inhibir) las reacciones La vía tiene 2 Fosforilaciones a nivel de sustrato (paso 7 y 10) y 1 deshidrogenación (oxidación a nivel de sustrato (paso 6). Además de presentar 2 metabolitos de alta energía (productos de reacciones 6 y 9) que se produjeron por 1 Deshidrogenación y 1 Deshidratación respectivamente (Regla: después de 1 met de alta energía: Fosforilación a nivel de sustrato) Se producen 2 ATP, 2 NADH + H+, 2 H2O y 2 Piruvatos (3 reacciones irreversibles, correspondientes con las enzimas reguladoras: HK, PFK1 y PK). Balance total: (Sabiendo que cada NADH + H+ son 3 ATP) 8 ATP son el balance total *Los eritrocitos no poseen mitocondrias, son dependientes de la glucolisis para su energía (La def de PK hace def la prod de ATP, lo que produce “anemia hemolítica” en los eritrocitos) Glucolisis anaerobia Reacción Sustrato Enzima Producto Reducción Piruvato Lactato Deshidrogenasa (LDH) Lactato El lactato es liberado por los tejidos (eritrocitos o músculo en ejercicio) y pude ser utilizado por el hígado para la gluconeogénesis (reversible) (se gastan los NADH de la Glucolisis). Produce 2 ATP Gluts Glut Tejidos Afinidad a Glut 1 Todos Alta por Glucosa Glut 2 Hígado, riñón y c β del páncreas Baja por Glucosa Glut 3 Cerebro Alta Glut 4 Tejido adiposo y músculo Sensible a Insulina Glut 5 Espermatozoides Fructosa *Glut 2 y Glucocinasa tienen un Km más alto para el transporte y la fosforilación de la Glucosa, si fllan se libera Glucagón pero no Insulina (páncreas) Descarboxilación oxidativa del piruvato Oxidación del piruvato para dar Acetil CoA y CO2, se hace sobre el llamado “complejo piruvato deshidrogenasa” (similar al complejo α Ceto-­‐glutarato deshidrogenasa del ciclo de Krebs) Complejo: • • • Piruvato deshidrogenasa (E1) (da nombre a todo el complejo) Dihidrolipoil transacetilasa (E2) Dihidrolipoil deshidrogenasa (E3) Enzima Función E1 Descarboxila al piruvato E2 Cataliza la transferencia del grupo acetilo a la CoASH (Transcetilación) E3 Oxida nuevamente a la dihidrolipoamida (Deshidrogenación) Regulación: • • Coenzimas TPP (Pirofosfato de tiamina) Ácido lipoico, CoASH NAD+, FAD+ (+): Acetil CoA, NADH + H+ (−): ADP, NAD+, CoASH, Piruvato Coenzimas TPP Lipoato FAD NAD Coenzima A (CoA o CoASH) Función -­‐Coenzima de todas las descarboxilaciones de los αcetoacidos -­‐Coenzima de la piruvato descarboxilasa -­‐Coenzima de la E1 -­‐En la oxidación del piruvato es el siguiente aceptor de aldehído generado por el TPP -­‐Tiene 2 grupos tiol que experimentan reacciones de oxido-­‐ reducción, y actúa como 1 transportador de hidrógeno (transportador electrónico) y de un grupo acilo -­‐Coenzima de la E2 -­‐Transportador de electrones -­‐Coenzima de la E3 -­‐Transportador de electrones -­‐Contiene un grupo tiol reactivo que se une covalentemente al grupo acilo y lo transporta a otras reacciones metabólicas Derivado de Vitamina B1 (tiamina) Ácido lipoico Vitamina B2 (Riboflavina) Nicotinamida Pantotenato Ciclo de Krebs (vía anfibólica) 1 ⇒ Pasos Condesación de (Escisión de enlace tioéster) Sustratos AcetilCoA + Oxalacetato (OAA) Enzima Citrato sintasa (ligasa) REGULA Productos Citrato (6C) 2a ⇔ Deshidratación (salida de H2O) Hidratación (entrada de H2O) Aconitasa (isomerasa) Cis-­‐Aconitato (intermediario) 2b ⇔ Citrato (alimentador de Sint de Ac G) Cis-­‐Aconitato (intermediario) Isocitrato + H2O Regulación enz (−) Citrato, NADH + H+, ATP, Succinil CoA y ac gras (+) Acetil CoA (−) Cloroacetato y flouroacetato 3a ⇒ 3b ⇒ 4a ⇒ 4b ⇒ 4c ⇒ 5 ⇔ 6 ⇔ 7 ⇔ Oxidación (Lib de NADH + H+) Isocitrato + NAD+ Dscarboxilación (Lib de CO2) Oxalo-­‐succinato (intermediario) Oxidación (Lib de NADH + H+) Dscarboxilación (Lib de CO2) α Ceto-­‐glutarato (5C) + CoASH + NAD+ * Complejo α Ceto-­‐glutarato dshidrogenasa Succinil CoA (metabolito de alta energía) Succinato (4C) Transcetilación (entrada d CoASH) Conversión (Lib de GTP y salida de CoASH) (Escisión de enlace tioéster) Oxidación (Lib de FADH2) Hidratación Fumarato (entrada de H2O: doble enlc) Oxidación (Lib Malato de NADH + H+) Isocitrato dshidrogenasa REGULA VEL Oxalo-­‐succinato + NADH + H+ α Ceto-­‐glutarato [Glutamato] + CO2 Succinil CoA + NADH + H+ (+) ADP, Ca2+ (−) NADH + H+, ATP Succinil CoA sintetasa (tiocinasa) Succinato + GTP + CoA Succinato dshidrogenasa (no libre) Fumarasa (hidratasa) Fumarato y FADH2 (−) Malonato (−) Succinil CoA, Arsénico Malato (parte de 1 lanzadera) + H2O 8 Malato OAA [Aspartato] (−) NADH + H+ Dshidrogenasa (encruzijada ⇔ met) + NADH + H+ *Complejo: usa 5 cofactores: TPP, ácido lipoico, CoASH, FAD y NAD *En corchetes: los aminoácidos intermediarios del ciclo; y las flechas si la reacción es reversible o no (Del piruvato: alanina) Existen 3 Deshidrogenaciones (salida de Hidrogenos) a nivel de sustrato/Oxidaciones en el ciclo: 3 NADH + H+ y 1 FADH2 (donan electronea a la cadena de transporte de electrones) El paso de estos electrones a O2 (fosfoliración oxidativa) genera por cada NADH + H+ aprox 3 ATP y por cada FADH2 aprox 2 ATP Existe 1 Fosfoliración a nivel de sustrato (posterior a la creación de 1 metábolito de alta energía) (Escisión de succinil COA produce GTP) La energía total generada por 1 vuelta del ciclo, empezando por 1 acetilCoA, es aprox: 12 ATP (11 ATP y 1 GTP) Existen 2 Descarboxilaciones a nivel de sustrato (Liberación de CO2) Las hidratasas usan de cofactor al Fe+ y las deshidrogenasas al Mg2+ La piruvato carboxilasa (usa de sustrato al piruvato) convierte al piruvato en OAA (reacción anaplerótica) y es activada por la AcetilCoA (cofactor: biotina) Cadena de transporte de electrones Complejos: NADH Deshidrogenasa I Succinato Deshidrogenasa II Ubiquinona-­‐cito oxidoreductasa / complejo bc1 citoc-­‐ reductasa III Citocromo c oxidasa IV -­‐1er Sitio de Bombeo de protones -­‐Recibe H+ de NADH + H+ (reducido) -­‐Tiene al FMN (Flavín mononucleótido) como aceptor de ē(s) del NADH + H+ (que transfiere a través de los centros Fe-­‐S a la coenzima Q (ubiquinona) -­‐Tiene el potencial de Oxido-­‐Reduc + neg -­‐Se reduce la Ubiquinona -­‐Bombea 4 protones -­‐Único que no transloca (bombea) protones (hidrogenos) al espacio intermembranal -­‐Enzima del Ciclo de Krebs embebida en la memb mit int -­‐También manda ē(s) a la CoQ (centros Fe-­‐S) -­‐Grupo prostetico: FAD -­‐No bombea -­‐2ndo Sitio de Bombeo de protones -­‐Recibe ē(s) del CoQ (forma reducida) -­‐Tiene, en su estructura, citocromos b y c1 (2 tipos): cada cit consiste en 1 grupo hemo asociado a 1 prot -­‐Contiene ferro-­‐sulfo-­‐ proteínas (hierro de grupo Hemo se reduce cuando cit acepta 1 ē) -­‐Bombea 4 protones -­‐Último sitio de bombeo de protones -­‐Transfiere los ē(s) al O2 molecuar reduciéndolo a H2O (se requieren 2 ē(s) para reducir 1 átomo de O2) (citrocromo oxidasa cataliza la reacción) -­‐Contiene a los citocromos a y a3 (cada uno de llos contiene 1 grupo hemo y 2 prot dif que contienen Cu: Cobre) -­‐Tiene el potencial de Oxido-­‐Reduc + posit -­‐Bombea 2 protones Inhibe Cianuro y Monoxido de Carbono y H2S (sulfuro de Hidrógeno) y Azida de Sodio Inhibido por Amital y Lo inhibe el Malonato Demerol (Barbitúricos) Rotenona (acumulación de NADH + H+) *FMN derivada de la riboflavina Inhibido por Antimicina A (proteínas Rieske: inhib x mixiotaxol, Antimicina B e etigmatelina) *Azida de Sodio (practica levadura: el pH extracelular se mantiene, se detiene la sint mit de ATP, pero continua el consumo de O2) *CoQ: puede sintetizarse en el organismo, no deriva de inguna vitamina (semiquinona: forma oxidada; ubiquinol: forma reducida) *En forma férrica/oxidada (Fe3+) el hierro hemo aceptar 1 ē y reducirse a la forma ferrosa (Fe2+) La energía producida por la transferencia de ē(s) se emplea para bombear protones al lado citosólico de la memb mit int Entre los complejos (cara mitocondrial, excepto en II) hay 3 sitios para la fosforilación oxidativa: • • • Se genera 1 ATP por cada NADH que transfiere ē(s) a la CoQ Se genera 1 ATP por cada CoQ que transfiere 2 ē(s) al citocromo c Se genera 1 ATP por cada 2 ē(s) transferidos del citocromo c al O2 (por cada ½ O2 que se reduce a H2O) Fosfoliración oxidativa: El paso de ē(s) del complejo I al IV genera 1 potencial electroquímico/fuerza mot protónica (del potencial oxid-­‐reduc más neg al posit). El lado citósolico de la memb int mit es muy ácido (bajo pH), superior al de la matriz; los protones sólo pueden volver a entrar por el: Complejo V, F0-­‐F1/ ATPasa (sintasa) (Translocasa de nucleotido de adenina: ADP) -­‐Alimentador: ADP + Pi (regula la velocidad) -­‐El componente F0 forma 1 canal en la memb mit int a través del cual pasan los protones -­‐El F1 es la cabeza sintetizadora de ATP (con 3 sitios activos) que se proyecta a la matriz y se conecta al F0 por 1 tallo -­‐Producto: ATP (bombeo de protones al contrario) -­‐Inhibido por Oligomicina (F1) *Dinitrofenol: se inserta en la memb mit int (y hace que entren protones sin pasar por V) *Se producen 3 ATP por cada NADH + H+; y se producen 2ATP por cada FADH2 *Valinomisina (ionóforo): Permite la entrada de Na+ a la mitocondria Antiporte ATP-­‐ADP: el ATP producido en el interior de las mitocondrias se transfiere al citosol, gracias al intercambio por ADP mediante esta prot de transp en la memb mit int (inhibe: atractilósido) *Descoplante (de V) e Inhibidores (de I a IV) Radicales libres: Cualquier átomo o molécula que cuenta con uno o más ē(s) desemparejados (partícula sola en 1 orbital), que incrementa la reactividad química de 1 átomo o molécula (pues busca con avidez completarse). Pueden alterar la estructura y funcionamiento de moléculas biológicas importantes, como: enzimas, fosfolípidos (membranas), proteínas ácidos nucleicos… Se forman por rupturas homolíticas Hay radicales libres centrados en nitrógeno, carbono… En los sistemas biológicos los más importantes son los del oxígeno ERO: Especies reactivas de oxígeno Radicales libres Dioxígeno Anión Superóxido Hidroxilo Peroxilo Alcoxilo Hidroperoxido Dioxígeno (oxígeno molecular) Anión superóxido No radicales Peróxido de hidrogeno Ácido hipocloroso Ozono Singulete de oxígeno Unión covalente de 2 átomos individuales de oxígeno Posee 2 electrones que no forman pares en su último orbital Poco reactivo Radical con carga negativa (posee un electrón adicional) Se forma cuando un O2 capta un electrón (se reduce) Muy reactivo (se genera cuando se reperfunde un paciente que ha sufrido una “isquemia”) No se difunde al exterior de la célula Fuentes (endógenas): -­‐CoQ (de la CTE: mitocondria): al perder 1 ē en la transferencia a los complejos; y transferido al O2 (CoQ es la principal fuente de superóxido en el interior de la célula) -­‐“NADPH oxidasa”: enzima incluida en la membrana del fagolisosoma (macrófago) del interior de las células inmunitarias; los electrones transfieren del NADPH oxidasa al O2 (que se emplea para destruir microorganismos). La enzima genera el radical superóxido en la “llamarada/estallido respiratorio” consecuente con la interacción de 1 antígeno con los polimorfonucleares y los macrófagos Hidroxilo (OH) Es la especie de oxígeno más reactiva (tóxica) Se obtiene en la reacción de Fenton Peróxido de Resulta de la reducción completa del anión superóxido (no es 1 radical) hidrógeno No posee electrones desemparejados (H2O2) Puede producir hidroxilo (OH) Fuentes (endógenas): -­‐Peroxisoma: en su interior se produce la “oxidación de grasas” (transferencia de 2 ē(s) de FADH2 al O2) -­‐“Mieloperoxidasa”: enzima de células inmunitarias (especialmente de los neutrófilos); cataliza la formación de ácido hipocloroso (HOCl) a partir de H2O2 y en presencia de 1ión haluro (como el cloro). Se libera por los polimorfonucleares a la circulación y utiliza los cloruros plasmáticos para generar hipoclorito, con acción bactericida Singulete de Tampoco es un radical (porque todos sus electrones forman pares) oxígeno Es una molécula muy inestable Antioxidantes (defensa celular frente a las ERO) Los ha desarollado la célula (enzimas y otras moléculas) para protegerse frente a las ERO. Funcionan como atrapadores (scavengers) de radicales libres. Clasificación: Endógenos Enzimaticos Superóxido dismutasa (SOD) Catalasa Glutatión peroxidasa No enzimáticos Lactoferrina Ferritina Álbumina Exógenos (dietéticos) Vitamina C (ácido ascórbico/ascorbato) Vitamina E (tocoferol α) Vitamina A (carotenos β) Flavonoides (compuestos fenólicos) Fármacos de actividad antioxidante (antiinflamatorios no esteroides AINES, penicilamina, deferoxamina, captopril…) SOD Catalasa Glutatión peroxidasa β Carotenos Tocoferol Vitamina C Las isoenzimas de esta enzima se encuentran en la mitocondria, el citosol y el medio extracelular (3 tipos de isoformas) Cataliza la conversión del anión superóxido a H2O2 y O2 Actúa sobre el radical libre de oxígeno que se genera cuando se reduce la molécula de oxígeno con 1 solo ē (anión superóxido) Se encuentra en el interior de los peroxisomas (donde protege a la celula de la producción endógena de H2O2) Enzima que favorece la conversión de H2O2 a 2H2O y O2 (previniendo la formación de hidroxilos) Tripéptido que es oxidado para donar equivalentes reductores destinados a regenerar moléculas celulares oxidasas Es generado como parte del ciclo del γ-­‐glutamilo (su concentración es mayor en el hígado) Cataliza la reducción de H2O2 en 2H2O No funciona en la “anemia hemolítica” porque uno de sus sutratos, no puede regenerarse Se relaciona con la vía de las pentosas Precursor de la Vitamina A, junto con los flavonoides atrapa moléculas del singulete de oxígeno (B2) Vitamina (E) liposoluble que reacciona con los radicales libres de oxígeno x Glucogénesis (síntesis de glucógeno) GUARDAR (en músculo, híago y riñón) 1 2 Pasos Fosforilación Isomerización 3 Activación (sintesis de UDP Glucosa) Sustrato Glucosa Glucosa 6 P (alimentador) Glucosa 1 P + UTP Enzima Hexocinasa o Glucocinasa Fosfoglucomutasa Productos Glucosa 6 P Glucosa 1 P UDP glucosa (activada) + UDP glucosa pirofosfolirasa PPi (escindido en 2Pi x pirofosfatasa) 4 Unión (sintesis de enlaces α-­‐ 1,4) Ramificación UDP glucosa Glucógeno sintasa (reguladora) a: forma inactiva b: forma activa Glucosil-­‐(amilo) 4:6 transferasa (Enz Ramificante/dora) Transferencia de 1 Glucosa (unidad glucosilo) a extremos no reductores del glucógeno + UDP Cadena de Rompe un enlace α-­‐1,4 y 5 residuos de forma un enlace α-­‐1,6 glucosa (incrementa solubilidad y densidad) *Los cebadores (pedazos de glucógeno) estan unidos por su extremo reductor a la glucogenina *Glucógeno se almacena en hígado, músculo y riñones Glucogenolisis (degradación del glucógeno) SACAR (músculo e hígado) 1 2 Pasos Rompimiento (de enlaces α-­‐ 1,4) Sustrato Extremo reductor de cebador de glucógeno Enzima Glucógeno a: forma fosforilasa inactiva (reguladora) b: forma + 8Pi activa Glucosil-­‐(amilo) 4:4 Desramificación Puntos de transferasa y α-­‐1,6 (rompimiento ramificación α-­‐1,6 glucosidasa (Enz tiene límite) con 4 Glucosas Desramificante/dora) (2 acciones: corta y pega) Productos (8) Glucosa 1 P 3 Glucosas (externas) incorporadas en forma de trisacárido al extremo no reductor (por 4:4-­‐ transferasa) y 1 Glucosa libre (α 1, 6) 3 Isomerización Glucosa 1 P Fosfoglucomutasa Glucosa 6 P 4 Desfosforilación Glucosa 6 P Glucosa 6 fosfatasa Glucosa (libre) + Pi * Se repite el proceso fosfolirasa/desramificación generando: Glucosa 1P y Glucosa libre (10:1) (la proporción refleja la longitud de las cadenas en la región externa) *Los otros 2 pasos los lleva a cabo el hígado para la glucemia, y en el músculo para entrar a la glucólisis (músculo no contiene glucosa 6 fosfatasa: no contribuye a la glucemia) Regulación de glucogénesis y glucogenolisis Simbología: Símbolo Significado Símbolo Significado Símbolo Significado è Activa èDP Desfosforila D Acción directa èI Inactiva (P) Fosforilada ID Acción indirecta (+ enzimas) èP Fosforila (DP) Desfosforilada PP1: Fosforilasa fosfatasa/Proteinfosfatasa (dependiente de insulina) (existen 3 fosfatasas/desfosforilasas: 1 de la fosforilasa cinasa, 2 de la glucógeno fosforilasa a y b, 3 de la glucógeno sintasa a y b: asociadas a insulina) DPç Hormona (1er mensj) Músc Epinefrina (Adrenalina) (estrés)è Pánc Glucagón (ayuno)è éAMPc è (acumulación) 1 Receptor è Proteína G Inactiva Gsα (sub unidad α) unida a GDP èP PKA (Proteincinasa a depediente de AMPc) (activa) èP (en residuos de Serina) Activa Gsα (unida a GTP) è 1 D Sep de subunidades è Inactiva AdenilCiclasa (Adenilatociclasa) cataliza: AMPc a partir de: ATP è cAMP (2ndo m) Glucógeno Sintasa b (P) 2 ID Fosforilasa cinasa (P) Reduce su actividad (comienzo d Glucogenolisis) (Act x Ca2+ en musc, se une a la subunidad: calmodulina) Inhibición de Glucogénesis Glucógeno PKA (Proteincinasa) Glucógeno -­‐Reduce su Sintasa b èP D Sintasa a actividad (activa) (P) (inactiva) (DP) -­‐Reduce la síntesis DPç Fosfatasa GUARDA NO GUARDA de Glucógeno (al mismo tiempo) (al mismo tiempo) 2 Activación de Glucógeno Fosforilasa cinasa Glucógeno -­‐Degradación del Glucogenólisis Fosforilasa a (P) èP ID Fosforilasa b Glucógeno (inactiva) (DP) DPç Fosforilasa a (activa) (P) -­‐Liberación de G1P NO SACA SACA a torrente fosfatasa (PP1) *Act: de Glucogenólisis: Fosforilasa activa y Sintasa inactiva. Inb de Glucogénesis: Sintasa activa y Fosforilasa inactiva Hormona Páncreas Insulina è (abundancia) Fosfodiesterasa (enz cat de:) AMPcè 5’AMPèI Glucosa Hexocinasa/ Glucinasa èP Receptor è Fosfodiesterasa è Inhibición de cascada Exposición de Captura de Glucosa Gluts (4 y 2) è PKA Bloqueo de las fosforilaciones (inactivación) Activación de fosfatasas (desfosforilasas) por insulina (DPç) Glucosa 6P Fosfoglucomutasa Glucosa 1P (isomerasa) è UDP Glucosa è (sustrato de:) Glucógeno sintasa (activa) 1 Inhibición de Glucógeno Fosforilasa èDP Glucogenólisis Fosforilasa b (PP1) (activa) (P) Pç Fosforilasa b SACA cinasa (PKA ID) 2 Activación de Glucógeno Fosforilasa a èDP Glucogénesis Sintasa a fosfatasa (PP1) (inactiva) (DP) Pç PKA NO GUARDA (Proteincinasa D) Pirofosforilasa + UTP è Comienzo de la Glucogénesis Glucógeno Fosforilasa a (inactiva) (DP) NO SACA Glucógeno Sintasa b (activa) GUARDA -­‐Reduce su actividad -­‐Reduce la síntesis de Glucógeno -­‐Aumento de Glucosa -­‐Sintesís de Glucógeno *La Glucógeno fosforilasa requiere: Pirodoxal Fosfato (se act x AMPc y Ca2+) *La Fosforilasa a (PP1) es el modulador (+) más importante de la Glucólisis (Glucogénesis activa y Glucogenólisis inactiva) Síntesis: Cél (panc) Alfa (α) Hormona Glucagón Condiciones Glicemia baja (escasez de Glu) (Supraren) Epinefrina Estrés (Adrenalina) (Simpático) Efecto Hiper-­‐ glucemiante Vías 1 Inhiben la Glucólisis (−) Vías 2 Activan la Glucogenólisis (+) Activan la Inactivan la Gluconeogénesis Glucogénesis hep (+) (−) Beta (β) Insulina Glicemia alta Favorece la Inhibe la (abundancia Glucólisis (Gluts) Glucogenólisis de Glu) Hipo-­‐ (+) (−) glucemiante Reprime la Activa la Gluconeogénesis Glucogenésis hep (−) (+) *Glucagón mantiene la Glucemia entre comidas (sólo actúa sobre la fosfolirasa hepática, y en los riñones) *Los efectos de la insulina son para todos los órganos (Glucólisis) *La PKA también estimula la Gluconeogénesis. El glucagón activa la PKA (por AMPc), que puede fosfolirar (inactivar) a la PK de la Glucólisis (PK, se activa postparandial por las fosfatasas de la insulina) Gluconeogénesis (oxidación alt de Glucosa: vía Hexosa Monofosfato) Vía anabólica que se produce principalmente en el hígado, y en menor grado en el riñon (hepatocito y/o célula renal) para la formación de glucosa a partir de compuestos no azucares. Predominante en la inanición y acidos metabólica. En condiciones de ayuno, los niveles de “glucagón” son elevados y estimula esta vía (inhibiendo la glucólisis) Precursores: • • • Lactato (Lactato Deshidrogenasa + NAD+) è Piruvato Aminoácidos (que forman productos intermediarios del piruvato o del CAT) è Piruvato (Transaminasa: Alanina è Piruvato) Glicerol (de los TAG’s) è DHAP (Dihidroxicetona fosfato) *La piruvato carboxilasa hace una “reacción anaplerótica” 1 Sustratos (2) Piruvato OAA Enzimas Piruvato carboxilasa (enz mit, biotina:cofactor) + Co2 + (2)ATP Malato Deshidrogenasa mit + NADH + H+ Productos Reg enz L OAA (dentro de la mit) + (2) (+) Acetil CoA A N ADP y Pi (−) ADP Z 2 Malato o Aspartato (puede atravesar la memb mit: M Lanzadera) + NAD+ A 3 Malato Malato deshidrogenasa cit + OAA (fuera de la mit) + L /Aspartato NAD+ (tmb para β-­‐reducción) NADH + H+ (no regresa a Lanzadera) A 4 OAA Fosfoenolpiruvato carboxinasa PEP (Fosfoenolpiruvato) + S Ī (PEPCK) (Descarboxilación) + (2) Co2 + (2) GDP y Pi P GTP (Mg 2+) Reversión de reacciones glucolíticas (2 PEP hacen 1 Fructosa 1, 6 Bifosfato) (Se gasta otro (2) ATP en transf 3PGlicerato en 1, 3BPGlicerato) 5 F 1,6 BP Fructosa 1, 6 Bifosfatasa (Mg Fructosa 6 Fosfato (F6P) + (+) G3P Ī 2+) (Reguladora) + H2O + ATP Pi (−) AMPc, F 2,6 BP F6P se convierte en G6P x la misma isomerasa de la Glucolisis 6 G6P Glucosa 6 Fosfatasa (Mg 2+) Glucosa libre + Pi (−) Glucosa Ī (tmb participa en Glucogenolisis) + H2O + ATP *PEPCK homologa de PK, F 1, 6 Bftasa homologa de PFK y G 6 Ftasa homologa de HK/GK (en glucólisis: reacciones no reversibles) *La G6 Fosfatasa sólo se encuentra en hígado y riñones (deficiencia: Von Gierke) (No es musc) *Es la vía más cara del metabolismo porque para formar 1 molécula de Glucosa se usan 6 ATP *Comprende las mismas reacciones de la glucólisis excepto en los 3 pasos de control enzimático (PFK, PK y HK) (Reacción inversa: Ī ) *Biotina: Vitamina hidrosoluble que hace de cofactor para carboxilasas: piruvato c, AcetilCoA c… *Papel de la FosfoFructoCinasa 2 (PFK2) (la 1 es análoga, en la Glucólisis, a la Fructosa 1, 6 Bifosfatasa: reguladora) PFK2 Fsfolirizada (inactiva) (Glucagón) No produce F2, 6 BP (ausencia) No fosfolirizada (activa) (Insulina) Produce F2, 6 BP Ciclo de Cori (Pendiente) (+) Gluconeogénesis (−) Glucólisis (+) Gluconeogénesis Vía de las Pentosas (vía del fosfogluconato) Produce NADPH + H+ (agentes reductores) para la síntesis de acidos grasos (y reducir el glutatión) (Fructosa 6P y G3P, generados en la vía, vuelven a entrar en la glucolisis) 1 2 Pasos Oxidación (enz REG) Sustratos (1) Glucosa 6P (encruzijada) + (6)NADP+ 6PGLactona Primera fase (oxidativa) Enzima Productos Glucosa 6P Deshidrogenasa 6-­‐Fosfogluconolactona + + NADP+ (coenzima) (6) NADPH + H+ Hidrólisis GluconoLactonasa + H2O 6-­‐FosfoGluconato + H+ (paso irrever) (hidrolasa) 3 Descarbox 6PGluconato 6-­‐FosfoGluconato Ribulosa 5 Fosfato + (6) oxidativa Deshidrogenasa + NADPH NADPH + H+, + Co2 Segunda fase (no oxidativa) (reversible) 4 Isomerización Ribulosa 5P Ribulosa 5P Isomerasa Ribosa 5P (5c) y/o Epimeriz. Ribulosa 5P Epimerasa Xilulosa 5P (5c) Ribosa 5P (5c) Transcetolasa (Transfiere 2 Seudoheptolasa (+2c: 7c) 5 Transferencia Xilulosa 5P (5c) carbonos) (TPP cofactor) G3P (−2c: 3c) de Carbonos S.heptolasa (7c) Transaldosa (Transfiere 3 Eritrosa P (−3c: 4c) carbonos) G3P (3c) Fructosa 6P (+3c: 6c) *La Glucosa 6P Deshidrogenasa es la enzima reguladora de la vía; su defiencia causa una producción deficiente de NADPH + H+; se asocia a “anemia hemolítica” en los eritrocitos (por glutatión no reducido adecuadamente, produciendo radicales libres) El producto de la vía son 12 NADPH + H+ por cada molécula de hexosa (Glucosa 6P: encruzijada metabólica) (2 Deshidrogenaciones a nivel de sustrato: 6 x 2) Cuando la [NADPH + H+] es baja: las reacciones oxidativas de la vía pueden reutilizarse para generar más “Ribosa 5P” (biosíntesis de nucleótidos). Cuando la [NADPH + H+] es alta la parte no oxidativa ayuda a la biosíntesis de nucleótidos (a partir de F6P y G3P)