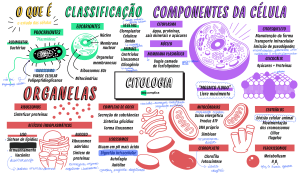
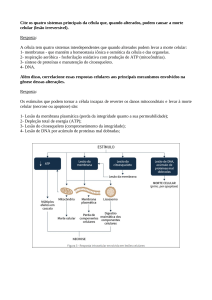
UNIVERSIDADE FEDERAL DO PAMPA ENGENHARIA DE ALIMENTOS DISCIPLINA DE QUÍMICA DE ALIMENTOS PROTEÍNAS Profa. Valéria Terra Crexi Propriedades Funcionais das Proteínas As proteínas têm uma grande influência sobre os atributos sensoriais dos alimentos. Atributos sensoriais: Textura, sabor, cor e aparência. no alimento são o efeito líquido de interações complexas entre vários componentes. Propriedades Funcionais das Proteínas Ex: Propriedades sensoriais dos produtos de padaria: propriedades viscoelásticas formação da massa do glúten do trigo. e de Propriedades Funcionais das Proteínas Ex: produtos cárneos características texturais e de suculência dependem das proteínas do músculo (actina, miosina, actomiosina e várias proteínas solúveis da carne) Propriedades Funcionais das Proteínas Ex: estrutura de bolos, propriedades de batimento de alguns produtos propriedades das proteínas da clara de ovo - Propriedades Funcionais das Proteínas Propriedade funcional- toda propriedade nãonutricional que influi no comportamento de um alimento . características sensoriais, propriedades físicas dos alimentos e de seus ingredientes Processamento, armazenamento, preparo e consumo Propriedades físico-químicas proteínas X Funcionalidade das proteínas Tamanho, forma, composição e seqüência de aminoácidos, carga líquida e distribuição das proteínas, Razão de hidrofobicidade/hidrofilicidade conformação (estrutura secundária, terceária e quartenária), capacidade de reação com outros componentes. Tabela 1: Funções das proteínas alimentares em sistemas de alimentícios Propriedade funcional Alimento Solubilidade, viscosidade Bebidas Viscosidade, capacidade de absorção de água, Cremes, sopas, molhos emulsificação Formação da massa Massas alimentícias, pães Formação de espuma, emulsificação, Pães, bolos, biscoitos capacidade de absorção de água Geleificação, formação de espuma Sobremesas lácteas, merengue Emulsificação, viscosidade, geleificação Queijos Geleificação, capacidade de absorção de água, Produtos de carne emulsificação cozidos Texturização, fixação de aromas, absorção e Similares da carne retenção de água Emulsificação Maionese, manteiga Geleificação, formação de espumas Produtos do ovo As propriedades funcionais podem ser observadas como manifestações de três aspectos moleculares das proteínas 1) Propriedades de hidratação 2) Propriedades relacionadas a superfície proteica 3) Propriedades hidrodinâmicas/reológicas 1) Hidratação proteica Propriedades funcionais: Umectabilidade,expansão,solubilidade, espessamento/viscosidade, capacidade de retenção de água, gelificação, coagulação, emulsificação e formação de espuma INTERAÇÕES ENTRE ÁGUA E PROTEÍNA Moléculas de água ligam-se a diversos grupos nas proteínas 1) Hidratação proteica A capacidade da proteína de se ligar à água é definida como gramas de água ligada por grama de proteína, quando um pó seco de proteína é equilibrado com vapor de água a uma umidade relativa de 90-95%. “Propriedades de hidratação das proteínas estão relacionadas com fatores intrínsecos da própria molécula” Composição de aminoácidos e conformação : interação com a água através de pontes de hidrogênio, ligações dipolo-dipolo ou cadeias laterais de aminoácidos (interação com os grupos ionizados). Composição de aminoácidos: # aminoácidos com cadeias laterais hidrofóbicas: menor capacidade de hidratação # aminoácidos com cadeia laterais hidrófilas: estabelecem mais facilmente pontes de hidrogênio com a água Conformação: # Ordenação no espaço ao longo das cadeias polipeptídicas unidas por pontes de hidrogênio – ESTRUTURA SECUNDÁRIA # Organização tridimensional dessas cadeias ordenadas – ESTRUTURA TERCEÁRIA Relacionado com fatores ambientais: pH, força iônica, temperatura, tipo de sais pH Valores menores ou maiores que o ponto isoelétrico Cargas positivas ou negativas (repulsão entre as moléculas de proteína) – moléculas de água interagem com essas cargas, solubilizando a proteína. pH próximo ao ponto isoelétrico (cargas líquida neutra) Aumento da interação proteína-proteína Solubilidade As propriedades funcionais das proteínas são afetadas pela solubilidade da proteína Espessamento, formação de espuma, emulsificação e geleificação A solubilidade manifestação do equilíbrio entre as interações proteína-proteína e proteína-solvente Proteína-Proteína+ Água Proteína-Água Proteína solúvel Interage com solvente (pontes de hidrogênio, dipolo-dipolo e interações iônicas) Interações de natureza hidrofóbica – promovem interação proteína-proteína, resultando em diminuição da solubilidade Proteína solúvel Interações de natureza iônicas – promovem interação proteína-água, resultando em aumento da solubilidade Resíduos iônicos- repulsão eletrostática entre as moléculas de proteína que se deve à carga positiva ou à negativa líquida, em qualquer pH que não seja o pH isoelétrico Classificação das Proteínas quanto a Solubilidade Albuminas São solúveis em água (ovoalbumina, α-lactoalbumina) em pH 6,6 Globulina São solúveis em soluções salinas diluídas em um pH 7,0 (glicinina, β-lactoalbumina) Classificação das Proteínas quanto a Solubilidade # Proteínas altamente hidrofóbicas Glutelinas São solúveis apenas em soluções ácidas de pH 2,0 e soluções alcalinas de pH 12 (ex. glutelinas do trigo) Prolaminas São solúveis em etanol a 70% (gliadinas) pH e Solubilidade pH abaixo ou acima do pH isoelétrico # proteínas possuem carga líquida positiva ou negativa A repulsão eletrostática e a hidratação dos resíduos carregados promovem a solubilidade da proteína. Gráfico solubilidade X pH = formato em U pH e Solubilidade Solubilidade mínima próxima ao pH isoelétrico falta de repulsão eletrostática, o que promove a agregação e a precipitação por meio de interações hidrofóbicas. pH e Solubilidade Maior parte das proteínas é altamente solúvel em pH alcalino de 8-9 Extração proteica de fontes vegetais, como farinha de soja, é realizada a esse pH pH e Solubilidade Desnaturação pelo calor pelo calor muda o perfil da solubilidade-pH das proteínas Alteração no perfil da solubilidade na presença da desnaturação pelo calor se deve ao aumento da hidrofobicidade da superfície proteica como conseqüência do desdobramento. # Alteração do equilíbrio entre as interações proteína-proteína e proteína-solvente, a favor da primeira. Força iônica e solubilidade Salting in: solubilidade baixa concentração salina – aumenta a Concentrações < 1 Íons estabilizam a proteína aumentando a hidratação proteica, ligando-se fracamente a proteínas Diminui a atração eletrostática entre as proteínas Abre-se a rede protéica que estará em maior contato com a água Força iônica e solubilidade Salting in: solubilidade baixa concentração salina – aumenta a Concentrações < 1 Íons estabilizam a proteína aumentando a hidratação proteica, ligando-se fracamente a proteínas Diminui a atração eletrostática entre as proteínas Abre-se a rede protéica que estará em maior contato com a água Saltin-out: alta concentração salina –diminui a solubilidade Concentrações > 1M concorrência entre os íons e as proteínas para captar água diminui as interações água-proteína Temperatura Solubilidade aumenta com temperatura 0 e 400C Temperatura Aumento de temperatura acima de 400C Diminui a capacidade de ligar água Ruptura das pontes de hidrogênio Desnaturação seguida de agregação (redução da superfície da proteína exposta a água) Solventes Orgânicos e Solubilidade Adição de solventes orgânicos (etanol e acetona)redução da constante dielétrica do meio Forças eletrostáticas de atração aumentam Intramolecular (dentro da molécula) – desdobramento da molécula proteica Intermolecular (entre as moléculas) – ligação entre grupos de carga oposta AGREGAÇÃO PRECIPITAÇÃO DAS PROTEÍNAS Solventes Orgânicos e Solubilidade Adição de solventes orgânicos Competem pelas moléculas de água reduzindo a solubilidade das proteínas Redução da solubilidade é explicada por dois fatores: # redução da constante dielétrica do meio # redução da hidratação das moléculas proteicas b) Propriedades Interfaciais das Proteínas Incluem-se neste item a capacidade de formação de espumas, as emulsões e todos os fenômenos relacionados com a tensão superficial. Propriedades Interfaciais das Proteínas Alimentos – produtos de tipo emulsão (sistemas dispersos instáveis) Necessário Substância anfifílicas entre as duas fases (estabilidade) Proteínas – moléculas anfifílicas, migram espontaneamente para uma interface ar-água ou interface óleo-água SURFACTANTES tensão interfacial) (redução da b) Propriedades Interfaciais das Proteínas PROTEÍNAS COMO SURFACTANTES Formam uma película altamente viscoelástica, em uma interface, a qual tem a capacidade de suportar choques mecânicos durante a estocagem e a manipulação. - As espumas e as emulsões estabilizadas por proteínas são mais estáveis do que as preparadas com surfactantes de baixo peso molecular e, por causa disso, as proteínas são muito usadas para esses fins. b) Propriedades Interfaciais das Proteínas A migração espontânea das proteínas a partir do volume total de líquido para uma interface indica que a energia livre das proteínas é menor na interface que na fase aquosa total. Dessa, forma quando o equilíbrio é estabelecido, a concentração da proteína na região interfacial é sempre maior do que a encontrada na fase aquosa. Figura 1: Diferença entre o modo de adsorção de um surfactante de baixo peso molecular e o de uma proteína, nas interfaces ar-água e óleo-água. Propriedades Interfaciais das Proteínas Atributos que as proteínas com propriedades surfactantes devem ter: 1) Capacidade de adsorver rapidamente à interface 2) Capacidade de desdobrar-se com rapidez e orientar-se em uma interface 3) Uma vez na interface, a capacidade de interagir com moléculas vizinhas e formar uma forte película coesiva e viscoelástica que pode suportar movimentos térmicos e mecânicos Propriedades Emulsificantes Dispersões são sistemas partículas em líquido contínuo. discretos de Emulsão quanto as partículas são líquidas tem-se uma emulsão Tipos de emulsão óleo em água (o/w) água em óleo (w/o) * Maioria das emulsões alimentícias é do tipo óleo em água (leite) Propriedades Espumante Dispersões são sistemas partículas em líquido contínuo. discretos de Espuma quanto as partículas são gasosa tem-se uma espuma Exemplos: Espuma da cerveja – solução que contém bolhas de gás sorvetes bolos merengues Emulsões e espumas “São sistemas de duas fases imiscíveis entre si e instáveis, a menos que haja substâncias anfifílicas na interface que diminuem a tensão interfacial e evitem a coalescência das gotas dispersas” Coalescência: desestabilização da emulsão , união das gotas dispersas Exemplo de alimentos: leite, maionese, salsichas,sorvetes etc. a manteiga, Propriedades espumantes As espumas alimentícias são dispersões de gotas de gás (ar ou CO2) em fase contínua líquida ou semi-sólida. exemplos: merengue, nata batida e pão Proteínas ajudam na formação e estabilização da fase gasosa dispersa, formando a barreira protetora elástica entre as bolhas de gás capturadas . Distribuição uniforme e tamanho reduzido das bolhas de gás produzem um alimento suave e leve e com maior intensidade de aroma Propriedades Emulsificantes e Espumantes As proteínas possuem a estabilizar emulsões e espumas. propriedade de Fatores: pH força iônica temperatura presença de surfactantes de baixo peso molecular açúcares volume da fase óleo tipo de proteína tipo de equipamento taxa de cisalhamento Propriedades Emulsificantes e Espumantes pH pH isoelétrico: falta de carga líquida, falta de interações repulsivas promove interações favoráveis de proteínaproteína ajudam a maximizar a carga da proteína na interface Formação de uma película altamente viscoelástica (interações proteína-proteína) contribuindo para estabilidade de emulsão Propriedades Emulsificantes e Espumantes força iônica Temperatura tipo de equipamento taxa de cisalhamento DESNATURAÇÃO Desnaturação parcial das proteínas antes da emulsificação, a qual resulta em insolubilização, costuma melhorar suas propriedades emulsificantes. AUMENTO DA FLEXIBILIDADE MOLECULAR E DA HIDROFOBICIDADE DE SUPERFÍCIE. Propriedades Emulsificantes Surfactantes de baixo peso molecular - difundem-se com rapidez na interface - inibem a adsorção das proteínas em concentrações elevadas Ex. fosfolipídeos (geralmente encontrados em alimentos) - competem com as proteínas pela adsorção na superfície óleo-água Se um surfactante de baixo peso molecular for adicionado a uma emulsão estabilizada por proteína, eles poderão deslocá-la da interface, causando instabilidade na emulsão. Propriedades Emulsificantes e Espumantes Açúcares Adição de sacarose, lactose e outros açúcares a soluções proteicas. Aumenta a estabilidade da espuma – aumento da viscosidade, o que reduz a mobilidade Propriedades Emulsificantes e Espumantes Açucares Diminuição da capacidade de formação de espuma - * aumento da estabilidade da estrutura proteica nas soluções de açúcar; menor capacidade de desdobrar quando da adsorção na interface Redução da capacidade da proteína de reduzir a tensão interfacial, produzir grandes áreas interfaciais e um grande volume de espuma durante o batimento Exemplo: Em produtos de sobremesa do tipo espuma, que contêm açúcar, como merengues, suflês e bolos, é preferível que acrescente o açúcar depois do batimento, quando possível. Isso permitirá a adsorção da proteína e seu desdobramento, formando uma película estável, então, o açúcar acrescentado aumentará a estabilidade da espuma, elevando a viscosidade do fluido. Propriedades Espumantes Lipídeos Presentes em concentrações > 0,5% - Diminuem as propriedades proteínas de estabilizar a espuma das - Adsorvem rapidamente na interface arágua, inibindo a adsorção das proteínas durante a formação de espuma Exemplos: Os isolados proteicos de soja livre de lipídeos, bem como as proteínas da soja e as proteínas do ovo sem gema, mostram melhores propriedades de formação de espuma do que as preparações contaminadas por lipídeos Propriedades Espumantes Concentração proteica Quanto maior a concentração de proteína, mais firme será a espuma * Firmeza deve-se do pequeno tamanho da bolha e da alta viscosidade Estabilidade da espuma- aumenta conforme a concentração de proteína * Aumento da viscosidade Propriedades Espumantes Batimento - Velocidade moderada: espumas com bolhas de tamanho pequeno, pois a ação de cisalhamento resulta em desnaturação parcial da proteína antes que ocorra a adsorção - Velocidade alta, alta taxa de cisalhamento diminui o poder de formação de espuma por causa de desnaturação extensa, agregação e precipitação das proteínas Fixação de aroma As proteínas em si são inodoras. Podem-se ligar a compostos de aroma e, dessa forma, afetar as propriedades sensoriais dos alimentos. Aspectos indesejável Ex. Sementes oleaginosas Odores indesejáveis (off- flavors) – resultado de aldeídos, cetonas e alcoois gerados pela oxidação de ácidos graxos insaturados. Esses compostos ligam-se às proteínas e produzem odores indesejáveis característicos. Fixação de aroma Aspectos desejável Carregadores alimentos. ou modificadores de aroma em Ex. Produtos análogos da carne que contêm proteínas vegetais A imitação bem-sucedida de um aroma semelhante à carne é essencial para sua aceitação. Fixação de aroma Proteína funcione como bom carregador de aroma: - ligar-se estreitamente aos aromas - retê-los durante o processamento - liberá-los durante a mastigação do alimento Viscosidade A viscosidade de uma solução se relaciona a sua resistência ao fluxo quando uma força é aplicada Relacionada com o diâmetro aparente das moléculas dispersas (orientação do seu eixo na direção do fluxo) Fatores que afetam a viscosidade: - interação das moléculas (inchamento das moléculas) - interações proteína-proteína tamanho dos agregados) pH Temperatura Concentração protéica e salina proteína-água (influem no Gelificação Consiste na formação de uma rede protéica ordenada a partir de proteínas previamente desnaturadas, capaz de aprisionar água Importante: produtos lácteos, produtos de carne, gelatinas, massa de pão. Influi em outras propriedades funcionais: absorção de água formação e a estabilização de espumas e emulsões “ Para que se forme o gel protéico, é necessário que haja desnaturação e agregação posterior de forma ordenada, em que predominem as interações proteína-proteína” Formação do gel: a) Desnaturação protéica: tratamento térmico, hidrólise enzimática, acidificação ou alcalinização b) Separação das moléculas protéicas: na proteína nativa, os grupos hidrófobos estão voltados para o interior da molécula. durante a separação ficam descobertos , fato que potencializa as interações entre proteínas. c) Interação proteína-proteína d) Agregação posterior