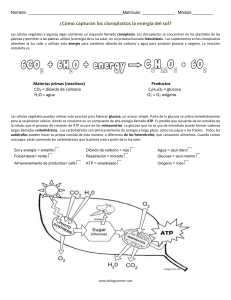
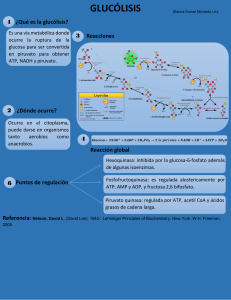
lOMoARcPSD|18474748 Aminoacidos - Primer cuatrimestre de bioquimica Quimica (Universidad Favaloro) Studocu is not sponsored or endorsed by any college or university Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 AMINOACIDOS Las proteínas son polímeros de aminoácidos. Los AA poseen un grupo acido, carboxilo (-COOH) y un grupo básico, amina (-NH2). Los 20 aminoácidos que forman las proteínas son α-aminoácidos. Los aminoácidos se pueden clasificar según su grupo R. Polaridad: tendencia a interaccionar con H2O a pH biológico. Según hidrolisis. Los aminoácidos aromáticos (principalmente, triptófano y tirosina) absorben la luz ultravioleta. AMINOÁCIDOS Nomenclatura: Códigos de tres y una letra. El carbono α está unido a cuatro grupos diferentes (excepto glicina). Es asimétrico o quiral. Quiral es cuando guardan entre si la misma relación entre la mano izquierda y derecha. Luz polarizada: Aquella cuyas vibraciones ocupan solo un plano. Actividad óptica: Ópticamente activa: cuando un haz de luz polarizada atraviesa una solución de un compuesto quieral y el plano de vibración es rotado sobre su eje y desviado a otra posición. Que giran a la derecha son positivos y se llaman Dextrogiros y los que rotan a la izquierda son negativos y se llaman Levogiros. Los dos isómeros ópticos de la sustancia se designan anteponiendo la letra L o D. Ejemplo con Gliceraldehido. Dos ordenamientos espaciales: enantiómeros. Los enantiómeros son imágenes especulares no superponibles. Todos los aminoácidos presentes en las proteínas son de la serie L. Propiedades AA Las propiedades de la cadena de cada aa permiten predecir su comportamiento. Las cadenas laterales permiten agruparlos en polares y apolares. Polares: Glicina, serina, treonina, cisteína, tirosina, ácido aspártico, ácido glutámico, asparragina, glutamina, lisina, histidina y argina. Apolares: Alanina, valina, leucina, isoleucina, metionina, fenilalanina, triptófano y prolina. Propiedad acido base general: Una solución es NEUTRA cuando su concentración de iones hidrogeno es igual a la de iones hidróxido. Cuando en una solución la concentración de iones hidrogeno es mayor que la de iones hidróxido se dice que es ACIDA. BASE O ALCALINA: cuando la concentración de iones hidrogeno es menor que la de iones hidróxido. ACEPTAN PROTONES. ACIDOS: Son sustancias que al ser disueltas en agua o soluciones acuosas producen aumento de concentración de hidrogeniones. SEDEN PROTONES. BASE O ALCALINO: Cuando se disuelven en agua producen concentración de hidrogeniones. La fuerza de una base o un acido se mide según la tendencia de perder y ganar protones. Los ácidos fuertes se ionizan en forma prácticamente total al ser disueltos en agua. Los ácidos débiles solo ionizan una pequeña proporción de sus moléculas. Base fuerte: se disocian completamente en la solución. Y las bases débiles disuelven una pequeña porción de las moléculas. Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 ACIDO BASE EN AA: El grupo carboxilo se comporta como acido (dador de protones) y el grupo amina como base (acepta protones). En soluciones acidas fuertes el aa se convierte en un catión con carga positiva. En solución alcalina el aa queda cargado negativamente. En un pH alcalino el grupo amino se comporta como un acido. La carga eléctrica del aa depende del pH del medio en el cual esta disuelto. Si la concentración de iones de H aumente en le medio, lo iones de COO captan protones, disminuyen progresivamente las formas ionias dipolares y forman cationes. Cuando un aminoácido sin grupo R ionizable se disuelve en agua a pH neutro, se encuentra en solución en forma de ion dipolar o zwitterion, que puede actuar como ácido (dador de H+) o base (aceptor). Las sustancias con esta naturaleza dual (ácido-base) son anfóteras y se las denomina anfolitos La titulación ácido-base implica la adición o eliminación gradual de H+. La carga de los distintos grupos varía de acuerdo al pH. Curvas de titulación. Curva de titulación de la glicina Punto isoeléctrico pH al cual la forma predominante es el zwitterion, sin carga eléctrica neta. Valor de pH, característico de cada AA, en el cual la ionización de cargas positivas y negativas se iguala y por lo tanto la carga de AA es NULA. (pHi o pI). El aa no se desplaza hacia ninguno de los polos. Punto isoeléctrico proteínas: Si en un pH acido se le va agregando álcali de modo que el pH suba progresivamente, los grupos ionizables de la proteína irán liberando iones de hidrogeno. La carga positiva inicial de la proteína se reduce porque los grupos más ácidos (-COOH) ceden sus protones y se hacen electronegativos. Hasta que llega un momento que el número de cargas negativas es el mismo que las positivas. En ese momento la molécula tiene carga total igual a cero. Ejercicio: graficar la curva de titulación de la asparagina Curvas de titulación. Ejemplo ALANINA. Las dos funciones de aa están ionizadas y el pH del medio es el correspondiente al punto isoeléctrico de la Alanina. A partir de este punto se pueden hacer dos curvas por separado, una para el grupo COO que se comporta como base (acepta protones) y la segunda para NaOH. Ver HOJA APARTE. Los aminoácidos con grupos R ionizables tienen curvas de titulación más complejas: tres etapas correspondientes a los tres pasos de ionización posibles. Aminoácidos no estándar. Aminoácidos que forman parte de proteínas. Modificaciones de los aminoácidos estándar. × Hidroxiprolina e hidroxilisina: colágeno. × Metil-lisina: Miosina (músculo). Aminoácidos con otras funciones. × Ornitina y citrulina: ciclo de la urea y biosíntesis arginina. × GABA: neurotransmisor. Union Peptídica: Los AA pueden establecer enlaces covalentes entre el grupo carboxilo de uno y el nitrógeno del grupo amina de otro. Eso es la unión peptídica. Cuando son dos AA se llama dipeptidica y así, y si son muchos es polipeptidica. (Muchos son más de 10) A cada extremo de la cadena polipeptida se llama N- terminal, principio y C- terminal final. Propiedades Acido Base: Los grupos carboxilo y amina interesados en las uniones peptidicas perdieron OH e H por Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 ende no pueden ionizarse. Las propiedades las determina los grupos aminas y carboxilos terminales. Tienen importancia biológica porque están metidos en funciones de hormonas, etc. (abajo) PROTEINAS Son proteínas casi todas las enzimas catalizadoras de reacciones químicas, como las hormonas, reguladores de actividades celulares, hemoglobina, anticuerpos, receptores, colágeno, etc. Reacción de condensación para la formación de una unión covalente entre aminoácidos: unión peptídica. La unión de sucesivos aminoácidos resultará en la síntesis de proteínas. Características de la unión peptídica. No rota: Carácter parcial de doble enlace. Planar: Todos los átomos de la unión se encuentran en el mismo plano. Configuración trans: O del grupo carbonílico e H del N amídico. Polar, sin carga. × Participa en la formación de puentes de H. Propiedades acido – base La carga eléctrica de una proteína depende de la ionización de los grupos ionizables existentes en las cadenas laterales de los restros aa componentes. Carácter básico: Abundantes residuos de lisina, arginina o histidina en la molécula. Carácter positivo: Lisina y arginina aceptan protones. Carácter Acido: Grupo fenolico de tirosina y sulfhidrilo de cisteína. CARACTERISITICA DE BUFFER: También tiene que ver por el grupo de fenolico y sulfhidrilo porque captan o liberan protones según la cantidad de iones de H en el medio. En solución acida los grupos anima libres captan iones H mientras la mayoría de los grupos acidicos están no ionizados. Carga neta positiva. En solución alcalina los grupos amina libres ceden protones, quedan no ionizados y los grupos carboxilo se ionizan. La proteína exhibe una carga total o neta negativa. El tamaño y peso molecular de las proteínas es muy variable. Desde unos pocos aminoácidos, como la insulina (51 aminoácidos y 5.700 daltons), hasta cientos de ellos como la glutamina sintasa (468 aminoácidos y 600.000 daltons de peso molecular). NIVELES DE ORGANIZACIÓN ESTRUCTURAL DE LAS PROTEÍNAS Estructura primaria: Se refiere al número e identidad de los AA que componen la molécula y al ordenamiento o secuencia de esas unidades en la cadena polipeptidica. La unión polipeptica solo permite formar estructuras lineales, por ello las cadenas no presentan ramificaciones. Cada proteína se caracteriza por poseer una composición definida de aa y especialmente por la secuencia según la cual las unidades se ordenan. La secuencia de aa de una proteína es el principal determinante de su conformación, propiedades y características funcionales. Las alteraciones en ese ordenamiento o sustituciones de aa pueden afectar la capacidad funcional de la molécula u hasta tornarla inútil. Las células sintetizan sus proteínas ensamblando aa según instrucciones que están contenida en el ADN que forman el material genético. Estructura secundaria: Disposición espacial regular, repetitiva que adopta la cadena polipeptifica, generalmente mantenida por PUENTE DE HIDROGENO. La disposición espacial que adopta la cadena polipeptidica depende de la orientación de los enlaces entre los átomo C-Nca que se suceden en forma repetitiva constituyendo la columna vertebral de la proteína. El enlace peptídico posee un carácter intermedio entre el de un enlace simple y uno doble, por eso no pueden rotar. (Ver pág. 39 libros) Se refiere a cualquier segmento específico de la cadena polipeptídica y describe la distribución espacial local de los átomos de su cadena principal. Estructuras secundarias estables: × Hélice α, Hoja β, Giros o vueltas Estructuras no repetitivas × Estructura supersecundarias Hélice α. Esqueleto polipeptídico estrechamente enrollado alrededor de una eje imaginario (eje central) dibujado longitudinalmente por el centro de la hélice. Los grupos R sobresalen hacia fuera del esqueleto helicoidal. Cada giro de hélice incluye 3,6 residuos aminoácidos. Se encuentra estabilizada por puentes de hidrógeno entre el átomo de hidrógeno unido al átomo de nitrógeno electronegativo de un enlace peptídico y el átomo de oxígeno carbonílico electronegativo del cuatro aminoácido, que se encuentra del lado aminoterminal con respecto al mismo. Todos los puentes de hidrogeno quedan paralelos a la hélice. Uso óptimo de los puentes de hidrógeno internos: cada uno de los enlaces peptídicos de la hélice α participa Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 en esta trama de puentes de hidrógeno .El número de residuos implicados en una hélice varía de hélice en hélice y de proteína en proteína. En promedio hay 10 aminoácidos por hélice. Hay ciertas restricciones a la formación hélices alfa: × La repulsión electrostática entre aminoácidos cargados. × Muchos grupos con la misma carga se repelerán y tampoco favorecerán la formación de la hélice. × El volumen de los grupos R de aminoácidos adyacentes (ej. Asn, Ser, Thr y Leu tienden a impedir la formación de hélices si están cercanos). × La presencia de residuos de prolina e hidroxiprolina interrumpen la hélice alfa (aportan rigidez a la cadena aminoacídica). Hoja β. El esqueleto de la cadena polipeptídica se encuentra extendido en zig-zag de manera adyacente formando una estructura que semeja una serie de pliegues. Los segmentos individuales que forman una hoja β son normalmente cercanos pero también pueden estar muy distantes. Los grupos R sobresalen en direcciones opuestas de la lámina. También se estabiliza por puentes de hidrogeno entre átomos que forman la unión peptídica, pero más distantes. Las cadenas polipeptídicas adyacentes pueden ser paralelas o antiparalelas. × Paralelas: misma orientación aminocarboxilo. × Antiparalelas: orientación opuesta amino-carboxilo. Giros o vueltas. Conformados por 4 o 5 residuos de aminoácidos, de los cuales uno suele ser Pro. Es una estructura en forma de U. Se estabilizan por uniones puentes de hidrógeno entre el primer y el cuarto residuo. Se encuentran a menudo en la superficie de la proteína. Estructura secundaria: estructuras no repetitivas. Conformaciones espaciales sin una estructura particular, generalmente son enrollamientos y son propias de cada proteína. Estructuras supersecundarias Combinaciones reconocibles de hélices α, láminas β y giros presentes en las proteínas. Están relacionadas a las diferentes funciones que desempeña cada proteína Estructura terciaria. Disposición tridimensional global de todos los átomos de una proteína. Aminoácidos alejados pueden interactuar dentro de la estructura totalmente plegada de la proteína. La estructura terciaria se estabiliza por diversas interacciones débiles (figura). A partir de la estructura terciaria emerge la función de la proteína. Estructura cuaternaria. Sólo en proteínas compuestas por dos o más cadenas polipeptídicas o subunidades. Disposición de dichas subunidades en complejos tridimensionales. Estabilizada por las mismas interacciones que la estructura terciaria. Clasificación según estructura 3D. ESTRUCTURA TERCIARIA. La dispiciosion tridimensional que adopta la molécula se mantiene gracias a uniones e interacciones de las cadenas laterales de residuos de aa del polipéptido. Las estructuras responsables del mantenimiento de las estructuras terciarias son: - FUERZA DE ATRACCION O REPULSION ELECTROSTATICA: Según grupos de carga eléctrica. Si los grupos tienen igual signo, el efecto será de repulsión y alejamiento de los sectores correspondientes. - PUENTES DE HIDROGENO: EL O del carbonilo de un carboxilo libre en restos aspárticos o glutámico etc. Son distintos a lo de las hélices y laminas. - Puentes de disulfuro: El enfrentamiento de los grupos SH de dos residuos cisteína puede determinar, por oxidación, el establecimiento de una unión covalente S-S. - INTERACCIONES DE CADENA LATERALES HIDROFOBICAS: La presencia de restos de AA hidrofóbicos como LEUCINA, ISOLEUCINA, VALINA, METIONINA, FENILALANINA, ETC. Tiene importancia con la conformación de proteínas en sc acuosa. Las apolares suelen alejarse del contacto con el agua y provocan plegamientos que agrupan restos hidrófobos en el interior de la molécula. - PAPEL DE CADENAS LATERALES HIDROFILAS: Los restos de aa con grupos hidrófilos (- COO; NH3, OH) tienden a ubicarse hacia el exterior de la molécula, en contacto con el solvente polar. Cuando la proteína se encuentra en un ambiente de moléculas apolares, como en la doble capa lipídica, las que interactúan son los aa de la cadena hidrófoba. - FUERZAS DE VAN DER WAALS/ FUERZAS DE LONDON: Interacciones eléctricas cuándos dos átomos no unidos entre sí por enlaces covalentes se aproximan a una distancia pequeña, el dipolo de un átomo induce un dipolo opuesto en Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 el otro y ello determina atracción mutua. FIBROSAS: Las cadenas polipeptidicas se ordenan paralelamente formando fibras o laminas extendidas, en las culés el eje longitudinal predomina notoriamente sobre los transversales. Son poco solubles o insolubles y participan en la constitución de estructuras de sostén como el tc, etc. Presentan cadenas polipeptídicas dispuestas en largas cadenas u hojas. Constan mayoritariamente de un único tipo de estructura secundaria que se repite y su estructura terciaria es relativamente simple. Confieren fuerza y/o flexibilidad a las estructuras en las que se encuentran. Dan soporte y forma. Insolubles en agua: elevada concentración de aminoácidos hidrofóbicos. Ejemplo: colágeno. COLAGENO: PROTEINA MAS ABUNDANTE. Componente estructural de gran resistencia mecánica. × Proporciona fuerza. × Tipos variados. × Tejido conjuntivo de cartílagos, tendones, matriz orgánica de huesos y córnea del ojo. × Tres cadenas α polipeptídicas separadas, superenrolladas una alrededor de la otra. INSOLUBLE EN AGUA. La estructura primaria tiene mucho de glicina y prolina por eso no puede doblarse para formar hélices alfa normales. También tiene casi inexistente de triptófano y cisteína. Las fibrillas de colágeno son entramados supramoleculares constituidos por una triple hélice de moléculas de colágeno asociadas en una variedad de formas que proporcionan diferentes grados de fuerza de tensión. Estas fibrillas se forman a partir de moléculas de colágeno alineadas de manera escalonada y entrecruzadas por enlaces covalentes. (Hélices levógira) Casi exclusiva de la proteína. Súper hélice: Tres cadenas polipeptidica así enrolladas, se envuelven a su vez apretadamente sobre un eje central. Unidas por puente de hidrógenos. Pág. 50 está la estructura completa. La resistencia es muy grande. Con el tiempo se vuelven más rígidas y más débiles. Existen 14 tipos de colágenos, los más comunes son tipo I, II Y III. TIPO I: en piel, tendones, huevos y dentina. TIPO II: cartílago y humor vítreo. TIPO III: Piel, musculo y vasos sanguíneos. Colagenopatías Se han descripto varios defectos genéticos que llevan a que las fibras de colágeno no se formen correctamente y por lo tanto los tejidos afectados pierden su capacidad de tensión. Síndrome de Ehlers-Danlos: Grupo heterogéneo de enfermedades hereditarias del tejido conectivo. Caracterizadas por hiperlaxitud articular, hiperextensibilidad de la piel y fragilidad de los tejidos. Es la base de la enorme movilidad de los “hombres de goma” y de los contorsionistas. Osteogénesis imperfecta: Enfermedad conocida como huesos de cristal. Defecto genético que provoca una mala formación o una cantidad deficiente de colágeno óseo. GLOBULARES: Son aquellas en las cuales la molécula se pliega sobre sí misma para formar un conjunto compacto semejante a un esferoide u ovoide con sus tres ejes de similar longitud. Pueden existir porciones de la cadena que adoptan estructuras en hélice alfa o en lámina beta, son segmentos dispuestos al azar entre las zonas estructuradas para permitir las acodaduras y plegamientos indispensables a fin de alcanzar conformación esferoidal. En general las proteínas de gran actividad funcional como las enzimas, hormonas, HEMOGLOBINA, son globulares. Son solubles en medios acuosos. Presentan cadenas polipeptídicas plegadas en formas esféricas compactas. Contienen varios tipos de estructura secundaria. Su función dentro de la célula es móvil y dinámica. Las enzimas y proteínas reguladoras, motoras, de transporte son globulares. Son solubles en sistemas acuosos. Ejemplo: mioglobina y hemoglobina. Globinas e intercambio gaseoso. Una etapa del intercambio gaseoso se produce en los pulmones e involucra la incorporación de oxígeno (O2) al organismo y la eliminación del dióxido de carbono (CO2) producido por el metabolismo celular. Otra etapa del intercambio gaseoso se produce en los tejidos e involucra la incorporación de oxígeno (O2) a los tejidos y la eliminación de dióxido de carbono (CO2) producido en los mismos. Los gases son transportados por la sangre. Baja solubilidad del O2 en soluciones acuosas. Proteínas transportadoras: HEMOGLOBINA Y MIOGLOBINA: GRUPO HEMO. Mioglobina o Presente en corazón y músculo esquelético. O Presenta un 80% de hélice α. o Interior no polar. O Único Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 sitio de unión para O2: grupo hemo. Mioglobina: función. La curva de saturación de la mioglobina está muy relacionada con su función de almacenamiento. Baja sensibilidad a cambios en [O2] Su función principal es la de almacenar O2. Esta reserva es importante para asegurar un aporte adecuado de O2 cuando el consumo del mismo se incrementa frente a una demanda energética elevada, de esta manera la mioglobina funciona como un transportador intracelular de O2. Hemoglobina o Presente en eritrocitos. Compuesta por cuatro cadenas polipeptídicas, dos α y dos β. o Transporta O2 desde los pulmones hacia los tejidos. O Cuatro sitios de unión para O2: un grupo hemo por cada globina. O Puede unir CO2 Hemoglobina: función. Es una proteína transportadora de O2 y en menor medida de CO2. La curva de saturación de la hemoglobina está relacionada con su función de transporte. Hemoglobina: efectores alostéricos. PROTEÍNAS ALOSTÉRICAS Cambian su conformación al unirse una molécula moduladora y cambia su afinidad por otro ligando en un sitio distinto de la molécula. Alosterismo homotrópico Modulador = Ligando Alosterismo heterotrópico Modulador ≠ Ligando Positivo o Negativo Hemoglobina: efectores alostéricos. COOPERATIVIDAD Desoxihemoglobina Forma tensa Baja afinidad por O2 Oxihemoglobina Forma relajada Alta afinidad por O2 Hemoglobina: efectores alostéricos. La hemoglobina es más sensible a pequeños cambios en la pO2 entre los tejidos y los pulmones. Une O2 en los pulmones (alta pO2) y lo libera en los tejidos (baja pO2). COOPERATIVIDAD La curva de la hemoglobina es sigmoidea como consecuencia de la cooperatividad. Hemoglobina: efectores alostéricos. EFECTO BOHR La liberación del O2 de la hemoglobina aumenta cuando el pH disminuye o aumenta la presión parcial de CO2 El CO2 también disminuye la afinidad de la hemoglobina por el O2 al unirse a sus grupos NH2 terminales y estabilizarla Hemoglobina: efectores alostéricos. BIFOSFOGLICERATO (BPG) Disminuye la afinidad por el O2 al unirse a la desoxihemoglobina (un BPG por molécula de Hb). Se encuentra en alta concentración en los eritrocitos y participa en la adaptación a la altura y en las situaciones de hipoxia. Homo o heterotrópico? Negativo o positivo? Hemoglobina: efectores alostéricos. BIFOSFOGLICERATO (BPG) Disminuye la afinidad por el O2 al unirse a la desoxihemoglobina (un BPG por molécula de Hb). Se encuentra en alta concentración en los eritrocitos y participa en la adaptación a la altura y en las situaciones de hipoxia. Homo o heterotrópico? Negativo o positivo? Hemoglobina: efectores alostéricos. MONÓXIDO DE CARBONO (CO) Se une al grupo hemo y favorece la asociación del O2 a la hemoglobina. Esto provoca que la curva de disociación sea hiperbólica y no se pueda liberar el O2 en los tejidos. Hemoglobinopatías: Patologías que se desarrollan como consecuencia de alteraciones en la estructura o producción de hemoglobina. Producción anormal de globinas α o β talasemia, de acuerdo al tipo de globina cuya producción se ve reducida o anulada. Producción de hemoglobina anormal. Anemia falciforme (HbS): Sustitución del aminoácido en posición 6 (Glu por Val) en la globina β. Anemia hemolítica crónica (HbC): Sustitución del aminoácido en posición 6 (Glu por Lys) en la cadena de globina b Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 ENZIMAS Para que las reacciones transcurran en un tiempo acorde a las necesidades del organismo es necesaria la presencia en el sistema de elementos que favorezcan que esa reacción ocurra. CATALIZADORES: Los catalizadores AUMENTAN la velocidad pero no modifican el equilibrio químico. Son sustancias que estando presentes en el medio, aumentan la velocidad de la reacción y se recuperan sin alteraciones al final del proceso. Aceleran las reacciones espontáneas. Se recuperan intactos al finalizar la reacción. No se los considera reactivos de la reacción. Modifican de igual manera al sustrato y al producto de una reacción reversible. Las ENZIMAS son catalizadores biológicos: Son proteínas con capacidad catalítica que actúan por activación de los sustratos. Son efectivas en cantidades pequeñas. No sufren modificaciones una vez que finalizó la reacción. No afectan la posición del equilibrio químico de la reacción que catalizan. Presentan alta especificidad en relación a la naturaleza de la reacción que catalizan y del sustrato que utilizan. Generalmente son termolábiles. Pueden estar reguladas. Cofactor: Algunas enzimas no requieren para su actividad más grupos químicos que sus residuos aa., Otros requieren un componente químico adiciona, que sería el COFACTOR. El cofactor puede ser uno o varios iones inorgánicos como Fe, Mg, Mn o Zn o una molécula organiza o metaloorganiza completa denominada COENZIMA. Las coenzimas actúan como trasportadores transitorios de grupos funcionales específicos. La mayoría son vitaminas, nutrientes orgánicos que son necesarios en pequeñas cantidades en la dieta. Un coenzima o ion metabólico unido covalentemente o de manera muy fuerte a la proteína enzimática se denomina grupo prostético. Un enzima completo y catalíticamente activo junto con su coenzima y/o iones metabólicos se denomina HOLOENZIMA. La parte proteica de la enzima se denomina APOENZIMA O APOPROTEINA. La enzimas se pueden clasifican según la reacción catalizada. ASA= CATALIZADORES ej.: ireasa cataliza la hidrolisis de la urea. Después hay otros nombres que varían según función, ej.: peptina viene de pepsis digestión. Todas las enzimas son proteínas (menos un grupo de moléculas de RNA catalítico). La función catalizadora depende de la conformación de proteínas. Sitio Activo. Sustrato: molécula fijada en el sitio activo y sobre la que actúa la enzima. La superficie del sitio activo del enzima esta revestida con residuos aa con grupos sustituyentes ue se unen al sustrato y catalizan su transformación química. Sitio Activo: Es una zona de la enzima que está directamente involucrada en la acción enzimática. Es una porción relativamente pequeña de la enzima. Tiene una estructura tridimensional en forma de hoyo o hendidura. La especificidad está dada por una disposición especial y espacial de determinados átomos que están presentes en ciertos aminoácidos que conforman la enzima. En el sitio activo se puede reconocer el sitio de unión o reconocimiento y el sitio catalítico. Modelos de interacción enzima-sustrato -Modelo de interacción llave-cerradura (Lock and Key) Propuesto por Emil Fischer en 1890, establece que el sitio activo y el sustrato tienen estructuras complementarias. La forma y la distribución de cargas del sustrato le permiten "entrar" e interaccionar con el sitio activo de la enzima. Ambos encajarían perfectamente uno en otro -Modelo de interacción ajuste inducido (Induced-fit) Propuesto por Daniel Koshland en 1958. Las interacciones nocovalentes entre sustrato y enzima alteran la estructura tridimensional del sitio activo haciendo que éste se adapte al sustrato. Especificidad: Las enzimas son altamente específicas pues actúan con un solo sustrato específico y catalizan un solo tipo de reacción química. Solo algunas enzimas van a tener más de un sustrato, pero van a catalizar la misma reacción (primera enzima de la glucolisis) Localización: Cada enzima particular está localizada en un compartimiento celular específico. Permite aislar sustratos o productos que pueden competir por determinadas enzimas. Organiza espacialmente diferentes enzimas que participan en vías metabólicas para hacer al sistema más eficiente. Cada enzima tiene una localización particular dentro de la célula (citoplasma, mitocondria, núcleo) y esa localización está asociada a su función) Eficiencia catalítica: Es la capacidad de transformar en forma eficiente el sustrato en producto. En general las enzimas convierten entre 100 y 1000 moléculas de sustrato en producto por segundo. A este parámetro se lo llama número Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 de recambio. Factores que afectan actividad de las enzimas Las enzimas poseen un rango de pH en el cual la velocidad de catálisis es máxima. La disminución de la velocidad fuera de ese pH óptimo es atribuible al cambio en el estado de ionización de las cadenas laterales de los aminoácidos que forman parte del sitio activo. Temperatura: Las enzimas poseen una temperatura óptima a la cual la velocidad de catálisis es m máxima. Esta temperatura es particular de cada enzima. Temperaturas por encima de los 60°C llevan a la desnaturalización de la proteína, temperaturas por debajo de los 10°C dificultan los movimientos de las moléculas. Las ENZIMAS son catalizadores biológicos: * Son efectivas en cantidades pequeñas. * No sufren modificaciones una vez que finalizó la reacción. * No afectan la posición del equilibrio químico de la reacción que catalizan. * Solo aceleran las reacciones termodinámicamente favorables es decir con ΔG negativo * Presentan alta especificidad en relación a la naturaleza de la reacción que catalizan y del sustrato que utilizan. Las enzimas aceleran las reacciones disminuyendo la energía de activación, lo que se traduce en un incremento en la velocidad de la reacción. La energía requerida para disminuir la energía de activación proviene generalmente de la suma de interacciones débiles no covalentes entre la enzima y su sustrato (ES). Esta energía dada por la interacción de enzima y sustrato se denomina energía de fijación y es utilizada tanto para disminuir la energía de activación como para dar especificidad a la reacción. La enzima debe aportar grupos funcionales para que puedan interaccionar por puentes de H, interacciones electrostáticas, hidrofóbicas con el sustrato. Cinética Enzimática: (ver pág. 216 -186- del libro) Estudia la velocidad de las enzimas. También pág. 227 Siempre se mide la velocidad inicial o Vo donde se conoce exactamente la concentración de sustrato, la [S] >>> [E] por lo que se considera [S] constante y no se da la reacción inversa de P a S. La ecuación de Michaelis-Menten describe el comportamiento cinético de la mayoría de las enzimas. Velocidad máxima: se relaciona con el Número de recambio que se define como el número de moléculas sustrato convertidas en producto por unidad de tiempo cuando la enzima está totalmente saturada. Km: se define como la concentración de sustrato a la cual la velocidad de la reacción es numéricamente igual a la mitad de la velocidad máxima de reacción. Depende del sustrato, del pH, de la temperatura, de la fuerza iónica. Se relaciona con la constante de velocidad de las etapas catalíticas por lo tanto, permite inferir la estabilidad del complejo ES. Se relaciona en forma inversa con la afinidad. Unidades de Velocidad: Unidades Internacionales (UI): cantidad de enzima que transforma 1µmol de sustrato por minuto en condiciones óptimas de pH y temperatura. Katal: cantidad de enzima que convierte un mol de sustrato por segundo en condiciones óptimas de pH y temperatura Actividad específica (UI/mg Pr): cantidad de enzima presente en una preparación en relación a la cantidad de proteínas totales presentes en la misma. Inhibidores enzimáticos: Los inhibidores enzimáticos son sustancias que disminuyen la velocidad de catálisis de una enzima. Inhibición irreversible: el inhibidor se une en forma covalente a la enzima, ya sea en el sitio activo o en otro lugar y la modifica por lo tanto impide su funcionamiento. Inhibición Reversible: la molécula de inhibidor interactúa con la enzima a través de uniones reversibles. Inhibidor Competitivo: la molécula de inhibidor presenta estructura química semejante al sustrato, se une a la enzima en el sitio de unión pero no puede ser transformado en producto. Inhibidor No Competitivo: la molécula de inhibidor presenta estructura química totalmente diferente al sustrato, se une a la enzima en un sitio diferente al sitio activo y modifican la estructura tridimensional de la enzima. La enzima se inactiva en presencia del inhibidor. Cuadrito. Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 Enzimas alostéricas Las enzimas alostéricas son enzimas reguladoras cuya actividad catalítica es modulada por la unión no covalente de una sustancia específica a un sitio de la proteína diferente del sitio activo. *Compuestas por más de una cadena polipeptídica. Presentan sitios alostéricos diferentes al sitio activo, generalmente ubicados en distintas subunidades. Pueden estar sujetas a control positivo o negativo ejercido por uno o más factores. Presentan curvas cinéticas de tipo sigmoidea. Se encuentran en los primeros pasos o en los puntos de ramificación de las vías metabólicas. REGULACION DE LA ACTIVIDAD ENZIMATICA La actividad enzimática puede ser regulada, es decir, las enzimas pueden ser activadas o inhibidas de manera tal que la formación de productos del metabolismo puedan satisfacer las necesidades de la célula. 1. Disponibilidad de sustrato: La actividad de la enzima varía de acuerdo a la cantidad de sustrato disponible. A mayor disponibilidad de sustrato mayor actividad y viceversa. 2. Modificación covalente: La actividad de la enzima varía por el agregado o remoción de grupos unidos covalentemente a la enzima. Se requiere de la participación de dos enzimas, una que agrega el grupo funcional y otra que lo remueva. Enzimas moduladas covalentemente Presentan formas activas e inactivas que se obtienen por interconversión reversible. En las interconversiones actúan otras enzimas que adicionan y remueven grupos funcionales. Los grupos funcionales pueden ser: * Fosforilos * Metilos * Acetilos * Uridilos * Adenilos * Adenosina difosfato ribosilos 3. Modulación alostérica: La actividad de la enzima varía por la presencia de ciertos productos. Mecanismos de regulación del metabolismo por retroalimentación negativa por producto final y positivo por sustrato. 4. Inducción o represión de la síntesis de la enzima: Control de la síntesis de las enzimas. Una mayor síntesis de enzima se traduce en una mayor actividad enzimática. Mecanismo más lento que los anteriores. Isoenzimas: Son formas moleculares diferentes de una misma enzima. Estas tienen secuencias de aminoácidos similares, pero no idénticas. Todas catalizan la misma reacción bioquímica y tienen: * Distintas propiedades cinéticas: diferentes Km y Vmax * Diferentes propiedades reguladoras (diferentes efectores) * Diferentes preferencias por coenzimas * Diferente distribución celular La presencia de isoenzimas permite regular determinados procesos metabólicos. Ruptura proteolítica Las proenzimas o cimógenos son precursores enzimáticos inactivos. Estos pueden producirse y almacenarse y luego convertirse, en forma irreversible, en la enzima activa. El proceso implica la ruptura de uno o más enlaces péptidos, lo que elimina al péptido bloqueador y libera a la enzima activa. Cofactores: Muchas enzimas necesitan la presencia de moléculas no proteicas para poder efectuar la catálisis. Enzimas: Activadores: moléculas inorgánicas, cationes o aniones. Ejemplos: Na+; Mg2+; Ca2+; Mn2+; Fe2+; PO3 3-; SO4 2-; Cl Coenzimas: moléculas no proteicas débilmente unidas a la enzima, asociación y disociación reversible Ejemplos: NAD+/NADH; NADP+/NADPH Grupos prostéticos: moléculas no proteicas fuertemente unidas a la enzima Enzima + Grupo prosterico Holoenzima -> Activa Enzima – Grupo prosterico Apoenzima -> Inactiva Ej.: biotina, flavinas (FMN, FAD), GRUPO HEMO Resumen: -Las enzimas son catalizadores muy fuertes. - Las reacciones catalizadas por enzimas se caracterizan por la formación de un complejo entre el sustrato y la enzima. La fijación del sustrato se produce en una bolsa del enzima llamada SITIO ACTIVO. - La función de las enzimas y de otros catalizadores consiste en hacer disminuir la energía de activación (AG) de una reacción para incrementar su velocidad de reacción. El equilibrio de una reacción no se ve afectado por la enzima. - Una parte significativa de la energía utilizada para el incremento de la velocidad de las reacciones enzimáticas Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 proviene de las interacciones débiles (enlaces de hidrogeno, interacciones hidrofóbicas e interacciones iónicas) entre enzima y sustrato. El sitio activo de la enzima tiene una estructura tal que hace que algunas de estas interacciones débiles tengan lugar de modo preferente en el estado de transición de la reacción, con lo que lo estabilizan. El tamaño de la enzima tiene relación con la necesidad de que existan múltiples reacciones. La energía de fijación (AGb) puede utilizarse para disminuir la entropía de sustrato o para producir un cambio de conformación en la enzima (encaje inducido). La energía de fijación es también la responsable de la exquisita especifidad de los enzimas por sus sustratos. - Catálisis acido – base general, la catálisis covalente y la catálisis por iones metálicos. VITAMINAS Las vitaminas son sustancias orgánicas de naturaleza química muy variada que son esenciales en determinados procesos metabólicos. • Las vitaminas no se sintetizan en el organismo, por lo tanto deben ser aportadas con la dieta. • Las vitaminas actúan en concentraciones muy pequeñas. Vitaminas solubles en agua: Vitamina C (Acido ascórbico): Cítricos, papas, tomates, vegetales verdes Verdes La Vitamina C tiene funciones antioxidantes. Secuestra radicales libres. Participa en el mecanismo de hidroxilación de Prolina del colágeno y favorece el transporte de Fe del plasma a los depósitos celulares. Patología: La deficiencia de Vitamina C provoca una enfermedad denominada escorbuto, se presenta con fatiga muscular, osteoporosis, caída de dientes, fragilidad vascular, anemia. Todos estos síntomas se asocian a defectos en la síntesis de colágeno Vitaminas del Complejo B: Liberadoras de energía Tiamina (Vitamina B1): granos enteros, legumbres, cerdo. La Tiamina o Vitamina B1 participa en reacciones involucradas en la liberación de energía. Patologías: La deficiencia de Tiamina o Vitamina B1 provoca una enfermedad denominada beri-beri, se presenta con piel seca, irritabilidad, desorden mental y parálisis progresiva. Síndrome de Vernicke-Korsakoff: está asociado al alcoholismo, hay apatía y pérdida de la memoria. Riboflavina (Vitamina B2): leche, huevos, hígado, vegetales de hojas verdes. La Riboflavina o Vitamina B2 participa en reacciones involucradas en la transferencia de electrones o hidrogeniones. Patología: La deficiencia de Riboflavina o Vitamina B2 es muy rara, en general se asocia al alcoholismo, se observa glositis, seborrea, fotofobia, dermatitis. Niacina (Vitamina B3): cereales, leche, carnes. La Niacina o Vitamina B3 participa en reacciones involucradas en la transferencia de electrones o hidrogeniones Patologías: La deficiencia de Niacina o Vitamina B3 provoca una enfermedad denominada pelagra, se presenta con un cuadro de dermatitis, diarrea y demencia. Si no se trata conduce a la muerte. Biotina (Vitamina B7): está ampliamente distribuida, la sintetizan las bacterias intestinales La Biotina participa en reacciones en las que está involucrada la transferencia de grupos carboxilos. Patología: La deficiencia de Biotina es muy rara. Ácido pantoténico (Vitamina B5): granos de cereal, legumbres, carnes El ácido pantoténico como parte de la coenzima A participa en la transferencia de grupos acetilo en el metabolismo de ácidos grasos, en el ciclo de Krebs, también participa en el complejo de la ácido graso sintetasa. Participa en la transferencia de grupos acilo (unidades de dos carbonos). Patología: La deficiencia de ácido pantoténico es muy rara. Vitaminas del Complejo B Hematopoyéticas Ácido Fólico (Vitamina B9): Vegetales de hoja, hígado, cereales El ácido fólico participa en reacciones de activación y transferencia de unidades de un carbono de un compuesto a otro. Las reacciones enzimáticas en las que participan pertenecen al metabolismo de aminoácidos y de purinas. Patologías: La deficiencia de ácido fólico es particularmente importante en el embarazo pues puede ocasionar defectos en el desarrollo del tubo neural dando lugar a la manifestación de Espina Bífida. Se asocia a la anemia megaloblástica. Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 Vitamina B12: hígado, leche, huevos, pollo, sintetizada por bacterias intestinales. La Vitamina B12 participa en reacciones de transferencia de grupos metilos y en reacciones de isomerización Patología: La deficiencia de Vitamina B12 trae como consecuencia la aparición de Anemia Perniciosa, esta patología se produce por una deficiencia en la producción de Factor Intrínseco que ocasiona la mala absorción de Vitamina B12. Se pueden observar también alteraciones en el sistema nervioso central. OTRAS: Piridoxina Piridoxal Piridoxamina (Vitamina B6): cereales, carnes, hígado La Vitamina B6 participa en reacciones involucradas en la síntesis, degradación e interconversión de aminoácidos. Patología: La deficiencia de Vitamina B6 es muy rara. Vitaminas solubles en lípidos Vitamina A (β-caroteno, retinol): hígado, riñón, derivados lácteos, vegetales amarillos y verde oscuro La Vitamina A es precursor del ácido retinoico. El ácido retinoico actúa en el núcleo de la célula favoreciendo la transcripción de genes específicos. Patologías: Las alteraciones que produce la falta de vitamina A se asocian con epitelios, órganos reproductivos, cartílagos, además se produce ceguera nocturna. Vitamina E (tocoferoles): aceites vegetales La Vitamina E tiene funciones antioxidantes. Evita la peroxidación de los ácidos grasos insaturados presentes en las membranas celulares. Patología: La deficiencia de Vitamina E es rara, generalmente están asociadas a problemas en la absorción intestinal. El síntoma que se observa es fragilidad de los glóbulos rojos. Vitamina K (filoquinonas, menoquinonas): coliflor, repollo, espinaca, huevos, hígado, síntesis por bacterias intestinales La Vitamina K participa en el proceso de coagulación sanguínea. La Vitamina K es necesaria para la síntesis hepática de los factores de coagulación II (protrombina); VII (proconvertina); IX (componente de tromboplastina del plasma); X (StuartPrower). Estos factores se sintetizan como precursores inactivos y luego mediante la participación de la Vitamina K, bicarbonato y oxígeno se activan. Patología: La deficiencia de Vitamina K en los adultos puede ocurrir luego de un tratamiento prolongado con antibióticos. En los recién nacidos se aplica una dosis profiláctica para prevenir hemorragias. Vitamina D (colecalciferol): hígado, huevos, pescados grasos La Vitamina D actúa en el núcleo de la célula favoreciendo la transcripción de genes específicos. Participa junto con la calcitonina y la paratohormona en el control de la absorción, transporte y deposición de calcio y en menor medida de fósforo. Patología: El déficit de Vitamina D en los niños causa raquitismo y en los adultos osteomalacia. IMPRESO. Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 CICLO DE KREBS pag 645 pdf Ciclo de Krebs = Ciclo cítrico. En la mitocondria Ruta metabólica cilica que oxida completamente el Acetil Coa liberando energía en forma de GTP, NADH Y FADH2. Acetil CoA -> Molécula resultante del CATABOLISMO de las grasas, proteínas, glúcidos (por el piruvato) Acetil CoA -> ciclo de krebs -> NADH, FADH2 -> Cadena respiratoria (en la membrana interna de la mitocondria) El Ciclo de Krebs también tiene como resultado precursores metabólicos para otras cosas imporantes. El piruvato formado en la glucolisis en vez de ser reducido a lactato, etanol o algún otro producto de fermentación, sufre una oxidación mayor hasta H2O Y CO2. Esta fase aeróbica del catabolismo se denomina RESPIRACION CELULAR -> Las células consumen 02 y producen CO2. La respiración celular tiene lugar en tres fases principales. En la primera, las moléculas de combustible organico (glucosa, acidos grasos y algunos aa) se oxidan para dar lugar a fragmentos de dos atomos de C en forma de grupo acetil- coenzima A (acetil-coA). En la segunda fase, los grupos acetilo se incorporan al ciclo del acido cítrico, donde son oxidados enzimáticamente hasta CO2. La energía liberada en esta oxidación se conserva en los transporatodres de electones reducidos NADG Y FADH2. En la tercera esotos coenziams reducidos son a su vez oxidados, liberando protones (H+) y electrones. Los electrones son transferidos a lo largo de una cedena de moléculas transporatadoras (conocida como cadena respiratoria) al O2 el aceptador final. Durante este proceso de transferencia se libre ATP. 1. Producción de ACETIL-COA AA, glucosa y otros azucares y los acidos grasos se oxidan finalmente a CO2 Y H2O a través del ciclo del acido cítrico y la cadena respiratoria. Antes de entrar en el ciclo los esqueletos ccarbonados deben de ser degradados al grupo acetilo del acetil- CoA. Entran al ciclo por otras vías de degradación. Complejo de la Piruvato Deshidrogenada, esta localizado en las mitrocondrias y en el citosol. Ayuda a oxidar el piruvato para ser Acetil- Coa y entrar al ciclo de krebs. El complejo PDH es el prototipo de otros dos importantes complejos encimaticos. La alfacetoglutarato deshidrogenasa y la alfacetoacido de las rutas oxidativas de los aa. El piruvato se oxida a Acetil-CoA: Es un proceso de oxidación IRREVERSIBLE. Pierde un grupo carboxilo y los dos carbonos. Forma un NADH y 2 ATP. El PDH utiliza cinco coenzimas. La deshidrogenacion y descarboxilacion del piruvato además de las coenzimas usa tres enzimas diferentes, que son las que forman el complejo esta la piruvato deshidrogenasa y dos mas.. (pag 647 pero no es importante). Resumen de la producción del Acetil- CoA: - El piruvato, producto de la glucolisis, se onvierte en acetil-CoA, material de partida del ciclo del acido cítrico, por acción del complejo de la piruvato deshidrogenasa. - El complejo de la PDH esta compuesto por multiples copias de tres enzimas. Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 En el Ciclo de Krebs se generaron tres moléculas de NADH y una molécula de FADH2, dos dióxidos de carbono y también una molécula de GTP. PAG 652 esta todo el ciclo de Krebs MEGA EXPLICADO muchos detalles. Va a entrar Acetil-CoA a este ciclo y se va a generar dióxido de carbono y agua. RESUMEN: - Ocurre en la mitocondria (matriz mitocondrial), la mitocondria tiene una estructura que tiene una doble membrana (membrana externa de la mitocondria que la delimita, después un espacio que se llama espacio intermembral, y después una membrana interna, que se llama membrana interna mitocondrial). Lo que queda adentro de la membrana interna mitocondrial se llama matriz mitocondrial. Como la membrana interna esta plegada, a esos pliegues se los llama crestas mitocondriales, aca adentro están todos los compuestos del Ciclo de Krebs. - Perminte la oxidación completa del Acetil CoA. El Ciclo de Krebs sirve para oxidar completamente el Acetil-CoA (degradarlo) y de esta manera generar ATP y coenzimas reducidas. Cuando hablamos de oxidar completamente el Acetil-CoA, es el pasaje de este a dióxido de carbono mas agua (no hay nada mas oxidado que el dióxido de carbono). - Generan coenzimas reducidas que luego pasan a la cadena respiratoria. - Las moléculas de Acetil CoA que entran al ciclo vienen de la degradación de la glucosa, acidos grasos y AA. FOSFORILACION OXIDATIVA – Teoria quimiostica de Mitchell pag 737 Permite explicar cómo la energía libre generada por el transporte de electrones es usada para sintetizar ATP a partir de ADP y Pi. La fosforilacion oxidativa es la culminación del metabolismo productor de energía en los organismos aerobicos. Todos los pasos oxidativos en la defradacion de glúcidos, grasas y aa convergen en esta etapa final de la respiración celular en la que la energía de la oxidación impulsa la síntesis de ATP. La fosforilacion oxidativa y fotofosforilacion aportan conjuntamente la mayaor parte del ATP sintetizado por la mayor parte de los organismos la mayor parte de las veces. En la fosforilacion oxidativa se produce REDUCCION de O2 a H2O gracias a los electrones cedidos por NADH y FADH2. En la fotofosforilacion se produce la OXIDACION de H2O a O2 con NADP. Cosas similares entre la oxidación fosforilativa y la fotofosforilacion: - Ambos procesos interviene un flujo de electrones a través de una cadena de transportes ligados a membrana. - La energía libre puesta a disposición por el flujo de electrones esta acomplada al transporte de protones a través de una membrana impermeable, conservándose la energía libre de oxidación de los combustibles metabolicos en forma de potencial electroquímico. - El flujo transmembrana de protones a favor de su gradiente de concentración mediante canales proteicos proporciona la energía libre para la síntesis de ATP catalizada. Electrones pasan a través de una serie de transportadores unidos a membrana. Hay tres tipos d etransferencias electrónicas en la fosftorilacion oxidativa: - Transferencia directa de electrones, tal como sucede en la reducción de Fe3+ a Fe2+ - Transferencia de un atomo de hidrogeno - Transferencia de un ion hidrocarburo portador de dos electrones. -Bomba de protones : el transporte electrónico está acoplado al transporte de protones a través de la membrana interna de la mitocondria. Por lo que se genera un gradiente electroquímico. (Potencial quimico (H+/OH-) y electrico (+/-). - ATP sintasa : Posee un canal de protones por el cual éstos reingresan a la matriz mitocondrial. La disipación del gradiente genera suficiente energía para sintetizar 2,5 moles de ATP por mol de NADH ó 1,5 moles de ATP por mol de Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 FADH2 ingresado a la cadena respiratoria. El pasaje de H por la subunidad de F0 permite la rotación de la subunidad y y F1. CADENA RESPIRATORIA PAG 742 Objetivos: - Reoxidacion de las coenzimas reducidas (NADH – FADH2) - Transdormacion de la energía liberada por la ocidacion de los distintos nutrientes (representada por las coenzimas reducidad) en sitesis de ATP. PARES REDOX: UN COMPUESTO SE REDUCE Y OTRO COMPUESTO SE OXIDA. Donde ocurre: MATRIZ MITROCONDRIAL La cadena respiratoria esta conformada por una serie de reacciones acopladas entre si en las que los electrones de desecho provenientes de las moléculas de los alimentos que han sido degradadas y oxidadas mediante los procesos metabólicos (catabolismo) son transferidos a moléculas de oxigeno provenientes de la respiración para su expulsión del organismo humano, que por este ultimo hecho, se define como aerobio. Esto implica que el O2 suministrado al organismo por medio de la respiración, será el receptor ultimo de los electrones. Quienes son los encargados de remover los electrones . NAD Y FAD que se incorporan en su forma reducidas NADH Y FADH 2. Los NADH Y FADH conducen hasta unas enzimas a las que se enlazan en el complejo I para el NADH y complejo II para el FADH. Amabas enzimas se ahllan empotradas en la membrana mitocondrial interna, donde se ubican también dos enzimas mas, el complejo II y complejo IV. COMPLEJO I NADH UBIQUINONA REDUCTASA El NAD recibe hidrogens de sustratos oxidados por deshidrogenasas ligadas a la coenzima ubiquinona reductasa. Contiene FMN Y varios centros de Fe-S. Entrega los hidrogenos a la coenzima Q. Es decir, el NADH transfiere los electrones a la coenzima Q o ubiquinona. El NADH cede un anion hidruro a la coenzima q, la cual a su vez toma un proton de lamatriz mitrocondrial. Resultado: la coenzima q se convierte asi en su forma reducida QH2. - NADH – UBIQUINONA REDUCTASA O NADH DESHIDROGENASA. Formando por flavina mononucleotido y Fes Proteinas. - Se expulsan cuatro protones hacia el espacio intermembrana por el canal que atraviesa la membrana interna. - Se liberan los productos de la reacción hacia la matriz mitocondial. NAD regresa por mas protones que se requieren elimina. - Coenzima QH2 pasa al complejo III. COMPLEJO II – SUCCINATO UBIQUINONA REDUCTASA Correspnde a la succinato-ubiquinona reductasa. Posee un grupo prostético FAD y tres centros de Fe-S. Transfiere equivalentes de reducción desde el succinato a coenzima Q. Es una enzima del ciclo de Krebs-> el succinado es deshidrogenado y transformado en fumarato, los electrones y los atomos de hidrogeno que pierde el anion succinato se incorporan a una molecula de la coenzima FAD mediante un proceso que involucra radicales libres. El FADH2 puede ser capturado por el complejo III para que los electrones continúen su camino a través de las restantes etapas de la cadena. COMPLEJO III UBIQUINONA CITOCROMO C REDUCTASA. Contiene citocromos b y c y un centro Fe-S. Transfiere electrones desde ubiquinona a citocromo c. El QH2 transfiere ahora en el sitio activo de la enzima (quedando en coenzima Q), dos electrones de desecho que cedió el NADH a una molecula -> CITROCROMO C, que la capturo el complejo III también en la matriz mitrocondrial y que cuenta con un atomo de Fe en su forma oxidada. Este atomo es el sitio donde el cirocromo aloja los electrones Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 de desecho, que a su vez solo puede alojar un único electron de desecho por ende se necesitan 2 moleculas de citocromo. Luego de que la transferencia electrónica ha tenido lugar en el complejo III envía al cirocromo C ya reducido con su atomo Fe a la matriz mitocondrial, desde donde será capturado por ultima enzima en el complejo. Ubiquinol citocromo C reductasa o citocromo C reductasa. Formado por citocromo b, FeS, proteínas y citocromo C. COMPLEJO IV – CITOCROMO C OXIDASA En la ultima etapa el complejo IV captura al citocromo C reducido, lo despoja de su electron unido al atomo de hierro y se lo transfiere a mleculas de oxigeno, o2, el ultimo acarreador de electrones, que es explusado del organismo en forma de moléculas de agua. Formado por citocromo A, citocromo a3 y proteínas unidas al Cu. -En el curso del pasaje de electrones se genera un gradiente de H a través de la membrana mitocondrial interna. - Todos los protones que se juntaron en el lugar de acoplamiento del espacio intermembrana, conducen a los protones al interior de la enzima ATP SINTASA, la cual agarra los protones del espacio intermembrana y los expulsa de vuelta hacia la matriz mediante un mecanismo generado a partir de ADP Y Pi existentes en la matriz, nuevas moléculas de ATP, por lo que cada que se oxida una molecula de un nutriente y sus electrones de desechos son expulsados a través de la cadena repsiratoria esto e elimina por la fosforilacion oxidativa. Inhibidores de la cadena respiratoria y de la fosforilación oxidativa Amital, un barbiturato, y la Rotenona, un producto vegetal obtenido de las plantas que se usa como insecticida y pesticida, bloquean la cadena de transporte electrónico entre la NADH deshidrogenasa (Complejo I) y la CoQ. Como consecuencia, ellos impiden la utilización del NADH como donante de equivalentes de reducción a la cadena respiratoria. Sin embargo, el flujo de electrones que resulta de la reducción-oxidación del Complejo II no es afectada, ya que los electrones entran en un punto posterior al bloqueo, a través de la CoQ. CADENA RESPIRATORIA Antimicina A es un antibiótico producido por Streptomyces griseous e interfiere con el flujo de electrones desde el citocromo bH en el Complejo III (Q-citocromo c oxidoreductasa). En presencia de esta substancia, el citocromo bH puede ser reducido pero no oxidado, y consecuentemente, el citocromo c permanece oxidado, al igual que los citocromos a y a3 del Complejo IV. CADENA RESPIRATORIA El monoxido de carbono (CO) es responsable a nivel mundial por mas del 50 % de las muertes por envenenamiento. La intoxicación por monóxido de carbono causa trastornos en la entrega de oxígeno a los tejidos y en su utilización celular. La afinidad de la Hemoglobina por el monoxido de carbono es casi 300 superior a la que tiene por el oxigeno. Además, el CO se une a la forma reducida del hierro (Fe ++) de los grupos Hemo de la Citocromo Oxidasa (Complejo IV). El cianuro y las azidas también se unen a dichos grupos hemo. CADENA RESPIRATORIA Varios antibióticos como la oligomicina inhiben la síntesis de ATP por unión a la subunidad Fo de la ATP sintasa, impidiendo el pasaje de protones desde el espacio intermembrana hacia la matriz. Por lo tanto, hay acumulación de protones y no se aprovecha el gradiente protomotriz. Como consecuencia también se inhibe la respiración. FOSFORILACION OXIDATIVA El atractilósido, un veneno vegetal, inhibe la translocasa ADP/ATP. De esta manera, disminuye el ADP en la matriz, aumenta el ATP, se acumulan los protones en el espacio intermembrana, y como con la oligomicina, se inhibe el consumo de oxígen. FOSFORILACION OXIDATIVA. Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 HIDRATOS DE CARBONO – GLUCIDOS (265) Los hidratos de carbono son moleculas organicas formadas por C, H y O. Estructuralmente son polihidroxialdehidos o polihidroxicetonas FUNCION: - Fuente y/o reserva de energía para las células. - Elementos estructurales en paredes celulares de vegetales. - Lubricantes en articulaciones oseas. -Forman parte de otras moléculas importantes ADN – ARN Existen 3 clases principales de hidratos de cabono. MONOSACARIDO: Una sola unidad de polihidroxialdehidos o polihidroxicetonas. OLIGOSACARIDOS: Cadenas cortas de monosacáridos. Los mas abundantes son lso disacáridos formados por 2 unidades de monosacáridos. POLISACARIDO: Cadena larga de cientos o miles de unidades de monosacáridos. Pueden ser cadenas lineales o ramificadas. ESTRUCTURA Los monosacáridos mas simples son las TRISOSAS. Isomeria: Los isómeros son aquellas moléculas que poseen la misma formula molecular pero diferente formula estructural y por lo tanto diferentes propiedades Gliceraldehido – Dehidroxiacetona ESTAS DOS MOLECULAS SON ISOMEROS (de función) ENTRE SI Todos los monosacáridos menos la dishidroxiacetona tienen carbonos quirales o asimétricos. Un carbono quiral es aquel que posee cuatro sustituyentes o restros distintos. La presencia de un centro quiral permite la existencia de un tipo mas de isomeros, los isomeros opticos, que son un tipo de esteroisomeros (compuestos que poseen formulas moleculares idénticas y sus átomos presentan la misma distribución pero su disposición en el espacio es distinta). Al tener carbonos quirales van a tener isómeros ópticos o estereoisomeros. Una molécula con un número n de centros quirales va a tener 2n estereoisomeros. El gliceraldehido tiene 1 centro quiral por lo tanto 21 = 2 . Por convención uno es el isomero D y el otro el isomero L. MONOSACARIDOS- Serie D Y L. La mayor parte de las hexosas presentes en los organismos son de la serie D. Aldosas, Cetosas. EPIMEROS: Los hidratos de carbono que solo difieren en la configuración de 1 de sus carbonos quirales. ESTRUCTURA CICLICA Y FORMACION DE ANOMEROS: Todo lo que esta a la dererecha en la estructura lineal aparece debajo en la estructura cíclica. El intercambio entre formas se da mediante mutarrotacion. Cuando se ciclan surve un nuevo carbono quiral (carbono anomerico) y por lo tanto dos formas isomericas alfa y beta. Dos monosacáridos que solo se difieren en la configuración del carbono anomerico se los denomina ANOMEROS. Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 DISACARIDOS: Estan formado por dos monosacáridos unidos por enlace O-GLUCOSIDICO. Union del C anomerico de un monosacarido con un OH de otro monosacarido) Ejemplo MALTOSA/LACTOSA/SACAROSA buscar dibujito Aquellos disacáridos que conservan un carbono anomerico libre, es decir NO unido a otro monosacarido, son REDUCTORES. POLISACARIDOS Homopolisacaridos: Contienen un único tipo de monosacáridos. Almidon, glucógeno, celulosa Heteropolisacaridos: Contienen 2 o mas tipos diferentes de monosacáridos. Peptidoglucano, glucosoaminoglucanos (acido hialuronico) Polisacaridos vegetales: Celulosa. Polímero estructural Resistente e insoluble presente en paredes celulares de plantas en tallos, troncos y cañas. ALMIDON Formado por 20-25% amilosa y 75-80% amilopecana. GLUCOGENO: GLUCÓGENO El glucógeno presenta ramificaciones cada 8-12 residuos de gluc Polímero ramificado (Glu α 1-4 y ramificaciones α 1-6 ). El glucógeno es un polisacárido de reserva en células animales (hígado y músculo). El glucógeno es más ramificado que la amilopecana (ram cada 8-12 residuos de gluc). El glucógeno al ser ramificado facilita su degradación Almacenamiento que no modifica la presión osmóaca de la célula que si se modificaría si almacenara glucosa libre. Función principal de los HC y otras funciones • Que son quimicamente los HC (aldosas y cetosas) • Cual es el menor numero de carbonos que puede tener un HC • Fórmulas lineal y hemiacetálica de Fischer de la D-glucosa. • Que son anómeros • Que significa azúcar reductor • Representación de Haworth de la D-glucosa • Que son epímeros • Fórmulas de Haworth de la ribosa y fructosa • Tipos de unión más comunes en los HC (α-1,4 y α-1,6) • Disacáridos: maltosa, celobiosa, lactosa y sacarosa. • Polisacáridos: Glucógeno, almidón, celulosa. Distribución, estructura y función • Polisacáridos: Ventajas de la estructura ramificada del glucógeno Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 CATABOLISMO Y ANABOLISMO Etapa I: Hidrólisis de moléculas combustibles complejas en componentes simples. En esta etapa no se genera energía útil. Etapa II: Conversión de los distintos componentes simples en un metabolito intermediario común (Acetil-CoA). En esta etapa se genera algo de ATP. Etapa III: Oxidación del Acetil-CoA, eliminación de CO2 y formación de equivalentes de reducción (NADH y FADH2). Reducción del O2 y síntesis de ATP por fosforilación oxidativa. Es la etapa donde se produce la mayor proporción de ATP Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 GLUT: transportadores de glucosa sin necesidad de energía. Son proteínas. Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 METABOLISMO Vias metabolicas de la glucosa: (pag 222) - GLUCOGENOGENESIS: Conversion de glucosa en glucógeno. - GLUCOGENOLISIS: Liberacion de glucosa a partir de glucógeno. - GLUCOLISIS: Degradacion de glucosa a piruvato y lactato. - DESCARBOXILACION OXIDATIVA DE PIRUVATO: El piruvato dormado en la glucolisis es convertido en un resto de dos carbonos (acetato) - CICLO DE KREBS: Los restos del acetato son finalmente oxidados a CO2 Y H2O - VIA DE LAS PENTOSAS O HEXOSA MONOFOSFATO: Via alternativa de oxidación de glucosa. - GLUCONEOGENESIS: Formacion de glucosa o glucógeno a partir de geuentes no glucidicas. Los principales sutratos para la cluconeogenesis son aa glucogénicos, lactato y glicerol. GLUCOLISIS pag 557 Catabolismo de glúcidos. Anaerobica. *Degradación de la glucosa para obtener energía *Ocurre en el citoplasma celular *Tiene 2 fases, una preparatoria y una de beneficios *Tiene 3 pasos irreversibles Se dergrada una molecula de glucosa en una serie de reacciones catalizadas enzimáticamente, dando dos moléculas del compuesto de tres carbono, piruvato. Durante la secuenta de reacciones de la glucolisis, parte de la energía libre cedida por la glucosa se conserva en forma de ATP Y NADH. Fermentacion es un termino general que indica la degradación anaeróbica de la glucosa u otros nutrientes organicos para obtener energiaen forma de ATP. LA GLUCOLISIS TIENE DOS FASES: Fase Preparatoria: estas reacciones la glucosa es fosforilada en primer lugar en el hidroxilo en C-6. La D- glucosa 6fosfato asi formada se convierte en D. fructosa 6 . fosfato la cual vuelve a ser fosforilada, esta vez en C-1, dando Dfructosa 1,6 bifosfato. El ATP es el dador del grupo fosforilo en ambas fosforilaciones. La glucosa ingresa a las células por transportadores denominados GLUT Glucoquinasa en hígado (menor afinidad, mayor V max) IMPORTANTE: PASOS IRREVERSIBLES- PASO LIMITANTE PRIMERA ETAPA: POR CADA GLUCOSA SE FORMAN 2 GLICERALDEHIDO- 3 FOSFATO CON GASTO DE 2 ATP SEGUNDA ETAPA: Por cada gliceraldehido- 3-P se forman 2 ATP y 1 NADH y 1 piruvato Resumen – Glucolisis - La glucolisis es una ruta metabolica casi universal mediante la cual una molecula de glucosa se oxida a dos moléculas de piruvado conservando energía en forma de ATP Y NADH - Las enzimas se hallan en el citosol. - Fase preparatoria, se invierte ATP para conversitr la glucosa en gructosa 1,6 bisfosfato. A continuación se rompe en el enlace entre C3 Y C4 dando dos moléculas de triosa fosfato. - Fase de beneficios, cada una de las moléculas de gliceraldehido 3- fosfato derivadas de la glucosa se oxidan en C-1, la energía de esta reacción de oxidación se conserva en Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 forma de un NADH y dos ATP por triosa fosfato oxidada. - La glucolisis esta fuertemente coordinada con otras rutas productoras de energía para asegurar un suministro constante de ATP Entrada de otros azucares a la glucolisis Los mas significativos son los polisacáridos de almacenamiento, glucógeno y almidon. Los disacáridos maltosa, lactosa, trehalosa y sacarosa y los monosacáridos fructosa, manosa y galactosa. Los polisacáridos y disacáridos de la dieta se hidrolizan a monosacáridos. El almidón es la principal fuente de glúcidos en la dieta. La digestión comienza en la boca, donde la alfaamilasa de la saliva hidroliza al almidon dando lugar a fragmentos cortos de polisacáridos u oligosacáridos. En el estomago, la alfaamilasa de la saliva es inactivada por el pH bajo, Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 pero una segunda forma de alfa-amilaas, secretada por el páncreas al intestino delgado, continua el proceso de degradación. La alfra- amilasa pancreática da lugar principalmente a maltosa y maltotriosa (di y trisacáridos) y a oligosacáridos. La maltosa y los oligosacáridos son degradadas a glusoca por enzimas de las microvellosidades intestinales. El glucógeno de la dieta tiene básicamente la misma estructura que el almidón y su digestión sigue el mismo proceso. El glucógeno y el almidon endógenos se degradan mediantes fosforolisis. El glucógeno almacenado en los tejidos (principalmente hígado y musculo esquelético) se pueden movilizar para su uso dentro de la propia celula mediantes una reacción FOSFORILITICA catalizada por la glucógeno fosforilasa. En la fosfolisis se conserva parte de la energía del enlace glucosidico en el ester fosfato, glucosa 1- fosfato. La glucógeno fosforilasa (o la almidon fosforilasa) actua repetitivamente hasta alcanzar un punto de ramificación. Una enzima elimina las ramificaciones. Pasa todo el metabolismo del glucógeno. La glucosa 1- fosfato producida por la glucógeno fosforilacion se convierte en glucosa 6, fosfato por la fosfoglucomutasa. El termino general mutsasa se utiliza con las enziams que catalizan la transferencia de un grupo funcional desde una posición a otra en la misma molecula. Las mutasas son una subclase de las isomerasas. La glucosa 6 fosfato formada en la reacción de la fosfoglucomutsasa puede entrar en la glucolisis o en otra via como la via de las pentosas fosfato. Otros monosacáridos pueden entrar en diferentes puntos de la ruta glucolitica: Las hexosas pueden entrar a la glucolisis después de ser transformadas en un derivado fosforilado. La D fructosa peude ser fosforilada por hexoquinada. En el musculo y riñon son rutas importantes de entrada de la fructuosa en la glucolisis. En el hígado la fructosa entra por una ruta diferente. La enzima hepática cataliza la fosforilacion de la fuctosa en un carbono diferente, en vez de ser C6 es C1. Se convierte en gliceraldehido, que es fosforilado por un ATP entra en forma de gliceraldehido 3 fosfato. Resumen de rutas alimentadoras de la glucolisis - El glucógeno y el almidon endógenos, las formas de almacenamiento de la glucosa, entran en la glucolisis en un proceso de dos pasos. La rotura fosforolitica de un residuo de glucosa de un extremo del polmero que forma glucosa1- fosfato es catalizada por la glucógeno fosforilasa o la almidon fosforilasa. A continuación la fosfoglucomutasa convierete la glucosa 1- fosfato en glucosa 6-fosfato, que puede entrar en la glucolisis. - Los polisacáridos y disacáridos ingeridos se convierten en monosacáridos por acción de enzimas hidroliticos del intestino y los monosacáridos entran en las células intestinales y se transportan al hígado o otros tejidos. - Diversas D- hexosas, entre ellas la fructosa, la galactosa y la manosa, se peuden canalizar hacia la glucolisis. Cada una es fosforilada y a continuación se conviernte en glucosa 6 fosfato, en fructosa 6 fosfato o fructosa 1 fosfato. - La conversión de galactosa 1- Fosfato en glucosa 1- fosfato se hace a través de dos intermediarios que son derivados de nucleoridos. Defectos genéticos en cualquiera de las tres enzimas que catalizan la conversión de galactosa en glucosa 1- fosfato son causa de galactosemias que son graves. REGULACION DE LA GLUCOLISIS (BUSCAR A VER SI HAY ALGO MAS) GLUCAGON Y ADENALINA: Al unirse a sus respectivos receptores (de la familia de los GPCR), activan la formación del 2do mensajero, el AMPc. Éste activa a la PKa que fosforila a la enzima bifuncional. La enzima, fosforilada tiene Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 actividad de F-2,6-Pasa. Por lo tanto, disminuye la concentración de F-2,6-P2 (que pasa a F-6-P) y de esta manera se activa la gluconeogénesis y se inhibe la glucólisis. INSULINA: Luego de unirse a su receptor tirosina kinasa y a través de la estimulación del camino de las MAPKs, activa a una fosfatasa que defosforila a la enzima bifuncional y de esta manera tiene actividad de FFKII, sintetizando la F2,6-P2 a partir de F-6-P. El metabolito F-2,6-P2 activa a la FFKI e inhibe a la F-1,6-Pasa, por lo tanto activa la glucólisis e inhibe la gluconeogénesis. ATP -> ADP -> AMP DESTINOS DEL PIRUVATO: (577) - Ciclo de acido cítrico (krebs): Se oxida. OXIDACION DEL PIRUVATO A ACETIL COA. Complejo de piruvato deshidrogenasa en la mitocondria . Formado por tres enzimas: piruvato deshidrogenasa (e1), dehidrolipoiltransacetilasa (e2) y dehidropolipoildeshidrogenasa (e3) Utilizan 5 coeenzimas: Pirofosfato de tiamina (PPT), flavina adenina dinocleotido (FAD), nicotinamina adenaina dinucleotido (NAD), coenzima A, acido Lipoico. Regulacion del complejo de piruvato deshidrogenasa: la regulación se da por modificación covalente , fosforilacion. La fosforilacion en la E1 inhibe la activadad del complejo, esta fosforilacion la realiza una kinasa. La kinasa a su vez es regulada en forma alosterica (activada por atp, acetilcoa y NADH e imihibida por NAD, coenzima a, piruvato y adp) FERMENTACION: En condiciones aerobicas el piruvato formado en el ultimo paso de la glucolisis se oxida a acetil coa, el cual entra en el ciclo de krebs y se oxida a CO2 y H2O. El NADH formado por la deshidrogenacion del gliceraldehido 3.fosfato se reoxida finalmente a NAD mediante el paso final de sus electrones al O2 en el proceso de la respiración mitocondrial. En condiciones de poco oxigeno, como en los musculos esqueléticos, el acido lactivo NADH generado en a glucolisis no puede ser reoxidado por O2. La incapacidad de regenerar NAD dejaría la celula sin aceptor de electrones para la oxidación del gliceraldehido 3 fosfato. - Fermentacion de acido láctico En anaerobiosis (musculo en ejercicio) Retina, eritrocitos y cerebro. NAD+ en cantidad limitante de la celula, mediante la producción de lactato se regenera el NAD+ y puede continuar realizando la glucolisis. Se reduce el piruvato a lactato. Se produce lactato a patrir de la glucosa en condiciones aerobicas. La reducción del lactato lo cataliza la LACTATO DESHIDROGENASA. En la glucoliss l adeshidrogenacion de las dos moléculas de gliceraldehido 3- fosfato procedentes de cada molecula de glucosa ttansforma dos moléculas de NAD en dos NADH. Debito a que la reducción de dos moléculas de piruvato a dos de lactato regenera dos moléculas de NAD, no hay cambio neto de NAD o de NADH. El lactato formado por los musculos esqueléticos activos puede recilarse, se transporta la sangre al hígado, en donde se convierte en glucosa durante la recuperación de la actividad muscular vigorosa. En la oxidación- reducción de glucosa en lactato, no hay cambio neto en el estado de oxidacin del carbono de la glucosa y el acido lactivo, solo hay extraido parte de la energía de la molecula de glucosa. Fermentacion se le dice a todo ese tipo de procesos que extraen energía, en forma de ATP pero no consumen oxi’geno o cambian las concentraciones de NAD o NADH - Fermentacion Alcoholica: Levaduras y otros microorganismos. REOXIDACION DE NAD+. La levadura y otros microorganismos fermental la glucosa a etanol y CO2, en lugar de formar lactato. La glucosa se convierte en piruvato durante la glucolisis y el piruvato se Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 trnasforma en etanol y CO2 en un proceso de dos paso. En el primer paso el piruvato se descarboxila en una reacción irreversible catalizada por la piruvato descarboxilasa. No es la oxidación neta del piruvato. En el segundo paso el acetaldehiso se reduce a aetano a través de la acción de la alcohol deshidrogensasa mediante el poder reductor del NADH procedente de la deshidrogenacion del gliceraldehido 3 fosfato. No hay cambio neto de los atomos de hidogeno a atomos de carbono cuando se fermenta la glucosa. El piruvato descarboxilada esta en levaduras de cerveza y panificación y en organismos que dan lugar a la fermentación alcoholica de algunas plantas. ¿Cómo se reoxida el NADH citosólico? *El NADH citosólico formado en la glucólisis no puede atravesar la membrana mitocondrial interna para ser reoxidado desde la matriz por la cadena respiratoria ¿Cómo se reoxida el NADH citosólico? *Existen sistemas especiales de lanzaderas que transportan los equivalentes de reducción desde el NADH citosólico hacia las mitocondrias en forma indirecta Lanzadera malato-aspartato-oxalacetato (MAO) (Higado y músculo cardíaco) Lanzadera del glicerol-3-fosfato (Musculo esquele^co y cerebro) Transfiere los equivalentes al FAD y por úl?mo al complejo III ( 2 ATP) No involucra transporte de membrana RESUMEN: - El NADH formado en la glucolisis debe reciclarse para regenerar el NAD que s erequiere como aceptor electrónico en el primer paso de la face de beneficios. En condiciones aerobicas los electones pasan desde el NADH al O2 en la respiración mitrocondrial. - En condiciones ANAEROBICAS muchos orgnaismos regenrar el NAD, transfirierndo los electrones del NADH al piruvato y formando lactato. Otros organismos como la levadura, regenerar NAD mediante reducción del piruvato a etanol y CO2. En estos procesos anaeróbicos (fermentaciones) no se produce oxidación o reducción neta de los carbono de la glucosa. - Una gran variedad de microorganismos peuden fermentar el azúcar de los alimentos frescos, donde cambia p, gusto y textura. Se utiliza en al industria como materia prima barata. COSAS IMPORTANTES DE LA GLUCOLISIS: Glucólisis Vías metabólicas principales de los HC (G-6-P) Glucólisis. Etapas Glucólisis. Enzimas reversibles e irreversibles Concentraciones plasmá?cas de glucosa Importancia de la fosforilación de los metabolitos intermediarios Glucólisis. Rendimiento energé?co (ATP y NADH) Glucólisis. Regulación alostérica de la Fosfofrutoquinasa I Glucólisis. Regulación hormonal por insulina, glucagon y adrenalina Glucólisis aeróbica Glucólisis. Anaeróbica (fermentaciones lác?ca-LDHs y alcohólica) Glucólisis aeróbica y anaeróbica. Rendimiento energé?co (ATP y NADH) Lanzaderas malato-aspartato-oxalacetato y glicerol-3-fosfato Glucólisis: Metabolismo de galactosa y fructosa Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 GLUCONEOGENESIS Varios tejidos depende spor completo de la glucosa. Para el cerebr y el sistema nervioso, asi como para los eritrocitos, testículos, medula renal y tejidos embrionarios, la glucosa de la sangre es la única o principal fuente de combustible. La glucosa se mantiene almacenada como glucógeno en musculo y en hígado. El glucógeno se puede agotar después de un ejercicio vigoroso, ayunos prolongados, durante estos periodos los organismos sintetizan glucosa a partir de precursores no glusidicos, gluconeogénesis, encargada de convertir el piruvado y los compuestos relacionados de tres o cuatro carbonos en glucosa. Los precursores importantes son lactaco, piruvato y glicerol, asi como algunos AA. - Síntesis de glucosa a partir de precursores no glucosídicos tales como lactato, piruvato, glicerol y la mayoría de los aminoácidos. La degradación de ácidos grasos no entran a gluconeogénesis. - Se produce en el hígado y en riñones. Permite mantener la glucemia durante el ayuno. - Es una ruta esencial dado que algunos tejidos como el cerebro u? lizan glucosa como única o principal fuente de energía. - Van a participar enzimas mitocondriales y citosólicas. - Piruvato proveniente de citoplasma o generado en mitocondria por desaminación de alanina. El piruvato viene desde el citosol. - Piruvato es carboxilado en la mitocondria y pasa a oxalacetato. - El oxalacetato sale de la mitocondria como malato y vuelve a convertirse a oxalacetato en el citosol. MITOCONDRIA. - En el citosol el oxalacetato se transforma en fosfoenolpiruvato. Esta reacción requiere de energía en forma de GTP. Se gastaron 1ATP y 1GTP para pasar de piruvato a fosfoenolpiruvato - Si parto de piruvato voy a consumir 4ATP, 2GTP y 2 NADH INTERMEDIARIOS DEL CICLO DEL ACIDO CITRICO (KREBS) Y MUCHOS AA SON GLUCOGENICOS: Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 La rura biosentetica de la glucosa antes descrita permite la síntesis neta de glucosa no solo desde el piruvaro si no también de los intermediarios de cuatro, cinco y seis carbonos del ciclo de krebs. Citrato, isocritato, alfacetoglutarato, acetil coa, fumarato y malato son aquellos intermediarios del ciclo de krebs que se pueden oxidar dando oxalacetato. Algunos atomos de carbonso de la mayoría de los AA procedientes de las proteínas se convierten en piruvato o en intermediarios del cliclo de krebs. Tales AA pueden experimentar una conversión neta en glucosa por lo que se denominan glucogénicos. Alaninay glutamina son los principales que se pueden canalizar rápidamente hacia la gluconeogenesis. No se pueden convertir los acidos grasos en glucosa. RESUMEN: - La gluconeogensis es un proceso ubicuo de multiples pasos en el que la glucosa se produce a partir de lactato, piruvato u oxalacetato o otros compuestos como lso intermediarios del ciclo de acido cítrico, que pueden convertirse en intermediarios. Los pasos que son iguales a la glucolsis (7) son reversibles. - Los tres pasos irreversibles de la ruta glucolitica son rodeados mediante reacciones catalizadas por enzimas gluconeogenicos: x Convension del piruvato en PEP a través del oxalacetato, catalizada por la piruvato carboxilasa y pep carboxiquinada. x Desfosforilacion de la fructosa 1,6 bisfosfato por parte de la FBpasa 1 x Desfosforilacion de la glucosa 6 fosfato por parte de la glucosa 6 fosfatasa - Se requieren 4 ATP, 2 GTP Y 2 NADH - Se produce en Higado y riñon - La piruvato carboxilasa es estimulada por el acetil Coa incrementando la velocidad de la gluconeogensis cuando la celula ya tiene cantidades adecuadas de otros sustratos (acidos graoss ) para la producción de energía. - No se produce acetil Coa por la oxidación de acidos grasos - la glucolisis y gluconeogensis están reguladas recirpocamente para impedir funcionamiento desfilfarrador de ambras rutas al mismo tiempo Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 CICLO DE CORI En ejercicio excautivo (actividad contracti, intensa), hay poco oxigeno. Gran parte del PIRUVATO es reducido a LACTATO, pasa por la sangre es captado por el hígado donde se convierte en glucosa y glucógeno. Cuando la glucemia desciende el hígado degrada su glucógeno y envía glucosa a al circulación, desde donde la toma el musculo para cubrir sus necesidades o restaurar sus reservas de glucógeno. Asi como compuestos de origen no glucidico pueden generar glucosa o glucógeno, productos de derivados de la glucosa sirven para sintetizar lípidos o esqueletos carbonados de algunos AA. leer 219 Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 METABOLISMO DE HIDRATOS DE CARBONO (HC) Gluconeogénesis Gluconeogénesis: Definición Gluconeogénesis desde lactato y piruvato Gluconeogénesis: Gasto energé?co Gluconeogénesis desde alanina Gluconeogénesis desde glicerol Gluconeogénesis: Regulación hormonal Ciclo de Cori: Funciones y compar?mientos involucrados Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 VIA DE LAS PENTOSAS O HEXOSAS MONOFOSFATO pag 588 -Ocurre en el citoplasma de la célula -Tiene 2 fases (una oxida^va y una no oxida^va) -No consume ni produce ATP -1 C de la glucosa 6-P es liberado como CO2 -Se producen dos NADPH por glucosa 6-P -Produce Ribosa 5-P para síntesis de nucleó^dos -Produce intermediarios de glucolisis El destino catabólico principal de la glucosa 6 fosfato es la degradación glucolitica a piruvato. Que este piruvato se oxida via ciclo de krebs lo que lleva en ultimo termino a la generación de ATP. La glucosa 6 fosfato tiene otros destinos catabólicos que conducen a productos especializados necesrios para la celula. La oxidación de la glucosa 6 fosfato a pentosas fosfato por la ruta de las pentosas fostao (ruta fosfogluconato, hexosas monofosfato). En esta ruta oxidativa, el NADP es aceptor electrónico dando NADPH. Funciones principales de la via de las pentosas - Síntesis de ribosa-5-fosfato, precursor imprescindible para la síntesis de novo de nucleó?dos de purinas y pirimidinas -Síntesis de NADPH que será generalmente u?lizado en diversas biosíntesis reduc?vas, es decir que necesitan equivalentes de reducción. Por ejemplo: x Síntesis de ácidos grasos a par?r de ace?l-CoA x Síntesis de colesterol a par?r de ace?l CoA x Síntesis de esteroides a par?r de colesterol x Síntesis de desoxirribonucleó?dos difosfato a par?r de ribonucleó?dos difosfato (enzima Ribonucleó?do Reductasa) x Además el NADPH se usa para mantener reducido al gluta?ón, el cual de esta manera puede reducir y eliminar a las ROS (Reac?ve Oxygen Species), los cuales ?enen alto poder oxidante y son nocivos a las células La fase oxidativa produce pentosas fosfato y NADPH. La fase no oxidativa recicla pentosas fosfato a glucosa 6 fosfato. Pasa en el citosol. Todas las enzimas de la ruta de las pentosas están localizadas ahí, igual que la de la glucolisis y la mayoría de la gluconeogenesis. Estas tres rutas están conectadas a través de varios intermediarios y enzimas compartidos. El gliceraldehido 3 fostato formado por la acción de la transcetolasa se convierte rápidamente en dihidroxiacetona fostato por acciondel enxima glucolitico triosa fostato isomerasa y estas dos triosas se pueden unir gracias a la intervención de la aldolasa que sucede en la gluconeogenesis, formando frucosa 1,6 bifosfato. De modo alternativo, las triosas fosfato pueden oxidarse a piruvato mediante las reacciones glucoliticas. EL destino de las triosas viene determinado por las necesidades relativas de la celula respecto a pentosas fosfato, NADPH Y ATP. Resumen: - La ruta oxidativa de las pentosas fosfato (ruta del fosfogluconato o ruta de la hexosa monofosfato) da lugar a la oxidación y la descarboxilacion de la glucosa 6- fosfato en posición c1 reduciendo el NADP a NADPH y formando Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 penosas fosfato. - El NADPH proporciona poder reductor para las reacciones biosinteticas y la ribosa 5 fosfato es un precursor para la síntesis de nucleótidos y acidos nucleicos. Los tejidos con biosíntesis activa de acidos grasos, coleterol y hormonas esteroideas envían mas glucosa 6 fosfato atraves de la ruta de las penstosas. - La primera fase de la ruta consiste en dos oxidaciones que converten la glucosa 6 fosfato en ribulosa 5 fosfato y reducen el NADP a NADPH. -La segunda fase comprendepasos no oxidativos que convierten pentosas fosfato en glucosa 6 fosfato y empieza de nuevo el ciclo. Vía de las pentosas Ciclo de las pentosas: Etapas Ciclo de las pentosas: Enzimas Ciclo de las pentosas: Funciones Ciclo de las pentosas: Anemia hemolí?ca Fórmula del gluta?ón Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 GLUCOGENOLISIS blan 225/ li 624 - Degradación del glucógeno. Papel funcional del glucógeno: En la mayoría de los tejidos es una reserva cuando se requiere glucosa durante periodos de hipoglucemia o hipoxia. Pero en Hígado y músculos, que son órganos muy ricos en glucógeno cumple otras funciones. Hígado: papel importante: regulador de la glucosa en todos los tejidos. Inmediatamente después de una comida aumenta (transitoriamente) la glucemia. En estos periodos de exceso de oferta, el hígado sustrae glucosa de la circulación y la almacena como glucógeno. En los intervalos entre comida, el hígado degrada su glucógeno y libera glucosa en sangre. Musculo: El glucógeno actúa como reserva rápidamente movilizante que provee combustible para la CONTRACCION. El musculo no puede liberar glucosa, sus depósitos de glucógeno son utilizados exclusivamente por el propio tejido. Proceso inverso de la gluconeogénesis. Etapas de la glucogenolisis: 1- Fosforolisis de glucógeno: La degradación del glucógeno es iniciada por la fosforilasa, que cataliza la ruptura de uniones glucosidicas alfa (1-4) por inserción de fosfato en el carbono 1. El ortofosfato utilizado en esta reacción proviene del medio por ende no se gasta ATP. La acción enzimática son tres enzimas. La fosforilasa actúa a partir del extremo no reductor de las ramificaciones y libera glucosa 1- fosfato. La acción enzimática se detiene 4 restos antes de la glucosa próxima donde interviene la glucantransferasa que desprende el trisacrarido terminal de la ramificación y lo transfiere al extremo de una rama vecina que se une por enlace alfa 1-> 4. Ka ramificación queda reducida a una sola glucosa con unión alfa 1-6: La fosforilasa contiene piridoxal fosfato covalente que es una enzima regulatoria que corresponde a efectores alostericos y a modificación covalente. 2- Hidrolisis de uniones glucosidicas alfa 1-> 6. La ruptura de este enlace se realiza por hidrolisis, catalizada por alfa glucosidasa o enzima desramificante dejando la glucosa en libertad. Luego de esto, la cadena es nuevamente por la atacada por la fosforilasa que continua liberando glucosa 1 fosfato hasta que la próxima unión alfa 1->6 se encuentra a una distancia de cuatro restos glucosa y repite la participación de las otras enzimas. 3- Formación de glucosa 6 fosfato: La glucosa 1 fosfato es convertida en glucosa 6 fosfato por la fosfoglucomutasa. Es la misma reacción que en la glucogenogenesis pero inversa. 4- Formación de glucosa libre: La última etapa es la hidrolisis de glucosa6 fosfato a glucosa y fosfato inorgánico, catalizada por glucosa 6 fosfatasa. El hígado y el riñón pueden sacar la glucosa porque tienen la glucosa 6 fosfatasa que el musculo no lo tiene. Esta tiene subunidades, una de las más importantes es la GLUT 7, permite el paso de la glucosa hacia el citosol. En el musculo no puede hidrolizarte por que le falta la enzima, entonces sigue su camino catabólico hacia la glucolisis. El glucógeno hepático se agota en 12 a 24 hs. Es menor a la grasa acumulada (triaglicerol) Resumen: - En el musculo e hígado las unidades de glucosa de las ramas exteriores del glucógeno entran a la ruta glucolitica por tres enzimas: glucógeno fosforilasa, enzima desramificante (alfa glucosida) y fosfoglucomutasa. - La glucógeno fosforilaza caaliza la reacción para romper un enlace glucosidico (alfa 1-4). Este enlace uno dos Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 residuso de glucosa en un extremo no reductor del glucógeno donde sufre un ataca por parte del fosfato inorgánico y asi se elimina el residuo glucosa. Este residuo s eelimina en alfa-D- glucosa 1 fosfato. No es lo mismo que hidrolizar el glucógeno en el intestino porque aca se guarda energía. Cofactor: piridoxal, prevé el ataca del Pi. Esta actúa otra vez hasta romper el enlace 1-6 donde se detiene su acción. Ahora actúa la enzima desramificante. - Enzima desramificante: cataliza dos reacciones consecutivas que transfieres ramificaciones, una vez que pasa esto actual la glucógeno fosforilasa. -Glusa 1 fosfato se convierte en glucosa 6 fosfato por la acción de la fosfoglucomutasa. Reacción reversible. - La glucosa 6 fosfato del musculo puede entrar en la glucolisis y así sirve como fuente de energía para la contracción muscular. -En el hígado, la degradación del glucógeno sirve como reserva. - La enzima desramificante tiene dos actividades: Libera glucosa de cada ramificación. Regulación de la glucemia: (ver pagina242 blanco) - Insulina: Una concentración elevada de glucosa en sangre produce la secreción de la insulina: la glucosa se transporta a las células corporales. La absorción de la glucosa por el hígado, el riñón y las células del cerebro se realiza por difusión y no necesita insulina. - Glucagón: Opuestos a la insulina Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 GLUCOGENOGENESIS SINTESIS DE GLUCOGENO - Proceso anabólico que requiere energía. - Síntesis de glucógeno a partir de glucosa. - Hígado y musculo. Hay más glucógeno en hígado que en musculo. Etapas: 1- Fosforilacion de glucosa: La primera etapa en la síntesis de glucógeno es la conversión de glucosa en glucosa 6 fosfato. Catalizada por la glucoquinasa son 6 enzimas. 2- Formación de glucosa 1 fosfato: Actual la fosfoglucomutasa, transfiere el grupo fosfato del carbono 6 al carbono 1 y se convierte en glucosa 1 fosfato. REVERSIBLE. 3- Activación de la glucosa: La glucosa 1 fosfato reacciona con el nucleótido de alta energía. La reacción la cataliza pla glucosa 1 p uridiltransferasa. Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 4- Adición de la glucosa en estructura polimerica: La glucosa activada es transferida a glucógeno preexistente. Se une al carbono 4 de una glucosa terminal. Catalizada por: glucógeno sistasa. IRREVERSIBLE. 5- Formación de ramificaciones: Cuando hay más de 10 residuos de glucosa, interviene otra enzima que secciona un segmento terminal de no menos de 6 glucosas. La enzima es la enzima ramificante. El glucógeno sintasa está de dos formas en los tejidos: INACTIVA Y FOSFORILADA: muestra actividad en presencia de concentraciones saturantes de glucosa 6 fosfato , aloesterico positivo. ACTIVA Y DESFOFORILADA: independiente de la existencia de glucosa 6 fosfato. - CORTA 6-8 GLUCOSAS Y LAS TANSFIERE GENERANDO UN ENLACE 1-6 - GENERA MAS RAMIFICACIONES POR LAS CUALES LA FOSFORILASA VA A DEGRADAR LUEGO AL GLUCOGENO Glucogenina: No actúa si no hay polisacárido. Es una proteína. Ayuda a sintetizar glucógeno cuando no hay glucógeno preexistente. (Ausencia total) Se una con un resto de tirosina. Enzima desramificante: Corta 6-8 glucosas y las transfiere a un enlace 1-6. Genera más ramificaciones por las cuales la fosforilasa va a degradas luego el glucógeno. REGULACION DEL METABOLISMO DEL GLUCOGENO Síntesis y degradación tienen una regulación contrapuesta., es decir lo que inhibe una ruta , activa la contraria. La regulación implica control alostérico, llevado a cabo por METABOLITOS y también por modificaciones covalentes, realizada por ENZIMAS bajo CONTROL HORMONAL CONTROL DE LA DEGRADACION DE GLUCOGENO O GLUCOGENOLISIS Downloaded by Facundo (espasandinfacundo@gmail.com) lOMoARcPSD|18474748 El punto de regulación es la glucógeno fosforilasa, que existe en dos estados conformacionales diferentes: fosforilasa B (muy poco activa) y fosforilasa A (muy activa). Debido al diferente papel del glucógeno muscular y el hepátco, la regulación es diferente en estos órganos. REGULACIÓN DE LA GLUCOGENOLISIS MUSCULAR El glucógeno del músculo tiene como finalidad suministrar glucosa para que sea degradada oxidativamente y se pueda obtener ATP para la actividad muscular. -Regulación de glucógeno por activación del PKA Downloaded by Facundo (espasandinfacundo@gmail.com)