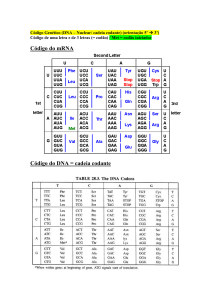
Bioquímica Básica e Metabolismo Prof.ª Graziela dos Santos Barni Indaial – 2019 1a Edição Copyright © UNIASSELVI 2019 Elaboração: Prof.ª Graziela dos Santos Barni Revisão, Diagramação e Produção: Centro Universitário Leonardo da Vinci – UNIASSELVI Ficha catalográfica elaborada na fonte pela Biblioteca Dante Alighieri UNIASSELVI – Indaial. B262b Barni, Graziela dos Santos Bioquímica básica e metabolismo. / Graziela dos Santos Barni. – Indaial: UNIASSELVI, 2019. 212 p.; il. ISBN 978-85-515-0340-9 1. Bioquímica. - Brasil. 2. Metabolismo. – Brasil. II. Centro Universitário Leonardo Da Vinci. CDD 572 Impresso por: APRESENTAÇÃO Prezado acadêmico, este livro didático reúne informações preciosas sobre bioquímica e metabolismo. Mas questionamos: O que é a Bioquímica? Como podemos definir Metabolismo? A bioquímica é considerada uma ciência interdisciplinar que utiliza princípios e métodos da química na investigação das transformações que ocorrem nas substâncias e moléculas dos seres vivos, enquanto que o metabolismo são as transformações e reações químicas relacionadas aos processos de síntese, degradação e decomposição envolvendo nossas células. Neste livro didático conheceremos os principais processos e conceitos que envolvem essas ciências tão importantes para os seres vivos e que vivenciamos diariamente. Para tornar este momento mais organizado e de fácil entendimento, dividimos em três unidades. Na Unidade 1, nosso foco inicialmente estará direcionado para as informações relacionadas aos fundamentos da bioquímica. Esta unidade estará dividida em dois tópicos: a lógica molecular da vida e célula eucarionte e procarionte. Você lembra quais são as principais teorias para explicar o aparecimento da vida no nosso planeta? O que significa ser eucarionte e procarionte? Na Unidade 2 será abordado o tema biomoléculas. Afinal, o que são biomoléculas? Como podemos imaginar, biomoléculas são moléculas essenciais à vida. Esta unidade está dividida em sete tópicos, sendo eles: características gerais das biomoléculas; água; aminoácidos; proteínas; enzimas; carboidratos; ácidos nucleicos; e lipídios. E, por fim, na Unidade 3 iremos direcionar nossas informações para o metabolismo que acontece no interior de nossas células. Esta unidade está dividida em cinco tópicos: princípios de bioenergética; ciclo do ácido cítrico; metabolismo de ácidos graxos e triglicerídeos; metabolismo de aminoácidos; e metabolismo de nucleotídeos. Mas como nossas células obtêm energia para realizar todas as suas funções? Por que acontecem erros no metabolismo de lipídios, podendo gerar doenças como hipercolesterolemia e adrenoleucodistrofias, por exemplo? Esses são alguns questionamentos que serão respondidos ao longo deste livro didático. Está curioso? Vamos começar essa leitura cheia de informações que nos leva a compreender melhor o funcionamento do nosso organismo? Bons estudos! Prof.ª Graziela dos Santos Barni GIO Você lembra dos UNIs? Os UNIs eram blocos com informações adicionais – muitas vezes essenciais para o seu entendimento acadêmico como um todo. Agora, você conhecerá a GIO, que ajudará você a entender melhor o que são essas informações adicionais e o porquê você poderá se beneficiar ao fazer a leitura dessas informações durante o estudo do livro. Ela trará informações adicionais e outras fontes de conhecimento que complementam o assunto estudado em questão. Na Educação a Distância, o livro impresso, entregue a todos os acadêmicos desde 2005, é o material-base da disciplina. A partir de 2021, além de nossos livros estarem com um novo visual – com um formato mais prático, que cabe na bolsa e facilita a leitura –, prepare-se para uma jornada também digital, em que você pode acompanhar os recursos adicionais disponibilizados através dos QR Codes ao longo deste livro. O conteúdo continua na íntegra, mas a estrutura interna foi aperfeiçoada com uma nova diagramação no texto, aproveitando ao máximo o espaço da página – o que também contribui para diminuir a extração de árvores para produção de folhas de papel, por exemplo. Assim, a UNIASSELVI, preocupando-se com o impacto de ações sobre o meio ambiente, apresenta também este livro no formato digital. Portanto, acadêmico, agora você tem a possibilidade de estudar com versatilidade nas telas do celular, tablet ou computador. Junto à chegada da GIO, preparamos também um novo layout. Diante disso, você verá frequentemente o novo visual adquirido. Todos esses ajustes foram pensados a partir de relatos que recebemos nas pesquisas institucionais sobre os materiais impressos, para que você, nossa maior prioridade, possa continuar os seus estudos com um material atualizado e de qualidade. QR CODE Olá, acadêmico! Para melhorar a qualidade dos materiais ofertados a você – e dinamizar, ainda mais, os seus estudos –, a UNIASSELVI disponibiliza materiais que possuem o código QR Code, um código que permite que você acesse um conteúdo interativo relacionado ao tema que você está estudando. Para utilizar essa ferramenta, acesse as lojas de aplicativos e baixe um leitor de QR Code. Depois, é só aproveitar essa facilidade para aprimorar os seus estudos. ENADE Acadêmico, você sabe o que é o ENADE? O Enade é uma dos meios avaliativos dos cursos superiores no sistema federal de educação superior. Todos os estudantes estão habilitados a participar do ENADE (ingressantes e concluintes das áreas e cursos a serem avaliados). Diante disso, preparamos um conteúdo simples e objetivo para complementar a sua compreensão acerca do ENADE. Confira, acessando o QR Code a seguir. Boa leitura! LEMBRETE Olá, acadêmico! Iniciamos agora mais uma disciplina e com ela um novo conhecimento. Com o objetivo de enriquecer seu conhecimento, construímos, além do livro que está em suas mãos, uma rica trilha de aprendizagem, por meio dela você terá contato com o vídeo da disciplina, o objeto de aprendizagem, materiais complementares, entre outros, todos pensados e construídos na intenção de auxiliar seu crescimento. Acesse o QR Code, que levará ao AVA, e veja as novidades que preparamos para seu estudo. Conte conosco, estaremos juntos nesta caminhada! SUMÁRIO UNIDADE 1 - FUNDAMENTOS DE BIOQUÍMICA.......................................................1 TÓPICO 1 - A LÓGICA MOLECULAR DA VIDA.......................................................... 3 1 INTRODUÇÃO......................................................................................................... 3 2 A UNIDADE QUÍMICA DOS DIFERENTES ORGANISMOS VIVOS..........................4 2.1 A BIOQUÍMICA PROCURA EXPLICAR A VIDA EM TERMOS QUÍMICOS.......................6 2.2 MACROMOLÉCULAS CONSTRUÍDAS A PARTIR DE COMPOSTOS SIMPLES.......... 8 2.3 PRODUÇÃO DE ENERGIA E SEU CONSUMO NO METABOLISMO...............................9 2.4 TRANSFERÊNCIA DA INFORMAÇÃO BIOLÓGICA......................................................... 17 RESUMO DO TÓPICO 1...........................................................................................23 AUTOATIVIDADE....................................................................................................24 TÓPICO 2 - CÉLULA EUCARIONTE E PROCARIONTE...........................................25 1 INTRODUÇÃO.......................................................................................................25 2 COMPARTIMENTOS CELULARES.......................................................................25 3 DIMENSÕES CELULARES...................................................................................32 4 CÉLULAS E TECIDOS USADOS EM ESTUDOS BIOQUÍMICOS...........................34 5 EVOLUÇÃO E ESTRUTURA DAS CÉLULAS PROCARIÓTICAS..........................34 5.1 O ESTUDO DA Escherichia coli........................................................................................ 36 6 EVOLUÇÃO DAS CÉLULAS EUCARIÓTICAS......................................................39 6.1 PRINCIPAIS CARACTERÍSTICAS ESTRUTURAIS DAS CÉLULAS EUCARIÓTICAS....................................................................................................................40 7 ESTUDO DOS COMPONENTES CELULARES......................................................45 7.1 ORGANELAS ISOLADAS POR CENTRIFUGAÇÃO.......................................................... 45 7.2 ESTUDOS IN VITRO............................................................................................................ 47 8 EVOLUÇÃO DOS ORGANISMOS MULTICELULARES E A DIFERENCIAÇÃO CELULAR............................................................................................................... 48 9 VÍRUS: PARASITAS DAS CÉLULAS.................................................................... 51 LEITURA COMPLEMENTAR...................................................................................53 RESUMO DO TÓPICO 2...........................................................................................54 AUTOATIVIDADE....................................................................................................55 UNIDADE 2 — BIOMOLÉCULAS.............................................................................59 TÓPICO 1 — CARACTERÍSTICAS GERAIS............................................................. 61 1 INTRODUÇÃO....................................................................................................... 61 2 COMPOSIÇÃO E LIGAÇÃO QUÍMICA................................................................... 61 3 BIOMOLÉCULAS SÃO COMPOSTOS DE CARBONO...........................................62 4 GRUPOS FUNCIONAIS DETERMINAM AS PROPRIEDADES QUÍMICAS...........63 5 ESTRUTURA TRIDIMENSIONAL: CONFIGURAÇÃO E CONFORMAÇÃO............64 6 REATIVIDADE QUÍMICA......................................................................................65 7 MACROMOLÉCULAS E SUAS SUBUNIDADES MONOMÉRICAS........................69 RESUMO DO TÓPICO 1............................................................................................71 AUTOATIVIDADE.................................................................................................... 72 TÓPICO 2 - ÁGUA................................................................................................... 73 1 INTRODUÇÃO....................................................................................................... 73 2 PONTES DE HIDROGÊNIO................................................................................... 73 3 INTERAÇÕES DE VAN DER WAALS.................................................................... 76 4 IONIZAÇÃO DA ÁGUA, ÁCIDOS FRACOS E BASES FRACAS............................. 76 5 AÇÃO TAMPONANTE CONTRA AS VARIAÇÕES DE PH NOS SISTEMAS BIOLÓGICOS...........................................................................................................78 LEITURA COMPLEMENTAR...................................................................................82 RESUMO DO TÓPICO 2.......................................................................................... 84 AUTOATIVIDADE....................................................................................................85 TÓPICO 3 - AMINOÁCIDOS, PEPTÍDEOS E PROTEÍNAS......................................87 1 INTRODUÇÃO.......................................................................................................87 2 AMINOÁCIDOS.....................................................................................................88 2.1 CARACTERÍSTICAS ESTRUTURAIS................................................................................88 2.2 CLASSIFICAÇÃO PELO GRUPO R...................................................................................89 2.3 PROPRIEDADES DOS AMINOÁCIDOS............................................................................ 92 3 PEPTÍDEOS E PROTEÍNAS.................................................................................93 3.1 ASPECTOS GERAIS DA ESTRUTURA PROTEICA......................................................... 94 3.2 ESTRUTURA SECUNDÁRIA DAS PROTEÍNAS.............................................................. 94 3.3 ESTRUTURAS TERCIÁRIAS E QUATERNÁRIAS DAS PROTEÍNAS........................... 95 3.4 DESNATURAÇÃO PROTEICA E ENOVELAMENTO....................................................... 95 3.5 FUNÇÕES DAS PROTEÍNAS..............................................................................................97 RESUMO DO TÓPICO 3...........................................................................................99 AUTOATIVIDADE.................................................................................................. 101 TÓPICO 4 - ENZIMAS...........................................................................................103 1 INTRODUÇÃO.....................................................................................................103 2 FUNÇÃO ENZIMÁTICA......................................................................................104 3 CINÉTICA ENZIMÁTICA....................................................................................104 3.1 ENZIMAS REGULADORAS............................................................................................... 105 RESUMO DO TÓPICO 4......................................................................................... 107 AUTOATIVIDADE..................................................................................................108 TÓPICO 5 - CARBOIDRATOS E GLICOCONJUGADOS......................................... 111 1 INTRODUÇÃO...................................................................................................... 111 2 MONOSSACARÍDEOS E DISSACARÍDEOS....................................................... 112 3 POLISSACARÍDEOS.......................................................................................... 114 4 GLICOCONJUGADOS: PROTEOGLICANOS, GLICOPROTEÍNAS E GLICOLIPÍDIOS.................................................................................................... 116 RESUMO DO TÓPICO 5.........................................................................................120 AUTOATIVIDADE.................................................................................................. 121 TÓPICO 6 - NUCLEOTÍDEOS E ÁCIDOS NUCLEICOS.......................................... 123 1 INTRODUÇÃO..................................................................................................... 123 2 ESTRUTURA DOS NUCLEOTÍDEOS E NUCLEOSÍDEOS................................... 123 3 LIGAÇÕES FOSFODIÉSTERES.......................................................................... 125 4 ESTRUTURA DOS ÁCIDOS NUCLEICOS........................................................... 126 4.1 CARACTERÍSTICAS DO DNA........................................................................................... 126 5 CARACTERÍSTICAS DOS RNAS........................................................................ 126 6 A QUÍMICA DO ÁCIDO NUCLEICO..................................................................... 127 7 OUTRAS FUNÇÕES DOS NUCLEOTÍDEOS.......................................................128 RESUMO DO TÓPICO 6......................................................................................... 129 AUTOATIVIDADE..................................................................................................130 TÓPICO 7 - LIPÍDIOS.............................................................................................131 1 INTRODUÇÃO......................................................................................................131 2 LIPÍDIOS DE ARMAZENAMENTO.......................................................................131 3 LIPÍDIOS ESTRUTURAIS DE MEMBRANA........................................................ 133 4 LIPÍDIOS COMO SINAIS, COFATORES E PIGMENTOS.....................................134 5 SEPARAÇÃO E ANÁLISE DE LIPÍDIOS............................................................. 135 RESUMO DO TÓPICO 7.........................................................................................138 AUTOATIVIDADE.................................................................................................. 139 UNIDADE 3 — METABOLISMO.............................................................................. 141 TÓPICO 1 — PRINCÍPIOS DA BIOENERGÉTICA...................................................143 1 INTRODUÇÃO.....................................................................................................143 2 SERES AUTOTRÓFICOS, HETEROTRÓFICOS E VIAS METABÓLICAS............144 3 GLICÓLISE E VIA PENTOSE-FOSFATO............................................................148 3.1 A FASE PREPARATÓRIA DA GLICÓLISE REQUER ATP...............................................152 3.2 A FASE DE PAGAMENTO DA GLICÓLISE PRODUZ ATP E NADH........................... 153 4 A CAPTAÇÃO DA GLICOSE É DEFICIENTE NO DIABETES MELITO TIPO 1..... 153 5 VIAS ALIMENTADORAS DA GLICÓLISE........................................................... 155 5.1 OS POLISSACARÍDEOS E OS DISSACARÍDEOS DA DIETA....................................... 156 5.2 O GLICOGÊNIO ENDÓGENO E O AMIDO SÃO DEGRADADOS POR FOSFORÓLISE.....................................................................................................................157 6 GLICONEOGÊNESE...........................................................................................158 LEITURA COMPLEMENTAR.................................................................................160 RESUMO DO TÓPICO 1..........................................................................................161 AUTOATIVIDADE.................................................................................................. 162 TÓPICO 2 - CICLO DO ÁCIDO CÍTRICO................................................................ 163 1 INTRODUÇÃO..................................................................................................... 163 2 PRODUÇÃO DE ACETATO.................................................................................164 3 REAÇÕES DO CICLO DO ÁCIDO CÍTRICO......................................................... 166 4 O CICLO DO GLIOXILATO..................................................................................168 RESUMO DO TÓPICO 2..........................................................................................171 AUTOATIVIDADE.................................................................................................. 172 TÓPICO 3 - METABOLISMO DE ÁCIDOS GRAXOS E TRIGLICERÍDEOS............. 173 1 INTRODUÇÃO..................................................................................................... 173 2 DIGESTÃO, MOBILIZAÇÃO E TRANSPORTE DE GORDURAS.......................... 174 2.1 AS GORDURAS DA DIETA SÃO ABSORVIDAS NO INTESTINO DELGADO..............175 2.2 HORMÔNIOS ATIVAM A MOBILIZAÇÃO DOS TRIACILGLICERÓIS ARMAZENADOS..................................................................................................................176 2.2.1 Oxidação dos ácidos graxos..................................................................................178 2.2.2 Corpos cetônicos.....................................................................................................179 2.2.3 Corpos cetônicos são produzidos em excesso no diabetes e durante o jejum............................................................................................................................ 180 RESUMO DO TÓPICO 3.........................................................................................182 AUTOATIVIDADE..................................................................................................183 TÓPICO 4 - METABOLISMO DE AMINOÁCIDOS..................................................185 1 INTRODUÇÃO.....................................................................................................185 2 DESTINOS METABÓLICOS DOS GRUPOS AMINOS......................................... 187 2.1 AS PROTEÍNAS DA DIETA SÃO ENZIMATICAMENTE DEGRADADAS ATÉ AMINOÁCIDOS.................................................................................................................... 188 2.2 O GLUTAMATO LIBERA SEU GRUPO AMINO NA FORMA DE AMÔNIA................... 191 2.3 A GLUTAMINA TRANSPORTA A AMÔNIA NA CORRENTE SANGUÍNEA.................192 2.4 A ALANINA TRANSPORTA A AMÔNIA DOS MÚSCULOS ESQUELÉTICOS PARA O FÍGADO................................................................................................................................. 194 2.5 A AMÔNIA É TÓXICA PARA OS ANIMAIS..................................................................... 195 2.6 EXCREÇÕES DE NITROGÊNIO E CICLO DA UREIA.................................................... 196 2.7 A UREIA É PRODUZIDA A PARTIR DA AMÔNIA.......................................................... 196 2.8 DEFEITOS GENÉTICOS DO CICLO DA UREIA PODEM SER FATAIS....................... 198 2.9 VIAS DE DEGRADAÇÃO DOS AMINOÁCIDOS............................................................. 198 2.10 O CATABOLISMO DA FENILALANINA / FENILCETONÚRIA................................... 199 RESUMO DO TÓPICO 4.........................................................................................201 AUTOATIVIDADE................................................................................................. 202 TÓPICO 5 - METABOLISMO DE NUCLEOTÍDEOS............................................... 203 1 INTRODUÇÃO.................................................................................................... 203 2 BIOSSÍNTESE DE NUCLEOTÍDEOS................................................................. 203 2.1 A SÍNTESE DE NOVO DE NUCLEOTÍDEOS PÚRICOS................................................204 2.2 BASES PÚRICAS E PIRIMÍDICAS SÃO RECICLADAS POR VIAS DE SALVAÇÃO.207 RESUMO DO TÓPICO 5........................................................................................ 208 AUTOATIVIDADE................................................................................................. 209 REFERÊNCIAS...................................................................................................... 211 UNIDADE 1 - FUNDAMENTOS DE BIOQUÍMICA OBJETIVOS DE APRENDIZAGEM A partir do estudo desta unidade, você deverá ser capaz de: • compreender a lógica molecular da vida; • identificar as principais evidências para o surgimento da vida; • estabelecer as características que diferenciam os seres vivos dos inanimados; • compreender que cada organismo vivo tem uma função específica; • estabelecer os princípios da bioquímica para explicar a vida em termos químicos; • identificar que as macromoléculas são construídas a partir de compostos simples; • compreender como ocorre a produção de energia e o seu consumo no metabolismo; • refletir acerca da transferência da informação biológica. PLANO DE ESTUDOS Esta unidade está dividida em dois tópicos. No decorrer dela, você encontrará autoatividades com o objetivo de reforçar o conteúdo apresentado. TÓPICO 1 – A LÓGICA MOLECULAR DA VIDA TÓPICO 2 – CÉLULA EUCARIONTE E PROCARIONTE CHAMADA Preparado para ampliar seus conhecimentos? Respire e vamos em frente! Procure um ambiente que facilite a concentração, assim absorverá melhor as informações. 1 CONFIRA A TRILHA DA UNIDADE 1! Acesse o QR Code abaixo: 2 UNIDADE 1 TÓPICO 1 - A LÓGICA MOLECULAR DA VIDA 1 INTRODUÇÃO Há mais de três bilhões e meio de anos, sob condições não inteiramente claras, elementos com carbono, hidrogênio, oxigênio, nitrogênio, enxofre e fósforo formaram compostos químicos simples. Esses compostos simples foram chamados de coacervados e representaram a primeira forma proteica descrita. Eles combinaramse, dispersaram-se e recombinaram-se, formando várias moléculas maiores, até surgir uma combinação capaz de se autorreplicar (NELSON; COX, 2002). Essas macromoléculas consistiram de moléculas mais simples, unidas por ligações químicas. Com a contínua evolução e a formação de moléculas ainda mais complexas, o meio aquoso ao redor de muitas dessas moléculas autorreplicativas foi envolto por uma membrana lipídica. Esse desenvolvimento proporcionou a essas estruturas primordiais a capacidade de controlar, num certo grau, seu próprio meio. Uma forma de vida tinha se desenvolvido e a unidade básica da vida, a célula, tinha se estabelecido. Com o passar do tempo, diversas células se desenvolveram e tanto a química quanto a estrutura dessas células tornaram-se mais complexas. Elas conseguiram extrair nutrientes do meio, converter quimicamente esses nutrientes em fonte de energia ou em moléculas mais complexas, controlar os processos químicos que catalisavam e fazer replicação celular. Deste modo, a vasta diversidade de vida hoje observada começou. A célula é a unidade básica da vida em todas as formas de organismos vivos, da menor célula bacteriana ao mais complexo animal multicelular (NELSON; COX, 2002, p. 1). Admite-se que o processo que originou as primeiras células começou na Terra a aproximadamente 4,6 bilhões de anos, na então chamada Terra Primitiva. Naquela época, a atmosfera continha muito vapor d’água, amônia, metano, hidrogênio e gás carbônico. Existia uma atividade vulcânica intensa e as tempestades com descargas elétricas eram frequentes. Há 4 bilhões de anos, a superfície da Terra estaria coberta por grande quantidade de água, disposta em grandes “oceanos” e “lagos”. Essa massa líquida, chamada de caldo primordial, era rica em moléculas inorgânicas e continha em solução os gases que constituíam a atmosfera (JUNQUEIRA; CARNEIRO, 2007). Sob a ação do calor e da radiação ultravioleta, vindos do Sol, e de descargas elétricas, oriundas das tempestades, as moléculas dissolvidas no caldo primordial combinaram-se quimicamente para constituírem os primeiros compostos contendo carbono. Substâncias relativamente complexas, como proteínas e ácidos nucleicos, teriam aparecido espontaneamente ao acaso. 3 NOTA Curiosidade: A atmosfera terrestre também sofreu mudanças significativas. Contudo, não existe um acordo sobre a constituição da atmosfera da época. Acredita-se que ela se apresentava ora mais ou menos redutora, de acordo com os estudos realizados na composição das nuvens de poeira estelar, meteoritos e de gases retidos em rochas antigas. 2 A UNIDADE QUÍMICA DOS DIFERENTES ORGANISMOS VIVOS O que distingue os organismos vivos dos objetos inanimados se as moléculas que constituem as células são formadas pelos mesmos átomos encontrados nesses seres (inanimados)? Primeiro, é o seu grau de complexidade química e de organização. Eles possuem estruturas celulares internas intrincadas (Figura 1) e contêm muitas espécies de moléculas complexas. Em contraste, a matéria inanimada existente ao nosso meio – terra, areia, rochas, água do mar – usualmente consiste de misturas de compostos químicos relativamente simples (NELSON; COX, 2002). FIGURA 1 – VISTO AO MICROSCÓPIO ELETRÔNICO, ESSE PEDAÇO DE TECIDO MUSCULAR DE VERTEBRADO EVIDENCIA SUA COMPLEXIDADE E ORGANIZAÇÃO FONTE: A autora Segundo, os organismos vivos extraem, transformam e usam a energia que encontram no meio ambiente (Figura 2), habitualmente na forma de nutrientes químicos ou de energia radiante da luz solar. Essa energia torna os organismos vivos capazes de construir e manter suas próprias estruturas intrincadas e de realizar trabalhos mecânico, químico, osmótico e de vários outros tipos. Em contraste, a matéria inanimada não usa energia de forma sistemática para manter a sua estrutura ou para realizar trabalho. A matéria inanimada tende a se degenerar em um estado mais desordenado, alcançando um equilíbrio com o seu meio ambiente (NELSON; COX, 2002). 4 FIGURA 2 – A ÁGUIA ADQUIRE NUTRIENTES NO MEIO AMBIENTE PELA INGESTÃO DE PRESAS MENORES FONTE: <http://g1.globo.com/planeta-bizarro/noticia/2014/01/fotografo-flagra-aguia-capturando-peixe-em-rio-nos-eua.html>. Acesso em: 11 jul. 2019. O terceiro, e mais característico atributo dos organismos vivos, é a capacidade para a autorreplicação e automontagem, propriedades que podem ser vistas como a quinta essência do estado vivo (Figura 3). Uma única célula bacteriana de Escherichia coli, por exemplo, colocada num meio nutriente estéril pode dar origem, a cada 20 minutos, à outra célula bacteriana idêntica à célula-mãe, com as mesmas características genéticas. Cada uma das células contém milhares de moléculas diferentes, algumas extremamente complexas; mesmo assim, cada bactéria é uma cópia fiel da original, constituída inteiramente a partir da informação contida no interior do material genético da célula original (NELSON; COX, 2002). FIGURA 3 – A REPRODUÇÃO BIOLÓGICA OCORRE COM FIDELIDADE PRÓXIMA À PERFEIÇÃO FONTE: <pt.depositphotos.com/27718179/>. Acesso em: 13 mar. 2019. Erwin Schodinger propôs, em seu ensaio O que é a vida?, que o material genético das células deveria ter as propriedades de um cristal. Esse ensaio de Schrodinger é de 1944 (anos antes do atual entendimento da estrutura do gene ter sido estabelecido), mas descreve de forma acurada muitas das propriedades do ácido desoxirribonucleico, o material dos genes. 5 FIGURA 4 – ERWIN SCHODINGER (1887-1961) FONTE: <https://www.nobelprize.org/prizes/physics/1933/schrodinger/biographical/>. Acesso em:11 jul. 2019. Cada componente de um organismo vivo tem uma função específica. Isso é verdade não somente para as estruturas macroscópicas, como folhas e caules ou corações e pulmões, mas também para as estruturas intracelulares microscópicas, como os núcleos e os cloroplastos. Até mesmo os compostos químicos individuais, existentes nas células, têm funções específicas. O inter-relacionamento entre os componentes químicos de um organismo vivo é dinâmico; alterações em um componente provocam mudanças coordenadas ou compensatórias em outro, tendo como resultado o conjunto exibindo características que vão além daquelas exibidas pelos constituintes individuais. A coleção de moléculas executa um programa cujo resultado é a reprodução do programa e a autoperpetuação daquela coleção de moléculas, em suma, vida (NELSON; COX, 2002). 2.1 A BIOQUÍMICA PROCURA EXPLICAR A VIDA EM TERMOS QUÍMICOS Se os organismos vivos são compostos de moléculas intrinsecamente inanimadas, como podem essas moléculas exibir a extraordinária combinação de características que chamamos de vida? Como pode ser que um organismo vivo pareça ser mais do que a soma de suas partes inanimadas? Os filósofos, uma vez, responderam que os organismos vivos são dotados de uma força vital divina e misteriosa, mas essa doutrina (vitalismo) tem sido firmemente rejeitada pela ciência moderna. O objetivo básico da ciência bioquímica é mostrar como as moléculas, que constituem os organismos vivos, interagem entre si para manter e perpetuar a vida exclusivamente pelas leis químicas que governam o universo não vivo (NELSON; COX, 2002). 6 Até o momento, pesquisas bioquímicas revelam que todos os organismos são notadamente semelhantes em níveis celular e químico. A Bioquímica descreve em termos moleculares as estruturas, os mecanismos e os processos químicos compartilhados por todos os organismos, e fornece os princípios organizacionais que fundamentam a vida em todas as suas diferentes formas, princípios esses que coletivamente serão referidos como a lógica molecular da vida. Embora a bioquímica produza importantes visões do conhecimento e das aplicações práticas em medicina, agricultura, nutrição e indústria, ela está, em última instância, preocupada e interessada na maravilha que a vida é em si mesma. FIGURA 5 – ORGANISMOS VIVOS DIFERENTES COMPARTILHAM CARACTERÍSTICAS QUÍMICAS IGUAIS FONTE: <http://shaareishalom.net.br/curso-temas-do-chumash-no3-no-jardim-do-eden>. Acesso em: 13 mar. 2019. Embora a vida seja fundamentalmente unitária, é importante reconhecer que pouquíssimas generalizações a respeito dos organismos vivos são absolutamente corretas para todos eles e sob quaisquer condições. A variação de hábitat nos quais os organismos vivem, desde fontes termais quentes até tundra ártica, de intestinos de animais a dormitórios de residências estudantis, é acompanhada por uma variação igualmente ampla de adaptações bioquímicas específicas. Essas adaptações são integradas em um padrão químico fundamental, compartilhado por todos os organismos. Embora as generalizações não sejam perfeitas, elas permanecem úteis. De fato, as exceções geralmente iluminam as generalizações científicas. 7 2.2 MACROMOLÉCULAS CONSTRUÍDAS A PARTIR DE COMPOSTOS SIMPLES A maioria dos constituintes moleculares dos sistemas vivos é composta de átomos de carbono unidos covalentemente a outros átomos de carbono e átomos de hidrogênio, oxigênio e nitrogênio. As propriedades especiais de ligação do carbono permitem a formação de uma grande variedade de moléculas. Para Nelson e Cox (2014), cada célula da bactéria Escherichia coli (E. coli) contém mais de 6.000 tipos diferentes de compostos orgânicos, incluindo perto de 3.000 proteínas diferentes e um número similar de moléculas de ácidos nucleicos e centenas de tipos de carboidratos e lipídios. Em humanos, pode haver dezenas de milhares de tipos diferentes de proteínas, assim como muitos tipos de polissacarídeos, uma grande variedade de lipídios e muitos outros compostos de peso molecular menor. Purificar e caracterizar exatamente todas essas moléculas seria um trabalho insuperável se não fosse o fato de cada classe de macromoléculas (proteínas, ácidos nucleicos, polissacarídeos) ser composta de um pequeno conjunto de subunidades monoméricas comuns. Essas subunidades monoméricas podem ser unidas covalentemente em uma variedade virtualmente ilimitada de sequências (Figura 6), exatamente como as 26 letras do alfabeto podem ser arranjadas em um número ilimitado de palavras, sentenças ou livros. FIGURA 6 – SUBUNIDADES MONOMÉRICAS EM SEQUÊNCIAS LINEARES PODEM EXPRESSAR MENSAGENS COMPLEXAS FONTE: <slideplayer.com.br/slide/384421/>. Acesso em: 15 mar. 2019. 8 Os ácidos desoxirribonucleicos (DNA) são formados por quatro tipos de unidades monoméricas simples, os nucleotídeos (timina, adenina, citosina e guanina), enquanto os ácidos ribonucleicos (RNA) são compostos por também quatro tipos de nucleotídeos, semelhantes aos do DNA, sendo a timina substituída pela uracila no RNA. As proteínas são constituídas por 20 tipos de aminoácidos (essenciais e não essenciais). Os oito tipos de nucleotídeos que os ácidos nucleicos são constituídos e os 20 tipos de aminoácidos que formam as proteínas são os mesmos em todos os organismos vivos. Os nucleotídeos são muito importantes como subunidades na constituição dos ácidos nucleicos, mas também exercem um importante papel como moléculas transportadoras de energia. Os aminoácidos, além de serem as subunidades que formam as proteínas, também são precursores de neurotransmissores, pigmentos e outros tipos de biomoléculas (RODWELL; MURRAY; GRANNER, 2017). 2.3 PRODUÇÃO DE ENERGIA E SEU CONSUMO NO METABOLISMO A energia é um tema central em bioquímica: as células e os organismos dependem de um suprimento constante de energia para poderem se opor à tendência, inexorável da natureza, de queda para níveis de estado energético (NELSON; COX, 2002). Todas as reações que acontecem a nível celular envolvem o fornecimento de energia, como por exemplo, as reações de síntese, a energia consumida no movimento de uma bactéria ou até mesmo no transporte ativo da bomba de sódio e potássio. As células desenvolveram, durante o processo evolutivo, mecanismos especializados para capturar a energia do sol ou também extrai-la de alimentos e transferi-la para os processos que dela necessitam. No curso da evolução biológica um dos primeiros desenvolvimentos deve ter sido o aparecimento de uma membrana lipídica que envolveu as moléculas hidrossolúveis da célula primitiva, separando-as do meio ambiente e permitindo que elas se acumulassem em concentrações relativamente altas. As moléculas e os íons contidos no interior dos organismos vivos diferem em tipo e em concentrações das existentes no meio ambiente. Por exemplo, as células de um peixe de água doce contêm certos íons inorgânicos em concentrações muito diferentes das da água em que vivem. Proteínas, ácidos nucleicos, açúcares e lipídios estão presentes no peixe, mas essencialmente ausentes no meio ambiente, o qual, por sua vez, contém átomos de carbono, hidrogênio e oxigênio em moléculas mais simples como o dióxido de carbono e a água. Quando o peixe morre, as substâncias que o compõe entram, finalmente, em equilíbrio com aquelas do meio ambiente (NELSON; COX, 2002, p. 6). 9 FIGURA 7 – OS ORGANISMOS VIVOS NÃO ESTÃO EM EQUILÍBRIO COM O MEIO AMBIENTE. A MORTE E A DECOMPOSIÇÃO RESTABELECEM O EQUILÍBRIO FONTE: Nelson e Cox (2002, p. 6) Para Nelson e Cox (2002), as células e os organismos precisam realizar trabalho para permanecerem vivos e para se reproduzirem. A síntese contínua de componentes celulares requer trabalho químico; o acúmulo e a retenção de sais e de vários compostos orgânicos contra um gradiente de concentração envolvem um trabalho osmótico; a contração de um músculo ou o movimento do flagelo de um espermatozoide representa trabalho mecânico. A taxa de conversão da energia química para mecânica durante a contração muscular é considerada um dos principais eventos fisiológicos determinantes do desempenho esportivo. Em linhas gerais, assume-se que durante os esforços de curta duração e com alta intensidade, a molécula de adenosina trifosfato (ATP) é ressintetizada, predominantemente, pela degradação da fosfocreatina e do glicogênio muscular, com subsequente formação de lactato (BERTUZZI et al., 2008). Na bioquímica, os processos pelos quais a energia é extraída, canalizada e consumida, envolvem os estudos da bioenergética – transformações ou trocas de energia das quais todos os organismos vivos dependem. A transformação da energia biológica obedece às leis da Termodinâmica. Mas quais são essas Leis? A Primeira Lei da Termodinâmica é conhecida como Princípio da Conservação da Energia. Para qualquer mudança física ou química, a quantidade total de energia no universo permanece constante. A energia pode até mudar de forma ou ser transportada, mas não pode ser destruída (RODWELL; MURRAY; GRANNER, 2017). 10 Os seres vivos usam energia para realização de trabalho mecânico, químico, osmótico ou elétrico e para a manutenção de sua organização, reprodução e interação com o meio. As células vivas se comportam como transdutores de energia, convertendo energia química em algo que seja necessário para a célula. A Segunda Lei é referente à desordem do universo. Segundo essa lei, a desordem sempre tende a aumentar, onde em todos os processos naturais a entropia (grau de desorganização) do universo sempre tende a aumentar. Os organismos vivos preservam sua organização interna retirando energia livre do ambiente e retornando a sua vizinhança energia na forma de calor, aumentando assim o número de moléculas (BERG; TYMOCZKO; STRYERT, 2015). Através de um conjunto de reações químicas produtoras ou consumidoras de energia, os organismos conseguem ter suas características ou funções preservadas. Para reações que ocorrem em solução, podemos definir um sistema como todos os reagentes e produtos, o solvente e a atmosfera próxima, ou seja, tudo o que está dentro de uma região definida do espaço. Juntos, o sistema e seus arredores constituem o universo. Se o sistema não trocar matéria nem energia com seus arredores, ele é dito fechado. Se o sistema trocar energia, mas não trocar matéria com seu meio, ele é dito sistema isolado; se trocar ambas, energia e matéria, com o meio, ele é um sistema aberto (NELSON; COX, 2002). Para Rodwell, Murray e Granner (2017 p. 23): Um organismo vivo é um sistema aberto, ele troca matéria e energia com seu meio. Organismos vivos usam duas estratégias para captar energia do seu meio: (1) eles obtêm combustíveis químicos da vizinhança e extraem a energia oxidando-os; ou (2) eles absorvem energia da luz solar. Organismos vivos criam e mantêm suas estruturas complexas e ordenadas usando energia extraída de combustíveis ou da luz solar. Praticamente todos os seres vivos obtêm energia, direta ou indiretamente, da energia radiante da luz solar, a qual se origina de reações de fusão termonuclear que foram o elemento hélio e que ocorrem no interior do Sol, conforme mostra a figura a seguir: FIGURA 8 – A LUZ SOLAR É FONTE ÚLTIMA DE TODA ENERGIA BIOLÓGICA, ATRAVÉS DAS REAÇÕES TERMONUCLEARES NO INTERIOR DO SOL FONTE: <https://brasilescola.uol.com.br/quimica/fusao-nuclear.htm>. Acesso em: 15 mar. 2019. 11 Para Berg (2014), as células fotossintéticas absorvem a energia radiante do Sol e a utilizam para retirar elétrons da molécula de água e adicioná-la à molécula de dióxido de carbono, formando produtos ricos em energia, como o amido e a sacarose. Quando promovem essas reações, a maioria dos organismos fotossintéticos liberam oxigênio molecular na atmosfera. Em última análise, os organismos que não executam a fotossíntese obtêm energia para suas necessidades pela oxidação dos produtos ricos em energia elaborados pela fotossíntese, passando elétrons para o oxigênio atmosférico e sintetizando água, dióxido de carbono e outros produtos, os quais são recicladas no meio ambiente. Virtualmente todos os transdutores de energia nas células podem ser relacionados ao fluxo de elétrons de uma molécula para outra na oxidação de combustíveis ou na captura de energia luminosa durante a fotossíntese. Esse fluxo de elétrons é “morro-abaixo”, quer dizer, de um potencial eletroquímico maior para outro menor; como tal, ele é formalmente análogo ao fluxo de elétrons em um circuito elétrico acionado por uma bateria. Todas essas reações que envolvem fluxos de elétrons são reações de oxirredução. Assim, emergem outros princípios característicos do estado vivo da matéria: (1) as necessidades energéticas de, virtualmente, todos os organismos são providos, direta ou indiretamente, da energia solar. (2) O fluxo de elétrons nas reações de oxirredução é a base da transdução e da conservação da energia nas células vivas. (3) todos os organismos vivos são interdependentes, trocando entre si energia e matéria por meio do meio ambiente (NELSON; COX, 2002, p. 15). O tema central em bioenergética é o modo pelo qual a energia do metabolismo de combustíveis ou de captura de luz é acoplada a reações que requerem energia. Considere um exemplo mecânico simples de acoplamento de energia mostrado na Figura 9. Um objeto no alto de um plano inclinado tem certa quantidade de energia potencial devido a sua altura. Esse objeto tende a deslizar para baixo espontaneamente, perdendo a sua energia potencial de posição na medida em que se aproxima do solo. Quando um instrumento apropriado, constituído de correios e polias, é ligado ao objeto, o movimento espontâneo para baixo pode realizar certa quantidade de trabalho, quantidade esta nunca maior que a variação da energia potencial de posição. A quantidade de energia realmente disponível para a realização de trabalho, chamada de energia livre, G, será sempre um pouco menor que a variação total em energia, porque uma parte dela é dissipada como calor de fricção (BERG, 2014). 12 FIGURA 9 – ACOPLAMENTO DE ENERGIA EM PROCESSOS MECÂNICOS FONTE: Nelson e Cox (2002, p. 8) Reações químicas podem ser acopladas assim que uma reação liberadora de energia promove uma reação que requer energia. Reações químicas em sistemas fechados ocorrem espontaneamente até que o equilíbrio seja alcançado. Quando um sistema está em equilíbrio, a velocidade de formação do produto é exatamente igual à velocidade na qual o produto é convertido para reagente. Portanto, não existe nenhuma variação líquida nas concentrações de reagentes e produtos, e um “estado estacionário” é alcançado. Existem reações exergônicas e endergônicas. As reações exergônicas ocorrem quando há uma diminuição da energia livre e os produtos são expressos em valores negativos. As reações endergônicas requerem uma quantidade de energia e seus valores na variação de energia livre são positivos. Nelson e Cox (2002) relatam que, nos processos mecânicos, somente parte da energia liberada nas reações bioquímicas exergônicas pode ser usada para executar trabalho. Nos sistemas vivos, parte da energia dissipada como calor ou perdida são necessárias para aumentar a entropia. NOTA VOCÊ SABIA? O termo “entropia”, que literalmente significa “mudança em seu interior”, foi usado pela primeira vez em 1851 por Rudolf Clausius, um dos formuladores da Segunda Lei da Termodinâmica. Uma definição quantitativa rigorosa de entropia envolve considerações probabilísticas e estatísticas. Entretanto, sua natureza pode ser ilustrada qualitativamente por três exemplos simples, cada um demonstrando um aspecto da entropia. A chave para a descrição de entropia é a aleatoriedade e a desordem, manifestadas em diferentes maneiras. 13 Segundo Berg (2014), o acoplamento de reações endergônicas com aquelas exergônicas é absolutamente central para trocas de energia nos sistemas vivos. O mecanismo pelo qual o acoplamento de energia ocorre nas reações biológicas é via um intermediário compartilhado. Por exemplo, a quebra de adenosina trifosfato (ATP) é a reação exergônica, que dirige muitos processos endergônicos, nas células. De fato, ATP (Figura 10) é o maior transportador de energia química em todas as células, acoplando processos endergônicos àqueles exergônicos O grupo fosfato terminal do ATP é transferido para uma variedade de moléculas receptoras, que são ativadas para favorecer transformações químicas. Adenosina difosfato (ADP) é reciclado (fosforilado) para ATP, à custa de energia química (durante oxidação dos combustíveis) ou da luz solar (na fotossíntese celular). FIGURA 10 – ADENOSINA TRIFOSFATO (ATP). A REMOÇÃO DO GRUPO FOSFATO TERMINAL DO ATP É ALTAMENTE EXERGÔNICA E ESTA REAÇÃO É ACOPLADA A MUITAS REAÇÕES ENDERGÔNICAS NA CÉLULA FONTE: <https://www.infoescola.com/bioquimica/adenosina-trifosfato-atp/>. Acesso em: 16 mar. 2019. O fato de uma reação ser exergônica não significa que ela necessariamente se processará de forma rápida. O caminho que vai do reagente ao produto quase invariavelmente envolve uma barreira energética, chamada barreira de ativação (Figura 11), a qual precisa ser superada para que qualquer reação ocorra. A quebra e síntese de ligações geralmente requerem tensionamento e a torção das ligações existentes, criando um estado de transição de alto nível de energia livre, tanto em relação ao reagente quanto ao produto. O ponto mais alto da coordenada da reação, no diagrama, representa o estado de transição (NELSON; COX, 2014). 14 FIGURA 11 – CURSO DE UMA REAÇÃO QUÍMICA DO PONTO DE VISTA ENERGÉTICO FONTE: Nelson e Cox (2014, p. 15) No interior das células, todas as reações químicas ocorrem devido à presença de enzimas – catalisadores biológicos que aumentam a velocidade das reações químicas. As enzimas como catalisadores agem diminuindo a barreira de ativação entre o reagente e o produto. FIGURA 12 – UMA ENZIMA AUMENTA A VELOCIDADE DE UMA REAÇÃO QUÍMICA ESPECÍFICA FONTE: <https://www.vestibulandoweb.com.br/biologia/enzimas.asp>. Acesso em: 19 mar. 2019. As enzimas são proteínas, com exceção da ribozima, uma enzima presente no RNA, cuja constituição não é proteica. Cada proteína enzimática é específica para a catálise de uma determinada reação, e cada reação no interior da célula é catalisada por uma enzima diferente. Cada célula requer, portanto, milhares de tipos diferentes de enzimas. A multiplicidade de enzimas, a sua alta especificidade para os reagentes e a sua suscetibilidade à regulação dão às células a capacidade de diminuir as barreiras de ativação seletivamente (BERG, 2014). 15 Nelson e Cox (2002, p. 10) relatam que: Milhares reações químicas enzimaticamente catalisadas nas células são funcionalmente organizadas em muitas sequências diferentes de reações consecutivas chamadas vias, nas quais o produto de uma reação se torna o reagente para a próxima. Algumas dessas sequências de reações enzimaticamente catalisadas degradam nutrientes orgânicos em produtos finais simples, de forma a extrair energia química e convertê-la em uma forma utilizável pela célula. Juntos esses processos degradativos liberadores de energia livre são designados de catabolismo. Outras vias enzimaticamente catalisadas partem de moléculas precursoras pequenas e as convertem, progressivamente, em moléculas maiores e mais complexas, incluindo proteínas e ácidos nucleicos. Essas vias sintéticas requerem invariavelmente a adição de energia, e quando consideradas em conjunto representam o anabolismo. Esse conjunto de vias imbricadas e enzimaticamente catalisadas constitui o que chamamos de metabolismo. O ATP é transportador universal de energia metabólica e une o catabolismo e o anabolismo. As células vivas não só podem sintetizar simultaneamente milhares de tipos diferentes de moléculas de carboidratos, lipídios, proteínas e ácidos nucleicos e suas subunidades mais simples, mas também podem fazê-lo nas proporções requeridas pela célula (NELSON; COX, 2014). Por exemplo, quando ocorre uma rápida multiplicação celular, os precursores de proteínas e ácidos nucleicos precisam ser sintetizados em grandes quantidades, enquanto as necessidades desses precursores para células que estão em repouso são muito reduzidas (BAYNES, 2015). As enzimas-chave em cada via metabólica são reguladas de tal forma que cada tipo de molécula precursora é produzido em quantidades apropriadas às necessidades das células (BERG; TYMOCZKO; STRYERT, 2015). Na Figura 13, observamos a síntese de isoleucina (um dos aminoácidos, as subunidades monoméricas das proteínas). Se a célula começar a produzir mais isoleucina do que o necessário para a síntese proteica, a isoleucina não utilizada se acumula, dessa forma, altas concentrações de isoleucina inibem a atividade catalítica da primeira enzima na via, diminuindo, imediatamente, a produção desse aminoácido. Essa retroalimentação (feedback) negativa mantém em equilíbrio a produção e a utilização de cada intermediário metabólico (NELSON; COX, 2002). FIGURA 13 – INIBIÇÃO RETROATIVA FONTE: Nelson e Cox (2002, p. 10) 16 Apesar de o conceito de rota discreta ser uma ferramenta importante para organizar o conhecimento do metabolismo, ele é muito simplificado. Existem milhares de metabólitos intermediários na célula, muitos dos quais fazem parte de mais de uma rota. O metabolismo seria mais bem representado por uma rede de rotas interconectadas e interdependentes. A mudança na concentração de qualquer metabólito dá início a um efeito de ondulação, influenciando o fluxo de materiais pelas outras rotas (NELSON; COX, 2014). A tarefa de compreender essas complexas interações entre intermediários e rotas em termos quantitativos é desencorajadora, mas a nova ênfase em biologia de sistemas começou a oferecer uma importante compreensão da regulação global do metabolismo (MARZZOCO; TORRES, 2007). As células regulam também a síntese de seus próprios catalisadores, as enzimas, em resposta ao aumento ou à diminuição da necessidade de um produto metabólito. A expressão de genes (a tradução da informação contida no DNA em proteínas ativas na célula) e a síntese de enzimas são outros níveis de controle metabólico na célula. Todos os níveis devem ser levados em conta na descrição do controle global do metabolismo celular (NELSON; COX, 2014). 2.4 TRANSFERÊNCIA DA INFORMAÇÃO BIOLÓGICA Talvez a propriedade mais marcante dos organismos e das células vivas seja sua capacidade de se reproduzir por incontáveis gerações com fidelidade quase perfeita. Essa continuidade de traços herdados sugere constância, ao longo de milhões de anos, na estrutura das moléculas que contêm a informação genética. Poucos registros históricos de civilizações sobreviveram por mil anos mesmo quando riscados em superfícies de cobre ou talhados em pedra (Figura 14). Contudo, existem boas evidências de que as instruções genéticas permaneceram praticamente intactas nos organismos vivos por períodos muito maiores; muitas bactérias têm praticamente o mesmo tamanho, forma e estrutura interna, apresentando também o mesmo tipo de moléculas precursoras e enzimas das bactérias que viveram há cerca de quatro bilhões de anos (NELSON; COX, 2014). Essa continuidade da estrutura e da composição é o resultado da continuidade da estrutura do material genético. 17 FIGURA 14 – DOIS REGISTROS MUITO ANTIGOS. (A) O PRISMA DE SENNACHERIB; (B) UMA ÚNICA MOLÉCULA DE DNA DA BACTÉRIA E. COLI, EXTRAVASANDO DE UMA CÉLULA ROMPIDA FONTE: Nelson e Cox (2014, p. 30) NOTA Sobre a Figura 14 – Dois registros muito antigos. (a) o prisma de Sennacherib, inscrito em torno de 700 a.c., descreve em caracteres da linguagem assíria alguns eventos históricos durante o reinado de Sennacherib. (b) uma única molécula de DNA da bactéria e. coli, extravasando de uma célula rompida. o DNA bacteriano contém cerca de 5 milhões de caracteres. Entre as descobertas mais notáveis da biologia no século XX está a natureza química e a estrutura tridimensional do material genético, ácido desoxirribonucleico, DNA. A sequência de subunidades monoméricas, os nucleotídeos (composto por bases nitrogenadas, pentose e um grupo fosfato), codifica as instruções para formar todos os outros componentes celulares e fornece o molde para a produção de moléculas de DNA idênticas a serem distribuídas aos descendentes por ocasião da divisão celular. Segundo Marzzoco e Torres (2007), a perpetuação de uma espécie biológica requer que sua informação genética seja mantida de modo estável, expressa com exatidão na forma de produtos dos genes e reproduzida com o mínimo de erros. O armazenamento, a expressão e a reprodução efetivas da mensagem genética definem espécies individuais, distinguem umas das outras e asseguram a sua continuidade em sucessivas gerações. O DNA é um polímero orgânico, fino e longo, em forma de hélice; a rara molécula que é construída na escala atômica em uma dimensão (largura) na escala humana em outra (comprimento: uma molécula de DNA pode ter vários centímetros de comprimento). Um esperma ou ovócito humano, carregando a informação hereditária acumulada em 18 bilhões de anos de evolução, transmite essa herança na forma de moléculas de DNA, nas quais a sequência linear de subunidades de nucleotídeos, ligados covalentemente, codifica a mensagem genética (NELSON; COX, 2002). Normalmente quando são descritas as propriedades de espécies químicas, é descrito o comportamento médio de um número muito grande de moléculas idênticas. Embora seja difícil prever o comportamento de uma única molécula em uma população, por exemplo, de um picomol de compostos (cerca de 6 3 1011 moléculas), o comportamento médio das moléculas é previsível porque muitas delas entram no cálculo da média. O DNA celular é uma notável exceção. O DNA que forma todo o material genético da E. coli é uma única molécula contendo 4,64 milhões de pares de nucleotídeos. Essa única molécula tem de ser replicada com perfeição nos mínimos detalhes para que uma célula de E. coli possa gerar descendentes idênticos por divisão celular; não existe espaço para tomar médias nesse processo! O mesmo vale para todas as células. O esperma humano traz para o óvulo que ele fertiliza somente uma molécula de DNA de cada um dos 23 cromossomos, para se combinar com somente uma molécula de cada cromossomo correspondente no óvulo. O resultado dessa união é altamente previsível: um embrião com todos os seus 25.000 genes, feitos de 3 bilhões de pares de nucleotídeos, intactos. Um feito químico impressionante! (NELSON; COX, 2014, p. 60). Sackheim (2001) relata em sua obra Química e bioquímica para ciências biomédicas que uma única página deste livro contém cerca de 5.000 caracteres, de tal forma que o livro inteiro contém 5 milhões de caracteres. O cromossomo da E. coli também contém 5 milhões de caracteres (pares de nucleotídeos). Se você fizer uma cópia manual deste livro e, então, passá-lo a um colega de classe para também fazer uma cópia manual, e se essa cópia for passada para um terceiro colega de classe para fazer a terceira cópia da cópia, e assim por diante, quanto cada cópia vai se assemelhar com o livro original? Agora, imagine o texto que resultaria ao se fazer cópias de cópias à mão alguns trilhões de vezes! A capacidade dos seres vivos de preservar seu material genético e duplicálo para a próxima geração resulta da complementaridade entre as duas fitas da molécula de DNA (Figura 15). A unidade básica do DNA é um polímero linear de quatro subunidades monoméricas diferentes, desoxirribonucleotídeos, arranjados em uma sequência linear precisa. Essa sequência linear codifica a informação genética. Duas dessas fitas poliméricas estão torcidas uma em torno da outra, formando a dupla-hélice de DNA, na qual cada desoxirribonucleotídeo em uma fita, pareia especificamente com um desoxirribonucleotídeo complementar na fita oposta. Antes de a célula se dividir, as duas fitas de DNA se separam uma da outra e cada uma serve de molde para a síntese de uma nova fita complementar, gerando duas moléculas em forma de dupla-hélice idênticas, uma para cada célula-filha. Se qualquer uma das fitas é danificada, então a continuidade da informação é assegurada pela informação presente na fita oposta, que pode atuar como molde para reparar o dano (GRIFFITHS, 2016). 19 FIGURA 15 – COMPLEMENTARIDADE ENTRE AS DUAS FITAS DE DNA FONTE: Nelson e Cox (2014, p. 31) ATENÇÃO Referente à Figura 15, o DNA é um polímero linear de quatro tipos de desoxirribonucleotídeos, ligados covalentemente: desoxiadenilato (A), desoxiguanilato (G), desoxicitidilato (C), desoxitimidilato (T). A informação no DNA é codificada na sequência linear (unidimensional) de subunidades de desoxirribonucleotídeos, mas a expressão dessa informação resulta em uma célula tridimensional. Essa transformação da informação de uma dimensão para três dimensões ocorre em duas fases (NELSON; COX, 2014). Uma sequência linear de desoxirribonucleotídeos no DNA codifica (por meio de um intermediário, RNA) a produção de uma proteína com a sequência linear de aminoácidos correspondente (Figura 16). A proteína é enovelada em uma forma tridimensional particular determinada pela sua sequência de aminoácidos e estabilizada principalmente por interações não covalentes. Embora a forma final da proteína enovelada seja ditada pela sua sequência 20 de aminoácidos, o processo de enovelamento é assistido por “chaperonas moleculares”. A estrutura tridimensional precisa ou conformação nativa de uma proteína é crucial para sua função. FIGURA 16 – DO DNA AO RNA, DO RNA À PROTEÍNA E DA PROTEÍNA À ENZIMA (HEXOCINASE) FONTE: Nelson e Cox (2014, p. 31) As chaperonas (do francês chaperon, “dama de companhia”) são proteínas importantes para auxiliar no enovelamento proteico, fazendo com que as proteínas atinjam a configuração terciária correta. Se por alguma situação (disfunção, defeito genético) essas proteínas não conseguirem atingir a configuração correta, as chaperonas encaminham essas proteínas para a destruição (NELSON; COX, 2014). Uma vez em sua conformação nativa, a proteína pode associar-se não covalentemente com outras macromoléculas (outras proteínas, ácidos nucleicos, carboidratos ou lipídios) para formar complexos supramoleculares, como cromossomos, ribossomos e membranas. As moléculas individuais desses complexos têm sítios de ligação para cada uma com alta afinidade específica, e dentro das células elas se agrupam espontaneamente em complexos funcionais (BERG, 2014). 21 Apesar de as sequências de aminoácidos das proteínas carregarem toda a informação necessária para alcançar a conformação nativa da proteína, o enovelamento preciso e a automontagem também requerem o ambiente celular correto – pH, força iônica, concentrações de íons metálicos, e assim por diante. Portanto, a sequência de DNA sozinha não é suficiente para formar e manter uma célula completamente funcional (NELSON; COX, 2014). 22 RESUMO DO TÓPICO 1 Neste tópico, você adquiriu certos aprendizados, como: • Todas as células são delimitadas por uma membrana plasmática; têm um citosol contendo metabólitos, coenzimas, íons inorgânicos e enzimas; e têm um conjunto de genes contidos dentro de um nucleoide (bactérias e arqueas) ou de um núcleo (eucariotos). • Todos os organismos requerem uma fonte de energia para realizar o trabalho celular. • Os fototróficos obtêm energia da luz solar; os quimiotróficos oxidam combustíveis químicos, transferindo elétrons para bons aceptores: compostos inorgânicos, compostos orgânicos ou oxigênio molecular. • As células de bactérias e de arqueas contêm citosol, nucleoide e plasmídeos, todos contidos dentro de um envelope celular. • As células eucarióticas possuem um núcleo delimitado por uma membrana – a membrana nuclear. • Todas as macromoléculas são construídas a partir de compostos simples. • Os organismos vivos dependem da bioenergética (transformações ou trocas de energia). • Os organismos transformam energia e matéria do meio ambiente. • O fluxo de elétrons fornece energia para os organismos. • As enzimas são catalisadores biológicos que promovem reações químicas em cadeia. • A continuidade genética é atribuída às moléculas de DNA. • A estrutura do DNA permite seu reparo e sua replicação com fidelidade quase perfeita. 23 AUTOATIVIDADE 1 Faça um desenho esquemático evidenciando as características da Terra Primitiva e o aparecimento das primeiras biomoléculas – coacervados. 2 A hidrólise de ATP é uma reação altamente: a) b) c) d) e) ( ( ( ( ( ) Endergônica. ) Aeróbia. ) Volátil. ) Exergônica. ) Aleatória. 3 As reações metabólicas podem ser classificadas em dois processos metabólicos. Explique esses processos e evidencie qual deles leva à síntese de biomoléculas. 24 UNIDADE 1 TÓPICO 2 - CÉLULA EUCARIONTE E PROCARIONTE 1 INTRODUÇÃO O universo se formou, de acordo com os dados geológicos mais aceitos atualmente, há cerca de um pouco mais de 14 bilhões de anos, e a Terra há cerca de 4,5 bilhões de anos, a partir de sedimentos provenientes de material oriundo das estrelas. Foi necessário que a Terra sofresse mudanças que favorecessem o surgimento da vida como conhecemos (MAYWORM, 2014). A unidade e a diversidade dos organismos se tornam aparentes mesmo em nível celular. Os menores organismos consistem em células isoladas e são microscópicos. Os organismos multicelulares maiores têm muitos tipos celulares diferentes (geralmente derivados de células mesenquimais), os quais variam em tamanho, forma e função especializada. Apesar dessas diferenças óbvias, todas as células dos organismos, desde o mais simples ao mais complexo, compartilham determinadas propriedades fundamentais, que podem ser vistas em nível bioquímico e microscópio, como por exemplo, a superfície celular (membrana plasmática), que é essencial para todas as formas de célula. 2 COMPARTIMENTOS CELULARES Células de todos os tipos compartilham algumas características estruturais comuns (Figura 17). A membrana plasmática define o contorno da célula, impede o extravasamento do citoplasma, separando seu conteúdo do ambiente. Ela é composta por uma dupla camada de lipídios e proteínas que formam uma barreira fina, resistente, flexível. A membrana plasmática é considerada uma estrutura anfipática, ou seja, possui uma região hidrofílica (com afinidade pela água) e outra região hidrofóbica (com fobia pela água). Geralmente a região hidrofílica (polar) é a cabeça dos fosfolipídios, enquanto a região hidrofóbica é representada pela causa dos fosfolipídios. Isso acaba conferindo à membrana plasmática das células um aspecto de mosaico fluido, em que as cabeças dos fosfolipídios permitem a entrada e saída de água na célula, ao passo que as caudas repelem essa água. A membrana é uma barreira para a passagem livre de íons inorgânicos e para a maioria de outros compostos carregados ou polares. Proteínas de transporte na membrana plasmática permitem a passagem de determinados íons e moléculas; proteínas receptoras transmitem sinais para o interior da célula; e enzimas de membrana participam em algumas rotas de reações. Como os lipídios individuais 25 e as proteínas da membrana não estão covalentemente ligados, toda a estrutura é extraordinariamente flexível, permitindo mudanças na forma e no tamanho da célula. À medida que a célula cresce, novas moléculas de proteínas e de lipídios são inseridas na membrana plasmática; a divisão celular produz duas células, cada qual com sua própria membrana. O crescimento e a divisão celular (fissão) ocorrem sem perda da integridade da membrana. Ainda devemos destacar que as proteínas presentes na membrana plasmática são classificadas em periféricas e integrais (transmembrana). As proteínas periféricas estão relacionadas com a integração entre as outras proteínas de membrana, não ficando realmente claras suas funções, enquanto as proteínas integrais ou transmembrana são as responsáveis pelo reconhecimento, transporte de substâncias através da membrana e receptores para hormônios, enzimas. Existem especializações de Membrana Plasmática muito importantes para o desempenho de funções específicas nas células. As especializações da superfície livre da membrana envolvem: cílios, estereocílios, microvilosidades e flagelos. Os cílios presentes na traqueia, por exemplo, têm como função filtrar partículas que entram com o ar inspirado, como também expelir as secreções produzidas pelas células caliciformes. Os estereocílios estão presentes no epidídimo e aumentam a superfície de contato do espermatozoide com a glândula, visto que os espermatozoides recebem nutrientes importantes no epidídimo. As microvilosidades aumentam a superfície de contato dos nutrientes no intestino delgado, facilitando sua absorção, enquanto os flagelos realizam movimentos para conduzir o espermatozoide até o ovócito (ALBERTS et al., 1997). FIGURA 17 – AS CARACTERÍSTICAS UNIVERSAIS DAS CÉLULAS VIVAS FONTE: <www.sobiologia.com.br/conteudos/Citologia2/nucleo.php>. Acesso em: 19 mar. 2019. 26 ATENÇÃO Referente à Figura 17: Células eucariontes possuem um núcleo delimitado por um envoltório nuclear, enquanto nas células procariontes o material genético encontra-se disperso no citoplasma. NOTA Curiosidade: Você já ouviu falar em fibrose cística? A fibrose cística é uma doença genética que compromete o funcionamento das glândulas exócrinas que produzem muco, suor ou enzimas pancreáticas. O excesso de muco nos alvéolos respiratórios dificulta a hematose (trocas gasosas) (Figura 18). Essa patologia é resultado de uma alteração na proteína transmembrana presente na membrana plasmática das células respiratórias e do sistema digestório. Essa patologia é diagnosticada no teste do pezinho. FIGURA 18 – FIBROSE CÍSTICA FONTE: <https://www.hc.unicamp.br/node/1101>. Acesso em: 20 mar. 2019. O volume interno envolto pela membrana plasmática, o citoplasma, é composto por uma solução aquosa, o citosol, e uma grande variedade de partículas em suspensão com funções específicas. Esses componentes particulados (organelas envoltas por membrana como mitocôndria e cloroplastos; estruturas supramoleculares como ribossomos e proteossomos, os sítios de síntese e degradação das proteínas) sedimentam-se quando o citoplasma é centrifugado a 150.000 g (g é aceleração da gravidade na superfície terrestre). 27 O que sobra como fluido sobrenadante é o citosol, solução aquosa altamente concentrada que contém enzimas e as moléculas de RNA que as codificam; os componentes (aminoácidos e nucleotídeos) que formam essas macromoléculas; centenas de moléculas orgânicas pequenas chamadas de metabólitos, intermediários em rotas biossintéticas e degradativas; coenzimas, compostos essenciais em muitas reações catalisadas por enzimas; e íons inorgânicos (NELSON; COX, 2002). O citoplasma também possui um citoesqueleto (Figura 19), que dá forma para a célula e está relacionado com as funções que esta célula desempenha no organismo. O citoesqueleto é constituído por filamentos de actina, filamentos intermediários e microtúbulos. Os filamentos de actina, como o próprio nome lembra, é formado pela união de várias proteínas contrácteis actina e geralmente encontra-se revestindo a periferia das células. Ele é responsável pela movimentação celular, fagocitose, dá forma e sustentação para as microvilosidades e na fase de telófase, do ciclo celular, separar as células recém-formadas. Os filamentos intermediários possuem uma constituição proteica mais variada, pois estão presentes em células de diferentes tecidos. Se presentes no tecido epitelial, teremos como proteínas a queratina; se presentes na lâmina nuclear, teremos como proteína a lamina. São muito importantes para a função estrutural, ou seja, eles fornecem resistência mecânica para as células. Já os microtúbulos são constituídos pela proteína tubulina e criam uma rede de trilhos sob os quais vesículas e organelas celulares podem se locomover. Os microtúbulos também são responsáveis por organizar as organelas dentro da célula, formar o fuso mitótico e estão presentes na composição de cílios e flagelos. Uma importante observação, quando falamos de citoesqueleto, é a formação do citoesqueleto das hemácias. As hemácias ou eritrócitos são células que necessitam de muita flexibilidade, pois devem passar dos vasos mais calibrosos e chegar até os capilares sanguíneos. Para garantir essa flexibilidade, o citoesqueleto das hemácias apresenta três importantes proteínas: aducina, anquirina e espectrina. 28 FIGURA 19 – CONSTITUIÇÃO DO CITOESQUELETO DAS CÉLULAS EUCARIONTES. OBSERVAR A DISPOSIÇÃO DOS FILAMENTOS INTERMEDIÁRIOS, DOS MICROTÚBULOS E DOS FILAMENTOS DE ACTINA FONTE: Junqueira e Carneiro (2007, p. 96) Segundo Nelson e Cox (2014), todas as células eucariontes têm, pelo menos em algum momento de sua vida, um nucleoide ou núcleo, em que o genoma – o conjunto completo de genes composto por DNA – é replicado e armazenado com suas proteínas associadas. O núcleo tem como função comandar e controlar todas as atividades da célula. Poderíamos fazer uma analogia entre o núcleo das células e a CPU de um computador, em que nas células, o núcleo define todas as atividades celulares, e no computador, a CPU é a unidade central de processamento. Em bactérias e em arqueas, o nucleoide não é separado do citoplasma por uma membrana; o núcleo, nos eucariotos, é confinado dentro de uma dupla membrana, o envelope nuclear. As células com envelope nuclear compõem o grande domínio dos Eukarya (do grego eu, “verdade”, e karyon, “núcleo”). Os microrganismos sem membrana nuclear, antes classificados como procariontes (do grego pro, “antes”), são agora reconhecidos como pertencentes a dois grupos muito distintos: Bacteria e Archaea. O núcleo é composto por estruturas muito importantes, como membrana nuclear interna e externa, espaço perinuclear, poros nucleares, lâmina nuclear, nucleoplasma, cromática e nucléolo. Cada uma dessas estruturas desempenha um papel importante para o equilíbrio e bom funcionamento celular. Em geral, o núcleo é único, arredondado, centralizado ou pode ser desviado do centro celular, tornando-se periférico. 29 FIGURA 20 – A) NÚCLEOS PERIFÉRICOS EM CÉLULAS MUSCULARES ESTRIADAS ESQUELÉTICAS. B) NÚCLEO CENTRALIZADO EM UM CORPO CELULAR DE NEURÔNIO A B FONTE: A autora Como citado anteriormente, o núcleo possui vários componentes. Esses componentes são de fundamental importância para que ele desempenhe com eficácia sua função na célula. O envoltório nuclear, por exemplo, é responsável pela separação do conteúdo nuclear do citoplasma. Ele é constituído por duas membranas separadas por um espaço de 40 a 70 nanômetros, chamadas de cisterna perinuclear. Esse envoltório também apresenta poros cuja função é o transporte seletivo de moléculas para fora e para dentro do núcleo. Essas membranas podem ser chamadas de: membrana interna e membrana externa. A membrana interna possui como função dar estruturação ao núcleo. Ela possui ligações das fibras cromatínicas ao envoltório nuclear (ALBERTS et al., 1997). Também verificamos na membrana ou envoltório nuclear a presença de poros nucleares, que são interrupções do envoltório nuclear que permite a troca citoplasmanucleoplasma. O transporte de substâncias no complexo de poros é dependente dos receptores de importação ou exportação nuclear. Geralmente do núcleo das células para o citoplasma, passam através do complexo de poros nucleares, metabólitos e RNA mensageiro e ribossômico, enquanto do citoplasma para o interior do núcleo irão atravessar proteínas, íons e nucleotídeos pelo complexo de poro. Para Junqueira e Carneiro (2007), a importação de proteínas através do Complexo do Poro Nuclear acontece de algumas maneiras. A primeira etapa envolve a proteína com sequência de localização nuclear (NLS), que é identificada por outra proteína presente, chamada importina, ligada ao GDP (Guanina Difosfato). O complexo proteínaimportina-RAN-GDP liga-se a uma proteína específica dos filamentos citoplasmáticos do poro nuclear. O complexo é translocado através do poro nuclear. No núcleo, o GDP (Guanina Difosfato) ligado a RAN é substituído por GTP (Guanina trifosfato), gerando uma alteração conformacional, em seguida ocorre a liberação da proteína. O complexo importina-RAN-GTP é exportado através do poro nuclear e o GTP é hidrolisado a GDP no citoplasma, como mostra o esquema a seguir: 30 FIGURA 21 – PROCESSO DE IMPORTAÇÃO ATRAVÉS DO COMPLEXO DE PORO NUCLEAR FONTE: A autora NOTA Curiosidade: O que é Talassemia? A talassemia é uma forma de anemia crônica, de origem genética (hereditária), que faz parte de um grupo de doenças do sangue (hemoglobinopatias) caracterizada por defeitos genéticos que resultam em diminuição da produção de um dos tipos de cadeias que formam a molécula de hemoglobina. Alguns desses defeitos envolvem uma disfunção na formação dos poros nucleares, dificultando a saída do RNAm do núcleo para ser traduzido no citoplasma das células pelos polirribossomos em hemoglobina. Na figura a seguir podemos observar um esfregaço sanguíneo com hemácias normais e outro esfregaço sanguíneo com hemácias alteradas (talassemia): 31 FIGURA 22 – ESFREGAÇO SANGUÍNEO EVIDENCIANDO HEMÁCIAS NORMAIS E HEMÁCIAS ALTERADAS (TALASSEMIA) FONTE: <https://www.abrasta.org.br/tipos/>. Acesso em: 26 mar. 2019. 3 DIMENSÕES CELULARES A maioria das células é microscópica, invisível a olho nu. As células dos animais e das plantas têm um diâmetro geralmente de 5 a 100 mm, e muitos microrganismos unicelulares têm comprimento de 1 a 2 mm. Então, o que limita as dimensões de uma célula? O limite inferior provavelmente é determinado pelo número mínimo de cada tipo de biomolécula requerido pela célula. As menores células, certas bactérias conhecidas como micoplasmas, têm diâmetro de 300 nm e volume de cerca de 10-14 mL. Um único ribossomo bacteriano tem 20 nm na sua dimensão mais longa, de forma que poucos ribossomos ocupam uma fração substancial do volume de uma célula de micoplasma (NELSON; COX, 2002). O limite superior de tamanho celular provavelmente é determinado pela taxa de difusão das moléculas de soluto nos sistemas aquosos. Por exemplo, uma célula bacteriana que depende de reações de consumo de oxigênio para extração de energia deve obter oxigênio molecular, por difusão, a partir do ambiente através de sua membrana plasmática. A célula é tão pequena, e a relação entre sua área de superfície e seu volume é tão grande, que cada parte do seu citoplasma é facilmente alcançada pelo O2 que se difunde para dentro dela. Com o aumento do tamanho celular, no entanto, a relação área-volume diminui, até que o metabolismo consuma O2 mais rapidamente do que o que pode ser suprido por difusão. Assim, o metabolismo que requer O2 torna-se impossível quando o tamanho da célula aumenta além de certo ponto, estabelecendo um limite superior teórico para o tamanho das células. O oxigênio é somente uma entre muitas espécies moleculares de baixo peso que precisam difundir de fora para várias regiões do seu interior, e o mesmo argumento da razão área-volume se aplica a cada uma delas (NELSON; COX, 2014, p. 3). 32 Há exceções interessantes a essa generalização de que a célula deva ser pequena. A alga verde Nitella possui células gigantes de vários centímetros de comprimento. Para garantir a chegada de nutrientes, de metabólitos e de informação genética (RNA) para todas as suas partes, cada célula é vigorosamente “agitada” por correntes citoplasmáticas vivas. A forma da célula também pode ajudar a compensar o seu longo tamanho. Uma esfera lisa possui a menor razão possível superfície/volume para um dado volume (NELSON; COX, 2014). Muitas células grandes, embora aproximadamente esféricas, possuem superfície altamente convoluta (Figura 23), criando grandes áreas de superfície para o mesmo volume e, portanto, facilitando a captação de combustíveis e nutrientes. A figura mostra as vilosidades intestinais e suas microvilosidades, especializações da superfície celular que aumentam a área de contato com os nutrientes, facilitando sua absorção (NELSON; COX, 2002). FIGURA 23 – CÉLULAS DA MUCOSA DE REVESTIMENTO INTESTINAL, EVIDENCIANDO SUAS VILOSIDADES E A BORDA MAIS ESCURA, AS MICROVILOSIDADES INTESTINAIS FONTE: <https://www.misodor.com/ANATOFISIOINTDELGADO.php>. Acesso em: 26 mar. 2019. Células como os neurônios possuem uma elevada razão superfície/volume pelo fato de serem longas e delgadas, em forma de estrela ou altamente ramificadas, em vez de esféricas. FIGURA 24 – NEURÔNIOS DO HIPOCAMPO FONTE: <http://anatpat.unicamp.br/bineuhipocamponlmap2.html>. Acesso em: 27 mar. 2019. 33 4 CÉLULAS E TECIDOS USADOS EM ESTUDOS BIOQUÍMICOS Pelo fato de todas as células vivas terem se desenvolvido dos mesmos progenitores, elas compartilham certas semelhanças fundamentais. Os métodos para estudo das células são bastante diversificados e o conhecimento sobre elas progridem com o aperfeiçoamento das técnicas de estudo. O estudo da célula começou através do microscópio óptico e com o surgimento do microscópio eletrônico houve um grande avanço no estudo das funções celulares. Estudos bioquímicos cuidadosos de apenas alguns tipos de células devem gerar princípios gerais aplicáveis a todas as células e organismos (BAYNES, 2015). O conhecimento em bioquímica é primariamente derivado de alguns organismos e tecidos representativos como a bactéria Escherichia coli, a levedura Sacharomyces cerevisiae, as algas fotossintetizantes, tais como Chlamydomonas, as folhas de espinafre, o fígado de rato e o músculo esquelético de vários vertebrados. Alguns estudos bioquímicos focalizam o isolamento, a purificação e a caracterização de componentes celulares; outras pesquisas investigam as vias metabólicas e genéticas das células vivas (NELSON; COX, 2002, p. 18). 5 EVOLUÇÃO E ESTRUTURA DAS CÉLULAS PROCARIÓTICAS Todos os organismos vivos se enquadram em três grandes grupos, que definem os três ramos da árvore evolucionária da vida que se originou a partir de um ancestral comum (Figura 25). Dois grandes grupos de microrganismos unicelulares podem ser distinguidos em bases genéticas e bioquímicas: Bacteria e Archaea. As bactérias habitam o solo, as águas superficiais e os tecidos de organismos vivos ou em decomposição. Muitas das arqueas, reconhecidas na década de 1980 por Carl Woese como um grupo distinto, habitam ambientes extremos – lagos de sais, fontes termais, pântanos altamente ácidos e profundezas do oceano. As evidências disponíveis sugerem que Bacteria e Archaea divergiram cedo na evolução. Todos os organismos eucariontes, que formam o terceiro domínio, Eukarya, evoluíram a partir do mesmo ramo que deu origem a Archaea; por isso, os eucariontes são mais proximamente relacionados às archaeas do que às bactérias (JUNQUEIRA; CARNEIRO, 2007). Algumas células primitivas evoluíram gradativamente na capacidade de fixar CO2 e utilizar a energia radiante do sol para a produção das próprias moléculas nutritivas. Antes ou durante a evolução dos seres unicelulares para os organismos autótrofos, um evento evolutivo possibilitou o surgimento destes novos organismos unicelulares: os pigmentos capazes de promover a captação da energia solar, fixação do CO2 e a produção de moléculas mais complexas. Inicialmente, os primeiros doadores de elétrons utilizados por organismos fotossintetizantes durante a rota fotossintética foi possivelmente o H2S. Estes eliminavam, como resíduo, o enxofre elementar (S0) ou sulfato (SO4 -2). Este novo tipo celular era bastante semelhante às algas azuis ou cianofíceas. Com o surgimento 34 da capacidade enzimática, as células começaram a utilizar a H2O como doador de elétrons eliminando o O2 como subproduto. O oxigênio (O2) levou aproximadamente 1,5 bilhão de anos para atingir a concentração dos 21% atuais. O oxigênio é um agente fortemente oxidante e tóxico para as células anaeróbicas. As células que existiam no meio ambiente primitivo, não estavam adaptadas para sobreviver a um ambiente rico em oxigênio (MAYWORM, 2014). FIGURA 25 – FILOGENIA DOS TRÊS GRUPOS DA VIDA FONTE: <http://sateuece.blogspot.com/2014/05/filogenia-simplificadareino-animalia.html>. Acesso em: 18 mar. 2019. É possível classificar os organismos pela maneira como obtêm a energia e o carbono de que necessitam para sintetizar o material celular (conforme resumido na Figura 26). Existem duas categorias amplas com base nas fontes de energia: fototróficos (do grego trophe, “nutrição”), que captam e usam a luz solar, e quimiotróficos, que obtêm sua energia pela oxidação de um combustível químico. Alguns quimiotróficos oxidam combustíveis inorgânicos – por exemplo, HS – a S0 (enxofre elementar), S0 a SO4 – NO2 – a NO3 –, ou Fe21 a Fe31. 35 FIGURA 26 – CLASSIFICAÇÃO DOS ORGANISMOS DE ACORDO COM A FONTE DE ENERGIA UTILIZADA FONTE: Nelson e Cox (2014, p. 5) 5.1 O ESTUDO DA Escherichia coli Escherichia coli, a bactéria mais estudada, é geralmente um habitante inofensivo do trato intestinal humano. A célula de E. coli (Figura 27) é um ovoide com cerca de 2 mm de comprimento e um pouco menos de 1 mm de diâmetro, mas outras bactérias podem ser esféricas ou ter forma de bastonete. Ela tem uma membrana externa protetora e uma membrana plasmática interna que envolve o citoplasma e o nucleoide. Entre a membrana interna e a externa existe uma fina, mas resistente, camada de um polímero de alto peso molecular (peptidoglicano) que confere à célula sua forma e rigidez (NELSON; COX, 20014). Essa camada mais espessa e resistente é chamada de cápsula, uma estrutura gelatinosa, rica em glicoproteínas e diversos polissacarídeos. 36 FIGURA 27 – CARACTERÍSTICAS ESTRUTURAIS COMUNS DAS CÉLULAS DE BACTÉRIAS E ARQUEAS FONTE: Nelson e Cox (2014, p. 6) Para Nelson e Cox (2014, p. 6): A membrana plasmática e as camadas externas a ela constituem o envelope celular. A membrana plasmática das bactérias consiste em uma bicamada fina de moléculas lipídicas impregnadas de proteínas. As membranas plasmáticas arqueanas têm arquitetura similar, mas os lipídios podem ser acentuadamente diferentes das bactérias. Bactérias e arqueias têm especializações grupo-específicas em seus envelopes celulares. Algumas bactérias, chamadas gram-positivas porque se coloram com o corante de Gram (desenvolvido por Hans Peter Gram em 1882), têm uma camada espessa de peptidoglicanos na parte externa da sua membrana plasmática, mas não apresentam uma membrana externa. Já as bactérias gram-negativas têm uma membrana externa composta de uma dupla camada lipídica na qual se encontram inseridos lipopolissacarídeos e proteínas chamadas porinas que proveem canais transmembrana para que compostos de baixo peso molecular e íons possam se difundir através dessa membrana externa. As estruturas na parte externa da membrana plasmática das arqueias diferem de organismo para organismo, mas eles também têm uma camada de peptidoglicanos ou proteínas que conferem rigidez aos seus envelopes celulares. O citoplasma da E. coli contém cerca de 15.000 ribossomos, várias cópias (de 10 a milhares) de cada uma das aproximadamente 1.000 diferentes enzimas, talvez 1.000 compostos orgânicos de massa molecular menor do que 1.000 (metabólitos e cofatores), e uma variedade de íons inorgânicos. O nucleoide contém uma única molécula de DNA circular, e o citoplasma (como na maioria das bactérias) contém um ou mais segmentos de DNA circular chamados de plasmídeos (Figura 28). Na natureza, alguns 37 plasmídeos conferem resistência a toxinas e antibióticos do ambiente. No laboratório, esses segmentos de DNA circular são práticos para a manipulação experimental e são ferramentas poderosas para a engenharia genética (JUNQUEIRA; CARNEIRO, 2007). FIGURA 28 – PLASMÍDEO DE UMA CÉLULA BACTERIANA, EVIDENCIANDO SEUS GENES DE RESISTÊNCIA Bactéria Plasmídeo circular (cada um com vários milhares de pares de bases) Cromossomo circular principal (quatro milhões de pares de bases) Gene de resistência a antibiótico Plasmídeo móvel Gene necessário para transferência de DNA FONTE: <https://www.todoestudo.com.br/biologia/plasmideos>. Acesso em: 26 mar. 2019. Quando falamos de bactérias, devemos lembrar que: Outras espécies de Bacteria e também de Archaea contêm uma coleção similar de moléculas, mas cada espécie tem especializações físicas e metabólicas relacionadas ao nicho ambiental e fontes nutricionais. Cianobactérias, por exemplo, têm membranas internas especializadas em capturar energia da luz. Muitas arqueias vivem em ambientes extremos e têm adaptações bioquímicas para sobreviver em extremos de temperatura, pressão ou concentração de sal. Diferenças observadas na estrutura dos ribossomos deram a primeira indicação de que Bacteria e Archaea constituem grupos diferentes. A maioria das bactérias (inclusive E. coli) existe na forma de células individuais, mas muitas vezes associadas a biofilmes ou películas, nas quais inúmeras células se aderem umas às outras e ao mesmo tempo ao substrato sólido que fica junto ou próximo de uma superfície aquosa. Células de algumas espécies de bactérias (p. ex., mixobactéria) mostram um comportamento social simples, formando agregados multicelulares em resposta a sinais entre células vizinhas (NELSON; COX, 2014, p. 36). 38 6 EVOLUÇÃO DAS CÉLULAS EUCARIÓTICAS Fósseis mais antigos do que 1,5 bilhão de anos estão limitados àqueles organismos pequenos e relativamente simples, semelhantes na forma e no tamanho aos procariotos modernos. Iniciando-se há cerca de 1,5 bilhão de anos, os registros fósseis começam a mostrar evidência de organismos mais complexos e maiores, provavelmente as primeiras células eucarióticas. Para Nelson e Cox (2002, p. 23): Três alterações principais devem ter ocorrido quando os procariotos deram origem aos eucariotos. Primeiro, as células adquiriram mais DNA, surgiram mecanismos que o dobraram e o compactaram em discretos complexos com proteínas específicas e dividiramno igualmente entre as células filhas durante a divisão celular. Esses complexos DNA-proteína, os cromossomos, tornaramse especialmente compactados no instante da divisão celular, quando podem ser observados ao microscópio óptico como fios de cromatina. Segundo, à medida que as células se tornaram maiores, um sistema de membranas intracelulares se desenvolveu, incluindo a membrana dupla que envolve o DNA. E a terceira alteração, seria quando as células eucarióticas primitivas, que eram incapazes de realizar fotossíntese ou metabolismo anaeróbico, misturaram suas vantagens com as das bactérias aeróbicas ou fotossintetizantes para formar associações endossimbióticas que se tornaram permanentes. Na Figura 29 podemos observar a evolução dos procariotos para os eucariotos. Os organismos modernos podem ter surgido a partir de um ancestral procarioto comum por uma série de associações endossimbióticas. Acredita-se que algumas bactérias aeróbicas evoluíram para as mitocôndrias, quando as condições do meio ambiente tornaram-se desfavoráveis e algumas cianobactérias fotossintetizantes tornaram-se os plastídios, tais como os cloroplastos das algas verdes, os prováveis ancestrais das modernas células das plantas (NELSON; COX, 2014). FIGURA 29 – EVOLUÇÃO DOS PROCARIONTES PARA OS EUCARIONTES FONTE: <http://1.bp.blogspot.com/-sXWYAODckOM/Vq5OOwmFcNI/AAAAAAAAD3w/ZvQygdTCrFI/ s1600/1.gif>. Acesso em: 30 mar. 2019. 39 As células procariontes e eucariontes possuem características bem distintas. O Quadro 1 faz uma comparação de células procarióticas com eucarióticas: QUADRO 1 – COMPARAÇÃO ENTRE CÉLULAS PROCARIONTES E EUCARIONTES Características Célula Procariótica Célula Eucariótica Tamanho Geralmente pequeno (1-10 um). Geralmente grande (5-100 um). Genoma DNA com proteínas não histonas, genoma no nucleoide, não envolvido por membrana. DNA complexado com proteínas histonas e não histonas em cromossomos; Cromossomos no núcleo com envelope membranoso. Divisão Celular Fissão ou brotamento, não ocorre mitose. Mitose, incluindo fuso mitótico, centríolos em muitas espécies. Organelas ligadas a membranas Ausentes Mitocôndria, cloroplastos, retículo endoplasmático, complexos de Golgi, lisossomos. Nutrição Absorção, alguns fotossintetizantes. Absorção, ingestão, fotossíntese em algumas espécies Citoesqueleto Nenhum Complexo, com Microtúbulos, filamentos intermedipários e filamentos de actina. Movimento intracelular Não possui Citoplasma fluídico, endocitose, fagocitose, mitose, vesícula de transporte. FONTE: Nelson e Cox (2002, p. 23) Acredita-se que as células eucariontes primitivas originaram diversos protistas (organismos unicelulares eucarióticos). Alguns se assemelham aos protistas fotossintetizantes modernos, como a Euglena; outros protistas não fotossintetizantes eram mais parecidos com o Paramecium (COOPER, 2001). 6.1 PRINCIPAIS CARACTERÍSTICAS ESTRUTURAIS DAS CÉLULAS EUCARIÓTICAS As células eucarióticas típicas (Figura 30) são muito maiores do que as bactérias – em geral de 5 a 100 mm de diâmetro, com um volume de mil a um milhão de vezes maior do que o das bactérias. As características que distinguem os eucariotos são o núcleo e uma grande variedade de organelas envoltas por membranas com funções específicas. 40 FIGURA 30 – CÉLULA EUCARIONTE ANIMAL E SUAS ORGANELAS ESPECIALIZADAS FONTE: <https://encrypted-tbn0.gstatic.com/images?q=tbn:ANd9GcQbGluPRVYq1A8nMGd1_St69SgQ8ShSABrfeU8ybzdjCgyszKGk>. Acesso em: 26 mar. 2019. A célula eucarionte possui organelas especializadas em diversas funções. A mitocôndria é considerada a usina energética da célula, pois é onde ocorre o sítio ativo na produção de energia (ATP). Além disso, a mitocôndria possui uma característica bem peculiar. Ela possui material genético próprio, fazendo com que seja autorreplicativa, ou seja, dá origem a outras mitocôndrias sempre que houver na célula um aumento da necessidade de ATP. Geralmente as células que possuem um número maior de mitocôndrias são justamente aquelas que têm uma demanda maior de energia, como as células musculares, por exemplo. As mitocôndrias possuem na sua estrutura uma membrana externa, membrana interna, espaço intermembranas, matriz mitocondrial, ribossomos livres e DNA mitocondrial. FIGURA 31 – (A) ESTRUTURA DAS MITOCÔNDRIAS. (B) ELETROMICROGRAFIA DE UMA MITOCONDRIAL (A) (B) FONTE: A autora 41 Além das mitocôndrias, a célula eucarionte possui o retículo endoplasmático, sendo este de dois tipos: granular ou rugoso e agranular ou liso (Figura 32). Os retículos são formados a partir da invaginação da membrana plasmática, é constituído por uma rede de túbulos e vesículas achatadas e interconectas. Essas vesículas no retículo endoplasmático granular se comunicam com o envoltório nuclear. O retículo endoplasmático granular possui ribossomos aderidos as suas cisternas, o que o deixa com esse aspecto granular. Ele tem como função síntese, segregação de proteínas. Já o retículo endoplasmático agranular (REA) é uma rede de membranas de formato tubular e desorganizado. Uma das características do REA é a ausência de ribossomos aderidos as suas vesículas e possui funções mais distintas: síntese de lipídios, glicólise, reservatório de cálcio e destoxificação (geralmente converte substâncias insolúveis em compostos solúveis). Uma das funções do retículo endoplasmático liso é a síntese de lipídios de membrana (fosfolipídios, glicolipídios e colesterol). Os fosfolipídios são sintetizados no lado citosólico da membrana do REL, enquanto que os glicolipídios são sintetizados no Complexo de Golgi a partir da ceramida. Outra função importante atribuída ao retículo endoplasmático liso é a destoxificação, onde drogas insolúveis, que tendem a se acumular no organismo, podem chegar a níveis tóxicos. No retículo endoplasmático liso, essas drogas insolúveis são transformadas em substâncias hidrossolúveis. No fígado, em suas células chamadas de hepatócitos, ocorre o acúmulo de glicogênio. O retículo endoplasmático liso libera a enzima glicose 6-fosfatase, que degrada essa molécula de glicogênio e devolve glicose para circulação sanguínea, controlando a glicemia do organismo. Nas células musculares, o retículo endoplasmático, recebe um nome especial – retículo sarcoplasmático. No retículo sarcoplasmático ocorre o reservatório de cálcio, que estará diretamente relacionado para a contração muscular. FIGURA 32 – (A) RETÍCULO ENDOPLASMÁTICO GRANULAR (NOTE A PRESENÇA DE RIBOSSOMOS ADERIDOS EM SUAS VESÍCULAS). (B) RETÍCULO ENDOPLASMÁTICO AGRANULAR (A) (B) FONTE: A autora 42 O Complexo de Golgi (Figura 33) é composto por cisternas envoltas por membranas achatadas e empilhadas. Apresenta uma face cis (de entrada) e uma fase trans (de saída). Ele é responsável pelo processamento e endereçamento de proteínas, além de realizar a glicosilação de glicoproteínas e glicolipídios do retículo endoplasmático granular. O complexo golgiense também é responsável pela formação do acrossomo dos espermatozoides e possui dois tipos de secreção: constitutiva e regulada. A secreção constitutiva acontece quando as vesículas finais golgianas são secretadas diretamente, sem armazenamento no citosol, de forma constitutiva (sem sinalização). Ex.: células produtoras de proteínas da matriz extracelular. Já a secreção regulada ocorre quando as vesículas finais golgianas são primeiramente armazenadas, podem fundir-se umas com as outras, formando grânulos de secreção que são estocados perto do ápice da célula até haver um sinal (nervoso ou hormonal) para secreção. Ex.: glândulas. Junqueira e Carneiro (2007) relatam que, em muitas células, o complexo golgiense localiza-se em posição constante, quase sempre ao lado do núcleo, podendo ser encontrado disperso pelo citoplasma em outras células. FIGURA 33 – ELETROMICROGRAFIA EVIDENCIANDO AS CISTERNAS DO COMPLEXO DE GOLGI FONTE: A autora Outra organela presente nas células eucariontes são os peroxissomos, que são estruturas caracterizadas pela presença de enzimas oxidativas que transferem átomos de hidrogênio de diversos substratos para o oxigênio (COOPER, 2001). Eles realizam a desintoxicação celular e possuem uma quantidade de enzimas oxidativas, que realizam oxidação formando o peróxido de hidrogênio, abundante nas células hepáticas (400 peroxissomos por célula). Os peroxissomos surgem através de brotamentos do retículo endoplasmático rugoso e contêm a maior parte da enzima catalase, que converte peróxido de hidrogênio em água e oxigênio. 43 NOTA Adrenoleucodistrofia é uma doença genética rara, autossômica recessiva, ligada ao sexo (mulheres portadoras). Ocorre uma mutação na enzima ligase acil CoA gordurosa (membrana dos peroxissomos), levando ao acúmulo de ácidos graxos no citoplasma de células do tecido nervoso, gerando a degeneração das bainhas de mielina e disfunção adrenal. O Filme: O Óleo de Lorenzo retrata o surgimento, sinais e sintomas dessa patologia associada a essa disfunção em enzimas do peroxissomos. Células eucariontes também possuem organelas derivadas do complexo golgiense, chamadas de lisossomos. Os lisossomos são organelas em formato arredondado, cheias de enzimas digestivas e envoltas por uma membrana lipoproteica. Possui como funções a autofagia (eliminação de organelas citoplasmáticas); digestão de partículas prejudiciais ao organismo e digestão intracelular. Possuem enzimas digestivas que degradam substratos específicos, como por exemplo lipases e fosfolipases, digerindo lipídios; as proteases que realizam a digestão de proteínas; as glicosidades, digerindo polissacarídeos e as nucleases, que realizam a digestão de ácidos nucleicos. As enzimas lisossômicas são produzidas no retículo endoplasmático granular, passam pelo complexo golgiense, no qual são sintetizadas e liberadas sob a forma de vesículas: FIGURA 34 – SÍNTESE DE ENZIMAS LISOSSÔMICAS FONTE: A autora Os lisossomos são classificados em primários e secundários. Os lisossomos primários não estão em atividade de digestão. São menores e homogêneos. Já os lisossomos secundários estão em constante atividade de digestão, são maiores e heterogêneos. 44 Além dessas organelas, as células vegetais também têm vacúolos (que acumulam grandes quantidades de ácidos orgânicos) e cloroplastos (nos quais a luz solar realiza a síntese de ATP no processo da fotossíntese). No citoplasma de muitas células estão presentes também grânulos ou gotículas contendo nutrientes armazenados, como amido e gordura (JUNQUEIRA; CARNEIRO, 2007). 7 ESTUDO DOS COMPONENTES CELULARES Algumas técnicas foram desenvolvidas ao longo dos anos, para o estudo dos componentes celulares. A seguir, você conhecerá algumas delas, suas características e importância clínica. 7.1 ORGANELAS ISOLADAS POR CENTRIFUGAÇÃO Em um avanço importante na bioquímica, Albert Claude, Christian de Duve e George Palade desenvolveram métodos para separar as organelas do citosol e elas entre si – etapa essencial na investigação de suas estruturas e funções (NELSON; COX, 2014). Em um processo típico de fracionamento (Figura 35), as células ou tecidos em solução são suavemente rompidos por cisalhamento físico. Esse tratamento rompe a membrana plasmática, mas deixa intacta a maioria das organelas. O homogeneizado é então centrifugado; organelas como núcleo, mitocôndria e lisossomos diferem em tamanho e por isso sedimentam em velocidades diferentes. Esses métodos foram utilizados para estabelecer, por exemplo, que os lisossomos contêm enzimas degradativas, as mitocôndrias contêm enzimas oxidativas e os cloroplastos contêm pigmentos fotossintéticos. O isolamento de uma organela rica em determinada enzima é, com frequência, a primeira etapa de purificação dessa enzima. Nelson e Cox (2014) relatam que organelas, como os núcleos, as mitocôndrias e os lisossomos, diferem em tamanho e, portanto, sedimentam com velocidades diferentes durante a centrifugação. Elas também diferem na gravidade específica e “flutuam” em diferentes níveis em um gradiente de densidade (Figura 35). A centrifugação diferencial leva a um fracionamento grosseiro do conteúdo citoplasmático, que deve ser purificado por centrifugação isopícnica (mesma densidade). 45 FIGURA 35 – FRACIONAMENTO SUBCELULAR DE TECIDOS FONTE: Nelson e Cox (2014, p. 8) As técnicas de imunocitoquímica permitem o estudo da localização intracelular de proteínas específicas. Ela localiza, com precisão, um determinado tipo de molécula proteica, excluindo todas as outras proteínas existentes nas células. A imunocitoquímica se baseia na reação antígeno-anticorpo e pode ser classificada em Imunocitoquímica Direta e Indireta (JUNQUEIRA; CARNEIRO, 2007). Imunocitoquímica Direta: suponha-se que, de um determinado órgão de rato, se possa extrair e purificar quimicamente uma proteína, que será chamada proteína X. O problema citoquímico consiste em descobrir em que células ou parte da célula está localizada a proteína X, pois ela foi isolada de um órgão inteiro. Injetando-se a proteína X (antígeno) em um coelho, este formara uma gamaglobulina (anticorpo) com a propriedade de se combinar exclusivamente com a proteína X, não se combinando com qualquer outra. O anticorpo aparece porque a proteína X pertence a um órgão de rato e, portanto, estranha para o coelho no qual foi injetada (JUNQUEIRA; CARNEIRO, 2007, p. 30). 46 Na técnica de Imunocitoquímica Indireta, a marcação é colocada em um anticorpo, isto é, uma antigamaglobulina. Por sua maior sensibilidade, permitindo a demonstração de quantidades mínimas de antígeno, a técnica indireta é a mais usada na prática. 7.2 ESTUDOS IN VITRO In vitro (“em vidro”) é uma expressão que designa todos os processos biológicos que têm lugar fora dos sistemas vivos, no ambiente controlado e fechado de um laboratório e que normalmente são utilizadas as vidrarias. Em 1904, ocorreu o primeiro cultivo in vitro de crucíferas observando a necessidade de suplementação do meio mineral com sacarose para a germinação dos embriões, bem como mostrando o efeito das diferentes fontes de nitrogênio sobre sua morfologia. Uma abordagem para o entendimento de um processo biológico é o estudo in vitro de moléculas purificadas (“no vidro” – no tubo de ensaio), sem a interferência de outras moléculas presentes na célula intacta – isto é, in vivo (“no vivo”). Embora essa abordagem seja muito esclarecedora, deve-se considerar que o interior de uma célula é totalmente diferente do interior de um tubo de ensaio. Os componentes “interferentes” eliminados na purificação podem ser cruciais para a função biológica ou para a regulação da molécula purificada. Por exemplo, estudos in vitro de enzimas puras são comumente realizados com concentrações muito baixas da enzima em soluções aquosas sob agitação. Na célula, uma enzima está dissolvida ou suspensa no citosol com consistência gelatinosa junto com milhares de outras proteínas, e algumas delas se ligam à enzima e influenciam sua atividade. Algumas enzimas são componentes de complexos multienzimáticos nos quais os reagentes passam de uma enzima para a outra, sem interagir com o solvente. Quando todas as macromoléculas conhecidas de uma célula são representadas em suas dimensões e concentrações conhecidas (Figura 36), fica claro que o citosol é bem ocupado e que a difusão de macromoléculas dentro do citosol deve ser mais lenta devido à colisão com outras estruturas grandes. Em resumo, certa molécula pode ter um comportamento muito diferente na célula e in vitro. Um desafio central na bioquímica é entender as influências da organização celular e das associações macromoleculares sobre a função das enzimas individuais e outras biomoléculas – para entender a função in vivo assim como in vitro (NELSON; COX, 2002, p. 33). 47 FIGURA 36 – A CÉLULA LOTADA. ESTE DESENHO DE DAVID GOODSELL É UMA REPRESENTAÇÃO PRECISA DOS TAMANHOS RELATIVOS E NÚMERO DE MACROMOLÉCULAS EM UMA REGIÃO PEQUENA DA CÉLULA DE E. COLI FONTE: Nelson e Cox (2014, p. 11) 8 EVOLUÇÃO DOS ORGANISMOS MULTICELULARES E A DIFERENCIAÇÃO CELULAR Todos os organismos eucariotos unicelulares modernos – os protistas – contêm as organelas e os mecanismos que descrevemos anteriormente. Essas organelas e mecanismos devem ter se originado relativamente cedo. O Reino Protista é um dos reinos dos seres vivos, caracterizado por organismos eucariontes, autótrofos (sintetizam seu próprio alimento) ou heterótrofos (ingerem partículas alimentares do meio externo). Podem ser unicelulares (possuem apenas uma célula) ou pluricelulares (formados por várias células). Os protistas compreendem os protozoários e as algas. Existem também os mixomicetos, organismos semelhantes aos fungos, mas classificados como Protistas (JUNQUEIRA; CARNEIRO, 2007). Os protistas são muito versáteis. Um exemplo é o protista Paramecium (Figura 37), que move-se rapidamente com auxílio de uma especialização de membrana chamada cílios. Ele percebe estímulos mecânicos, químicos e térmicos do seu ambiente e responde alterando o seu caminho. Consegue realizar a fagocitose de diversas substâncias, como as partículas alimentares, por exemplo. Possui a habilidade de excretar os fragmentos não digeridos; elimina o excesso de água (NELSON; COX, 2014). Em alguma etapa posterior da evolução, os organismos unicelulares descobriram a vantagem de se agregar, adquirindo, portanto, maior motilidade, eficiência ou sucesso reprodutivo do que os seus competidores unicelulares de 48 vida livre. A evolução posterior de tais organismos aglutinados levou às associações permanentes entre células individuais e eventualmente à especialização da colônia – a diferenciação celular (JUNQUEIRA; CARNEIRO, 2007). FIGURA 37 – PARAMECIUM: PROTOZOÁRIO CILIADO FONTE: <http://www.carloshotta.com.br/brontossauros/2009/4/16/paramecios-se-comunicam-por-luz. html>. Acesso em: 11 jul. 2019. Para Nelson e Cox (2002, p. 34): As vantagens da especialização celular levaram a evolução de organismos mais complexos e altamente diferenciados, nos quais algumas células desempenham funções sensoriais, outras digestivas, fotossintetizantes ou reprodutoras. Muitos organismos multicelulares modernos contêm centenas de diferentes tipos celulares, cada um especializado em alguma função que apoia o organismo inteiro. Mecanismos fundamentais que surgiram anteriormente foram refinados e completados durante a evolução. O mecanismo simples responsável pela movimentação da miosina ao longo dos filamentos de actina no mofo foi conservado e elaborado nas células musculares dos vertebrados. A mesma estrutura básica e o mesmo mecanismo que sustenta a movimentação do bater dos cílios do Paramecium e dos flagelos na Chlamydomonas são empregados nas células altamente diferenciadas dos vertebrados, o espermatozoide. As células individuais de organismos multicelulares permaneceram delimitadas por membranas plasmáticas, mas também desenvolveram estruturas especializadas na superfície para a fixação e comunicação entre as células. As moléculas de adesão celular permitem o contato entre células epiteliais, e este contato é estabilizado por junções celulares especializadas (KIERSZENBAUM, 2008). 49 Embora moléculas de adesão celular sejam responsáveis pela adesão do tipo célula-célula, as junções celulares são importantes para fornecer estabilidade mais intensa. As junções celulares podem ser de três tipos: junções de oclusão, junções de ancoragem (adesão) e junções comunicantes (tipo gap). As junções de oclusão promovem a vedação do trânsito de íons e moléculas entre as células. Os folhetos externos da membrana plasmática das duas células se fundem. São formadas pelas proteínas adesivas claudinas e ocludinas. As junções de ancoragem ou adesão promovem a adesão entre as células. É uma zônula que circunda a célula como um cinturão e possui como proteínas adesivas as caderinas. Nas junções de adesão, devemos citar estruturas em forma de botões chamadas de desmossomos, que também são responsáveis pela coesão celular e dependentes das proteínas transmembranas, chamadas de caderinas. NOTA Você sabia? Existe uma doença autoimune chamada de Pênfigo Bolhoso (Figura 38), em que ocorre uma produção de anticorpos contra a proteína caderina dos desmossomos da epiderme. As pessoas desenvolvem bolhas grandes e pruriginosas, com áreas de pele inflamada. Para diagnosticar o pênfigo bolhoso são examinadas amostras da pele no microscópio e verificado se existem depósitos de certos anticorpos. Ocorre com mais frequência nos homens com mais de 60 anos, mas também podem ocorrer em crianças. É uma doença menos séria que o pênfigo vulgar (que também provoca bolhas), geralmente não é fatal, e não resulta em descamação generalizada da pele. No entanto, pode envolver uma grande extensão da pele e causar muito desconforto (JUNQUEIRA; CARNEIRO, 2007). FIGURA 38 – PÊNFIGO BOLHOSO NA EPIDERME FONTE: <http://doencasautoimunes.com.br/noticias/penfigo-bolhoso-o-que-e-e-como-tratar/>. Acesso: 29 mar. 2019. 50 Os desmossomos mecanicamente fornecem resistência às conexões físicas entre as células, mas não impedem a passagem de material através do espaço extracelular entre as células conectadas (JUNQUEIRA; CARNEIRO, 2007). As junções comunicantes ou do tipo gap (Figura 39) promovem a comunicação entre as células através de um canal chamado de conexon. Cada conexon é formado por seis proteínas chamadas de conexinas. Geralmente encontram-se abertas, provocando um aumento no cálcio intracelular. FIGURA 39 – JUNÇÕES COMUNICANTES OU DO TIPO GAP FONTE: <https://transformandodoremamor.wordpress.com/2018/04/03/o-papel-das-juncoes-gap nas-sistoles-cardiacas/>. Acesso: 31 mar. 2019. 9 VÍRUS: PARASITAS DAS CÉLULAS Devido as suas relações com as células e seus efeitos sobre estas, podendo causar doenças de gravidade variável, abordaremos algumas informações importantes sobre os vírus. Vírus são acelulares, ou seja, não possuem célula e, portanto, não podem ser considerados seres vivos. Eles não são capazes de se multiplicar, exceto quando parasita uma célula e utiliza essa célula para sintetizar novas partículas virais. São, portanto, parasitas intracelulares obrigatórios. Na verdade, os vírus são parasitas nível molecular, pois induzem a maquinaria sintética das células parasitadas a trabalhar para formar novos vírus, em vez de trabalhar para formar seus próprios componentes (JUNQUEIRA; CARNEIRO, 2007). Os vírus constituem de uma única molécula de ácido nucleico (DNA ou RNA). O ácido nucléico é envolvido por uma capa proteica chamada capsídeo, onde encontramos também no capsídeo, as proteínas virais, que determinam a célula que o vírus irá infectar. 51 Nelson e Cox (2002, p. 34) relatam que: Os vírus existem em dois estados. Fora das células hospedeiras que os formam, os vírus são simplesmente partículas não vivas chamadas de virions, os quais podem ser cristalizados. Assim que um vírus ou seu componente ácido nucleico entra numa célula hospedeira específica, ele se torna um parasita intracelular. O ácido nucleico viral transporta a mensagem genética especificando a estrutura do vírion intacto. Ele desvia os ribossomos e as enzimas das células hospedeiras das suas funções celulares normais para a construção de muitas novas partículas virais filhas. Em consequência, uma progênie de centenas de vírus pode se originar de apenas um vírion que infecta a célula hospedeira. Em alguns sistemas vírus-hospedeiro, a progênie do vírion escapa através da membrana plasmática da célula hospedeira. Outros vírus produzem a lise celular (quebra da membrana e morte da célula hospedeira) quando são liberados. Muito da patologia associada com as doenças virais resulta da lise da célula hospedeira. Centenas de vírus diferentes são conhecidos, sendo cada um mais ou menos específico para uma célula hospedeira. Geralmente os vírus que infectam as células animais não infectam os vegetais, e vice-versa. Porém, existem alguns vírus vegetais que invadem e multiplicam-se nas células de insetos disseminadores deste vírus de uma planta para outra. Os vírus que infectam bactérias são chamados de bacteriófagos ou, simplesmente, fagos. A Bioquímica tem ganhado enormemente com o estudo dos vírus, que tem fornecido informação nova sobre a estrutura do genoma, os mecanismos enzimáticos da síntese dos ácidos nucleicos e de proteínas e a regulação do fluxo da informação genética (NELSON; COX, 2002). FIGURA 40 – ESTRUTURA VIRAL FONTE: <https://horadaescola.com/biologia/433-virus-biologia>. Acesso em: 31 mar. 2019. 52 LEITURA COMPLEMENTAR A COMPARAÇÃO GENÔMICA APRESENTA IMPORTÂNCIA CRESCENTE NA BIOLOGIA E NA MEDICINA HUMANA Os genomas de chimpanzés e humanos são 99,9% idênticos; mesmo assim, as diferenças entre as duas espécies são enormes. As poucas diferenças nos conteúdos genéticos devem explicar o domínio da linguagem em humanos, a extraordinária capacidade física dos chimpanzés e uma miríade de outras diferenças. A comparação de genomas está permitindo aos pesquisadores identificar genes candidatos conectados a divergências no programa de desenvolvimento de humanos e dos outros primatas e a emergência de funções complexas como a linguagem. Tudo se tornará mais claro somente quando o genoma de mais primatas se tornar disponível para comparação com o genoma humano. Da mesma forma, as diferenças no conteúdo genético entre humanos são extremamente pequenas se comparadas com as diferenças entre humanos e chimpanzés. Mesmo assim, essas poucas diferenças são responsáveis pelas diferenças dentro da espécie humana – incluindo diferenças na saúde e na suscetibilidade a doenças crônicas. Há muito a aprender sobre a variabilidade na sequência entre humanos, e a disponibilidade dessa informação genômica vai certamente transformar o diagnóstico e o tratamento médico. Pode-se esperar que, para algumas doenças genéticas, os tratamentos paliativos até agora utilizados serão substituídos por curas. Pode-se esperar também que o alerta e a prevenção serão as medidas usadas quando suscetibilidades a doenças são detectadas por marcadores genéticos específicos. O atual “histórico médico” poderá ser substituído pelo “prognóstico médico”. FONTE: NELSON, D. L.; COX, M. M. Princípios de bioquímica de Lehninger. 6. ed. Porto Alegre: Artmed, 2014. 53 RESUMO DO TÓPICO 2 Neste tópico, você adquiriu certos aprendizados, como: • As células, unidade da vida, são de dimensões microscópicas. • Todas as células compartilham algumas características: DNA contendo a informação genética, ribossomos e uma membrana plasmática que envolve o citoplasma. • Certos organismos, tecidos e células oferecem vantagens para os estudos bioquímicos. • A E. coli pode ser muito utilizada para estudos bioquímicos, pois possui curto tempo de geração sendo especialmente apropriada para a manutenção genética. • As primeiras células vivas foram os procariotos e anaeróbicos. • Com o passar do tempo, a evolução biológica conduziu as células capazes de produzir fotossíntese, com o oxigênio como subproduto. • Cerca de 1,5 bilhão de anos atrás surgiram as células eucarióticas. • As células eucarióticas foram evoluindo e cada organela se especializou em uma função específica. • As células eucarióticas modernas possuem um sistema complexo de membranas intracelulares. • O material genético nas células eucarióticas está organizado nos cromossomos complexos altamente organizados de DNA e proteínas histonas. • O citoesqueleto é uma rede intracelular de filamentos de actina, filamentos intermediários e microtúbulos. • O citoesqueleto confere a forma da célula e geralmente essa forma está associada com a função que a célula desempenha no organismo. • As organelas intracelulares movem-se ao longo dos filamentos do citoesqueleto, propelidas por proteínas como a cinesina, a dineína e a miosina, usando a energia do ATP. • Os vírus são parasitas intracelulares obrigatórios. 54 AUTOATIVIDADE 1 Leia o texto a seguir e responda ao que se pede: Relatos de uma viagem Finalmente conseguimos visitar a célula. É um mundo pequeno, totalmente cercado por uma fronteira bem controlada, que regula tudo o que entra e o que sai. O acesso pode ser feito por diferentes tipos de portões. Alguns são como as portas giratórias de lojas ou bancos, que permitem atravessar a fronteira em um piscar de olhos; em outros, um funcionário da alfândega de lá nos agarra e nos empurra para dentro (ou para fora), mesmo que não queiramos. Há um incrível trânsito de matéria-prima e de energia nas fronteiras dessa cidadela, pois sua vida depende totalmente de produtos importados. É verdade também que há alguns produtos internos que são exportados e muito requisitados no exterior. O lugar é muito organizado, com túneis e canais que levam a todas as partes, garantindo um trânsito rápido e fácil. Além disso, esses canais estão diretamente ligados às fábricas, nas quais são produzidas matérias-primas necessárias ao dia a dia e também produtos para exportação; estes são levados aos centros de armazenagem e de estocagem onde ficam até a hora de serem exportados. Há encarregados de limpeza e de consertos, que eliminam os resíduos e mantêm limpo e em perfeito funcionamento. Mas o que chama a atenção são as usinas de produção de energia. Aqui se adota um modelo descentralizado: em vez de uma única usina grande, há dezenas ou centenas de pequenas usinas, distribuídas por toda parte. A energia da matéria-prima que chega à usina é extraída e convertida em pacotes energéticos rotulados de ATP, uma espécie de moeda energética local, com a qual se faz qualquer coisa. Dizem que o mais impressionante daqui é o núcleo de controle, um prédio em formato esférico e estilo futurista, que utiliza os mais modernos sistemas informatizados para organizar a vida dentro da célula. Isso nós não fomos visitar ainda, vimos apenas de longe. Mais notícias em breve. FONTE: A autora Essa viagem, impossível na vida real, tornou-se possível graças às descobertas que os pesquisadores têm feito sobre a estrutura e o funcionamento das células vivas. a) Este texto deverá ser traduzido para a linguagem científica da Biologia Celular, relatando quais são as estruturas celulares (sublinhadas no texto) correspondentes a cada descrição. 55 b) Pela descrição dada no texto, trata-se de uma célula eucarionte ou procarionte? Justifique sua resposta. 2 A microscopia eletrônica foi inicialmente criada para estudos de estrutura de material bélico, sendo posteriormente utilizada para estudos de estruturas e organelas celulares. As eletromicrografias I e II mostram organelas citoplasmáticas distintas. Com base na identificação das organelas nas figuras I e II, sabemos que a primeira participa na síntese de lipídios, enquanto a segunda é responsável pela produção de proteínas. Essas organelas são, respectivamente: FIGURA – ORGANELAS FONTE: A autora a) b) c) d) e) ( ( ( ( ( ) Retículo endoplasmático liso e retículo endoplasmático rugoso. ) Retículo endoplasmático rugoso e retículo endoplasmático liso. ) Mitocôndrias e lisossomos. ) Complexo de Golgi e retículo endoplasmático liso. ) Retículo endoplasmático rugoso e ribossomos. 3 Paciente branco, 47 anos, tabagista com história de tosse produtiva crônica, expectoração purulenta abundante, cefaleia frontal e dor em região malar. Desde a infância apresentou vários episódios de sinusite, pneumonia e otite média. Ao exame: hipocratismo digital, sibilos difusos e estertores crepitantes em ambas as bases pulmonares. Espirometria revelou moderada obstrução sem resposta à terapia broncodilatadora. Radiografia de tórax com situs inversus, hiperinsuflação pulmonar. Exame de sêmen mostrou mobilidade reduzida e/ou ausente dos espermatozoides. Qual o diagnóstico do caso descrito? b) Qual estrutura celular apresenta-se comprometida neste caso? c) Descreva a composição da estrutura descrita. d) Qual a relação existente entre a mobilidade reduzida dos espermatozoides e os problemas respiratórios do paciente do caso e a estrutura celular acometida? 56 4 A membrana plasmática possui várias especializações, seja ela de um organismo unicelular ou pluricelular, estas especializações são variadas em relação às designações celulares. São especializações envolvidas com a união da célula à matriz extracelular, adesão célula-célula, uniões transitórias e especializações da superfície livre, como microvilosidades, cílios, flagelos, estereocílios. Sobre as especializações de membrana, analise as frases a seguir: I- Os hemidesmossomos têm como função unir a célula à matriz extracelular, através de proteínas chamadas de integrinas. II- A zônula de oclusão veda a passagem de substâncias entre as células e possui como proteínas as claudinas e ocludinas. III- Desmossomos são junções celulares, presentes no tecido muscular e possuem a proteína caderina. IV- As junções tipo GAP também são chamadas de junções comunicantes. A alternativa que contém as afirmativas CORRETAS é: a) ( ) I e III. b) ( ) I, II e IV. c) ( ) III e IV. d) ( ) I, II e III. e) ( ) II, III e IV. 57 58 UNIDADE 2 — BIOMOLÉCULAS OBJETIVOS DE APRENDIZAGEM A partir do estudo desta unidade, você deverá ser capaz de: • compreender a função biológica em termos químicos; • identificar as principais biomoléculas; • estabelecer as características que diferenciam as biomoléculas; • compreender que em cada organismo vivo as biomoléculas exercem funções que permitem a manutenção da vida; • estabelecer os princípios da bioquímica para explicar as biomoléculas em termos químicos; • identificar os monômeros que formam as macromoléculas; • compreender as funções das biomoléculas; • estabelecer que o surgimento de algumas patologias está associado a disfunções nas biomoléculas. PLANO DE ESTUDOS Esta unidade está dividida em sete tópicos. No decorrer dela, você encontrará autoatividades com o objetivo de reforçar o conteúdo apresentado. TÓPICO 1 – CARACTERÍSTICAS GERAIS DAS BIOMOLÉCULAS TÓPICO 2 – ÁGUA TÓPICO 3 – AMINOÁCIDOS, PEPTÍDEOS E PROTEÍNAS TÓPICO 4 – ENZIMAS TÓPICO 5 – CARBOIDRATOS E GLICOCONJUGADOS TÓPICO 6 – NUCLEOTÍDEOS E ÁCIDOS NUCLEICOS TÓPICO 7 – LIPÍDIOS CHAMADA Preparado para ampliar seus conhecimentos? Respire e vamos em frente! Procure um ambiente que facilite a concentração, assim absorverá melhor as informações. 59 CONFIRA A TRILHA DA UNIDADE 2! Acesse o QR Code abaixo: 60 UNIDADE 2 TÓPICO 1 — CARACTERÍSTICAS GERAIS 1 INTRODUÇÃO Bioquímica não é nada menos que a “química da vida”; com essa ciência a vida pode ser investigada, analisada e compreendida. O maior objetivo da bioquímica é explicar a forma e a função biológica em termos químicos. Uma das formas mais produtivas de abordar o entendimento dos fenômenos biológicos tem sido aquela de purificar os componentes químicos individuais, tais como a proteína de um organismo, e caracterizar a sua estrutura química ou sua atividade catalítica. No início do estudo das biomoléculas e de suas interações, algumas questões básicas merecem atenção. Quais espécies de moléculas estão presentes nos organismos vivos e em quais proporções? Quais são as estruturas dessas moléculas? Como interagem umas com as outras? Neste tópico, faremos uma revisão dos princípios químicos que estão relacionados com as propriedades das moléculas biológicas: ligação covalente entre os átomos de carbono entre si e com outros elementos, grupos funcionais que ocorrem nas biomoléculas, entre outras características. 2 COMPOSIÇÃO E LIGAÇÃO QUÍMICA No final do século XVIII, ficou evidente para os químicos que a composição da matéria viva era claramente diferente do mundo inanimado. Antoine Lavoisier (1743-1794) notou a relativa simplicidade química do mundo mineral e comparou com a complexidade do mundo dos animais e das plantas. Animais e plantas eram compostos por substâncias ricas nos elementos carbono, oxigênio, nitrogênio e fósforo. Dos mais de 90 elementos químicos que ocorrem naturalmente, apenas cerca de 30 são essenciais para os organismos vivos. A maioria dos elementos químicos da matéria viva tem números atômicos relativamente pequenos e apenas cinco deles têm número atômico acima do selênio. Os quatro elementos químicos mais abundantes nos organismos, em termos das porcentagens do número total de átomos, são o hidrogênio, o oxigênio, o nitrogênio e o carbono, os quais, juntos, perfazem mais de 99% da massa da maioria das células. Eles são os elementos mais leves, capazes formar uma, duas, três e quatro ligações, respectivamente. Em geral, os elementos mais leves formam as ligações químicas mais fortes (NELSON; COX, 2002). 61 12 D AV I D L . N E L S O N & M I C H A E L M . COX FIGURA 1 – ELEMENTOS ESSENCIAIS PARA A VIDA ANIMAL E PARA A MANUTENÇÃO DA SAÚDE 1 FIGURA 113 E vida e a saúde principais (verme rais das células e d dieta em uma qu dia. Para os elem tidades requerida manos, alguns m são suficientes, e demais elemento plantas e micror mostradas aqui; o quais eles adquire 2 H He 3 Elementos principais Elementos-traço 4 Li Be 11 19 Ca 37 38 Rb 55 Sr Al 21 Sc 39 Y 56 Cs Fr 13 Mg 20 K 6 Ba 88 Ra 22 23 Ti 40 Zr 72 24 V Cr 41 42 Nb 73 Hf Mo 74 Ta W 25 Mn 43 Tc 75 Re 7 B 12 Na 87 5 26 27 Fe 44 28 Co 45 Ru 46 Rh 76 77 Os Ni Pd 78 Ir Pt 29 Cu 47 Ag 79 Au 30 31 Zn 48 Ga 49 Cd 80 In 81 Hg Tl 8 C 14 15 Si 32 Ge 50 Sn 82 Pb 9 N As 51 Sb 83 Bi F 16 P 33 10 O 17 S Cl 34 35 Se 52 Br 53 Te 84 Po Ne 18 Ar 36 Kr 54 I 85 At Xe 86 Rn Lantanídeos Actinídeos FONTE: Nelson e Cox (2002, p. 42) Menos de 30 entre os mais de 90 elementos químicos bono também podem compartilha de ocorrência natural são essenciais para os organismos. A elétrons, formando assim ligações d maioria dos elementos da matéria viva tem um número atôAs quatro ligações simples que 3 BIOMOLÉCULAS SÃO COMPOSTOS DEatô-CARBONO mico relativamente baixo; somente três têm números átomo de carbono se projetam a p micos maiores do que o selênio, 34 (Figura 1-13). Os qua- os quatro vértices de um tetraed A química dos organismos está organizada ao redor doângulo elemento o tro elementos químicos mais vivos abundantes nos organismos de carbono, aproximadamente 109 quaisquer comprimento médio d em termos porcentagem total número qualvivos, representa mais dademetade do peso do seco dasde células. No de metano (CH4), ume átomo de é livresimples. em torno de cada l átomos, são hidrogênio, oxigênio, nitrogênio e carbono,formando que rotação carbono compartilha quatro pares de elétrons compartilhados, uma ligação juntos constituem mais de 99% da massa das células. Eles que grupos muito grandes ou altam Bertuzzi et al. (2008) relatam que o carbono pode também estabelecer ligações simples e são os elementos mais leves capazes de formar de maneira ligados aos átomos de carbono. Ne duplas com osuma, átomos de três oxigênio e com o de nitrogênio. eficiente duas, e quatro ligações; em geral, os ele- ser limitada. Já a ligação dupla é m mentos mais leves formam ligações mais fortes. Os elemen- nm) e rígida, permitindo somente De maior importância em biologia é fração a capacidade de ostorno átomos de carbono do seu eixo. tos-traço (Figura 1-13) representam uma minúscula Átomos carbonode carbono covalentem do peso do corpo mas todos à vida, compartilharem pareshumano, de elétrons entresão si essenciais para formar ligações simples léculas podem formar cadeias linea geralmente porsão serem essenciais a função carbono, as quais muito estáveis.para Cada átomo de de proteícarbono também pode formar nas específicas, incluindo muitas enzimas. A capacidade turas cíclicas. Aparentemente, a ve ligações simples com um, dois, três ou quatro átomos de carbono. Dois átomos de de transporte de oxigênio da hemoglobina, por exemplo, é carbono com outro carbono e com carbono podemdependente também compartilhar dois ferro, (ou três) de elétrons, formando assim principal fator na seleção dos com totalmente de quatro íons quepares somados ligações duplas ou triplas carbono-carbono (Figura 2). a maquinaria molecular das célul representam somente 0,3% da massa total. evolução dos organismos vivos. N químico consegue molécul As quatro ligações simples que podem ser estabelecidas por um átomo formar de Biomoléculas são compostos de carbono com uma de tamanhos, formas e composição carbono estão dispostas tetraedricamente. Os grupos participantes de cada ligação grande variedade de grupos funcionais A maioria das biomoléculas der simples carbono-carbono podem girar livremente ao redor dela; essa liberdade sofre tendo átomos de hidrogênio subs A química dos organismos vivos está organizada em torno restrições somente essas ligações estão ocupadas por grupos muito variedade de grandes grupos funcionais qu do carbono, quequando contribui com mais da metade do peso ou quando são portadoras de cargas elétricas muito altas (NELSON; COX, 2002). químicas específicas à molécula, fo seco das células. O carbono pode formar ligações simples com átomos de hidrogênio, assim como ligações simples e de compostos orgânicos. Exemplo culas são os álcoois, duplas átomos de oxigênio e nitrogênio 1-14). podem Os com átomos de carbono unidos entre si (Figura covalentemente formar cadeiasque têm um o aminas, com grupos amina; aldeí A capacidade dos átomos de carbono de formar ligações lineares, cadeias ramificadas e estruturas cíclicas. Outros grupos de átomos, chamados simples estáveis com até quatro outros átomos de carbono pos carbonila; e ácidos carboxílic grupos funcionais, são adicionados a esses esqueletos carbônicos, o que confere é de grande importância na biologia. Dois átomos de car- la (Figura 1-16). Muitas biomolé propriedades químicas específicas à molécula assim formada. As moléculas que contêm esqueletos carbônicos são chamadas de compostos orgânicos; eles ocorrem em uma variedade quase ilimitada. A maioria das biomoléculas são compostos orgânicos; C 1 H C N C 1 N H C H C N portanto, podemos inferirC que a versatilidade de ligações do carbono foi um fator maior 62 C 1 O C O C O C 1 C C C C C na seleção dos compostos de carbono para a maquinaria molecular das células durante a origem e a evolução dos organismos vivos. Nenhum outro elemento químico pode formar moléculas com tanta diversidade de formas e de tamanhos ou com tal variedade de grupos funcionais (RODWELL; MURRAY; GRANNER, 2017). FIGURA 2 – OBSERVE A VERSATILIDADE DO ÁTOMO DE CARBONO EM FORMAR LIGAÇÕES COVALENTES FONTE: Bertuzzi et al. (2008, p. 36) 4 GRUPOS FUNCIONAIS PROPRIEDADES QUÍMICAS DETERMINAM AS A maioria das biomoléculas pode ser vista como derivada dos hidrocarbonetos, os quais são compostos formados por um esqueleto de átomos de carbono ligados covalentemente entre si e aos quais estão ligados apenas átomos de hidrogênio. Os esqueletos carbônicos desses compostos são muito estáveis. Os átomos de hidrogênio podem ser substituídos individualmente por uma grande variedade de grupos funcionais para formar famílias diferentes dos compostos orgânicos. Famílias típicas de compostos orgânicos são: os álcoois, os quais possuem um ou mais grupos hidroxila; as aminas, possuidoras do grupo funcional amino; os aldeídos e as cetonas, os quais possuem o grupo carbonila; e os ácidos carboxílicos, que exibem os grupos carboxilas (NELSON; COX, 2002). Na Figura 3 podemos observar todos os grupos em sua forma neutra (não ionizada). Nesta figura, e em toda parte deste livro didático, usamos R para representar “qualquer substituinte”. Pode ser um simples átomo de H, mas tipicamente ele é uma porção que contém carbono. Quando dois ou mais constituintes são mostrados em uma molécula, iremos designar R1, R2, e assim por diante. 63 FIGURA 3 – ALGUNS DOS GRUPOS FUNCIONAIS COMUNS DE BIOMOLÉCULAS FONTE: Nelson e Cox (2002, p. 43) 5 ESTRUTURA TRIDIMENSIONAL: CONFIGURAÇÃO E CONFORMAÇÃO Embora as ligações covalentes e os grupos funcionais das biomoléculas tenham importância central para a função delas, eles não contam toda a história; o arranjo espacial em três dimensões dos átomos de uma biomolécula – sua estereoquímica – é também crucialmente importante. Os compostos de carbono podem existir como estereoisômeros, moléculas nas quais a ordem das ligações é a mesma, mas a relação espacial entre os átomos é diferente. Interações moleculares entre biomoléculas são invariavelmente estereoespecíficas; isto é, elas requerem estereoquímica específica nas moléculas interativas (BERG; TYMOCZKO; STRYERT, 2015). A Figura 4 mostra três maneiras de ilustrar a configuração estereoquímica das moléculas simples. O diagrama ilustra perspectivas específicas de forma não ambígua à configuração (estereoquímica) de um composto. O modelo bola e bastão representa melhor os ângulos entre as ligações e o comprimento da ligação centro a centro, enquanto os contornos das moléculas são mais bem representados pelos modelos do tipo espaço-cheio (NELSON; COX, 2002). 64 FIGURA 4 – MANEIRAS DE ILUSTRAR A CONFIGURAÇÃO ESTEREOQUÍMICA FONTE: Nelson e Cox (2002, p. 44) A configuração de uma molécula geralmente é mudada somente pela quebra de uma ligação. Configuração é o arranjo espacial de uma molécula orgânica, que lhe é conferido ou pela presença de duplas ligações, ao redor das quais não existe liberdade de rotação, ou então por centros quirais, ao redor dos quais os grupos substituintes estão arranjados em uma sequência específica. A característica identificadora dos isômeros configuracionais é que eles podem ser convertidos um no outro sem a quebra de uma ou mais ligações covalentes (BERG; TYMOCZKO; STRYERT, 2015). Segundo Berg (2014), a conformação molecular é alterada pela rotação ao redor das ligações simples. O termo conformação molecular refere-se ao arranjo espacial dos grupos substituintes que são livres para assumir diferentes posições no espaço, sem a quebra de qualquer ligação, devido à liberdade de rotação da ligação. Por exemplo, no etano, um hidrocarboneto simples, existe uma liberdade de rotação quase completa ao redor da ligação simples carbono-carbono. Muitas conformações moleculares do etano, diferentes e interconvertíveis, são possíveis, dependendo do grau de rotação. 6 REATIVIDADE QUÍMICA Os mecanismos das reações bioquímicas não são diferentes dos de outras reações químicas. Eles podem ser entendidos e previstos a partir da natureza dos grupos funcionais dos reagentes. Os grupos funcionais alteram a distribuição eletrônica e a geometria dos átomos vizinhos e dessa maneira afetam a reatividade química de toda a molécula. Embora um grande número de reações químicas diferentes ocorra em uma célula típica, essas reações são de apenas alguns tipos gerais. Abordaremos de forma geral e breve os aspectos fundamentais sobre ligação química e reatividade (NELSON; COX, 2002). 65 Para Berg (2014), nas reações químicas, ligações são quebradas e novas são formadas. A força de uma ligação química depende de eletronegatividades relativas – as afinidades relativas por elétrons – dos elementos ligados (Tabela 1), da distância dos elétrons que participam da ligação em relação a cada um dos núcleos e da carga nuclear de cada átomo. TABELA 1 – A ELETRONEGATIVIDADE DE ALGUNS ELEMENTOS QUÍMICOS Elemento Eletronegatividade Elemento Eletronegatividade F 4,0 Fe 1,8 O 3,5 Co 1,8 Cl 3,0 Ni 1,8 N 3,0 Mo 1,8 Br 2,8 Zn 1,6 S 2,5 Mn 1,5 C 2,5 Mg 1,2 I 2,5 Ca 1,0 Se 2,4 Li 1,0 P 2,1 Na 0,9 H 2,1 K 0,8 FONTE: Berg (2014, p. 45) É importante ressaltar que quanto maior for o número da eletronegatividade, tanto mais eletronegativo é o elemento. O número de elétrons compartilhados também influencia a força da ligação; ligações duplas são mais fortes que ligações simples, e ligações triplas são ainda mais fortes. Na Tabela 2 podemos observar a energia de dissociação das ligações mais frequentes nas biomoléculas. Podemos observar que quanto maior a energia requerida para a dissociação da ligação (quebra), mais forte é essa ligação (NELSON; COX, 2002). TABELA 2 – ENERGIA DE DISSOCIAÇÃO (RESISTÊNCIA) NAS BIOMOLÉCULAS Tipo de ligação Energia de dissociação da ligação (kJ/mol) Ligações Simples O–H 461 H–H 435 P–O 419 C–H 414 N–H 389 C–O 352 Ligações Duplas C=O 712 C=N 615 C=C 611 FONTE: Nelson e Cox (2002, p. 49) 66 A força de uma ligação química é expressa em joules, e conhecida como energia de ligação (em bioquímica, as calorias têm sido as unidades de energia mais frequentemente empregadas, como por exemplo, para expressar a força de ligação e a energia livre; o joule é a unidade de energia no Sistema Internacional de Unidades e será usado para conversões, 1 cal é igual a 4,184J). A energia de ligação pode ser imaginada como a quantidade de energia ganha pelo ambiente, quando os dois átomos formam essa ligação. Um meio de se introduzir energia em um sistema é aquecê-lo, o que dá às moléculas maior energia cinética; a temperatura é uma medida da energia cinética média de uma população de moléculas. Quando o movimento molecular é suficientemente violento, as vibrações intramoleculares e as colisões intermoleculares podem, em algumas ocasiões, quebrar as ligações químicas. O aquecimento aumenta a fração de moléculas com energia suficientemente alta para reagir. Quando o movimento molecular é suficientemente violento, vibrações intramoleculares e colisões intermoleculares, algumas vezes, quebram ligações e permitem a formação de novas (NELSON; COX, 2002, p. 49). Quando nas reações químicas as ligações são quebradas e novas ligações são formadas, a diferença entre a energia do ambiente usada para romper as ligações e a energia recebida pelo ambiente na formação de novas ligações é virtualmente idêntica à variação da entalpia para a reação (NELSON; COX, 2002). A maioria das células tem a capacidade de realizar milhares de reações específicas e enzimaticamente catalisadas, como por exemplo, a transformação de nutrientes simples, como a glicose em aminoácidos, nucleotídeos ou lipídios; a extração de energia dos alimentos por oxidação ou a polimerização de subunidades em macromoléculas (BAYNES, 2015). As reações nas células vivas pertencem a um dos cinco tipos (ou categorias) gerais: (1) oxidação-redução; (2) reações que formam ou quebram ligações carbonocarbono; (3) reações que rearranjam a estrutura das ligações ao redor de um ou mais átomos de carbono; (4) transferência de grupos funcionais; (5) reações nas quais duas moléculas se condensam com a eliminação de uma molécula de água. As reações em uma mesma categoria geral ocorrem por meio de mecanismos similares (BAYNES, 2015). Quando os dois átomos que compartilham elétrons em uma ligação covalente têm afinidade igual para os elétrons, como no caso de dois átomos de carbono, a ligação resultante é não polar. Quando dois elementos diferem em afinidade por elétrons, ou eletronegatividade, formam uma ligação covalente (por exemplo, C e O), a ligação é polarizada, ou seja, os elétrons compartilhados estarão na região do átomo mais eletronegativo (O) e não naquela do átomo menos eletronegativo (C). No caso extremo de dois átomos de eletronegatividade muito diferente (Na e Cl, por exemplo), um dos átomos cede os elétrons para o outro átomo, resultando na formação de íons e interações iônicas, como a existente no cloreto de sódio (NaCl) sólido (NELSON; COX, 2002). 67 Nas ligações carbono-hidrogênio, o carbono mais eletronegativo possui os dois elétrons compartilhados com H, mas, nas ligações carbono-oxigênio, os dois elétrons estão deslocados unicamente em favor do oxigênio. Então, na transformação de – CH3 (um alcano) para – CH2OH (um álcool), o átomo de carbono perde efetivamente elétrons, o que é por definição: oxidação. A Figura 5 mostra que átomos de carbono encontrados em bioquímica podem existir em cinco estados de oxidação (alcano, álcool, aldeído, ácido carboxílico e dióxido de carbono), dependendo dos elementos com os quais o carbono compartilha elétrons (NELSON; COX, 2002). FIGURA 5 – ESTADO DE OXIDAÇÃO DO CARBONO EM BIOMOLÉCULAS FONTE: <https://image.slidesharecdn.com/biomoleculas-121110173452-phpapp02/95/biomoleculas-23-638.jpg?cb=1352569229>. Acesso: 10 abr. 2019. Em muitas oxidações biológicas, um composto perde dois elétrons e dois íons de hidrogênio (isto é, dois átomos de hidrogênio); essas reações são comumentemente chamadas de desidrogenações e as enzimas que as catalisam são chamadas de desidrogenases. Em algumas, mas não em todas as oxidações biológicas, um átomo de carbono torna-se covalentemente ligado a um átomo de oxigênio. As enzimas que catalisam essas oxidações são geralmente chamadas de oxidases (BERTUZZI et al., 2008). De acordo com Nelson e Cox (2002, p. 50): Toda oxidação é acompanhada de redução, na qual um grupo que recebe elétrons adquire os elétrons removidos pela oxidação. Reações de oxidação geralmente liberam energia (imagine um incêndio no campo, em que vários compostos da madeira são oxidados pelas macromoléculas de oxigênio do ar). A maioria das células vivas obtém a energia necessária para o trabalho celular oxidando combustíveis, como carboidratos ou gorduras; organismos fotossintéticos podem também usar a energia da luz solar. As vias catabólicas são reações de oxidação-redução em cadeia que resultam na transferência de elétrons das moléculas combustíveis por meio de uma série de transportadores de elétrons até oxigênio. A afinidade alta do O2 por elétrons torna todo processo de transferência de elétrons altamente exergônico, fornecendo a energia que impulsiona a síntese de ATP – o objetivo central do catabolismo. 68 FIGURA 6 – ESQUEMA DE UMA REAÇÃO DE OXIDAÇÃO E REDUÇÃO FONTE: A autora 7 MACROMOLÉCULAS MONOMÉRICAS E SUAS SUBUNIDADES Muitas moléculas encontradas no interior das células são macromoléculas, polímeros de alto peso molecular construídos com precursores relativamente simples. Os polissacarídeos, as proteínas e os ácidos nucleicos, os quais podem ter pesos moleculares variando de dezenas de milhares até bilhões (DNA), são construídos pela polimerização de subunidades relativamente pequenas, de peso molecular ao redor de 500 ou menos. A síntese de macromoléculas é uma atividade celular que pode ser classificada como forte consumidora de energia (RODWELL; MURRAY; GRANNER, 2017). A Tabela 3 mostra as principais classes de biomoléculas em um organismo unicelular típico, a Escherichia coli. A água é o composto simples mais abundante na E. coli e em todas as outras células e organismos. Em todos os tipos de células, quase toda a matéria sólida é substância orgânica e está presente em quatro formas principais: proteínas, ácidos nucleicos, carboidratos e lipídios. Os sais inorgânicos e os elementos minerais constituem apenas uma fração muito pequena do peso seco total (BERG; TYMOCZKO; STRYERT, 2015). TABELA 3 – COMPONENTES MOLECULARES DE UMA CÉLULA DA E. COLI Porcentagem do peso total da célula Número aproximado das diferentes espécies moleculares Água 70 1 Proteínas 15 3.000 DNA 1 1 RNA 6 > 3.000 Carboidratos 3 5 Lipídios 2 20 Íons inorgânicos 1 20 Ácidos Nucleicos FONTE: Adaptado de Berg, Tymoczko e Stryert (2015) 69 As proteínas são polímeros de aminoácidos, constituem ao lado da água a maior fração das células. Algumas proteínas têm atividade catalítica e funcionam como enzimas, outras servem como elementos estruturais e ainda transportam sinais específicos (no caso dos receptores) ou substâncias específicas (no caso das proteínas de transporte) para o interior ou exterior das células. As proteínas podem ser consideradas as mais versáteis das biomoléculas. Os ácidos nucleicos, DNA e RNA, são polímeros de nucleotídeos. Eles armazenam, transmitem e transcrevem a informação genética (NELSON; COX, 2014). Os carboidratos, polímeros de açúcares ou hidratos de carbono, têm duas principais funções: servem como armazenadores de energia (na forma de glicogênio e amido) e como elementos estruturais (celulose e quitina, por exemplo). Carboidratos (oligossacarídeos) ligados a proteínas ou lipídios na superfície celular servem como receptores para sinalizadores específicos. Entre seus inúmeros papéis, os lipídios, derivados oleaginosos dos hidrocarbonetos, servem principalmente como componentes estruturais das membranas e como forma de armazenamento de alimentos ricos em energia. Todas essas quatro classes de grandes biomoléculas são sintetizadas em reações de condensação (NELSON; COX, 2002). Cada uma dessas macromoléculas tem diferentes funções nos organismos vivos. Os aminoácidos, por exemplo, não são apenas as subunidades monoméricas das proteínas; alguns agem como neurotransmissores e como precursores de hormônios e toxinas. A adenina serve tanto como subunidades na estrutura dos ácidos nucleicos e do ATP, como neurotransmissora. Os ácidos graxos servem como componentes de membranas lipídicas complexas, como gorduras ricas em energia e que funcionam como reserva de alimentos e também como precursores de um grupo de moléculas sinalizadoras potentes, os eicosanoides (BERG; TYMOCZKO; STRYERT, 2015). Nos tópicos seguintes, conheceremos as principais características bioquímicas das biomoléculas. 70 RESUMO DO TÓPICO 1 Neste tópico, você adquiriu certos aprendizados, como: • A maior parte do peso seco dos organismos vivos consiste de compostos orgânicos, moléculas que contêm esqueletos ou estruturas de átomos de carbono ligados covalentemente entre si. • Átomos de carbono, nitrogênio, hidrogênio e oxigênio podem ser ligados. • Aos esqueletos carbônicos são ligados diferentes tipos de grupos funcionais, o que determina as propriedades químicas das moléculas orgânicas. • As forças das ligações químicas covalentes, medidas em joules, dependem da eletronegatividade e do tamanho dos átomos que compartilham elétrons. • A variação da entalpia para uma reação química reflete o número e o tipo de ligações que são quebradas ou sintetizadas. • Para as reações endotérmicas, a variação da entalpia é positiva, para as reações exotérmicas, negativa. • As diferentes reações químicas que ocorrem no interior de uma célula pertencem a cinco categorias gerais: reações de oxidação-redução, quebra ou formação de ligações carbono-carbono, rearranjo de ligações ao redor de átomos de carbono, transferência de grupos e condensações. • A maior parte da matéria orgânica nas células vivas consiste em macromoléculas: ácidos nucleicos, proteínas e carboidratos. • Moléculas de lipídios, outro componente importante das células, são moléculas pequenas que formam grandes agregados. • Cada tipo de macromolécula é composto de subunidades monoméricas pequenas unidas por ligações covalentes. • Ácidos nucleicos e proteínas são macromoléculas informacionais; as sequências características de suas subunidades constituem a individualidade genética da espécie. • Os carboidratos simples funcionam como componentes estruturais, mas os mais complexos também são macromoléculas informacionais. 71 AUTOATIVIDADE 1 No laboratório de bioquímica, primeiramente é necessário separar a molécula de interesse de outras biomoléculas presentes em uma amostra – isto é, purificar proteínas, ácidos nucleicos, carboidratos ou lipídios. Pela observação das subunidades monoméricas das quais as biomoléculas grandes são formadas, você deve imaginar quais características dessas biomoléculas permitem separá-las umas das outras. a) Quais características do aminoácido e do ácido graxo permitiriam separá-los facilmente um do outro? b) Como os nucleotídeos devem ser separados das moléculas de glicose? 2 Alguns anos atrás, duas companhias farmacêuticas comercializaram um remédio sob os nomes de Dexedrina e Benzedrina. A estrutura da droga é mostrada a seguir: FIGURA – ESTRUTURA QUÍMICA DA DEXEDRINA FONTE: Nelson e Cox (2014, p. 53) As propriedades físicas e químicas (elementos constitutivos como C, H, N, ponto de fusão, solubilidade etc.) de ambas eram idênticas. A dosagem por via oral recomendada da Dexedrina era 5 mg por dia, mas a dosagem recomendada da Benzedrina era significativamente mais alta. Aparentemente, para um mesmo efeito, era necessária uma dose muito menor de Dexedrina. Explique essa contradição. 72 TÓPICO 2 - UNIDADE 2 ÁGUA 1 INTRODUÇÃO A água é a substância mais abundante nos sistemas vivos, constituindo mais de 70% do peso da maioria dos organismos. O primeiro organismo vivo na Terra, sem dúvida, nasceu em ambiente aquoso, e o curso da evolução tem sido moldado pelas propriedades do meio aquoso no qual a vida começou (NELSON; COX, 2014). Dentre as várias funções que a água desempenha nas células, podemos citar algumas, como: solvente para compostos bioquímicos, recebe resíduo, absorve calor e participa diretamente das reações químicas. Sem água, a vida como a conhecemos, poderia não existir, pois nenhum organismo pode permanecer biologicamente ativo sem água. Neste tópico, conheceremos as propriedades físicas e químicas da água, às quais são adaptados todos os aspectos da estrutura e função da célula, as forças de atração entre as moléculas de água, ionização da água e ação do tamponamento contra as variações de pH nos sistemas biológicos. 2 PONTES DE HIDROGÊNIO As ligações de hidrogênio entre moléculas de água fornecem as forças coesivas que fazem da água um líquido à temperatura ambiente e um sólido cristalino (gelo) com arranjo altamente ordenado de moléculas em temperaturas frias. As biomoléculas polares se dissolvem facilmente em água porque elas podem substituir interações entre as moléculas de água (água-água) por interações energeticamente mais favoráveis entre a água e o soluto (água-soluto). Em contrapartida, as biomoléculas apolares são pouco solúveis em água porque interferem nas interações do tipo água-água, mas são incapazes de formar interações do tipo água-soluto. Em soluções aquosas, moléculas apolares tendem a formar agregados. Ligações de hidrogênio e interações iônicas, hidrofóbicas (do grego, “medo de água”) e de Van der Waals são individualmente fracas, mas coletivamente têm influência significativa nas estruturas tridimensionais de proteínas, ácidos nucleicos, polissacarídeos e lipídios de membranas (NELSON; COX, 2014). As ligações ou pontes de hidrogênio são responsáveis pelas propriedades incomuns da água. A água tem ponto de fusão, ebulição e calor de vaporização mais alto que os outros solventes comuns. Essas propriedades incomuns são uma consequência 73 da atração entre as moléculas de água adjacentes que oferecem à água líquida grande coesão interna. A visualização da estrutura eletrônica da molécula de H2O revela a origem dessas atrações intermoleculares (NELSON; COX, 2014). TABELA 4 – PONTO DE FUSÃO, PONTO DE EBULIÇÃO E CALOR DE VAPORIZAÇÃO DE ALGUNS SOLVENTES COMUNS Ponto de fusão (ºC) Ponto de ebulição Calor de Vaporização (ºC) J/g Água 0 100 2.260 Metanol -98 65 1.100 Etanol -117 78 854 Propanol -127 97 687 Acetona -95 56 523 Hexano -98 69 423 Benzeno 6 80 394 Butano -135 -0,5 381 Clorofórmio -63 61 24 FONTE: Adaptado de Nelson e Cox (2014) Cada átomo de hidrogênio de uma molécula de água compartilha um par de elétrons com o átomo central do oxigênio. A geometria da molécula é ditada pela forma dos orbitais eletrônicos mais externos do átomo de oxigênio, que são similares aos orbitais ligantes sp3 do carbono. Na Figura 7 observamos que esses orbitais descrevem um formato aproximado de tetraedro, com um átomo de hidrogênio em cada um de dois vértices e pares de elétrons não compartilhados nos outros dois. O núcleo do átomo de oxigênio atrai elétrons mais fortemente que o núcleo de hidrogênio (um próton); ou seja, o oxigênio é mais eletronegativo. Isso significa que os elétrons compartilhados estão mais frequentemente nas vizinhanças do átomo de oxigênio que os de hidrogênio. O resultado desse compartilhamento desigual de elétrons é a formação de dois dipolos elétricos na molécula de água (COOPER, 2001). NOTA Você sabia? Que a quantidade de água é diretamente proporcional ao metabolismo da célula? Células com uma atividade metabólica intensa, como por exemplo, os neurônios, possuem 80% de água no seu interior. 74 Na figura a seguir podemos observar a natureza dipolar da molécula de água em modelo de esfera e bastão, em que as linhas tracejadas representam os orbitais não ligantes. Existe um arranjo aproximadamente tetraédrico dos pares de elétrons mais externos da camada ao redor do átomo de oxigênio; os dois átomos de hidrogênio têm cargas parciais positivas e o átomo de oxigênio tem carga parcial negativa. Em (b) vê-se duas moléculas de H2O unidas por ligações de hidrogênio, representada por três linhas azuis. FIGURA 7 – ESTRUTURA DA MOLÉCULA DE ÁGUA FONTE: Nelson e Cox (2014, p. 48) As ligações de hidrogênio não são exclusivas para a molécula de água. Elas se formam prontamente entre um átomo eletronegativo (aceptor de hidrogênio, geralmente oxigênio ou nitrogênio) e um átomo de hidrogênio ligado covalentemente a outro átomo eletronegativo (doador de hidrogênio) na mesma molécula ou em outra (Figura 8). Átomos de hidrogênio covalentemente ligados a átomos de carbono não participam de ligações de hidrogênio, porque o átomo de carbono é somente um pouco mais eletronegativo que o hidrogênio e, portanto, a ligação C-H é apenas levemente polar (RODWELL; MURRAY; GRANNER, 2017). FIGURA 8 – LIGAÇÕES DE HIDROGÊNIO COMUM EM SISTEMAS BIOLÓGICOS FONTE: <https://player.slideplayer.com.br/46/11652478/data/images/img15.jpg>. Acesso em: 11 abr. 2019. 75 3 INTERAÇÕES DE VAN DER WAALS Quando dois átomos não carregados são colocados bem próximos um do outro, as suas nuvens eletrônicas influenciam uma à outra. Variações aleatórias nas posições dos elétrons ao redor do núcleo podem criar um dipolo transitório elétrico, que induz à formação de um dipolo transiente de carga oposta no átomo mais próximo a ele. Os dois dipolos atraem-se fracamente um ao outro, aproximando os dois núcleos. Essas atrações fracas são chamadas de interações de Van der Waals (também conhecidas como forças de London). À medida que os dois núcleos se aproximam, as nuvens eletrônicas começam a repelir uma à outra. Nesse ponto, no qual a atração líquida é máxima, diz-se que o núcleo está em contato de Van der Waals. Cada átomo tem um raio de Van der Waals característico, uma medida do quão próximo um átomo permite que outro se aproxime (NELSON; COX, 2014). 4 IONIZAÇÃO DA ÁGUA, ÁCIDOS FRACOS E BASES FRACAS Embora muitas propriedades de solvente da água possam ser explicadas em termos da molécula de água não carregada, o pequeno grau de ionização da água em seus íons (H1) e (OH–) deve também ser levado em consideração. Como todas as reações reversíveis, a ionização da água pode ser descrita por uma constante de equilíbrio. Quando ácidos fracos são dissolvidos na água, eles contribuem com um H1 por ionização; bases fracas consomem um H1 se tornando protonadas. Esses processos também são governados por constantes de equilíbrio. A concentração total dos íons hidrogênio a partir de todas as fontes é experimentalmente mensurável, sendo expressa como o pH da solução. Para predizer o estado de ionização de solutos na água, devem-se considerar as constantes de equilíbrio relevantes para cada reação de ionização (NELSON; COX, 2014, p. 58). Para Rodwel, Murry e Granner (2017), as moléculas de água têm a leve tendência de sofrer uma ionização reversível, produzindo um íon hidrogênio (próton) e um íon hidróxido, gerando o equilíbrio: H2O Δ H1 1 OH (2-1). Apesar de geralmente se mostrar o produto de dissociação da água como H1, os prótons livres não existem em solução; os íons hidrogênio formados em água são imediatamente hidratados para formar íons hidrônio (H3O). As ligações de hidrogênio entre as moléculas de água fazem com que a hidratação dos prótons dissociados seja praticamente instantânea. A ionização da água pode ser medida pela sua condutividade elétrica; a água pura carrega corrente elétrica enquanto o H3O1 migra para o cátodo e OH– para o ânodo. O movimento dos íons hidrônio e hidróxido no campo elétrico é extremamente rápido comparado com o de outros íons como Na1, K1 e Cl–. Essa alta mobilidade iônica resulta do tipo de “salto de prótons”, mostrado na Figura 9. Os prótons individuais não se movem para muito longe na solução, mas uma série de prótons salta entre as moléculas 76 de água ligadas por hidrogênio e gera um movimento líquido de prótons por uma longa distância em um tempo extremamente curto (OH também se move rapidamente por saltos, mas na direção oposta). Como resultado da alta mobilidade iônica do H1, reações ácido/básicas em soluções aquosas são excepcionalmente rápidas. FIGURA 9 – SALTO DE PRÓTONS FONTE: Nelson e Cox (2014, p. 58) O produto iônico da água, Kw, é a base para a escala de pH. É um meio conveniente de designar a concentração de H1 (e, portanto, de OH–) em qualquer solução aquosa no intervalo de 1,0 M H1 e 1,0 M OH–. O termo pH é definido pela expressão: pH = log 1 H+ = − log H + O símbolo p denota “logaritmo negativo de”. Para uma solução neutra a 25 ºC, na qual a concentração de íons hidrogênio é exatamente 1,0 3 10–7 M. Quando temos uma solução com pH 7, uma solução neutra não é um número escolhido arbitrariamente, sendo derivado do valor absoluto do produto iônico da água a 25 ºC, que, por uma coincidência conveniente, é um valor inteiro. 77 Soluções com pH maior que 7 são alcalinas ou básicas; a concentração de OH– é maior que a de H1. Inversamente, soluções tendo pH menor que 7 são ácidas. Lembrese de que a escala de pH é logarítmica e não aritmética. Se duas soluções diferem em pH por uma (1) unidade, isso significa que uma solução tem dez vezes mais a concentração de íons H1 que a outra, mas isso não indica a magnitude absoluta da diferença. Um refrigerante de cola (pH 3,0) ou um vinho tinto (pH 3,7) têm uma concentração de íons H1 de aproximadamente 10.000 vezes a do sangue (pH 7,4) (NELSON; COX, 2014). O pH de uma solução aquosa pode ser medido por aproximação, usando vários tipos de indicadores coloridos, incluindo tornassol, fenolftaleína e vermelho de fenol. Essas substâncias passam por uma mudança de cor quando um próton se dissocia da molécula. Determinações precisas do pH em laboratórios químicos ou clínicos são feitas com um eletrodo de vidro que é seletivamente sensível à concentração dos íons H1, mas insensível à concentração de Na1, K1 e outros cátions. Em um pH-metro, o sinal do eletrodo de vidro colocado em uma solução de teste é amplificado e comparado com o sinal gerado por uma solução de pH conhecido (NELSON; COX, 2014). A medida do pH é um dos procedimentos mais importantes e usados com mais frequência na bioquímica. O pH afeta a estrutura e a atividade de macromoléculas biológicas; por exemplo, a atividade catalítica das enzimas é extremamente dependente do pH. As medidas do pH do sangue e da urina são comumentemente usadas em diagnóstico médico. O pH do plasma sanguíneo das pessoas com diabetes grave e não controlado é comumentemente abaixo do valor normal de 7,4; essa condição é chamada de acidose. Em outras doenças, o pH sanguíneo é mais alto que o normal, uma condição conhecida como alcalose. A acidose ou a alcalose extrema podem ameaçar a vida. 5 AÇÃO TAMPONANTE CONTRA AS VARIAÇÕES DE PH NOS SISTEMAS BIOLÓGICOS Quase todos os processos biológicos são dependentes do pH; uma pequena mudança no pH produz uma grande mudança na velocidade do processo. Os grupos amino e carboxila protonados de aminoácidos e os grupos fosfato de nucleotídeos, por exemplo, agem como ácidos fracos; o seu estado iônico é determinado pelo pH do meio circundante. As interações iônicas estão entre as forças que estabilizam a molécula da proteína e permitem que uma enzima reconheça e se ligue ao seu substrato (BERG; TYMOCZKO; STRYERT, 2015). Células e organismos mantêm um pH citosólico específico e constante, em geral, perto de pH 7, mantendo biomoléculas em seu estado iônico otimizado. Em organismos multicelulares, o pH dos fluidos extracelulares também é rigorosamente regulado. A constância do pH é atingida principalmente por tampões biológicos: misturas de ácidos fracos e suas bases conjugadas (NELSON; COX, 2014). 78 Tampões são sistemas aquosos que tendem a resistir a mudanças de pH quando pequenas quantidades de ácido (H1) ou base (OH–) são adicionadas. Um sistema tampão consiste em um ácido fraco (o doador de prótons) e sua base conjugada (o aceptor de prótons). Como um exemplo, uma mistura de concentrações iguais de ácido acético e íons acetato, encontradas no ponto central da titulação na Figura 10, é um sistema tampão. Observe que a curva de titulação do ácido acético tem uma zona relativamente plana que se estende por cerca de uma unidade de pH em ambos os lados do seu pH do ponto central de 4,76. Nessa zona, uma dada quantidade de H1 ou OH– adicionada ao sistema tem muito menos efeito no pH que a mesma quantidade adicionada fora da zona. Essa zona relativamente plana é a região de tamponamento do par tampão ácido acético/acetato (RODWELL; MURRAY; GRANNER, 2017). No ponto central da região de tamponamento, no qual a concentração do doador de prótons (ácido acético) é exatamente igual à do aceptor de prótons (acetato), a força de tamponamento do sistema é máxima; isto é, seu pH muda menos pela adição de H1 ou OH–. O pH do sistema tampão acetato muda levemente quando uma pequena quantidade de H1 ou OH– é adicionada, mas essa mudança é muito pequena comparada com a mudança de pH que resultaria se a mesma quantidade de H1 ou OH– fosse adicionado à água pura ou a uma solução salina de um ácido forte e de uma base forte, como NaCl, que não tem poder tamponante (NELSON; COX, 2014). FIGURA 10 – CURVA DE TITULAÇÃO DO ÁCIDO ACÉTICO FONTE: Nelson e Cox (2014, p. 62) 79 Sackheim (2001) relata que o tamponamento resulta do equilíbrio entre duas reações reversíveis ocorrendo em uma solução de concentrações quase iguais de doador de prótons e de seu aceptor de prótons conjugado. A Figura 11 explica como um sistema tampão funciona. Sempre que H1 ou OH– é adicionado em um tampão, o resultado é uma pequena mudança na razão das concentrações relativas dos ácidos fracos e seus ânions e, portanto, uma pequena mudança no pH. O decréscimo na concentração de um componente do sistema é equilibrado exatamente pelo aumento do outro. A soma dos componentes do tampão não muda somente a sua razão. FIGURA 11 – ACÉTICO/ACETATO COMO SISTEMA TAMPÃO FONTE: Nelson e Cox (2014, p. 64) Os fluidos intracelulares ou extracelulares de organismos multicelulares têm como característica um pH quase constante. A primeira linha de defesa dos organismos contra mudanças internas de pH é proporcionada por sistemas tampão. O citoplasma da maioria das células contém altas concentrações de proteínas e, estas, contêm muitos aminoácidos com grupos funcionais que são ácidos fracos ou bases fracas. Por exemplo, a cadeia lateral da histidina tem um pKa de 6,0 e, por isso, pode existir tanto nas formas protonadas quanto nas desprotonadas, próximo ao pH neutro. Proteínas contendo resíduos de histidina, portanto, são tampões efetivos próximo ao pH neutro. Nucleotídeos como ATP, assim como muitos metabólitos de baixa massa molecular, contêm grupos ionizáveis que podem contribuir para o poder tamponante do citoplasma. Algumas organelas altamente especializadas e compartimentos extracelulares apresentam altas concentrações de compostos que contribuem para a capacidade de tamponamento: ácidos orgânicos tamponam os vacúolos das células das plantas; amônia tampona a urina (RODWELL; MURRAY; GRANNER, 2017). Dois tampões biológicos especialmente importantes são o sistema fosfato e o bicarbonato. O tampão fosfato, que age no citoplasma de todas as células, consiste em H2PO4 – como doador de prótons e HPO como aceptor de prótons. O sistema tampão fosfato é mais efetivo em um pH perto de seu pKa de 6,86 e, portanto, tende a resistir 80 a mudanças de pH em um intervalo de 5,9 e 7,9. Esse é, então, um tampão efetivo em fluidos biológicos; em mamíferos, por exemplo, fluidos extracelulares e a maioria dos compartimentos citoplasmáticos têm pH no intervalo de 6,9 a 7,4 (BERG et al., 2008). IMPORTANTE Fique Ligado! Posso substituir a ingestão de água por chá, café, sucos, vinho e cerveja? Quanto mais destas bebidas se consome, mais desidratado o corpo se torna. Bebidas contendo cafeína, por exemplo, disparam resposta de estresse devido ao forte efeito diurético, aumentando as micções. Bebidas com açúcar aumentam rapidamente os níveis de açúcar sanguíneo (> diurese). NOTA Curiosidades: • Sob desidratação: as pessoas observam que realmente começam a reter água nas pernas, pés, braços e face. Os rins começam a “economizar” água, reduzindo a produção de urina e levando à retenção de produtos tóxicos potencialmente danosos. • A diminuição da água no cérebro acarreta a diminuição da energia e deprime muitas funções vitais. Com baixo nível de energia cerebral, ficamos incapazes de lidar com o medo, a ansiedade, a raiva e muitas outras emoções. 81 LEITURA COMPLEMENTAR SENDO SUA PRÓPRIA COBAIA (NÃO TENTE ISSO EM CASA!) Este é um relato de J. B. S. Haldane dos experimentos fisiológicos sobre o controle do pH sanguíneo, do livro Mundos Possíveis (HARPER; BROTHERS, 1928). “Eu queria descobrir o que aconteceria com um homem se ele fosse mais ácido ou mais alcalino... Poder-se-ia, claro, fazer experimentos em um coelho primeiro, e alguns trabalhos haviam sido feitos nesse sentido; mas é difícil, de qualquer forma, ter certeza como um coelho se sente. Na verdade, alguns coelhos não levavam a sério a possibilidade de cooperar comigo. “[...] Um colega e eu então começamos a fazer experimentos em nós mesmos [...]. Meu colega Dr. H. W. Davies e eu nos tornamos alcalinos pela respiração e pela ingestão de tudo que contivesse mais de 85,05 g de bicarbonato de sódio. Tornamonos ácidos ficando sentados em uma sala apertada contendo entre 6 e 7% de dióxido de carbono no ar. Isso faz a respiração ficar como se recém-tivéssemos terminado uma regata de remo, e também dá uma tremenda dor de cabeça... Duas horas foi o máximo de tempo que alguém conseguiu permanecer sob dióxido de carbono, mesmo se a câmara de gás à nossa disposição não tivesse retido um odor irremovível de gás mostarda de alguns experimentos de guerra, o qual faz lacrimejar quem quiser que entre nela. A coisa mais óbvia a fazer foi tentar beber ácido clorídrico. Se tomássemos concentrado, isso dissolveria os dentes e queimaria a garganta, razão pela qual eu quis deixá-lo difundirse suavemente em meu corpo. A concentração maior que tive a coragem de ingerir foi aproximadamente uma parte do ácido comercial em cem partes de água, mas meio litro foi o suficiente para mim, pois irritou minha garganta e estômago, enquanto meus cálculos mostravam que eu precisaria de um galão e meio para obter o efeito que eu desejava... Argumentei que se cloreto de amônio fosse ingerido, ele poderia se dissociar parcialmente no corpo, liberando ácido clorídrico. Isso provaria estar correto... o fígado transforma amônia em uma substância inofensiva chamada ureia antes que alcance o coração e o cérebro depois de absorvida pelo intestino. O ácido clorídrico que foi deixado para trás combina-se com o bicarbonato de sódio, que existe em todos os tecidos, produzindo cloreto de sódio e dióxido de carbono. Esse gás foi produzido em mim dessa forma na taxa de 6,6 L por hora (embora não por uma hora inteira nessa taxa). “Eu estava bem satisfeito de reproduzir em mim o tipo de respiração curta que ocorre nos estágios terminais de doenças dos rins e diabetes. Sabe-se, há muito tempo, que isso é devido ao envenenamento por ácido, mas em cada caso o envenenamento é complicado por outras anormalidades químicas, e não se tem certeza quais os sintomas são decorrentes do ácido em si. 82 “A cena agora muda para Heidelberg, onde Freudenberg e György estavam estudando o tétano em bebês... ocorreu a eles que poderia ser bastante válido tentar o efeito de aumentar de forma incomum a acidez do corpo. Visto que o tétano havia sido ocasionalmente observado em pacientes que foram tratados, por outras queixas, pela administração de doses muito altas de bicarbonato de sódio, ou perderam grande quantidade de ácido clorídrico por constantes vômitos; e se alcalinidade dos tecidos produzisse tétano, a acidez poderia ser uma expectativa de cura. Infelizmente, dificilmente se curaria um bebê moribundo colocando-o em uma sala cheia de ácido carbônico, e ainda menos com a indicação de ingestão de ácido clorídrico; então, nada poderia resultar dessa ideia, e eles estavam usando sais de lima, não facilmente absorvidos no organismo, os quais perturbam a digestão, mas certamente foram benéficos em muitos casos de tétano. Entretanto, no momento em que leram o meu artigo sobre os efeitos do cloreto de amônio, eles começaram a administrá-lo aos bebês, e ficaram encantados ao descobrir que o tétano era eliminado em poucas horas. Desde então, tem sido usado com sucesso na Inglaterra e na América, tanto em crianças como em adultos. Ele não remove a causa, mas coloca o paciente em melhores condições de recuperação”. FONTE: NELSON, D. L.; COX, M. M. Princípios de bioquímica de Lehninger. 6. ed. Porto Alegre: Artmed, 2014. (Adaptado) 83 RESUMO DO TÓPICO 2 Neste tópico, você adquiriu certos aprendizados, como: • A diferença entre a eletronegatividade do H e a do O torna a água uma molécula muito polar, capaz de formar ligações de hidrogênio entre suas moléculas e com solutos. • As ligações de hidrogênio são curtas, basicamente eletrostáticas e mais fracas que as ligações covalentes. • A água é um bom solvente para solutos polares (hidrofílicos), com os quais forma ligações de hidrogênio, e para solutos carregados, com os quais forma interações eletrostáticas. • Compostos apolares (hidrofóbicos) se dissolvem fracamente em água; eles não formam ligações de hidrogênio com o solvente, e a sua presença força um ordenamento energeticamente desfavorável de moléculas de água nas suas superfícies hidrofóbicas. • Interações fracas e não covalentes, em grande número, influenciam decisivamente o enovelamento de macromoléculas como proteínas e ácidos nucleicos. • As conformações mais estáveis são aquelas nas quais as ligações de hidrogênio são maximizadas dentro da molécula e entre a molécula e o solvente, e nas quais as partes hidrofóbicas se agregam no interior das moléculas, longe do solvente aquoso. • A água é tanto o solvente no qual as reações metabólicas ocorrem quando um reagente em muitos processos bioquímicos, incluindo hidrólise, condensação e reações de oxidação-redução. • A água pura se ioniza levemente, formando número igual de íons hidrogênio (íons hidrônio, H3O1) e íons hidróxido. • Uma mistura de um ácido fraco (ou base) e seus sais resiste a mudanças de pH causadas pela adição de H1 ou OH–. A mistura, portanto, funciona como tampão. • Em células e tecidos, tampões de fosfatos e bicarbonatos mantêm os fluidos intracelulares e extracelulares em seu pH ótimo (fisiológico), que em geral é próximo de 7. As enzimas costumam ter atividade ótima nesse pH. • Condições de saúde que diminuem o pH sanguíneo, causando acidose, ou aumentam, causando alcalose, podem ameaçar a vida. 84 AUTOATIVIDADE 1 O sistema de tamponamento biológico é muito importante, pois permite que sangue mantenha seu pH em torno de 7,40/7,45 independentemente da chegada de substâncias ácidas ou alcalinas. Para que isso aconteça de forma correta, sabemos que existe uma ação conjunta do sistema respiratório, urinário e o sistema químico, que envolve o mais importante componente. O componente químico responsável em manter o pH sanguíneo constante é: a) b) c) d) e) ( ( ( ( ( ) Cloreto de Sódio. ) Azul de Bromotimol. ) Bicarbonato. ) Ninidrina. ) Ácido Clorídrico. 2 Quimicamente, os ácidos referem-se a compostos capazes de transferir íons H+ numa reação química, podendo gerar a queda do pH. Sendo que o pH se refere justamente à concentração destes íons, que quanto maior, mais ácido se torna o meio. As bases são “análogos” opostos aos “ácidos”, que têm em sua composição OH, conhecidas como hidroxilas. As hidroxilas consomem os íons H+ presentes no meio, diminuindo então a concentração de íons H+, aumentando o pH. Neste caso, dizemos que o pH é mais alcalino. De acordo com o que foi estudado, observe a seguinte equação e analise as afirmativas que seguem: I- A equação é um exemplo hipotético de uma solução aquosa. II- Na equação: o A representa o ácido e o H3O representa a base. III- A equação demonstra uma dissociação parcial. IV- A água teve comportamento de base nesta equação, mas pode se comportar como ácido, pois se trata de uma molécula anfótera. A alternativa que apresenta a sequência CORRETA é: a) ( ) I, II, III e IV. b) ( ) Apenas I, II e IV. c) ( ) Apenas I, II e III. d) ( ) Apenas II e III. e) ( ) Apenas I, III e IV. 85 3 Analise o gráfico que segue: FONTE: A autora Com relação ao gráfico, analise as afirmativas e marque V para as afirmativas que são verdadeiras e F para as falsas. ( ) A solução inicial na qual está representado o gráfico se trata de uma solução ácida, com um pH aproximado de 7,0. ( ) À medida que se adiciona base, representada por OH, o pH sobe. ( ) No momento em que se adicionou 25 mL de base (OH), o pH sobe bruscamente. ( ) No gráfico está representada uma solução contendo tampão. Assinale a alternativa CORRETA: a) ( ) V – V – V – V. b) ( ) F – F – V – V. c) ( ) V – V – F – F. d) ( ) F – V – V – F. e) ( ) F – V – F – F. 86 UNIDADE 2 TÓPICO 3 - AMINOÁCIDOS, PEPTÍDEOS E PROTEÍNAS 1 INTRODUÇÃO Proteínas controlam praticamente todos os processos que ocorrem em uma célula, exibindo uma quase infinita diversidade de funções. Para explorar o mecanismo molecular de um processo biológico, um bioquímico estuda quase que inevitavelmente uma ou mais proteínas. Proteínas são as macromoléculas biológicas mais abundantes, ocorrendo em todas as células e em todas as partes das células. As proteínas também ocorrem em grande variedade; milhares de diferentes tipos podem ser encontrados em uma única célula. Como os árbitros da função molecular, as proteínas são os resultados mais importantes e são os instrumentos moleculares pelos quais a informação genética é expressa. Subunidades monoméricas, relativamente simples, fornecem a chave da estrutura de milhares de proteínas diferentes. As proteínas de cada organismo, da mais simples das bactérias aos seres humanos, são construídas a partir do mesmo conjunto onipresente de 20 aminoácidos. Como cada um desses aminoácidos tem uma cadeia lateral com propriedades químicas características, esse grupo de 20 moléculas precursoras pode ser considerado o alfabeto no qual a linguagem da estrutura proteica é lida (NELSON; COX, 2014). Para gerar uma determinada proteína, os aminoácidos se ligam de modo covalente em uma sequência linear característica. O mais marcante é que as células produzem proteínas com propriedades e atividades completamente diferentes, ligando os mesmos 20 aminoácidos em combinações e sequências muito diferentes. A partir desses blocos de construção, diferentes organismos podem gerar produtos tão diversos como enzimas, hormônios, anticorpos, transportadores, fibras musculares, proteínas das lentes dos olhos, penas, teias de aranha, chifres de rinocerontes, proteínas do leite, antibióticos, venenos de cogumelos e uma miríade de outras substâncias com atividades biológicas distintas. Entre esses produtos de proteínas, as enzimas são as mais variadas e especializadas. Como catalisadoras de quase todas as reações celulares, as enzimas são uma das chaves para compreensão da química da vida e, assim, fornecem um ponto central para qualquer curso de bioquímica (BERTUZZI et al., 2008). 87 2 AMINOÁCIDOS Proteínas são polímeros de aminoácidos, com cada resíduo de aminoácido unido ao seu vizinho por um tipo específico de ligação covalente (o termo “resíduo” reflete a perda de elementos de água quando um aminoácido é unido a outro). As proteínas podem ser degradadas (hidrolisadas) em seus aminoácidos constituintes por vários métodos, e os estudos mais iniciais de proteínas naturalmente se concentraram nesses aminoácidos livres delas derivados. Vinte aminoácidos diferentes são comumentemente encontrados em proteínas. O primeiro a ser descoberto foi a asparagina, em 1806. O último dos 20 a ser descoberto (treonina) não havia sido identificado até 1938. Todos os aminoácidos têm nomes comuns ou triviais, em alguns casos derivados da fonte da qual foram primeiramente isolados. A asparagina foi descoberta pela primeira vez no aspargo e o glutamato no glúten do trigo; a tirosina foi isolada a primeira vez a partir do queijo (seu nome é derivado do grego tyros, “queijo”); e a glicina (do grego glykos, “doce”) foi assim denominada devido ao seu sabor adocicado (NELSON; COX, 2014). 2.1 CARACTERÍSTICAS ESTRUTURAIS Todos os 20 tipos de aminoácidos comuns são a-aminoácidos. Eles têm um grupo carboxila e um grupo amino ligados ao mesmo átomo de carbono (o carbono a): FIGURA 12 – ESTRUTURA GERAL DE UM AMINOÁCIDO FONTE: <https://pt.wikipedia.org/wiki/Amino%C3%A1cido>. Acesso em: 11 jul. 2019. Para Nelson e Cox (2014, p. 43), os aminoácidos: Diferem uns dos outros em suas cadeias laterais ou grupos R, que variam em estrutura, tamanho e carga elétrica, e que influenciam a solubilidade dos aminoácidos em água. Além desses 20 aminoácidos, há muitos outros menos comuns. Alguns são resíduos modificados após a síntese de uma proteína; outros são aminoácidos presentes em organismos vivos, mas não como constituintes de proteínas. Foram atribuídas aos aminoácidos comuns das proteínas abreviações de três letras e símbolos de uma letra, utilizados como abreviaturas para indicar a composição e a sequência de aminoácidos polimerizados em proteínas. 88 O código de três letras é transparente (Figura 13); as abreviações em geral consistem nas três primeiras letras do nome do aminoácido. O código de uma letra foi concebido por Margaret Oakley Dayhoff, considerada por muitos a fundadora do campo da bioinformática. O código de uma letra reflete uma tentativa de reduzir o tamanho dos arquivos de dados (em uma época da computação de cartões perfurados) utilizados para descrever as sequências de aminoácidos. Foi desenvolvido para ser facilmente memorizado, e a compreensão de sua origem pode ajudar os estudantes a fazer exatamente isso. Para seis aminoácidos (CHIMSV), a primeira letra do nome do aminoácido é única e, portanto, utilizada como o símbolo. Para cinco outros (AGLPT), a primeira letra não é única, mas é atribuída ao aminoácido mais comum em proteínas (por exemplo, leucina é mais comum do que lisina). Para todos os aminoácidos comuns, exceto a glicina, o carbono a está ligado a quatro grupos diferentes: um grupo carboxila, um grupo amino, um grupo R e um átomo de hidrogênio (RODWELL; MURRAY; GRANNER, 2017). FIGURA 13 – CÓDIGO GENÉTICO FONTE: A autora 2.2 CLASSIFICAÇÃO PELO GRUPO R O conhecimento das propriedades químicas dos aminoácidos comuns é fundamental para a compreensão da bioquímica. O tópico pode ser simplificado agrupando-se os aminoácidos em cinco classes principais com base nas propriedades dos seus grupos R, particularmente sua polaridade ou tendência para interagir com a água em pH biológico (próximo do pH 7,0). A polaridade dos grupos R varia amplamente, de apolar e hidrofóbico (não hidrossolúvel) ao altamente polar e hidrofílico (hidrossolúvel). Alguns aminoácidos são um pouco difíceis de caracterizar ou não se 89 encaixam perfeitamente em qualquer grupo, particularmente glicina, histidina e cisteína. Suas atribuições a determinados grupos são o resultado de avaliações ponderadas em vez de absolutas (NELSON; COX, 2014). Os aminoácidos são classificados em relação às gradações de polaridade, tamanho e forma dos grupos R: Grupos R apolares, alifáticos (Figura 14) – Os grupos R nesta classe de aminoácidos são apolares hidrofóbicos. As cadeias laterais de alanina, valina, leucina e isoleucina tendem a se agrupar no interior de proteínas, estabilizando a estrutura proteica por meio de interações hidrofóbicas. A glicina tem a estrutura mais simples. Embora seja mais facilmente agrupada com os aminoácidos apolares, sua cadeia lateral muito pequena não contribui realmente para interações hidrofóbicas. A metionina, um dos dois aminoácidos que contém enxofre, tem um grupo tioéter ligeiramente apolar em sua cadeia lateral. A prolina tem cadeia lateral alifática com estrutura cíclica distinta. O grupo amino secundário (imino) de resíduos de prolina é mantido em uma configuração rígida que reduz a flexibilidade estrutural de regiões polipeptídicas contendo prolina (NELSON; COX, 2014). PRINCÍPIOS DE BIOQUÍMICA D FIGURA 14 – GRUPOS R APOLARES, ALIFÁTICOS Grupos R apolares, alifáticos COO 1 H 3N C COO 2 H 1 H 3N C H H Glicina 2 CH3 COO H C 1 H 2N CH 2 CH 2 H 2C COO C H CH2 1 H3N H3N C H C CH2 COO2 OH H3N C H CH3 CH2 CH2 CH2 CH3 S Fenilalanina Isoleucina Metionina FONTE: Nelson e Cox (2014, p. 79) Grupos R polares, não carregados COO2 COO2 Tirosina Grupos R carregados pos CH3 COO2 1 H3N COO2 1 C H H3N C H CH2 CH2 CH2 CH2 CH2 CH2 1 1 1 Grupos R aromáticos com suas C H H3eN triptofano, H3N– CFenilalanina, H H3N Ctirosina H CH2 cadeias laterais aromáticas, são relativamente apolares (hidrofóbicos). Todos1 podem CH2 CH2 H C OH NH3 participar em interações hidrofóbicas. O grupo hidroxila da tirosinaSHpode formar ligações OH CH3 de hidrogênio e é um importante grupo funcional em algumas enzimas. A tirosina e Treonina Serina Cisteína Lisina o triptofano são significativamente mais polares do que a fenilalanina (NELSON; COX, 2014). COO 2 1 H 3N 90 H 2N H CH2 1 CH COO2 H 3N C H 3N C H CH3 CH3 CH3 CH3 Leucina COO2 1 1 CH 2 C H H COO 2 Valina COO 2 H3N COO 2 1 Prolina Alanina 1 Grupos R aromáti 2 C H COO2 NH C NH2 Arginina Grupos R carregados neg 1 COO2 H 3N C H 1 H 3N C H CH2 CH2 C CH2 CH2 C COO2 O 1 NH2 1 H 3N 79 PRINCÍPIOS DE BIOQUÍMICA DE LEHNINGER FIGURA 15 – GRUPOS R AROMÁTICOS apolares, alifáticos Grupos R aromáticos COO H C 1 H 2N CH 2 2 CH 2 H 2C Prolina 1 C H 3N C H CH COO2 1 H 3N C COO2 1 H H3N C H CH2 CH2 C COO 1 COO CH3 H3N CCHH 2 HCH2 S Glicina CH3 CH3 Isoleucina Metionina COO H C 1 Tirosina H 2N CH 2 COO 2 1 H3NFenilalanina C H CH NH Grupos R apolares, alifáticos OH 2 2 2 PRINCÍPIOS DE BIOQUÍMI CH2 CH3 CH3 H3N C H 1 CH2 3 1 H3N C H 2 C H H COO 1 2 Valina COO H3N COO 2 COO Grupos R ar COO 2 1 1 1 C H H Triptofano 3N H 3N C H 3N C H CH3 CH FONTE:H Nelson e Cox p. 79) CH(2014, 2C 2 CH3 CH3 C 2 C CH2 Grupos R carregados positivamente Alanina COO2 Prolina COO2 Valina COO2 1 COO 1 1 COO2 COO H grupos Grupos R polares, H carregados C HR desses aminoácidos são H3N Cnão H3N C H – Os O 3N 1 1 1 mais solúveis em água, hidrofílicos doHque aqueles dos aminoácidos apolares, H3NouCmais H C N H N C H 3 3 CH CHH H C 2 2 2 porque eles contêm grupos que formam ligações de hidrogênio com a Tirosin Fenilalanina upos R polares, não carregados CCHH2funcionais H C C H CH2 C NH 3 H C 2 2 água. Essa classe 2 2 de aminoácidos inclui a serina, treonina, cisteína, asparagina e COO COO CCHH2 CHC CCH H2 2 H2 1 1 glutamina. Os grupos hidroxila da serina e treonina e os grupos amida da asparagina e C N H3N C H H 3N C H CH3CH CH NHCH3 2 3 S H glutamina contribuem para suas polaridades (NELSON; COX, 2014). Grupos R carregado 1 H C CH2 OH CH3 SH Treonina Cisteína COO 2 1 H 3N C H CH2 CH3 Metionina Arginina Histidina O Glutamina COO2 1 H3N Grupos R carregados negativamente COO 2 1 COO 2 COO 2 COO 1 2 1 1 1 H3N H3N C HH N CH H 3N C HH 3 3N C H CH2 CH2 H C OHCH2 COO 2 CH3 CH2 Treonina Serina Aspartato COO 2 C H CH2 1 H3N C CH2 CH CH2 CH CH2 CH CH2 NH NH3 C SH COO2 Cisteína NH Lisina Arginin Glutamato sem carga, seu pKa (ver a Tabela 3-1) é tal que uma pequena mas significativa2 2 COOem COO fração desses grupos seja positivamente carregada pH 7,0. A forma pro1 1 tonada da histidina é mostrada acima do gráfico na Figura 3-12b. H 3N COO 1 C H Grupos R polares, não carregados OH C muns de proteínas. As fórmulas esão que predomina em pH 7,0. As pormuns a todos os aminoácidos; aquelas o grupo R da histidina seja mostrado NH2 NH2 Isoleucina Lisina CH2 H2N C NH3 FIGURA 16 – GRUPOS R POLARES, NÃO CARREGADOS H 3N C H O 2 Leucina 1 C Asparagina 1 COO2 CH2 H 2N 2 C H CH2 Grupos R carregado COO2 H 3N C H CH2 1 H 3N C H CH2 H2 C da tirosinaCpode ui realmente para interações terações hidrofóbicas. O grupo hidroxila H N O um dos dois aminoácidos que formar ligações de hidrogênio e2é um importante grupo COO2 C funsão sigpo tioéter ligeiramente apolar cional em algumas enzimas. A tirosina e o triptofano O H2N na tem cadeia lateral alifática nificativamente mais polares do que a fenilalanina, devido ao grupo hidroxila da tirosina Asparagina e ao nitrogênio doGlutamina anel indol Aspartato a. O grupo amino secundário do triptofano. a é mantido em uma configuO triptofano, a tirosina e, em menor extensão, a fenilalabilidade estrutural de regiões FONTE: Nelson e Cox (2014, p. 79) sem carga, seu pKa (ver a Tabela 3-1) é tal qu FIGURA 35 Os 20 aminoácidos comuns de proteínas. As fórmulas nina, absorvem a luz ultravioleta (Figura 3-6; verestambém na. truturais mostram o estado de ionização que predomina em pH 7,0. As porfração desses grupos seja positivamente ca Quadro 3-1). Isso explica a forte absorbância de luz com ções não sombreadas são aquelas comuns a todos os aminoácidos; aquelas tonada da histidina é mostrada acima do gr nina, tirosina e triptofano, comprimento de onda de 280 nm característica da maior sombreadas são os grupos R. Embora o grupo R da histidina seja mostrado romáticas, são relativamente parte das proteínas, propriedade explorada por pesquisadores na caracterização de proteínas. dos podem participar em in- 91 res, alifáticos Grupos R aromáticos COO H C 1 H 2N CH 2 2 COO COO 2 1 1 H3N C H COO2 2 H 3N C H 1 H 3N C H COO2 1 H3N C H CH2 (básicos) CH–2 Os grupos R mais hidrofílicos CH R carregados CHpositivamente Grupos 2 PRINCÍPIOS DE BIOQUÍMICA DE LEHNINGER 79 CH 2 CHcarregados 3 CH3 C CH são aqueles positiva ou negativamente. Os aminoácidos nos quais os grupos R H 2C Prolina Valina NH têm uma carga positiva significativa em pH 7,0 são a lisina, a arginina e a histidina, seus 2 2 COO muitas reações catalisadas COO alifáticos Grupos R aromáticos resíduos facilitam por enzimas, funcionando como doadores/ OH 1 1 2 2 2 2 2 HCOO C aceptores H3COO H N prótons C H de (NELSON; COX, 2014). COO 3N COO COO H 1 1Tirosina 1Triptofano 1 Fenilalanina CH2 CH C CH3H3N C H H 3N C H H3N C H H 3N C H HH2 CC GRUPOS CARREGADOS (BÁSICOS) 2 CH2 POSITIVAMENTE CH2 CH CH2 FIGURA 17 – CH 2 CH S 3 CH2 3 CH3 CH C CH Grupos R carregados positivamente Prolina Valina CH3 Metionina 2 Isoleucina 2 COO COO 1 N 1 C H H3N C H RHpolares, não C C H3carregados CH2 2 CHCOO 2 1 H3NCHC H 3 H C OH Isoleucina CH3 COO2 1 H3N 2 CH2 Tirosina CH2 CH2 CH2 Treonina 1 NH COO32 1 H3N Cisteína 2 2 COO 2 2 COO COO COO C H CH2 Triptofano C NH CH C H Lisina N 1 C NH COO2 2 1 NH2 H3N C H Arginina CH2 olares, não carregados H3N C CH2 NH positivamente H Grupos R carregados H3N SC H CH2 CH 3 SH Metionina 1 H3N COHH CH2 Fenilalanina CH 2 CCOO H2 1 C H COO2NH COO2 1 COO2 1 H3N C H Histidina CH2 CH2 Nelson e Cox (2014, p. 79) C NH CHFONTE: CH 2 2 Grupos R carregados negativamente CH CH2 2 2 COO COO HC C H HN H3NC CH H C N – Os dois aminoácidos 3N H 3 Grupos 3N R carregados negativamente (ácidos) CH2 NH 1 1 H H N C H H N C H H H C C 1 3 3 2 CH2 2 grupos R H C OH 1 com carga negativa final em pH 7,0 são o aspartato e o que apresentam C NH2 NH3 C H CH2 (NELSON; COX, 2014). H C C 2 2 cada um tem um segundo grupo carboxila SH CH3 glutamato, NH 2 H 2N O 2 CH2 COO Treonina CisteínaC Lisina Arginina Histidina O H2N COO2 1 1 1 Asparagina 1 CH2 FIGURA 18 – GRUPOS R CARREGADOS NEGATIVAMENTE (ÁCIDOS) Glutamina Aspartato Glutamato Grupos R carregados negativamente COO COO sem carga, seu pKa (ver a Tabela 3-1) é2tal que uma pequena2mas significativa s de1proteínas. As fórmulas 1 esCOO COO H N C H H 3N C Hfração desses grupos seja positivamente e 3predomina em pH 7,0. As porcarregada em pH 7,0. A forma pro1 a todos os aminoácidos; aquelas tonada da histidina é mostrada acima do gráfico1na Figura 3-12b. H 3N C H H 3N C H CH2 CH po R da histidina seja mostrado 2 H 2N 2 C O 2 CH2 CH2 CH2 C COO2 CH almente para interações terações hidrofóbicas. O grupo hidroxila da2 tirosina pode H2N COO2 grupo funos dois aminoácidos que O formar ligações de hidrogênio e é um importante e o triptofano são sigoéter ligeiramente Glutamina apolar cional em algumas enzimas. Aspartato A tirosina Glutamato Asparagina em cadeia lateral alifática nificativamente mais polares do que a fenilalanina, devido ao grupo hidroxila da tirosina eeao nitrogênio do indol grupo amino secundário sem Nelson Cox p. mas 79)anel carga, seu pKa (ver FONTE: proteínas. As fórmulas esa Tabela 3-1) é tal que uma(2014, pequena significativa do triptofano. mantido em uma configuedomina em pH 7,0. As porfração desses grupos seja positivamente carregada em pH 7,0. A forma proa tirosina e, do emgráfico menor adeosestrutural deaquelas regiões tonadaOdatriptofano, dos aminoácidos; histidina é mostrada acima naextensão, Figura 3-12b.a fenilalanina, absorvem a luz ultravioleta (Figura 3-6; ver também R da histidina seja mostrado Quadro 3-1). Isso explica a forte absorbância de luz com , tirosina e triptofano, comprimento de onda de 280 nm característica da maior ticas, são relativamente parte das proteínas, propriedade explorada por pesquisaterações hidrofóbicas. O de grupo hidroxila da tirosina pode permitem algumas ente para interações As inpropriedades compartilhadas de muitos aminoácidos dores na caracterização proteínas. podem participar em dois aminoácidos que formar ligações de hidrogênio e é um importante grupo fungeneralizações simplificadas sobre seu comportamento acido-básico. Em primeiro er ligeiramente apolar cional em algumas enzimas. A tirosina e o triptofano são siglugar,alifática todos osnificativamente aminoácidos mais com polares um único grupo a-amino, um único grupo a-carboxila do que a fenilalanina, devido cadeia lateral grupo hidroxilatêm da tirosina ao nitrogênio anel indol à da glicina. Esses upo aminoe secundário um grupo Raonão ionizável curvasede titulação do semelhantes do triptofano. ntido em uma configu- têm aminoácidos valores de pKa muito semelhantes, mas não idênticos (BERG; O triptofano, a tirosina e, em menor extensão, a fenilalaestrutural de regiões TYMOCZKO; STRYERT, 2015).a luz ultravioleta (Figura 3-6; ver também nina, absorvem 02/04/14 18:42 Quadro 3-1). Isso explica a forte absorbância de luz com 92 rosina e triptofano, comprimento de onda de 280 nm característica da maior as, são relativamente 2.3 PROPRIEDADES DOS AMINOÁCIDOS Os aminoácidos com um grupo R ionizável têm curvas de titulação mais complexas, com três estágios correspondendo às três etapas possíveis de ionização; assim, eles possuem três valores de pKa. O estágio adicional para a titulação do grupo R ionizável se funde, em algum grau, com aquele para a titulação do grupo a-carboxila, para a titulação do grupo a-amino, ou ambos (NELSON; COX, 2002). 3 PEPTÍDEOS E PROTEÍNAS Agora o foco passa a ser os polímeros de aminoácidos, os peptídeos e as proteínas. Os polipeptídeos que ocorrem biologicamente variam em tamanho de pequenos a muito grandes, consistindo em dois ou três a milhares de resíduos de aminoácidos ligados. Duas moléculas de aminoácidos podem ser ligadas de modo covalente por meio de uma ligação amida substituída, denominada ligação peptídica, a fim de produzir um dipeptídio. Tal ligação é formada pela remoção de elementos de água (desidratação) do grupo a-carboxila de um aminoácido e do grupo a-amino do outro (Figura 19). A formação da ligação peptídica é um exemplo de uma reação de condensação, uma classe comum de reações nas células vivas. Em condições bioquímicas padrão, o equilíbrio para a reação mostrada favorece os aminoácidos em relação ao dipeptídio. Para tornar a reação mais favorável termodinamicamente, o grupo carboxila deve ser modificado ou ativado quimicamente, de modo que o grupo hidroxila possa ser mais rapidamente eliminado (NELSON; COX, 2014). 86 D AV I D L . N E L S O N & M I C H A E L M . COX FIGURA 19 – LIGAÇÃO PEPTÍDICA R1 1 H3N CH H C OH 1 H N R2 CH COO2 O 1 R1 1 H3N CH CH2OH H H H2O H2O C O H R2 N CH COO2 H 3N C C H O N C H C N H O Extremidade aminoterminal FIGURA 314 O pentapetídeo Formação de uma ligação peptídica por condensação. Gly–Tyr–Ala–Leu, ou SGYAL. O FONTE: Nelson e Cox (2014, p.2 86) O grupo a-amino de um aminoácido (com grupo R ) atua como nucleófiduo aminoterminal, que por conv lo para deslocar o grupo hidroxila de outro aminoácido (com grupo R1), peptídicas são sombreadas; os gru formando uma ligação peptídica (sombreada). Os grupos amino são bons Três aminoácidos podem ser unidos por duas ligações peptídicas nucleófilos, mas o grupo hidroxila é um grupo de saída fraco e não prontapara formar um tripeptídeo; do mesmo modo, mente deslocado. No pH fisiológico, a reação mostrada aqui não ocorre em quatro aminoácidos podem ser unidos para formar um tetrapeptídeo, cinco para formar grau apreciável. FIGURA 313 Embora a hidrólise de um pentapeptídeo, e assim por diante. Quando alguns aminoácidos se reação exergônica, ela só ligam desse modo, a estrutura é chamada de oligopeptídeo. Quando uma elevada energia de at muitos aminoácidos se ligam, o produto de polipeptídeo. uma reação de condensação, uma classe comum édechamado reaas ligações peptídicas em p As proteínas podem ter milhares de resíduos de aminoácidos. ções nas células vivas. Em condições bioquímicas padrão, meia-vida média (t ) de Embora termos “proteína” e “polipeptídeo” sejam algumas vezes 1/2 o equilíbrio para aosreação mostrada na Figura 3-13 favorecondições intracelulares. intercambiáveis, as ao moléculas chamadas dea polipeptídeos têm ce os aminoácidos em relação dipeptídeo. Para tornar massas moleculares abaixo de 10.000, e as carchamadas de proteínas reação mais favorável termodinamicamente, o grupo têmser massas moleculares mais elevadas (BERTUZZI al., 2008,podem p. 27). ser difer boxila deve modificado ou ativado quimicamente, de etPeptídeos modo que o grupo hidroxila possa ser mais rapidamente comportamentos de ioniz 93 eliminado. Uma abordagem química para esse problema Peptídeos contêm apenas será destacada posteriormente neste capítulo. A aborda- 3.1 ASPECTOS GERAIS DA ESTRUTURA PROTEICA A purificação de uma proteína é geralmente apenas um prelúdio para uma dissecção bioquímica detalhada de sua estrutura e função. O que torna uma proteína uma enzima, outra um hormônio, outra uma proteína estrutural e, ainda, outra um anticorpo? Como elas diferem quimicamente? As distinções mais óbvias são estruturais, e agora será abordada a estrutura das proteínas. A estrutura de grandes moléculas, tais como proteínas, pode ser descrita em vários níveis de complexidade, arranjada em um tipo de hierarquia conceitual. Quatro níveis de estrutura proteica são comumente definidos. Uma descrição de todas as ligações covalentes (principalmente ligações peptídicas e ligações dissulfeto) ligando resíduos de aminoácidos em uma cadeia polipeptídica é a sua estrutura primária. O elemento mais importante da estrutura primária é a sequência de resíduos de aminoácidos (NELSON; COX, 2014). As diferenças na estrutura primária podem ser especialmente informativas. Cada proteína tem um número e uma sequência de resíduos de aminoácidos distintos. FIGURA 20 – NÍVEIS DE ESTRUTURA NAS PROTEÍNAS FONTE: Nelson e Cox (2014, p. 96) 3.2 ESTRUTURA SECUNDÁRIA DAS PROTEÍNAS A estrutura secundária se refere a arranjos particularmente estáveis de resíduos de aminoácidos dando origem a padrões estruturais recorrentes. O termo estrutura secundária se refere a qualquer segmento de uma cadeia polipeptídica e descreve o arranjo espacial de seus átomos na cadeia principal, sem considerar a posição de suas cadeias laterais ou sua relação com outros segmentos. 94 3.3 ESTRUTURAS TERCIÁRIAS E QUATERNÁRIAS DAS PROTEÍNAS O arranjo tridimensional total de todos os átomos de uma proteína é chamado de estrutura terciária. Enquanto o termo “estrutura secundária” se refere ao arranjo espacial dos resíduos de aminoácidos adjacentes em um segmento polipeptídico, a estrutura terciária inclui aspectos de alcance mais longo da sequência de aminoácidos. Aminoácidos que estão bem distantes na sequência polipeptídica e em diferentes tipos de estruturas secundárias podem interagir na estrutura da proteína completamente dobrada. O arranjo das subunidades proteicas em complexos tridimensionais constitui a estrutura quaternária. Considerando esses níveis mais altos de estrutura, é conveniente designar dois grandes grupos nos quais muitas proteínas podem ser classificadas: proteínas fibrosas, com cadeias polipeptídicas arranjadas em longos filamentos ou folhas, e proteínas globulares, com cadeias polipeptídicas dobradas em forma esférica ou globular (BERG, 2014). 3.4 DESNATURAÇÃO PROTEICA E ENOVELAMENTO Para Nelson e Cox (2014, p. 148): O enovelamento dos polipeptídeos é sujeito a uma série de limitações físicas e químicas, e várias regras foram propostas a partir de estudos de padrões comuns de enovelamento proteico. 1. As interações hidrofóbicas dão uma grande contribuição para a estabilidade da estrutura de proteínas. O ocultamento dos grupos R dos aminoácidos hidrofóbicos, de modo a excluir a água, necessita de pelo menos duas camadas de estrutura secundária. 2. Quando ocorrem juntas em uma proteína, as hélices a e as folhas b geralmente são encontradas em camadas estruturais diferentes. 3. Segmentos adjacentes na sequência de aminoácidos normalmente se posicionam de forma adjacente na estrutura dobrada. Segmentos distantes do polipeptídeo podem se aproximar na estrutura terciária, mas não é a regra. As proteínas têm uma existência surpreendentemente precária. A conformação de uma proteína nativa é apenas marginalmente estável. Além disso, a maioria das proteínas deve manter certa flexibilidade conformacional para funcionar. A manutenção contínua do grupo ativo de proteínas celulares, necessárias em um dado conjunto de condições, é chamada proteostase. A proteostase celular requer a atividade coordenada de vias para síntese e enovelamento de proteínas, o redobramento de proteínas parcialmente desdobradas e o sequestro e degradação de proteínas irreversivelmente desdobradas. Em todas as células, essas redes envolvem centenas de enzimas e proteínas especializadas. Na Figura 21 podemos observar que a vida de uma proteína engloba muito mais do que sua síntese e degradação. A estabilidade marginal da maioria das proteínas pode produzir um balanço tênue entre os estados dobrados e desdobrados (NELSON; COX, 2014). 95 FIGURA 21 – VIAS QUE CONTRIBUEM PARA PROTEOSTASE FONTE: Rodwell, Murray e Granner (2017, p. 108) À medida que as proteínas são sintetizadas nos ribossomos, elas devem dobrarse em sua conformação nativa. Algumas vezes isso ocorre de forma espontânea, porém, mais frequentemente com a assistência de enzimas e complexos especializados chamados chaperonas. Muitos desses mesmos auxiliares do enovelamento atuam para redobrar proteínas que se tornaram transitoriamente desdobradas. As proteínas inapropriadamente dobradas frequentemente expõem superfícies hidrofóbicas que as tornam “pegajosas”, conduzindo à formação de agregados inativos. Esses agregados podem perder suas funções normais, mas não são inertes; seu acúmulo nas células situa-se no centro de doenças que vão de diabetes a doenças de Parkinson e Alzheimer. Não surpreendentemente, todas as células elaboraram vias de reciclagem e/ou degradação de proteínas irreversivelmente deformadas (NELSON; COX, 2014). As estruturas proteicas evoluíram para atuar em determinados ambientes celulares. Condições diferentes daquelas da célula podem resultar em mudanças estruturais grandes ou pequenas na proteína. A perda de estrutura tridimensional suficiente para causar a perda de função é chamada de desnaturação. O estado desnaturado não necessariamente corresponde ao desdobramento completo da proteína e à randomização da conformação. Na maioria das condições, as proteínas desnaturadas existem como um conjunto de estados parcialmente dobrados (BERG; TYMOCZKO; STRYERT, 2015). 96 A maioria das proteínas pode ser desnaturada pelo calor, que tem efeitos complexos nas muitas interações fracas da proteína (principalmente sobre as ligações de hidrogênio). 3.5 FUNÇÕES DAS PROTEÍNAS As proteínas são fundamentais para qualquer ser vivo, pois grande parte dos processos orgânicos que acontecem nas células são mediados por proteínas (enzimas). Toda manifestação genética é dada por meio de proteínas, pois os genes são fragmentos de DNA que codificam proteínas. As proteínas podem ter função estrutural, participando na composição de várias estruturas do organismo, sustentando e promovendo rigidez, como a queratina, colágeno e elastina. Existem proteínas que promovem a defesa do organismo contra microrganismos e substâncias estranhas, como os macrófagos e as imunoglobulinas. Outras funções desempenhadas pelas proteínas envolvem a ação catalítica, transportadora (hemoglobina transportando os gases respiratórios), nutritiva, energética, promovem a contração e podem atuar como mensageiros químicos (hormônios). NOTA A anemia falciforme é causada por uma mutação homozigota (aa) de um único nucleotídeo que codifica para a cadeia B da hemoglobina fazendo com que a forma da hemácia seja modificada, provocando um transporte ineficiente de O2. NOTA A anemia falciforme é causada por uma mutação homozigota (aa) de um único nucleotídeo que codifica para a cadeia B da hemoglobina fazendo com que a forma da hemácia seja modificada, provocando um transporte ineficiente de O2. 97 NOTA Morte por enovelamento errado: as doenças priônicas Uma proteína cerebral dobrada de forma errada parece ser o agente causador de doenças cerebrais neurodegenerativas raras em mamíferos. Talvez a mais conhecida seja a encefalopatia espongiforme bovina (EEB, ou BSE, do inglês bovine spongiform encephalopathy; também conhecida como doença da vaca louca). Doenças relacionadas incluem a kuru e a doença de Creutzfeldt-Jakob em humanos, scrapie em ovinos, e doença debilitante crônica em cervos e alces. Essas doenças também são conhecidas como encefalopatias espongiformes porque o cérebro doente frequentemente se torna cheio de buracos. A deterioração progressiva do cérebro leva a um espectro de sintomas neurológicos, incluindo perda de peso, comportamento errático, problemas de postura, equilíbrio e coordenação, e perda da capacidade cognitiva. Essas doenças são fatais. Nos anos de 1960, pesquisadores descobriram que amostras de agentes causadores de doença pareciam não conter ácidos nucleicos. Naquela época, Tikvah Alper sugeriu que o agente fosse uma proteína. Inicialmente, a ideia pareceu uma heresia. Todos os agentes causadores de doenças conhecidos até aquele momento – vírus, bactérias, fungos, e assim por diante – continham ácidos nucleicos, e sua virulência estava relacionada à reprodução genética e propagação. Os agentes infecciosos foram identificados como uma única proteína (Mr 28.000), que Prusiner apelidou de proteína príon (PrP). O nome foi derivado de proteinaceous infectious (proteína infecciosa), mas Prusiner achou que “príon” soava melhor do que “proin”. A proteína príon é um constituinte normal do tecido cerebral em todos os mamíferos. Seu papel não é conhecido em detalhes, mas deve ter uma função de sinalização molecular. Várias outras condições neurodegenerativas envolvem agregação intracelular de proteínas com enovelamento errado. Na doença de Parkinson, a forma mal dobrada da proteína a-sinucleína se agrega em massas esféricas filamentosas, chamadas de corpos de Lewy. A doença de Huntington envolve a proteína huntingtina, que tem uma longa repetição de poliglutaminas. Em alguns indivíduos, essa repetição é maior do que o normal, ocorrendo um tipo de agregação intracelular mais sutil. Notavelmente, quando proteínas mutantes humanas envolvidas nas doenças de Parkinson e Huntington são expressas em Drosophila melanogaster, as moscas demonstram degeneração expressa como deterioração dos olhos, tremores e morte precoce. Todos esses sintomas são altamente suprimidos se a expressão da chaperona Hsp70 também estiver aumentada. FONTE: Nelson e Cox (2014, p. 150) 98 RESUMO DO TÓPICO 3 Neste tópico, você adquiriu certos aprendizados, como: • Os vinte aminoácidos comumentemente encontrados como resíduos em proteínas contêm um grupo a-carboxila, um grupo a-amino e um grupo R característico substituído no átomo do carbono a. • Os aminoácidos podem ser classificados em cinco tipos com base na polaridade e carga (em pH 7) de seus grupos R. • Aminoácidos podem ser unidos de modo covalente por meio de ligações peptídicas para formar peptídeos e proteínas. • As células geralmente contêm milhares de proteínas diferentes, cada uma com uma atividade biológica diferente. • Proteínas podem ser cadeias peptídicas muito longas, de 100 a muitos milhares de resíduos de aminoácidos. Entretanto, alguns peptídeos que ocorrem naturalmente possuem apenas alguns poucos resíduos de aminoácidos. • Algumas proteínas são compostas por várias cadeias polipeptídicas associadas de modo não covalente, chamadas de subunidades. • Proteínas simples produzem, por hidrólise, apenas aminoácidos; proteínas conjugadas contêm além deles, outros componentes, tais como um metal ou um grupo prostético. • Peptídeos e proteínas pequenas (até cerca de 100 resíduos) podem ser sintetizados quimicamente. • Sequências proteicas são uma fonte rica de informação sobre a estrutura e a função da proteína, bem como sobre a evolução da vida na Terra. • Estrutura secundária é o arranjo espacial dos átomos da cadeia principal em um determinado segmento da cadeia polipeptídica. • A estrutura terciária é a estrutura tridimensional da cadeia polipeptídica. Muitas proteínas se encaixam em uma ou duas classes de proteínas em geral, com base na estrutura terciária: fibrosa e globular. 99 • A estrutura quaternária resulta de interações entre as subunidades de proteínas com múltiplas subunidades ou grandes associações de proteínas. A estrutura tridimensional e a função da maioria das proteínas podem ser destruídas pela desnaturação, demonstrando uma relação entre estrutura e função. Algumas proteínas desnaturadas podem renaturar espontaneamente para formar proteínas biologicamente ativa. 100 AUTOATIVIDADE 1 A proteína é a mais importante das macromoléculas biológicas, compondo mais da metade do peso seco de uma célula. Está presente em todo ser vivo e tem as mais variadas funções. Ela é um polímero de aminoácidos que pode atuar como enzimas, catalisando reações químicas, podem transportar pequenas moléculas ou íons; podem ser motoras para auxiliar no movimento em células e tecidos; participam na regulação gênica, ativando ou inibindo; estão no sistema imunológico, entre outras centenas de funções. Praticamente, todas as funções celulares necessitam de proteínas para intermediá-las. A formação das proteínas acontece através de ligações peptídicas. A ligação peptídica resulta da união entre o grupo: a) b) c) d) e) ( ( ( ( ( ) Carboxila de um aminoácido e o grupo carboxila do outro. ) Carboxila de um aminoácido e o grupo amina do outro. ) Amina de um aminoácido e o grupo amina do outro. ) Amina de um aminoácido e o radical (R) do outro. ) Carboxila de um aminoácido e o radical (R) do outro. 2 As proteínas, formadas pela união de aminoácidos, são componentes químicos fundamentais na fisiologia e na estrutura celular dos organismos. Em relação às proteínas, assinale a alternativa correta: a) ( ) O colágeno é a proteína menos abundante no corpo humano, sendo classificado como uma proteína globular. b) ( ) A ligação peptídica entre dois aminoácidos acontece pela reação do grupo carboxila de um aminoácido com o grupo amino de outro aminoácido. c) ( ) A testosterona, hormônio sexual masculino, é um hormônio proteico. d) ( ) A proteína albumina é amplamente encontrada nos vegetais. e) ( ) A vitamina sódio é importante para regular a pressão arterial. 101 102 TÓPICO 4 - UNIDADE 2 ENZIMAS 1 INTRODUÇÃO Boa parte da história da bioquímica é a história da pesquisa sobre enzimas. A catálise biológica foi reconhecida e descrita no final dos anos de 1700 em estudos da digestão de carne por secreções do estômago. A pesquisa continuou no século seguinte, examinando a conversão do amido em açúcar pela saliva e por vários extratos de plantas. Por volta de 1850, Louis Pasteur concluiu que a fermentação de açúcar em álcool por leveduras é catalisada por “fermentos”. Ele postulou que esses fermentos eram inseparáveis da estrutura das células de levedura vivas. Esse ponto de vista, chamado de vitalismo, prevaleceu por décadas. Então, em 1897, Eduard Buchner descreveu que extratos de levedura podiam fermentar açúcar em álcool, provando que a fermentação era feita por moléculas que continuavam ativas mesmo após removidas das células. Os experimentos de Buchner, ao mesmo tempo, marcaram o final da visão vitalista e o alvorecer da ciência bioquímica. Posteriormente, Frederick W. Kühne deu o nome de enzimas para as moléculas detectadas por Buchner (NELSON; COX, 2014). Exceto por um pequeno grupo de moléculas de RNA catalíticas (ribozimas), todas as enzimas são proteínas. A atividade catalítica depende da integridade das suas conformações nativas. Se uma enzima for desnaturada ou dissociada nas suas subunidades, geralmente a atividade catalítica é perdida. Algumas enzimas não necessitam de outros grupos químicos além dos seus próprios resíduos de aminoácidos. Outras, necessitam de um componente químico adicional denominado cofator, que pode ser um ou mais íons inorgânicos como Fe21, Mg21, Mn21 ou Zn21) ou uma molécula orgânica ou metalorgânica complexa, denominada coenzima. As coenzimas agem como carreadores transitórios de grupos funcionais específicos. A maioria deles é derivada das vitaminas, nutrientes orgânicos cuja presença na dieta é necessária em pequenas quantidades. Algumas enzimas necessitam tanto de uma coenzima quanto de um ou mais íons metálicos para terem atividade. Uma coenzima ou um íon metálico que se ligue muito firmemente, ou mesmo covalentemente, a uma enzima é denominado grupo prostético. Uma enzima completa, cataliticamente ativa junto a sua coenzima e/ou íons metálicos é denominada holoenzima. A parte proteica de uma dessas enzimas é denominada apoenzima ou apoproteína. Finalmente, algumas enzimas são modificadas covalentemente por fosforilação, glicosilação e outros processos. Muitas dessas modificações estão envolvidas na regulação da atividade enzimática (BERTUZZI et al., 2008). 103 2 FUNÇÃO ENZIMÁTICA A catálise enzimática das reações é essencial para os sistemas vivos. Nas condições biológicas relevantes, as reações não catalisadas tendem a ser lentas – a maioria das moléculas biológicas é muito estável nas condições internas das células com pH neutro, temperaturas amenas e ambiente aquoso. Além disso, muitos processos químicos corriqueiros, como a formação transitória de intermediários instáveis carregados ou a colisão de duas ou mais moléculas na orientação exata necessária para que as reações ocorram, são desfavoráveis ou improváveis no ambiente celular (NELSON; COX, 2014). As reações necessárias para digerir os alimentos, enviar sinais nervosos ou contrair os músculos simplesmente não ocorrem em velocidades adequadas sem catálise. As enzimas contornam esses problemas ao proporcionarem um ambiente específico adequado para que uma dada reação possa ocorrer mais rapidamente. A propriedade característica das reações catalisadas por enzimas é que a reação ocorre confinada em um bolsão da enzima denominado sítio ativo (Figura 22). A molécula que se liga no sítio ativo e sobre a qual a enzima age é denominada substrato. FIGURA 22 – ESQUEMA DE FUNCIONAMENTO DE UMA ENZIMA FONTE: <https://www.infoescola.com/bioquimica/complexo-chave-e-fechadura/>. Acesso em: 25 abr. 2019. 3 CINÉTICA ENZIMÁTICA Normalmente os bioquímicos utilizam várias abordagens para estudar o mecanismo de ação de enzimas purificadas. A estrutura tridimensional das proteínas fornece informações importantes, que são incrementadas pela química de proteínas e por modernos métodos de mutagênese sítio dirigida (mudança na sequência de aminoácidos de uma proteína por engenharia genética). Essas tecnologias permitem que os enzimologistas examinem o papel de aminoácidos individualmente na estrutura e na atividade de uma enzima. Entretanto, a abordagem mais antiga para entender o mecanismo das enzimas, e que permanece ainda entre as mais importantes, é determinar a velocidade da reação e como ela se modifica em resposta às mudanças nos parâmetros experimentais, disciplina conhecida como cinética enzimática (NELSON; COX, 2014). 104 Um fator-chave que afeta a velocidade das reações catalisadas por enzimas é a concentração do substrato [S]. Entretanto, o estudo dos efeitos da concentração do substrato é complicado pelo fato de [S] modificar-se durante o curso de uma reação in vitro à medida que o substrato é convertido em produto (NELSON; COX, 2014). As enzimas têm um pH (ou uma faixa de pH) ótimo no qual a atividade catalítica é máxima; a atividade decresce em pH maior ou menor. Isso não surpreende. As cadeias laterais dos aminoácidos do sítio ativo podem funcionar como ácidos ou bases fracas em funções críticas que dependem da manutenção de certo estado de ionização, e em outras partes da proteína, as cadeias laterais ionizáveis podem ter uma participação essencial nas interações que mantêm a estrutura proteica (RODWELL; MURRAY; GRANNER, 2017). 3.1 ENZIMAS REGULADORAS No metabolismo celular, grupos de enzimas trabalham conjuntamente em vias sequenciais para realizar um determinado processo metabólico, como a degradação da glicose a lactato por uma série de reações ou as muitas reações da síntese de aminoácidos a partir de precursores simples. Nesses sistemas enzimáticos, o produto da reação de uma enzima é o substrato da enzima seguinte. Para Nelson e Cox (2014, p. 190): A maioria das enzimas das vias metabólicas segue os padrões cinéticos que foram descritos. Cada via, entretanto, inclui uma ou mais enzimas que influenciam em muito a velocidade de toda a sequência de reações. Essas enzimas regulatórias têm a atividade catalítica aumentada ou diminuída em resposta a certos sinais. Ajustes na velocidade das reações catalisadas por enzimas regulatórias e, portanto, ajustes na velocidade da sequência metabólica inteira permitem que as células atendam às necessidades de energia e das biomoléculas de que precisam para crescer e se manter. As atividades das enzimas regulatórias são moduladas de várias maneiras. Enzimas alostéricas agem por meio de ligações reversíveis e não covalentes com compostos regulatórios denominados moduladores alostéricos ou efetores alostéricos, que geralmente são metabólitos pequenos ou cofatores. Outras enzimas são reguladas por modificações covalentes reversíveis. As duas classes de enzimas regulatórias tendem a ser proteínas com subunidades múltiplas e, em alguns casos, o(s) sítio(s) regulatório(s) e o sítio ativo se encontram em subunidades separadas. Os sistemas metabólicos têm ao menos dois outros mecanismos de regulação enzimática. Algumas enzimas são estimuladas ou inibidas quando estão ligadas a proteínas regulatórias distintas. Outras são ativadas quando segmentos peptídicos são removidos por proteólise. Diferentemente da regulação mediada por efetores, a regulação por proteólise é irreversível. 105 Exemplos importantes desses mecanismos são encontrados em processos fisiológicos como digestão, coagulação do sangue, ação hormonal e visão. O crescimento e a sobrevivência das células dependem do uso eficiente dos recursos disponíveis, e essa eficiência é possibilitada pelas enzimas regulatórias. Não há uma regra única para governar os diferentes tipos de regulação dos diferentes sistemas. Em certo grau, a regulação alostérica (não covalente) talvez possibilite os ajustes finos das vias metabólicas que constantemente são necessários e em níveis, variando em decorrência das mudanças da atividade e das condições das células. A regulação por modificações covalentes pode ser do tipo “tudo ou nada”, normalmente no caso de proteólise, ou então possibilitar mudanças sutis na atividade. Vários tipos de regulação podem ocorrer em uma única enzima regulatória (BERG; TYMOCZKO; STRYERT, 2015). 106 RESUMO DO TÓPICO 4 Neste tópico, você adquiriu certos aprendizados, como: • A vida depende de catalisadores poderosos e específicos: as enzimas. • Praticamente todas as reações bioquímicas são catalisadas por enzimas. • Com a exceção de poucos RNA catalíticos, todas as enzimas conhecidas são proteínas. • Muitas proteínas necessitam de coenzimas ou cofatores não proteicos para exercerem a atividade catalítica. • As enzimas são classificadas segundo o tipo de reação que catalisam. • As reações catalisadas por enzimas são caracterizadas pela formação de um complexo entre o substrato e a enzima (complexo ES). A ligação ao substrato ocorre em um bolsão da enzima denominado sítio ativo. • A maioria das enzimas tem algumas propriedades cinéticas em comum. • Cada enzima tem um pH ótimo (ou um intervalo de pH), no qual a atividade é máxima. • A atividade das vias metabólicas nas células é regulada pelo controle da atividade de determinadas enzimas. • Outras enzimas regulatórias são moduladas por modificações covalentes de grupos funcionais específicos que são necessários para a atividade. A fosforilação de resíduos de determinados aminoácidos é uma maneira muito comum de regular a atividade de enzimas. 107 AUTOATIVIDADE 1 Nos dias atuais, sabemos que as moléculas de proteínas são formadas por dezenas, centenas ou milhares de outras moléculas, ligadas em sequência como os elos de uma corrente. Assinale a alternativa que menciona quais moléculas formam as proteínas: a) b) c) d) e) ( ( ( ( ( ) Moléculas de proteínas. ) Moléculas de aminoácidos. ) Moléculas de glicose. ) Moléculas de polissacarídeos. ) Moléculas de quitina. 2 A figura ilustra a ligação que ocorre entre dois aminoácidos. Analise e preencha as lacunas da frase que segue: FIGURA – LIGAÇÃO QUE OCORRE ENTRE DOIS AMINOÁCIDOS FONTE: A autora A formação de proteínas ocorre devido à ligação da amina de um aminoácido com o ________________ de outro aminoácido. Esta ligação está circulada na figura apresentada e é denominada _______________. Para que esta ligação ocorra é necessária a saída de uma molécula de ____________. 3 Com o título Boca livre, a revista Veja, edição 1298, ano 26, nº 30, de 28 de julho de 1993, página 55, publicou um artigo sobre uma nova droga ainda em testes, o Orlistat, desenvolvida pelo laboratório Hoffmann-La Roche. A reportagem diz que essa droga “[...] bloqueia (uma fatia dessas) enzimas, impedindo que elas desdobrem as enormes 108 moléculas de gordura em fragmentos menores. Assim, a gordura não tem como atravessar as paredes do intestino e não chega à corrente sanguínea”. As enzimas que o Orlistat bloqueia correspondem às: a) b) c) d) e) ( ( ( ( ( ) Proteases. ) Lipases. ) Amilases. ) Lactases. ) Peptidases. 4 Enzimas são moléculas orgânicas de natureza proteica e agem nas reações químicas das células como catalisadoras, ou seja, aceleram a velocidade dos processos sem alterá-los. Geralmente são os catalisadores mais eficazes, por sua alta especificidade. Sua estrutura quaternária é quem determinará sua função, a que substrato ela se acoplará para acelerar determinada reação. Nosso corpo é mantido vivo por uma série de reações químicas em cadeia que chamamos de vias metabólicas, nas quais o produto de uma reação serve como reagente posteriormente. Todas as fases de uma via metabólica são mediadas por enzimas. Muitas enzimas podem ser utilizadas como marcadores biológicos para auxiliar no diagnóstico de algumas patologias. Pesquise a importância clínica das seguintes enzimas: a) b) c) d) e) f) g) h) i) j) AMILASE: LIPASE: FOSFATASE ALCALINA: AMINOTRANSFERASE: GGT: ALT: AST: CREATINA QUINASE: TGO: TGP: 109 110 UNIDADE 2 TÓPICO 5 - CARBOIDRATOS E GLICOCONJUGADOS 1 INTRODUÇÃO Os carboidratos são as biomoléculas mais abundantes na Terra. A cada ano, a fotossíntese converte mais de 100 bilhões de toneladas métricas de CO2 e H2O em celulose e outros produtos vegetais. Alguns carboidratos (açúcar e amido) são os principais elementos da dieta em muitas partes do mundo, e sua oxidação é a principal via de produção de energia na maioria das células não fotossintéticas. Polímeros de carboidratos (também chamados de glicanos) agem como elementos estruturais e protetores nas paredes celulares bacterianas, vegetais e nos tecidos conectivos animais. Outros polímeros de carboidratos lubrificam as articulações e auxiliam o reconhecimento e a adesão intercelular. Polímeros de carboidratos complexos covalentemente ligados a proteínas ou lipídios atuam como sinais que determinam a localização intracelular ou o destino metabólico dessas moléculas híbridas, chamadas de glicoconjugados. Existem três classes principais de carboidratos: monossacarídeos, dissacarídeos e polissacarídeos (a palavra “sacarídeo” é derivada do grego sakcharon, que significa “açúcar”). Os monossacarídeos, ou açúcares simples, são constituídos por uma única unidade poli-hidroxicetona ou poli-hidroxialdeído. O monossacarídeo mais abundante na natureza é o açúcar de seis carbonos D-glicose, algumas vezes chamado de dextrose. Monossacarídeos de quatro ou mais carbonos tendem a formar estruturas cíclicas. Os oligossacarídeos consistem em cadeias curtas de unidades de monossacarídeos, ou resíduos, unidas por ligações características chamadas de ligações glicosídicas (NELSON; COX, 2014). Os mais abundantes são os dissacarídeos, com duas unidades de monossacarídeos. Um dissacarídeo típico é a sacarose (açúcar de cana), constituído pelos açúcares de seis carbonos D-glicose e D-frutose. Todos os monossacarídeos e dissacarídeos comuns têm nomes terminados com o sufixo “-ose”. Em células, a maioria dos oligossacarídeos constituídos por três ou mais unidades não ocorre como moléculas livres, mas sim ligada a moléculas que não são açúcares (lipídios ou proteínas), formando glicoconjugados. Os polissacarídeos são polímeros de açúcar que contêm mais de 20 unidades de monossacarídeo; alguns têm centenas ou milhares de unidades. Alguns polissacarídeos, como a celulose, têm cadeias lineares; outros, como o glicogênio, são ramificados. Ambos são formados por unidades repetidas de D-glicose, mas diferem no tipo de ligação glicosídica e, em consequência, têm propriedades e funções biológicas notavelmente diferentes (NELSON; COX, 2014). Neste tópico estudaremos as características e a importância dos diferentes grupos de carboidratos. 111 deste livro. São apresentados também alguns importantes derivados de monossacarídeos encontrados em capítulos posteriores. As duasE famílias de monossacarídeos são 2 MONOSSACARÍDEOS DISSACARÍDEOS aldoses e cetoses Todos os monos tona, contêm um (quirais) e, por ticamente ativa ceraldeído, cont central) e assim enantiômeros Os monossacarídeos são sólidos cristalinos e incolores CONVENÇÃOCHAV Os mais simples dos carboidratos, os monossacarídeos, são aldeídos ou cetonas, plenamente solúveis em água, mas insolúveis em solven- deído é, por co com dois ou mais grupos hidroxila; os monossacarídeos seis carbonos, glicose e tes apolares. A maioria tem sabordeadocicado (ver Quadro é isômero L. As frutose, têm cinco grupos hidroxila. Muitos átomosdos de monossacarídeos carbono aos quais os grupos 7-2, p. 254). Osdos esqueletos comuns centros quirais, são compostos cadeias de carbono não estereoisômeros ramificadas, hidroxila estão ligados são centros quirais,por o que origina os muitos são conhecidas nas quais todos os átomos de carbono estão unidos por representar est de açúcares encontrados na natureza. Esse estereoisomerismo é biologicamente ligações simples. Nessa forma de cadeia aberta, um dos papel, em geral importante, porque as enzimas que sobre açúcares são absolutamente átomos de agem carbono está os ligado duplamente a um áto- de Fischer (F mo depreferindo oxigênio, formando um grupo carbonil; os por outros estereoespecíficas, normalmente um estereoisômeros a outro três ou Fischer, as ligaç átomos de carbono estão ligados, cada um, a um grupo mais ordens de magnitude (NELSON; COX, 2014). plano do papel, hidroxila. Quando o grupo carbonil está na extremidade se projetam par da cadeia de carbonos (isto é, em um grupo aldeído), o do leitor. ■ Os monossacarídeosmonossacarídeo são sólidos cristalinos e incolores plenamente solúveis em é uma aldose; quando o grupo carbonil Geralmente, está em qualquer posição (emrelata um grupo o água, mas insolúveis em solventes apolares.outra Baynes (2015) que cetona), os esqueletos ter 2n estereoisô monossacarídeo é uma cetose. Os monossacarídeos mais dos monossacarídeos comuns são compostos por cadeias de carbono não ramificadas, simples são as duas trioses de três carbonos: gliceralde- -hexoses, com q nas quais todos os átomos de carbono estão unidos por ligações simples. Nessa cada um dos co ídos (aldotrioses) e di-hidroxiacetonas (cetotrioses, verforma reoisômeros dos de cadeia aberta, um dos átomos carbono está ligado duplamente a um átomo de Figurade 7-1a). dois grupos, os Monossacarídeos quatro, cinco, seisestão e seteligados, átomoscada oxigênio, formando um grupo carbonil; os outroscom átomos de carbono centro quiral ma de carbono no esqueleto são chamados, respectivamente, um, a um grupo hidroxila. Quando o grupo carbonil está na extremidade da cadeia de de tetroses, pentoses, hexoses e heptoses. Existem aldoses les nos quais a c carbonos (isto é, em um grupo aldeído), o monossacarídeo é uma aldose; quando e cetoses para cada um desses comprimentos de cadeia: al- aomesma daquel dotetroses e cetotetroses, e cetopentoses, e ros D, e aqueles grupo carbonil está em qualquer outra posição (em umaldopentoses grupo cetona), o monossacarídeo deído são isôme assim pormais diante. As hexoses, aldo-hexose é uma cetose. Os monossacarídeos simples são as que duasincluem triosesade três carbonos: gliceraldeídos (aldotrioses) e di-hidroxiacetonas (cetotrioses, ver Figura 23). H FIGURA 23 – MONOSSACARÍDEOS REPRESENTATIVOS H C H C H C OH H C OH H D-Gliceraldeído, aldotriose OH C O H C OH H Di-hidroxiacetona, cetotriose (a) C H C H O H O H C C OH HO C H H HO C OH H H C OH H CH2OH O C H C OH C OH CH 2OH D-Glicose, aldo-hexose D-Frutose, ceto-hexose (b) FONTE: Nelson e Cox (2014, p. 244) FIGURA 71 Monossacarídeos representativos. (a) Duas trioses, uma aldose e uma cetose. O grupo carbonil em cada molécula está sombreado. (b) Duas hexoses comuns. (c) As pentoses componentes de áci- dos nucleicos. A D-ri e a 2-desóxi-D-ribos (DNA). A nomenclatura dos monossacarídeos é baseada na quantidade de átomos de carbono, então onde existem monossacarídeos com quatro, cinco, seis e sete átomos de carbono no esqueleto eles são chamados, respectivamente, de tetroses, pentoses, hexoses e heptoses. Existem aldoses e cetoses para cada um desses comprimentos de cadeia: aldotetroses e cetotetroses, aldopentoses e cetopentoses, e assim por diante. As hexoses, que incluem a aldo-hexoseD-glicose e a ceto-hexose D-frutose (Figura 24) são os monossacarídeos mais comuns na natureza – os produtos da fotossíntese e Nelson_6ed_07.indd 244 os intermediários-chave das sequências de reações produtoras de energia centrais da maioria dos organismos. As aldopentoses ribose e desoxirribose são componentes dos nucleotídeos e dos ácidos nucleicos (será discutido no próximo tópico). 112 OH Observe o esquema a seguir sobre a nomenclatura dos monossacarídeos: FIGURA 24 – NOMENCLATURA DOS MONOSSACARÍDEOS FONTE: A autora Podemos perceber que a nomenclatura dos monossacarídeos envolve três etapas: 1. Verificar se é uma aldose ou uma cetose. 2. Verificar a quantidade de átomos de carbono. 3. Acrescentar o sufixo Ose. Por simplicidade, até este momento foram representadas as estruturas de aldoses e cetoses como moléculas de cadeia aberta. Na verdade, em solução aquosa, as aldotetroses e todos os monossacarídeos com cinco ou mais átomos de carbono no esqueleto ocorrem predominantemente como estruturas cíclicas (em anel), nas quais o grupo carbonil está formando uma ligação covalente com o oxigênio de um grupo hidroxila presente na cadeia. A formação dessas estruturas em anel é o resultado de uma reação geral entre álcoois e aldeídos ou cetonas para formar derivados chamados de hemiacetais ou hemicetais (NELSON; COX, 2014). Muito frequentemente, durante a síntese e o metabolismo de carboidratos, os intermediários não são os próprios açúcares, mas os seus derivados fosforilados. A condensação do ácido fosfórico com um dos grupos hidroxila de um açúcar forma um éster de fosfato, como na glicose-6-fosfato, o primeiro metabólito da rota por meio da qual a maioria dos organismos oxida a glicose para energia. Os açúcares fosforilados são relativamente estáveis em pH neutro e têm carga negativa. Um dos efeitos da fosforilação intracelular de açúcares é o confinamento do açúcar dentro da célula; a maioria das células não tem transportadores para açúcares fosforilados na membrana plasmática. A fosforilação também ativa açúcares para subsequente transformação química. Alguns derivados de açúcares fosforilados importantes são componentes dos nucleotídeos (BERG, 2008). 113 Os monossacarídeos podem ser oxidados por agentes oxidantes relativamente suaves, como o íon cúprico (Cu21). O carbono do carbonil é oxidado a um grupo carboxil. A glicose e outros açúcares capazes de reduzir o íon cúprico são chamados de açúcares redutores. O íon cúprico oxida a glicose e certos outros açúcares a uma complexa mistura de ácidos carboxílicos. Essa é a base da reação de Fehling, teste semiquantitativo para a presença de açúcar redutor, que por muitos anos foi utilizado para detectar e dosar níveis elevados de glicose em pessoas com diabetes melito. Hoje, utilizamse métodos mais sensíveis, que envolvem uma enzima imobilizada em uma tira de teste e requerem apenas uma única gota de sangue (NELSON; COX, 2014, p. 251). Os dissacarídeos (como maltose, lactose e sacarose) consistem em dois monossacarídeos unidos covalentemente por uma ligação O-glicosídica, a qual é formada quando um grupo hidroxila de uma molécula de açúcar, normalmente cíclica, reage com o carbono anomérico de outro. Ligações glicosídicas são prontamente hidrolisadas por ácido, mas resistem à clivagem por base. Assim, os dissacarídeos podem ser hidrolisados para originar seus componentes monossacarídicos livres por fervura em ácido diluído. Ligações N-glicosídicas unem o carbono anomérico de um açúcar a um átomo de nitrogênio em glicoproteínas e nucleotídeos (NELSON; COX, 2014). 3 POLISSACARÍDEOS A maioria dos carboidratos encontrados na natureza ocorre como polissacarídeos, polímeros de média a alta massa molecular. Os polissacarídeos, também chamados de glicanos, diferem uns dos outros na identidade das unidades de monossacarídeos repetidas, no comprimento das cadeias, nos tipos de ligações unindo as unidades e no grau de ramificação. Os homopolissacarídeos contêm somente uma única espécie monomérica; os heteropolissacarídeos contêm dois ou mais tipos. Alguns homopolissacarídeos, como o amido e o glicogênio, servem como formas de armazenamento para monossacarídeos utilizados como combustíveis. Outros homopolissacarídeos, como a celulose e a quitina, atuam como elementos estruturais em paredes celulares de plantas e em exoesqueletos de animais. Os heteropolissacarídeos fornecem suporte extracelular para organismos de todos os reinos. Por exemplo, a camada rígida do envelope celular bacteriano (o peptidoglicano) é parcialmente composta por um heteropolissacarídeo construído por duas unidades alternadas de monossacarídeo. Nos tecidos animais, o espaço extracelular é preenchido por alguns tipos de heteropolissacarídeos, os quais formam uma matriz que conecta células individuais e fornece proteção, forma e suporte para células, tecidos e órgãos (RODWELL; MURRAY; GRANNER, 2017). Os polissacarídeos de armazenamento mais importantes são o amido, em células vegetais, e o glicogênio, em células animais. Ambos ocorrem intracelularmente em grandes agrupamentos ou grânulos. As moléculas de amido e glicogênio são 114 extremamente hidratadas, pois têm muitos grupos hidroxila expostos e disponíveis para formarem ligações de hidrogênio com a água. A maioria das células vegetais possui a capacidade de sintetizar amido, e o seu armazenamento é especialmente abundante em tubérculos – como a batata – e em sementes. O amido contém dois tipos de polímero de glicose, amilose e amilopectina (NELSON; COX, 2014). O glicogênio é o principal polissacarídeo de armazenamento das células animais. Como a amilopectina, o glicogênio é um polímero formado pela união de várias moléculas de glicose. O glicogênio é especialmente abundante no fígado, podendo constituir até 7% do peso líquido; ele também está presente no músculo esquelético. Nos hepatócitos, o glicogênio é encontrado em grandes grânulos, os quais são agrupamentos de grânulos menores compostos por moléculas únicas de glicogênio, altamente ramificadas, com massa molecular média de alguns milhões. Esses grânulos de glicogênio também apresentam, firmemente ligadas, as enzimas responsáveis pela síntese e degradação do glicogênio (NELSON; COX, 2014). Alguns homopolissacarídeos estão presentes como componentes estruturais na parede celular de vegetais (celulose) e no exoesqueleto de insetos e crustáceos (quitina). O espaço extracelular dos tecidos dos animais multicelulares é preenchido com um material semelhante a gel, a matriz extracelular (MEC), também chamada de substância fundamental, que mantém as células unidas e provê um meio poroso para a difusão de nutrientes e oxigênio para cada célula. A MEC, que circunda fibroblastos e outras células do tecido conectivo, é composta por uma rede entrelaçada de polissacarídeos e proteínas fibrosas, como colágenos, elastinas e fibronectinas fibrilares. A membrana basal é uma MEC especializada sobre a qual se assentam as células epiteliais; ela é constituída por colágenos especializados, laminas e heteropolissacarídeos (NELSON; COX, 2014). Os heteropolissacarídeos, os glicosaminoglicanos, formam uma família de polímeros lineares compostos por unidades de dissacarídeo repetidas. Os glicosaminoglicanos são exclusivos de animais e bactérias, não sendo encontrados em plantas. O glicosaminoglicano ácido hialurônico (hialuronana) forma soluções claras, altamente viscosas, que funcionam como lubrificantes no líquido sinovial das articulações e geram a consistência gelatinosa do humor vítreo nos olhos dos vertebrados (a palavra grega hyalos significa “vidro”; o ácido hialurônico pode ter aparência vítrea ou translúcida). O ácido hialurônico também é um componente da matriz extracelular de cartilagens e tendões, em que auxilia na resistência à tensão e elasticidade, devido a sua forte interação não covalente com outros componentes da matriz. A hialuronidase, enzima secretada por certas bactérias patogênicas, hidrolisa as ligações glicosídicas do ácido hialurônico, tornando os tecidos mais suscetíveis à infecção bacteriana. Em muitas espécies animais, uma enzima similar presente no espermatozoide hidrolisa o revestimento de glicosaminoglicano que envolve o ovócito, permitindo a penetração do espermatozoide. 115 NOTA Você sabia? O condroitin-sulfato, um heteropolissacarídeo, é um dos principais componentes estruturais da cartilagem. Colírios oftalmológicos, em sua maioria, são soluções de condroitin-sulfato que permitem uma melhor lubrificação do globo ocular. 4 GLICOCONJUGADOS: GLICOPROTEÍNAS E GLICOLIPÍDIOS PROTEOGLICANOS, Além dos importantes papéis como armazenadores de combustível (amido, glicogênio, dextrana) e como material estrutural (celulose, quitina, peptidoglicanos), os polissacarídeos e oligossacarídeos são transportadores de informação. Alguns fornecem comunicação entre as células e a matriz extracelular circundante; outros sinalizam proteínas para o transporte e a localização em organelas específicas ou para degradação, quando a proteína é malformada ou supérflua; e outros atuam como pontos de reconhecimento para moléculas de sinalização extracelulares (fatores de crescimento, por exemplo) ou parasitas extracelulares (bactérias e vírus). Em praticamente todas as células eucarióticas, cadeias de oligossacarídeos específicos ligadas a componentes da membrana plasmática formam uma camada de carboidratos (o glicocálice) com alguns nanômetros de espessura, que serve como uma superfície rica em informações que a célula expõe para o meio exterior. Esses oligossacarídeos são componentes centrais para reconhecimento e adesão entre células, migração celular durante o desenvolvimento, coagulação sanguínea, resposta imune, cicatrização de ferimentos e outros processos celulares. Na maioria desses casos, o carboidrato que carrega a informação está covalentemente ligado a uma proteína ou lipídio, formando um glicoconjugado (Figura 25), molécula biologicamente ativa. 116 peptidoglicano em bacrídeo que se repete no )Mur2Ac; no ágar, é D- eropolissacarídeos exduas unidades de moco (o queratan-sulfato m aminoaçúcar N-acetiuns dos grupos hidromino de certos resíduos o heparan-sulfato dão a dade de cargas negatinformações estendidas. ico, sulfato de condroian-sulfato) garantem à adesão e resistência à grânulos de secreção e lisossomos. As porções oligossacarídicas das glicoproteínas são muito heterogêneas e, assim como os glicosaminoglicanos, são ricas em informação, forFIGURA 25 – ESTRUTURA DE ALGUNS GLICOCONJUGADOS Proteoglicanos +NH | 3 Sulfato de condroitina Ser Heparan-sulfato Fuc Gal Glc Man Xilose Ser Glicoproteínas +NH 3 | N-glicano GlcA GalNAc GlcNAc Asn IdoA Asn licanos, pídeos Neu5Ac Glicoesfingolipídeos armazenadores de comna) e como material eslicanos), os polissacarírtadores de informação. re as células e a matriz alizam proteínas para o elas específicas, ou para alformada ou supérflua; onhecimento para moléfatores de crescimento, lulares (bactérias e vílas eucarióticas, cadeias O-glicano Ser/Thr Ser/Thr Fora Membrana Dentro | COO– | COO– FONTE: Nelson eAs Cox (2014, p.de263) FIGURA 724 Glicoconjugados. estruturas alguns proteoglicanos, glicoproteínas e glicoesfingolipídeos típicos descritos no texto. Os proteoglicanos são macromoléculas da superfície celular ou da matriz extracelular nas quais uma ou mais cadeias de glicosaminoglicanos sulfatados estão covalentemente unidas a uma proteína de membrana ou a uma proteína secretada. A cadeia de glicosaminoglicano pode ligar-se a proteínas extracelulares por meio de interações eletrostáticas entre a proteína e os açúcares negativamente carregados do 07/04/14 14:30 proteoglicano. Os proteoglicanos são os principais componentes de todas as matrizes extracelulares. As glicoproteínas têm um ou alguns oligossacarídeos de complexidades variadas, unidos covalentemente a uma proteína. Costumam ser encontradas na superfície externa da membrana plasmática (como parte do glicocálice), na matriz extracelular e no sangue. Nas células são encontradas em organelas específicas, como aparelho de Golgi, grânulos de secreção e lisossomos. As porções oligossacarídicas das glicoproteínas são muito heterogêneas e, assim como os glicosaminoglicanos, são ricas em informação, formando locais extremamente específicos para o reconhecimento e a ligação de alta afinidade por proteínas ligantes de carboidratos, chamadas de lectinas. Algumas proteínas citosólicas e nucleares também podem ser glicosiladas (NELSON; COX, 2014). 117 Os glicoesfingolipídios são componentes da membrana plasmática nos quais o grupo hidrofílico da cabeça é um oligossacarídeo. Como nas glicoproteínas, os oligossacarídeos servem como pontos específicos para o reconhecimento por lectinas. O cérebro e os neurônios são ricos em glicoesfingolipídios, os quais auxiliam na condução nervosa e na formação da mielina. Os glicoesfingolipídios também são importantes para a transdução de sinal celular (NELSON; COX, 2014). NOTA Curiosidades: Você sabia que os glicoconjugados estão envolvidos com a sinalização descoberta em hemácias (glóbulos vermelhos) envelhecidas? Sim, as hemácias jovens têm, em sua superfície, glicoproteínas cuja extremidade é rica em ácido siálico. Quando tais células envelhecem, suas glicoproteínas perdem esse ácido e passam a expressar, em sua extremidade, a galactose. Esse monossacarídeo é reconhecido por receptores do fígado, que então capturam e removem da circulação as hemácias ‘velhas’. NOTA Dosagem de glicose sanguínea no diagnóstico e no tratamento do diabetes A glicose é o principal combustível para o cérebro. Quando a quantidade de glicose que chega até o cérebro é muito baixa, as consequências podem ser desastrosas: letargia, coma, dano cerebral permanente e morte. Com a evolução, os animais desenvolveram mecanismos hormonais complexos para garantir que a concentração de glicose no sangue permaneça alta o suficiente (aproximadamente 5 mM) para satisfazer as necessidades cerebrais, mas não alta demais, já que níveis elevados de glicose no sangue também podem ter consequências fisiológicas sérias. Os indivíduos com diabetes melito dependente de insulina não produzem insulina suficiente, o hormônio que normalmente atua para a redução da concentração de glicose no sangue, e, se o diabetes não for tratado, os níveis de glicose sanguínea nesses indivíduos podem elevar-se, ficando algumas vezes maiores do que o normal. Acredita-se que esses altos níveis de glicose sejam pelo menos uma das causas das sérias consequências de longo prazo no diabetes não tratado – insuficiência renal, doenças cardiovasculares, cegueira e cicatrização debilitada –, de modo que um dos objetivos da terapia é prover exatamente a quantidade de insulina suficiente (por injeção) para manter os níveis de glicose próximos do normal. Para manter o balanço correto entre exercício, dieta e insulina para cada indivíduo, a concentração de glicose sanguínea deve ser dosada algumas vezes ao dia, e a quantidade de insulina injetada deve ser ajustada de modo apropriado. 118 As concentrações de glicose no sangue e na urina podem ser determinadas por meio de um ensaio simples para açúcares redutores, como a reação de Fehling, que por muitos anos foi o teste diagnóstico padrão para diabetes. Dosagens modernas precisam de apenas uma gota de sangue, que é adicionada a uma fita de teste contendo a enzima glicose-oxidase. Uma segunda enzima, uma peroxidase, catalisa a reação do H2O2 com um composto incolor gerando um produto colorido, quantificado com um fotômetro simples que mostra a concentração de glicose no sangue. Como os níveis de glicose sanguínea variam com os períodos de refeição e exercício, essas dosagens em momentos específicos não refletem a glicose sanguínea média ao longo de horas ou dias, de modo que elevações perigosas podem passar despercebidas. A concentração de média glicose pode ser estimada pelo seu efeito na hemoglobina, a proteína carreadora de oxigênio dos eritrócitos. Transportadores na membrana dos eritrócitos equilibram a concentração de glicose intracelular e plasmática, de modo que a hemoglobina está constantemente exposta à concentração de glicose presente no sangue, qualquer que seja essa concentração. Uma reação não enzimática ocorre entre a glicose e os grupos amino primários da hemoglobina. A velocidade desse processo é proporcional à concentração de glicose; por isso, essa reação pode ser usada como base para a estimativa do nível médio de glicose sanguínea ao longo de semanas. A quantidade de hemoglobina glicada (HbG) circulante em qualquer momento reflete a concentração de glicose sanguínea média durante o “período de vida” do eritrócito (cerca de 120 dias), embora a concentração das últimas duas semanas seja a mais importante na determinação do nível de HbG. FONTE: Adaptado de Nelson e Cox (2014, p. 280-281) 119 RESUMO DO TÓPICO 5 Neste tópico, você adquiriu certos aprendizados, como: • Os açúcares (também chamados de sacarídeos) são compostos que contêm um grupo aldeído ou cetona e dois ou mais grupos hidroxila. • Os monossacarídeos comumente formam hemiacetais ou hemicetais internos, nos quais o grupo aldeído ou cetona se une a um grupo hidroxila da mesma molécula, criando uma estrutura cíclica. • Oligossacarídeos são polímeros curtos, com alguns monossacarídeos unidos por ligações glicosídicas. Em uma das extremidades da cadeia, a extremidade redutora está uma unidade de monossacarídeo com seu carbono anomérico não envolvido em uma ligação glicosídica. • Os polissacarídeos (glicanos) servem para o armazenamento de combustível como componentes estruturais da parede celular e da matriz extracelular. • Os homopolissacarídeos amido e glicogênio armazenam combustível em células vegetais, animais e bacterianas. • Os homopolissacarídeos celulose, quitina e dextrana têm funções estruturais. A celulose, composta por resíduos de D-glicose em ligações (b1S4), garante força e rigidez à parede celular de plantas. A quitina, um polímero de N-acetilglicosamina com ligações (b1S4), fortalece o exoesqueleto de artrópodes. A dextrana forma um revestimento aderente ao redor de certas bactérias. • Os glicosaminoglicanos são heteropolissacarídeos extracelulares nos quais uma das duas unidades de monossacarídeo é um ácido urônico. Esses polímeros (ácido hialurônico, sulfato de condroitina, dermatan-sulfato e queratan-sulfato) garantem à matriz extracelular viscosidade, adesão e resistência à compressão. • Os proteoglicanos são glicoconjugados nos quais um ou mais glicanos grandes, chamados de glicosaminoglicanos sulfatados (heparan-sulfato, sulfato de condroitina, dermatan-sulfato ou queratan-sulfato) estão covalentemente ligados a uma proteína central. Eles fornecem pontos de adesão, reconhecimento e transferência de informação entre as células ou entre as células e a matriz extracelular. • Muitas proteínas extracelulares ou da superfície celular são glicoproteínas, assim como a maioria das proteínas secretadas. Os oligossacarídeos covalentemente ligados influenciam o enovelamento e a estabilidade das proteínas, fornecem informações cruciais sobre o destino de proteínas recentemente sintetizadas e permitem o reconhecimento específico por outras proteínas. 120 AUTOATIVIDADE 1 Os polissacarídeos são macromoléculas formados pela união de muitos monossacarídeos. Estes compostos apresentam uma massa molecular muito elevada que depende do número de unidades de monossacarídeos que se unem. Podem ser hidrolisados em polissacarídeos menores, assim como em dissacarídeos ou monossacarídeos mediante a ação de determinadas enzimas. Nos organismos, os polissacarídeos são classificados em dois grupos dependendo da função biológica que exercem. Um importante polissacarídeo é a heparina. A heparina é um anticoagulante, produzido de forma natural no nosso organismo. As células que produzem heparina são ____________________. A heparina é um polissacarídeo classificada como ____________________. A alternativa que preenche corretamente as lacunas é, respectivamente: a) ( ) Fibroblastos, Heteropolissacarídeos. b) ( ) Mastócitos, Homopolissacarídeos. c) ( ) Fibroblastos, Homopolissacarídeos. d) ( ) Mastócitos, Heteropolissacarídeos. e) ( ) Macrófagos, Heteropolissacarídeo. 2 Os monossacarídeos são os carboidratos mais simples, em que o número de átomos de carbono pode variar de cinco, como nas pentoses, a seis carbonos, como nas hexoses. Os dissacarídeos são associações de dois monossacarídeos, enquanto que os polissacarídeos possuem muitos carboidratos do tipo monossacarídeo. Levando em consideração o que foi estudado acerca destes compostos, analise a seguinte figura: FIGURA – EXEMPLOS DE CARBOIDRATOS FONTE: A autora Com relação à classificação destes carboidratos, marque com V as sentenças verdadeiras e com F as falsas. 121 ( ) A glicose é um monossacarídeo, se trata de uma hexose, e seu grupamento químico é um aldeído. ( ) A frutose é uma pentose, também se trata de um monossacarídeo, no entanto, difere da glicose por apresentar o grupamento do tipo cetona. ( ) Manose se trata de uma pentose do tipo aldeído, assim como a frutose. ( ) A galactose é um dissacarídeo, que forma a lactose, “açúcar do leite”, se trata de uma hexose, pois possui seis carbonos centrais e seu grupamento é o aldeído. Agora, assinale a alternativa CORRETA: a) ( ) V – F – V – F. b) ( ) V – F – F – V. c) ( ) V – F – F – F. d) ( ) F – V – V – F. e) ( ) F – F – V – V. 122 UNIDADE 2 TÓPICO 6 - NUCLEOTÍDEOS E ÁCIDOS NUCLEICOS 1 INTRODUÇÃO Nucleotídeos apresentam uma variedade de funções no metabolismo celular. Eles são a moeda energética nas transações metabólicas; são as ligações químicas essenciais nas respostas da célula a hormônios e a outros estímulos extracelulares; também são os componentes estruturais de uma estrutura ordenada de cofatores enzimáticos e intermediários metabólicos. E, por último, mas não menos importante, são os constituintes dos ácidos nucleicos: ácido desoxirribonucleico (DNA) e ácido ribonucleico (RNA), os repositórios moleculares da informação genética. A estrutura de cada proteína – e, em última análise, de cada biomolécula e componente celular – é o produto da informação programada na sequência nucleotídica dos ácidos nucleicos da célula. A capacidade de armazenar e transmitir a informação genética de uma geração à outra é uma condição fundamental para a vida (NELSON; COX, 2014). Os ácidos nucleicos são assim chamados por seu caráter ácido e por terem sido originalmente descobertos no núcleo das células. A partir da década de 1940, os ácidos nucleicos passaram a ser intensivamente estudados, pois foi descoberto que eles formam os genes responsáveis pela herança biológica (RODWELL; MURRAY; GRANNER, 2017). A sequência de aminoácidos de cada proteína na célula e a sequência nucleotídica de cada RNA são especificadas pela sequência nucleotídica do DNA da célula. Um segmento de uma molécula de DNA que contém a informação necessária para a síntese de um produto biologicamente funcional, seja proteína ou RNA, é denominado gene. Uma célula costuma ter muitos milhares de genes, e moléculas de DNA, não surpreendentemente, tendem a ser muito grandes. O armazenamento e a transferência da informação biológica são as únicas funções conhecidas do DNA. O RNA tem uma ampla variedade de funções e muitas classes são encontradas nas células (NELSON; COX, 2014). Este tópico fornecerá a você, acadêmico, uma visão geral da natureza química dos nucleotídeos e ácidos nucleicos encontrados na maioria das células. 2 ESTRUTURA DOS NUCLEOTÍDEOS E NUCLEOSÍDEOS Os nucleotídeos apresentam três componentes característicos: (1) uma base nitrogenada (contendo nitrogênio); (2) uma pentose; e (3) um ou mais fosfatos. A molécula sem o grupo fosfato é denominada nucleosídeo (Figura 26). 123 FIGURA 26 – ESTRUTURA DOS NUCLEOTÍDEOS E NUCLEOSÍDEO FONTE: A autora As bases nitrogenadas são derivadas de dois compostos relacionados: a pirimidina e a purina. As bases e as pentoses dos nucleotídeos comuns são compostos heterocíclicos. A base de um nucleotídeo é ligada covalentemente por uma ligação N-bglicosídica ao carbono 19 da pentose, e o fosfato é esterificado no carbono 59. A ligação N-b-glicosídica é formada pela remoção dos elementos de água (um grupo hidroxila da pentose e o hidrogênio da base), como na formação da ligação O-glicosídica. Tanto o DNA quanto o RNA contêm duas bases púricas principais: adenina (A) e guanina (G), e duas pirimídicas. No DNA e no RNA, uma das pirimidinas é a citosina (C), mas a segunda pirimidina não é a mesma nos dois: é a timina (T) no DNA e a uracila (U) no RNA. As estruturas das cinco principais bases estão mostradas na Figura 27 (RODWELL; MURRAY; GRANNER, 2017). FIGURA 27 – PRINCIPAIS BASES PÚRICAS E PIRIMÍDICAS DOS ÁCIDOS NUCLEICOS FONTE: Rodwell, Murray e Granner (2017, p. 178) 124 Os ácidos nucleicos são constituídos por duas pentoses. Se o açúcar em questão é a ribose, teremos um ribonucleosídeo, característico do RNA. Se o açúcar em questão é a desoxirribose, teremos um desoxirribonucleosídeo, característico do DNA. 3 LIGAÇÕES FOSFODIÉSTERES Os nucleotídeos consecutivos de ambos DNA e RNA são ligados covalentemente por “pontes” de grupos fosfato, nas quais o grupo 59-fosfato de uma unidade nucleotídica é ligado ao grupo 39-hidroxila do próximo nucleotídeo, criando uma ligação fosfodiéster (Figura 28). Portanto, o esqueleto covalente dos ácidos nucleicos consiste em fosfatos e resíduos de pentose alternados, e as bases nitrogenadas podem ser consideradas como grupos laterais ligados ao esqueleto em intervalos regulares. O esqueleto do DNA e do RNA são hidrofílicos. Os grupos hidroxila dos resíduos de açúcar formam ligações de hidrogênio com a água. Os grupos fosfato, com um pKa próximo a 0, são completamente ionizados e carregados negativamente em pH 7, e as cargas negativas são, de um modo geral, neutralizadas pelas interações iônicas com cargas positivas nas proteínas, nos íons metálicos e nas poliaminas (NELSON; COX, 2014). FIGURA 28 – LIGAÇÕES FOSFODIÉSTER NO ESQUELETO COVALENTE DO DNA E DO RNA FONTE: Nelson e Cox (2014, p. 285) 125 4 ESTRUTURA DOS ÁCIDOS NUCLEICOS A descoberta da estrutura do DNA por Watson e Crick, em 1953, deu origem a disciplinas completamente novas e influenciou o rumo de muitas já estabelecidas. Agora, abordaremos algumas características particulares presentes no DNA e no RNA. 4.1 CARACTERÍSTICAS DO DNA O DNA foi inicialmente isolado e caracterizado por Friedrich Miescher, em 1868. Ele chamou a substância contendo fósforo de “nucleína”. Até os anos de 1940, com o trabalho de Oswald T. Avery, Colin MacLeod e Maclyn McCarty, não existia uma evidência convincente de que o DNA fosse o material genético. Avery e seus colegas descobriram que DNA extraído de uma linhagem virulenta (patogênica) da bactéria Streptococcus pneumoniae, e injetado em uma linhagem não virulenta da mesma bactéria, transformava a linhagem não virulenta em virulenta. Eles concluíram que o DNA da linhagem virulenta carregava a informação genética para virulência. Então, em 1952, experimentos de Alfred D. Hershey e Martha Chase, que estudaram a infecção de células bacterianas por um vírus (bacteriófago), com DNA ou proteína marcados radioativamente, acabaram com qualquer dúvida remanescente de que o DNA, e não a proteína, portava a informação genética. Outra pista importante para a estrutura do DNA veio do trabalho de Erwin Chargaff e seus colegas, no final dos anos 1940. Eles descobriram que as quatro bases nucleotídicas do DNA eram encontradas em proporções diferentes nos DNAs de organismos diferentes e que as quantidades de certas bases estavam relacionadas (NELSON; COX, 2014). James Watson e Francis Crick contaram com essas informações acumuladas sobre o DNA para deduzir sua estrutura. Em 1953, eles postularam o modelo tridimensional da estrutura do DNA que levava em consideração todos os dados disponíveis. O modelo consiste em duas cadeias de DNA helicoidais enroladas em torno do mesmo eixo para formar uma dupla hélice de orientação à direita. O DNA é uma molécula extremamente flexível, em que entre as bases nitrogenadas adenima e timina observamos a presença de duas ligações de hidrogênio, enquanto no pareamento de citocina e guanina, percebemos a presença de três ligações de hidrogênio. 5 CARACTERÍSTICAS DOS RNAS Agora o foco será a expressão da informação genética que o DNA contém. O RNA, a segunda maior forma de ácidos nucleicos nas células, tem muitas funções. Na expressão gênica, o RNA atua como intermediário pelo uso da informação codificada no DNA para especificar a sequência de aminoácidos da proteína funcional. Uma vez que 126 o DNA de eucariotos é basicamente confinado no núcleo, enquanto a síntese proteica ocorre nos ribossomos no citoplasma, alguma outra molécula que não o DNA deve carregar a mensagem genética do núcleo para o citoplasma. Já por volta da década de 1950, o RNA foi considerado o candidato lógico: o RNA é encontrado tanto no núcleo quanto no citoplasma e um aumento na síntese proteica é acompanhado por um aumento na quantidade de RNA citoplásmico e um aumento da sua taxa de renovação. Essas e outras observações levaram vários pesquisadores a sugerir que o RNA carrega a informação genética do DNA para a maquinaria biossintética proteica do ribossomo (RODWELL; MURRAY; GRANNER, 2017). Em 1961, François Jacob e Jacques Monod apresentaram uma descrição consistente de muitos aspectos desse processo. Eles propuseram o nome “RNA mensageiro” (mRNA) para aquela porção do RNA celular total que carrega a informação genética do DNA para os ribossomos, em que os mensageiros fornecem os moldes que especificam as sequências de aminoácidos nas cadeias polipeptídicas. O processo de formação de um mRNA a partir de um molde de DNA é conhecido como transcrição (NELSON; COX, 2014). Além do RNA mensageiro, existem também o RNA ribossômico e RNA transportador. O RNA ribossômico participa da constituição dos ribossomos e são armazenados no núcleo da célula, em uma região denominada de nucléolo. Já o RNA transportador transporta os aminoácidos até o local da síntese de proteínas na Tradução. 6 A QUÍMICA DO ÁCIDO NUCLEICO O papel do DNA como repositório da informação genética depende em parte da sua estabilidade inerente. As transformações químicas que ocorrem geralmente são muito lentas na ausência de um catalisador enzimático. Entretanto, o armazenamento de longo prazo da informação inalterada é tão importante para a célula que mesmo reações muito lentas, que alteram a estrutura do DNA, podem ser fisiologicamente significativas. Processos como carcinogênese e envelhecimento podem estar intimamente ligados ao acúmulo lento e irreversível de alterações no DNA. Outras alterações, não destrutivas, também ocorrem e são essenciais para a função, como a separação das cadeias que deve preceder a replicação do DNA ou a transcrição. Além de proporcionar maior compreensão dos processos fisiológicos, nosso conhecimento da química dos ácidos nucleicos nos concedeu um conjunto poderoso de tecnologias que tem aplicações em biologia molecular, na medicina e na ciência forense (NELSON; COX, 2014). 127 7 OUTRAS FUNÇÕES DOS NUCLEOTÍDEOS Além das suas funções como subunidades dos ácidos nucleicos, os nucleotídeos têm uma variedade de outras funções em cada célula: como carreadores de energia, componentes de cofatores enzimáticos e mensageiros químicos. Podemos citar algumas funções relacionadas ao nucleotídeo: • os nucleotídeos carregam energia química nas células; • nucleotídeos da adenina são componentes de muitos cofatores enzimáticos; • alguns nucleotídeos são moléculas reguladoras. 128 RESUMO DO TÓPICO 6 Neste tópico, você adquiriu certos aprendizados, como: • Um nucleotídeo é constituído por uma base nitrogenada (purina ou pirimidina), um açúcar pentose e um ou mais grupos fosfato. Os ácidos nucleicos são polímeros de nucleotídeos, unidos por ligações fosfodiéster entre o grupo 59-hidroxila de uma pentose e o grupo 39-hidroxila da próxima pentose. • Existem dois tipos de ácidos nucleicos: RNA e DNA. • Os nucleotídeos no RNA contêm ribose e as bases pirimídicas comuns são a uracila e a citosina. • No DNA, os nucleotídeos contêm 29-desoxirribose e as bases pirimídicas comuns são a timina e a citosina. As purinas primárias são adenina e guanina tanto no RNA quanto no DNA. • Muitas linhas de evidência demonstram que o DNA carrega a informação genética. • Alguns dos primeiros indícios vieram do experimento de Avery-MacLeod-McCarty, o qual demonstrou que o DNA isolado de uma linhagem bacteriana pode entrar em células de outra linhagem e transformá-las, dotando-as com algumas características hereditárias do doador. • O RNA mensageiro transfere a informação genética do DNA para os ribossomos para a síntese proteica. • O RNA transportador e o RNA ribossômico também estão envolvidos na síntese proteica. • O ATP é o carregador central de energia química nas células. A presença de uma porção adenosina em uma variedade de cofatores enzimáticos pode ser relacionada às necessidades de energia de ligação. 129 AUTOATIVIDADE Através dessa sequência de perguntas e respostas, observe a importância dos ácidos nucleicos. Ex.: Como a célula realiza suas funções? R.: Através de reações químicas. Quem catalisa essas reações? R.: As enzimas. Quimicamente, o que são enzimas? R.: Proteínas. Quem comanda a síntese das proteínas? R.: Os A.N. Logo, sem A.N. as células não receberiam de suas antecessoras as informações genéticas para orientar a síntese das enzimas certas capazes de catalisar as reações responsáveis pelo tipo de atividades a ser desenvolvida por cada tipo de célula. Agora, responda: 1 Quais as funções dos ácidos nucleicos? 2 Diferencie DNA e RNA. 3 O que é um nucleotídeo? E um nucleosídeo? 130 TÓPICO 7 - UNIDADE 2 LIPÍDIOS 1 INTRODUÇÃO Os lipídios biológicos são um grupo de compostos quimicamente diversos, cuja característica em comum que os define é a insolubilidade em água. As funções biológicas dos lipídios são tão diversas quanto a sua química. Gorduras e óleos são as principais formas de armazenamento de energia em muitos organismos. Os fosfolipídios e os esteróis são os principais elementos estruturais das membranas biológicas. Outros lipídios, embora presentes em quantidades relativamente pequenas, desempenham papéis cruciais como cofatores enzimáticos, transportadores de elétrons, pigmentos fotossensíveis, âncoras hidrofóbicas para proteínas, chaperonas para auxiliar no enovelamento de proteínas de membrana, agentes emulsificantes no trato digestivo, hormônios e mensageiros intracelulares (NELSON; COX, 2014). Este tópico apresentará os lipídios mais representativos de cada um dos tipos de lipídios, organizados de acordo com suas funções, com ênfase na estrutura química e nas propriedades físicas. 2 LIPÍDIOS DE ARMAZENAMENTO As gorduras e os óleos utilizados de modo quase universal como formas de armazenamento de energia nos organismos vivos são derivados de ácidos graxos. Os ácidos graxos são derivados de hidrocarbonetos, com estado de oxidação quase tão baixo (ou seja, altamente reduzido) quanto os hidrocarbonetos nos combustíveis fósseis. A oxidação celular de ácidos graxos (a CO2 e H2O), assim como a combustão controlada e rápida de combustíveis fósseis em motores de combustão interna, é altamente exergônica (RODWELL; MURRAY; GRANNER, 2017). Mas o que é uma reação exergônica? São reações que liberam energia para o trabalho celular a partir do potencial de degradação dos nutrientes orgânicos. Os ácidos graxos representam o grupo mais abundante de lipídios e são derivados dos ácidos carboxílicos (COOH). Possuem de 4 a 24 átomos de carbono e podem ser chamados de lipídios saponificáveis, porque a reação destes com uma solução quente de hidróxido de sódio produz o correspondente sal sódico do ácido carboxílico, isto é, o sabão. 131 Ácidos graxos podem ser classificados em saturados e insaturados. Os saturados geralmente estão no estado sólido e são armazenados no interior de células de gordura chamadas de adipócitos. Os ácidos graxos insaturados geralmente estão no estado líquido e faltam alguns átomos de hidrogênio em sua molécula e, por isso, ocorre uma ligação dupla entre os átomos de carbono. Nos saturados essa ligação é simples. NOTA Você sabia? Existe um tipo de gordura formada por um processo químico (hidrogenação), no qual óleos vegetais líquidos são transformados em ácido graxo trans, uma gordura sólida. Essa gordura é muito prejudicial, pois além de aumentar os níveis de Lipoproteína de baixa densidade LDL, acaba diminuindo os níveis de Lipoproteína de alta densidade HDL. Similar à gordura saturada, na gordura trans os átomos de hidrogênio estão dispostos transversalmente (na diagonal), e não em paralelo, como ocorre nos ácidos graxos encontrados na natureza. Daí vem o nome trans. Os lipídios mais simples construídos a partir de ácidos graxos são os triacilgliceróis, também chamados de triglicerídeos, gorduras ou gorduras neutras. Os triacilgliceróis são compostos por três ácidos graxos, cada um em ligação éster com uma molécula de glicerol (Figura 29). Aqueles que contêm o mesmo tipo de ácido graxo em todas as três posições são chamados de triacilgliceróis simples, e sua nomenclatura é derivada do ácido graxo que contêm. A maioria dos triacilgliceróis de ocorrência natural é mista, pois contém dois ou três ácidos graxos diferentes. Os lipídios têm densidades específicas mais baixas do que a água, o que explica por que as misturas de óleo e água (por ex., tempero de salada com azeite e vinagre) têm duas fases: o óleo, com densidade específica mais baixa, flutua sobre a fase aquosa (NELSON; COX, 2014). As ceras biológicas são ésteres de ácidos graxos saturados e insaturados de cadeia longa (C14 a C36) com álcoois de cadeia longa (C16 a C30). No plâncton, microrganismos de vida livre na base da cadeia alimentar dos animais marinhos, as ceras são a principal forma de armazenamento de combustível metabólico. As ceras também servem para uma diversidade de outras funções relacionadas as suas propriedades impermeabilizantes e sua consistência firme. Certas glândulas da pele de vertebrados secretam ceras para proteger os pelos e a pele e mantê-los flexíveis, lubrificados e impermeáveis. As aves, particularmente as aquáticas, secretam ceras por suas glândulas uropigiais para manter suas penas impermeáveis à água. As folhas lustrosas do azevinho, do rododendro, da hera venenosa e de muitas outras plantas tropicais são cobertas por uma camada grossa de ceras, que impede a evaporação excessiva de água e as protege contra parasitas. As ceras biológicas têm várias aplicações em indústrias como a farmacêutica, a cosmética, entre outras. A lanolina (da lã de cordeiro), a cera de abelha, a cera de carnaúba (palmeira brasileira) e a cera extraída do óleo do cachalote (espécie de baleia) são amplamente utilizadas na manufatura de loções, pomadas e polidores (NELSON; COX, 2014). 132 específicas mais baixas do que a água, o que explica por que as misturas de óleo e água (p. ex., tempero de salada com azeite e vinagre) têm duas fases: o óleo, com densidade específica mais baixa, flutua sobre a fase aquosa. os átomos de carbo FIGURA 29 – O GLICEROL E UM TRIACILGLICEROL 1 HO 3 CH2 CH2 2 CH OH OH Glicerol C CH2 3 CH2 O 2 CH O O 1 O C O O C 1-estearoil, 2-linoleoil, 3-palmitoil glicerol, um triacilglicerol misto FONTE:eNelson e Cox (2014, O p. triacilglicerol 360) FIGURA 103 O glicerol um triacilglicerol. misto mostrado aqui tem três ácidos graxos diferentes ligados à cadeia do glicerol. Quando o glicerol apresenta ácidos graxos diferentes em C-1 e C-3, o C-2 é um centro quiral (p. 17). 3 LIPÍDIOS ESTRUTURAIS DE MEMBRANA FIGURA 104 Depósito de tecido adiposo branc de gordura (branco) tão lho) contra a membrana cotilédone de uma sem escuras são corpos prote mento nos corpos oleos A característica central na arquitetura das membranas biológicas é uma dupla camada de lipídios que atua como barreira à passagem de moléculas polares e íons. Os lipídios de membrana são anfipáticos: uma extremidade da molécula é hidrofóbica e a outra é hidrofílica. Suas interações hidrofóbicas entre si e suas interações hidrofílicas Nelson_6ed_book.indb 360 com a água direcionam o seu empacotamento em camadas, chamadas de bicamadas de membrana. Existem cinco tipos gerais de lipídios de membrana: glicerofosfolipídios, nos quais as regiões hidrofóbicas são compostas por dois ácidos graxos ligados ao glicerol; galactolipídios e sulfolipídios, que também contêm dois ácidos graxos esterificados com o glicerol, mas não apresentam os fosfatos característicos dos fosfolipídios; lipídios tetraéter em arquea, nos quais duas cadeias muito longas de alquilas estão unidas por ligação éter ao glicerol em ambas as extremidades; esfingolipídios, nos quais um 133 único ácido graxo está ligado a uma amina graxa, a esfingosina; e esteróis, compostos caracterizados por um sistema rígido de quatro anéis hidrocarbonados fusionados (RODWELL; MURRAY; GRANNER, 2017). Os esfingolipídios diferem dos fosfolipídios, pois nos esfingolipídios em vez de ter o glicerol, eles são derivados de um amino álcool. Um dos esfingolipídios mais importantes é a Esfingomielina, popularmente chamada de bainha de mielina, que reveste o axônio dos neurônios. 4 LIPÍDIOS COMO SINAIS, COFATORES E PIGMENTOS As duas classes funcionais de lipídios consideradas até agora são importantes componentes celulares; os lipídios de membrana compõem de 5 a 10% da massa seca da maioria das células, e os lipídios de armazenamento, mais de 80% da massa de um adipócito. Com algumas exceções importantes, esses lipídios desempenham um papel passivo na célula; os combustíveis lipídicos formam barreiras impermeáveis em volta das células e dos compartimentos celulares (NELSON; COX, 2014). Outro grupo de lipídios, presente em quantidades bem menores, tem papéis ativos no tráfego metabólico como metabólitos e mensageiros. Alguns servem como sinalizadores potentes – como hormônios, carregados no sangue de um tecido a outro, ou como mensageiros intracelulares gerados em resposta a uma sinalização extracelular (hormônio ou fator de crescimento). Outros funcionam como cofatores enzimáticos em reações de transferência de elétrons nos cloroplastos e nas mitocôndrias, ou na transferência de porções de açúcar em várias reações de glicosilação (NELSON; COX, 2014). Um terceiro grupo consiste em lipídios com um sistema de ligações duplas conjugadas: moléculas de pigmento que absorvem a luz visível. Alguns deles atuam como pigmentos fotossensíveis na visão e na fotossíntese; outros produzem colorações naturais, como o alaranjado das abóboras e cenouras e o amarelo das penas dos canários. Finalmente, um grupo muito grande de lipídios voláteis produzidos nas plantas serve de sinalizador, que é transportado pelo ar, permitindo às plantas comunicarem-se umas com as outras, atraírem animais amigos e dissuadirem inimigos (NELSON; COX, 2014). As prostaglandinas (PG) contêm um anel de cinco carbonos que se origina da cadeia do ácido araquidônico. Seu nome deriva da glândula próstata, o tecido a partir do qual elas foram isoladas pela primeira vez por Bengt Samuelsson e Sune Bergström. As prostaglandinas apresentam diversas funções. Algumas estimulam a contração da musculatura lisa do útero durante a menstruação e o trabalho de parto. Outras afetam o fluxo sanguíneo a órgãos específicos, o ciclo sono-vigília e a sensibilidade de certos 134 tecidos a hormônios como a epinefrina e o glucagon. As prostaglandinas de um terceiro grupo elevam a temperatura corporal (produzindo a febre) e causam inflamação e dor (NELSON; COX, 2014). Os tromboxanos têm um anel de seis membros que contém éter. São produzidos pelas plaquetas (também chamadas de trombócitos) e atuam na formação dos coágulos e na redução do fluxo sanguíneo no local do coágulo. Os leucotrienos, encontrados pela primeira vez em leucócitos, contêm três ligações duplas conjugadas e são poderosos sinalizadores biológicos. Por exemplo, o leucotrieno D4, derivado do leucotrieno A4, induz a contração da musculatura lisa que envolve as vias aéreas até o pulmão. A produção excessiva de leucotrienos causa a crise de asma, e a síntese de leucotrienos é um dos alvos dos fármacos antiasmáticos, como a prednisona. A forte contração da musculatura lisa dos pulmões que ocorre durante o choque anafilático é parte da reação alérgica potencialmente fatal em indivíduos hipersensíveis a ferroadas de abelha, penicilina ou outros agentes (NELSON; COX, 2014). Os esteroides são derivados oxidados dos esteróis; eles têm o núcleo esterol, mas não a cadeia alquila ligada ao anel D do colesterol. Os hormônios esteroides circulam pela corrente sanguínea (em carreadores proteicos) do local onde foram produzidos até os tecidos-alvo, onde entram nas células, ligam-se a receptores proteicos altamente específicos no núcleo e causam mudanças na expressão gênica e, portanto, no metabolismo. Como os hormônios têm afinidade muito alta por seus receptores, concentrações muito baixas (nanomolar ou menos) são suficientes para produzir respostas nos tecidos-alvo. Os principais grupos de hormônios esteroides são os hormônios sexuais masculinos e femininos e os hormônios produzidos pelo córtex suprarrenal, cortisol e aldosterona. A prednisona e a prednisolona são fármacos esteroides com atividades anti-inflamatórias potentes, mediadas em parte pela inibição da liberação do araquidonato pela fosfolipase A2 e pela consequente inibição da síntese de leucotrienos, prostaglandinas e tromboxanos. Elas têm uma série de aplicações médicas, incluindo o tratamento de asma e de artrite reumatoide (RODWELL; MURRAY; GRANNER, 2017). 5 SEPARAÇÃO E ANÁLISE DE LIPÍDIOS Como os lipídios são insolúveis em água, sua extração e seu posterior fracionamento requerem o uso de solventes orgânicos e de algumas técnicas pouco utilizadas na purificação de moléculas hidrossolúveis, como as proteínas e os carboidratos. Em geral, misturas complexas de lipídios são separadas por diferenças na polaridade ou na solubilidade em solventes apolares. Os lipídios que contêm ácidos graxos ligados a éster ou amida podem ser hidrolisados pelo tratamento com ácido ou base ou com enzimas hidrolíticas específicas (fosfolipases, glicosidases) para liberar seus componentes para análise. Alguns métodos bastante utilizados nas análises de lipídios são mostrados a partir da seguinte figura: 135 adores, cofatores e A extração de lipídeos requer solventes orgânicos Os lipídeos neutros (triacilgliceróis, ceras, pigmentos, etc.) a presentes em quanti- são prontamente extraídos dos tecidos com éter etílico, clorofórmio ou benzeno, solventes que não permitem a sempenham papéis cruFIGURA 30 – PROCEDIMENTOS COMUNS NA EXTRAÇÃO, NA hidrofóbicas. SEPARAÇÃO E NA DE LIPÍagregação causada pelas interações OsIDENTIFICAÇÃO lipídores. DIOS CELULARES hidrolisado para proTecido Células lulares, o diacilglicerol (a) Homogeneizado em clorofórmio/metanol/água fosfatidilinositol-3,4,5eação para complexos volvidos na sinalização xanos e os leucotrienos araquidonato, são hor. omo os hormônios seis. Servem como podealterando a expressão Metanol + água Clorofórmio + lipídeos (b) Separa as principais classes primeiro ompostos lipossolúveis preno. Todos desempebolismo ou na fisiologia ursora de um hormônio cio. A vitamina A forneolho dos vertebrados e é ca durante o crescimenna E funciona na proteontra o dano oxidativo, processo de coagulação Cromatografia em camada delgada Cromatografia de adsorção, cromatografia gasosa, HPLC (c) Usa o método rápido Espectrometria direta do extrato total onas, também derivadas adores de elétrons nas respectivamente. s açúcares às membrasão então utilizados na xos, glicolipídeos e gli- s servem como pigmenàs penas das aves suas Espectrometria de massa com tipos, condições FONTE: Nelson e Cox (2014, p. 377) e modos de monitoramento diferentes turais amplamente usa- eos Misturas complexas de lipídiosLipidoma dos tecidos podem ser fracionadas por procedimentos cromatográficos com base nas diferentes polaridades de cada classe de FIGURA 1025 Procedimentos comuns na extração, na separação e na identificação lipídio (NELSON; COX, 2014).de lipídeos celulares. (a) O tecido é homogeneizado em m água, sua extração e rem o uso de solventes uco utilizadas na purificomo as proteínas e os mplexas de lipídeos são dade ou na solubilidade que contêm ácidos gram ser hidrolisados pelo om enzimas hidrolíticas ases) para liberar seus s métodos comumente ão mostrados na Figura 136 uma mistura de clorofórmio/metanol/água, que gera duas fases com a adição de água e a remoção dos sedimentos não extraíveis por centrifugação. (b) As principais classes dos lipídeos extraídos na fase clorofórmio podem ser primeiro separados por cromatografia de camada delgada (CCD), na qual os lipídeos são carregados para cima em uma placa de sílica coberta de gel por uma frente ascendente de solvente, com os lipídeos menos polares migrando mais do que os lipídeos mais polares ou carregados, ou por cromatografia de adsorção em uma coluna de sílica gel em que passam solventes de polaridade crescente. Por exemplo, cromatografia em coluna com solventes apropriados pode ser usada para separar espécies lipídicas intimamente relacionadas, tal como fosfatidilserina, fosfatidilglicerol, e fosfatidilinositol. Uma vez separados, os ácidos graxos complementares a cada lipídeo podem ser determinados por espectrometria de massa. (c) Alternativamente, no método rápido, um extrato de lipídeos não fracionado pode ser diretamente submetido à espectrometria de massa de alta resolução de diferentes tipos e sob condições distintas para determinar a composição total de todos os lipídeos: o lipidoma. NOTA Acúmulos anormais de lipídios de membrana: algumas doenças Os lipídios polares das membranas sofrem constante renovação metabólica (turnover), e a sua taxa de síntese normalmente é contrabalançada por sua taxa de degradação. A degradação dos lipídios é promovida por enzimas hidrolíticas nos lisossomos, sendo cada enzima capaz de hidrolisar uma ligação específica. Quando a degradação de esfingolipídios é prejudicada por um defeito em uma dessas enzimas, os produtos da degradação parcial se acumulam nos tecidos, causando doenças graves. Por exemplo, a doença de Niemann-Pick é causada por um defeito genético raro na enzima esfingomielinase, que cliva a fosfocolina da esfingomielina. A Esfingomielina se acumula no encéfalo, no baço e no fígado. A doença se torna evidente em bebês e causa deficiência intelectual e morte prematura. Mais comum é a doença de Tay-Sachs, na qual o gangliosídeo GM2 se acumula no encéfalo e no baço devido à falta da enzima hexosaminidase A. Os sintomas da doença de Tay-Sachs são retardo progressivo no desenvolvimento, paralisia, cegueira e morte até os 3 ou 4 anos de idade. O aconselhamento genético pode prever e evitar muitas doenças hereditárias. Os testes nos futuros pais podem detectar enzimas anormais, então testes de DNA podem determinar a natureza exata do defeito e o risco que ele representa para os descendentes. Uma vez que ocorra a gravidez, as células fetais obtidas por amostra de parte da placenta (da vilosidade coriônica) ou do líquido amniótico (amniocentese) podem ser testadas. FONTE: Nelson e Cox (2014, p. 369) 137 RESUMO DO TÓPICO 7 Neste tópico, você adquiriu certos aprendizados, como: • Os lipídios são componentes celulares insolúveis em água, de estruturas diversas, que podem ser extraídos dos tecidos por solventes apolares. • Quase todos os ácidos graxos, os componentes hidrocarbonados de muitos lipídios, têm um número par de átomos de carbono (geralmente 12 a 24); eles são saturados ou insaturados, com ligações duplas quase sempre na configuração cis. • Os triacilgliceróis contêm três moléculas de ácidos graxos esterificadas aos três grupos hidroxila do glicerol. • Os triacilgliceróis simples contêm somente um tipo de ácido graxo; os mistos contêm dois ou três tipos. Eles são principalmente gorduras de reserva, estando presentes em muitos alimentos. • A hidrogenação parcial de óleos vegetais na indústria alimentícia converte algumas ligações duplas cis para a configuração trans. Ácidos graxos trans na dieta são um importante fator de risco para doenças cardíacas coronarianas. • Os lipídios polares, com grupos polares e caudas apolares, são importantes componentes das membranas. Os mais abundantes são os glicerofosfolipídios, que contêm ácidos graxos esterificados a dois dos grupos hidroxila do glicerol e um segundo álcool, o grupo cabeça, esterificado à terceira hidroxila do glicerol via uma ligação fosfodiéster. Outros lipídios polares são os esteróis. • Alguns tipos de lipídios, embora presentes em quantidades relativamente baixas, desempenham papéis cruciais como cofatores ou sinalizadores. • As prostaglandinas, os tromboxanos e os leucotrienos (os eicosanoides), derivados do araquidonato, são hormônios extremamente potentes. • Os hormônios esteroides, tal como os hormônios sexuais, são derivados dos esteróis. Servem como poderosos sinalizadores biológicos, alterando a expressão gênica nas células-alvos. 138 AUTOATIVIDADE 1 Os lipídios possuem alta solubilidade em solventes orgânicos e baixa solubilidade em água (Hidrofóbicas). Estão distribuídos em todos os tecidos, principalmente nas membranas celulares e nas células de gordura, possuindo uma classificação muito ampla. A coluna I, a seguir, apresenta quatro grupos de lipídios, e a coluna II, alguns exemplos desses lipídios. Associe adequadamente a segunda coluna com a primeira. COLUNA I 1- Lipoproteína 2- Glicerídeos 3- Esfingolipídio 4- Esteroides COLUNA II ( ) Glicerol ( ) Bainha de Mielina ( ) Colesterol ( ) Testosterona ( ) Aldosterona ( )HDL ( ) LDL A sequência correta de preenchimento dos parênteses, de cima para baixo, é: a) ( ) 2 – 3 – 1 – 4 – 4 – 2 – 1. b) ( ) 2 – 3 – 4 – 4 – 4 – 1 – 1. c) ( ) 3 – 1 – 3 – 4 – 2 – 1 – 4. d) ( ) 2 – 3 – 4 – 1 – 3 – 1 – 2. e) ( ) 1 – 2 – 2 – 3 – 1 – 3 – 4. 2 A adrenoleucodistrofia, também conhecida pelo acrônimo ALD, é uma doença genética rara, incluída no grupo das leucodistrofias, e que tem duas formas, sendo a mais comum a forma ligada ao cromossomo X, uma herança ligada ao sexo de caráter recessivo transmitida por mulheres portadoras e que afeta fundamentalmente homens. O causador é um gene mutante localizado no cromossomo X. Afeta as células brancas do cérebro, bem como o sistema nervoso, além de alterar o metabolismo dos peroxissomos, codificando a síntese da proteína ALDO, relacionada ao metabolismo lipídico. O filme O óleo de Lourenço fala sobre essa patologia genética. Essa patologia acaba trazendo danos às células nervosas – neurônios, em que um importante componente lipídico é degenerado. O componente lipídico é ___________________ e está presente no __________________ de neurônios. A alternativa que completa a sentença é, respectivamente: a) ( ) Fosfolipídio, Corpo celular de neurônio. b) ( ) Esfingomielina, Dendritos. c) ( ) Cerídeos, Axônio. d) ( ) Esteroides, Terminal Axônico. e) ( ) Esfingomielina, Axônio. 139 140 UNIDADE 3 — METABOLISMO OBJETIVOS DE APRENDIZAGEM A partir do estudo desta unidade, você deverá ser capaz de: • relatar a primeira e a segunda lei da termodinâmica e compreender como elas se aplicam aos sistemas biológicos; • explicar o que significam os termos energia livre, entropia, entalpia, exergônica e endergônica; • observar como as reações endergônicas podem ser favorecidas por meio do acoplamento às reações que são exergônicas nos sistemas biológicos; • compreender o papel dos fosfatos de alta energia, do ATP e de outros nucleotídeos trifosfato na transferência de energia livre dos processos exergônicos para os endergônicos, possibilitando que atuem como a “moeda” energética nas células; • explicar os conceitos das vias metabólicas anabólicas, catabólicas e anfibólicas. • descrever, em linhas gerais, o metabolismo de carboidratos, lipídios e aminoácidos no nível dos tecidos e órgãos e no nível subcelular e a conversão dos combustíveis metabólicos; • caracterizar o modo como é regulado o fluxo de metabólitos através de vias metabólicas; • elucidar como uma provisão de combustíveis metabólicos é fornecida tanto no estado alimentado quanto no jejum, assim como a formação de reservas de combustíveis metabólicos no estado alimentado e a sua mobilização durante o jejum. PLANO DE ESTUDOS Esta unidade está dividida em cinco tópicos. No decorrer dela, você encontrará autoatividades com o objetivo de reforçar o conteúdo apresentado. TÓPICO 1 – PRINCÍPIOS DA BIOENERGÉTICA TÓPICO 2 – CICLO DO ÁCIDO CÍTRICO TÓPICO 3 – METABOLISMO DE ÁCIDOS GRAXOS E TRIGLICERÍDEOS TÓPICO 4 – METABOLISMO DE AMINOÁCIDOS TÓPICO 5 – METABOLISMO DE NUCLEOTÍDEOS CHAMADA Preparado para ampliar seus conhecimentos? Respire e vamos em frente! Procure um ambiente que facilite a concentração, assim absorverá melhor as informações. 141 CONFIRA A TRILHA DA UNIDADE 3! Acesse o QR Code abaixo: 142 UNIDADE 3 TÓPICO 1 — PRINCÍPIOS DA BIOENERGÉTICA 1 INTRODUÇÃO O metabolismo é uma atividade celular altamente coordenada, em que muitos sistemas multienzimáticos (vias metabólicas) cooperam para: (1) obter energia química capturando energia solar ou degradando nutrientes energeticamente ricos obtidos do meio ambiente; (2) converter as moléculas dos nutrientes em moléculas com características próprias de cada célula, incluindo precursores de macromoléculas; (3) polimerizar precursores monoméricos em macromoléculas (proteínas, ácidos nucleicos e polissacarídeos); e (4) sintetizar e degradar as biomoléculas necessárias para as funções celulares especializadas, como lipídios de membrana, mensageiros intracelulares e pigmentos. Embora o metabolismo englobe centenas de diferentes reações catalisadas por enzimas, o grande objetivo dessa unidade é o estudo das principais vias metabólicas, poucas em número e notavelmente semelhantes em todas as formas de vida (NELSON; COX, 2014). Os organismos vivos podem ser divididos em dois grandes grupos de acordo com a forma química pela qual obtêm carbono do meio ambiente. Os autotróficos (como bactérias fotossintéticas, algas verdes e plantas vasculares) podem usar o dióxido de carbono da atmosfera como sua única fonte de carbono, a partir do qual formam todas as suas biomoléculas constituídas de carbono. Alguns organismos autotróficos, como as cianobactérias, também podem utilizar nitrogênio atmosférico para gerar todos os seus componentes nitrogenados. Os heterotróficos não conseguem utilizar o dióxido de carbono atmosférico e devem obter carbono a partir do ambiente na forma de moléculas orgânicas relativamente complexas, como a glicose. Os animais multicelulares e a maioria dos microrganismos são heterotróficos. As células e os organismos autotróficos são relativamente autossuficientes, enquanto as células e os organismos heterotróficos, por necessitarem de carbono em formas mais complexas, dependem de produtos de outros organismos (RODWEL; MURRAY; GRANNER, 2017). 143 2 SERES AUTOTRÓFICOS, HETEROTRÓFICOS E VIAS METABÓLICAS Segundo Berg (2014), muitos organismos autotróficos são fotossintéticos e obtêm sua energia da luz solar, enquanto organismos heterotróficos obtêm sua energia a partir da degradação de nutrientes orgânicos produzidos por autotróficos. Em nossa biosfera, os autotróficos e heterotróficos vivem juntos em um ciclo vasto e interdependente onde os organismos autotróficos usam o dióxido de carbono atmosférico para construir suas biomoléculas orgânicas, alguns deles gerando oxigênio a partir da água durante o processo. Os organismos heterotróficos, por sua vez, utilizam os produtos orgânicos dos autotróficos como nutrientes e devolvem dióxido de carbono para a atmosfera. Algumas das reações de oxidação que produzem dióxido de carbono também consomem oxigênio, convertendo-o em água. Assim, carbono, oxigênio e água são constantemente reciclados entre os mundos heterotrófico e autotrófico, com a energia solar como a força que impulsiona esse processo global. FIGURA 1 – CICLO DO DIÓXIDO DE CARBONO E DO OXIGÊNIO ENTRE O DOMÍNIO AUTOTRÓFICO (FOTOSSINTÉTICO) E O HETEROTRÓFICO NA BIOSFERA FONTE: Nelson e Cox (2014, p. 502) Todos os organismos vivos também exigem uma fonte de nitrogênio, necessária para a síntese de aminoácidos, nucleotídeos e outros componentes. As bactérias e as plantas, geralmente, podem usar amônia ou nitrato como única fonte de nitrogênio, mas os vertebrados devem obter nitrogênio na forma de aminoácidos ou de outros compostos orgânicos. Somente alguns organismos – as cianobactérias e muitas espécies de bactérias do solo, que vivem simbioticamente sobre as raízes de algumas plantas – são capazes de converter (“fixar”) nitrogênio atmosférico (N2) em amônia. Outras bactérias (as bactérias nitrificantes) oxidam amônia em nitritos e nitratos; e outras, ainda, convertem nitrato a N2. As bactérias anamox convertem amônia e nitrito em N2. Portanto, além dos ciclos globais de carbono e oxigênio, um ciclo de nitrogênio opera 144 na biosfera, movimentando enormes quantidades de nitrogênio (Figura 2). A reciclagem de carbono, oxigênio e nitrogênio que, em última análise, envolve todas as espécies, depende do equilíbrio adequado entre as atividades dos produtores (autotróficos) e consumidores (heterotróficos) em nossa biosfera (NELSON; COX, 2014). FIGURA 2 – CICLO DO NITROGÊNIO NA BIOSFERA FONTE: Nelson e Cox (2014, p. 502) Esses ciclos de matéria são impulsionados por um enorme fluxo de energia na biosfera, iniciando com a captura da energia solar pelos organismos fotossintéticos e a utilização dessa energia para gerar carboidratos ricos em energia e outros nutrientes orgânicos; esses nutrientes são, então, usados como fontes de energia por organismos heterotróficos. Nos processos metabólicos, e em todas as transformações energéticas, existe uma perda de energia útil (energia livre) e um aumento inevitável na quantidade de energia não utilizável (calor e entropia). Ao contrário da reciclagem de matéria, portanto, a energia flui em uma direção através da biosfera; os organismos não conseguem reciclar energia útil a partir da energia dissipada na forma de calor e entropia. Carbono, oxigênio e nitrogênio são reciclados continuamente, mas energia é constantemente transformada em formas não utilizáveis, como o calor (RODWEL; MURRAY; GRANNER, 2017). O metabolismo, a soma de todas as transformações químicas que ocorrem em uma célula ou em um organismo, ocorre por meio de uma série de reações catalisadas por enzimas que constituem as vias metabólicas. Cada uma das etapas consecutivas em uma via metabólica produz uma pequena alteração química específica, em geral a remoção, a transferência ou a adição de um átomo particular ou um grupo funcional. O precursor é convertido em um produto por meio de uma série de intermediários metabólicos chamados de metabólitos. O termo metabolismo intermediário frequentemente é aplicado às atividades combinadas de todas as vias metabólicas que interconvertem precursores, metabólitos e produtos de baixo peso molecular. 145 NOTA Curiosidade: Todo mundo vive falando nesse tal de metabolismo. Mas, o que precisamos realmente saber sobre ele? Muitas pessoas acreditam que ele pode ser tratado como um músculo ou órgão, que você pode flexionar ou controlar de alguma forma. Mas, na realidade, o seu metabolismo está relacionado com uma série de processos químicos que ocorre em cada célula, que basicamente transforma as calorias que você consome em combustível para o corpo. Para Nelson e Cox (2014, p. 502): O catabolismo é a fase de degradação do metabolismo, na qual moléculas, nutrientes orgânicos (carboidratos, gorduras e proteínas) são convertidas em produtos finais menores e mais simples (como ácido láctico, CO2 e NH3). As vias catabólicas liberam energia, e parte dessa energia é conservada na forma de ATP (adenosina trifosfato) e de transportadores de elétrons reduzidos (NADH – Dinucleótido de nicotinamida e adenina; NADPH – Nicotinamida adenina dinucleótido fosfato e FADH2-Dinucleótido de flavina e adenina; o restante é perdido como calor. No anabolismo, também chamado de biossíntese, precursores pequenos e simples formam moléculas maiores e mais complexas, incluindo lipídios, polissacarídeos, proteínas e ácidos nucleicos. As reações anabólicas necessitam de fornecimento de energia, geralmente na forma de potencial de transferência do grupo fosforil do ATP e do poder redutor de NADH, NADPH e FADH2. Algumas vias metabólicas são lineares e algumas são ramificadas, gerando múltiplos produtos úteis a partir de um único precursor ou convertendo vários precursores em um único produto. Em geral, as vias catabólicas são convergentes e as vias anabólicas são divergentes (Figura 3). Algumas vias são cíclicas: um composto inicial da via é regenerado em uma série de reações que converte outro componente inicial em um produto. A maioria das células tem as enzimas para realizar tanto a degradação quanto a síntese das categorias importantes de biomoléculas – ácidos graxos, por exemplo. No entanto, a síntese e a degradação simultâneas de ácidos graxos seriam inúteis, e isso é evitado pela regulação recíproca das sequências de reações anabólicas e catabólicas: quando uma sequência está ativa, a outra está suprimida. Tal regulação não poderia ocorrer se as vias anabólicas e catabólicas fossem catalisadas por exatamente o mesmo grupo de enzimas, operando em um sentido para o anabolismo, e no sentido oposto para o catabolismo: a inibição de uma enzima envolvida no catabolismo também inibiria a sequência de reações no sentido do anabolismo. As vias catabólicas e anabólicas que conectam os mesmos produtos finais, como por exemplo a transformação da glicose em piruvato e vice-versa, podem empregar muitas das mesmas enzimas, mas 146 invariavelmente pelo menos uma das etapas é catalisada por enzimas diferentes nos sentidos catabólico e anabólico, e essas enzimas constituem pontos de regulação independentes. Além disso, a fim de que as vias anabólicas e catabólicas sejam essencialmente irreversíveis, pelo menos uma das reações específicas de cada sentido deve ser termodinamicamente muito favorável – em outras palavras, uma reação cuja reação inversa é muito desfavorável. Como contribuição adicional à regulação independente das sequências de reações anabólicas e catabólicas, elas geralmente ocorrem em compartimentos celulares distintos: por exemplo, o catabolismo de ácidos graxos na mitocôndria, e a síntese dos ácidos graxos no citosol. Como as vias metabólicas são cineticamente controladas pela concentração do substrato, conjuntos separados de intermediários anabólicos e catabólicos também contribuem para o controle das taxas metabólicas. Esses recursos que separam os processos anabólicos e catabólicos serão de interesse particular em nossa discussão sobre o metabolismo (NELSON; COX; 2014, p. 503). 504 D AV I D L . N E L S O N & M I C H A E L M . COX FIGURA 3 – TRÊS TIPOS DE VIAS METABÓLICAS NÃO LINEARES Borracha Fosfolipídeos Triacilgliceróis Isopentenil-pirofosfato Glicogênio Sacarose Alanina Glicose Serina Hormônios esteroides Colesterol Ácidos biliares Ácidos graxos Mevalonato Amido Pigmentos carotenoides Ésteres de colesteril Vitamina K Fenilalanina Acetato (acetil-CoA) Piruvato Eicosanoides Acetoacetil-CoA Leucina Ácidos graxos Isoleucina Triacilgliceróis (a) Catabolismo convergente Diacilglicerol-CDP Citrato Oxaloacetato CO2 CO2 (c) Via cíclica Fosfolipídeos (b) Anabolismo divergente FIGURA 4 Três tipos de vias metabólicas não lineares. (a) Convergente, catabólica, (b) divergente, anabólica, e (c) cíclica. Em (c), um dos compostos de partida (no caso, o oxaloacetato) é regenerado e reingressa na via. O acetato, um intermediário metabólico chave, é o produto da degradação de uma variedade de combustíveis (a), serve de precursor de um grande número de produtos (b) e é consumido na via catabólica conhecida como o ciclo do ácido cítrico (c). FONTE: Nelson e Cox (2014, p. 504) membrana, produzido tanto por oxidação de substratos páginas ocorre e tem funções fundamentais em organiscomo por absorção de luz, promove a síntese de ATP. mos vivos. A cada reação e a cada via que você encontrar, Os Capítulos 20 a 22 descrevem as principais vias ana- questione: o que essa transformação química faz pelo orbólicas pelas as células utilizam a energia do ATP para em ganismo? Como essa viadentro se conecta com asdas outras vias que Asquais vias metabólicas são reguladas vários níveis, e fora células. produzir carboidratos, lipídeos, aminoácidos e nucleotídeos operam simultaneamente na mesma célula para produzir a a partir de precursores simples. OéCapítulo 23 volta a energia produtos necessários para a manutenção eo A regulação maismais imediata a disponibilidade dee os substrato, a velocidade de reação abordar o estudo das vias metabólicas – como elas ocorrem crescimento da célula? Como os diferentes níveis dos medepende muito da concentração do substrato. Um segundo tipo de controle rápido em todos os organismos, de Escherichia coli a humanos canismos de regulação cooperam para o balanço metabólico – e considera elasésão e integradas por me-pore um o fornecimento e consumo de energia, alcançando o esdentro da como célula a reguladas regulação alostérica intermediário metabólico ou por uma canismos hormonais nos mamíferos. tado de equilíbrio dinâmico da vida? Estudando com essa coenzima – um aminoácido ou ATP, exemplo – queo metabolismo sinaliza o proporciona estado metabólico no No momento em que o foco de estudo será o por metaboperspectiva, dados fascinantes lismo intermediário, uma observação final. Não esqueça de e reveladores sobre a vida, com aplicações incontáveis na interior da célula. Quando a célula contém uma quantidade de aspartato, por exemplo, que uma grande quantidade das reações descritas nestas medicina, agricultura e biotecnologia. suficiente para suas necessidades imediatas, ou quando os níveis celulares de ATP indicam não ser necessário o consumo adicional de combustível no momento, esses sinais inibem alostericamente a atividade de uma ou mais enzimas nas vias pertinentes. Em organismos multicelulares, as atividades metabólicas de tecidos diferentes são 147 reguladas e integradas por fatores de crescimento e hormônios que atuam de fora da célula. Em alguns casos, essa regulação ocorre quase que instantaneamente (algumas vezes em menos de um milissegundo) por alterações nos níveis dos mensageiros intracelulares que, por sua vez, modificam a atividade de enzimas intracelulares por mecanismos alostéricos ou por modificações covalentes, como a fosforilação. Em outros casos, o sinal extracelular modifica a concentração celular de uma enzima alterando a velocidade de sua síntese ou degradação, de tal forma que o efeito é visto apenas em minutos ou horas (RODWEL; MURRAY; GRANNER, 2017). 3 GLICÓLISE E VIA PENTOSE-FOSFATO A glicose ocupa posição central no metabolismo de plantas, animais e muitos microrganismos. Ela é relativamente rica em energia potencial e, por isso, é um bom combustível. Por meio do armazenamento da glicose na forma de polímero de alta massa molecular, como o amido e o glicogênio, a célula pode estocar grandes quantidades de unidades de hexose, enquanto mantém a osmolaridade citosólica relativamente baixa. Quando a demanda de energia aumenta, a glicose pode ser liberada desses polímeros de armazenamento intracelulares e utilizada para produzir ATP de maneira aeróbia ou anaeróbia (NELSON; COX, 2014). Para Nelson e Cox (2014), a glicose, além de excelente combustível, também é um precursor admiravelmente versátil, capaz de suprir uma enorme variedade de intermediários metabólicos em reações biossintéticas. Uma bactéria como a Escherichia coli pode obter, a partir da glicose, os esqueletos carbônicos para cada aminoácido, nucleotídeo, coenzima, ácido graxo ou outro intermediário metabólico necessário para o seu crescimento. Um estudo abrangente dos destinos metabólicos da glicose compreenderia centenas ou milhares de transformações químicas. Em animais e em vegetais vasculares, a glicose tem quatro destinos principais: ela pode ser usada na síntese de polissacarídeos complexos direcionados ao espaço extracelular; ser armazenada nas células (como polissacarídeo ou como sacarose); ser oxidada a compostos de três átomos de carbonos (piruvato) por meio da glicólise, para fornecer ATP e intermediários metabólicos; ou ser oxidada pela via das pentoses-fosfato (fosfogliconato) produzindo ribose-5-fosfato para a síntese de ácidos nucleicos e NADPH para processos biossintéticos redutores. 148 FIGURA 4 – AS PRINCIPAIS VIAS DE UTILIZAÇÃO DA GLICOSE FONTE: Rodwel, Murray e Granner (2017, p. 389) Os organismos sem acesso à glicose de outras fontes devem sintetizá-la. Os organismos fotossintéticos sintetizam glicose inicialmente por redução do CO2 atmosférico a trioses e, em seguida, por conversão das trioses em glicose. As células não fotossintéticas produzem glicose a partir de precursores simples com três ou quatro átomos de carbono pelo processo de gliconeogênese, que reverte a glicólise em uma via que utiliza muitas enzimas glicolíticas. Iremos descrever as reações individuais da glicólise, da gliconeogênese e da via das pentoses-fosfato e o significado funcional de cada via, bem como os destinos metabólicos do piruvato produzido na glicólise. Na glicólise (do grego glykys, “doce” ou “açúcar”, e lysis, “quebra”), uma molécula de glicose é degradada em uma série de reações catalisadas por enzimas, gerando duas moléculas do composto de três átomos de carbono, o piruvato. Durante as reações sequenciais da glicólise, parte da energia livre da glicose é conservada na forma de ATP e NADH. A glicólise foi a primeira via metabólica a ser elucidada e é provável que seja a mais bem entendida. Desde a descoberta da fermentação, em 1897, por Eduard Buchner, em extratos de células de levedura até a elucidação da via completa em leveduras (por Otto Warburg e Hans von Euler-Chelpin) e em músculo (por Gustav Embden e Otto Meyerhof) na década de 1930, as reações da glicólise em extratos de leveduras e de músculo foram o objetivo principal da pesquisa bioquímica (BERG, 2014). O desenvolvimento de métodos de purificação de enzimas, a descoberta e o reconhecimento da importância de coenzimas, como o NAD, e a descoberta do crucial papel metabólico do ATP e de outros compostos fosforilados resultaram dos estudos da glicólise. Enzimas glicolíticas de muitas espécies foram purificadas e minuciosamente estudadas. 149 A glicólise é uma via central quase universal do catabolismo da glicose, a via com o maior fluxo de carbono na maioria das células. A quebra glicolítica da glicose á a única fonte de energia metabólica em alguns tecidos e células de mamíferos (p. ex., eritrócitos, medula renal, cérebro e esperma). Alguns tecidos vegetais modificados para o armazenamento de amido (como os tubérculos da batata) e algumas plantas aquáticas (p. ex., agrião) derivam a maior parte de sua energia da glicólise; muitos microrganismos anaeróbios são totalmente dependentes da glicólise. Quando ocorre a degradação anaeróbia da glicose, utilizamos o termo Fermentação. Como os organismos vivos surgiram inicialmente em uma atmosfera sem oxigênio, a quebra anaeróbia da glicose provavelmente seja o mais antigo mecanismo biológico de obtenção de energia a partir de moléculas orgânicas combustíveis. O sequenciamento do genoma de vários organismos revelou que algumas arquibactérias e alguns microrganismos parasitas são deficientes em uma ou mais enzimas da glicólise, mas possuem as enzimas essenciais da via; provavelmente realizam formas variantes de glicólise. No curso da evolução, a sequência dessas reações químicas foi completamente conservada; as enzimas glicolíticas dos vertebrados são estreitamente similares, na sequência de aminoácidos e na estrutura tridimensional, às suas homólogas em levedura e no espinafre. A glicólise difere entre as espécies apenas nos detalhes de sua regulação e no destino metabólico subsequente do piruvato formado. Os princípios termodinâmicos e os tipos de mecanismos regulatórios que governam a glicólise são comuns a todas as vias do metabolismo celular. A via glicolítica de importância central por si só, também pode servir de modelo para muitos aspectos das vias discutidas ao longo desta unidade (NELSON; COX, 2014, p. 544). A quebra da glicose, formada por seis átomos de carbono, em duas moléculas de piruvato, cada uma com três carbonos, ocorre em dez etapas, sendo que as cinco primeiras constituem a fase preparatória (nessas reações a glicose é inicialmente fosforilada no grupo hidroxil ligado ao C-6 (etapa 1). A D-glicose-6-fosfato assim formada e convertida a D-frutose-6-fosfato (etapa 2), a qual é novamente fosforilada, desta vez em C-1, para formar D-frutose-1,6-bifosfato (etapa 3). Nas duas reações de fosforilação, o ATP e o doador de grupos fosforil. Como todos os açúcares formados na glicólise são isômeros D, omite-se a designação D, exceto quando o objetivo e enfatizar sua estereoquímica (NELSON; COX, 2014). NOTA Em bioquímica, fosforilação é a adição de um grupo fosfato (PO4) a uma proteína ou outra molécula. A fosforilação é um dos principais participantes nos mecanismos de regulação das proteínas. É importante nos mecanismos de reações da qual participa o trifosfato de adenosina (ATP), que funciona como uma "moeda de energia" nas células dos organismos vivos. 150 A frutose-1,6-bifosfato é dividida em duas moléculas de três carbonos, a dihidroxiacetona-fosfato e o gliceraldeido-3-fosfato (etapa 4); essa é a etapa de “lise” que dá nome à via. A di-hidroxiacetona-fosfato é isomerizada a uma segunda molécula de gliceraldeido-3-fosfato (etapa 5), finalizando a primeira fase da glicólise. Note que duas moléculas de ATP são consumidas antes da clivagem da glicose em duas partes de três carbonos; haverá depois um bom retorno para esse investimento (NELSON; COX, 2014). IMPORTANTE Em síntese, na fase preparatória da glicólise, a energia do ATP é consumida, aumentando o conteúdo de energia livre dos intermediários, e as cadeias de carbono de todas as hexoses metabolizadas são convertidas a um produto comum, o gliceraldeido-3-fosfato. Os ganhos de energia provêm da fase de pagamento da glicólise (Figura 5). Cada molécula de gliceradeido-3- -fosfato é oxidada e fosforilada por fosfato inorgânico (não por ATP) para formar 1,3-bifosfoglicerato (etapa 6). Ocorre liberação de energia quando as duas moléculas de 1,3-bifosfoglicerato são convertidas a duas moléculas de piruvato (etapas 7 a 10). Grande parte dessa energia é conservada pela fosforilação acoplada de quatro moléculas de ADP a ATP. O rendimento líquido são duas moléculas de ATP por molécula de glicose utilizada, já que duas moléculas de ATP foram consumidas na fase preparatória. A energia também é conservada na fase de pagamento com a formação de duas moléculas do transportador de elétrons NADH por moléculas de glicose (NELSON; COX, 2014). 151 FIGURA 5 – FASE DE PAGAMENTO DA GLICÓLISE FONTE: Nelson e Cox (2014, p. 545) Nas reações seguintes da glicólise, três tipos de transformações químicas são particularmente notáveis: (1) a degradação do esqueleto carbônico da glicose para produzir piruvato; (2) a fosforilação de ADP a ATP pelos compostos com alto potencial de transferência de grupos fosforil, formados durante a glicólise; e (3) a transferência de um íon hidreto para o NAD1, formando NADH. 3.1 A FASE PREPARATÓRIA DA GLICÓLISE REQUER ATP Na fase preparatória da glicólise, duas moléculas de ATP são consumidas e a cadeia carbônica da hexose é clivada em duas trioses-fosfato. A compreensão de que as hexoses fosforiladas são intermediárias na glicólise foi conseguida lentamente e por um feliz acaso. Em 1906, Arthur Harden e William Young testaram suas hipóteses de que inibidores de enzimas proteolíticas estabilizariam as enzimas da fermentação da glicose em extratos de leveduras. Adicionaram soro sanguíneo (conhecido por conter inibidores de enzimas proteolíticas) a extratos de levedura e observaram o estímulo predito do metabolismo da glicose. No entanto, em um experimento de controle realizado com a intenção de demonstrar que ferver o soro destrói a atividade estimulante, eles descobriram que o soro fervido foi tão efetivo em estimular a glicólise quanto o soro não fervido. Exames cuidadosos e testes do conteúdo do soro fervido revelaram que o fosfato inorgânico foi o responsável pela estimulação. Harden e Young logo perceberam 152 que a glicose adicionada ao seu extrato de levedura era convertida a hexose-bifosfato. Esse foi o início de uma longa série de investigações sobre o papel dos ésteres orgânicos e anidridos de fosfato em bioquímica, que levaram ao nosso entendimento atual do papel central da transferência de grupos fosforil em biologia (NELSON; COX, 2014). A fosforilação da glicose é catalisada pela hexocinase. Cinases são enzimas que catalisam a transferência do grupo fosforil terminal do ATP a um aceptor nucleofílico. As cinases são uma subclasse das transferases. Ela geralmente, como muitas outras cinases, requer Mg21 para sua atividade, já que o verdadeiro substrato da enzima não é ATP4-, mas sim o complexo MgATP22. A hexocinase está presente em praticamente todos os organismos. O genoma humano codifica quatro hexocinases diferentes (I a IV), e todas catalisam a mesma reação (RODWEL; MURRAY; GRANNER, 2017). 3.2 A FASE DE PAGAMENTO DA GLICÓLISE PRODUZ ATP E NADH A fase de pagamento da glicólise (Figura 5) inclui as etapas de fosforilação que conservam energia, nas quais parte da energia química da molécula da glicose é conservada na forma de ATP e NADH. Lembre-se de que uma molécula de glicose rende duas moléculas de gliceraldeido-3-fosfato, e as duas metades da molécula de glicose seguem a mesma via na segunda fase da glicólise. A conversão das duas moléculas de gliceraldeido-3-fosfato a duas moléculas de piruvato é acompanhada pela formação de quatro moléculas de ATP a partir de ADP. No entanto, o rendimento líquido de ATP por molécula de glicose consumida é de apenas dois, já que dois ATP foram consumidos na fase preparatória da glicólise para fosforilar as duas extremidades da molécula da hexose (BERG; TYMOCZKO; STRYERT, 2015). 4 A CAPTAÇÃO DA GLICOSE É DEFICIENTE NO DIABETES MELITO TIPO 1 O metabolismo de glicose em mamíferos é limitado pela taxa de captação da glicose pelas células e sua fosforilação pela hexocinase. A captação da glicose do sangue é mediada pela família GLUT de transportadores de glicose. Nelson e Cox (2014, p. 558) relatam que: 153 Os transportadores nos hepatócitos (GLUT1, GLUT2) e nos neurônios cerebrais (GLUT3) estão sempre presentes nas membranas plasmáticas. Por outro lado, o principal transportador de glicose nas células do músculo esquelético, músculo cardíaco e tecido adiposo (GLUT4) está armazenado em pequenas vesículas intracelulares e se desloca para a membrana plasmática apenas em resposta a um sinal de insulina. Portanto, em músculo esquelético, coração e tecido adiposo, a captação e o metabolismo da glicose dependem da liberação normal de insulina pelas células b pancreáticas em resposta à quantidade elevada de glicose no sangue. Os indivíduos com diabetes melito tipo 1 (também chamado de diabetes dependente de insulina) têm pouquíssimas células b e são incapazes de liberar insulina suficiente para desencadear a captação de glicose pelas células do músculo esquelético, do coração ou do tecido adiposo. Assim, após uma refeição contendo carboidratos, a glicose se acumula a níveis anormalmente altos no sangue, condição conhecida como hiperglicemia. Incapazes de captar glicose, o músculo e o tecido adiposo utilizam os ácidos graxos armazenados nos triacilgliceróis como seu principal combustível. No fígado, a acetil-CoA, derivada da degradação desses ácidos graxos, é convertida a “corpos cetônicos” – acetoacetato e b-hidroxibutirato – que são exportados e levados a outros tecidos para serem utilizados como combustível. Esses compostos são especialmente críticos para o cérebro, que utiliza os corpos cetônicos como combustível alternativo quando a glicose está indisponível (RODWEL; MURRAY; GRANNER, 2017). Em pacientes com diabetes tipo 1 não tratados, a superprodução de acetoacetato e b-hidroxibutirato leva a seu acúmulo no sangue e a consequente redução do pH sanguíneo leva à cetoacidose, uma condição potencialmente letal. NOTA Você sabia? Os ácidos graxos não conseguem atravessar a barreira hematoencefálica e, por isso, não servem de combustível para os neurônios do encéfalo. 154 P R I NDOS C Í P ICARBOIDRATOS O S D E B I O Q U Í MEI CDAS A DGORDURAS E LEHNINGER FIGURA 6 – EFEITO DO DIABETES TIPO 1 SOBRE O METABOLISMO EM UM ADIPÓCITO ➊ ➍ Pâncreas secreta insulina Principal defeito no diabetes Glicose entra por meio de GLUT4 Membrana plasmática GLUT4 IRS ➋ Receptor de insulina ativado PI-3K Glicose ➎ 5 PKB Hexocinase fosforila a glicose Vesículas contendo ➌ GLUT4 fundem-se com a membrana plasmática Glicose-6-fosfato Via das pentoses-fosfato ➏ Glicólise Gota de gordura Ribulose-5-fosfato ➓ Cetoacidose acetoacetato, b-hidroxibutirato 2 ATP ,30 ATP Piruvato ➐ Oxidação do piruvato pelo ciclo do ácido cítrico CO2 Fosforilação oxidativa na mitocôndria ➑ Ácido graxo Triacilglicerol ➒ A mobilização de triacilglicerol fornece ácidos graxos como combustível alternativo A transferência de elétrons CO2 nas mitocôndrias direciona a síntese de ATP privadas de glicose, enquanto ela está elevada na corrente sanguí FIGURA 1410 Efeito do diabetes tipo 1 sobreFONTE: o metabolismo Nelson e Coxsão (2014, p. 559) Sem glicose para o suprimento de energia, os adipócitos degradam triac dos carboidratos e das gorduras em um adipócito. Normalceróis estocados em gotas de gordura e fornecem os ácidos graxos resul mente, a insulina desencadeia a inserção de transportadores GLUT4 na tes para outros tecidos para a produção mitocondrial de ATP. Dois subpro membrana plasmática pela fusão de vesículas contendo GLUT4 com a memtos da oxidação dos ácidos graxos acumulam-se no fígado (acetoaceta brana, permitindo a captação de glicose do sangue. Quando os níveis de inb-hidroxibutirato, ver p. 686) e são liberados na corrente sanguínea, fo sulina diminuem no sangue, GLUT4 é ressequestrado em vesículas por endocendo combustível para o cérebro, mas também diminuindo o pH do citose. No diabetes melito tipo 1 (dependente de insulina), a inserção de gue, causando cetoacidose. A mesma sequência de eventos ocorre no m GLUT4 nas membranas, assim como outros processos normalmente estimuMuitos carboidratos, além da glicose, encontram seus destinos catabólicos culo, exceto que os miócitos não estocam triacilgliceróis, mas captam lados por insulina, estão inibidos como indicado por X. A deficiência de insuácidos graxos que são liberados glicolíticos. na corrente sanguínea pelos adipócitos lina impede a captação de glicoseapós por GLUT4; comotransformados consequência, as células na glicólise, serem em um dos intermediários Os mais 5 VIAS ALIMENTADORAS DA GLICÓLISE significativos são os polissacarídeos de armazenamento, glicogênio e amido, contidos nas células (endógenos) ou obtidos da dieta; os dissacarídeos maltose, lactose, trealose continua o processo de degradação. A a-amilase pancreá- essencialmente a mesma estrutura do amido, e sua dig e sacarose; e os monossacarídeos frutose, manose e galactose. tica gera principalmente maltose e maltotriose (os di e trissacarídeos de glicose) e oligossacarídeos chamados de dextrinas-limite, fragmentos de amilopectina contendo pontos de ramificação (a1S6). A maltose e as dextrinas são degradadas até glicose por enzimas do epitélio intestinal com borda em escova (as microvilosidades das células epiteliais do intestino, que aumentam muito a área da superfície intestinal). O glicogênio da dieta tem tão segue a mesma via. Como foi visto no Capítulo 7, a maioria dos animais n pode digerir celulose devido à falta da enzima celulase, q cliva as ligações glicosídicas (b1S4) da celulose. Em a mais ruminantes, o estômago estendido inclui uma câm onde microrganismos simbióticos que produzem celul 155 degradam celulose em moléculas de glicose. Esses micr ganismos utilizam a glicose resultante por meio de ferm 560 D AV I D L7. –NENTRADA E L S O N & MDE ICH A E L M . COX AMIDO, DISSACARÍDEOS E HEXOSES DA DIETA NO ESTÁGIO PREPAFIGURA GLICOGÊNIO, RATÓRIO DA GLICÓLISE Trealose Lactose HO Lactase Trealase H CH2OH O H OH H H HO Sacarose Sacarase H2O a -amilase H OH Fosforilase OH H Glicose-1-fosfato Hexocinase H OH HO ATP OH D-Galactose UDP-glicose ATP H Fosfoglicomutase HO Glicose 6-fosfato OH CH2OH O H OH HO H H OH H D-Manose ATP H D-Frutose H OH UDP-galactose CH2OH O H Glicogênio endógeno H Pi D-Glicose HOCH2 Glicogênio da dieta; amido CH2OH O H OH H ATP Hexocinase Frutose 6-fosfato Frutocinase Frutose-1-fosfato Hexocinase Manose-6-fosfato Fosfomanose-isomerase Frutose-1-fosfato-aldolase Frutose-1,6-bifosfato Gliceraldeído ATP 1 Di-hidroxiacetona fosfato Triosecinase Triose-fosfato-isomerase Gliceraldeído-3-fosfato FIGURA 1411 FONTE: Rodwel, Murray da e Granner (2017, preparatório p. 410) Entrada de glicogênio, amido, dissacarídeos e hexoses dieta no estágio da glicólise. tação anaeróbia, produzindo grandes quantidades de propionato. Esse propionato serve como material de partida para a gliconeogênese, que gera a maior parte da lactose do leite. (a1S6) (ver Figura 7-13), onde cessa sua ação. Uma enzi- de desramificação remove ramificações. Os meca5.1 OS POLISSACARÍDEOS E OS ma DISSACARÍDEOS DAasDIETA nismos e o controle da degradação de glicogênio são descritos em maior detalhe no Capítulo 15. Para a maioria dos seres humanos, o amido é a principal fonte de carboidratos na A glicose-1-fosfato produzida pela glicogênio-fosforilase é convertida a glicose-6-fosfato pela fosfoglicomutase, dieta. A digestão inicia na boca, onde a amilase salivar hidrolisa as ligações glicosídicas O glicogênio endógeno e o amido são degradados por que catalisa a reação reversível: internas do amido, produzindo fragmentos polissacarídeos curtos ou oligossacarídeos. fosforólise ∆segunda Glicose-6-fosfato Os estoques de glicogênioaem tecidos salivar animais é (principalNo estômago, amilase inativada pelo pHGlicose-1-fosfato baixo, mas uma forma mente no fígado e no músculo esquelético), em microrA fosfoglicomutase utiliza basicamente o mesmo de amilase, secretada pelo pâncreas no intestino delgado, continua o processo demecanisganismos ou em tecidos vegetais podem ser mobilizados, mo que a fosfoglicerato-mutase (Figura 14-9): ambas endegradação. A amilase geraca-principalmente maltose e bifosfato, maltotriose (os di ée transitopara o uso da mesma célula, por umapancreática reação fosfolítica volvem um intermediário e a enzima talisada pela glicogênio-fosforilase riamente fosforilada em cada ciclo catalítico. O nome geral trissacarídeos de glicose)(amido-fosforilase e oligossacarídeos chamados de dextrinas-limite, fragmentos em vegetais) (Figura 14-12). Essas enzimas catalisam o mutase é dado a enzimas que catalisam a transferência de de amilopectina. A maltose e as dextrinas são degradadas até glicose por enzimas do ataque por Pi sobre a ligação glicosídica (a1S4) que une um grupo funcional de uma posição para outra, na mesma epitélio intestinal com na borda em escova microvilosidades epiteliais do os dois últimos resíduos de glicose extremidade não re-(as molécula. As mutasesdas são células uma subclasse das isomerases, dutora, gerando glicose-1-fosfato e um muito polímeroa com enzimas que interconvertem estereoisômeros ou isômeros intestino, que aumentam áreauma da superfície intestinal). O glicogênio da dieta unidade de glicose a menos. A fosforólise preserva parte estruturais ou de posição (ver Tabela 6-3). A glicose-6-fostem a mesma estrutura do amido, e suanadigestão a mesma viaentrar na da energia da essencialmente ligação glicosídica do éster-fosfato da glicofato formada reação da segue fosfoglicomutase pode se-1-fosfato. A glicogênio-fosforilase (NELSON; COX, 2014). (ou amido-fosforilase) glicólise ou em outra via, como a via das pentoses-fosfato, age repetidamente até alcançar um ponto de ramificação descrita na Seção 14.5. 156 5.2 O GLICOGÊNIO ENDÓGENO E O AMIDO SÃO DEGRADADOS POR FOSFORÓLISE Os estoques de glicogênio em tecidos animais (principalmente no fígado e no músculo esquelético), em microrganismos ou em tecidos vegetais podem ser mobilizados, para o uso da mesma célula, por uma reação fosfolítica catalisada pela glicogênio-fosforilase (amido-fosforilase em vegetais) (Figura 9). A fosforólise preserva parte da energia da ligação glicosídica do ester-fosfato da glicose- 1-fosfato (BERG; TYMOCZKO; STRYERT, 2015). PRINCÍPIOS DE BIO FIGURA 8 – DEGRADAÇÃO DO GLICOGÊNIO INTRACELULAR PELA GLICOGÊNIO-FOSFORILASE Extremidade não redutora H HO CH2OH O H OH H H H CH2OH O H OH H O H O H OH H H OH Glicogênio (amido) n unidades de glicose P OH Dextrina 1 nH2O Maltose 1 H2O Lactose 1 H2O Sacarose 1 H2O O2 O Os dissacarídeos deve rídeos antes de entrar na dextrinas são hidrolisado cie externa das células ep O2 Glicogênio-(amido)-fosforilase Trealose 1 H2O d malt lact sac tre Os monossacarídeos a ativamente para as célula CH2OH CH2OH seguida passam para o sa O O rios tecidos, onde são fo H H H H H H H glicolítica. 1 O OH H OH H A intolerância à l HO HO O P O2 O maior parte das pop originárias do norte da E H OH H OH O2 devida ao desaparecimen Glicogênio (amido) Glicose-1-fosfato (n-1) unidades de glicose ou de toda atividade lact nais. Na ausência de lact FONTE: Berg, Tymoczko e Stryert (2015, p. 561) FIGURA 1412 Degradação do glicogênio intracelular pela glicogêser completamente diger nio-fosforilase. A enzima catalisa o ataque pelo fosfato inorgânico (em cor do, passando para o intes salmão) sobre o resíduo glicosil terminal (em azul) na extremidade não reduvertem em produtos tóxic tora de uma molécula de glicogênio, liberando glicose-1-fosfato e formando uma molécula de glicogênio com um resíduo de glicose a menos. A reação e diarreia. O problema é umapolissacarídeos fosforólise (não hidrólise). A quebra éde da dieta, como o glicogênio e o amido lactose no nãotrato digerida e seu ridade do conteúdo intes gastrintestinal, por fosforólise, em vez de hidrólise, não produziria ganho de energia: água no intestino. Na mai açúcares fosfatados não são transportados para dentro das células que revestem o PROBLEMA RESOLVIDO 141 Economia de energia para a quebra do intolerância à lactose é pr intestino, devendo primeiro ser desfosforilados a por açúcar livre. Os dissacarídeos glicogênio fosforólise alimentodevem para adultos, em ridos2014). com lactase estejam ser hidrolisados a monossacarídeos antes de entrar na célula (NELSON; COX, Calcule a economia de energia (em moléculas de ATP por alguns países. Em certas monômeros de glicose) obtida pela quebra do glicogênio tes algumas ou todas as Os monossacarídeos são transportados ativamente as digesti por fosforóliseassim em vezformados de hidrólise para iniciar o processo casos, opara distúrbio de glicólise. da dieta ser minimiz células epiteliais, em seguida passam para o sangue e são transportados parapode vários tecidos, onde sãoSolução: fosforilados e entram na sequência A fosforólise produz uma glicoseglicolítica. fosforilada (glicose-1-fosfato), que é então convertida a glicose-6-fosfato – sem gasto da energia celular (1 ATP) necessária para a formação de glicose-6-fosfato a partir de glicose livre. Por- Outros monossacarídeos diversos pontos 157 Na maior parte dos organ IMPORTANTE A intolerância à lactose, comum entre adultos na maior parte das populações humanas, exceto aquelas originárias do norte da Europa e alguns países da África, é devida ao desaparecimento, após a infância, da maior parte ou de toda atividade lactásica das células epiteliais intestinais. Na ausência de lactase intestinal, a lactose não pode ser completamente digerida e absorvida no intestino delgado, passando para o intestino grosso, onde bactérias a convertem em produtos tóxicos que causam cãibras abdominais e diarreia. O problema é ainda mais complicado porque a lactose não digerida e seus metabólitos aumentam a osmolaridade do conteúdo intestinal, favorecendo a retenção de água no intestino. Na maioria dos lugares do mundo, onde a intolerância a lactose é prevalente, o leite não é usado como alimento para adultos, embora os produtos do leite pré-digeridos com lactase estejam comercialmente disponíveis em alguns países. Em certas patologias humanas estão ausentes algumas ou todas as dissacaridases intestinais. Nesses casos, o distúrbio digestivo ocasionado pelos dissacarídeos da dieta pode ser minimizado por uma dieta controlada (NELSON; COX, 2014). 6 GLICONEOGÊNESE O papel central da glicose no metabolismo surgiu cedo na evolução e esse açúcar permanece sendo combustível quase universal e unidade estrutural nos organismos atuais, desde micróbios até humanos. Em mamíferos, alguns tecidos dependem quase completamente de glicose para sua energia metabólica. Para o encéfalo humano e o sistema nervoso, assim como para os eritrócitos, os testículos, a medula renal e os tecidos embrionários, a glicose do sangue é a principal ou a única fonte de combustível. Apenas o encéfalo requer em média 120 g de glicose por dia – mais da metade de toda a glicose estocada como glicogênio nos músculos e no fígado. No entanto, o suprimento de glicose a partir desses estoques não é sempre suficiente; entre as refeições e durante períodos de jejum mais longos, ou após exercício vigoroso, o glicogênio se esgota. Para esses períodos, os organismos precisam de um método para sintetizar glicose a partir de precursores que não são carboidratos. Isso é realizado por uma via chamada de gliconeogênese (“nova formação de açúcar”), que converte em glicose o piruvato e os compostos relacionados, com três e quatro carbonos (RODWEL; MURRAY; GRANNER, 2017). A gliconeogênese ocorre em todos os animais, vegetais, fungos e microrganismos. As reações são essencialmente as mesmas em todos os tecidos e em todas as espécies. Os precursores importantes da glicose em animais são compostos de três carbonos como o lactato, o piruvato e o glicerol, assim como certos aminoácidos (Figura 10). Em mamíferos, a gliconeogênese ocorre principalmente no fígado, e em menor extensão no córtex renal e nas células epiteliais que revestem internamente o intestino delgado. A glicose assim produzida passa para o sangue e vai suprir outros tecidos. Após exercícios 158 vigorosos, o lactato produzido pela glicólise anaeróbia no músculo esquelético retorna para o fígado e é convertido a glicose, que volta para os músculos e é convertida a glicogênio – circuito chamado de ciclo de Cori (NELSON; COX, 2014). PRINCÍPIOS DE BI FIGURA 9 – SÍNTESE DE CARBOIDRATOS A PARTIR DE PRECURSORES SIMPLES Glicose sanguínea Glicoproteínas Glicogênio Outros monossacarídeos Dissacarídeos Sacarose Amido Glicólise Glicose-6-fosfato ATP Energia Animais Hexocinase Plantas ADP Fosfoenol-piruvato ATP Fosfofrutocinase-1 Ciclo do ácido cítrico Piruvato ADP Aminoácidos Glicerol glicogênicos 3-Fosfoglicerato Di-hidroxiacetona-fosfato (2 Lactato Triacilgliceróis Fixação do CO2 2NA Síntese carboidratos a partir de precursores simFONTE:de Nelson e Cox (2014, p. 569) ples. A via a partir de fosfoenolpiruvato até glicose-6-fosfato é comum para a conversão biossintética de muitos precursores diferentes de carboidratos de animais e plantas. A via partindo de piruvato a fosfoenolpiruvato passa por oxaloacetato, um intermediário do ciclo do ácido cítrico, discutido no Capítulo 16. Qualquer composto que possa ser convertido a piruvato ou oxaloacetato pode, consequentemente, servir como material inicial para a gliconeogênese. Isso inclui alanina e aspartato, que podem ser convertidos a piruvato e oxaloacetato, respectivamente, e outros aminoácidos que também podem gerar fragmentos de três ou quatro carbonos, os chamados aminoácidos glicogênicos (ver Tabela 14-4; ver também Figura 18-15). Plantas e bactérias fotossintetizantes são as únicas capazes de converter CO2 em carboidratos, usando o ciclo de Calvin (ver Seção 20.1). FIGURA 1416 nucleotídeos, coenzimas e uma série de outros metabólitos essenciais das plantas. Em muitos microrganismos, a gliconeogênese inicia a partir de compostos orgânicos simples de dois ou três carbonos, como acetato, lactato e propionato, presentes em seu meio de crescimento. Embora as reações da gliconeogênese sejam as mesmas em todos os organismos, o contexto metabólico e a regulação da via diferem de uma espécie para outra e de tecido para tecido. Nesta seção, analisa-se a gliconeogênese e como ela ocorre no fígado de mamíferos. No Capítulo 20 2NADH 1 2 (2) 1 2A 2A (2) (2 (2) F 2ADP Piruvato-cinase 2ATP 159 LEITURA COMPLEMENTAR Alta taxa da glicólise em tumores sugere alvos para quimioterapia e facilita o diagnóstico José de Felippe Junior Em muitos tipos de tumores encontrados em humanos e em outros animais, a captação e a degradação de glicose ocorrem cerca de 10 vezes mais rápido do que em tecidos normais, não cancerosos. A maior parte das células tumorais cresce em condições de hipóxia (i.e., com suprimento de oxigênio limitado) devido à falta, pelo menos inicialmente, das redes capilares que suprem com oxigênio suficiente. Células cancerosas localizadas a mais de 100 a 200 mm dos capilares mais próximos dependem somente da glicose (sem oxidação adicional de piruvato) para a maior parte da produção de ATP. O rendimento de energia (2 ATP por glicose) é muito menor do que o que pode ser obtido pela oxidação completa do piruvato a CO2 na mitocôndria (cerca de 30 ATP por glicose). Portanto, para fazer a mesma quantidade de ATP, as células tumorais devem captar muito mais glicose do que as células normais, convertendo-a a piruvato e depois a lactato enquanto reciclam NADH. É provável que as duas etapas iniciais na transformação de uma célula normal em uma célula tumoral sejam (1) a mudança para a dependência da glicólise na produção de ATP, e (2) o desenvolvimento de tolerância a pH baixo no fluido extracelular (causado pela liberação do produto da glicólise, o ácido láctico). Em geral, quanto mais agressivo é o tumor, maior é a taxa de glicólise. Esse aumento da glicólise é alcançado ao menos em parte pelo aumento da síntese das enzimas glicolíticas e dos transportadores da membrana plasmática GLUT1 e GLUT3 que carregam a glicose para a célula. Com a alta velocidade de glicólise resultante, as células tumorais podem sobreviver em condições anaeróbias até que o suprimento de vasos sanguíneos alcance o tumor em crescimento. Outra proteína induzida por HIF1 e o hormônio peptídico VEGF (fator de crescimento vascular endotelial), que estimula crescimento dos vasos sanguíneos (angiogênese) em direção do tumor. Existe também a evidência de que a proteína supressora de tumor p53, mutada na maior parte dos tipos de câncer, controla a síntese e a montagem das proteínas mitocondriais essenciais para o transporte dos elétrons ao O2. As células com p53 mutada são deficientes no transporte de elétrons na mitocôndria e são forçadas a depender mais significativamente da glicólise para a produção de ATP. Essa dependência maior dos tumores pela glicólise em comparação aos tecidos normais sugere uma possibilidade de terapia anticâncer: inibidores da glicólise poderiam atingir e matar tumores por esgotar seu suprimento de ATP. FONTE: Adaptado de <http://www.medicinabiomolecular.com.br/biblioteca/pdfs/Cancer/ca-0369.pdf>. Acesso em: 12 jul. 2019. 160 RESUMO DO TÓPICO 1 Neste tópico, você adquiriu certos aprendizados, como: • A glicólise é uma via quase universal pela qual uma molécula de glicose é oxidada a duas moléculas de piruvato, com energia conservada na forma de ATP e NADH. • Na fase preparatória da glicólise, ATP é consumido para a conversão de glicose em frutose-1,6-bifosfato. • Na fase de pagamento, cada uma das duas moléculas de gliceraldeido-3-fosfato derivada da glicose sofre oxidação em C-1; a energia dessa reação de oxidação é conservada na forma de um NADH e dois ATP. • A glicólise é rigidamente regulada de forma coordenada com outras vias geradoras de energia para garantir um suprimento constante de ATP. • No diabetes tipo 1, a captação deficiente de glicose pelo músculo e tecido adiposo tem efeitos profundos sobre o metabolismo de carboidratos e gorduras. • O glicogênio e o amido endógenos, as formas de armazenamento da glicose, entram na glicólise em um processo de duas etapas. • A clivagem fosforolítica de um resíduo de glicose de uma extremidade do polímero, formando glicose-1-fosfato, é catalisada pela glicogênio-fosforilase ou pela amidofosforilase. A fosfoglicomutase então converte a glicose-1-fosfato em glicose-6fosfato, que pode entrar na glicólise. • Os polissacarídeos e os dissacarídeos ingeridos são convertidos a monossacarídeos por enzimas hidrolíticas intestinais, e os monossacarídeos entram nas células intestinais e são transportados para o fígado ou para outros tecidos. • A gliconeogênese é um processo de múltiplas etapas em que a glicose é produzida a partir de lactato, piruvato ou oxaloacetato, ou qualquer composto que possa ser convertido a um desses intermediários. 161 AUTOATIVIDADE 1 Adultos engajados em exercício físico intenso requerem, para nutrição adequada, uma ingestão de cerca de 160 g de carboidrato diariamente, mas apenas em torno de 20 mg de niacina. Dado o papel da niacina na glicólise, como você explica essa observação? 2 Os sintomas clínicos das duas formas de galactosemia – deficiência de galactocinase ou de UDP-glicose: galactose-1-fosfato-uridiltransferase – mostram severidades radicalmente diferentes. Embora os dois tipos provoquem desconforto gástrico após a ingestão de leite, a deficiência da transferase também leva a disfunções do fígado, dos rins, do baço, do cérebro e, finalmente, à morte. Quais produtos se acumulam no sangue e nos tecidos em cada tipo de deficiência enzimática? 3 Uma consequência do jejum prolongado é a redução da massa muscular. O que acontece com as proteínas musculares? 162 TÓPICO 2 - UNIDADE 3 CICLO DO ÁCIDO CÍTRICO 1 INTRODUÇÃO Como mencionamos no tópico anterior, algumas células obtêm energia (ATP) pela fermentação, degradando a glicose na ausência de oxigênio. Para a maioria das células eucarióticas, e muitas bactérias que vivem em condições aeróbias e oxidam os combustíveis orgânicos a dióxido de carbono e água, a glicólise é apenas a primeira etapa para a oxidação completa da glicose. Em vez de ser reduzido a lactato, etanol ou algum outro produto da fermentação, o piruvato produzido pela glicólise é posteriormente oxidado a H2O e CO2. Essa fase aeróbia do catabolismo é chamada de respiração. No sentido fisiológico ou macroscópico mais amplo, respiração alude à captação de O2 e eliminação de CO2 por organismos multicelulares. Bioquímicos e biólogos celulares, entretanto, utilizam esse termo em um sentido mais estrito para referirem-se ao processo molecular por meio do qual as células consomem O2 e produzem CO2 – processo mais precisamente denominado respiração celular. A respiração celular acontece em três estágios principais (Figura 11). No primeiro, a glicólise, ocorre quando a glicose é transformada em duas moléculas de piruvato. Esse estágio acontece no citosol das células. No segundo estágio, o piruvato entra na mitocôndria, se une à Coenzima A e forma a Acetil – CoA. Já no terceiro estágio, chamado de cadeia respiratória, ocorre na membrana mitocondrial interna e os elétrons do NADH são enviados para a cadeia transportadora de elétrons. No curso da transferência de elétrons, a grande quantidade de energia liberada é conservada na forma de ATP, por um processo chamado de fosforilação oxidativa. A respiração é mais complexa do que a glicólise e acredita-se que tenha evoluído muito mais tardiamente, após o surgimento das cianobactérias. As atividades metabólicas das cianobactérias são responsáveis pelo aumento dos níveis de oxigênio na atmosfera terrestre, um momento decisivo na história evolutiva (NELSON; COX, 2014). Neste tópico, abordaremos a conversão de piruvato a grupos acetil e, então, a entrada destes grupos no ciclo do ácido cítrico, também chamado de ciclo de Krebs (em homenagem ao seu descobridor, Hans Krebs). Em seguida, serão examinadas as reações do ciclo e as enzimas que as catalisam. Já que os intermediários do ciclo do ácido cítrico também são desviados como precursores biossintéticos, serão consideradas algumas maneiras pelas quais esses intermediários são repostos. O ciclo do ácido cítrico é um pivô do metabolismo, com vias catabólicas chegando e vias anabólicas partindo, sendo cuidadosamente regulado em coordenação com outras vias. Terminamos esse tópico com uma descrição da via do glioxilato, uma sequência metabólica presente em certos organismos que utiliza algumas das mesmas enzimas e reações utilizadas pelo ciclo do ácido cítrico, causando a síntese líquida de glicose a partir dos triacilgliceróis armazenados. 163 634 D AV I D L . N E L S O N & M I C H A E L M . COX FIGURA 10 – CATABOLISMO DE PROTEÍNAS, GORDURAS E CARBOIDRATOS ilustra como uma combinação d Amino- Ácidos Estágio 1 e mecanismos alostéricos result Glicose ácidos graxos Produção te regulado em uma etapa meta de acetil-CoA plexo da PDH é o protótipo par Glicólise complexos enzimáticos: a-cetog ciclo do ácido cítrico, e a-cetoá deia ramificada, das vias de oxi Piruvato e2 dos (ver Figura 18-28). A notáve Complexo da de proteínas, na exigência de co piruvato-desidrogenase reação desses três complexos in 2 e e2 uma origem evolutiva comum. CO 2 e2 Estágio 2 Oxidação da acetil-CoA O piruvato é oxidado a acetil-Co Acetil-CoA Oxaloacetato e2 Citrato Ciclo do ácido cítrico e2 e2 CO2 Estágio 3 Transferência de elétrons e fosforilação oxidativa e2 CO2 NADH, FADH2 (transportadores de e2 reduzidos) e2 + 1 2H + 2 O2 Cadeia respiratória (transferência de elétrons) H 2O A reação geral catalisada pelo c drogenase é uma descarboxil cesso de oxidação irreversível n removido do piruvato na forma os dois carbonos remanescente acetil da acetil-CoA (Figura 162 reação doa um íon hidreto (:H ) (Figura 16-1), que transferirá o ou, em microrganismos anaeró trons alternativo, como nitrato de elétrons do NADH ao oxigêni las de ATP por par de elétrons. ção do complexo da PDH foi de tos com marcação isotópica: o c CO2 radioativamente marcado à a molécula de piruvato com o carb O complexo da piruvato-desidr cinco coenzimas A combinação de desidrogenaçã ruvato ao grupo acetil da acetil-C ATP ADP + Pi ação sequencial de três enzimas mas diferentes ou grupos prosté na (TPP, de thiamine pyropho FONTE: Nelson e Cox (2014, 634) e carboidratos FIGURA 161 Catabolismo de proteínas, gorduras durante os três estágios da respiração celular. Estágio 1: a oxidação flavina-adenina (FAD, de flavin de ácidos graxos, glicose e alguns aminoácidos gera acetil-CoA. Estágio 2: coenzima A (CoA, algumas vezes a oxidação dos grupos acetil no ciclo do ácido cítrico inclui quatro etapas enfatizar a função do grupo ¬S nas quais os elétrons são removidos. Estágio 3: os elétrons carreados por tinamida-adenina (NAD, de nico NADH e FADH2 convergem para uma cadeia de transportadores de elétrons cleotide) e lipoato. Quatro vitam mitocondrial (ou, em bactérias, ligados à membrana plasmática) – a cadeia respiratória – reduzindo,glicose no final, Oe H2O. Este açúcares, fluxo de elétrons impele agraxos à nutrição humana são compon Em organismos aeróbios, ácidos e a maioria 2 aoutros produção de ATP. tiamina (no dos aminoácidos são finalmente oxidados a CO2 e H2O pelo ciclo do ácido cítrico e TPP), pela riboflavina (n 2 PRODUÇÃO DE ACETATO cadeia respiratória. Antes de entrarem no ciclo do ácido cítrico, os esqueletos de carbono é oxidado a acetil-CoA e CO2 pelo complexo da piruvatodos açúcares e ácidos graxos são(PDH, convertidos ao grupo acetil da acetil-CoA, a forma na -desidrogenase de pyruvate dehydrogenase), um O O 2 CoA-SH qual a maioria dosgrupo combustíveis no cópias ciclo. de Ostrês carbonos muitos aminoácidos de enzimas –entra múltiplas enzimas de – locaNAD1 TPP C lipoat lizado mitocôndrias células eucarióticas e no citosolsejam convertidos também entram no ciclonas dessa maneira,deembora alguns aminoácidos FAD de bactérias. C O a outros intermediários do ciclo. Aqui, o foco será em como o piruvato, derivado da Complexo O exame cuidadoso desse complexo enzimático é grapiruvato-desidrogenase 3 complexo glicose e de outrostificante açúcares glicólise, é oxidado a acetil-CoA CO2 pelo CH sob pela diversos aspectos. O complexo da PDH éeum Piruvato exemplo clássico e muito estudado de um complexo mulda piruvato desidrogenase (utilizaremos a abreviação PDH), um grupo de enzimas – tienzimático no qual uma série de intermediários químicos múltiplas cópias de três enzimas – localizado nas mitocôndrias de células eucarióticas permanece ligada às moléculas de enzima à medida que o e no citosol de bactérias (RODWEL; MURRAY; GRANNER, 2017). substrato é transformado no produto final. Cinco cofatores, 164 quatro derivados de vitaminas, participam do mecanismo da reação. A regulação desse complexo enzimático também FIGURA 162 Reação geral catalisad -desidrogenase. As cinco enzimas part zimas que formam o complexo são discu O exame cuidadoso desse complexo enzimático é gratificante sob diversos aspectos. O complexo da PDH é um exemplo clássico e muito estudado de um complexo multienzimático no qual uma série de intermediários químicos permanece ligada às moléculas de enzima à medida que o substrato é transformado no produto. Cinco cofatores, quatro derivados de vitaminas, participam do mecanismo da reação. A regulação desse complexo enzimático também ilustra como uma combinação de modificações covalentes e mecanismos alostéricos resultam em um fluxo precisamente regulado em uma etapa metabólica. Finalmente, o complexo da PDH é o protótipo para dois outros importantes complexos enzimáticos: a-cetoglutarato-desidrogenase, do ciclo do ácido cítrico, e a-cetoácido-desidrogenase de cadeia ramificada, das vias de oxidação de alguns aminoácidos. A notável similaridade na estrutura de proteínas, na exigência de cofator e nos mecanismos de reação desses três complexos inquestionavelmente reflete uma origem evolutiva comum (NELSON; COX, 2014). O piruvato será oxidado a acetil-CoA e CO2. Essa reação geral é catalisada pelo complexo da piruvato-desidrogenase e é considerada uma descarboxilação oxidativa, um processo de oxidação irreversível no qual o grupo carboxil é removido do piruvato na forma de uma molécula de CO2, e os dois carbonos remanescentes são convertidos ao grupo acetil da acetil-CoA (Figura 11). O NADH formado nessa reação doa um íon hidreto (H-) para a cadeia respiratória (Figura 10), que transferirá os dois elétrons ao oxigênio ou, em microrganismos anaeróbios, a um aceptor de elétrons alternativo, como nitrato ou sulfato. A transferência de elétrons do NADH ao oxigênio gera, ao final, 2,5 moléculas de ATP por par de elétrons (RODWEL; MURRAY; GRANNER, 2017). FIGURA 11 – REAÇÃO GERAL CATALISADA PELO COMPLEXO DA PIRUVATO-DESIDROGENASE FONTE: Rodwel, Murray e Granner (2017, p. 501) 165 A combinação de desidrogenação e descarboxilação do piruvato ao grupo acetil da acetil-CoA (Figura 12) requer a ação sequencial de três enzimas diferentes e cinco coenzimas diferentes ou grupos prostéticos – pirofosfato de tiamina (TPP), dinucleotídeo de flavina-adenina (FAD), coenzima A (CoA), dinucleotídeo de nicotinamida-adenina (NAD) e lipoato. Quatro vitaminas diferentes essenciais à nutrição humana são componentes vitais desse sistema: tiamina (no TPP), riboflavina (no FAD), niacina (no NAD) e pantotenato (na CoA). Já sabemos que FAD e NAD têm como função serem transportadores de elétrons e verificamos que o TPP era a coenzima da piruvatodescarboxilase (NELSON; COX, 2014). 3 REAÇÕES DO CICLO DO ÁCIDO CÍTRICO Agora serão focalizados os processos por meio dos quais a acetil-CoA é oxidada. Essa transformação química é realizada pelo ciclo do ácido cítrico, a primeira via cíclica descoberta (Figura 13). Para iniciar uma rodada do ciclo, a acetil-CoA doa seu grupo acetil ao composto de quatro carbonos oxaloacetato, formando o composto de seis carbonos citrato. O citrato é, em seguida, transformado a isocitrato, também uma molécula com seis carbonos, o qual é desidrogenado com a perda de CO2 para produzir o composto de cinco carbonos a-cetoglutarato (também chamado de oxoglutarato). O a-cetoglutarato perde uma segunda molécula de CO2, originando ao final o composto de quatro carbonos succinato. O succinato é, então, convertido por quatro etapas enzimáticas ao composto de quatro carbonos oxaloacetato – que está, assim, pronto para reagir com outra molécula de acetil-CoA. Em cada rodada do ciclo entra um grupo acetil (dois carbonos) na forma de acetil-CoA, e são removidas duas moléculas de CO2; uma molécula de oxaloacetato é utilizada para a formação do citrato e uma molécula de oxaloacetato é regenerada. Não ocorre nenhuma remoção líquida de oxaloacetato; teoricamente, uma molécula de oxaloacetato pode participar da oxidação de um número infinito de grupos acetil, e, na verdade, o oxaloacetato está presente nas células em concentrações muito baixas. Quatro das oito etapas deste processo são oxidações, nas quais a energia da oxidação é conservada de maneira muito eficiente na forma das coenzimas reduzidas NADH e FADH2 (NELSON; COX, 2014). Como mencionado antes, embora o ciclo do ácido cítrico seja fundamental ao metabolismo gerador de energia, sua função não está limitada à conservação energética. Intermediários do ciclo com quatro e cinco carbonos servem como precursores para uma ampla variedade de produtos. 166 PRINCÍPIOS DE BIOQUÍMICA DE LEHNINGER FIGURA 12 – REAÇÕES DO CICLO DO ÁCIDO CÍTRICO 639 ❶ Condensação de Claisen: grupo metil da acetil-CoA convertido a metileno no citrato. Acetil-CoA O ❽ CH3 Desidrogenação: oxidação do —OH completa a sequência de oxidação; carbonil gerado posicionado para facilitar a condensação de Claisen na próxima etapa. S-CoA H2O CoA-SH Citrato Oxaloacetato O C Citrato-sintase CH2 HO COO2 CH2 C COO2 Ciclo do ácido cítrico Desidratação/reidratação: grupo —OH do citrato reposicionado no isocitrato preparando para a descarboxilação da próxima etapa. COO2 CH2 COO2 Malato-desidrogenase ❼ C COO2 H2 O Aconitase Malato Hidratação: COO2 adição de CH HO água à ligação dupla CH2 introduz COO2 o grupo —OH para a próxima Fumarase etapa de oxidação. CH2 COO2 C COO2 C COO2 cis-Aconitato H H2 O (3) NADH Aconitase Reidratação H2 O COO2 CH2 Fumarato CH HC COO2 ❻ H C COO2 HO C H FADH2 COO2 Isocitrato-desidrogenase Succinato-desidrogenase Desidrogenação: introdução da ligação dupla inicia a sequência de oxidação do metileno. CH2 CH2 Succinil-CoA-sintatetase Succinato COO2 CH2 ❺ GTP (ATP) Fosforilação ao nível do substrato: energia do tioéster conservada na ligação fosfoanidrido do GTP ou ATP. C S-CoA GDP O (ADP) Succinil-CoA 1 Pi FIGURA 167 Reações do ciclo do ácido cítrico. Os átomos de carbono Nelson e sombreados em cor salmão são aqueles derivados FONTE: do acetato da acetil-CoA durante a primeira rodada do ciclo; estes não são os carbonos liberados na forma de CO2 durante a primeira rodada. Observe que, no succinato e no fumarato, o grupo de dois carbonos derivado do acetato não pode mais ser especificamente indicado; como succinato e fumarato são moléculas simétricas, C-1 e C-2 são indistinguíveis de C-4 e C-3. O número ao lado de cada COO2 CO2 CH2 C COO2 O COO2 CoA-SH a-Cetoglutarato CH2 CoA-SH CH2 Complexo a-cetoglutarato-desidrogenase COO2 CO2 COO2 Isocitrato ❸ Descarboxilação oxidativa: grupo —OH oxidado a carbonil, o que, por sua vez, facilita a descarboxilação por meio da estabilização do carbânion formado no carbono adjacente. ❹ Descarboxilação oxidativa: mecanismo similar a piruvato-desidrogenase; dependente do carbonil no carbono adjacente. etapa de reação corresponde a um tópico numerado nas p. 640-647. As setas Cox p. 639)onde a energia é conservada pela transferência de em(2014, vermelho mostram elétrons ao FAD ou NAD1, formando FADH2 ou NADH 1 H1. As etapas ➊, ➌ e ➍ são essencialmente irreversíveis na célula; todas as outras etapas são reversíveis. O nucleosídeo trifosfatado produzido na etapa ➎ pode ser tanto ATP quanto GTP, dependendo da isoenzima de succinil-CoA-sintetase que está catalisando a reação. IMPORTANTE ção do citrato (etapa ➊ na Figura 16-7). O grupo metil série de oxidações que eliminam dois carbonos na forma O acetato Ciclo édo Ácido aCítrico matriz de CO2. ObserveO quepiruvato todas as etapas levando à quebra ou do convertido metilenoocorre no ácido na cítrico. Esse mitocondrial. ácido tricarboxílico, então, prontamente por uma à formação carbono-carbono (etapas ➊, ➌ e penetra na mitocôndria, se unepassa à Coenzima-A e formadealigações Acetil-CoA. Rendimento do ciclo: 2 ATP, 6NADH e 2FADH2. Nelson_6ed_book.indb 639 03/04/14 07:44 167 O fluxo de átomos de carbono que entram no ciclo do ácido cítrico a partir do piruvato, e também durante o curso do ciclo, está sob constante regulação em dois níveis: a conversão de piruvato a acetil-CoA, o material de partida do ciclo (a reação da piruvato-desidrogenase), e a entrada da acetil-CoA no ciclo (a reação da citrato-sintase). A acetil-CoA também é produzida por outras vias que não a reação do complexo da PDH – a maioria das células produz acetil-CoA pela oxidação de ácidos graxos e certos aminoácidos – e a disponibilidade de intermediários a partir dessas vias é importante para a regulação da oxidação do piruvato e do ciclo do ácido cítrico. O ciclo também é regulado nas reações da isocitrato-desidrogenase e da a-cetoglutarato-desidrogenase (RODWEL; MURRAY; GRANNER, 2017). NOTA Você sabia? Quando os mecanismos da regulação de uma via como o ciclo do ácido cítrico são afetados por uma perturbação metabólica importante, o resultado pode ser uma doença grave. São raríssimas as mutações nas enzimas do ciclo do ácido cítrico em humanos e outros mamíferos, mas quando ocorrem são devastadoras. Defeitos genéticos no gene da fumarase levam a tumores no músculo liso (leiomas) e nos rins; mutações na succinato-desidrogenase levam a tumores da glândula suprarrenal (feocromocitomas). 4 O CICLO DO GLIOXILATO Os vertebrados não conseguem converter ácidos graxos, ou o acetato derivado deles, a carboidratos. As conversões de fosfoenolpiruvato a piruvato e de piruvato a acetil--CoA de tão exergônicas são essencialmente irreversíveis. Se uma célula não consegue converter acetato a fosfoenolpiruvato, o acetato não pode ser o material de partida para a via gliconeogênica, que leva de fosfoenolpiruvato a glicose. Sem essa capacidade, portanto, uma célula ou organismo é incapaz de converter combustíveis ou metabólitos que são degradados a acetato (ácidos graxos e certos aminoácidos) em carboidratos. Como os átomos de carbono das moléculas de acetato que entram no ciclo do ácido cítrico aparecem oito etapas depois no oxaloacetato, pode parecer que esta via pode produzir oxaloacetato a partir de acetato e, assim, originar fosfoenolpiruvato para a gliconeogênese. Contudo, como mostrado por um exame da estequiometria do ciclo do ácido cítrico, não há conversão líquida de acetato a oxaloacetato; nos vertebrados, para cada dois carbonos que entram no ciclo na forma de acetil-CoA, dois são liberados na forma de CO2. Em muitos organismos que não os vertebrados, o ciclo do glioxilato funciona como mecanismo para a conversão de acetato a carboidratos (NELSON; COX, 2014). 168 No ciclo do glioxilato, a acetil-CoA é condensada com o oxaloacetato para formar citrato, e o citrato é convertido a isocitrato, exatamente como no ciclo do ácido cítrico. A próxima etapa, porém, não é a quebra do isocitrato pela isocitrato-desidrogenase, mas a clivagem do isocitrato pela isocitrato-liase, formando succinato e glioxilato. O glioxilato, então, é condensado com uma segunda molécula de acetil-CoA para a geração de malato, em uma reação catalisada pela malato-sintase. O malato é posteriormente oxidado a oxaloacetato, o qual pode ser condensado com outra molécula de acetil-CoA para iniciar outra volta do ciclo (Figura 13). Cada volta do ciclo do glioxilato consome duas moléculas de acetil-CoA e produz uma molécula de succinato, que está, então, disponível aos propósitos biossintéticos (BERG; TYMOCZKO; STRYERT, 2015). nismo é incapaz de converter que são degradados a acetato ácidos) em carboidratos. ussão sobre reações anapleenolpiruvato pode ser sinteto em uma reação reversível nase: FIGURA 13 – CICLO DO GLIOXILATO O CH3 O ¡ 1 inato 1 2CoA 1 NADH 1 H il-CoA é condensada com o ato, e o citrato é convertido o no ciclo do ácido cítrico. A a quebra do isocitrato pela as a clivagem do isocitrato ndo succinato e glioxilato. sado com uma segunda mogeração de malato, em uma S-CoA COO2 C Citrato-sintase COO2 CH2 Oxaloacetato CH2 NADH HO Malato-desidrogenase Ciclo do glioxilato CH CH2 COO2 Malato O CH3 C S-CoA Acetil-CoA COO2 COO2 Aconitase CH2 Malato-sintase COO2 Citrato COO2 HO C CH2 NAD1 ompostos de quatro dos e alguns microrganismos o acetato pode ser tanto um omo uma fonte de fosfoenoloidratos. Nesses organismos, xilato catalisam a conversão ou outros intermediários de cido cítrico: C Acetil-CoA oenolpiruvato 1 CO2 1 GDP das moléculas de acetato que co aparecem oito etapas derecer que esta via pode proe acetato e, assim, originar oneogênese. Contudo, como tequiometria do ciclo do áciquida de acetato a oxaloaceda dois carbonos que entram A, dois são liberados na forma os que não os vertebrados, o mo mecanismo para a conver- 657 PRINCÍPIOS DE BIOQUÍMICA DE LEHNINGER HO O 2 COO2 CH COO2 CH COO2 Isocitrato C O C O Isocitrato-liase H Glioxilato CH2 COO2 CH2 COO2 Succinato FONTE: Rodwel, Murray e Granner (2017, p.a510) FIGURA 1622 Ciclo do glioxilato. A citrato-sintase, aconitase e a malato-desidrogenase do ciclo do glioxilato são isoenzimas das enzimas do ciclo do ácido cítrico; isocitrato-liase e malato-sintase são exclusivas do ciclo do glioxilato. Observe que dois grupos acetil (em cor salmão) entram no ciclo e quatro carbonos saem na forma de succinato (em azul). O ciclo do glioxilato foi elucidado por Hans Kornberg e Neil Madsen no laboratório de Hans Krebs. madas de glioxissomos, os quais são peroxissomos especializados (Figura 16-23). As enzimas comuns ao ciclo do ácido cítrico e do glioxilato têm duas isoenzimas, uma espe- 169 Em plantas, as enzimas do ciclo do glioxilato estão sequestradas em organelas delimitadas por membrana chamadas de glioxissomos, os quais são peroxissomos especializados (Figura 15). As enzimas comuns ao ciclo do ácido cítrico e do glioxilato têm duas isoenzimas, uma específica das mitocôndrias, outra específica dos glioxissomos. Os glioxissomos nem sempre estão presentes em todos os tecidos vegetais. Eles se desenvolvem nas sementes ricas em lipídios durante a germinação, antes de a planta adquirir a capacidade de produzir glicose pela fotossíntese. Além das enzimas do ciclo do glioxilato, os glioxissomos contêm todas as enzimas necessárias para a degradação dos ácidos graxos estocados nos óleos das sementes (RODWEL; MURRAY; GRANNER, 2017). FIGURA 14 – MICROGRAFIA ELETRÔNICA DE UMA SEMENTE DE PEPINO EM GERMINAÇÃO, MOSTRANDO GLIOXISSOMO, MITOCÔNDRIAS E CORPOS LIPÍDICOS FONTE: Nelson e Cox (2014, p. 658) 170 RESUMO DO TÓPICO 2 Neste tópico, você adquiriu certos aprendizados, como: • Piruvato, o produto da glicólise, é convertido a acetil-CoA, o material de partida para o ciclo do ácido cítrico, pelo complexo da piruvato-desidrogenase. • O complexo da PDH é composto por múltiplas cópias de três enzimas: piruvatodesidrogenase; di-hidrolipoil-transacetilase e di-hidrolipoil-desidrogenase. • O ciclo do ácido cítrico (ciclo de Krebs, ciclo do ácido tricarboxílico [TCA]) é uma via catabólica central e praticamente universal por meio da qual os compostos derivados da degradação de carboidratos, gorduras e proteínas são oxidados a CO2, com a maior parte da energia da oxidação temporariamente armazenada nos transportadores de elétrons FADH2 e NADH. • Durante o metabolismo aeróbio, esses elétrons são transferidos ao O2, e a energia do fluxo de elétrons é capturada na forma de ATP. • A acetil-CoA entra no ciclo do ácido cítrico (na mitocôndria de eucariotos, no citosol em bactérias) quando a citrato-sintase catalisa sua condensação com o oxaloacetato para a formação de citrato. • O ciclo do glioxilato está ativo nas sementes em germinação de algumas plantas e em certos microrganismos que conseguem viver utilizando acetato como a única fonte de carbono. • Nas plantas, essa via ocorre nos glioxissomos dos brotos. Ela inclui algumas enzimas do ciclo do ácido cítrico e duas enzimas adicionais: isocitrato-liase e malato-sintase. • No ciclo do glioxilato, o desvio das duas etapas de descarboxilação do ciclo do ácido cítrico torna possível a formação líquida de succinato, oxaloacetato e outros intermediários do ciclo do ácido cítrico a partir de acetil-CoA. O oxaloacetato formado deste modo pode ser utilizado para a síntese de glicose via gliconeogênese. 171 AUTOATIVIDADE 1 Indivíduos com dieta deficitária em tiamina têm níveis relativamente altos de piruvato na corrente sanguínea. Explique esse fenômeno em termos bioquímicos. 2 Como uma deficiência de riboflavina afetaria o funcionamento do ciclo do ácido cítrico? Explique. 3 Que fatores poderiam diminuir a quantidade de oxaloacetato disponível para a atividade do ciclo do ácido cítrico? Como o oxaloacetato pode ser reposto? 4 Pessoas com beribéri, doença causada pela deficiência de tiamina, apresentam níveis sanguíneos elevados de piruvato e a-cetoglutarato, especialmente após consumirem uma refeição rica em glicose. Como esses resultados se relacionam à deficiência de tiamina? 5 Com relação à respiração celular é correto afirmar que: a) ( ) A glicólise, que ocorre no espaço intermembranas devido à ação de enzimas específicas, rende um total de 2 ATP e 2 NADH. b) ( ) A descarboxilação oxidativa de um piruvato rende, no final da cadeia transportadora de elétrons, um total de 2,5 ATP. c) ( ) Os NADH produzidos durante a glicólise chegam até a matriz mitocondrial e rendem sempre um total de 2,5 ATP cada. d) ( ) Os complexos proteicos que participam da cadeia transportadora de elétrons são encontrados por toda a membrana interna da mitocôndria. e) ( ) No ciclo do ácido cítrico os NADH produzidos necessitam da ação de lançadeiras para que possam chegar até a matriz mitocondrial. 172 UNIDADE 3 TÓPICO 3 - METABOLISMO DE ÁCIDOS GRAXOS E TRIGLICERÍDEOS 1 INTRODUÇÃO A oxidação dos ácidos graxos de cadeia longa a acetil-CoA é uma via central de geração de energia em muitos organismos e tecidos. No coração e no fígado de mamíferos, por exemplo, ela fornece até 80% das necessidades energéticas em todas as circunstâncias fisiológicas. Os elétrons retirados dos ácidos graxos durante a oxidação passam pela cadeia respiratória, levando à síntese de ATP; a acetil-CoA produzida a partir dos ácidos graxos pode ser completamente oxidada a CO2 no ciclo do ácido cítrico, resultando em mais conservação de energia. Em algumas espécies e em alguns tecidos, a acetil-CoA tem destinos alternativos. No fígado, a acetil-CoA pode ser convertida em corpos cetônicos – combustíveis solúveis em água exportados para o cérebro e para outros tecidos quando glicose não está disponível. Em vegetais superiores, a acetilCoA serve principalmente de precursor biossintético, e apenas secundariamente como combustível. Embora o papel biológico da oxidação dos ácidos graxos varie de acordo com o organismo, o mecanismo é essencialmente o mesmo (NELSON; COX, 2014). O processo repetitivo de quatro etapas, chamado de b-oxidação, por meio do qual os ácidos graxos são convertidos em acetil-CoA é o item principal deste tópico. No Tópico 7 da Unidade 2, foram descritas as propriedades dos triacilgliceróis (também chamados de triglicerídeos ou gorduras neutras) que os tornam especialmente adequados como combustíveis de armazenamento. Vimos que seus ácidos graxos constituintes são essencialmente hidrocarbonetos, estruturas altamente reduzidas com uma energia de oxidação completa (38 kJ/g) mais de duas vezes maior que a produzida pelo mesmo peso de carboidratos ou proteínas. Essa vantagem é composta pela extrema insolubilidade dos lipídios em água; os triacilgliceróis celulares se agregam em gotículas lipídicas, que não aumentam a osmolaridade do citosol. As propriedades que tornam os triacilgliceróis compostos de armazenamento adequados, no entanto, apresentam problemas em seu papel como combustível. Por serem insolúveis em água, os triacilgliceróis ingeridos devem ser emulsificados antes que possam ser digeridos por enzimas hidrossolúveis no intestino, e os triacilgliceróis absorvidos no intestino ou mobilizados dos tecidos de armazenamento devem ser carregados no sangue ligados a proteínas que neutralizam a sua insolubilidade. Para superar a relativa estabilidade das ligações C-C em um ácido graxo, o grupo carboxil do C-1 é ativado pela ligação à coenzima A, que permite a oxidação gradativa do grupo acil graxo na posição C-3, ou b – daí o nome b-oxidação (RODWEL; MURRAY; GRANNER, 2017). 173 Este tópico iniciará com uma breve discussão sobre as fontes de ácidos graxos e sobre as vias pelas quais eles se deslocam até o seu sítio de oxidação, com ênfase especial no processo em vertebrados. Em seguida, descreve as etapas químicas da oxidação dos ácidos graxos nas mitocôndrias. A oxidação completa dos ácidos graxos a CO2 e H2O ocorre em três etapas: a oxidação dos ácidos graxos de cadeia longa a fragmentos de dois carbonos, na forma de acetil-CoA (b-oxidação); a oxidação de acetilCoA a CO2 no ciclo do ácido cítrico; e a transferência de elétrons dos transportadores de elétrons reduzidos à cadeia respiratória mitocondrial. Neste tópico, também será apresentada a primeira dessas etapas. A discussão sobre a b-oxidação inicia com o caso simples no qual um ácido graxo completamente saturado com um número par de átomos de carbono é degradado a acetil-CoA. Então são analisadas brevemente as transformações extras necessárias para a degradação de ácidos graxos insaturados e ácidos graxos com um número ímpar de carbonos. Finalmente, são discutidas as variações sobre o tema da b-oxidação nas organelas especializadas – peroxissomos e glioxissomos. O tópico é concluído com uma descrição de um destino alternativo para a acetil-CoA formada pela b-oxidação em vertebrados: a produção de corpos cetônicos no fígado. 2 DIGESTÃO, GORDURAS MOBILIZAÇÃO E TRANSPORTE DE As células podem obter combustíveis de ácidos graxos de três fontes: gorduras consumidas na dieta, gorduras armazenadas nas células como gotículas de lipídios e gorduras sintetizadas em um órgão para exportação a outro. Algumas espécies utilizam as três fontes sob várias circunstâncias, outras utilizam uma ou duas delas. Os vertebrados, por exemplo, obtêm gorduras na dieta, mobilizam gorduras armazenadas em tecidos especializados (tecido adiposo, consistindo em células chamadas adipócitos) e, no fígado, convertem o excesso dos carboidratos da dieta em gordura para a exportação aos outros tecidos. Em média, 40% ou mais das necessidades energéticas diárias das pessoas que vivem em países altamente industrializados são supridos pelos triacilgliceróis da dieta (embora a maioria das diretrizes nutricionais recomende que o consumo calórico diário de gorduras não ultrapasse 35%). Os triacilgliceróis fornecem mais da metade das necessidades energéticas de alguns órgãos, particularmente o fígado, o coração e a musculatura esquelética em repouso. Os triacilgliceróis armazenados são praticamente a única fonte de energia dos animais hibernantes e das aves migratórias. As plantas vasculares mobilizam gorduras armazenadas nas sementes durante a germinação, mas não dependem de gorduras para a obtenção de energia (NELSON; COX, 2014). 174 2.1 AS GORDURAS DA DIETA SÃO ABSORVIDAS NO INTESTINO DELGADO Nos vertebrados, antes que os triacilgliceróis possam ser absorvidos através da parede intestinal, eles precisam ser convertidos de partículas de gordura macroscópicas insolúveis em micelas microscópicas finamente dispersas. Para Nelson e Cox (2014, p. 668): Essa solubilização é realizada pelos sais biliares, como o ácido taurocólico, um ácido que é sintetizado a partir das moléculas de colesterol no fígado, armazenados na vesícula biliar e liberados no intestino delgado após a ingestão de uma refeição gordurosa. Os sais biliares são compostos anfipáticos que atuam como detergentes biológicos, convertendo as gorduras da dieta em micelas mistas de sais biliares e triacilgliceróis. A formação de micelas aumenta muito a fração das moléculas de lipídeo acessíveis à ação das lipases hidrossolúveis no intestino, e a ação das lipases converte os triacilgliceróis em monoacilgliceróis (monoglicerídeos) e diacilgliceróis (diglicerídeos), ácidos graxos livres e glicerol. Esses produtos da ação da lipase se difundem para dentro das células epiteliais que revestem a superfície intestinal (a mucosa intestinal), onde são reconvertidos em triacilgliceróis e empacotados com o colesterol da dieta e proteínas específicas em agregados de lipoproteínas chamados quilomícrons. FIGURA 15 – O PROCESSAMENTO DOS LIPÍDIOS DA DIETA EM VERTEBRADOS FONTE: Nelson e Cox (2014, p. 668) 175 As apolipoproteínas são proteínas de ligação a lipídios no sangue, responsáveis pelo transporte de triacilgliceróis, fosfolipídios, colesterol e ésteres de colesterol entre os órgãos. As apolipoproteínas (“apo” significa “destacado “ou “separado”, designando a proteína em sua forma livre de lipídios) se combinam com os lipídios para formar várias classes de partículas de lipoproteína, que são agregados esféricos com lipídios hidrofóbicos no centro e cadeias laterais hidrofílicas de proteínas e grupos polares de lipídios na superfície. Várias combinações de lipídios e proteínas produzem partículas de densidades diferentes, variando de quilomícrons e lipoproteínas de densidade muito baixa (VLDL) a lipoproteínas de densidade muito alta (VHDL), que podem ser separadas por ultracentrifugação (NELSON; COX, 2014). As porções proteicas das lipoproteínas são reconhecidas por receptores nas superfícies celulares. Na absorção de lipídios no intestino, os quilomícrons, que contêm a apolipoproteína C-II (apoC-II), deslocam-se da mucosa intestinal para o sistema linfático e então entram no sangue, que os carrega para os músculos e o tecido adiposo (Figura 15, etapa 5). Nos capilares desses tecidos, a enzima extracelular, lipase lipoproteica, ativada pela apoC-II, hidrolisa os triacilgliceróis em ácidos graxos e glicerol (etapa 6), absorvidos pelas células nos tecidos-alvo (etapa 7). No músculo, os ácidos graxos são oxidados para obter energia; no tecido adiposo, eles são reesterificados para armazenamento na forma de triacilgliceróis (etapa 8). Os remanescentes dos quilomícrons, desprovidos da maioria dos seus triacilgliceróis, mas ainda contendo colesterol e apolipoproteínas, se deslocam pelo sangue até o fígado, onde são captados por endocitose mediada pelos receptores específicos para as suas respectivas apolipoproteínas. Os triacilgliceróis que entram no fígado por essa via podem ser oxidados para fornecer energia ou precursores para a síntese de corpos cetônicos (abordaremos a seguir). Quando a dieta contém mais ácidos graxos do que o necessário imediatamente como combustível ou como precursores, o fígado os converte em triacilgliceróis, empacotados com apolipoproteínas específicas formando VLDL. As VLDL são transportadas pelo sangue até o tecido adiposo, onde os triacilgliceróis são removidos da circulação e armazenados em gotículas lipídicas dentro dos adipócitos (NELSON; COX, 2014). 2.2 HORMÔNIOS ATIVAM A TRIACILGLICERÓIS ARMAZENADOS MOBILIZAÇÃO DOS Os lipídios neutros são armazenados nos adipócitos (e nas células que sintetizam esteroides do córtex da suprarrenal, dos ovários e dos testículos) na forma de gotículas lipídicas, com um centro de ésteres de esteróis e triacilgliceróis envoltos por uma monocamada de fosfolipídios. A superfície dessas gotículas é revestida por perilipinas, família de proteínas que restringem o acesso às gotículas lipídicas, evitando a mobilização prematura dos lipídios. Berg, Tymoczko e Stryert (2015) relatam que, quando hormônios sinalizam a necessidade de energia metabólica, os triacilgliceróis armazenados no 176 0 tecido adiposo são mobilizados (retirados do armazenamento) e transportados aos tecidos (musculatura esquelética, coração e córtex renal) nos quais os ácidos graxos podem ser oxidados para a produção de energia. Os hormônios adrenalina e glucagon, secretados em resposta aos baixos níveis de glicose ou atividade iminente, estimulam a enzima adenilil ciclase na membrana plasmática dos adipócitos (Figura 17), que produz o segundo mensageiro intracelular AMP cíclico (cAMP). A proteína-cinase dependente de cAMP (PKA) leva a mudanças que abrem a gotícula de lipídeo para a atividade de três lipases, que atuam sobre tri-, di- e monoacilgliceróis, liberando ácidos graxos e glicerol. D AV I D L . N E L S O N & M I C H A E L M . COX FIGURA 16 – MOBILIZAÇÃO DOS TRIACILGLICERÓIS ARMAZENADOS NO TECIDO ADIPOSO Adenilil-ciclase Glucagon ❶ Receptor Gs ATP ❺ CGI CGI ATGL ❷ ❹ ❸ P ❻ Perilipina ❼ Diacilglicerol Transportador de ácidos graxos PKA CGI P Triacilglicerol cAMP P P P P P Lipase sensível a hormônio HSL ATP HSL ➒ Gotícula de lipídeo ➑ CO2 Albumina sérica Ácidos graxos Monoacilglicerol b oxidação, ciclo do ácido cítrico, cadeia respiratória Adipócito Miócito MGL Corrente sanguínea FONTE: Berg, Stryert 670) se(2015, associap.com a lipase sensível a hormônios fosforilada, pe RA 173 Mobilização dos triacilgliceróis armazenados noTymoczko tecido e rilada oso. Quando os baixos níveis de glicose no sangue ativam a liberação ucagon, ➊ o hormônio se liga ao seu receptor na membrana do adio e assim ➋ estimula a adenilil-ciclase, via uma proteína G, a produzir P. Isso ativa a PKA, que fosforila ➌ a lipase sensível a hormônio (HSL, de mone-sensitive lipase) e ➍ as moléculas de perilipina na superfície da goa lipídica. A fosforilação da perilipina causa a ➎ dissociação da proteína da perilipina. A CGI então se associa com a enzima triacilglicerol lipase no ócito (ATGL, de adipose triacylglycerol lipase), ativando-a. A triacilglicerol e ativada ➏ converte triacilgliceróis em diacilgliceróis. A perilipina fosfo- acesso à superfície da gotícula lipídica, onde ➐ ela hidrolisa os dia em monoacilgliceróis. Uma terceira lipase, a monoacilglicerol lipas monoacylglycerol lipase) ➑ hidrolisa os monoacilgliceróis. ➒ Os ác saem do adipócito, se ligam à albumina sérica no sangue e são dos no sangue; eles são liberados da albumina e ➓ entram em u por meio de um transportador específico de ácidos graxos. 11 No ácidos graxos são oxidados a CO2, e a energia da oxidação é cons ATP, que abastece a contração muscular e outros tipos de metab necessitam de energia no miócito. a glicerol-cinase (Figura 17-4), e o glicerol-3-fosfato ultante é oxidado a di-hidroxiacetona fosfato. A enzima olítica triose-fosfato-isomerase converte esse composto gliceraldeído-3-fosfato, que é oxidado na glicólise. condrial externa, as acil-CoA-sintetases, que cat reação geral 177 Ácido graxo 1 CoA 1 ATP ∆ acil-CoA graxo 1 AM NOTA Você sabia? Os ácidos graxos liberados passam dos adipócitos para o sangue, onde eles se ligam à albumina sérica. Ligados a essa proteína solúvel, os ácidos graxos são transportados aos tecidos como o músculo estriado esquelético, o coração e o córtex renal. Nesses tecidos alvos, os ácidos graxos se dissociam da albumina e são levados por transportadores da membrana plasmática para dentro das células para servir de combustível. Cerca de 95% da energia biologicamente disponível dos triacilgliceróis residem nas suas três cadeias longas de ácidos graxos; apenas 5% são fornecidos pela porção glicerol. O glicerol liberado pela ação da lipase é fosforilado pela glicerol-cinase, e o glicerol-3-fosfato resultante é oxidado a di-hidroxiacetona fosfato. 2.2.1 Oxidação dos ácidos graxos A oxidação dos ácidos graxos ocorre em três etapas (Figura 17). Na primeira etapa – b-oxidação –, os ácidos graxos sofrem remoção oxidativa de sucessivas unidades de dois carbonos na forma de acetil-CoA, começando pela extremidade carboxílica da cadeia acil-graxo. Por exemplo, o ácido palmítico de 16 carbonos passa sete vezes pela sequência oxidativa, perdendo dois carbonos como acetil-CoA em cada passagem. Ao final de sete ciclos, os dois últimos carbonos do palmitato permanecem como acetilCoA. O resultado global é a conversão da cadeia de 16 carbonos do palmitato em oito grupos acetil de dois carbonos das moléculas de acetil-CoA. A formação de cada acetilCoA requer a remoção de quatro átomos de hidrogênio (dois pares de elétrons e quatro H1) da porção acil-graxo pelas desidrogenases. Na segunda etapa da oxidação de ácidos graxos, os grupos acetil da acetil-CoA são oxidados a CO2 no ciclo do ácido cítrico, que também ocorre na matriz mitocondrial. A acetil-CoA derivada dos ácidos graxos então entra em uma via de oxidação final comum com a acetil-CoA derivada da glicose precedente da glicólise e da oxidação do piruvato. As duas primeiras etapas da oxidação dos ácidos graxos produzem os transportadores de elétrons reduzidos NADH e FADH2, que na terceira etapa doam elétrons para a cadeia respiratória mitocondrial, por meio da qual os elétrons passam para o oxigênio com a fosforilação concomitante de ADP a ATP (Figura 17). A energia liberada pela oxidação dos ácidos graxos é, portanto, conservada como ATP (NELSON; COX, 2014). 178 NOTA Curiosidade: Muitos animais dependem da gordura armazenada para obter energia durante a hibernação, em períodos migratórios e em outras situações envolvendo ajustes metabólicos radicais. Um dos ajustes mais pronunciados do metabolismo de gorduras ocorre nos ursospardos em hibernação. Esses animais permanecem em estado contínuo de dormência por períodos de até sete meses. Diferente da maioria das espécies hibernantes, o urso mantém a temperatura corporal entre 32 e 35 °C, próxima ao nível normal (não hibernando). Embora gaste aproximadamente 25.000 kJ/dia (6.000 kcal/dia), o urso não come, bebe, urina ou defeca por meses seguidos. Estudos experimentais mostraram que os ursos-pardos em hibernação utilizam a gordura corporal como seu único combustível. A oxidação das gorduras produz energia suficiente para manter a temperatura corporal, a síntese ativa de aminoácidos e proteínas e outras atividades que requerem energia, como o transporte de membrana. A oxidação das gorduras também libera grandes quantidades de água, que repõem a água perdida na respiração. O glicerol liberado pela degradação dos triacilgliceróis é convertido em glicose sanguínea pela gliconeogênese. A ureia formada durante a degradação de aminoácidos é reabsorvida nos rins e reciclada, os grupos aminos são reutilizados para produzir novos aminoácidos para manter as proteínas corporais. Os ursos armazenam uma enorme quantidade de gordura corporal quando em preparação para o seu longo sono. Um urso-pardo adulto consome cerca de 38.000 kJ/dia durante o final da primavera e o verão, mas à medida que o inverno se aproxima ele come durante 20 horas por dia, consumindo até 84.000 kJ por dia. Essa mudança na alimentação é uma resposta a uma mudança sazonal na secreção de hormônios. Grandes quantidades de triacilgliceróis são formadas a partir da grande ingestão de carboidratos durante o período de engorda. Outras espécies hibernantes, incluindo o minúsculo arganaz (camundongo silvestre), também acumulam grandes quantidades de gordura corporal. 2.2.2 Corpos cetônicos Em humanos, e na maior parte de outros mamíferos, o acetil-CoA formado no fígado durante a oxidação dos ácidos graxos pode entrar no ciclo do ácido cítrico (etapa 2 da Figura 18) ou sofrer conversão a “corpos cetônicos”, acetona, acetoacetato e D-b-hidroxibutirato, para exportação a outros tecidos. (O termo “corpos” é um artefato histórico; esse termo é ocasionalmente aplicado a partículas insolúveis, mas esses compostos são solúveis no sangue e na urina). A acetona, produzida em menor quantidade do que os outros corpos cetônicos, é exalada. O acetoacetato é transportado pelo sangue para outros tecidos que não o fígado (tecidos extra-hepáticos), onde são convertidos a acetil-CoA e oxidados no ciclo do ácido cítrico, fornecendo muita da energia necessária para tecidos como o músculo esquelético e cardíaco e o córtex renal. O cérebro, que usa preferencialmente glicose como combustível, pode se adaptar ao uso de acetoacetato em condições de jejum prolongado, quando a glicose não está 179 disponível. A produção e exportação dos corpos cetônicos do fígado para tecidos extrahepáticos permite a oxidação contínua de ácidos graxos no fígado quando acetil-CoA não está sendo oxidada no ciclo do ácido cítrico (RODWEL; MURRAY; GRANNER, 2017). PRINCÍPIOS DE BIOQUÍ FIGURA 17 – ETAPAS DA OXIDAÇÃO DE ÁCIDOS GRAXOS Etapa 1 CH3 na a posição da ligação dupla menclatura dos ácidos graxos ligação dupla tem configuraçã duplas nos ácidos graxos insa mente com frequência estão cado dessa diferença será ana Etapa 2 CH2 CH2 b Oxidação 8 Acetil-CoA CH2 CH2 CH2 CH2 (a) CH2 CH2 CH2 (C16 ) R Ciclo do ácido cítrico CH2 Acil-CoA-desidrogenase CH2 CH2 H 64e2 CH2 16CO2 CH2 C b CH2 CH2 R CH2 C O O] Enoil-CoA-hidratase 28e2 Etapa 3 NADH, FADH2 OH e2 R Cadeia respiratória (transferência de elétrons) ADP + Pi 2H+ + 21 O2 C C H b -hidroxiacil-CoA-desidrogenase H2O R ATP CH2 C C O FONTE: e de Coxácidos (2014, p. 673)Etapa 1: Um ácido FIGURA 177 Etapas da Nelson oxidação graxos. graxo de cadeia longa é oxidado para produzir resíduos de acetil na forma de acetil-CoA. Esse processo é chamado de b-oxidação. Etapa 2: Os grupos acetil são oxidados a CO2 no ciclo do ácido cítrico. Etapa 3: Os elétrons derivados das oxidações das etapas 1 e 2 passam ao O2 por meio da cadeia respiratória mitocondrial, fornecendo a energia para a síntese de ATP por fosforilação oxidativa. CH2 2.2.3 Corpos cetônicos são produzidos em excesso no (C ) R diabetes e durante o jejum 14 Acil-CoA-acetiltransferase (tiolase) CH2 C S-C O de ADP a ATP (Figuraque 17-7). A energia liberadamelito pela oxiNelson eteCox (2014) relatam jejum e diabetes não tratado leva Acil-CoA à (miristoil-CoA) dação dos ácidos graxos é, portanto, conservada como ATP. superprodução de corpos cetônicos, com vários problemas médicos associados. Durante Agora será analisada com mais atenção a primeira etapa o jejum, a gliconeogênese consome osgraxos, intermediários do com cicloodo ácido da oxidação dos ácidos começando caso sim-cítrico, desviando (b) acetil-CoA para aples produção de corpos cetônicos (Figura 18). No diabetes não tratado, de uma cadeia acil-graxo saturada com um número par C14 deinsulina carbonos, passando os casos um pouco mais quando o nível de é então insuficiente, ospara tecidos extra-hepáticos não podem captar C12 complexos das cadeias insaturadas ou de número ímpar. a glicose do sangue de maneira eficiente, para combustível ou para conservação como Também será abordada a regulação da oxidação de ácidos C gordura. Nessas condições, os níveis de malonil-CoA materialnas deoutras início para a síntese de 10 graxos, os processos b-oxidativos que(oocorrem ácidos graxos) caem, os ácidos graxos entram na mitocôndria para sermadegradado a acetil- C8 organelas que não na mitocôndria e, finalmente, duas 180 neiras menos comuns de catabolismo de ácidos graxos, a a-oxidação e a v-oxidação. C6 C4 Acetil -CoA Jejum e diabetes melito não tratado leva à superpro- armazenadas no tecido a dução de corpos cetônicos, com vários problemas mé- energia, também têm nív dicos associados. Durante o jejum, a gliconeogênese conso- sangue e na urina. Esses me os intermediários do ciclo do ácido cítrico, desviando evitar os riscos da acidos acetil-CoA para a produção corpos cetônicos (Figura CoA que não pode passar pelo ciclo do ácido de cítrico, já que os intermediários do ciclo foram 17-21). No diabetes não tratado, quando o nível de insulina RESUMO 17.3 Corpos c drenados para uso como substrato na gliconeogênese. O acúmulo resultante de acetil-CoA é insuficiente, os tecidos extra-hepáticos não podem captar c Os corpos acelera a formação de corpos cetônicos além daeficiente, capacidade oxidação dos tecidos extra-cetônicos a glicose do sangue de maneira parade combustível droxibutirato – são f ou para conservação como gordura. Nessas condições, os hepáticos. compostos servem c níveis de malonil-CoA (o material de início para a síntese de tra-hepáticos, por m ácidos graxos) caem, a inibição da carnitina-aciltransferase trada no ciclo do ácid O aumento dos níveis sanguíneos de acetoacetato diminui o pH do sangue, I é aliviada, e os ácidos graxos entram na mitocôndria para c A superprodução de ser degradado a acetil-CoA – que não passar pelo ciclo causando a condição conhecida como acidose. A pode acidose extrema pode levar ao coma do ácido cítrico, que os intermediários ciclo foram e em alguns casos à morte. Osjácorpos cetônicos nodo sangue e nadreurina de controlado indivíduosou na red pode levar à acidose nados para uso como substrato na gliconeogênese. O acúcom diabetes não tratado pode alcançar níveis extraordinários – uma concentração mulo resultante de acetil-CoA acelera a formação de corpos sanguínea de 90cetônicos mg/mL (comparado com ode nível normal 3 mg/100 além da capacidade oxidação dosdetecidos ex- ml) e excreção Termos-chave O aumento com dos níveis de de acetoaurinária de 5.000tra-hepáticos. mg/24h (comparado uma sanguíneos taxa normal #125 mg/24h). Essa termos em negrito es pH do sangue,utilizando cau- Osas cetatocetose. e D-b-hidroxibutirato condição é chamada Indivíduos emdiminui dietas ohipocalóricas, gorduras sando a condição conhecida como acidose. A acidose b-oxidação 667 armazenadas noextrema tecido adiposo como sua principal fonte de àenergia, também têm níveis pode levar ao coma e em alguns casos morte. Os quilomícron 669 elevados de corpos cetônicos no sangue e na urina. Esses níveis devem monitorados corpos cetônicos no sangue e na urina de indivíduos com serapolipoproteína 669 diabetes não tratado pode alcançar níveis extraordinários – 669 para evitar os riscos da acidose e da cetose (cetoacidose) (NELSON; COX, lipoproteína 2014). uma concentração sanguínea de 90 mg/mL (comparado perilipina 669 com o nível normal de , 3 mg/100 mL) e excreção urinária ácidos graxos livres 669 albumina sérica 669 FIGURA 18 – FORMAÇÃO DE CORPOS CETÔNICOS E EXPORTAÇÃO A PARTIR DO FÍGADO ciclo da carnitina 670 carnitina-aciltransferase I 671 Gotículas de lipídeos transportador-acil-carniti carnitina 671 carnitina-aciltransferase I Hepatócito 671 Acetoacetato, proteína trifuncional (TF D-b-hidroxibutirato, Acetoacetato e D-b674 acetona -hidroxibutirato, metilmalonil-CoA-mutase exportados como formação de 678 CoA corpos cetônicos Ácidos graxos fonte de energia para o coração, o músculo esquelético, o rim e o cérebro Acetil-CoA Oxaloacetato ciclo do ácido cítrico Glicose Gerais Boyer, P.D. (1983) The Enzy Academic Press, Inc., Sa b-oxidação gliconeogênese Leituras adicionais Glicose exportada como combustível para o cérebro e outros tecidos Ferry, G. (1998) Dorothy H Laboratory Press, Cold Sprin Biografia fascinante de u Gurr, M.I., Harwood, J.L., Biochemistry: An Introduc UK. Plutzky, J. (2009) The migh 618–619. Scheffler, I.E. (1999) Mito Excelente obra sobre a e FONTE: Nelson e Coxcetônicos (2014, p.e 687) FIGURA 1721 Formação de corpos exportação a partir do fígado. As condições que promovem a gliconeogênese (diabetes não Wood, P.A. (2006) How Fat tratado, redução na ingestão de alimento) desaceleram o ciclo do ácido cítriCambridge, MA. co (pelo consumo do oxaloacetato) e aumentam a conversão de acetil-CoA Relato muito legível, de Como podemos observar na figura apresentada, as condições promovem em acetoacetato. A coenzima A liberada permite a b-oxidação contínua de quecontribuições daagenética e d ácidos graxos. do metabolismo e ob gliconeogênese (diabetes não tratado, redução na ingestão de alimento) desaceleram lipídico o ciclo do ácido cítrico e aumentam a conversão de acetil-CoA em acetoacetato. 181 RESUMO DO TÓPICO 3 Neste tópico, você adquiriu certos aprendizados, como: • Os ácidos graxos dos triacilgliceróis fornecem uma grande fração da energia oxidativa nos animais. • Os triacilgliceróis da dieta são emulsificados no intestino delgado por sais biliares, hidrolisados pelas lipases intestinais, absorvidos pelas células epiteliais intestinais, reconvertidos em triacilgliceróis, e então transformados em quilomícrons pela combinação com apolipoproteínas específicas. • Os quilomícrons distribuem os triacilgliceróis aos tecidos, onde a lipase lipoproteica libera ácidos graxos livres para a entrada nas células. • Os triacilgliceróis armazenados no tecido adiposo são mobilizados por uma lipase de triacilglicerol sensível a hormônio. • Os ácidos graxos liberados se ligam à albumina sérica e são transportados no sangue para o coração, para musculatura esquelética e outros tecidos que utilizam ácidos graxos como combustíveis. • Uma vez dentro das células, os ácidos graxos são ativados na membrana mitocondrial externa pela conversão em tioésteres de acil-CoA graxos. • A acil-CoA graxo será oxidada entra na mitocôndria em três passos, pelo ciclo da carnitina. • Na primeira etapa da b-oxidação, quatro reações retiram cada unidade de acetil-Coa da extremidade carboxila de um acil-CoA graxo saturado. • Na segunda etapa da oxidação dos ácidos graxos, o acetil-Coa é oxidado a CO2 no ciclo do ácido cítrico. • Defeitos genéticos na acil-CoA-desidrogenase de cadeia média resulta em doenças humanas graves, assim como mutações em outros componentes do sistema de b-oxidação. • Os corpos cetônicos – acetona, acetoacetato e D-b-hidroxibutirato – são formados no fígado. Os dois últimos compostos servem como combustíveis nos tecidos extrahepáticos, por meio da oxidação a acetil-CoA e entrada no ciclo do ácido cítrico. • A superprodução de corpos cetônicos no diabetes não controlado ou na redução severa da ingestão de calorias pode levar à acidose ou cetose. 182 AUTOATIVIDADE 1 Um indivíduo desenvolveu uma condição caracterizada por fraqueza muscular progressiva e dolorosas cãibras musculares. Os sintomas foram agravados durante o jejum, exercício e dieta rica em gordura. O homogenato de uma amostra de músculo esquelético do paciente oxida oleato mais lentamente do que homogenatos controle, consistindo de amostras de músculo de indivíduos sadios. Quando carnitina foi adicionada ao homogenato de músculo do paciente, a taxa de oxidação do oleato se igualou a dos homogenatos controle. O paciente foi diagnosticado como portador de uma deficiência de carnitina. Nesse contexto, responda às seguintes questões: a) Por que a carnitina adicionada aumenta a taxa de oxidação do oleato no homogenato de músculo do paciente? b) Por que os sintomas do paciente se agravaram durante o jejum, o exercício e em dieta rica em gordura? c) Sugira duas razões possíveis para a deficiência de carnitina muscular desse indivíduo. 2 Suponha que você tivesse que sobreviver com uma dieta de gordura de baleia e foca, com pouco ou sem carboidrato. Nesse contexto, responda às seguintes questões a) Qual seria o efeito da privação de carboidrato na utilização de gordura para energia? b) Se a sua dieta fosse completamente ausente de carboidratos, seria melhor consumir ácidos graxos de cadeia par ou ímpar? Explique. 3 Quando o acetil-CoA produzido durante a b-oxidação no fígado excede a capacidade do ciclo do ácido cítrico, o excesso de acetil-CoA forma corpos cetônicos – acetona, acetoacetato e D-b-hidroxibutirato. Isso ocorre em diabetes grave não controlada: já que os tecidos não podem usar glicose, eles oxidam grandes quantidades de ácidos graxos. Apesar de acetil-CoA não ser tóxico, a mitocôndria deve desviar o acetil-CoA em corpos cetônicos. Qual problema surgiria se acetil-CoA não fosse convertido a corpos cetônicos? Como o desvio a corpos cetônicos soluciona esse problema? 183 184 UNIDADE 3 TÓPICO 4 - METABOLISMO DE AMINOÁCIDOS 1 INTRODUÇÃO Neste tópico serão abordados os aminoácidos que, por sua degradação oxidativa, contribuem significativamente para a produção de energia metabólica. A fração de energia metabólica obtida a partir de aminoácidos, sejam eles provenientes de proteínas da dieta ou de proteínas teciduais, varia muito de acordo com o tipo de organismo e com as condições metabólicas. Carnívoros obtêm (imediatamente após uma refeição) até 90% de suas necessidades energéticas da oxidação de aminoácidos, enquanto herbívoros obtêm apenas uma pequena fração de suas necessidades energéticas a partir dessa via. A maior parte dos microrganismos obtém aminoácidos a partir do ambiente e os utiliza como combustível quando suas condições metabólicas assim o determinarem. Plantas, no entanto, nunca ou quase nunca oxidam aminoácidos para produzir energia; em geral, os carboidratos produzidos a partir de CO2 e H2O na fotossíntese são sua única fonte de energia. As concentrações de aminoácidos nos tecidos vegetais são cuidadosamente reguladas para satisfazer às necessidades de biossíntese de proteínas, ácidos nucleicos e outras moléculas necessárias para o crescimento. O catabolismo dos aminoácidos não ocorre nas plantas, mas seu propósito é a produção de metabólitos para outras vias biossintéticas. Para Nelson e Cox (2014, p. 695), nos animais, os aminoácidos sofrem degradação oxidativa em três circunstâncias metabólicas diferentes: 1. Durante a síntese e a degradação normais de proteínas celulares, alguns aminoácidos liberados pela hidrólise de proteínas não são necessários para a biossíntese de novas proteínas, sofrendo degradação oxidativa. 2. Quando uma dieta é rica em proteínas e os aminoácidos ingeridos excedem as necessidades do organismo para a síntese proteica, o excesso é catabolizado; aminoácidos não podem ser armazenados. 3. Durante o jejum ou no diabetes melito não controlado, quando os carboidratos estão indisponíveis ou são utilizados de modo inadequado, as proteínas celulares são utilizadas como combustível. Em todas essas condições metabólicas, os aminoácidos perdem seu grupo amino para formar a-cetoácidos, os “esqueletos de carbono” dos aminoácidos. Os a-cetoácidos sofrem oxidação a CO2 e H2O ou, geralmente mais importante, fornecem unidades de três e quatro carbonos que podem ser convertidas, pela gliconeogênese, em glicose, o combustível para o cérebro, para o músculo esquelético e para outros tecidos (RODWEL; MURRAY; GRANNER, 2017). 185 As vias do catabolismo dos aminoácidos são bastante semelhantes na maioria dos organismos. O foco deste tópico concentra-se nas vias em vertebrados, pois essas vias têm recebido maior atenção por parte dos pesquisadores. Assim como no catabolismo dos carboidratos e dos ácidos graxos, os processos de degradação de aminoácidos convergem para vias catabólicas centrais, com os esqueletos de carbono da maioria dos aminoácidos encontrando uma via para o ciclo do ácido cítrico. Em alguns casos, as reações das vias de degradação dos aminoácidos representam etapas paralelas ao catabolismo dos ácidos graxos (NELSON; COX, 2014). Rodwel, Murray e Granner (2017) relatam que uma característica importante distingue a degradação dos aminoácidos de outros processos catabólicos descritos até aqui: todos os aminoácidos contêm um grupo amino, e as vias para a degradação dos aminoácidos incluem, portanto, uma etapa fundamental, na qual o grupo a-amino é separado do esqueleto de carbono e desviado para as vias do metabolismo do grupo amino (Figura 19). Serão discutidos inicialmente o metabolismo do grupo amino e a excreção do nitrogênio e, a seguir, o destino dos esqueletos de carbono derivados dos aminoácidos; ao longo deste estudo, será examinado de que modo essas vias estão interconectadas. Está curioso? Vamos começar. 6 96 D AV I D L . N E L S O N & M I C H A E L M . COX FIGURA 19 – VISÃO GERAL DO CATABOLISMO DOS AMINOÁCIDOS NOS MAMÍFEROS Proteínas intracelulares Proteínas da dieta Aminoácidos Esqueletos de carbono NH 4 Biossíntese de aminoácidos, nucleotídeos e aminas biológicas Carbamoil-fosfato Ciclo da ureia a-Cetoácidos Circuito do aspartato-arginino-succinato do ciclo do ácido cítrico Ureia (produto de excreção do nitrogênio) Ciclo do ácido cítrico Oxaloacetato Glicose (sintetizada na gliconeogênese) FIGURA 181 Visão geral Rodwel, do catabolismo aminoácidos nos p. mamíferos. Os grupos FONTE: Murraydos e Granner (2017, 589) amino e os esqueletos de carbono tomam vias separadas, porém interconectadas. 18.1 186 Destinos metabólicos dos grupos amino O nitrogênio, N , é abundante na atmosfera, mas é inerte te convertidos em intermediários do ciclo do ácido cítrico: glutamato e glutamina são convertidos em a-cetoglutarato, 2 DESTINOS METABÓLICOS DOS GRUPOS AMINOS O nitrogênio, N2, é abundante na atmosfera, mas é inerte para a utilização na maioria dos processos bioquímicos, pelo fato de que apenas poucos organismos conseguem converter o N2 em formas biologicamente úteis, como NH3, os grupos amino são cuidadosamente gerenciados nos sistemas biológicos. A Figura 21 fornece uma visão geral das vias catabólicas da amônia e dos grupos amino nos vertebrados. Os aminoácidos derivados das proteínas da dieta são a origem da maioria dos grupos amino. A maior parte dos aminoácidos é metabolizada no fígado. Parte da amônia gerada nesse processo é reciclada e utilizada em uma variedade de vias biossintéticas. O excesso é excretado diretamente ou convertido em ureia ou ácido úrico para excreção, dependendo do organismo. O excesso de amônia produzido em outros tecidos (extra-hepáticos) é enviado ao fígado (na forma de grupos amino, como descrito a seguir) para conversão em sua forma de excreção. Quatro aminoácidos desempenham papéis centrais no metabolismo do nitrogênio: glutamato, glutamina, alanina e aspartato. O lugar especial desses quatro aminoácidos no metabolismo do nitrogênio não é um acidente evolutivo (BERG; TYMOCZKO; STRYERT, 2015). 697 PRINCÍPIOS DE BIOQUÍMICA DE LEHNINGER FIGURA 20 – CATABOLISMO DOS GRUPOS AMINO Aminoácidos de proteínas ingeridas Fígado Proteínas celulares C C H O NH1 4 R R Amônia (como íon amônio) a-Cetoácidos Aminoácidos C O C CH2 CH2 CH2 CH2 a-Cetoglutarato a-Cetoglutarato H C H CH3 Alanina oriunda do músculo Animais amoniotélicos: a maior parte dos vertebrados aquáticos, como peixes ósseos e as larvas dos anfíbios Glutamato H 2N C C O Ureia CH3 Animais ureotélicos: muitos vertebrados terrestres; também os tubarões Piruvato C H Glutamina oriunda do músculo e de outros tecidos CH2 CH2 C O NH2 O O HN C NH2 O Glutamina C N H C C H N C O N H Ácido úrico ureia ou ácido úrico (a) FIGURA 182 Animais uricotélicos: aves e répteis FONTE: Berg, Tymoczko e Stryert (2015, p. 598) Catabolismo dos grupos amino. (a) Visão geral do catabolismo dos grupos amino (sombreados) no fígado de vertebrados. (b) Formas de excreção do nitrogênio. O excesso de NH14 é excretado como amônia (micróbios, peixes ósseos), ureia (maior parte dos vertebrados terrestres) ou (b) ácido úrico (aves e répteis terrestres). Observe que os átomos de carbono da ureia e do ácido úrico estão altamente oxidados; o organismo descarta carbonos apenas após extrair a maior parte da energia de oxidação disponível. 187 Esses aminoácidos, em especial, são aqueles mais facilmente convertidos em intermediários do ciclo do ácido cítrico: glutamato e glutamina que são convertidos em a-cetoglutarato; alanina em piruvato; e aspartato em oxaloacetato. Glutamato e glutamina são especialmente importantes, atuando como uma espécie de ponto de encontro para os grupos amino. No citosol das células do fígado (hepatócitos), os grupos amino da maior parte dos aminoácidos são transferidos para o a-cetoglutarato, formando glutamato, que entra na mitocôndria e perde seu grupo amino para formar NH4. O excesso de amônia produzido na maior parte dos demais tecidos é convertido no nitrogênio amídico da glutamina, que circula até chegar ao fígado, entrando na mitocôndria hepática. Glutamina, glutamato ou ambos estão presentes na maior parte dos tecidos em concentrações mais elevadas que os demais aminoácidos (NELSON; COX, 2014). No músculo esquelético, os grupos amino que excedem as necessidades geralmente são transferidos ao piruvato para formar alanina, outra molécula importante para o transporte de grupos amino até o fígado. A presente discussão começa com a degradação das proteínas da dieta e depois faz uma descrição geral dos destinos metabólicos dos grupos amino. 2.1 AS PROTEÍNAS DA DIETA SÃO ENZIMATICAMENTE DEGRADADAS ATÉ AMINOÁCIDOS Em humanos, a degradação das proteínas ingeridas até seus aminoácidos constituintes acontece no trato gastrintestinal. A chegada de proteínas da dieta ao estômago estimula a mucosa gástrica a secretar o hormônio gastrina, que por sua vez, estimula a secreção de ácido clorídrico pelas células parietais e de pepsinogênio pelas células principais das glândulas gástricas (Figura 22). A acidez do suco gástrico (pH 1,0 a 2,5) lhe permite funcionar tanto como antisséptico, matando a maior parte das bactérias e de outras células estranhas ao organismo, quanto como agente desnaturante, desenovelando proteínas globulares e tornando suas ligações peptídicas internas mais suscetíveis à hidrólise enzimática. O pepsinogênio (Mr 40.554), precursor inativo ou zimogênio, é convertido na pepsina ativa por meio de uma clivagem autocatalisada (clivagem mediada pelo próprio pepsinogênio) que ocorre apenas em pH baixo. No estômago, a pepsina hidrolisa as proteínas ingeridas, atuando em ligações peptídicas em que o resíduo de aminoácido localizado na porção aminoterminal provém dos aminoácidos aromáticos Phe, Trp e Tyr clivando cadeias polipeptídicas longas em uma mistura de peptídeos menores (NELSON; COX, 2014). À medida que o conteúdo ácido do estômago passa para o intestino delgado, o pH baixo desencadeia a secreção do hormônio secretina na corrente sanguínea. A secretina estimula o pâncreas a secretar bicarbonato no intestino delgado, para neutralizar o HCl (ácido clorídrico) gástrico, aumentando abruptamente o pH, que fica próximo a 7. 188 IMPORTANTE Todas as secreções pancreáticas chegam ao intestino delgado pelo ducto pancreático. A digestão das proteínas prossegue agora no intestino delgado. A chegada de aminoácidos na parte superior do intestino delgado (duodeno) determina a liberação para o sangue do hormônio colecistocinina, que estimula a secreção de diversas enzimas pancreáticas com atividades ótimas em pH 7 a 8. O tripsinogênio, o quimotripsinogênio e as procarboxipeptidases A e B – os zimogênios da tripsina, da quimotripsina e das carboxipeptidases A e B – são sintetizados e secretados pelas células exócrinas do pâncreas (Figura 21b ). O tripsinogênio é convertido em sua forma ativa, a tripsina, pela enteropeptidase, uma enzima proteolítica secretada pelas células intestinais. A tripsina livre catalisa então a conversão de moléculas adicionais de tripsinogênio em tripsina. A tripsina também ativa o quimotripsinogênio, as procarboxipeptidases e a proelastase (NELSON; COX, 2014). 189 698 D AV I D L . N E L S O N & M I C H A E L M . COX FIGURA 21 – PARTE DO TRATO DIGESTÓRIO HUMANO (a) Glândulas gástricas no revestimento do estômago Células parietais (secretam HCl) Células principais (secretam pepsinogênio) Mucosa gástrica (secreta gastrina) pH baixo Estômago Pepsinogênio Pepsina (b) Células exócrinas do pâncreas Pâncreas RE rugoso pH 7 Ducto coletor Zimogênios proteases ativas Ducto pancreático Intestino delgado Grânulos de zimogênio (c) Vilosidades do intestino delgado Vilosidade Mucosa intestinal (absorve aminoácidos) FONTE:humano. Nelson(a)e FIGURA 183 Parte do trato digestório (gastrintestinal) As células parietais e as células principais das glândulas gástricas secretam seus produtos em resposta ao hormônio gastrina. A pepsina inicia o processo de degradação das proteínas no estômago. (b) O citoplasma das células exócrinas é completamente preenchido pelo retículo endoplasmático rugoso, o sítio de síntese dos zimogênios e de muitas enzimas digestivas. Os zimogênios são concentrados em partículas de transporte circundadas por membranas, denominadas grânulos de zimogênios. Quando uma célula Cox (2014, p. 698) exócrina é estimulada, sua membrana plasmática funde-se com a membra- ções pancreáticas chegam ao intestino delgado pelo ducto pancreático.) A digestão das proteínas prossegue agora no tripsina, da quimotripsina e das carboxipeptidases A e B – são sintetizados e secretados pelas células exócrinas do na do grânulo de zimogênio e estes são liberados por exocitose no lúmen do ducto coletor. Os ductos coletores, por fim, levam ao ducto pancreático e daí ao intestino delgado. (c) Os aminoácidos são absorvidos pela camada de células epiteliais (mucosa intestinal) das vilosidades e chegam aos capilares. Lembre que os produtos da hidrólise dos lipídeos no intestino delgado, após sua absorção pela mucosa intestinal, entram no sistema linfático (ver Figura 17-1). Qual a razão para esse mecanismo elaborado ativar enzimas digestivas dentro do trato gastrintestinal? A síntese dessas enzimas como precursores inativos protege as células exócrinas do ataque proteolítico destrutivo. O pâncreas se protege ainda mais À medida que o conteúdo ácido do estômago passa para intestino delgado. A chegada de aminoácidos na parte supeda autodigestão da síntese de um rior inibidor específico, a proteína o intestino delgado,por o pHmeio baixo desencadeia a secreção do intestino delgado (duodeno) determinadenominada a liberação do hormônio secretina na corrente sanguínea. A secreti- para o sangue do hormônio colecistocinina, que estimula inibidor pancreático da tripsina, que previne efetivamente a produção prematura na estimula o pâncreas a secretar bicarbonato no intesti- a secreção de diversas enzimas pancreáticas com atividades de no delgado, para neutralizar o HCl gástrico, aumentando ótimas em pH 7 a 8. O tripsinogênio, o quimotripsinogêenzimas proteolíticas ativas dentro das células pancreáticas. abruptamente o pH, que fica próximo a 7. (Todas as secre- nio e as procarboxipeptidases A e B – os zimogênios da Para Nelson e Cox (2014, p. 699): Nelson_6ed_book.indb 698 190 A tripsina e a quimotripsina continuam a hidrólise dos peptídeos produzidos pela pepsina no estômago. Esse estágio da digestão proteica é realizado com grande eficiência, pois a pepsina, a tripsina e a quimotripsina apresentam especificidades distintas quanto aos 03/04/14 aminoácidos sobre os quais atuam. A degradação de pequenos peptídeos no intestino delgado é então completada por outras peptidases intestinais. Estas incluem as carboxipeptidases A e B (duas enzimas que contêm zinco), as quais removem resíduos sucessivos da extremidade carboxiterminal dos peptídeos e uma aminopeptidase, que hidrolisa resíduos sucessivos da extremidade aminoterminal de peptídeos pequenos. A mistura resultante de 07:45 aminoácidos livre é transportada para dentro das células epiteliais que revestem o intestino delgado através dos quais os aminoácidos entram nos capilares sanguíneos nas vilosidades e são transportados até o fígado. Nos humanos, a maior parte das proteínas globulares obtidas a partir de animais é hidrolisada quase completamente até aminoácidos no trato gastrintestinal, mas algumas proteínas fibrosas, como a queratina, são digeridas apenas parcialmente. Além disso, o conteúdo proteico de alguns alimentos obtidos a partir de vegetais está protegido contra a degradação por envoltórios não digeríveis de celulose. NOTA A pancreatite aguda é uma doença causada por obstrução da via normal pela qual as secreções pancreáticas chegam ao intestino. Os zimogênios das enzimas proteolíticas são prematuramente convertidos em suas formas cataliticamente ativas dentro das células pancreáticas e atacam o próprio tecido pancreático. Isso causa dores intensas e lesão ao órgão, o que pode ser fatal. 2.2 O GLUTAMATO LIBERA SEU GRUPO AMINO NA FORMA DE AMÔNIA Como já vimos, os grupos amino de muitos aminoácidos são coletados no fígado, na forma do grupo amino de moléculas de glutamato. Esses grupos amino devem ser removidos do glutamato e preparados para excreção. Nos hepatócitos, o glutamato é transportado do citosol para a mitocôndria, onde sofre desaminação oxidativa, catalisada pela L-glutamato-desidrogenase. Nos mamíferos, essa enzima está presente na matriz mitocondrial. É a única enzima que utiliza NAD1 ou NADP1 como aceptor de equivalentes redutores (Figura 22). A ação combinada de uma aminotransferase e da glutamato-desidrogenase é conhecida como transdesaminação. Uns poucos aminoácidos contornam a via de transdesaminação e sofrem diretamente desaminação oxidativa. O a-cetoglutarato formado a partir da desaminação do glutamato pode ser utilizado no ciclo do ácido cítrico e para a síntese de glicose (RODWEL; MURRAY; GRANNER, 2017). A glutamato-desidrogenase opera em uma importante intersecção do metabolismo do carbono e do nitrogênio. Essa enzima alostérica, com seis subunidades idênticas, tem sua atividade influenciada por um arranjo complicado de moduladores alostéricos. Os mais bem estudados são o modulador positivo ADP e o modulador negativo GTP (RODWEL; MURRAY; GRANNER, 2017). 191 702 D AV I D L . N E L S O N & M I C H A E L M . COX FIGURA 22 – REAÇÃO CATALISADA PELA GLUTAMATO-DESIDROGENASE COO2 1 H3N C H CH2 CH2 COO2 OOC CH2 CH NAD(P) 1 Glutamina-sintetase NAD(P)H Glutamato COO2 1 H2N C CH2 CH2 O CH2 CH2 O P O C CH2 CH O COO2 COO2 C O O Glutamina-sintetase H2O NH1 4 COO2 O C CH2 CH H 2N a-Cetoglutarato FONTE: Rodwel, Murraypela e Granner (2017, p. 604) FIGURA 187 Reação catalisada glutamato-desidrogenase. A glutamato-desidrogenase do fígado de mamíferos tem a capacidade incomum de utilizar tanto NAD1 quanto NADP1 como cofator. As glutamato-desidrogenases de plantas e microrganismos normalmente são específicas para um ou outro desses aceptores de elétrons. A enzima dos mamíferos é regulada alostericamente por GTP e ADP. 2.3 A GLUTAMINA TRANSPORTA A AMÔNIA NA CORRENTE SANGUÍNEA Glutaminase (mitocôndria hepática) O zãoémetabólica essepara padrão regulação ainda não foi A amônia bastante para tóxica os de tecidos animais (posteriormente serão C CH2 CH2 esclarecida em detalhe. Mutações que alterem o sítio alosexaminadas algumas possíveis razões para essa toxicidade) e seus níveis no sangue térico para a ligação do GTP ou que causem ativação perO são regulados. Em muitos tecidos, incluindo o cérebro, alguns processos, como a manente da glutamato-desidrogenase levam a uma doença genética humana, denominada síndrome do hiperinsulinisdegradação de nucleotídeos, geram amônia livre. Na maioria dos animais, FIGURA a maior parte 188 Transporte de amôn mo com hiperamonemia, caracterizada por níveis elevados dessa amônia livre é convertida em um composto não tóxico antes de ser so deexportada amônia nos tecidos é adicionad de amônia na corrente sanguínea e hipoglicemia. processo catalisado pela glutaminados tecidos extra-hepáticos para o sangue e transportada até o fígado ou até os rins. corrente sanguínea, a glutamina entra Para essa funçãoAde transporte, o glutamato, essencial para o metabolismo intracelular côndria pela enzima glutaminase. glutamina transporta a amônia na corrente do grupo amino é substituído pela L-glutamina. A amônia livre produzida nos tecidos sanguínea combina-se comAoamônia glutamato, produzindo glutamina, pela ação da glutamina-sintetase. é bastante tóxica para os tecidos animais (poste- A glutamina é uma forma de Essa reação requer ATP e ocorre em duas etapas (Figura 23).razões Inicialmente, o glutamato e amônia; ela normalmente est riormente serão examinadas algumas possíveis para centrações muito maiores qu essa toxicidade) seus níveis no sangue são regulados. que o ATP reagem para formar ADP e eum intermediário g-glutamil-fosfato, então reage Em muitos glutamina tecidos, incluindo o cérebro, alguns processos, com a amônia, produzindo e fosfato inorgânico (NELSON; COX, glutamina 2014). também serve com 192 como a degradação de nucleotídeos, geram amônia livre. Na maioria dos animais, a maior parte dessa amônia livre é convertida em um composto não tóxico antes de ser exportada dos tecidos extra-hepáticos para o sangue e transportada até o fígado ou até os rins. Para essa função de transporte, o glutamato, essencial para o metabolismo intracelular do grupo amino, é substituído pela L-glutamina. A amônia livre produzida nos tecidos combina-se com o glutamato, produzindo glutamina, pela ação da glutamina-sintetase. Essa reação requer ATP e ocorre em duas etapas (Figura 188). Inicialmente, o glutamato e o ATP reagem para formar ADP e um intermediário g-glutamil-fosfato, que então reage com a amônia, produzindo glutamina e fosfato inorgânico. várias reações biossintéticas contrada em todos os organi do um papel metabólico cent enzima serve como via de en fixado em sistemas biológico da glutamina-sintetase no m Capítulo 22.) Na maioria dos animais te cede as necessidades de bio sangue para o intestino, o fíga sada. Nesses tecidos, o nitrog íon amônio na mitocôndria, converte glutamina em gluta O N & M I C H A E L M . COX FIGURA 23 – TRANSPORTE DE AMÔNIA NA FORMA DE GLUTAMINA NH3 OOC CH2 CH2 CH COO L-Glutamato NAD(P) 1 ATP Glutamina-sintetase NAD(P)H ADP COO2 1 H2N C CH2 O O O P O NH3 C CH2 CH2 CH g-Glutamil-fosfato O CH2 COO2 NH4 Glutamina-sintetase Pi H2O NH1 4 NH3 O C CH2 CH2 CH COO H 2N L-Glutamina sada pela glutamato-desidrogenase. A ígado de mamíferos tem a capacidade incoquanto NADP1 como cofator. As glutamatomicrorganismos normalmente são específicas tores de elétrons. A enzima dos mamíferos é GTP e ADP. e padrão de regulação ainda não foi Mutações que alterem o sítio alosGTP ou que causem ativação perdesidrogenase levam a uma doença minada síndrome do hiperinsulinis, caracterizada por níveis elevados anguínea e hipoglicemia. a a amônia na corrente A COO Glutaminase (mitocôndria hepática) H2O Ureia NH4 NH3 O C CH2 CH2 CH COO O L-Glutamato FONTE: Nelson e Coxna(2014, p. glutamina. 703) Transporte de amônia forma de O excesso de amônia nos tecidos é adicionado ao glutamato para formar glutamina, processo catalisado pela glutamina-sintetase. Após ser transportada pela corrente sanguínea, a glutamina entra no fígado e NH41 é liberado na mitoglutamina é pela uma forma de transporte não tóxico para côndria enzima glutaminase. FIGURA 188 a amônia; ela normalmente está presente no sangue em concentrações muito maiores que os demais aminoácidos. A glutamina também fonte de grupos A glutamina é umaserve formacomo de transporte não tóxico amino para a em várias reações ica para os tecidos animais (posteamônia; ela normalmente está presente no sangue em conadas algumas possíveis razões para biossintéticas. A glutamina-sintetase é encontrada em todos os organismos, sempre s níveis no sangue são regulados. centrações muito maiores que os demais aminoácidos. A desempenhando um papel metabólico central. Nos microrganismos, uindo o cérebro, alguns processos, glutamina também serve como fonte de grupos amino em essa enzima serve reaçõesdo biossintéticas. glutamina-sintetase encomo via livre. de entrada essencial nitrogênio Afixado em sistemasébiológicos. ucleotídeos, geram amônia Na várias aior parte dessa amônia livre é cono não tóxico antes de ser exportada icos para o sangue e transportada ns. Para essa função de transporte, ara o metabolismo intracelular do do pela L-glutamina. A amônia livre ombina-se com o glutamato, produção da glutamina-sintetase. Essa orre em duas etapas (Figura 18mato e o ATP reagem para formar g-glutamil-fosfato, que então reage do glutamina e fosfato inorgânico. contrada em todos os organismos, sempre desempenhando um papel metabólico central. Nos microrganismos, essa Na maioria dos animais terrestres, a glutamina que excede as enzima serve como via de entrada essencial do nitrogênio necessidades de biossíntese é transportada pelo sangue para o fixado em sistemas biológicos. (Os papéis da glutamina e intestino, o fígado e os rins, para processada. Nesses tecidos, o da glutamina-sintetase no metabolismo são ser discutidos no nitrogênio amídico é liberado como íon amônio na mitocôndria, onde Capítulo 22.) a enzima converte glutamina Na maioria dosglutaminase animais terrestres, a glutamina queem ex-glutamato e NH4 1. O do intestino dos rins é transportado nopelo sangue para o fígado. No cede asNH4 necessidades de ebiossíntese é transportada a amôniao de todas essas utilizada na síntese da ureia. sangue fígado, para o intestino, fígado e os rins, fontes para seré procesPartetecidos, do glutamato produzido reação como da glutaminase pode ser sada. Nesses o nitrogênio amídicona é liberado adicionalmente processado no fígado pela glutamato-desidrogenase, íon amônio na mitocôndria, onde a enzima glutaminase 1 18-8). O converte glutaminamais em glutamato NH4 (Figura esqueletos liberando amônia ee produzindo de carbono para utilização como combustível. Contudo, a maior parte do glutamato entra em reações de transaminação necessárias para a biossíntese de aminoácidos e para outros processos (NELSON; COX, 2014, p. 703). 193 NOTA Você sabia? Na acidose metabólica há um aumento do processamento da glutamina pelos rins. Nem todo o excesso de NH4 assim produzido é liberado para a corrente sanguínea ou convertido em ureia; parte é excretado diretamente na urina. No rim, o NH4 forma sais com ácidos metabólicos, facilitando sua remoção na urina. O bicarbonato produzido pela descarboxilação do a-cetoglutarato no ciclo do ácido cítrico também pode funcionar como tampão no plasma sanguíneo. Tomados em conjunto, esses efeitos do metabolismo da glutamina no rim tendem a contrabalançar a acidose. 2.4 A ALANINA TRANSPORTA A AMÔNIA DOS MÚSCULOS ESQUELÉTICOS PARA O FÍGADO A alanina também desempenha um papel especial no transporte dos grupos amino para o fígado em uma forma não tóxica, por meio de uma via denominada ciclo da glicose-alanina (Figura 24). No músculo e em alguns outros tecidos que degradam aminoácidos como combustíveis, os grupos amino são coletados na forma de glutamato, por transaminação. O glutamato pode ser convertido em glutamina para transporte ao fígado, como descrito anteriormente, ou pode transferir seu grupo a-amino para o piruvato, produto da glicólise muscular facilmente disponível, pela ação da alanina-aminotransferase. A alanina produzida passa para o sangue e segue para o fígado. No citosol dos hepatócitos, a alanina-aminotransferase transfere o grupo amino da alanina para o a-cetoglutarato, formando piruvato e glutamato. O glutamato entra na mitocôndria, onde a reação da glutamato-desidrogenase libera NH4 ou sofre transaminação com o oxaloacetato para formar aspartato, outro doador de nitrogênio para a síntese de ureia (NELSON; COX, 2014). A utilização de alanina para o transporte da amônia dos músculos esqueléticos para o fígado é outro exemplo da economia intrínseca dos organismos vivos. Os músculos esqueléticos em contração vigorosa operam anaerobiamente, produzindo piruvato e lactato pela glicólise, assim como amônia pela degradação proteica. De algum modo, esses produtos devem chegar ao fígado, onde o piruvato e o lactato são incorporados na glicose, que volta aos músculos, e a amônia é convertida em ureia para excreção. O ciclo da glicose-alanina, em conjunto com o ciclo de Cori, realiza essa operação. O custo energético da gliconeogênese é assim imposto ao fígado e não ao músculo, e todo o ATP disponível no músculo é destinado à contração muscular (NELSON; COX, 2014). 194 PRINCÍPIOS DE BIOQUÍMICA DE LEHNINGER 703 FIGURA 24 – O CICLO DA GLICOSE-ALANINA rins é transportado no sangue para mônia de todas essas fontes é utilia. Parte do glutamato produzido na pode ser adicionalmente processamato-desidrogenase, liberando mais squeletos de carbono para utilização ntudo, a maior parte do glutamato transaminação necessárias para a cidos e para outros processos (Ca- bólica (p. 688), há um aumento do a glutamina pelos rins. Nem todo o produzido é liberado para a corrente o em ureia; parte é excretado direta1 o NH4 forma sais com ácidos metaa remoção na urina. O bicarbonato oxilação do a-cetoglutarato no ciclo m pode funcionar como tampão no ados em conjunto, esses efeitos do ina no rim tendem a contrabalançar Proteína muscular Aminoácidos Músculo Glicose 1 NH4 Glicólise Piruvato Glutamato Alanina-aminotransferase a-Cetoglutarato Alanina Alanina sanguínea Glicose sanguínea Fígado Alanina a-Cetoglutarato Alanina-aminotransferase amônia dos músculos ado Glutamato Glicose Gliconeogênese Piruvato mpenha um papel especial no transNH1 4 o para o fígado em uma forma não a via denominada ciclo da glicoseCiclo da ureia 9). No músculo e em alguns outros aminoácidos como combustível, os Ureia tados na forma de glutamato, por FONTE: Nelson e Cox (2014, p.funciona 703) como trans18-2a). O glutamato pode ser con- FIGURA 189 O ciclo da glicose-alanina. A alanina portadora de amônia e do esqueleto de carbono do piruvato do músculo ara transporte ao fígado, como despode transferir seu grupo a-amino esquelético até o fígado. A amônia é excretada, e o piruvato é utilizado para produzir glicose, que é devolvida ao músculo. to da glicólise muscular facilmente a alanina-aminotransferase (Fissim produzida passa para o sangue No citosol dos hepatócitos, a alanina- A amônia é tóxica para os animais A produção catabólica decatabólica amônia impõe um sério A produção de amônia impõe umproblema sério pro- bioquímico, por ser sfere o grupo amino da alanina para blema bioquímico, ser muito não tóxica. A base moletóxica. base molecular para essapor toxicidade é completamente compreendida. mando piruvato emuito glutamato. OA glupara essa toxicidade não é completamente compreenmitocôndria, onde aestágios reação dafinais glu- dacular Os intoxicação por amônia em humanos são caracterizados por indução 1 libera NH4 (Figura 18-7), ou sofre dida. Os estágios finais da intoxicação por amônia em deformar um estado de coma, acompanhado por edema cerebral (aumento humanos são caracterizados por indução de um estado deno conteúdo de água xaloacetato para aspartato, coma, por edema cerebral (aumento conênio para a síntese ureia. e aumento dodecérebro) daacompanhado pressão intracraniana, de modo que no pesquisas e especulações nina para o transporte da amônia teúdo de água do cérebro) e aumento da pressão intracraemé torno da intoxicação amônia sido focalizadas nesse tecido niana,por de modo quetêm pesquisas e especulações em torno da (RODWEL; MURRAY; icos para o fígado outro exemplo dos organismosGRANNER, vivos. Os músculos 2017). intoxicação por amônia têm sido focalizadas nesse tecido. ção vigorosa operam anaerobiamen- As especulações centralizam-se em uma possível depleção e lactato pela glicólise, assim como do ATP nas células do cérebro. As especulações centralizam-se emauma possível depleção do ATP nas células A amônia facilmente cruza barreira hematoencefálica, ão proteica. De algum modo, esses de modo que qualquer condição que aumente os níveis de r ao fígado, ondedo o piruvato e o laccérebro. A amônia facilmente cruza a barreira hematoencefálica, de modo que na glicose, que volta aos músculos, amônia na circulação sanguínea também exporá o cérebro a qualquer condição que aumente os níveis de amônia na circulação sanguínea também da em ureia para excreção. O ciclo altas concentrações. O cérebro em desenvolvimento é mais suscetível aos efeitos deletérios do íon que o céreconjunto com oexporá ciclo deo Cori (ver a altas cérebro concentrações. O cérebro emamônio desenvolvimento é mais suscetível 3-19), realiza essa operação. O custo bro adulto. Os danos causados pela toxicidade do amônio aos efeitos deletérios do íon amônio que o cérebro adulto. Os danos causados pela gênese é assim imposto ao fígado e incluem perda de neurônios, alteração na formação de sitoxicidade amônio incluem perdageral de neurônios, alteração na ceformação de sinapses napses e deficiência no metabolismo energético o ATP disponível no músculo do é desA remoção do excesso de amônia presente no citosol cular. e deficiência geral lular. no metabolismo energético celular (RODWEL; MURRAY; GRANNER, 2.5 A AMÔNIA É TÓXICA PARA OS ANIMAIS 2017). 195 2.6 EXCREÇÕES DE NITROGÊNIO E CICLO DA UREIA Se não forem reutilizados para a síntese de novos aminoácidos ou de outros produtos nitrogenados, os grupos amino são canalizados em um único produto de excreção. A maioria das espécies aquáticas, como os peixes ósseos, é amoniotélica e excreta o nitrogênio amínico como amônia. A amônia tóxica é simplesmente diluída na água do ambiente. Os animais terrestres necessitam de vias para a excreção do nitrogênio que minimizem a toxicidade e a perda de água. A maior parte dos animais terrestres é ureotélica e excreta o nitrogênio amínico na forma de ureia; aves e répteis são uricotélicos, excretando o nitrogênio amínico como ácido úrico (NELSON; COX, 2014). As plantas reciclam praticamente todos os grupos amino, e a excreção de nitrogênio ocorre apenas em circunstâncias muito incomuns. Nos organismos ureotélicos, a amônia depositada na mitocôndria dos hepatócitos é convertida em ureia no ciclo da ureia. Essa via foi descoberta em 1932, por Hans Krebs (que mais tarde também descobriu o ciclo do ácido cítrico) e seu colaborador, Kurt Henseleit, estudante de medicina. A produção de ureia ocorre quase exclusivamente no fígado, sendo o destino da maior parte da amônia canalizada para esse órgão. A ureia passa para a circulação sanguínea e chega aos rins, sendo excretada na urina (RODWEL; MURRAY; GRANNER, 2017). A produção de ureia será o foco da nossa discussão. 2.7 A UREIA É PRODUZIDA A PARTIR DA AMÔNIA O ciclo da ureia inicia dentro da mitocôndria hepática, mas três de suas etapas seguintes ocorrem no citosol; o ciclo abrange dois compartimentos celulares. O primeiro grupo amino que entra no ciclo da ureia é derivado da amônia na matriz mitocondrial – a maior parte desses NH4 é fornecida pelas vias descritas anteriormente. O fígado também recebe parte da amônia pela veia porta, sendo essa amônia produzida no intestino pela oxidação bacteriana de aminoácidos. Qualquer que seja sua fonte, o NH4 presente na mitocôndria hepática é utilizado imediatamente, juntamente ao CO2 produzido pela respiração mitocondrial, para formar carbamoil-fosfato na matriz (Figura 25). Essa reação é dependente de ATP, sendo catalisada pela carbamoil-fosfato-sintetase I, enzima regulatória (RODWEL; MURRAY; GRANNER, 2017). 196 Contudo, cada ciclo opera independentemente e a comunicação entre eles depende do transporte de intermediários-chave entre a mitocôndria e o citosol. Os principais transportadores na membrana interna da mitocôndria incluem o transportador malato-a-cetoglutarato, o transportador glutamato-aspartato e o transportador glutamato-OH . Jun- ocorre via um intermediário citrulil-AMP (Figura 18-11b). O arginino-succinato é então clivado pela arginino-succinase (etapa ➌ na Figura 18-10), formando arginina e fumarato; este último é convertido em malato e a seguir entra na mitocôndria para unir-se aos intermediários do ciclo do ácido cítrico. Esse passo é a única reação reversível do ciclo da FIGURA 25 – REAÇÕES QUE CAPTAM NITROGÊNIO NO CICLO DA UREIA ADP O ADP O O – P O –O C OH ❶ O ATP O C – O bicarbonato é fosforilado pelo ATP. O OH NH3 Anidrido carbônico-ácido fosfórico (a) O – O P O O – O P O – (b) O O O ATP C PPi + (CH2)3 H C + NH3 COO– Citrulina ❶ Um rearranjo leva à adição de AMP, ativando o oxigênio da carbonila da citrulina. AMP O C H2N + NH3 COO– Citrulil-AMP Aspartato C O O O + NH2 C AMP ❷ A adição de aspartato é facilitada pelo deslocamento do AMP. O– P – Carbamoil-fosfato H COO– (CH2)3 C C CH2 NH H ❸ O H2N COO– NH2 NH ADP – O carbamato é fosforilado, produzindo carbamoilfosfato. : P O Carbamato + : –O C A amônia desloca o grupo fosforila, gerando carbamato. NH2 O H2N ❷ Adenosina ATP O : Bicarbonato – P O Pi O O – NH N H COO– C H CH2 (CH2)3 COO– H C + NH3 COO– Arginino-succinato vras, essa reação apresenta dois passos de ativação (➊ e ➌). Mecanismo da MECANISMO FIGURA 1811 Reações que captam nitrogênio no ci- e Granner FONTE: Rodwel, Murray (2017, p. 617) carbamoil-fosfato sintetase (b) Na reação catalisada pela arginino-succinaclo da ureia. Os átomos de nitrogênio da ureia são obtidos por meio de duas reações que necessitam de ATP. (a) Na reação catalisada pela carbato-sintetase, o segundo nitrogênio entra no ciclo, a partir do aspartato. A moil-fosfato-sintetase I, entra o primeiro átomo de nitrogênio, sob a forma ativação do oxigênio do grupo ureído da citrulina no passo ➊ prepara o de amônia. Os grupos fosfato terminais de duas moléculas de ATP são uticomposto para a adição do aspartato, no passo ➋. Mecanismo da argininolizados para formar uma molécula carbamoil-fosfato. Em outras pala- que: -succinato sintetase Nelson e Coxde(2014, p. 706) relatam Nelson_6ed_book.indb 706 O carbamoil-fosfato, que funciona como doador ativado de grupos carbamoila, entra no ciclo da ureia. O ciclo tem apenas quatro etapas enzimáticas. Primeiro, o carbamoil--fosfato doa seu grupo carbamoila para a ornitina, formando citrulina, com a liberação de Pi (etapa 1). A reação é catalisada pela ornitina-transcarbamoilase. A ornitina não é um dos 20 aminoácidos encontrados nas proteínas, mas é um intermediário-chave no metabolismo do nitrogênio. Ela é sintetizada a partir do glutamato. A ornitina desempenha um papel que se assemelha àquele do oxaloacetato no ciclo do ácido cítrico, aceitando material a cada volta do ciclo da ureia. A citrulina produzida no primeiro passo do ciclo da ureia passa da mitocôndria para o citosol. Os próximos dois passos trazem o segundo grupo amino. A fonte é o aspartato produzido na mitocôndria por transaminação e transportado para o citosol. A reação de condensação entre o grupo amino do aspartato e o grupo ureído (carbonila) da citrulina forma arginino-succinato (etapa 2). Essa reação citosólica, catalisada pela arginino-succinato-sintetase, requer ATP e ocorre via um intermediário citrulil-AMP. O arginino-succinato é então clivado pela arginino-succinase (etapa 3), formando arginina e fumarato; este último é convertido em malato e a seguir entra na mitocôndria para unir-se aos intermediários do ciclo do ácido cítrico. Esse passo é a única reação reversível do ciclo da ureia. Na última etapa do ciclo (etapa 4), a enzima citosólica arginase cliva a arginina, produzindo ureia e ornitina. A ornitina é transportada para a mitocôndria para iniciar outra volta do ciclo da ureia. 03/04/14 07 197 2.8 DEFEITOS GENÉTICOS DO CICLO DA UREIA PODEM SER FATAIS Pessoas com defeitos genéticos em qualquer das enzimas envolvidas na formação de ureia não toleram dietas ricas em proteína. Os aminoácidos ingeridos em excesso, além das necessidades mínimas diárias para a síntese proteica, são desaminados no fígado, produzindo amônia livre, que não pode ser convertida em ureia para ser exportada para a corrente sanguínea e, como já foi frisado, a amônia é altamente tóxica. A ausência de uma enzima do ciclo da ureia pode resultar em hiperamonemia ou no aumento de um ou mais intermediários do ciclo da ureia, dependendo da enzima que estiver faltando. Uma vez que a maioria das etapas do ciclo da ureia é irreversível, a ausência de uma atividade enzimática frequentemente pode ser identificada pela determinação de qual intermediário do ciclo está presente em concentrações especialmente altas no sangue e/ou na urina. Embora a degradação dos aminoácidos possa apresentar sérios problemas para a saúde das pessoas com deficiências no ciclo da ureia, uma dieta desprovida de proteínas não é uma opção de tratamento. Humanos são incapazes de sintetizar metade dos vinte aminoácidos proteicos, e esses aminoácidos essenciais devem estar presentes na dieta (NELSON; COX, 2014). Uma variedade de tratamentos é disponibilizada para pessoas com defeitos no ciclo da ureia. A administração cuidadosa na dieta dos ácidos aromáticos benzoato ou fenilbutirato pode ajudar a diminuir os níveis de amônia no sangue. 2.9 VIAS DE DEGRADAÇÃO DOS AMINOÁCIDOS As vias do catabolismo dos aminoácidos, em conjunto, representam normalmente apenas 10 a 15% da produção de energia no organismo humano; essas vias são bem menos ativas que a glicólise e a oxidação dos ácidos graxos. O fluxo, ao longo das vias catabólicas, também varia muito, dependendo do equilíbrio entre as necessidades para processos biossintéticos e a disponibilidade de determinado aminoácido. As 20 vias catabólicas convergem para formar apenas seis produtos principais, os quais podem entrar no ciclo do ácido cítrico (Figura 26). Desse ponto, os esqueletos de carbono tomam vias distintas, sendo direcionados para a gliconeogênese ou para a cetogênese, ou oxidados completamente a CO2 e H2O (BERTUZZI et al., 2008). Sete dos aminoácidos podem ter seus esqueletos de carbono, total ou parcialmente, degradados para produzir acetil-CoA. Cinco aminoácidos são convertidos em a-cetoglutarato, quatro em succinil-CoA, dois em fumarato e dois em oxaloacetato. Seis aminoácidos têm seu esqueleto carbonado, total ou parcialmente, convertido em piruvato, o qual pode ser transformado em acetil-CoA ou em oxaloacetato (NELSON; COX, 2014). 198 PRINCÍPIOS DE BIOQUÍMICA DE LEHNINGER 7 FIGURA 26 – RESUMO DO CATABOLISMO DOS AMINOÁCIDOS Leucina Lisina Fenilalanina Triptofano Tirosina Glutamato Corpos cetônicos a -Cetoglutarato Isocitrato Acetoacetil-CoA Ciclo do ácido cítrico Citrato Arginina Glutamina Histidina Prolina Succinil-CoA Isoleucina Metionina Treonina Valina Succinato Acetil-CoA Fumarato Oxaloacetato Fenilalanina Tirosina Malato CO2 Piruvato Isoleucina Leucina Treonina Triptofano Alanina Cisteína Glicina Serina Treonina Triptofano Glicose Glicogênicos Asparagina Aspartato Cetogênicos FONTE: (2014, p. 705) Figuras 18-19 e 18-27), e a importância de determinada via pode variar FIGURA 1815 Resumo do catabolismo dos aminoácidos. OsNelson aminoá-e Cox o organismo e as condições metabólicas. Aminoácidos glicogênicos e cidos estão agrupados conforme seu principal produto final de degradação. gênicos também estão delineados na figura, sombreados em cores. Ob Alguns aminoácidos estão listados mais de uma vez, pois diferentes partes que cinco aminoácidos são tanto glicogênicos quanto cetogênicos. Os de seus esqueletos de carbono são degradadas em diferentes produtos finoácidos que produzem piruvato também são potencialmente cetogên nais. A figura mostra as vias catabólicas mais importantes em vertebrados; Apenas dois aminoácidos, lisina e leucina, são exclusivamente cetogên há, contudo, variações menores entre diferentes espécies de vertebrados. A treonina, por exemplo, é degradada por no mínimo duas vias diferentes (ver 2.10 O CATABOLISMO DA FENILALANINA / FENILCETONÚRIA Considerando que muitos aminoácidos são neurotransmissores, ou precursores de neurotransmissores, ou antagonistas deles, não é de surpreender que defeitos pode ser transformado em acetil-CoA ou em oxaloacetato. -CoA é convertida em acetoacetato e, então, em aceto genéticos no metabolismo dos aminoácidos causar prejuízo no desenvolvimento Posteriormente, serão resumidas as vias individuais para os possam b-hidroxibutirato (ver Figura 17-19). Esses são amino neural e deficiência intelectual. Emlevando muitas dessas doenças, intermediários 20 aminoácidos em diagramas de fluxo, cada um dos cetogênicos (Figura 18-15).específicos Sua capacidade de a um ponto específico de entrada no ciclo do ácido cítriduzir corpos cetônicos é especialmente evidente no di se acumulam. Por exemplo, um defeito genético na fenilalanina-hidroxilase, a primeira co. Nesses diagramas, os átomos de carbono que entram tes melito não controlado, quando o fígado produz gran enzima na via catabólica da fenilalanina, é responsável pela doença fenilcetonúria (PKU), no ciclo do ácido cítrico são mostrados coloridos. Observe quantidades de corpos cetônicos a partir de ácidos grax a causa mais comummais de níveis elevados de fenilalanina no sangue (hiperfenilalaninemia). que alguns aminoácidos aparecem de uma vez, reflede aminoácidos cetogênicos. Os aminoácidos degradados em piruvato, a-ceto tindo diferentes destinos para diferentes partes de seus estarato, succinil-CoA, fumarato oxaloacetato pod queletos de carbono. AEm vez de examinar cada etapa de fenilalanina-hidroxilase é uma enzima de uma classe geral e/ou de enzimas cada via no catabolismo dos aminoácidos, serão destacadas ser convertidos em glicose e glicogênio pelas vias d denominadas de função mista, quecritas catalisam simultaneamente a hidroxilação nos Capítulos 14 e 15. Esses são aminoácidos para uma discussão especialoxidases algumas reações enzimáticas um substrato um mecanismos átomo de oxigênio O2 e a redução do outro átomo de oxigênio Aminoácidos glicogênicos e cetogênicos de relevânciade particular, devidopor a seus ou seu docogênicos. são excludentes entre si; cincoque aminoácidos significado médico. em H2O. A fenilalanina-hidroxilase requer o cofator tetra-hidrobiopterina, transfere– triptofa tirosina, treonina e isoleucina elétrons do NADPH ao oxigênio, oxidando-sefenilalanina, a di-hidrobiopterina no processo (Figura – são ta cetogênicos quanto glicogênicos. O catabolismo dos a Alguns aminoácidos são convertidos em glicose, outros 27). Em seguida, esse cofator é reduzido pela enzimaédi-hidrobiopterina-redutase, noácidos especialmente crítico para a sobrevivênci em corpos cetônicos em uma reação que requer NADPH (NELSON;animais COX, 2014). em dietas ricas em proteína ou durante o jej A leucina é um aminoácido exclusivamente cetogên Os sete aminoácidos inteira ou parcialmente degradados muito comum em proteínas. Sua degradação contr em acetoacetil-CoA e/ou acetil-CoA – fenilalanina, tirosina, isoleucina, leucina, triptofano, treonina e lisina – podem substancialmente para a cetose em condições de je prolongado. produzir corpos cetônicos no fígado, onde a acetoacetil- 199 20 D AV I D L . N E L S O N & M I C H A E L M . COX FIGURA 27 – REAÇÃO DA FENILALANINA-HIDROXILASE 1 NAD(P) N H2N HN H H H N 8 5 7 6 CH CH CH3 N H H OH OH 5,6,7,8-Tetra-hidrobiopterina HN NAD(P)H 1 H1 N CH2 H O Di-hidrobiopterina-redutase 1 NH3 H H H N Fenilalanina O2 Fenilalanina-hidroxilase H2O 1 NH3 HO HN N O H CH CH CH3 OH OH 7,8-di-hidrobiopterina (forma quinonoide) CH COO2 CH2 H CH COO2 Tirosina O papel da tetra-hidrobiopterina naFONTE: reação da fenila-e Cox do(2014, diretamente do C-4 para o C-3 na reação. Essa característica, descoberta Nelson p. 719) nina-hidroxilase. O átomo de H sombreado em cor-de-rosa é transferino National Institute of Health (NIH), é denominada “troca NIH”. GURA 1824 Em pessoas com PKU, uma rota secundária do metabolismo da fenilalanina, idrobiopterina no processo (Figura 18-24). Em seguida, terina também é necessária para a formação de L-3,4-di-hidronormalmente pouco utilizada, passa a desempenhar um papel mais proeminente. Nessa se cofator é reduzido pela enzima di-hidrobiopterina- xifenilalanina (L-dopa), precursor dos neurotransmissores doa fenilalanina sofreNADPH. transaminação compamina o piruvato, produzindo A precursor e noradrenalina, e defenilpiruvato. 5-hidroxitriptofano, edutase,rota, em uma reação que requer Em pessoas com PKU,e uma rota secundária do metabo- no do sangue neurotransmissor serotonina. Na fenilcetonúria fenilalanina o fenilpiruvato acumulam-se e nos tecidos e são excretados desse tipo, mo da fenilalanina, normalmente pouco utilizada, passaUma a esses precursores devem ser supridos na dieta. A suplementana urina – daí o nome “fenilcetonúria”. quantidade considerável de fenilpiruvato esempenhar um papel mais proeminente. Nessa rota, a feni- ção da dieta com a própria tetra-hidrobiopterina é ineficiente, não é excretadacom como tal, mas sofre descarboxilação a fenilacetato ouaredução a fenilanina sofre transaminação o piruvato, produzindo fepois ela é instável e não cruza barreira hematoencefálica. lpiruvato (FiguraO18-25). A fenilalanina e oàfenilpiruvato A triagem de doenças genéticas em recém-nascidos pode lactato. fenilacetato confere urina um odor característico, tradicionalmente utilizado umulam-se sangue e nospara tecidos e são excretados na apresentar relação GRANNER, custo-benefício bastante favorável, pornoenfermeiros detectar PKU em bebês (RODWEL;uma MURRAY; 2017). ina – daí o nome “fenilcetonúria”. Uma quantidade consierável de fenilpiruvato não é excretada como tal, mas sofre 1 O acúmulo fenilalanina ou de Oseus metabólitos no início da vida escarboxilação a fenilacetato ou de redução a fenil-lactato. NH3 prejudica o nilacetatodesenvolvimento confere à urina um odor característico, tradicionormal do cérebro, causando grave deficiência intelectual. Isso 2 pode CH2 CH COO almente utilizado por enfermeiros para detectar PKU em beser causado pelo excesso de fenilalanina, que compete com outros aminoácidos pelo ês. O acúmulo de fenilalanina ou de seus metabólitos no iníFenilalanina através da barreira resultando em déficit de metabólitos o da vida transporte prejudica o desenvolvimento normalhematoencefálica, do cérebro, CH3 C COO2 usando grave deficiência A intelectual. Isso pode ser causado necessários. fenilcetonúria está entre os primeiros defeitos metabólicos herdados O elo excesso de fenilalanina, que compete com outros amido metabolismo descobertos em humanos. Quando essa condição é identificada nos Piruvato oácidos pelo transporte através da barreira hematoencefáliprimeiros dias de vida, a necessários. deficiência intelectual pode ser prevenida peloPLPcontrole rígido Aminotransferase , resultando em déficit de metabólitos A fenilcetonúria entre os primeiros defeitos metada dieta,está a qual deve suprir fenilalanina apenas suficiente para atender às necessidades 1 ólicos herdados do metabolismo em humanos. NH3 de síntese proteica.descobertos O consumo de alimentos ricos em proteínas deve ser reduzido. uando essa condição é identificada nos primeiros dias de CH3 CH COO2 Proteínas naturais, a caseína da, a deficiência intelectual podecomo ser prevenida pelo do con-leite, devem ser primeiramente hidrolisadas Alanina parte dadeve fenilalanina deve serapenas removida para que o paciente receba uma dieta ole rígidoedaboa dieta, a qual suprir fenilalanina ficiente para atender às necessidades de síntese proteica. adequada, pelo menos durante toda a sua infância (NELSON; COX, 2014).O consumo de alimentos ricos em proteínas deve ser reduCH2 C COO2 do. Proteínas naturais, como a caseína do leite, devem ser imeiramente hidrolisadas e boa parte da fenilalanina deve Fenilpiruvato r removida para que o paciente receba uma dieta adequaCO2 a, pelo menos durante toda a sua infância. Uma vez que o H2O doçante artificial aspartame é um dipeptídeo contendo asOH artato e um metil-éster da fenilalanina (ver Figura 1-24b), 2 CH2 COO CH2 CH COO2 imentos adoçados com aspartame contêm avisos dirigidos pessoas recebendo dietas em que o conteúdo de fenilalaniFenilacetato Fenil-lactato a deve ser controlado. A fenilcetonúria também pode ser causada por um defeito FIGURA 1825 Rotas alternativas para o catabolismo da fenilaa enzima que catalisa a regeneração da tetra-hidrobiopterina lanina na fenilcetonúria. Na PKU, o fenilpiruvato se acumula nos 200 Figura 18-24). O tratamento, nesse caso, é mais complexo do tecidos, no sangue e na urina. A urina pode ainda conter fenilacetato e fenil-lactato. ue a restrição da ingestão de fenilalanina. A tetra-hidrobiop- RESUMO DO TÓPICO 4 Neste tópico, você adquiriu certos aprendizados, como: • Humanos obtêm uma pequena fração de sua energia oxidativa a partir do catabolismo dos aminoácidos. • Os aminoácidos provêm da degradação normal de proteínas celulares (reciclagem), da degradação de proteínas da dieta e da degradação de proteínas teciduais no lugar de outros combustíveis, durante o jejum ou no diabetes melito não controlado. • Proteases degradam as proteínas da dieta no estômago e no intestino delgado. A maioria das proteases é primeiramente sintetizada como zimogênios inativos. • A primeira etapa no catabolismo dos aminoácidos é separar o grupo amino do esqueleto de carbono. • O glutamato é transportado à mitocôndria hepática, onde a glutamato-desidrogenase libera o grupo amino na forma de íon amônio (NH4). • O piruvato produzido pela desaminação da alanina no fígado é convertido em glicose, a qual é transportada de volta ao músculo como parte do ciclo da glicose-alanina. • A amônia é altamente tóxica para os tecidos animais. No ciclo da ureia, a ornitina combina-se com a amônia, na forma de carbamoil-fosfato, para formar citrulina. • Um segundo grupo amino é transferido para a citrulina a partir do aspartato, para formar arginina – o precursor imediato da ureia. • O ciclo da ureia resulta na conversão líquida de oxaloacetato em fumarato, ambos intermediários do ciclo do ácido cítrico. • Após a remoção dos grupos amino, os esqueletos de carbono dos aminoácidos sofrem oxidação a compostos capazes de entrar no ciclo do ácido cítrico para oxidação a CO2 e H2O. • Diversas doenças humanas graves são causadas por defeitos genéticos nas enzimas do catabolismo dos aminoácidos. 201 AUTOATIVIDADE 1 O plasma sanguíneo humano, normal, contém todos os aminoácidos necessários para a síntese das proteínas teciduais, mas não em iguais concentrações. A alanina e a glutamina estão presentes em concentrações muito mais elevadas que os demais aminoácidos. Sugira uma razão para que isto ocorra. 2 Em estudo realizado há alguns anos, gatos foram submetidos a um jejum durante a noite e então receberam uma única refeição, completa em relação a todos os aminoácidos, com exceção da arginina. Dentro de duas horas, os níveis de amônia no sangue aumentaram dos níveis normais de 18 mg/L para 140 mg/L, e os gatos mostraram sintomas clínicos de intoxicação por amônia. Um grupo controle recebeu uma dieta contendo todos os aminoácidos ou uma dieta em que a arginina era substituída pela ornitina e não mostrou qualquer sintoma clínico incomum. Nesse contexto, responda às seguintes questões: a) Qual a razão do jejum no experimento? b) Qual a causa do aumento dos níveis de amônia no grupo experimental? Por que a ausência de arginina levou à intoxicação pela amônia? A arginina é um aminoácido essencial para os gatos? Justifique. c) Por que a ornitina pode substituir a arginina? 3 A deficiência de vitamina B12 pode ser causada por raras doenças genéticas que levam a níveis diminuídos de vitamina B12, apesar de uma dieta normal, que inclui carne e laticínios, ricos em B12. Essas condições não podem ser tratadas com suplementos de vitamina B12. Explique. 202 UNIDADE 3 TÓPICO 5 - METABOLISMO DE NUCLEOTÍDEOS 1 INTRODUÇÃO O nitrogênio perde apenas para o carbono, o hidrogênio e o oxigênio em sua contribuição para a massa dos sistemas vivos. A maior parte desse nitrogênio está ligada à estrutura de aminoácidos e nucleotídeos. Neste tópico serão abordados todos os aspectos do metabolismo de nucleotídeos. 2 BIOSSÍNTESE DE NUCLEOTÍDEOS Os nucleotídeos apresentam uma variedade de importantes funções em todas as células. Eles são precursores do DNA e do RNA; são carreadores essenciais de energia química – papel desempenhado basicamente pelo ATP e, em parte, pelo GTP; são componentes dos cofatores NAD, FAD, coenzima A, assim como de intermediários biossintéticos ativados, como UDP-glicose (precursor do glicogênio) e CDP-diacilglicerol (enzima catalisadora); e alguns deles, como o cAMP e o cGMP, são também segundos mensageiros celulares. Dois tipos de vias levam aos nucleotídeos: as vias de novo e as vias de salvação. A síntese de novo dos nucleotídeos inicia com seus precursores metabólicos: aminoácidos, ribose-5-fosfato, CO2 e NH3. As vias de salvação reciclam as bases livres e os nucleosídeos liberados a partir da degradação de ácidos nucleicos. Ambos os tipos de vias são importantes no metabolismo celular (NELSON; COX, 2014). As vias de novo para a biossíntese de purinas e pirimidinas parecem ser quase idênticas em todos os organismos vivos. Como já vimos, as pirimidinas são representadas pelas bases nitrogenadas Citosina, Timina e Uracila, enquanto as purinas são representadas pela Adenina e Guanina. Uma observação notável é que as bases livres guanina, adenina, timina, citosina e uracila não são intermediárias nessas vias, isto é, as bases não são sintetizadas e então ligadas à ribose, como se poderia esperar. A estrutura do anel púrico é construída ligada à ribose durante todo o processo, com a adição de um ou de poucos átomos por vez. O anel pirimídico é sintetizado como orotato, ligado a ribose-fosfato e, então, convertido nos nucleotídeos pirimídicos comuns necessários para a síntese dos ácidos nucleicos (Figura 29). Embora as bases livres não sejam intermediárias nas vias de novo, elas são intermediárias em algumas das vias de salvação (RODWEL; MURRAY; GRANNER, 2017). 203 Diversos precursores importantes são compartilhados pelas vias de novo para a síntese de pirimidinas e purinas. O fosforribosil-pirofosfato (PRPP) é importante para a síntese de ambas e, nessas vias, a estrutura da ribose é mantida no nucleotídeo produzido, ao contrário do seu destino nas vias para a biossíntese de triptofano e histidina. Um aminoácido é um precursor importante em cada tipo de via: a glicina para as purinas e o aspartato para as pirimidinas. A glutamina é, novamente, a mais importante fonte de grupos amina. O aspartato também é utilizado como fonte de um grupo amino em dois dos passos das vias das purinas (NELSON; COX, 2014). FIGURA 28 – CLASSIFICAÇÃO DAS BASES NITROGENADAS FONTE: A autora 2.1 A SÍNTESE DE NOVO DE NUCLEOTÍDEOS PÚRICOS Os dois nucleotídeos púricos precursores dos ácidos nucleicos são 59-monofosfato de adenosina (AMP; adenilato) e 59-monofosfato de guanosina (GMP; guanilato), os quais contêm as bases púricas adenina e guanina. A Figura 29 mostra a origem dos átomos de carbono e de nitrogênio do sistema de anéis púricos, conforme determinado por John M. Buchanan, utilizando experimentos com marcadores isotópicos em aves. A via detalhada para a biossíntese de purinas foi elucidada principalmente por Buchanan e por G. Robert Greenberg, na década de 1950. 204 FIGURA 29 – ORIGEM DOS ÁTOMOS NO ANEL DAS PURINAS FONTE: Nelson e Cox (2014, p. 912) A biossíntese de nucleotídeos púricos é regulada por retroalimentação negativa, sendo que estas cooperam na regulação da velocidade geral da síntese de novo e das velocidades relativas de formação dos dois produtos, adenilato e guanilato. FIGURA 30 – MECANISMOS REGULADORES NA BIOSSÍNTESE DE NUCLEOTÍDEOS FONTE: Nelson e Cox (2014, p. 914) 205 O primeiro mecanismo é exercido sobre a primeira reação que é exclusiva da síntese de purinas: a transferência de um grupo amino para o PRPP para formar 5-fosforribosilamina. Essa reação é catalisada pela enzima alostérica glutamina-PRPPaminotransferase, que é inibida pelos produtos finais IMP, AMP e GMP. O AMP e o GMP atuam sinergicamente nessa inibição concertada. Assim, sempre que AMP ou GMP acumulam-se e estão presentes em excesso, o primeiro passo de sua biossíntese a partir de PRPP é parcialmente inibido. No segundo mecanismo de controle, exercido sobre um estágio posterior, um excesso de GMP na célula inibe a formação de xantilato a partir de inosinato, pela IMP-desidrogenase, sem afetar a formação de AMP. Por sua vez, um acúmulo de adenilato inibe a formação de adenilossuccinato pela adenilossuccinatosintetase, sem afetar a biossíntese de GMP. Quando os dois produtos estão presentes em quantidades suficientes, o IMP acumula-se e inibe um passo anterior da via; essa estratégia reguladora é chamada inibição sequencial por retroalimentação. No terceiro mecanismo, o GTP é necessário para a conversão de IMP em AMP, enquanto o ATP é necessário para a conversão de IMP em GMP, arranjo recíproco que tende a equilibrar a síntese dos dois ribonucleotídeos. O último mecanismo de controle é a inibição da síntese de PRPP pela regulação alostérica da ribose-fosfato-pirofosfocinase. Essa enzima é inibida por ADP e GDP, além de metabólitos de outras vias para as quais o PRPP é o ponto de partida (NELSON; COX, 2014, p. 914). NOTA Você sabia? Cerca de 10% dos seres humanos (e até 50% das pessoas em comunidades pobres) sofrem de deficiência de ácido fólico. Quando a deficiência é grave, os sintomas podem incluir doença cardíaca, câncer e alguns tipos de distúrbios encefálicos. Pelo menos alguns desses sintomas surgem da redução da síntese de timidilato, levando a uma incorporação anormal de uracila no DNA. A uracila é reconhecida pelos sistemas de reparo do DNA e é removida do DNA. A presença de altos níveis de uracila no DNA leva a quebras da fita, que podem afetar muito a função e a regulação do DNA nuclear, causando por fim os efeitos observados sobre o coração e o encéfalo, assim como aumento da mutagênese, que leva ao câncer. 206 2.2 BASES PÚRICAS E PIRIMÍDICAS SÃO RECICLADAS POR VIAS DE SALVAÇÃO As bases púricas e pirimídicas livres são constantemente liberadas nas células durante a degradação metabólica dos nucleotídeos. As purinas livres são, em grande parte, salvas e reutilizadas para sintetizar nucleotídeos, em uma via muito mais simples que a síntese de novo dos nucleotídeos púricos. Uma das principais vias de salvação consiste em uma única reação, catalisada pela adenosina-fosforribosiltransferase, na qual adenina livre reage com PRPP para produzir o correspondente nucleotídeo da adenina. Existe uma via de salvação semelhante para bases pirimídicas em microrganismos e, possivelmente, em mamíferos (RODWEL; MURRAY; GRANNER, 2017). Um defeito genético na atividade da hipoxantina-guanina-fosforribosiltransferase, observado quase exclusivamente em crianças do sexo masculino, resulta no conjunto de sintomas denominado síndrome de Lesch-Nyhan. Crianças com essa doença genética, que se manifesta em torno dos dois anos, apresentam, algumas vezes, baixa coordenação motora e deficiência intelectual. Além disso, são extremamente agressivas e mostram tendências à compulsão autodestrutiva: apresentam automutilação, mordendo dedos, artelhos e lábios. Os efeitos devastadores da síndrome de Lesch-Nyhan ilustram a importância das vias de salvação (NELSON; COX, 2014). Hipoxantina e guanina surgem constantemente da degradação dos ácidos nucleicos. Na ausência da hipoxantina-guanina-fosforribosil-transferase, os níveis de PRPP aumentam e ocorre uma superprodução de purinas pela via de novo, resultando na produção de altos níveis de ácido úrico e lesão tecidual semelhante à da gota. O cérebro é especialmente dependente das vias de salvação e isso pode ser a causa da lesão do sistema nervoso em crianças com síndrome de Lesch-Nyhan. Essa síndrome é outro alvo potencial para a terapia gênica (BERTUZZI et al., 2008). NOTA Curiosidade – Excesso de ácido úrico causa gota Durante muito tempo, acreditou-se erroneamente que a gota fosse devida a um “estilo de vida elevado”. A gota é uma doença das articulações, causada pela concentração elevada de ácido úrico no sangue e nos tecidos. As articulações tornam-se inflamadas, doloridas e artríticas devido à deposição anormal de cristais de urato de sódio. Os rins também são afetados, pois ácido úrico em excesso se deposita nos túbulos renais. A gota ocorre predominantemente em pessoas do sexo masculino. Sua causa precisa não é conhecida, frequentemente envolve uma excreção reduzida de uratos. A deficiência genética de alguma enzima do metabolismo das purinas também pode ser um fator em alguns casos. RESUMO DO TÓPICO 5 Neste tópico, você adquiriu certos aprendizados, como: • As vias de biossíntese de aminoácidos estão sujeitas à inibição alostérica pelo produto; a enzima reguladora geralmente é a primeira da sequência. • Glicina e a arginina originam a creatina e a fosfocreatina, um tampão energético. A glutationa, formada a partir de três aminoácidos, é um importante agente redutor na célula. • O sistema de anéis das purinas é construído passo a passo, iniciando com 5-fosforribosilamina. • Os aminoácidos glutamina, glicina e aspartato fornecem todos os átomos de nitrogênio das purinas. Os passos de fechamento dos dois anéis formam o núcleo das purinas. • As pirimidinas são sintetizadas a partir de carbamoil-fosfato e de aspartato, e a ribose-5-fosfato é então ligada para produzir ribonucleotídeos pirimídicos. • O ácido úrico e a ureia são derivados da degradação de purinas e pirimidinas. • Purinas livres podem ser usadas em vias de salvação, na reconstrução de nucleotídeos • Deficiências genéticas em certas enzimas das vias de salvação causam doenças graves, como a síndrome de Lesch-Nyhan e a deficiência de ADA. • O acúmulo de cristais de ácido úrico nas articulações, possivelmente causado por outra deficiência genética, resulta na gota. 208 AUTOATIVIDADE 1 A deficiência de ácido fólico, que se acredita ser a deficiência vitamínica mais comum, causa um tipo de anemia em que a síntese de hemoglobina está prejudicada e os eritrócitos não amadurecem adequadamente. Qual a relação metabólica entre a síntese de hemoglobina e a deficiência de ácido fólico? 2 Na biossíntese de aminoácidos estão envolvidas as purinas e pirimidinas. Quais as diferenças entre elas? 3 Quais os resultados da degradação de purinas e pirimidinas? 209 210 REFERÊNCIAS ALBERTS, B. Biologia molecular da célula. 3. ed. Porto Alegre: Artes Médicas, 1997. BAYNES, J. Bioquímica médica. 4. ed. Rio de Janeiro: Elsevier, 2015. BERG, J. M. Bioquímica. 7. ed. Rio de Janeiro: Guanabara Koogan, 2014. BERG, J. M.; TYMOCZKO, J. L.; STRYERT, L. Bioquímica. 7. ed. Rio de Janeiro: Guanabara Koogan, 2015. BERTUZZI, R. C. M. et al. Metabolismo do lactato: uma revisão sobre a bioenergética e a fadiga muscular. 2008. Disponível em: http://www.biologia.bio.br/ curso/1%C2%BA%20per%C3%ADodo%20Faciplac/Metabolismo%20do%20lactato.pdf . Acesso em: 28 fev. 2019. COOPER, G. M. A célula: uma abordagem molecular. 2. ed. Porto Alegre: Artmed, 2001. GONZÁLEZ, F. H. D.; SILVA, S. C. Perfil Bioquímico no Exercício. In: Introdução à bioquímica clínica veterinária. Porto Alegre: Universidade Federal do Rio Grande do Sul, 2006. GRIFFITHS, A. J. F. Introdução à genética. 11. ed. Rio de Janeiro: Guanabara Koogan, 2016. JUNQUEIRA, L. C.; CARNEIRO, J. Biologia celular e molecular. 9. ed. Rio de Janeiro: Guanabara Koogan, 2012. JUNQUEIRA, L. C.; CARNEIRO, J. Histologia básica: texto e atlas. 13. ed. Rio de Janeiro: Guanabara Koogan, 2007. JUNQUEIRA, L. C.; CARNEIRO, J. Histologia básica: texto e atlas. 10. ed. Rio de Janeiro: Guanabara Koogan, 2005. KIERSZENBAUM, L. L. T. Histologia e biologia celular: uma introdução à patologia. 4. ed. Rio de Janeiro: Elsevier, 2008. MARZZOCO, A.; TORRES, B. B. Bioquímica básica. 3. ed. Rio de Janeiro: Guanabara Koogan, 2007. MAYWORM, S. H. Introdução à biologia celular. Rio de Janeiro: Editora Universidade Estácio de Sá, 2014. 211 NELSON, D. L.; COX, M. M. Princípios de bioquímica de Lehninger. 6. ed. Porto Alegre: Artmed, 2014. NELSON, D. L.; COX, M. M. Princípios de bioquímica de Lehninger. 3. ed. Porto Alegre: Artmed, 2002. RODWELL, V. W.; MURRAY, R. K.; GRANNER, D. L. Bioquímica ilustrada de Harper. 30. ed. Porto Alegre: AMGH, 2017. SACKHEIM, G. I. Química e bioquímica para ciências biomédicas. 8. ed. São Paulo: Manole, 2001. 212