De Robertis - Bases da Biologia Celular e Molecular - 4 Ed.
advertisement

i
BASES DA
-
----/
GUANABARA~KOOGAN
1
Revisão Técnica
Jorge Mamede de Almeida
Professor (Aposentado) de Histologia e Embriologia do
Instituto Biomédico da Universidade Federal Fluminense - UFF.
Ex-Diretor do Instituto Biomédico da Universidade Federal Fluminense - UFF.
Comenda de Honra ao Mérito do Instituto Biomédico da Universidade Federal Fluminense - UFF.
Comenda do Mérito Laet César. Member of the New York Academy of Sciences.
Professor de Neuro-Histologia do Curso de Pós-Graduação em
Neurofisiologia do Instituto de Medicina e Reabilitação - IBMR.
Ex-Professor de Embriologia da Faculdade de Castelo - FaCastelo.
Ex-Professor de Histologia e Embriologia da Faculdade da Universidade do Grande Rio - UNIGRANRIO.
Ex-Professor de Histologia e Embriologia da Faculdade de Medicina da Universidade de Nova Iguaçu - UNIG.
Ex-Professor de Histologia e Embriologia da Universidade Estácio de Sá
Tradução
Antonio Francisco Dieb Paulo
Médico
Eduardo M. F. De Robertis
É doutor em Medicina e graduou-se com Medalha de Ouro na Faculdade
de Medicina da República Oriental del Uruguay. Além disso, é doutor em
Bioquímica da Faculdade de Ciências Exatas da Universidade de Buenos
Aires. Depois de completar seu doutorado na Fundación Campomar,
transferiu-se para Cambridge, Inglaterra, a fim de continuar seu treinamento
com Sir Gurdon em embriologia de anfíbios. Desde 1985, é professor titular
de Bioquímica da Faculdade de Medicina da Universidade da Califórnia, Los Angeles, onde ocupa
a Norman Sprague Endowed Chair for Molecular Oncology. Em 1994, foi nomeado Investigador
do Howard Hughes Medical Institute. Foi eleito membro da European Molecular Biology (EMBO),
da Organización Iberoamericana de Biología Molecular (IMBO) e é membro correspondente da
Société de Biologie de Paris. Recebeu distinções da Fundación Konex, do College de France
de Paris e de outras entidades. É membro de Conselhos Assessores de numerosas organizações
internacionais. Recentemente, foi eleito membro da American Academy of Arts and Sciences.
José Hib
Graduou-se na Faculdade de Medicina da Universidade de Buenos Aires. É
doutor em Medicina dessa universidade e doutor em Biologia da Universidade
de Salvador. Desde cedo, dedicou-se à docência e se transferiu - como
bolsista da Organização Mundial da Saúde - ao Centro Latino-Americano de
Perinatologia de Montevidéu, dirigido pelo professor Roberto Caldeyro-Barcia.
Nessa instituição, realizou seus primeiros trabalhos de pesquisa, vinculados
à contratilidade dos órgãos do sistema reprodutor masculino e sua regulação farmacológica e
hormonal. Depois, radicou-se em Buenos Aires, onde, como membro do CONICET, continuou
suas investigações, que foram publicadas em mais de 30 revistas estrangeiras, ou proferidas em
congressos nacionais e internacionais da especialidade. Em 1986, foi nomeado professor adjunto
do Departamento de Biologia Celular, Histologia, Embriologia e Genética da Faculdade de Medicina
da Universidade de Buenos Aires e, desde 1996, é professor titular dessa disciplina na Universidad
Abierta Interamericana. Foi membro do Comité Científico del Primer Cortgreso Panamericano de
Andrología e foi premiado pelo Ministerio de Educación de la Nación por seu trabalho Contractilidad
del epidídimo. É autor dos livros Embriología Médica e Histología de Di Piore -Texto y Atlas-;
esse último, da mesma forma que Bases, foi traduzido para o português.
Prólogo
Em primeiro lugar, desejamos expressar nosso reconhecimento pelas numerosas mensagens
recebidas de colegas felizes pelo aparecimento da terceira edição deste Bases, celebrando a possibilidade de que este texto clássico de biologia celular possa continuar sendo consultado pelos
estudantes. É que, em uma época como a atual , em que importantes descobrimentos sobre a célula
são publicados quase cotidianamente, os livros que descrevem as estruturas e as funções celulares
persistem na consideração dos docentes somente se forem atualizados com certa periodicidade.
Entretanto, antes de somarem informações novas, devem esses dados novos ser selecionados criteriosamente, a fim de que a novidade não prevaleça sobre o essencial e invada o lugar dos conhecimentos .básicos que os estudantes têm que aprender no começo de suas carreiras, já que, com
freqüência, abordam o estudo da célula com poucas noções sobre seu funcionamento. Além disso,
ao longo do livro, temos tratado de orientar o interesse dos estudantes para que compreendam que
o conhecimento das estruturas e funções celulares normai s são os fundamentos da maioria dos.
temas que deverão aprender quando cursarem outras disciplinas.
Todos os capítulos desta quarta edição foram revisados e atualizados, em especial as seções
correspondentes à migração celular, os revestimentos das vesículas transportadoras do sistema de
endomembranas, a incorporação de proteínas à mitocôndria, a transmissão intracelular de sinais, a
passagem de moléculas através do complexo do poro, a importância do RNAxist, as propriedades
dos miRNA (microRNA), a influência do enrolamento da cromatina sobre a atividade do? genes
(código histônico) , o ribossoma, a síntese da cadeia atrasada do DNA, os telômeros, o complexo
sinaptonêmico, a morte celular, a análise da função dos genes com a ajuda de RNA pequenos de
interferência etc.
Do mesmo modo que na edição anterior, procuramos apresentar os temas razoavelmente resumidos, apesar de, como dissemos, as publicações derivadas da investigação científica serem cada
dia mais numerosas. No entanto, cuidamos de não fazê-lo à custa da clareza didática, propósito
que se viu enonnemente favorecido pelas ilustrações coloridas com as quais conta esta edição.
Com relação a isso, o leitor observará que, a cada componente da célula, foi atribuída uma cor,
que se manteve em todas as figuras onde o componente aparece. Além disso, as seções em que se
dividem os capítulos foram encabeçadas por códigos simples que se repetem cada vez que se faz
referência a questões vinculadas a seus conteúdos, o que facilitará a busca dos temas e agilizará
as intenções de integrá-los.
Como é natural, o preparo de uma nova edição é uma tarefa complexa que depende do esforço
de muitas pessoas. Entre os colaboradores mais dedicados, destacamos o desenhista gráfico Alejandro F. Demartini, que teve a seu encargo a elaboração das ilustrações, das figuras novas e da
diagramação das páginas. Desejamos ressaltar o incalculável apoio que nos forneceu, não somente
por sua experiência editorial, mas também pelo empenho com que enfrentou os problemas advindos, pois não se deu por satisfeito até que a estética e a informação das figuras chegassem ao nível
que desejávamos.
Merece uma menção especial o Sr. Arnaldo Saita, de quem dependeu a correção do texto original a fim de alcançar - e não duvidamos que o conseguiu - a maior precisão idiomática possível. Cabe também mencionar a Srta. Marina von der Pahlen e os Srs. Américo Ruocco, Miguel
A. Romero e Roque Quinteros, pela colaboração dada às diferenciadas etapas da preparação do
X
•
PRÓLOGO
livro. Finalmente, deixamos registrados nossos agradecimentos à Diretora do Editorial da El Ateneo, Srª Luz Henríquez, pela anuência para a publicação desta nova edição de Bases, e ao Editor
do Departamento de Medicina, Sr. Enrique Lohnnann, pelo generoso e incondicional apoio desde
a gestão deste projeto.
ÜS AUTORES
Conteúdo
0
CÉLÚLA
Introdução, 1
, Níveis de organização, 1 /
Características gerais das células, 3
J
c"' 2. OS COMPONENTES QUÍMICOS DA CÉLULA (o~
Introdução, 17
Água e minerais, 18
Ácidos nucléicos, 18
Carboidratos, 22
Lipídios, 24
Proteínas, 29
Enzimas, 33
~origem das células, 36
. AS MEMBRANAS CELULARES. Permeabilidade das membranas
1
\
Atividades das membranas, 39 v
v
Estrutura das membranas celulares, 39
Fluidez das membranas, 43 '-.../
Permeabilidade das membranas celulares, 46 '-.../'
< membrana plasmática e a parede da célula vegetal, 56
4. O CITOSSOL
Componentes, 59
Chaperonas, 61
Proteassomas, 62
·*~. O CITOESQUELETO. Forma e motilidade ~
Componentes, 65
Filamentos intermediários, 65
Microtúbulos, 68
Centrossoma, 68
Cílios, 73
Corpos basais e centríolos, 75
Filamentos de actina, 77
Motilidade celular, 82
Microvilosidades, 86
Contratilidade muscular, 87
Citoesqueleto da hemácia, 91
xii
•
CONTEÚDO
.6. A JUNÇÃO DAS CÉLULAS ENTRE SI E COM A MATRIZ
EXTRACELULAR '<>
Á
Matriz extracelular, 95
Uniões das células com a matriz extracelular, 98
Uniões transitórias entre as células, 98
Uniões estáveis entre as células, 100
As conexões entre as células vegetais, 104
7. O SISTEMA DE ENDOMEMBRANAS. Digestão e secreção ('.)"
Componentes, 107
Retículo endoplasmático, 108
Complexo de Golgi, 109
Funções do retículo endoplasmático e do complexo de Golgi, 111
Secreção celular. Exocitose, 123
Endossamos. Endocitose, 125
Lisossomos. Digestão celular, 129
Vesículas transportadoras, 131
O sistema de endomembranas na célula vegetal, 138
~ 8.
AS MITOCÔNDRIAS. Energia celular I
Processos bioenergéticos, 141
Descrição geral e estrutura das mitocôndrias, 146
Funções das mitocôndrias, 149
Mitocôndrias das células de gordura parda, 154
Reprodução das mitocôndrias, 155
DNA mitocondrial, 156
Provável origem das mitocôndrias, 157
9. OS CLOROPLASTOS. Energia celular II
Tipos de plastídios, 159
Estrutura dos cloroplastos, 160
Fotossíntese, 162
Biogênese dos cloroplastos, 166
'lt10. OS PEROXISSOMAS. Desintoxicação celular
Conteúdo dos peroxissomas, 169
Funções, 169
Reprodução, 170
Os peroxissomas nas células vegetais, 171
"til.
A COMUNICAÇÃO INTERCELULAR E A TRANSMISSÃO
INTRACELULAR DE SINAIS
Formas de comunicação entre as células, 173
Induções celulares mediadas por receptores citosólicos, 175
Induções celulares mediadas por receptores localizados na membrana plasmática, 177
Receptores de membrana que adquirem atividade enzimática ou que ativam enzimas, 178
Receptores de membrana acoplados a proteínas G, 181
12. O NÚCLEO '~1-\
Descrição geral, 193
Envoltório nuclear (cario teca), 193
Cromossomos, 198
CONTEÚDO
Eucromatina e heterocromatina, 202
Cariótipo, 203
13. OS GENES
Introdução, 209
Código genético, 21 1
Composição dos genes, 213
14. A TRANSCRIÇÃO DO DNA
01t--
Definição, 217
Transcrição dos genes dos RNA mensageiros, 219
Regulação da atividade de genes que codificam RNA mensageiros, 220
Transcrição do gene do RNA ribossômico 45S , 228
Transcrição do gene do RNA ribossômico 5S, 228
Transcrição dos genes dos RNA de transferência, 229
Transcrição dos genes dos RNA pequenos, 229 ·
Transcrição dos genes do RNAxist, do RNAte e dos miRNA (microRNA), 230
Transcrição dos genes nas células procariontes, 230
15. O PROCESSAMENTO DO RNA º""
Processamento dos RNA mensageiros, 237
Regulação do processamento dos RNA mensageiros, 241
•
Processamento do RNA ribossômico 45S , 242
Nucléolo, 243
'\(
Processamento do RNA ribossômico 5S , 244
Processamento dos RNA de transferência, 245
Processamento dos RNA pequenos, 245
Processamento do RNAxist, do RNAte e dos miRNA, 246
t 0~
Descrição geral e código genético, 247
Tipos de RNA de transferência, 249
Aminoacil-RNAt sintetase, 250
Ribossomas, 251
As etapas da síntese protéica, 253
Regulação da tradução dos RNA mensageiros e da degradação das proteínas, 258
16. A TRADUÇÃO DO RNAm. Síntese de proteínas
17. A REPLICAÇÃO DO DNA. Mutação e reparo e,._,
Replicação do DNA. Descrição geral, 263
Origens de replicação, 264
Replicação contínua e descontínua, 267
Replicação do DNA nos telômeros, 27 1
Funções das topoisomerases, 273
Mutação do DNA, 275
Reparação do DNA, 277
Transposição de seqüências de DNA, 279
, 18. A MITOSE. Controle do ciclo celular
Mitose, 283
Descrição geral da mitose, 284
Fases da mitose, 285
Centrossomas, 287
, ,:r
•
xiii
xiv
•
CONTEÚDO
Cinetocoros, 288
Fuso mitótico, 289
Citocinese, 291
A mitose nas células vegetais, 291
Controle do ciclo celular, 293
Protooncogenes, oncogenes e genes supressores de tumores, 297
19. A MEIOSE. Fecundação
A meiose e a reprodução sexual, 301
Diferenças entre a mitose e a meiose, 301
Descrição geral da meiose, 302
Fases da meiose, 304
Conseqüências genéticas da meiose, 312
Fecundação, 314
Fases da fecundação, 315
A meiose nas células vegetais e a reprodução das plantas, 320
20. AS BASES DA CITOGENÉTICA
Leis da herança mendeliana, 323
Aberrações cromossômicas, 327
Aberrações cromossômicas na espécie humana, 330
Pápel dos cromossomos na evolução, 333
21. A DIFERENCIAÇÃO CELULAR
Características gerais, 335
Interações nucleocitoplasmáticas, 336
Determinantes citoplasmáticos, 338
Valores posicionais das células embrionárias, 341
Estabelecimento do plano corporal, 341
Fenômenos indutivos, 342
O estabelecimento do plano corporal na Drosophila, 345
Genes responsáveis pela formação do plano corporal, 346
22. A MORTE CELULAR
Definição e características gerais, 349
Apoptose por supressão de fatores tróficos, 350
Apoptose por ativação de receptores específicos, 352
Apoptose devida a mutações no DNA, 353
23. OS MÉTODOS DE ESTUDO EM BIOLOGIA CELULAR
Microscopia óptica, 357
Microscopia eletrônica, 362
Estudo das células vivas, 366
€itoquímica, 367
Imunocitoquímica, 368
Radioautografia, 369
Fracionamento celular e molecular, 370
Análise molecular do DNA e engenharia genética, 373
Análise da função dos genes, 381
ÍNDICE ALFABÉTICO, 385
A célula
L
ODU ÇÃO
As cél ulas são as estruturas com as quais os organismos
vivos são construídos
O esrudo do universo biológico mostra-nos que a evolução produziu uma imensa diversidade
as viventes. Existem cerca de quatro milhões de espécies de animais, vegetais, protozoátérias, cujos comportamentos, morfologias e funções diferem entre si. Entretanto, no nível
~ar e celular, estes seres vivos apresentam um plano mestre de organização único. O cam. biologia celular e molecular é, precisamente, o estudo desse plano de organização unificaem outri,!S palavras, é a análise das moléculas e dos componentes celulares com os quais se
;;rroem todas as formas de vida.
_.\célula é a unidade estrutural e funcional fundamental dos seres vivos, assim como o átomo
"dade fu ndamental das estruturas químicas. Se, por algum meio, a organização celular for
'da, a função da célula também será alterada.
Os e tudos bioquímicos demonstraram que a matéria viva é composta pelos mesmos elemenue constituem o mundo inorgânico, embora com diferenças em sua organização. No mundo
- ado, existe uma tendência contínua para o equilíbrio termodinâmico, no curso do qual são
;::;:;uduzidas transformações eventuais entre a energia e a matéria. Ao contrário, nos organismos
. existe um ordenamento manifestado nas transformações químicas, de modo que as estrutu- e as funções biológicas não se alteram.
_·o Cap. 23, são descritos ordenadamente os métodos de estudo que proporcionarão os conheentos essenciais sobre a estrutura íntima das células e permitirão descobrir a organização
lular até um nível molecular.
O pre ente capítulo tem como objetivos principais oferecer uma introdução ao estudo das ese das funções da célula e apresentar a nomenclatura dos componentes celulares. Após
ionar os níveis de organização concernentes à biologia, descreveremos a organização estrudo procariotas e dos eucariotas - os dois tipos principais de organismos vivos - e serão
illlaladas suas semelhanças e diferenças. Também o leitor será introduzido nos processos gerais
- divi ões mitótica e meiótica das células .
..\través da atenta leitura deste capítulo, o leitor obterá uma visão geral da célula, que servirá de
para a aprendizagem do material apresentado no restante do livro.
·
=
EI S DE ORGANIZAÇÃO
-2. Níveis de organizàção em biologia celular e poder
resolutivo dos instrumentos utilizados
O estudos modernos da matéria viva demonstram que as manifestações vitais do organismo
illltam de uma série de níveis de organização integrados. O conceito dos níveis de organização
~lica que; em todo o universo, tanto no mundo inerte como no mundo dos seres vivos, existem
-erentes níveis de complexidade,. de maneira que as leis ou regras que são cumpridas em um
, ·el podem não se manifestar em outros.
O Quadro 1.1 mostra os limites que separam o estudo dos sistemas biológicos em diferentes
'·ei . Os limites são impostos artificialmente pelo poder de resolução dos· instrumentos utiliza- _O olho humano só pode distinguir d.ois pontos separados por mais de 0,1 mm (100 µm). A
·oria das células é muito menor e, para estudá-las, é necessário o poder de resolução do micros-
1
2
•
ACÉLULA
Quadro 1.1 Ramos da morfologia
Dimensão
Ramo
Estrutura
Método
>0,lmm
100-lO µ,m
10-0,2 µ,m
Anatomia
Histologia
Citologia
Olho e lente si mples
Vários tipos de microscópios ópticos
Vários tipos de microscópios ópticos
200-0,4 nm
Morfologia submicroscópica
Ultra-estrutura
Estrutura molecular e atômica
Órgãos
Tecidos
Células
Bactéri as
Componentes celulares
Vírus
Posição dos átomos
< 1 nm
Microscopia eletrônica
Difração de raios X
1 mm equi vale a 1.000 µm ; 1 µm, a 1.000 nm.
cópio óptico (0,2 µm). A maior parte das subestruturas celulares é ainda menor e exige a resolução do microscópio eletrônico (Cap. 23-11). Com este instrumento, podem ser obtidas informações de subestruturas que medem entre 0,4 e 200 nm, o que amplia o campo de observação até o
mundo das macromoléculas. Os resultados obtidos mediante a aplicação da microscopia eletrônica transformaram o campo da citologia em um tal grau que grande parte deste livro é dedicada ao
estudo dos conhecimentos obtidos com esta técnica. Por outro lado, os estudos da configuração
molecular das proteínas, dos ácidos nucléicos e de outros complexos molecul ares de grande tamanho - incluídos alguns vírus - são realizados por intermédio da análise das amostras por difração de raios X.
Na Fig. 1.1 , estão indicados os tamanhos das células eucariontes, das bactérias, dos vírus e das
moléculas em escala logarítmica,..e são comparados com os comprimentos de onda das radiações
e com os limites de resolução do olho humano, do microscópio óptico e do microscópio eletrôni-
1 mm
Ondas de rádio
Limite do olho humano - - - - - - +
100 µm
. . . _ - - - - - - Células
Infravermelho
Fig. 1.1 Escala logarítmica das
dimensões microscópicas. Cada
divisão principal representa um ·
tamanho 10 vezes menor que a
precedente. À esquerda, está
indicada a posição dos diferentes
comprimentos de onda do
espectro eletromagnético e os
limites de resolução do olho
humano, do microscópio óptico
e do microscópio eletrônico. À
direita, aparecem as dimensões
das células, das bactérias, dos
vírus, das moléculas e dos
átomos.
Visível
Limite do microscópio óptico - - - - . .
Ultravioleta
'ºº
om]---Vic"'
10 nm
Raios '! e X
Limite do microscópio eletrônico _,....
1
J
Proteínas
nm } - - Aminoácidos
1 - - - - - Átomos
ACÉLULA
Quadro 1.2 Relações entre as dimensões lineares e os pesos
Dimensão linear
Peso
Terminologia
1 cm
1 mm
100 µ,m
1 µ,m
1g
Bioquímica convencional
Microquímica
Histoquímica }
Citoquímica
Ultramicroquímica
1mg, 10- 3 g
1 µ,g , 10- 6 g
1pg, 10-12 g
co. Vale a pena lembrar que o microscópio óptico permite um aumento de 500 vezes com relação
à resolução do olho humano, e o microscópio eletrônico um aumento 500 vezes maior que o microscópio óptico.
No Quadro 1.2, encontram-se apresentadas as relações gerais entre as dimensões lineares e os
pesos que são usados na análise química da matéria viva. É essencial nos familiarizarmos com
estas relações para o estudo da biologia molecular da célula. O peso dos componentes celulares é
expresso em picogramas (1 pg = 1 µµg , quer dizer 10- 12 g) e o das moléculas em dálton. Um
dálton (Da) é equivalente ao peso de um átomo de hidrogênio, porém, às vezes, utilizamos o seu
múltiplo, quilodálton (1 kDa = 1.000 Da). Por exemplo, uma molécula de água pesa 18 Da e uma
de hemoglobina, 64,5 kDa.
CARACTERÍSTICAS GERAIS DAS CÉLULAS
1-3. Existem células procariontes e células eucariontes
No começo do capítulo, dissemos que a vida se manifesta em milhões de espécies diferentes
que possuem comportamentos, formas e funções próprias. As espécies são ordenadas em grupos
de organismos cada vez mais amplôs - gêneros, famílias , ordens - até chegar ao nível dos reinos clássicos: vegetal e animal. Uma das classificações mais üsadas propõe' a divisão em cinco
reinos: morrera, protista, fungos , vegetal e animal, com suas subdivisões correspondentes (Qua~~dro 1.3).
.
Este quadro pode ser simplificado se examinarmos as distintas formas viventes em nível celular. Assim, é possível classificar as células em duas categorias reconhecíveis: procariontes e
eucariontes. No Quadro 1.3, verificamos que apenas os morreras (quer dizer, as bactérias e as
algas azuis) são células procariontes, enquanto todos os demais reinos são integrados por organismos compostos por células eucari9ntes.
• A principal diferença entre ambos os tipos celulares é que as céluh:is prQcariontes não possuem
eUYoltório nuclear. O cromossomo das células procariontes ocupa o espaço, dentro delas, denominado nucleóide e se encontra em contato direto com o resto do protoplilsma. Por outro lado, as
células eucariontes possuem um núcleo verdadeiro com um envoltório nuclear complicado,.atraés do qual ocorrem as trocas nucleocitoplasmáticas .. No Quadro 1.4 é estabelecida a comparação
da organização estrutural nos procariotas e nos eucariotas, o que ilustra as diferenças e as semelhanças entre os dois tipos celulares.
---
Quadro 1.3 Classificação das células e dos organismos
Células
Reino
Organismos representativos
Procariontes
Moneras
Eucariontes
Protistas
Bactérias
Algas azuis,
Protozoários
Cri só fitas
Mofas
Fungos verdadeiros
Algas verdes
Algas vermelhas
Algas pardas .
Briófitas
Traqueófitas
Metazoários
Fungos
Vegetais
Animais
•
3
4
•
ACÉLULA
Quadro 1.4 Organização celular em procariotas e eucariotas
En voltório nuclear
DNA
Cromossomos
Nucléolos
Divisão
Ribossomas
Endomembranas
Mitocôndrias
Cloroplastos
Parede celular
Exocitose e endocitose
Citoesqueleto
Procariotas
Eucariotas
Ausente
Desnudo
Únicos
Ausentes
Fissão binária
Presente
Combinado com proteínas
Múltiplos
Presentes
Mitose ou meiose
70S* (SOS
+ 30S)
Ausentes
Ausentes
Ausentes
Não celulósica
Ausentes
Ausente
SOS (60S
+ 40S)
Presentes
Presentes
Presentes em células vegetais
Celulósica em células vegetais
Presentes
Presente
'''S corresponde à unidade Sveclberg de sed imentação, que depe nde da densidade e da fotma da molécul a.
~
Do ponto de vista evolutivo, os procariotas são considerados antecessores dos eucariotas. Os
fósseis que datam de três bilhões de anos manifestam-se unicamente como procariotas, tanto que
os eucariotas provavelmente só aparecerão depois de bilhões de anos . Apesar das diferenças entre
os procariotas e os eucariotas, existem grandes semelhanças em sua organização molecular e em
suas funções. Por exemplo, ambos os tipos de organismos utilizam o mesmo código genético e
um maquinário similar para sintetizar proteínas.
1tf' 1- 4. Existem organismos autótrofos e organismos heterótrofos
O sol constitui a fonte original de energia para os organismos vivos. A energia incluída nos
fóton s é captada pelo pigmento chamado cloi;ofila - que se encontra nos cloroplastos dos vegetais verdes - e se acumula sob a forma de energia química nos diferentes alimentos consumidos
por outros organismos.
As células e os organismos pluricelulares (ou multicelulares) podem se agrupar em duas classes principais segundo o mecanismo que utilizam para extrair energia para seu próprio metabolismo. Os que pertencem à primeira classe - denominados autótrofos (p. ex., os vegetais verdes)
- utilizam o processo de fotossíntese para transformar C0 2 e H2 0 em carboidratos simples, a
partir dos quais podem produzir moléculas mais complexas. Os pertencentes à segunda classe-:chamados heterótrofos (p. ex. , os animais) - obtêm energia dos carboidratos, das gorduras e das
proteínas sintetizados pelos organismos autótrofos . A energia contida nessas moléculas orgânicas
_ é liberada mediante a combustão de 0 2 atmosférico (quer dizer, por oxidação), por um processo
denominado respiração aeróbica. A liberação, pelos organismos heterótrofos , de H20 e C0 2 , gerados por esse processo, completa o ciclo energético (Fig. 1.2).
Estes ciclos energéticos mantiveram-se relacionados entre si ao longo da evolução. Entre os
procariotas existem algumas espécies autótrofas e outras heterótrofas. Os vegetais (com exceções)
são autótrofos, enquanto os animais e os fungos são heterótrofos.
-
Glicose
Fótons
1t
Células
fotossintéticas
Fig. 1.2 Esquema do ciclo de
energia entre as células
autótrofas (fotossintéticas) e
heterótrofas.
Células
heterótrofas
A CÉLULA
•
5
1- 5. Organização geral das células procariontes
Bactérias. Embora este livro seja dedicado às células eucariontes dos organismos mais complexos, grande parte do conhecimento sobre biologia celular provém de estudos realizados em vírus
e bactérias. Uma célula bacteriana como a da Escherichia coli apresenta a vantagem do cultivo
fácil a 37º C em soluções aquosas de íons inorgânicos, glicose, aminoácidos e nucleotídeos, onde
duplica sua massa e se divide em aproximadamente 20 minutos. Devemos assinalar que a Escherichia coli pertence à classe de bactérias que não se coram pelo método de coloração desenvolvido pelo microbiólogo H.C. Gram e, por isso, são conhecidas como bactérias Gram-negativas.
Tanto a eletromicrografia quanto o esquema na Fig. 1.3 mostram que a membrana plasmática
dessas bactérias é circundada por uma parede celular que serve de proteção mecânica, é rígida e
consiste em duas camadas: uma interna de peptidoglicana e outra conhecida como membrana
extern~. Note-se que ambas são separadas pelo espaço periplasmático. A peptidoglicana é uma
macromolécula contínua composta por carboidratos incomuns unidos por peptídeos curtos. Por
outro lado, a membrana externa é uma dupla camada de lipoproteínas e lipopolissacarídeos com
estrutura similar à membrana plasmática. Um de seus complexos protéicos presentes na membrana externa recebe o nome de porina, por form ar um canal transmembrana que permite a difusão
livre de solutos.
A membrana plasmática* é uma estrutura lipoprotéica que serve de ban-eira para os elementos
presentes no meio circundante. Esta membrana, ao controlar a entrada e saída dos solutos, contribui
para o estabelecimento de um meio perfeitamente regulado no protoplasma da bactéria. Vale a pena
assinalar agora que nos procariotas os complexos protéicos da cadeia respiratória (Cap. 8-1 1) e os
fotossistemas utilizados na fotossíntese (Cap. 9-8) estão localizados na membrana plasmática.
No protoplasma encontram-se partículas de 25 nm de diâmetro, denominadas ribossomas,
compostas de ácido ribonucléico (RNA) e proteínas; estas contêm uma subunidade grande e outra
pequena. Os ribosSümas estão agrupados em polirribossomas e neles tem lugar a síntese protéica.
Ademais: o protoplasma contém água, íons, outros tipos de RNA, proteínas estruturais e enzimáticas, diversas moléculas pequenas, entre outras estruturas.
O cromossomo bacteriano é uma molécula circular única de DNA desnudo, bem pregueado
dentro do nucleóide, que, visto à microscopia eletrônica, é observado como a região mais clara do
protoplasma (F.ig. 1.3). É impmtante lembrar que o DNA da Escherichia coli, que possui um com-
A
Membrana plasmática
*N.R.T.: Também chamada plasmalema ou mem brana celular.
Fig. 1.3 A. Eletromicrografia de
uma Escherichia coli que
mostra, por fora da membrana
plasmática, o espaço
periplasmático e a membrana
extern a da parede celular. O
nucleóide aparece como um a
região irregular de pouca
densidade eletrôni ca. O restante
do protopl asma está ocupado por
ribossomas . (Cortesia de B.
Menge, M. Wurtz e E.
Kellenberger.) B. Esquema da
parede celular de uma bactéria
Oram -negativa. Observe a
peptidoglicana e a membrana
externa, cuja dupla camada
lipídica é atravessada por
porinas. No lado inferior da
figura, vê-se uma parte da
membrana plasmática.
6
•
ACÉLULA
primento de aproximadamente 106 nm (1 mm), contém informação genética para codificar entre
2.000 e 3.000 proteínas diferentes .
O cromossomo dos procariotas está unido à membrana plasmática. Acredita-se que esta fixação contribua para a separação dos cromossomos-filhos depois da replicação do DNA. Esta separação ocorreria com o aumento da membrana plasmática interposta entre ambos os cromossomos.
Além do cromossomo, algumas bactérias contêm um DNA pequeno - também circular denominado plasmídio. O plasmídio pode conferir à célula bacteriana resistência a um ou a vários antibióticos. Com o uso de técnicas de engenharia genética (Cap. 23 -34) é possível isolar os
plasmídios, inserir-lhes fragmentos específicos de DNA (genes) e, em seguida, transplantá-los a
outras bactérias.
Micoplasmas. A maioria das células procariontes é pequena (mede entre 1 e 10 µm), porém
algumas podem alcançar um diâmetro de até 60 µm. Entre os organismos vivos que possuem a
massa menor, os que melhor se adaptam para o seu estudo são as pequenas bactérias chamadas
micoplasmas, que produzem doenças infecciosas em diferentes animais e no homem e podem ser
cultivadas in vitro como qualquer outra bactéria. Estes agentes têm o diâmetro de 0,1 a 0,25 µm,
como o de alguns vírus grandes. Sua importância biológica baseia-se no fato de possuírem uma
massa mil vezes menor que o tamanho médio de uma bactéria e um milhão de vezes menor do que
o de uma célula eucarionte.
Vírus. Os vírus foram reconhecidos por sua propriedade de atravessar os poros de um filtro de
porcelana (daí sua denominação original de vírus filtráveis) e pelas alterações patológicas que
produzem nas células. O tamanho dos vírus varia entre 30 e 300 nm e sua estrutura mostra diferentes graus de complexidade. Muitos apresentam simetria icosaédrica (Fig. 1.4), que deriva do
modo como se combinam entre si certas unidades protéicas chamadas capsômeros, que formam
o envoltório do vírus ou capsídeo.
Os vírus não são considerados células verdadeiras. Embora participem de algumas propriedades celulares - como a auto-reprodução, a herança e a mutação gênica - , dependem de células
hospedeiras (procariontes ou eucariontes) para manifestá-las. Fora da célula hospedeira, os vírus
são metabolicamente inertes e até podem se cristalizar; ativam-se (quer dizer, se reproduzem)
quando ingressam em uma célula.
De acordo com o tipo de ácido nucléico que os vírus contêm, existem dois tipos de vírus: 1) os
que possuem uma molécula de RNA como cromossomo (p. ex., o vírus da AIDS); e 2) os que têm
uma molécula de DNA (p. ex. , os vírus bacterianos ou bacteriófagos).
Os vírus replicam seus genes para se reproduzirem. Também eles os transcrevem (em RNA
mensageiros), porém dependem do maquinário biossintético da célula hospedeira (quer dizer, ribossomas, RNA de transferência, enzimas, aminoácidos etc.) para sintetizar suas proteínas (p. ex .,
os capsômeros).
Os vírus são produzidos por um processo de agregação macromolecular, o que significa que
seus componentes são sintetizados separadamente em diferentes lugares da célula hospedeira e,
em seguida, reunidos de maneira coordenada em outra parte dela.
Os bacteriófagos são vírus que usam como hospedeiros as células bacterianas. O DNA encontra-se na cabeça do bacteriófago e é injetado na bactéria por meio de uma cauda que se adere à
parede da célula hospedeira e atua como uma seringa. Os processos posteriores na bactéria são
muito rápidos e começam com a hidrólise enzimática de seu DNA. Os nucleotídeos resultantes
são utilizados para sintetizar o DNA de novos bacteriófagos. A partir deste DNA são sintetizados
Fig. 1.4 Eletromicrografia de
vírus corados negativamente.
O desenho do detalhe mostra a
estrutura icosaédrica do vírus e
as pentanas (em preto) e hexanas
dos capsômeros.
A CÉLULA
-
7
Fig. 1.5 Escherichia coli
infectada por um bacteriófago
(compare com a Fig. 1.3 de
controle). Observam-se alguns
resíduos do bacteriófago
aderidos à parede celular (setas)
depois da entrada do DNA. O
nucleóide não pode ser visto e a
célul a aparece repleta de vírus.
(Cortesia de B. Menge, M.
Wurtz e E. Kellenberger.)
os RNA mensageiros e as proteínas estruturais dos vírus. Finalmente, todos estes componentes
são reunidos e os bacteriófagos maduros são arrumados dentro da bactéria infectada. Como se vê
na Fig. 1.5 , depois de ter sido infectada por um bacteriófago, a Escherichia coli aparece repleta de
vírus e pronta para se romper e, assim, deixar os novos bacteriófagos em liberdade.
Quando se trata de vírus que infectam células eucariontes, o p rocesso é mais complexo. Assim,
o DNA ou o RNA do vírus se replica no núcleo da célula hospedeira e as proteínas virais são sintetizatlas nos ribossomas citoplasmáticos. Em seguida, os novos componentes virais combinamse entre si no interior da célula.
Para concluir o estudo dos vírus, nós os comparamos com as células verdadeiras. Estas possuem: 1) um programa genético específi co que permite a formação de novas células similares às
predecessoras;,. 2) uma membrana plasmática que regula as trocas entre o interior e o exterior da \O
célula; 3) umá estrutura que retém a energia dos alimentos, e 4) um maquinário que sintetiza proteínas. Como vimos, os vírus possuem ap en ~s a primeira destas fac uldades e são desprovidos das
demais. Por este motivo, não são considerados como células verdadeiras, apesar de conterem os
_)
padrões genéticos para codificar suas proteínas e se reproduzir.
1-6. Organização geral das células eucariontes
•
l
Uma vez estudada a organização das células procariontes, é conveniente voltar a observar o
Quadro 1.4, onde estão resumidas as principais diferenças com as células eucariontes. Se compararmos a organização da Escherichia coli (Fig. 1.3) com a de uma célula vegetal (Fig. 1.6) ou de
uma célula animal (Fig. 1.7), a complexidade destas últimas chama a nossa atenção.
Na célula eucarionte em interfase, o núcleo constitui um compai1imento separado, limitado \ (J
pelo envoltório nuclear. Outro compartimento é representádo pelo citoplasma, que se encontra )'.1
circundado pela membrana plasmática que, às vezes, mostra diferenciações . Por sua vez, cada
um destes três componentes principais contém vários subcomponentes ou subcompartimentos.
Podemos utilizar o Quadro 1.5 como um guia que resume esta organização complexa, já que nele,.
estão enumeradas as funções mais importantes de cada componente.
__,,
1- 7. Existe uma grande diversidade morfológica entre as células eucariontes
As células de um organismo multicelular têm formas e estruturas variáveis e se diferenciam de
acordo com suas funções específicas nos diferentes tecidos. Esta especialização funcional faz com
que as células adquiram características singulares, mesmo quando em todas elas persiste um modelo de organização comum (Fig. 1.8).
Alguns tipos celulares, como os leucócitos, mudam de forma constantemente. Outros, como as l
células nervosas e a maioria das células vegetais, possuem uma conformação bastante estável. A 1
forma de uma célula depende de suas adaptações funcionai s, do citoesqueleto presente em seu b
cit_oplasma, da ação mecânica exercida pel as células adjacentes e da rigidez da- membrana piasmat1ca.
O tamanho das células oscila dentro de limites amplos. Embora algumas possam ser observadas a olho nu, a maioria das células é visível unicamente ao microscópio, posto que têm apenas
poucos micrômetros de diâmetro (Fig. 1.1).
J
í)
8
•
ACÉLULA
Fig. 1.6 Esquema da ultraestrutura de uma célula vegetal
idealizada, com seus principais
componentes.
Membrana plasmática
Cloroplasta
Retículo
endoplasmático
rugoso
-
Plasmodesma
l
~
. O volume da célula é bastante constante nos diferentes tipos celulares e é independente do ta\manho do organismo. Por exemplo, as células do rim e do fígado têm quase o mesmo tamanho no
elefante e no rato. Assim, a massa de um órgão depende do número e não do volume das células.
1- 8. A membrana plasmática separa o conteúdo da célula do meio externo
)
A estrutura que separa o conteúdo da célula do meio externo é a membrana plasmática. Tra-
i ta-se de uma película delgada de 6 a 10 nm de espessura, composta de uma dupla camada lipídica
"contínua e proteínas intercaladas ou aderidas a sua superfície.
A membrana plasmática só pode ser visualizada ao microscópio eletrônico, que revela suas
numerosas diferenciações e os diferentes tipos de estruturas que unem as células entre si ou que as
conectam com certos componentes da matriz extracelular (Fig. 1.7).
A membrana plasmática controla de maneira seletiva a passagem de solutos. Além disso, pro\ move a entrada e saída de macromoléculas por meio dos processos chamados endocitose e exoci;.. tose, respectivamente (Quadro 1.5). Nas células animais, a membrana plasmática pode contar com
uma quantidade abundante de carboidratos (Fig. 3.14), enquanto nas células vegetais sua superfí' cie é coberta por um segundo envoltório de espessura relativamente estável, denominada parede
,~elular (Fig. 1.6).
·
1- 9. O citoplasma contém uma matriz denominada citosol
O compartimento citoplasmático apresenta uma organização estrutural muito complexa, já que
seu estudo à microscopia eletrônica revela um assombroso conteúdo de membranas.
ACÉLULA
•
Fig. 1. 7 ~~Uel11Il geral da
ultra-estrutura de uma célula
animal idealizada, com seus
principais comp_onemes.
Vesícula
pmocít1ca ~
Membrana
plasmática
Nucléolo
Núcleo
Quadro 1.5 Organização geral da célula eucarionte
r Principais componentes
Membrana celular
Núcleo
Citosol
Citoesqueleto
Estruturas microtubulares
Organelas do sistema de
endomembranas
Outras organelas
Subcomponentes
Função principal
Parede celular
Cobertura celular
Membrana plasmática
Proteção
Interações celulares
Permeabilidade, exocitose e
endocitose
Informação genética
Síntese de ribossomas
Glicólise
Síntese protéica
Forma e mobilidade da célula
Cromossomos
Nucléolo
Enzimas solúveis
Ribossomas
Filamentos intermediários
Microtúbulos e centrossomo
Filamentos de actina
Corpúsculos basais e cílios
Centríolos
Retículo endoplasmático
Complexo de Golgi
i Endossomos e lisossomos
\M itocôndrias
Cloroplastos
Peroxissomas
Mobilidade ciliar
Síntese e processamento de lipídios
e glicídios
Digestão
Síntese de ATP
Fotossíntese
Desintoxicação
9
10
•
ACÉLULA
Fig. 1.8 Alguns dos tipos
celulares encontrados nos
tecidos animais. Observam-se
as diferenças de formas e
tamanhos.
'•
Célula
epitelial
mucosa
Célula
epitelial
ciliada
Célula
mucosa
•
Célula nervosa do cerebelo
Músculo
liso
•
Oócito
Células
do
sangue
Célula
do tecido
conjuntivo
. Célula adiposa
Este sistema de endomembranas ocupa grande parte do citoplasma - que é dividido em numerosas seções e subseções - e é tão polimorfo que acaba se tornando extremamente difícil deÍ fini-lo e descobri-lo. No entanto, em geral , considera-se que o citoplasma se divide em dois grandes compartimentos: um contido dentro do sistema de endomembranas e outro - o citosol ou
matriz citoplasmática - que fica fora. Muitos componentes importantes do citoplasma estão no
citosol, quer dizer, por fora do sistema de endomembranas.
Í O citosol constitui o verdadeiro meio interno da célula. Contém os ribossomas e os filamentos
·ido citoesqueleto - nos quais tem lugar a síntese protéica - e diversas classes de moléculas vinLculadas a numerosíssimas atividades metabólicas.
l
1-1 O. O citoesqueleto é composto por três tipos de filamentos principais
Trê ~
tipos de filamentos principais
o s de actina, os intermediários c os microtúbulos -
e
vários tipos de proteínas acessórias compõem uma espécie de citoesqueleto distribuído por todo
o citosol. O citoesqueleto é responsável pela forma da célula e intervém em outras funções importantes.
Os filamentos de actina medem 8 nm de diâmetro (Fig. 1.9). Entre suas funções mais destacadas está a de conferir motilidade às células.
Os filamentos intermediários, de 10 nm de diâmetro, são formados por proteínas fibrosas e
têm principalmente um papel mecânico.
Os microtúbulos são estruturas tubulares rígidas de cerca de 25 nm de diâmetro (Fig. 1.9).
Nascem de uma estrutura chamada centrossomo, na qual encontram-se os centríolos. Juntamente
com os filamentos de actina têm sob sua responsabilidade o deslocamento das organelas pelo citoplasma. Além disso, os microtúbulos compõem as fibras do fuso mitótico durante a divisão celular.
Os centríolos são estruturas cilíndricas que medem aproximadamente 0,2 µm pm 0,4 µm e
suas paredes são formadas por microtúbulos. Em geral , são duplos e suas duas unidades estão
dispostas perpendicularmente. Embora sejam encontrados nos centrossomos, não intervêm na
formação dos microtúbulos (as células vegetais não contam com centríolos e os microtúbulos são
igualmente formados). Durante a mitose, os centríolos migram para os pólos da célula.
\._,rr 1-11. O sistema de endomembranas engloba o complex9 de Golgi, o retículo
endoplasmático, os endossamos e os lisossomos
A Fig. 1.7 ilustra a continuidade e as interconexões funcionais dos diferentes componentes do
sistema de endomembranas no citoplasma.
.
O retículo endoplasmático constitui a parte mais extensa do sistema de endomembranas (Figs.
l.7'e 1.10). É composto por sacos achatados e túbulos. A superfície externa do retículo endoplas-
ACÉLULA
•
11
Fig. 1.9 Eletromicrografia de
uma célula cultivada. Observamse dois feixes de filamentos de
actina (Ac) , um grande número
de microtúbulos (Mi) e vesículas
repletas de material (Ve).
(Cortesia de K. R. Porter.)
mático rugoso encontra-se coberta de ribossomas, que sintetizam as proteínas destinadas ao sistema de endomembranas e à membrana plasmática. O retículo en1oplasmático liso continua-se com
o rugoso e intervém na síntese de diversas moléculas. D.Q retículo endoplasmáti co , deID!.a=.Se o
envoltório nuclear, comgosto or duas membranas concêntricas. Estas se unem entre si ao nível
os poros nucleares, que são orifícios que permitem a passagem de moléculas entre o núcleo e o
citosol. A membrana nuclear interna encontra-se em contato com os cromossomos, enquanto a
externa pode estar coberta por ribossomas.
O complexo de Golgi é formado por pilhas de sacos achatados, túbulos e vesículas (Figs. 1.7 e
1.10). Neles são processadas as moléculas provenientes do retículo endoplasmático, que em seguida
são incorporadas aos endossomos ou são liberadas (segregadas) para fora da célula por exocitose.
Os endossomos'são organelas destinadas a receber enzimas hidrolíticas provenientes do complexo de Golgi assim como o material que entra na célula por endocitose. Quando ambos os conteúdos são somados convertem-se em li sossomos.
Os lisossomos são organelas polimorfas (Figs. 1.7 e 1.11). Contêm as enzimas hidrolíticas responsáveis peia digestão das substâncias incorporadas na célula por endocitose. Também degradam as organelas envelhecidas (autofagia).
1-12. As mitocôndrias e os plastídios são organelas fundamentais para o
funcionamento celular
As mitocôndrias são encontradas praticamente em todas as células eucariontes. São estruturas
cilíndricas de cerca de 3 µm de comprimento por 0,5 µm de diâmetro que possuem duas membra' nas . A membrana mitocondrial externa encontra-se separada da membrana interna pelo espaço
intermembranoso. A membrana interna circunda a matriz mitocondrial e é pregueada. Estas pregas dão lugar às chamadas cristas mitocondriais, que invadem a matriz (Figs. 1.7 e 1.11). Amembrana interna e a matriz mitocondrial contêm numerosas enzimas que intervêm na extração da
energia dos alimentos e em sua transferência ao ATP.
As células vegetais possuem organelas denominadas plastídios, que estão ausentes nas células
animais. Alguns, como os leucoplastos, são incolores e participam do armazenamento do amido .~
Outros contêm pigmentos e são denominados cromoplastos; entre os mais importantes estão os
cloroplastos, com um pigmento verde chamado clorofila (Fig. 1.6). O cloroplasto possui duas
membranas, um estroma e um compartimento singular formado por sacos achatados denominados tilacóides. Nos cloroplastos, tem lugar a fotossíntese , que é o processo pelo qual as plantas
captam energia da luz e, com o affürfe de H 20 e C0 2 , sintetizam diversos compostos orgânicos
que aproveitam como alimento e cilleServem para alimentar os organismos heterótrofos.
Tanto as mitocôndrias quanto os cloroplastos contêm cromossomos circulares pequenos , cujos
genes formam RNAt, ribossomas e alguns poucos RNAm necessários para elaborar algumas pro\teínas pertencentes às próprias organelas.
·
12
•
A CÉLULA
1-13. Os peroxissomas têm funções desintoxicantes
Os peroxissomas são envoltos pol' uma única membrana. Contêm enzimas vinculadas à degradação do peróxido de hidrogênio (H 2 0 2 ) e uma de suas funções é proteger a célula.
1-14. A presença do núcleo caracteriza a célula eucarionte
Salvo exceções, todas as células eucariontes possuem núcleo. Em geral, as formas do núcleo e
da célula estão relacionadas. Por exemplo, nas células esféricas, cúbicas e poliédricas, o núcleo
deve ser esférico, enquanto nas cilíndricas e fusiformes, ele deve ser elipsóide.
Nas diferentes células somáticas, os núcleos têm tamanhos específicos, que dependem das proteínas neles contidas. Esses tamanhos variam discretamente com a atividade nuclear. Em geral,
existe uma proporção ideal entre o volume do núcleo e o volume do citoplasma; esta proporção é
conhecida como relação nucleocitoplasmática.
Quase todas as células são mononucleadas, porém existem algumas binucleadas (p. ex., as células
hepáticas e as células cartilaginosas) e outras polinucleadas. Nos plasmódios e nos sincícios que constituem grandes massas citoplasmáticas não divididas em territórios celulai·es independentes
- os núcleos podem ser extraordinariamente numerosos. Assim é o caso da célula muscular estriada e do sinciciotrofoblasto placentário que podem conter várias centenas de núcleos.
O crescimento e o desenvolvimento dos organismos vivos dependem do crescimento e da
multiplicação de suas células. Nos organismos unicelulai·es, a divisão celular implica sua reprodução; por este processo, a partir de uma célula se originam duas células-filhas independentes. Ao
contrário, os organismos multicelulares derivam-se de uma única célula - o zigoto-, e a multiplicação repetida desta e de suas descendentes determina o desenvolvimento e o crescimento
corporal do indivíduo.
A célula cresce e duplica todas as suas moléculas e estruturas antes que ocorra sua divisão.
Este processo se repete novamente nas duas células-filhas, de modo que o volume total das células descendentes é quatro vezes maior que o da célula original, e assim sucessivamente.
As células passam por dois períodos no curso de suas vidas: um de interfase (sem divisão) e
outro de divisão (no qual são produzidas duas células-filhas). Este ciclo se repete epi. cada geração celular, porém 9 tempo varia consideravelmente de um tipo celular para outro. l'A. função essencial do núcleo é proporcionar à célula informações genéticas armazenadas no DNA.~
As moléculas de DNA duplicam-se durante um período especial da interfase denominado fase
S (de síntese de DNA), em preparação para a divisão celular (Fig. 18.2).
Durante a interfase, a informação contida nos genes é transcrita em diferentes classes de moléculas de RNA (mensageiro, ribossômico e de transferência), que, depois de passarem para o citoplasma, traduzem-essa informação e sintetizam.proteínas específicas.
No núcleo interfásico humano são reconhecidas as seguintes estruturas (Fig. 1.7): 1) o envoltório nuclear ou carioteca, composto por duas membranas perfuradas por orifícios chamados
poros nucleares; 2) a matriz nuclear ou nucleoplasma, que ocupa grande parte do espaço nuclear; 3) o nucléolo, que é maior nas células com síntese protéica muito ativa, e geralmente esférico,
pode ser único ou múltiplo e nele são sintetizados os RNA ribossômicos, que se associam a numerosas proteínas para formar os ribossomas; 4) 46 cromossomos ou fibras de cromatina, compostos de DNA e de proteínas básicas chamadas histonas.
O DNA e as histonas form am estruturas gra~ulares em cerca de 10 nm de diâmetro - conhecidas como nucleossomas - , que se alternam com segmentos de DNA livres de histonas. A cromatina assim disposta é a mais delgada (Fig. 12.10) e é capaz de se enrolar sobre si mesma em
graus distintos. Na iqterfase, podem-se observar regiões de eucromatina, onde as fibras se encontram menos enroladas, e regiões de heterocromatina, que representam as partes da cromatina
mais condensadas. Durante a divisão celular, as fibras de cromatina enrolam-se ao máximo, de
modo que elas podem ser observadas ao microscópio óptico sob a forma de cromossomos (do grego
chrõma , cor, e sôma , corpo) (Fig. 12.14).
1-15. Os núcleos das células somáticas contêm dois jogos de cromossomos
homólogos
Os organismos pluricelulares que se reproduzem sexualmente desenvolvem-se a partir de uma
única célula - o zigoto ou célula-ovo-, que resulta da união de um ovócito* com um espermatozóide durante a fecundação.
''N.R.T.: Os especiali stas em reprodução preferem empregar o termo oócito.
A CÉLULA
•
13
Fig. 1.10 Eletromicrografia de
um plasmócito. Próximo do
núcleo (N) observa-se o
complexo de Golgi (G),
constituído por pequenas
cisternas achatadas e vesículas .
Algumas vesículas encontram-se
repletas de material (setas). Em
tomo do complexo de Golgi ,
existe um abundante retículo
endoplasmático rugoso (RER)
com cisternas cheias de material
amorfo (setas) . Ri, ribossomas;
M, mitocôndrias; EN, envoltório
nuclear. 48 .000 X; detalhe,
100.000 X. (De E. D. De
Robertis e A. Pellegrino de
Iraldi.)
As células somáticas descendentes do zigoto contêm dois jogos idênticos de cromossomos. Em
outras palavras, os cromossomos apresentam-se em pares. Um cromossomo de cada par é fornecido pelo ovócito e o outro pelo espermatozóide.
Os dois membros de cada par de cromossomos são denominados homólogos, e para indicar o
número de cromossomos de uma espécie fazemos referência aos pares de cromossomos ou aos
pares de homólogos. Por exemplo, o ser humano possui 23 pares de cromossomos, totalizando 46.
Os homólogos de cada par são praticamente idênticos, porém os pares de homólogos distintos são
diferentes entre si.
Para nos referirmos à presença dos dois jogos de cromossomos homólogos , utilizamos a expressão diplóide (2n). Nas células somáticas, ambos os jogos de cromossomos são conservados
durante as sucessivas divisões celulares ao longo do desenvolvimento embrionário, do crescimento
corporal e da manutenção dos tecidos na vida pós-natal.
14
•
ACÉLULA
Fig. 1.11 Região periférica de
uma célula hepática na qual,
entre outros componentes,
observam-se lisossomos (L), o
núcleo (N), um canalículo biliar
(CB), mitocôndrias (M), o
retículo endoplasmático (RE) e
inclusões de glicogênio (G/).
31.000 X. (Cortesia de K. R.
Porter.)
1-16. A mitose mantém a continuidade e o número diplóide dos
cromossomos
A estabilidade do número de cromossomos é mantida por meio de um tipo especial de divisão
celular, denominada mitose. Nela são gerados núcleos-filhos com o mesmo número de cromossomos; por conseguinte, quanto a sua constituição cromossômica, as células-filhas são idênticas
entre si e a suas antecessoras.
A mitose compreende uma série consecutiva de fases conhecidas como prófase, prometáfase, metáfase, anáfase e telófase.
Na mitose, o núcleo sofre uma série de alterações complexas. Entre as alterações mais chamativas estão o desaparecimento do envoltório nuclear e uma maior condensação das fibras de cromatina, que se convertem em cromossomos detectáveis.
ACÉLULA
Vimos que no núcleo interfásico, os cromossomos não podem ser individualizados, porque nesta
etapa do ciclo celul ar, as fi bras de cromatina estão mais desenroladas.
Na Fig. 1.1 2, estão representados dois dos 46 pares de cromossomos homólogos presentes
normalmente nas células somáti cas humanas. Como vimos, os cromossomos duplicam-se durante a fase S da interfase. No inicio da prófase, cada cromossomo - composto por duas fibras de
cromatina - aparece como um filamento muito delgado. Ao final da prófase, converte-se em um
bastão curto e compacto, uma vez que se enrola em suas duas fibras de cromatina, que passam a
ser denominadas cromátides. Passada a metáfase, no transcurso da anáfase, ambas as cromátides
se separam e cada cromátide-filha - quer di zer, cada cromossomo-filho - dirige-se a um dos
pólos da célul a. Finalmente, na telófase, form am-se núcleos um para cada célula a partir dos dois
conjuntos de cromossomos separados . A divisão celular é concluída com a partição do citoplasma, conhecida como citocinese.
Desta maneira, as mitoses mantêm o número diplóide de cromossomos (2n) nas células somáticas ao longo de toda a vida do indivíduo.
MEI OSE
MITOSE
lnterfase
lnterfase
Prófase
(long a e
complexa)
Prótase
(cu rta)
Metáfase
Metáfase 1
Anáfase
Anáfase 1
Telófase
Telófase 1
J
\
JÍ
1n
1n
/r
1n
Telófase li
1n
Fig. 1.12 Esquemas comparativos da mitose e meiose de'uma célula diplóide (2n) com quatro
cromossomos. Os cromossomos precedentes a cada progenitor são representados em azul e em vermelho,
respectivamente. Na mitose, a divisão é equacional, enq uanto na meiose é reducional. As duas di visões da
meiose dão lugar a quatro células hapl óides (1 n) que têm apenas dois cromossomos. Além disso, durante a
meiose, existe um intercâmbio de segmentos entre os cromossomos.
•
15
16
•
A CÉLULA
1-17. A meiose reduz os cromossomos a um número haplóide
Se os gametas (oócito II e espermatozóide) forem diplóides, o zigoto resulta com o dobro do
número diplóide de cromossomos. Para evitar isto, as células sex uais predecessoras dos gametas
sofrem um tipo especial de divisão celular denominado meiose, no qual o número diplóide é reduzido a um jogo único ou haplóide ( 1n) em cada gameta formado. O zigoto resultante será assim
novamente diplóide.
A divi são meiótica ocorre nos animais (Cap. 19-1) e nos vegetais (Cap. 19-20) que se reproduzem sexualmente e têm lugar no curso da gametogênese (Fig. 1.12). A meiose reduz o número de
cromossomos mediante duas div isões nucleares sucessivas - a primeira e a segunda divisão
meiótica - , uma vez que são acompanhadas por uma única duplicação cromossômica.
Em essência, o processo é o seguinte: na prófase da primeira divisão, os cromossomos homólogos se pareiam. Tendo em vista que cada cromossomo é composto de duas cromátides, formam
um bivalente composto por quatro cromátides (por isso é chamado também de tétrade). Além disso, as partes das cromátides pareadas podem se intercambiar de um homólogo para outro. Este
fenômeno recebe o nome de recombinação genética (em inglês, crossing -over).
Na metáfase da mesma divisão, os bivalentes (ou tétrades) dispõem-se no plano equatorial da
célula.
Na anáfase, cada cromossomo homólogo - com suas duas cromátides - dirige-se para um
dos pólos opostos.
Depois de um curto período de interfase, já na anáfase da segunda divisão meiótica, as duas
cromátides de cada homólogo separam-se, de modo que cada cromátide fica localizada em um
dos quatro gametas resultantes. Conseqüentemente, nos gametas, o núcleo contém um número
simples (ou haplóide) de cromossomos (Fig. 1.12).
BIBLIO~RAFIA
Bauneister W. (1978) Biological hori zo ns in molecular mic roscopy.
Cytobiologie 17:246.
Berna! J.D. and Synge A. (1973) The origin of life. ln: Readings in
Genetics and Evolution. Oxford University Press, London.
Bevéridge T.J. (1981) Ultrastructure, chemistry and function of bacterial wall. Int. Rev. Cytol. 72:299.
Claude A. (1975) The coming of age of the cell. Science 189:433.
De Robertis E.D.P. and De Robertis E.M.F. (1981). Essentials of Cell
and Molecular Biology. Saunders, Philadelphia.
Diener T.O. (1981 ) Viroids. Sei. Am. 244:66.
Giese A.C. (1979) Cell Physiology, 5th Ed. Saunders, Philadelphia.
Gray M.W. (1989) The evolutionary origins of organelles. Trends Genet. 5:294.
Hayflick L. (1980) The cell biology of human aging. Sei. Am . 242: 58.
Hess E.L. (1970) Origins ofmolec ular biology. Science 168:664.
Jacob F. (1977) Evolution and tinkerin g. Science 196:1161.
Johnson J.E. (1982) Aging and Cell Structure, Vol 1. Academic Press,.
NewYork.
Joyce G.F. (1992) Directed molec ular evolution. Sei. Am. 267:90.
Lodish H.F. et ai. (1999) Molecular Cell Biology, 4th Ed. W.H. Freeman, New York.
Margulis L. (1971) Symbiosis and evolution . Sei. Am. 225:48.
Margulis L. and Schwartz K.V. (1982) Five Kingdoms. An Illustrated Guide to the Phyla ofLife on Earth. W.H. Freeman & Co, New
York.
Monod J. (197 1) Chance and Necessity. Random House, New York.
Orgel L.E. (1992) Molecular replication, Nature 358:203.
Schwartz R. and Dayhoff M. ( 1978) Origi ns of prokaryotes, eukaryotes,
mitochondria and chloroplasts. Science 199:395.
Watson J.D. et ai. (1987) Molecular Biology ofthe Gene, 4th Ed. W.A.
Benjamin-Cummings, Menlo Park.
Woese C.R. and Fox G.E. (1977) Phylogenetic structure of the
prokaryotic domain: the primary kingdoms. Proc. Natl. Acad. Sei.
USA 74:5088.
Os componentes
químicos da célula
INTRODUÇAO
2-1. Os componentes químicos da célula são classificados
em inorgânicos e orgânicos
A estrutura da célula é a conseqüência de uma combinação de molécul as organizadas em uma
ordem muito precisa. Mesmo havendo ainda muito por aprender, j,á se conhecem os princípios
gerais da organização molecular da maioria das estruturas celulares, como os cromossomos, as
memlnanas , os ribossomas, as mitocôndrias, os cloroplastos etc. A biologia celular é inseparável
da biologia molecular; da mesma fo1ma que as células são os tijolos com os quais se edificam os
tecidos e os organismos, as moléculas são os tijolos com os quais se constroem as células.
No início, o estudo da composição química da célula foi feito mediante a análise bioquímica de
órgãos e tecidos inteiros, como o fígado , o cérebro, a pele ou o meristema vegetal. Estes estudos só
possuem um valor citológico relativo, porque o material analisado geralmente é composto por uma
mescla de diferentes tipos celulares e contém material extracelular. Nos últimos anos, o desenvolvimento .de diversos métodos de fracionamento celular (Caps. 23 -28 a 23-32) permitiu isolar os elementos subcelulares e recolher informações mais precisas sobre a estrutura molecular da célula. ~
Os componentes químicos da célula são classificados em inorgânicos (água e minerais) e orgâ-,
nicos (ácidos nucléicos, carboidratos, lipíoios e proteínas).
/
Do total dos componentes da célula, cerca de 75 a 85% correspondem a água, entre 2 e 3% são ,
constituídos de sais inorgânicos e o restante é formado por compostos orgânicos qw;~ representam as moléculas da vida. A maior parte das estrnturas celulares contém lipídios e moléculas muito
, grandes - denominadas macromoléculas ou polímeros - integradas por unidades ou m onôme~
rosque se conectam por meio de ligações covalentes.
Nos organismos, existem três polímeros importantes: 1) os ácidos nucléicos, formados pela ,
associação de quatro unidades químicas diferentes denominadas nucleotídeos; a seqüência linear
dos quatro tipos de nucleotídeos na molécula de DNA é a fonte primária da informação genética;
2) os polissacarídeos, que podem ser polímeros de glicose - com os quais se formam glicogênio, amido ou celulose - ou compreender a repetição de outros monossacarídeos, com os quais t
se formam polissacarídeos mai s complexos; e 3) as proteínas (polipeptídeos), que são constituídas por aminoácidos - existem 20 tipos - combinados em diferentes proporções; as quantida- j
des e as possibilidades de ordenamento desses 20 monômeros permitem um número extraordinário de combinações, o que determina não somente a especificidade, mas também a atividade biológica das moléculas protéicas.
Além de destacar as características e propriedades dos componentes químicos da célul a, neste
capítulo abordaremos o estudo das enzimas - um tipo específico de proteínas - como instrumentos moleculares capazes de produzir transformações em muitos desses componentes.
Também veremos como as macromoléculas podem se agregar e se organizar em estruturas
supramoleculares mais complexas, até se tomarem visíveis ao microscópio eletrônico. É provável
que tais agregações moleculares tenham atuado durante o período de evolução química e biológica que originou a primeira célula. Por esse motivo, no final deste capítulo, teceremos algumas
considerações especulativas acerca da possível origem das células procariontes e eucariontes, quer
dizer, do aparecimento da vida em nosso planeta. Os conceitos emitidos neste capítulo servem
apenas como uma introdução elementar ao conhecimento da biologia molecular e celular. O estudo mais amplo de seus temas compete aos textos de bioquímica.
2
18
•
OS COM PONENTES QUÍMICOS DA CÉLULA
ÁGUA E MINERAIS
2-2. A água é o componente mais abundante dos tecid~s
Fig. 2.1 Esquema que mostra a
distribuição assimétrica das
cargas na molécula de água.
'
Água. Com poucas exceções - por exemplo, o osso e o dente - a água é o componente encontrado em maior quantidade nos tecidos. O conteúdo de água do organismo está relacionado
com a idade e com a atividade metabólica; é maior no embrião (90-95%) e diminui com o passar
dos anos. A água atua como solvente natural dos íons e como meio de dispersão coloidal da maior
parte das macromoléculas. Mais ainda, é indispensável à atividade metabólica, já que os processos fisiológicos ocoITem exclusivamente em meios aquosos.
Na célula, a água é encontrada em duas frações, uma livre e outra li gada. A água livre representa 95 % da água total , e é parte usada principalmente como solvente para os solutos e como
meio de dispersão do sistema coloidal. A água ligada representa apenas 5% e é a que está unida
frouxamente a outras moléculas por ligações não covalentes (Seção 2-10); assim, compreende a
água imobilizada no seio das macromolécu las.
Como res ul tado da distribuição assimétrica de suas cargas, uma molécul a de água comporta-se
como um dipolo , conforme ilustra a Fig. 2.1. Devido a esta propriedade, a água pode se ligar
eletrostaticamente, por seus grupos positivos e negativos, tanto a ânions e cátions quanto a moléculas com ambos os tipos de carga (p. ex., proteínas). Outra propriedade da molécula de água é
sua ionização em um ânion hidroxila (OH - ) e em um próton ou íon hidrogênio (H+). A uma temperatura de 25ºC, 10- 7 M de H+ por litro de água se dissociam, concentração que COITesponde ao
pH neutro 7.
A água intervém na eliminação de substâncias da célula. Além disso, absorve calor (graças a
seu elevado coeficiente calórico) que evita que sejam geradas mudanças drásticas da temperatura
na célula.
Sais. A concentração de íons é diferente no interior da célula e no meio que a circunda. Assim,
a célula tem uma alta concentração de cátions K+ e Mg 2 +, enquanto o Na+ e o c1 - estão localizados principalmente no líquido extracel ular. Os ânions dominantes nas células são o fosfato (HPO/ - )
e o bicarbonato (HC0 3 - ).
Os sais dissociados em ânions (p. ex., ci - ) e cátions (Na+ e K +) são importantes para manter a
pressão osmótica e.o equi líbrio ácido-básico da célula. A retenção de íons produz um aumento da
pressão osmótica e, portanto, a entrada de água.
Alguns íons inorgânicos (como o Mg 2 +) são indispensáveis como co-fatores enzimáticos. Outros fazem parte de moléculas distintas. O fosfato , por exemplo, é encontrado nos fosfolipídios e
nos nucleotídeos; um destes, a adenosina trifosfato (A TP), é a principal fonte de energia para os
processos vitais da célula. Os íons de Ca2+ que se encontram nas células desempenham um importante papel como transmissores de sinais. Outros íons presentes nas células são o sulfato, o carbonato etc.
Certos minerais são encontrados na forma não ionizada. Assim oc01Te com o cálcio, que nos
ossos e nos dentes encontra-se unido ao fosfato e ao carbonato sob a forma de cristais. Outro exemplo compreende o feITO , que na hemoglobina, na fe rritina, nos citocromos e em várias enzimas
encontra-se unido por ligações carbono-metal.
Para manter a atividade celular normal são indispensáveis quantidades diminutas de manganês, cobre, cobalto, lodo, selênio, níquel , molibdênio e zinco. Quase todos esses elementos vestigiais (ou oligoelementos) são necessários para a atividade de certas enzimas. O iodo é um componente do hormônio tireóideo.
ÁCIDOS NUCLÉICOS
2-3. Existem dois tipos de ácidos nucléicos, o DNA e o RNA
Os ácidos nucléicos são macromoléculas de enorme importância biológica. Todos os seres vivos contêm dofs tipos de ácidos nucléicos, chamados ácido desoxirribonucléico (DNA) e ácido
ribonucléico (RNA). Os vírus contêm um só tipo de ácido nucléico, DNA ou RNA.
O DNA constitui o depósito da informaitão genética. Esta informação é copiada ou transcrita
em moléculas de RNA mensageiro, cujas seqüênci as de nucleotídeos contêm o código que estabelece a seqüência dos aminoácidos nas proteínas. É por isso que a síntese protéica também é
conhecida como tradução do RNA. A esta série de fenômenos é atribuído o caráter de dogma
central da biologia molecular, que pode ser expresso da seguinte maneira:
DNA transcrição
RNA tradução
PROTEÍNA
OS COMPO E 1TES QUÍMICOS DA CÉLULA
•
19
O papel biológico dos ácidos nucléicos será estudado com maiores detalhes nos Caps. 12 a 17;
aqui só consideraremos sua estrutura química, o que permitirá compreender suas funções.
Nas células superiores, o DNA encontra-se no núcleo integrando os cromossomos (uma pequena quantidade encontra-se no citoplasma, dentro das mitocôndrias e dos cloroplastos) . ORNA
localiza-se tanto no núcleo (onde é formado) como no citoplasma, para o qual se dirige a fim de
reger a síntese protéica (Quadro 2.1 ).
Os ácidos nucléicos contêm carboidratos (pentases), bases nitrogenadas (purinas e pirimidinas) e ácido fosfórico. A hidrólise do D A ou do RNA gera:
PENTOSE
BASES
?urinas
{ Pirimidinas
DNA
desoxirribose
adenina, guanina
citosina, timina
RNA
ribose
adenina, guanina
citosina, uracila
P0 4H 3
P0 4H 3
ÁCIDO FOSFÓRICO
A molécula de ácido nucl éico é um polímero cujos monômeros são nucleotídeos sucess ivamente ligados por meio de ligações fosfodiéster (Fig. 2.2). Nestas ligações, os fosfatos unem o
carbono 3' da pentase do nucleotídeo com o carbono 5' da pentase do nucleotídeo seguinte.
Como conseqüência, o eixo de um ácido nucléico é constituído por pentases e fo sfatos, e as
bases nitrogenadas surgem das pentases . A extremidade da molécula que contém a pentase com
o C5' livre é chamada extremidade 5 ' e a que possui a pentase com o C3' livre é denominada
extremidade 3' .
Como ilustra a Fig. 2.2, o ácido fosfórico utiliza dois dos seus três grupos ácidos nas ligaçõ.es 3' ,5 ' -diéster. O grupo restante confere ao ácido nucl éico suas propriedades ácidas , o que
possibilita a formação de ligações iônicas com proteínas básicas (no Cap. 1-14 assinalamos
que, iias células eucariontes, o DNA está associado a proteínas básicas chamadas histonas, com
as qu ais forma o complexo nucleoprotéico denominado cromatina). Além disso, esse grupo
ácido livre faz com que os ácidos nucléicos sejam basófilos (isto é, coram-se com corantes
básicos).
As pentoses são de dois tipos: desoxirribose no DNA e ribose no RNA. A diferença entre
estes açúcares é que a desoxirribose tem um átomo de oxigênio a menos (Fig. 2.2). Para visualizar
o DNA com microscópio óptico podemos utilizar uma reação citoquímica específica denominada
reação de Feulgen (Cap. 23-21 ).
As bases nitrogenadas encontradas nos ácidos nucléicos são também de dois tipos: pirimidinas e purinas ..As pirimidinas possuem um anel heterocíc lico, enquanto as purinas têm dois
anéis fundidos entre si : No DNA, as pirimidinas são a timina (T) e a citosina (C), e as purinas,
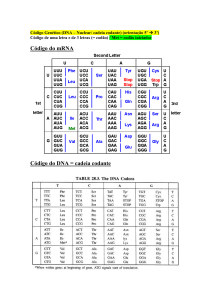
a adenfna (A) e a guanina (G) (Fig. 2.5 ). O RNA contém a üracila (U) no lugar da timina.
Existem três diferenças fundamentai s entre o DNA e o RNA. Como acabamos de assinalar, o
DNA tem desoxirribose e timina (T) e o RNA possui ribose e uracila (U). Outra diferença é que
a molécula de DNA é sempre dupla (contém du as cadeias polinucleotídicas), com veremos na
seção seguinte.
A combinação de uma base com uma pentase (sem o fosfato) constitui um nucleosídeo. Por
exemplo, a adenosina (adenina + ribose) é um nucleosídeo, enquanto a adenosina monofosfato
(AMP), a adenosina difosfato (ADP) e a adenosina trifosfato (A TP) são exemplos de nucle.otídeos (Fig. 2.3).
· ·
\
Quadro 2.1 Ácidos nucléicos
1
Ácido desoxirribonucléico
Ácido ribonucléico
Principalmente no núcleo (também nas
mitocôndrias e nos cloroplastos)
Principalmente no citoplasma (também no núcleo,
nas mitocôndrias e nos cloroplastos)
Papel na célula
Informação ge:_néti ca
Síntese de proteínas
Pen tose
Desoxirribose
Ribose
Bases pirimidínicas
Citosina
Timina
Citosina
Uracila
Bases purínicas
Adenina
Guanina
Ade nina
Guanina
Localização
1
20
•
OS COMPONENTES QUÍMICOS DA CÉLULA
Fig. 2.2 Setor de uma cadeia de
ácido nucléico que mostra os
diferentes tipos de nucleotídeos
que a compõem.
ADENINA .
CITOS INA
TIMINA
= CH 3
URACILA
=H
RIBOSE
X =OH
DESOXIRRIBOSE
X =H
3'
Além de atuarem como tijolos para construção dos ácidos nucl éicos, os nucleotídeos - por
exemplo, o já citado A TP - são utilizados para depositar e transferir energia química. A Fig. 2.3
mostra que as duas ligações fosfato terminais do ATP contêm grande quantidade de energia. Quando
ocorre a hidrólise nestas ligações, a energia liberada pode ser utilizada pela célula para realizar
suas atividades (Fig. 8.1). A ligação -P de alta energia permite que a célula acumule grande quantidade dela em um espaço reduzido e que a mantenha pronta para ser usada no momento em que
for necessário.
Outros nucleotídeos, como a citidina trifosfato (CTP), a uridina trifosfato (UTP), a guanosina
trifosfato (GTP) e a timosina trifosfato (TTP), também têm ligações de alta energia, porém a fonte principal de energia da célula é o ATP.
NH 2
N&>
Fig. 2.3 Estrutura química do
nucleosídeo adenosina e do
nucleotídeo adenosina trifosfato
(ATP).
N
bT
HO
OH
Nucleosídeo
HO
OH
Nucleotídeo
OS COMPONENTES QUÍMICOS DA CÉLULA
O DNA é encontrado nos organismos vivos sob a forma de molécula de peso molecular muito
alto. Por exemplo , a Escherichia coli tem uma molécula de D A circular de 3.400.000 pares
de bases com um comprimento de 1,4 mm. A quantidade de D A nos organismos superiores
pode ser várias centenas de vezes maior - 1.200 vezes no caso do homem. Assim, o DNA
completamente estendido de uma célul a diplóide humana tem um comprimento total de cerca
de 1,7 0 m .
Toda a informação genética de um organismo vivo encontra-se acumu lada na seqüência linear
das quatro bases de seus ácidos nucléicos. A estrutura primária de todas as proteínas (quer dizer,
a quantidade e a seqüência de seus aminoácidos) é codificada por um alfabeto de quatro letras (A ,
T, G, C). Uma das descobe11as mais extraordinárias da biologia molecular foi o achado e a interpretação deste código genético (Cap. 13-4).
Um pas so prévio a esse descobrimento - que teve uma grande influência na el ucidação
da estrutura do DNA - foi saber que, em cada molécu la de D A, a quantidade de adenina
é igual à de timina (A = T) e a de citosina igual à de guanina (C = G). Conseqüentemente, o
número de purinas é idêntico ao de pirimidinas (A + G = C + T ). Como é lógico , a relação
AT/GC varia entre as espécies (p. ex ., no homem , a relação é de 1,52 e na Escherichia coli é
de 0,93) .
5'
21
•
3'
2-4. O DNA é uma dupla hélice
Em 1953, com base nos dados obtidos por Wilkins e Franklin, mediante difração de raios X,
Watson e Crick propuseram um modelo para a estrutu ra do DNA que contemplava as propriedades químicas já citadas e, ainda, as propriedades biológicas, em especi al a capacidade de duplicação da molécula.
A molécula de DNA é ilustrada na Fig. 2.4. Ela é formada por duas cadeias de ácidos nucléicos helicoidais com uma rotação para a direita, que compõem uma dupla hélice em tomo de um
mesmo eixo central. As duas cadeias são antiparalelas, o que significa que suas ligações 3',5 ' fosfodiéster seguem sentidos opostos. As bases estão situadas no lado interno da dupla hélice, quase
em um reto perpendicul ar com relação ao eixo helicoidal. Cada volta completa da dupla hélice
compreende 10,5 pares de nucleotídeos e mede 3,4 nm.
Ambas as cadeias estão unidas entre si por pontes de hidrogênio estabelecidas entre os pares
de bases (seção 2-10). Tendo em vista que entre as pen toses das cadeias opostas existe uma distância fi xa, apenas certos pares de bases podem se estabelecer dentro da estrutura. Como se nota
nas Figs. 2.4 e 2.5, os únicos pares possíveis são A-T, T -A, C-G e G -C. É importante observar
que ente ~ as A e as T fo rmam-se duas pontes de hidrogênio , e entre as C e G, três. Conseqüentemente, o par C-G é mai s estável que o par A-T. A dupla estrutura helicoidal mantém-se estabili.zada gray-as às pontes de hidrogênio e às interações hidrófobas existentes entre as bases de cada
cadeia.
Apesar de, nas diferentes moléculas de DNA, as seqüências das bases ao longo das cadeias
variarem consideravelmente, em uma mesma molécu la de DNA, as seqüências das duas cadeias
são complementares, como se percebe no exemplo seguinte:
Cadei a 1
Cadeia 2
5'
3'
T
G
T
G
A
c
G
T
1
1
1
1
1
1
1
1
A
e
A
c
T
G
c
A
3'
5'
Devido a esta propriedade, quando as cadeias se separam durante a duplicação do DNA, cada
uma delas serve de molde para a síntese de uma nova cadeia complementar. Deste modo são geradas duas moléculas-filhas de DNA com a mesma constituição molecular que possuía a progenitora (Cap. 17-2).
2-5. Existem vários tipos de RNA
A estrutura do RNA é semelhante à do DNA, exceto pela presença de ribose no lugar de desoxirribose e de uracila no lugar de timina (Quadro 2. 1). Ademais, a molécula de RNA é formada
por uma única cadeia de nucleotídeos.
Existem três tipos principais de RNA: 1) RNA mensageiro (RNAm); 2) RNA ribossômico
(RNAr); 3) RNA de transferência (RNAt). Os três intervêm na síntese protéica. O RNAm leva
a informação genética - copiada do DNA - que estabelece a seqüência dos aminoácidos na
proteína. O RNAr representa 50% da massa do ribossoma (os outros 50% são proteínas) , que é a
estrutura que proporciona o apoio molecular para as reações químicas que originam a síntese protéica. Os RNAt identificam e transportam os aminoácidos até o ribossoma.
5'
3'
Fig. 2.4 A dupla hélice de DNA.
As cadeias desoxirribo se-fosfato
fora m desenhadas como fitas.
As bases são perpendiculares ao
eixo do DNA e , nesta visão
lateral, as bases aparecem
representadas por barras
horizontais. Observa-se que as
duas cadeias são antiparalelas e
que a dupla hélice dá uma volta
completa a cada 10 pares de
bases (3 ,4 nrn ). Além disso,
observa-se que a dupla hélice
dá lugar a duas fe ndÇts externas,
o sulco maior e o sulco menor
do DNA.
22
•
OS COMPONENTES QUÍMICOS DA CÉLULA
Fig. 2.5 Os dois pares de bases
do DNA. As bases
complementares são adenina e
timina (A-T) e citosina e guanina
(C-G). Observa-se que, no par
A-T, há duas pontes de
hidrogênio, enquanto no par C-G
existem três . A distância entre as
cadeias de desoxirribose-fosfato
é de aproximadamente 1, 1 nm.
(De L. Pauling e R. B. Corey.)
3'
Apesar de cada molécula de RNA ter uma única cadeia de nucleotídeos, isso não significa que
ele seja sempre uma estrutura linear simples. Nas moléculas de RNA podem existir segmentos
com bases complementares, o que dá lugar a pontes de hidrogênio, quer dizer, à formação de pares de nucleotídeos A-U e C-G entre várias regiões da mesma molécula. As Figs. 14.20, 15.4, ~ . 5,
15.11e16.3 mostram como a molécula de RNA pode dobrar-se sobre si mesma, pareand~-se.
Nelas pode ser formada uma estrutura helicoidal semelhante à do DNA. As estruturas tridimensionais do RNA têm importantes conseqüências biológicas.
CARBOIDRATOS
2-6. Os carboidratos constituem a principal fonte de energia da célula
Os carboidratos (ou hidratos de carbono), compostos por carbono, hidrogênio e oxigênio,
representam a principal fonte de energia para célula e são constituintes estruturais importantes
das membranas celulares e da matriz extracelular. De acordo com o número de monômeros
que contêm, classificam-se em monossacarídeos , dissacarídeos, oligossacarídeos e polissacarídeos.
Monossacarídeos. Os monossacarídeos são açúcares simples com uma fórmula geral Cn(H 20)n.
São classificados, com base no número de átomos de carbono que contêm, em triases, tetroses,
pentases e hexases.
Como vimos, as pentases ribose e desoxirribose estão presentes nos nucleotídeos (Fig. 2.2). A
xilose é uma pentase presente em algumas glicoproteínas (Fig. 2.11). A glicose, que é uma hexase (Fig. 2.6), constitui a fonte primária de energia para a célula. Outras hexases muito importantes
- que podem estar associadas entre si, sob a forma de oligossacarídeos ou polissacarídeos - são
a galactose , a manose, afrutose, afucose, o ácido glicurônico e o ácido idurônico. Algumas
possuem um grupo amina e se encontram acetiladas como a N -acetilglicosamina e a Nacetilgalactosamina. O ácido N-acetilneuramínico (ou ácido siálico) resulta da ligação de uma
amino-hexose com um composto de três carbonos, o ácido pirúvico.
Dissacarídeos. Os dissacarídeos são açúcares formados pela combinação de dois monômeros de hexase, com a perda correspondente de uma molécula de água. Portanto, sua fórmula é
C12H220 11.
Um dissacarídeo importante nos mamíferos é a lactose (glicose + galactose), o açúcar do
leite.
OS COMPONENTES QUÍMICOS DA CÉLULA
Oligossacarídeos. No organismo, os oligossacarídeos não estão livres , mas sim unidos a lipídios e a proteínas, de modo que fazem parte de glicolipídios e de glicoproteínas. Estes carboidratos são cadeias - às vezes ramificadas - compostas por distintas combinações de vários tipos de
monossacarídeos.
Os oligossacarídeos correspondentes aos glicolipídios serão analisados, juntamente com os
lipídios, na próxima seção.
Os oligossacarídeos das glicoproteínas conectam-se com a cadeia protéica por intermédio do
grupo OH (ligação 0-glicosídica ou ligação O) de uma serina ou de uma treonina ou por meio do
grupo amida (ligação N -glicosídica ou ligação N) de uma asparagina. A serina, a treonina e a
asparagina são aminoácidos (Seção 2-8).
No que diz respeito ao oligossacarídeo, nas ligações 0-glicosídicas pode· intervir uma Ngalactosamina e, nos N-glicosídicos, uma N-acetilglicosamina (Figs. 2.7 e 2.8). Portanto, estes
monossacarídeos são os mais próximos da proteína. Ao contrário, os ácidos siálicos às vezes se
localizam na periferia do oligossacarídeo.
Os oligossacarídeos ligados por ligações O (isto é, a uma serina ou a uma treonina) podem possuir
uma galactose ligada à primeira N-acetilgalactosamina (Fig. 2.7) . Em seguida, os monossacarídeos restantes combinam-se de forma diferente, segundo o tipo de oligossacarídeo.
Os oligossacarídeos ligados por meio de ligações N contêm um núcleo pentassacarídico comum, composto por duas N-acetilglicosaminas (uma delas ligada à asparagina) e três manoses
(Fig. 2.8). Os monossacarídeos restantes unem-se a este núcleo em combinações distintas, o que
gera uma extensa variedade de oligossacarídeos e, por conseguinte, uma grande diversidade de
glicoproteínas.
Devemos assinalar que o número de cadeias oligossacarídeas que se ligam a uma mesma proteína é muito variável.
Polissacarídeos-. Os polissacarídeos resultam da combinação de muitos monômeros de hexases, co1l1 a perda correspondente de moléculas de água. Sua fórmula é (C 6H 100 s) Ao se hidrolisar, dão lugar a monossacaiídeos. Os polissacarídeos como o amido e o glicogênio representam
as substâncias de reserva alimentícia das células vegetais e animais, respectivamente (Fig. 2.9).
Outro polissacarídeo, a celulose , é 0 elemento estrutural mais importante da parede da célula vegetal (Fig. 3.30).
Esses três polissacarídeos são polímeros de glicose, porém diferem porque exibem distintos
tipos de ligações entre seus monômeros. Por exemplo, o glicogênio é uma molécula ramificada na
qual as glicoses estão ligadas por ligações al-4 e a l-6 (Fig. 2.9) .
· Existem polissacarídeos complexos chamados glicosaminoglicanas (GAG), que são compostos por uma .sucessão de uma mesma unidade dissacarídica na qual um dos dois monômeros é um
ácido glicurônico, um ácido idurônico ou uma galactose e o outro possui um grupo amina, já que
é uma N-acetilglicosamina ou uma N-acetilgalactosamina (Fig. 2.10) .
As GAG mais importantes são o ácido hialurônico ,* o sulfato de condroitina, o
dermatansulfato, o heparansulfato e o queratansulfato. No Quadro 6.1 mencionamos as unidades dissacarídicas repetitivas que os integram; como se pode perceber, com exceção do ácido hialurônico, todos os demais são sulfatados.
Quase todas as GAG estão ligadas às proteínas com as quais formam glicoproteínas complexas
chamadas proteoglicanas (Fig. 2.11). Estas moléculas prevalecem no meio extracelular (Cap. 63). A GAG liga-se à proteína mediante um tetrassacarídeo composto por uma xilose, duas galac11
CH, OH
~
CH
GalNAC
Gal - GalN Ac - o -
Fig. 2.6 Molécula de glicose.
•
NH
1
CH
co
HNCOCH,
Gal - GlcNAc '
23
1
.. ·- o-vt-º"'-l o l
NANA
•
Serina .
S·T
Gal - GalNAc /
.. - o VCH,O~
.
Proteína
r
7H
- O - CH - CH
OH
1
HNCOCH,
GalNAC
1
90
Treonina
Fig. 2.7 Oligossacarídeo ligado a
uma proteína por meio de uma
ligação 0-glicosídica. S ·T,
serina ou treonina; NANA, ácido
N-acetilneuramínico; GalNAc,
N-acetilgalactosamina; GlcNAc,
N-acetilglucosamina; Gal,
galactose.
*N.R.T.: Atualmente chamado hialuronana .
/
24
•
OS COMPONENTES QUÍMICOS DA CÉLULA
Fig. 2.8 Oligossacarídeo ligado a
uma proteína por meio de uma
ligação N-glicosídica. Man ,
manose; A, asparagina.
NANA - Gal - Man
"
/ Man - GlcNAc - GlcNAc - N -
NANA - Gal - Man
A
Proteína
Fig. 2.9 O glicogênio é uma
molécul a ramificada que contém
até 30.000 unidades de glicose.
As ligações glicosídicas são
estabelecidas entre os carbonos 1
e 4 das glicoses, exceto nos
pontos de ramificação (1 e 6). A
parte su perior da figura mostra a
molécula com pequeno aumento.
Na parte inferior, se acha
representada a composição
química dil segmento molecular
ressaltado.
~º\7 ~\J ~'\f
H~~O~Q
H
6
~
OH
H
OH
H
OH
}
~ H2
HO~ H 2
HcXH 2
HO~H 2
1
-o
H
Fig. 2.10 Representação de um
pequeno segmento de uma
glicosaminoglicana (GAG). A,
ácido glicurônico ou ácido
idurônico ou galactose; B,N acetilgalactosam ina ou Nacetilglicosamina.
OH
o
H
'IH
OH
R
H
H
'IH
OH
·''"
H
OH
NH
toses e um ácido glicurônico. A xilose liga-se a uma serina da proteína mediante uma ligação O,
enquanto o ácido glicurônico o faz com a primeira hexose da GAG.
LIPÍDIOS
2-7. Os triglicerídios, os fosfolipídios e os esteróides são os
lipídios mais abundantes da célula
Os lipídios são um grupo de moléculas caracterizadas por sua insolubilidade em água e solubilidade nos solventes orgânicos. Tais propri edades são devidas às suas longas cadeias hidrocarbonadas alifáticas ou anéis benzênicos, que são estruturas não polares ou hidrófobas. Em alguns li-
OS COMPONE TES QUÍMICOS DA CÉLULA
•
?-
- :l
i
o~º-Grº -Grº~o- CH,-E
:
1
-' n
Tetrassacarídeo
GAG
Serina
pídios, estas cadeias podem estar ligadas a um grupo polar que lhes permite unir-se à água. Os
lipídios mais comuns da célula são os triglicerídios, fosfolipídios, glicolipídios, esteróides e
poliprenóides.
Triacilgliceróis. Os triacilgliceróis (ou triglicerídios) são triésteres dos ácidos graxos com
glicerol. Cada ácido graxo é constituído por uma longa cadeia hidrocarbonada, cuja fórmula
geral é:
Fig. 2.11 Representação de uma
proteoglicana. É mostrado como
a GAG se une à proteína. AcGlu,
ácido glicurônico; Gal,
galactose; Xil, xilose.
COOH
1
(CH 2ln
1
CHJ
Os grupos carboxila destes ácidos reagem com os grupos hidroxila do glicerol da maneira exposta na Fig. 2.12.
Quando apenas dois carbonos do glicerol estão ligados a ácidos graxos, a molécula é chamada
diacilglicerol (DAG) (Fig. 2.13).
Os ácidos graxos têm sempre um número par de carbonos, já que são sintetizados a partir de
grupos..acetila de dois carbonos. Por exemplo, o ácido palmítico tem 16 carbonos, enquanto o
esteárico e o oléico possuem 18. A cadeia hidrocarbonada pode ex ibir ligações duplas (--C=C- ),
e, neste caso, o ácido graxo é denominado insaturado. Estas ligações duplas são importantes porque produzem angulosidades nas cadeias hidrocarbonadas (Fig. 2.20).
Os triacilgliceróis servem como reserva energética para o organismo. Seus ácidos graxos liberam grandes quantidades de energia quando são oxidados; mais do dobro da que liberam os carboidratos.
Fosfolipídios. Nas células, existem dois tipos de fosfolipídio s, os glicerofosfolipídios e os
esfingofosfolipídios.
Os glicerofosfolipídios têm dois ácidos graxos unidos a uma molécula de glicerol, já que o
terceiro grupo hidroxila deste álcool encontra-se esterificado com um fosfato, ligado por sua vez
a um segundo álcool (Fig. 2.14).
A combinação do glicerol com os dois ácidos graxos e o fosfato dá lugar a uma molécula chamada ácido fosfatídico (AF) (Fig. 2.13), que constitui a estrutura básica dos glicerofosfolipídios. Como acabamos de mencionar, estes possuem um segundo álcool, que pode ser a etanolamina, a serina, a colina ou o inositol (Fig. 2.14). Com eles, são obtidos os fosfolipídios chamados
fosfatidiletanolamina (PE),fosfatidilserina (PS),fosfatidilcolina (PC) efosfatidilinositol (PI)
(Fig. 2.15).
Como o inositol do PI pode estar combinado com um, dois ou três fosfatos, a célula também
temfosfatidilinositol 4-fosfato (PIP), fosfatidilinositol 4,5-difosfato (PIP2) e fosfatidilinositol
3,4,5-trifosfato (PIP3) (Fig. 2.16).
Por outro lado, na membrana interna das mitocôndrias, existe um glicerofosfolipídio duplo
denominado difosfatidilglicerol, que comumente tem o nome de cardiolipina (Cap. 8-11). É composto de dois ácidos fosfatídicos ligados entre si por uma terceira molécula de glicerol (Fig. 2.17).
O esfingofosfolipídio existente nas células é a esfingomielina, que é produzida pela combinação da fosforilcolina com a ceramida (Fig. 2.18). A fosforilcolina (um fosfato ligado à colina)
encontra-se também na fosfatidilcolina (Fig. 2.1 5) , enquanto a ceramida é formada pela agregação de um ácido graxo à esfingosina que, como ilustra a Fig. 2.19, é um amino-álcool que possui
uma cadeia hidrocarbonada relativamente longa.
CH, -OH
CH -
OH
+ HOOC -(C H2 ln-CH,
+ H, O
=
CH, - 0 - CO-{C H,>n-CH,
+ H, O
1
1
1
CH, -
(CH 2 }0 - CH,
CH, -0-CO -
+ HOOC - (C H2 ln- CH3
1
OH +
Glicerol
HOOC-{CH,ln-CH,
Ácidos graxos
CH 2 -
0 - CO -
(CH 2 1n- CH3
Triacilglicerol
+ H2 0
Água
Fig. 2.12 Formação de um
triacilglicerol (triglicerídio) a
partir de um glicerol e três
ácidos graxos.
26
•
OS COMPONENTES QUÍMICOS DA CÉLULA
CH, - 0 - CO - (CH,}" -CH,
/
1
?H -
O-
Álcool
CO - (CH, 10 - CH,
1
CH, -
OH
Etanolam_ina
Senna
~ Colina
~ l nositol
O= P - 0 1
o
Diacilglice ro l
1
CH, - O -
CO -
ICH,) 0 -
CH2 -
CH,
CH
CH -
O - CO - (CH 1
CH, -
0 - P~(]H
1
Fig. 2.13 Fórmulas do
diacilglicerol (DAG) e do
ácido fosfatídico (AF).
Fig. 2.15 Representação dos
glicerofosfol ipídios
fosfatidiletanolamina (PE),
fosfatidilserina (PS),
fosfatidilcolina (PC) e
fosfatidilinositol (PI).
CH,
,_
0
·~H1
NH
'
~H2
CH,
l
1
1
O=P - 0
CH,
HO
o1
1
rr
a·
H00
O=P-0
o1
1
o·-r-00
0
HO
OH
1
.
~ - 0~
CH, - ~H - ·
o
1
li
1
o
o
1
(
\
CHi - CH
1
o
1
o
1
1
ff
\
Fosfatid ilinositol fosfato
CH 2 -CH -
CH,.
O
1
1
O= P - OH
1
o
1
~H1 - fH - CH 2
o1
1
OH
1
1
1
o
CHi
ol
-7H
o!
7H~
of
rr Tl
Cardiolipina
1
1
Fosfatidilinositol trifosfato
HO - P=O
1
CH 1
o
ff
Fosfatidilinositol difosfato
O
-
?
?Hi
CH ~"- 7 H
H
OH
0=~ - 0
o'1
<(.Ht
H
o
HO
o
C:;;:O C::;;O
)
ff
o
OH
O= P- 0 '
1
'
o'-Loo
1 _ ºJ~º
OH
- -o
o
o'
1
a·
O = ~ -o-
-
0H
o'
Fosfatidilinositol
-
1
1
CH1 -CH - CH i
1
Fosfatidilcolina
a·
O = ~-o·
CH1
ff
Fosfatidilserina
~ ·- 0"
1
o
1
1
o-
'
OH
OH
o
D=
CH 1 - CH
1
e
e1
0
1
1
ff
HO
o
CH 2 - CH - CH 1
Fosfatidiletanolamina
CH 3
1
1
o1
'
O .= ~ - o·
-
o
o
1
CH 3
o'
o
o
o:;;;P - o·
1
(CH,ln
1
~HJ
1
CH,
'
Fig. 2.17 Molécula do
difosfatidilglicerol ou
cardiolipina.
C=O
0
'
H-C-COO
O :::::
1
ICH,l"
Fig. 2.14 Estrutura química
geral dos glicerofosfolipídios.
Ácido fosfatídico
HO
o
1
1
CH ~- fH-TH 7
Fig. 2.16 Representação dos
glicerofosfolipídios
fosfatidilinositol fosfato (PIP),
fosfatidilinositol difosfato (PIP,)
e fosfatidilinositõl trifosfato
(PIP3).
1
o
C=O
,, o-
ol
CH,
1
1
OS COMPO ENTES QUÍMICOS DA CÉLULA
•
27
C H~
HlC,. ~ _,., CH l
1
~H 2
~ H,
o
O = ~-o­
'
O
OH
1
1
CH - CH - CH
'
1
NH
1
ºI
OH
OH
1
1
CH,- CH- CH
1
1
CH
NH
li
1
f
ºI
1
CH
n
Fig. 2.18 Representação do
esfingolipídio esfingomielina
OH
1
•
1
1
.NH 1
1
~H
f f
Ceramida
Esfingomiel ina
OH
CH,- CH - CH
Esfingosina
Fig. 2.19 Representação
das moléculas de
ceram ida e esfingosina.
(EM).
A Fig. 2.20 mostra que os fosfo lipídios possuem duas caudas hidrófobas não-polares longas (dois ácidos graxos) e uma cabeça hidrófila polar constituída por glicerol (exceto na esfingomielina), um segundo álcool e um fosfato. Portanto, os fosfolipídios são moléculas anfi páticas.
Os fusfolipídios são os principais componentes das membranas celulares e tanto sua anfipatia
como as características de seus ácidos graxos (número de carbonos, presença de ligações duplas)
conferem-lhes muitas de suas propriedades. Além disso, quando os fosfolipídios se di spersam em
água, adotam espontaneamente uma organização idêntica à das membranas celulares, com suas
cabeças polares dirigidas para fora e suas caudas não-polares confrontadas entre si no interior da
dupla camada (Cap. 3-2).
Glicolipídios. Os glicolipídios presentes nas células são classificados em cerebrosídios e gangliosídios.
Os cerebrosídios são formados pela ligação de uma glicose ou de uma galactose com a ceramida (Fig. 2.21). Assim, trata-se de esfingomielinas cujas fosforilcolinas são substituídas por um
destes monossacarídeos.
Colloo {
H 1 c-
~H ,0
7- 0-t 1
CH,
1
CH,
Fosfato {
o-
~t-
oG
1
Ô
Glicerol {
1
---
H
H
1
1
H - C- - C - - C-
1
1
1
o
o
/
O=C
'
/C M1
H, C
H
"'
o=(
'
CM,
/
H2C,
Cl"i1
'"•
H,C
HiC ,
Oleato e
palmitato
/
' CH,
CH,
/
/
H, C-
HC
' CH,
~ \M
"•'
CH,
/
/
"•' '
CH,
/
H,C
.,
,
H,C
,' ' "•
H2C,
CH ,
'CH,
/
H,C
.
'O ·ll
/
/
H,C
'
/ C.H2
HiC '
CH,
H1C,
CH ,
Caudas
hidrófobas
Fig. 2.20 Fosfolipídio com sua
cabeça hidrófila e suas duas
caudas hidrófobas. O
fosfo lipídio representado é o
palmitoil-oleil-fosfatidilcolina.
Observa-se que a ligação dupla
no ácido oléico produz uma
mudança de direção na cadeia
hidrocarbonada (s eta).
28
•
OS COMPONENTES QUÍMICOS DA CÉLULA
HKt>OC:
,OH O
O -
OH
Glicose
ou
galactose
?H
CH2 -
CH -
1
NH
1
O=C
CH
1
CH
li
CH
Ácido siálico
Cerebrosídio
Galactose
Glicose
Gangliosídio
Fig. 2.21 Representação de um
cerebrosídio.
Fig. 2.22 Representação de um gangliosídio.
A estrutura básica dos gangliosídios é similar à dos cerebrosídios, porém o carboidrato não é
a glicose nem a galactose mas sim um oligossacarídeo composto por vários monômeros, um a três
dos quais são ácidos siálicos (Fig. 2.22). Os diferentes tipos de gangliosídios diferem entre si tanto pelo número quanto pelo ordenamento relativo de seus monômeros. O monossacarídeo unido à
ceramida é quase sempre uma glicose seguida de uma galactose. Em seguida pode haver uma Nacetilgalactosamina ou uma N-acetilglicosamina e em seguida outra glicose ou outra galactose.
Às vezes, existe urna fucose. Geralmente, ela ou os ácidos siálicos localizam-se na parte final do
oligossacarídeo.
Esteróides. Os esteróides são lipídios derivados de um composto denominado ciclopentanoperidrofenantreno. Um dos mais importantes é o colesterol (Fig. 2.23), que é encontrado nas
membranas e em outra~partes da célula e também fora dela. A hidroxila de seu carbono 3' lhe
confere propriedades anfipática~.
Os esteróides assumem funções diferentes de acordo com os grupos químicos que estejam unidos
a sua estrutura básica. Os principais esteróides do organismo são os hormônios sexuais (estrógenos, progesterona; testosterona), os hormônios supra-renais (cortisol, aldosterona), a vitamina D
e os ácidos biliares.
Poliprenóides. Os poliprenóides são compostos derivados do hidrocarboneto isopreno (Fig.
2.24). Entre eles encontra-se o dolicol fosfato, uma molécula pertencente à membrana do retículo endoplasmático desenhada para incorporar oligossacarídeos aos polipeptídeos durante
a formação das glicoproteínas (Cap. 7-16). Trata-se de urna cadeia de 17 a 21 isoprenos que
contém entre 85 e 105 átomos de carbono, esterificada com um fosfato (Fig. 2.24 ). Outro
poliprenóide comum nas células faz parte da ubiquinona, uma molécula da membrana rnitocondrial interna (Cap. 8-11) que é composta de uma cadeia de 1O isoprenos e de uma
benzoquinona (Fig. 2.24).
CH 2
li
C- CH 3
1
CH
CH,
1
CH 3
1
CH-(CH2),-CH
CH,
1
CH 3
li
CH
H
:<:H:----:
,.-i--- -- 1
: CH
;
'li
'
: C- CH,:
'1
'
'CH
'
: li
:
: CH
:
·+---n
CH
(15a 19)
1 2
TH - CH,
}
'1
'
• li
•
: CH
:
'1
'
: CH- CH 3 :
lsopreno
f
~OC
_H_,____ i(.~)
H3C .p--
O
Benzoquinona
TH'
CH 2 - 0Colesterol
Fig. 2.23 Molécula de colesterol derivada do composto de 17
carbonos chamado ciclopentanoperidrofenantreno.
or
Dolicol fosfato
[
O
.& OCH 3
oc~
.
Ubiquinona
Fig. 2.24 Molécula de dolicol (composta por 17 a 21 isoprenos) e
de ubiquinona (com seus 10 isoprenos).
OS COMPO.NENTES QUÍMICOS DA CÉLULA
•
29
PROTEÍNAS
2-8. As proteínas são cadeias de aminoácidos unidos
por ligações peptídicas
Os monômeros que compõem as proteínas são os aminoácidos. Um aminoácido é um ácido
orgânico no qual o carbono unido ao grupo carboxila (- COOH) está também ligado a um grupo
amina (-NH2 ). Além disso, esse carbono se encontra ligado a um H e a um resíduo lateral (R) ,
que é diferente em cada tipo de aminoácido.
H
1
H.:-< -C -
COOH
1
R
Por exemplo, na alanina, a cadeia lateral R tem um único carbono, enquanto na leucina tem
quatro.
Ácido aspártico
(Asp) (D)
Ácido g!utâmico
(Glu)( E)
H
1
+
H 3N - C - COO
H
1
+
H 3 N-c-coo-
1
1
CH,
1
CH 2
o
Li sina
(lys) (K)
Arginina
( A.<g) (R)
H
H 3 N - c - coo-
H
1
+
H 3 N - C- COO
H,N-C-COO-
1
1
1
1
CH 1
c=CH
e
/)' \
o
o-
1
1
CH,
1
CH 1
1
1
+1
NH
HN
~ I
1
o-
H
+
CH 1
1
CH1
CH,
1
e
// \
Histidina
(His ) (H)
1
CH,
1
CH1
e
CH,
1
N- H
1
1
+NH ,
BÁSICOS
ÁCIDOS
Se ri na
(Se r)( S)
1
(Th r)(T )
H
H
1
+
H,N-c - coo-
H 3 N-C - COO
1
1
CH 2
-
+
H
1
H,N -c-coo-
H,N- c-coo-
1
1
~
1
CH,
Gtuta m ina
(G ln)( Q)
H
1
+
H-C - OH
1
OH
Asparagina
(Asn)( N)
Tirosina
(Tyr) (Y)
T re onina
H
+
C= NH2
1
NH,
+
1
H 3 N-C-COO-
I
CH 1
CH 1
1
1
e
CH,
// \
O
1
NH 1
e
//'
O NH1
OH
NEUTROS POLAR ES
G líci na
( Gly)(G)
Alan ina
( Ala )(A)
(Val) (V)
Leucin a
(Leu) (l )
H
H
H
H
1
+
1
+
H,N-c-coo·
H,N -c- coo-
1
1
H
Vali na
+
1
+
1
CH
CH 3
/
H
Pro!ina
( Pro) (P)
Fen ila!a n ina
(Phe ) (F )
Triplofano
(Trp)(W)
H
H
H
H
1
I
CH 2
1
+
H2 N-c - cooI
1
H 2C
1
SH
NEUTROS NÃO-POLARES
"
CH/2
CH 2
+
1
H 3 N -C-COO
1
ó
-
cdH,
1
+
CH
/ '\.
1
CH
Cisteína
(Cys)(C)
+
1
CH,
CH 3
/ '\
CH 3
CH 3
H 3 N-C-COO-
1
e-coo·
H,N-
1
'\.
CH 3
(lle) (1)
1
H,N-c - coo·
H 3N - C - COO
1soleucina
H, N-c-coo1
CH 2
CH 3
1
CH 3
Metionina
(M e t)(M)
H
+
1
H 3 N-C - COO
1
CH ,
1 -
CH 2
1
H
s
1
CH ,
Fig. 2.25 Estrutura química dos
vinte aminoácidos, classificados
em ácidos, básicos, neutros
polares e neutros não-polares.
As estruturas que se encontram
sob os grupos amina e carboxila
são. as cadeias laterais R.
30
•
OS COMPONENTES QUÍMICOS DA CÉLULA
Fig. 2.26 Formação de uma
ligação peptídica entre dois
am inoácidos. Também é
mostrado um pentapeptídeo
composto, da terminação amina
à terminação carboxila, por uma
tirosina, uma treonina, um ácido
aspártico, uma metionina e uma
leucina.
H
H
1
1
O
li
H
H
1
1 li
H
peptídica
0
H
O
H
o
O
H
O
H- h- b -~-~ - b- ~- OH
H-N - C- C- OH + H- N -C-C- OH
1
1
CH,
Ligação H- y - OH
1
CH,
CH,
~
1
+
~O
H- C- OH
!<,
1
OH
OH
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
1 1 li 1 1 li 1 1 li 1 1 li 1 1 li
Terminação amina H- N- y - C-N - ? - C- N- y -C-N - ? - C-N- y- C-OH Terminação carboxila
H-~~OH ~r
Q
CH,
O
O
~,.
::
S
J:~
H,C
CH 3
1
CH,
OH
A Fig. 2.25 mostra a estrutura de 20 tipos de aminoácidos existentes nas proteínas. Dois são
ácidos (ácido aspártico, ácido glutâmico); três são básicos (histidina, lisina, arginina); cinco são
neutros polares, quer dizer, hidrófilos (serina, treonina, tirosina, asparagina, glutamina) e dez são
neutros não polares, isto é, hidrófobos (glicina, alanina, valina, leucina, isoleucina, cisteína, prolina, fenilalanina, triptofano, metionina). Os nomes dos aminoácidos são abreviados usando-se as
três primeiras letras da nomenclatura inglesa (salvo cinco exceções) ou por meio de um código
que empregue uma única letra.
Vale lembrar que dois dos am inoácidos contêm um átomo de enxofre. No caso da cisteína, duas
de suas moléculas podem formar uma ponte dissulfeto (-S- S -). Esta ligação é do tipo covalente, já que os átomos de H de ambos os grupos -SH são eliminados (Fig. 2.27).
A combinação dos aminoácidos para formar uma molécula protéica ocorre de tal modo que o
grupo NH 2 de um aminoácido combina-se com o grupo COOH do aminoácido seguinte, com perda de uma molécula de água (Fig. 2.26). A combinação -NH- CO- é conhecida pelo nome de
ligação peptídica. A molécula formada mantém seu caráter anfotérico porque sempre contém um
grupo NH2 em uma extremidade (terminação amina) e um grupo COOH na outra extremidade
(terminação carboxila), além dos resíduos laterais básicos e ácidos.
Uma combinação de dois aminoácidos constitui um dipeptídeo; de três, um tripeptídeo. Quando
se unem entre si alguns aminoácidos , o composto é um oligopeptídeo (Fig. 2.26). Finalmente, um
polipeptídeo é formado por muitos aminoácidos. A maior proteína do organismo contém cerca
de 27.000 aminoácidos (Cap. 5-33).
A distância entre duas ligações peptídicas é de aproximadamente 0,35 nm. Uma proteína com
peso molecular de 30 kDa é constituída por 300 aminoácidos e, estendida, tem o comprimento de
cerca de 100 nm e uma largura de 1 nm.
O termo proteína (do grego, protefon, proeminente) sugere que todas as funções básicas das
células dependem de proteínas específicas. Podemos dizer que, sem as proteínas, não existiria vida;
elas estão presentes em cada célula e em cada organela. Além disso, podem ser estruturais ou enzimáticas.
Fig. 2.27 Estrutura primária de
uma proteína (ribonuclease
pancreática bovina). Vêem-se as
q.u atro pontes dissulfeto entre as
cisteínas. (De C. B. Anfinsen.)
OS COMPONENTES QUÍMICOS DA CÉLU LA
Existem proteínas conjugadas, ligada a porções não protéicas (grupos prostéticos). A esta
categoria pertencem as glicoproteínas (associadas a carboidratos), as nucleoproteínas (associadas a ácidos nucléicos), as lipoproteínas (associadas a gorduras) e as cromoproteínas, que têm
como grupo prostético um pigmento. Dois exemplos de cromoproteínas são a hemoglobina e a
mioglobina, nas quais o grupo prostético é o heme, um composto orgânico que contém ferro e que
se combina com o oxigênio.
2-9. Existem quatro níveis de organização estrutural nas proteínas
•
1
~
J
J-
Na estrutura das proteínas podem-se distinguir quatro níveis sucessivos de organização.
A estrutura primária compreende a ~ü ência dos aminoáciGes-fll:le-fu=an:ut-cadeiaprotéica (Fig. 2.27). Tal seqüência determina os demais níveis de organização da molécula. Sua importância biológica encontra um exemplo na doença hereditária chamada anemia falciforme, na qual
ocorrem alterações funcionais profundas pela substituição de um único aminoácido na molécula
de hemoglobina.
A estrutura secundária diz respeito à configuração espacial da proteína, que se deriva da
poµ_ç.ãO-Ciuletenn.inaàes-ami-ooáG-i@GS-e.IlLSlla-c.ad_eja. Assim, algumas proteínas (ou pai:te delas)
têm uma forma cilíndrica denominada hélice ex (ex, porque foi a primeira a ser descoberta); nela,
a cadeia polipeptídica se enrola em tomo de um cilindro imaginário porque se formam pontes de
hidrogênio entre os grupos amina de alguns aminoácidos e os grupos carboxila de outros, situados
quatro posições mais adiante (Fig. 2.28). Outras proteínas (ou parte delas) exibem uma estrutura
chamadafolha dobrada [3, nela, a molécula adota a configuração de uma folha dobrada em decorrência da ligação, mediante pontes de hidrogênio laterais, de grupos amina com grupos carboxila
da mesma cadeia polipeptídica (Fig. 2.28).
A estrutura terciária é cqnseqüên.cia.daformavãe-00-neva·s-dob.radura.s_n~s_tru turas_secundári,flS hélice a e folha dobrada ~ , o que dáJ ugar à configuração tridimensional-da proteína. As
novas dobraduras são produzidas porque certos aminoácidos distantes se relacionam entre si na
cadeia polipeptídica. Segundo a dobradura que adotam , são geradas proteínas fibro sas ou globulares (Fig. 2.29). As proteínas fibrosas são formadas a partir de cadeias polipeptídicas (ou de segmentos protéicos) com estrutura secundária tipo hélice a exclusivamente. Por outro lado, as proteínas globulares são formadas tanto a partir de hélices a como de fo lhas dobradas ~ , ou de uma
combinação de ambas.
A estrutura quaternária resulta da combinação de dois ou mais ~s, o que origina
moléculas de grande complexidade. Por exemplo, a hemoglobina é o resultado da integração de
quatro cadeias polipeptídicas (Fig. 2.30).
e---.._·
N
/
e ---.._
C·
N
"- c
"'/ c
C·
"'e"-/ e
·N
N "'-._
f
/
C·
"'-._ C·
A
B
Fig. 2.28 Estruturas secundári
das proteínas. A. Hél ice a. B. •
Folha dobrada ~·
32
•
OS COMPONENTES QUÍMICOS DA CÉLULA
Fig. 2.29 Estruturas terciárias
das proteínas. A. Fibrosa. B, C e
D. Globular.
~
) cooH
A
COOH
e
B
D
Fig. 2.30 Estrutura quaternária
das proteínas . Representa-se a
hemoglobina composta por
quatro subunidades, duas a e
duas ~· São indicados os sítios
onde se encontram localizados
os quatro grupos heme, o mesmo
que as terminações amina (N) e
carboxila (C) das cadeias
polipeptídicas.
2-1 O. Diversos tipos de ligações químicas determinam a
estrutura das proteínas
A disposição espacial de uma molécula protéica se acha predeterminada pela seqüência de seus
aminoácidos (estrutura primária). Os níveis restantes de organização dependem do estabelecimento
de diferentes tipos de ligações químicas entre os átomos dos aminoácidos. Desta forma, são produzidas ligações covalentes - por exemplo, pontes - S-S- entre os grupos -SH de duas
cisteínas - e vários tipos de interações fracas, isto é, ligações não-covalentes. Entre estas últimas encontram-se (Fig. 2.31):
NH 3
+
o
1
C=O
Fig. 2.31 Tipos de ligações nãocovalentes que estabilizam a
estrutura das proteínas: ligação
iônica (amarelo); interação de
van der Waals (azul-claro);
ponte de hidrogênio (rosa);
interação hidrófoba (verde).
(De C. B. Anfinsen.)
c~-NH2
NH 2 +
/o
C=O
OS COMPO ENTES QUÍMICOS DA CÉLULA
•
1) Pontes de hidrogênio, que são produzidas quando um próton (H+) é compartilhado entre
dois átomos eletronegativos (de oxigênio ou de nitrogênio) próximos entre si. Já vimos que as
pontes de hidrogênio são essenciais para o pareamento específico entre as bases complementares
dos ácidos nucléicos, o que proporciona a força que mantém unidas as duas cadeias de DNA. As
Figs. 2.5 e 2.31 mostram as pontes de hidrogênio no DNA e nas proteínas, respectivamente.
2) Ligações iônicas ou eletrostáticas, que são o resultado da força de atração entre grupos
ionizados de carga contrária.
3) Interações hidrófobas, que dão lugar à associação de grupos não-polares na qual se exclui
o contato com a água. Cabe acrescentar que, nas proteínas globulares, as cadeias laterais mais
hidrófobas localizam-se no interior das moléculas , enquanto os grupos hidrófilos situam-se na
superfície. Assim, os resíduos hidrófobos repelem as moléculas de água que rodeiam as proteínas
e determinam que sua estrutura globular se tome mais compacta.
4) Interações de van der Waals , que são produzidas quando os átomos estão muito próximos.
Esta proximidade induz a flutuações em suas cargas, que dão origem a atrações mútuas entre os
átomos.
A diferença fundamental entre as ligações químicas covalentes e as não-covalentes reside na
energia necessária para romper estas ligações. Por exemplo, uma ponte de hidrogênio exige 4,5
kcal/mo1- 1, uma cifra bastante menor que as 11 Okcal/mo1- 1 que a ligação covalente 0-H da água
necessita. Em geral, as ligações covalentes rompem-se pela intervenção de enzimas, enquanto as
não-covalentes se dissociam por forças físico-químicas. Ainda que individualmente as ligações
não-covalentes sejam fracas , quando são numerosas fazem com que a estrutura molecular se tome
estável, como ocorre com a dupla cadeia do DNA.
2-11. As proteínas têm cargas positivas e negativas, mas no ponto
isoelétrico sua carga é igual a zero
A carg; real de uma molécula protéica é o resultado da soma de todas as suas cargas. Uma vez
que os grupos ácidos e básicos se dissociam em concentrações distintas de íons hidrogênio no meio,
o pH influi na carga final da molécula. A Fig. 2.32 mostra que, no meio ácido, os grupos amina
captam H+ e se comportam como bases (-NH2 + H+ ___.,. -NH3 +), enquanto em um meio alcalino ocorre o fenômeno inverso e se dissociam·os grupos carboxila (-COOH ___.,.coo- + H+).
Existe um pH definido para cada proteína no qual a soma das cargas positivas 'e negativas é
igual a zero (Fig. 2.32). Este pH é denominado·ponto isoelétrico. Nele, as proteínas colocadas em
um campo elétrico não migram para nenhum dos pólos, enquanto num pH mais baixo deslocamse para o catodo e num pH mais alto o fazem para o anodo. O processo que origina estes movimentos é chamado eletroforese (Cap. 23-31).
~
ENZIMAS
2-12. As proteínas enzimáticas catalisam as reações químicas
A célula pode ser comparada a um m.inúsculo laboratório no qual ocorre a síntese e a degradação de grande número de substâncias. Estes processos são efetuados por enzimas (do grego, en,
dentro, e zyme·e, levedura) que atuam na temperatura do organismo e dentro de limites estreitos de
pH. As enzimas são os catalisadores biológicos. Um catalisador é uma substância que acelera as
reações químicas sem se modificar, o que significa que pode ser utilizado mais de uma vez.
O conjunto das enzimas constitui o grupo de proteínas mais extenso e mais especializado do
organismo, responsável pela direção da complexa rede de reações químicas que ocorrem na célula.
As enzimas (E) são proteínas ou glicoproteínas que têm um ou mais lugares denominados síti- /
os ativos, os quais se unem ao substrato (S), isto é, a substância sobre a qual a enzima atua. O
COOH NH,•
~
coo-NH
"t)': ; º;: º=H=~· LJ:; º;: º-==~·QcoºEm meio ácido
as proteínas têm
carga
Com pH igual ao
ponto isoelétrico a
carga é nula
Em meio alcalino ,
as proteínas têm
carga -
Fig. 2.32 A ionização das
proteínas depende do pH do
meio.
33
34
•
OS COMPONENTES QUÍMICOS DA CÉLULA
substrato é modificado quimicamente e convertido em um ou mais produtos (P). Como esta reação geralmente é reversível, pode ser expressa do seguinte modo:
[ES]
E+S
E+P,
onde [ES] é um complexo enzima-substrato formado transitoriamente. Os diferentes tipos de enzimas podem formar ligações covalentes entre átomos do substrato (síntese) ou podem rompê-las
(degradação). As enzimas aceleram a reação até que seja alcançado um ponto de equilíbrio, e podem
ser tão eficientes a ponto de a velocidade da reação ser de 108 a 1O 11 vezes mais rápida do que na
ausência do catalisador.
Uma característica muito importante da atividade enzimática é sua especificidade, o que significa que cada tipo de enzima atua somente sobre um determinado substrato. As enzimas podem
ser tão específicas que são incapazes de atuar sobre substâncias estreitamente relacionadas, como
por exemplo sobre uin estereoisômero do mesmo substrato.
Em geral, as enzimas levam o nome do substrato que elas modificam ou o da atividade que
exercem mais o sufixo "-ase". Desta forma, existem nucleases ou endonucleases (degradam ácidos nucléicos), fosfatases (subtraem fosfatos), cinases (os agregam), sulfatases, proteases, glicosidases, lipases, oxidases, redutases, desidrogenases etc.
É oportuno advertir que na célula existem moléculas com atividade enzimática que não são
proteínas e sim ácidos ribonucléicos. Recebem o nome de ribozimas e catalisam a formação da
ruptura de ligações fosfodiéster entre os nucleotídeos (ver Caps. 15-5 e 16-10).
2-13. Algumas enzimas necessitam de co-fatores
'
:/11
Algumas enzimas necessitam da presença de substâncias chamadas coenzimas para poder atuar. Por exemplo, as desidrogenases necessitam das coenzimas nicotinamida-adenina-dinucleotídeo (NAD+ ou NADP+) ou flavina-adenina-dinucleotídeo (FAD) (Fig. 8.4), já que estas são as
moléculas que recebem o hidrogênio extraído do substrato. A reação é a seguinte:
li
li
lt
E + S(H 2) + NAD+
H
~E+
S + NADH + W
Em alguns casos, a coenzima é um metal ou outro grupo prostético que se encontra ligado de
forma covalente à proteína enzimática. Em outros casos, as coenzimas associam-se frouxamente
às enzimas. Numerosas coenzimas são vitaminas pertencentes ao grupo B.
tl
11
"
n
2-14. Os substratos se ligam ao
o
ll
sít~o
ativo das enzimas
Como vimos, as enzimas têm uma grande especificidade para seus substratos e podem não aceitar moléculas relacionadas ou que tenham uma forma ligeiramente diferente. Isto pode ser explicado
considerando-se que a enzima e o substrato exibem uma interação semelhante à de uma fechadura
com sua chave. Na Fig. 2.33, observa-se que a enzima possui um sítio ativo, complementar a um dos
domínios do substrato. Ainda que a imagem da chave da fechadura seja válida, não significa que as
enzimas e substratos sejam moléculas estruturalmente rígidas. Assim, o sítio ativo da enzima se faz
complementar ao substrato somente depois de ter se unido a ele; é o chamado encaixe induzido.
Como se observa na Fig. 2.33, a ligação com o substrato induz uma mudança de conformação na
enzima, e somente então os grupos catalíticos entram em contato íntimo com o substrato.
Na ligação do substrato com o sítio ativo da enzima participam forças químicas de natureza
não covalente (ligações iônicas, pontes de hidrogênio, forças de van der Waals), cujo raio de ação
Fig. 2.33 Os substratos reagem
de forma muito precisa com o
sítio ativo da enzima. Algumas
enzimas têm um encaixe
induzido, pois o sítio ativo é
complementar do substrato
somente depois que este se liga
à enzima.
OS COMPONENTES QUÍMICOS DA CÉLULA
é muito limitado. Isto explica por que o complexo enzima-substrato somente pode ser formado se
a enzima tiver um sítio exatamente complementar ao exposto na superfície do substrato.
2-15. O comportamento cinético de muitas enzimas é definido pelos
parâmetros Vm áx e Km
As reações enzimáticas são realizadas em duas etapas. A primeira corresponde à ligação da
enzima com o substrato e pode ser escrita da seguinte maneira:
K1
E+S
~
[ES]
K2
Na segunda etapa, o complexo ES se desdobra no produto e a enzima, que fica disponível para
atuar sobre uma nova molécula de substrato:
K3
[ES]
~
E+P
K4
Os valores K 1, K 2 , K 3 e K 4 são constantes de velocidade das reações.
Como está ilustrado na Fig. 2.34, a velocidade da reação depende da concentração do substrato. Em baixas concentrações, a velocidade inicial (V) da reação descreve uma hipérbole. Todavia, à medida que aumenta a concentração do substrato, a reação se satura e alcança um patamar.
Nesse ponto - que corresponde a V rnáx - toda enzima intervém na formação do complexo ES. A
equação da curva é:
V rnáx [S]
V =---Km + [S]
onde Km é a constante de Michaelis, que pode ser definida como a concentração do substrato na
qual a metade das moléculas da enzima formam complexos ES. Quanto menor for o valor de Km,
maior será a afinidade da enzima pelo substrato. Conseqüentemente, o comportamento cinético
de uma enzima é definido pelos valores de V rnáx e K 01 •
2-16. Algumas enzimas estão sujeitas a regulações alostéricas
Na seção anterior, dissemos que, se diagramarmos a velocidade da reação de uma enzima em
função da concentração crescente do substrato, observamos que, para muitas enzimas, a curva
desenha uma hipérbole (Fig. 2.34). Deste modo, à medida que se agrega mais substrato, aumenta
a quantidade da enzima no complexo ES e aumenta a velocidade de aparição do produto; porém,
com altas concentrações do substrato, quase todas as moléculas da enzima se acham no complexo
ES e se alcança a velocidade máxima (Vmãx) da reação.
Km
Concentração de substrato [S]
Concentração de substrato
Fig. 2.34 Diagrama da velocidade de reação de uma enzima a concentrações
de substrato cada vez maiores. No texto estão descritas a V'""' e a K A
curva é uma hipérbole cuja primeira parte segue uma cinética de primeira
ordem (quer dizer, a reação é proporcional à concentração do substrato); a
segunda parte corresponde à saturação, que tem uma cinética de ordem zero
Uá que não depende da concentração de substrato) .
01 •
Fig. 2.35 Cinética da enzima
alostérica ATPase que mostra uma
curva sigmóide característica em
lugar de uma hipérbole. Observam-se
os efeitos de um ativador (ATP) e de
um inibidor (CTP).
•
35
36
•
OS COMPONENTES QUÍMICOS DA CÉLULA
Outras enzimas não obedecem à cinética anteriormente citada, já que mostram cooperativismo
e estão sujeitas a regulações alostéricas. Por conseguinte, em lugar de uma hipérbole dão lugar a
uma curva sigmóide (Fig. 2.35).
2-17. Os inibidores das enzimas são muito específicos
As enzimas podem ser inibidas reversível ou irreversivelmente.
A inibição irreversível pode decorrer da desnaturação da enzima ou da formação de uma ligação covalente entre ela e outra molécula.
Existem duas formas de inibição reversível: competitiva e não-competitiva. Na primeira, um
composto de estrutura similar à do substrato forma um complexo com a enzima, análogo ao complexo ES; este tipo de inibição pode ser revertido com concentrações altas do substrato. Na inibição não competitiva, o inibidor e o substrato não se relacionam estruturalmente, porém, da mesma forma, se unem por outros pontos de suas moléculas.
2-18. As enzimas da célula estão distribuídas em múltiplos compartimentos
As enzimas catalisam as inúmeras reações químicas que ocorrem nas células. Em alguns casos, as enzimas de uma via metabólica t ncontram-se no citosol, e o substrato e os produtos sucessivos passam de uma enzima para a seguinte em cadeia. Em outros casos, as enzimas que intervêm em uma cadeia de reações estão associadas e atuam juntas sob a forma de um complexo multienzimático; por exemplo, as enzimas que sintetizam os ácidos graxos se encontram intimamente
vinculadas. Os sistemas multienzimáticos facilitam as reações sucessivas porque estas ocorrem a
uma distância mínima entre si.
As enzimas possuem padrões de distribuição bastante específicos. Por exemplo, algumas enzimas hidrolíticas se localizam nos lisossomos, enquanto outras enzimas são encontradas nas cisternas do complexo de Golgi_e outras, como as RNA polimerases e as DNA polimerases, no núcleo.
A ORIGEM DAS CÉLULAS
2-19. Os mecanismos de auto-encaixe deram origem às primeiras células
Na Seção 2-9, vimos que uma proteína complexa (como a hemoglobina) é formada como resultado do auto-encaixe de várias unidades protéicas menores e, na Seção 2-7, estudamos que os
fosfolipídios dispersos em água desenvolvem espontaneamente uma dupla camada lipídica semelhante à das membranas celulares. Outro exemplo de auto-encaixe é encontrado nos vírus (Cap. 15), que são formados no interior da célula hospedeira a partir de material genético (DNA ou RNA)
e proteínas (capsômeros). Como podemos observar, mediante estes mecanismos de auto-encaixe
podem ser formadas tanto macromoléculas quanto estruturas subcelulares de complexidade variada.
As causas pelas quais se formam nas células estruturas em ordem cada vez mais complexa devem
ser buscadas na informação contida no DNA. É ela que determina a estrutura das proteínas. Por
outro lado, a formação de complexos macromoleculares e estruturas de maior complexidade é resultado da interação entre duas ou mais proteínas diferentes e entre proteínas e carboidratos, lipídios e ácidos nucléicos.
Um problema fundamental é determinar os mecanismos pelos quais se originou em nosso planeta a organização supramolecular que resultou na formação das células procariontes e eucariontes. Qualquer explicação sobre este tema é obviamente especulativa, pois tem a ver com nada menos
que a origem da vida.
Apesar de não se saber como se formaram as primeiras células, é possível estabelecer, por meio
do registro de fósseis , que os organismos procariotas precederam os eucariotas e apareceram há
três bilhões de anos. Observações recentes demonstraram que somente depois de bilhões de anos
de a Terra ter se formado apareceram organismos semelhantes às bactérias atuais. Anteriormente,
deve ter ocorrido o longo período de evolução química, no qual surgiram moléculas providas de
carbono e os precursores macromoleculares dos organismos viventes, como os aminoácidos, os
monossacarídeos e as bases dos nucleotídeos. Em seguida, por polimerização, formaram-se moléculas cada vez mais complexas. É possível que, durante este período, tenham entrado em ação
os mecanismos de auto-encaixe antes mencionados , já que se formou a primeira estrutura
supramolecular capaz de se auto-reproduzir (Fig. 2.36).
2- 20. A evolução química produziu moléculas orgânicas com carbono
Nos tempos pré-bióticos, quer dizer, anteriores ao aparecimento da vida, a atmosfera da Terra
não tinha oxigênio, da mesma forma que sucede com os outros planetas do sistema solar. Continha
OS COMPONENTES QUÍMICOS DA CÉLULA
•
37
Formação do sistema
solar há 4,6 x 1O' anos
Moléculas biogênicas, água,
amônia, formaldeído, ácido
cianídrico , acetonitrilo etc.
Evolução
química
Aminoácidos,
açúcares, bases
dos ácidos
nucléicos
Descargas
elétricas, luz
ultravioleta,
calor, pressão
t
Proteínas
Polissacarídeos
!
Ácidos nucléicos
!
\
'..,.. Proteinóides
Evol ução
biológica
Código genético
Prime iro procariota
•
J
Primeiro eucariota
Há 3,5 - 3,0 x 1O' anos
+
Há 0,9 x 1O' anos
hidrogênio, nitrogênio, amoníaco, metano, monóxido de carbono e dióxido de carbono; também
continha água que, em forma de vapor, cobr:ia parte da superfície terrestre. Apesar de, normalmente, essas moléculas serem pouco reativas, poderiam ter interatuado graças à energia fornecida
pela radiação ultravioleta, pelo calor e pelas descargas elétricas dos raios.
Ness~ época, a atmosfera também não tinha a camada protetora de ozônio, de modo que os raios
ultravioleta podiam banhar a superfície da Terra com uma intensidade que seria nefasta para a vida
atual. Isso originou moléculas intermediárias sumamente reativas , como o acetald~ído, o cianeto, o
formaldeído e outras, a partir das quais foram sintetizadas moléculas cada vez mais complexas.
Em 1920, Oparin e Haldane consideraram que a polimerização dessas moléculas podia dar
origem às proteínas, aos ácidos nucléicos e aos carboidratos presentes nos organismos vivos. Em
1953, Miller conduziu uma experiência fundamental na qual simulou as condições da atmosfera
no período pré-biótico. Foram produzidas descargas elétricas em um recipiente que continha água,
hidrogênio, amoníaco e metano. Na água, que se condensou, formaram-se aminoácidos (glicina,
alanina, ácido aspártico e ácido glutâmico ). Por meio de experiências similares, foram obtidos quase
todos os aminoácidos presentes nas proteínas. Vários monossacarídeos, ácidos graxos e as bases
dos nucleotídeos foram obtidos dessa maneira.
2-21. Os mecanismos de agregação formaram os proteinóides primitivos
O próximo passo provavelmente foi a polimerização dos aminoácidos para construir proteínas,
o que foi possível pela ação catalítica das argilas. Todos esses processos podem ter sido produzidos em meios aquosos (lagunas), nas quais as moléculas orgânicas se concentraram formando uma
espécie de "caldo" que favoreceu as interações moleculares.
A partir da formação da primeira proteína podem ter atuados mecanismos de agregação ou autoencaixe descritos anteriormente. Desta maneira, poderiam ter se originado as funções enzimáticas. É provável que no "caldo" primordial, as macromoléculas tenham formado complexos maiores, denominados proteinóides ou coacervados , que têm uma parede semelhante à de uma membrana e um interior líquido. Estes proteinóides primitivos podiam ter atividade enzimática e per- .
meabilidade, como no caso das membranas artificiais que mencionaremos no Cap. 3-2. Entretanto, a ausência de ácidos nucléicos impediu sua continuidade, e é possível que tenham tido uma
vida muito curta, já que não podiam se auto-reproduzir.
2-22. As células procariontes precederam as eucariontes
Somente depois do aparecimento dos ácidos nucléicos, foi possível ter se originado um organismo capaz de se autoperpetuar. Neste momento, teri a aparecido a primeira célula procarionte e,
assim, a vida na Terra.
É provável que o RNA- e não o DNA - tenha sido o primeiro material genético que surgiu, de
modo que, do ponto de vista cronológico, as macromoléculas teriam evoluído da seguinte maneira:
RNA -
-
- - > PROTEÍNAS
~----> D NA
Fig. 2.36 Seqüência temporal da
origem das células.
38
•
OS COMPONENTES QUÍMICOS DA CÉLULA
A replicação do RNA é mais simples do que a do DNA, pois exige um menor número de enzimas. Além disso, o RNA pode ser usado como material genético e como RNA mensageiro, e muitas
das etapas da síntese protéica dependem de interações RNA-RNA (RNAm-RNAt, RNAm-RNAr,
RNAr-RNAt) .
Todos os organismos vivos têm o mesmo código genético, que seria uma prova de que a vida
na Terra teve início a partir de um único organismo precursor. As forças da evolução, ao selecionarem as mutações favoráveis das células, levaram mais tarde a uma variedade assombrosa de
formas de vida.
É possível que os primeiros procariotas tenham sido heterótrofos (quer dizer, que se tenham
nutrido de moléculas orgânicas). Mais tarde, apareceram os procariotas autótrofos, como as algas
azuis. Graças à fotossíntese, ocorreram a produção e o acúmulo de oxigênio na atmosfera, com o
que foi possível o surgimento de células procariontes aeróbicas.
A célula eucarionte pode ter se originado depois da aparição de uma célula eucarionte anaeróbica. Esta deve ter sido parasitada por uma procarfonte anaeróbica que, mais tarde, converteu-se
em mitocôndria (Cap. 8-29).
De acordo com certos restos fósseis , os organismos eucariotas devem ter aparecido cerca de 1
bilhão e 500 milhões de anos atrás - ao se estabelecer uma atmosfera de oxigênio estável - e,
como dissemos, esses organismos podiam ser primeiramente anaeróbicos e depois aeróbicos. Até
então, a vida se encontrava somente na água, de onde as plantas e os animais passaram à terra.
O surgimento da reprodução sexual, milhões de anos depois, acelerou a evolução das formas
viventes, que até então era relativamente lenta. Os sexos tomaram possível o intercâmbio de informação genética entre os indivíduos, enquanto a mutação e a seleção produziram as diferentes
formas de vida que hoje se encontram em nosso planeta.
1~
BIBLIOGRAFIA
Anfinsen C.B. (1973) Principies that govern the (olding ofprotein chains.
Science 181:223.
Attenborough D. (1979) Life on Earth. Collins, England.
Berna! J.D. and Synge A. (1973) The origin of life. ln: Readings in
Genetics and Evolution. Oxford University Press, Oxford.
Blanco A. (2000) Química Biológica, 7ª Ed. El Ateneo, Buenos Aires.
Butler P.J.G. and Klug A. (1978) The assembly of a virus. Sei. Am.
239:62.
Cavalier-Smith T. (1975) The origin of nuclei and eukaryotic cells.
Nature 256:463.
Davidson J.N. (1976) The Biochemistry of the Nudeic Acü.b , Slh Ed.
Chapman & Hall, London.
de Duve Ch. (1996) The birth of complex cells. Sei Am. 274 (4):38 .
Dickerson R.E. (1978) Chemical evolution and the origin of life. Sei.
Am. 239:68.
Eigen M. (1971) Molecular self-organization and the early stages of
evolution. Q. Rev. Biophys. 4:149.
Fersht A.' (1977) Enzyme Structure and Mechanism. W.H. Freeman &
Co, San Francisco.
Fox S. and Dose K. (1972) Molecular Evolution and the Origin ofLife.
W.H. Freeman & Co, San Francisco.
Frieden E. (1972) The chemical elements of life. Sei. Am. 227:52.
Gupta R.S. and Golding G.B. (1996) The origin of eukaryotic cell . TIBS
21:166.
Hillis D.M. (1997) Biology recapitulates phylogeny. Science 276: 218.
Jacob F (1982) Evolution and tinkering. Science 196:121.
Judson H.F. ( 1979) The Eight Day of Creation: Makel'S of the Revolution
in Biology. Simon and Schuster, New York.
Klug A. (1972) Assembly of tobacco mosaic virus. Fed. Proc. 31 :30.
Lehninger A.L., Nelson D.L. and Cox M.M. (1993) Principies of Biochemistry, 2nd Ed. Worth, New York.
Murray R.K. et al. (1996) Harper's Biochemistry, 14th Ed. Appleton &
Lange, New York.
Oparin A.I. (1974) Evolution of the Concepts on the Origin of Life:
Seminar on the Origin of Life. Moscow .
Oparin A.I. (1978) The origin oflife. Scientia 113:7.
Ostro M.J. (1987) Liposomes. Sei. Am. 256 (1):102.
Perutz M. (1978) Hemoglobin structure and respiratory transport. Sei.
Am. 239:68.
PhillipsD.C . and No1th A.C.T. (1975) Protein Structure. Oxford Biology Readers, Vol 34. Oxford University Press, Oxford.
Richards F.M. (1991). The protein folding problem. Sei. Am. 264:54.
Rossmann M.G. and Argos P. (1978) Protein folding. Annu. Rev. Biochem. 50:497.
Saenger W . (1984) Principies of Nucleic Acid Structure. Springer, New
York.
SchopfW. (1978) The evolution of the earliest cells. Sei. Am. 239:110.
Sharon N. (1980) Carbohydrates. Sei. Am. 243:90.
Spiegelman S. (1971) An approach to the experimental analysis of
precellular evolution. Q. Rev. Biophys. 4:213.
Stryer L. (1995) Biochemistry, 4th Ed. W.H. Freeman & Co, New York.
Watson J.D. et al. (1987) Molecular Biology ofthe Gene, 4th Ed. W.A.
Benjamin-Cummings, Menlo Park.
Watson J.D. and Crick F.H.C. (1953) Molecular structure of nucleic
acids. A structure for deoxyribose nucleic acid. Nature 171:737.
Weinberg R.A. (1985) The molecules of life. Sei. Am. 253 (4):34.
Wilson A.C. (1985) The molecular basis of evolution. Sei. Am. 253
(4):148.
As membranas celulares
Permeabilidade das membranas
3
3-1. As membranas das células exe rcem diversas atividades
A célula está rodeada pela membrana plasmática, uma camada delgada de 6 a 10 nm de espessura composta por lipídios, proteínas e carboidratos (Fig. 3.1). Sua estrutura básica é semelhante
à das outras membranas da célula as quais envolvem as organelas do sistema de endomembranas
- inclusive o envoltório nuclear - as mitocôndrias e os peroxissomas.
As membranas celulares não são simples fronteiras inertes que compartimentam a célula, mas
sim estruturas que exercem atividades complexas, como as seguintes:
1) Constituem verdadeiras barreiras permeáveis seletivas que controlam a passagem de íons e
de moléculas pequenas, ou seja, de solutos. Assim, a permeabilidade seletiva das membranas impede
o intêrcâmbio indiscriminado dos componentes das organelas entre si e dos componentes extracelulares com os da célula.
2) Fornecem o suporte físico para a atividade ordenada das enzimas que nelas se encontram .
3) Mediante a formação de pequenas vesículas transportadoras tomam possível o deslocamento de substâncias pelo citoplasma (Cap. 7-1 ).
4) A membrana plasmática participa dos processos de endocitose e de exocitose. Primeiramente,
a célula incorpora substâncias do exterior (Cap. 7-29); em seguida, ela as segrega (Cap. 7-22).
S) Na membrana plasmática existem moléculas mediante as quais as células se reconhecem e
se aderem entre si e com componentes da matriz extracelular (Cap. 6-1 ).
6) A membrana plasmática possui receptores que interagem especificamente com moléculas
provenientes do exterior, como ho1mônios, neurotransmissores, fatores de crescimento e outros
indutores químicos. A partir destes receptores são desencadeados sinais transmitidos pelo interior
da célula; seus primeiros elos se situam próximo do receptor, em geral na própria membrana plasmática (Cap. 11-8).
ESTRUTURA DAS MEMBRANAS CELULARES
3- 2. A estrutura básica das membranas celulares corresponde
a uma dupla camada lipídica
Os lipídios fundamentais das membranas biológicas são fosfolipídios de tipos distintos e colesterol. No Cap. 2-7, assinalamos a natureza anfipática dos primeiros; são moléculas que possu-
Fig. 3.1 Desenho tridimensional
de uma membrana celular
(membrana plasmática).
40
•
AS MEMBRANAS CELULARES
em uma cabeça polar ou hidrófila e longas cadeias hidrocarbonadas apolares ou hidrófobas. Esta
dualidade tem grande importância na estruturação das membranas.
Quando os fosfolipídios são colocados entre um óleo e uma solução aquosa formam uma camada com uma molécula de espessura (monocamada), na qual todas as cabeças polares se orientam para a solução aquosa e os ácidos graxos se afastam dela, de modo que os fosfolipídios ficam
perpendiculares ao plano da interfase água/óleo (Fig. 3.2). Além disso, se os fosfolipídios e o óleo
forem "empurrados" para a solução aquosa, formam-se pequenas vesículas, com as cabeças dos
fosfolipídios na periferia - em contato com o meio aquoso.....:..... e os ácidos graxos orientados para
o óleo no interior das vesículas (Fig. 3.2).
Por outro lado, nas soluções aquosas puras, os fosfolipídios não formam monocamadas e sim
camadas duplas que se fecham sobre si mesmas, formando vesículas de até 1 µm de diâmetro
chamadas lipossomos (Fig.J.3). Como é de se esperar, os ácidos graxos hidrófobos se unem no
interior da dupla camada e as cabeças polares hidrófilas de cada monocamada se orientam para as
soluções aquosas. Visto que os lipossomos podem se fundir com as membranas plasmáticas, eles
são utilizados como veículos para incorporar diversos compostos às células; para tanto, são construídos em meio aquoso ao qual lhes são agregados um ou mais compostos (medicamentos, cosméticos), o que assegura suà incorporação ao interior das vesículas.
Quando os fosfolipídios são colocados entre duas soluções aquosas, separadas por uma parede
incompleta, formam uma dupla camada lipídica que completa a separação (Fig. 3.4). Aqui, também, as cabeças polares dos fosfolipídios se dirigem para as soluções aquosas e os ácidos graxos
se orientam para o interior da dupla camada que, por esse motivo, é altamente hidrófobo. Estas
duplas camadas lipídicas artificiais são construídas para estudar a permeabilidade e as propriedades físico-químicas das membranas biológicas, já que exibem estrutura básica e comportamento semelhantes.
1~1
3-3. Os fosfolipídios não são os lipídios mais abundantes
das membranas celulares
'
As membranas celulares são formadas por.duplas camadas lipídicas similares às descritas na
seção anterior. Na Fig. 3.5 são mostradas quatro duplas camadas lipídicas tal como observadas à
microscopia eletrônica.
Estas duplas camadas contêm fosfolipídios e colesterol, mas os primeiros podem ser as moléculas lipídicas mais abundantes.
As estruluras dos diferentes tipos de fosfolipídios presentes nas membranas foram descritas no
Cap. 2-7. Devemos lembrar que as cadeias hidrocarbonadas dos ácidos graxos podem estar saturadas ou não (Fig. 2.20). Nas cadeias saturadas, as ligações simples entre os carbonos conferem
aos ácidos graxos uma configuração estendida, o que faz com que estes se posicionem perpendicularmente em relação ao plano da dupla camada (bicamada) lipídica e que, em cada monocamada, os fosfolipídios fiquem agrupados em conjuntos bastante compactos. Ao contrário, as ligações duplas das cadeias não saturadas produzem angulosidades nos ácidos graxos, o que separa os
fosfolipídios e confere à dupla camada uma configuração menos compacta (Fig. 3.6).
O fosfolipídio predominante nas membranas celulares é a fosfatidilcolina. Em seguida, nesta ordem, estão a fosfatidiletanolamina, a fosfatidilserina, a esfingomielina e o fosfatidilinositol. Um
derivado deste último, o fosfatidilinositol 4,5-difosfato ou PIP2 (Fig. 2.16), quando é hidrolisado produz diacilglicerol (DAG) e inositol 1,4,5-trifosfato (IP3), duas pequenas moléculas implicadas na transmissão de sinais intracelulares (Caps. 11-14 e 11-17). Ao contrário, quando se adiciona ao PIP2 um
fosfato, este se converte em fosfatidilinositol 3,4,5-trifosfato ou PIP3 (Caps. 11-14 e 11-20).
Óleo
Água
-----
Água
Fig. 3.2 Esquema que ilustra como se
ordenam os fosfolipídios quando colocados
em uma interfase de óleo e água.
Fig. 3.3 Lipossomo derivado do
ordenamento espontâneo dos fosfolipídios
quando são colocados em um meio aquoso.
~-
Fig. 3.4 Dupla camada lipídica artificial
formada ao se colocar fosfolipídios entre dois
.meios aquosos.
AS MEMBRANAS CELULARES
Fig. 3.5 Eletromicrografia de quatro membranas celulares (MC) . Em cada uma observa-se a dupla camada
lipídica. E!, espaço intercelular. 240.000X . (De E. D. De Robertis .)
A membrana interna da mitocôndria contém um fosfolipídio duplo chamado difosfatidilgliceroI
ou cardiolipina (Cap. 2-7) (Fig. 2.17).
O colesterol é um componente quantitativamente importante das membranas celulares, especialmente na membrana plasmática. Em virtude de ser anfipático, em cada monocamada se dispõe entre os fosfolipídios, com o grupo OH do C3' de seu núcleo cíclico orientado para a solução
aquosa (Cap. 2-7) (Fig. 3.7).
Na membrana do retículo endoplasmático ex\ste um lipídio especial chamado dolicol (Figs.
2.24 e 7 .15), necessário para a incorporação dos oligossacarídeos às moléculas protéicas durante
a, formação de algumas glicoproteínas (Cap. 7-16).
Os diferentes componentes lipídicos são mantidos na dupla camada graças as suas interações
com ô meio aquoso e com os ácidos graxos dos fosfolipídios vizinhos, sem que sejam produzidas
ligações covalentes entre eles.
As duas camadas da bicamada lipídica não são idênticas em sua composição, e por esta razão
se diz que as membranas são assimétricas. A fosfatidiletanolamina, a fosfatidilserina e o fosfatidilinositol predominam na camada que está em contato com o citosol, enquanto a fosfatidilcolina e
a esfingomielina predominam na camada não citosólica (na membrana plasmática, voltada para o
exterior; em uma organela, voltada para sua cavidade).
A composição das membranas celulares apresenta diferenças quantitativas e qualitativas segundo a análise da membrana plasmática ou da membrana de alguma organela em particular. Por
exemplo, a membrana mitocondrial interna possui difosfatidilglicerol e a do retículo endoplasmático contém dolicol, lipídios que não existem em outras membranas. Ao contrário, o colesterol é
abundante na membrana plasmática e muito escasso na membrana interna da mitocôndria. Também existem diferenças entre as membranas quando são analisados os diferentes tipos celulares.
Às temperaturas fisiológicas, a dupla camada lipídica comporta-se como uma estrutura fluida.
A fluidez aumenta quando a proporção de ácidos graxos curtos e não saturados nos fosfolipídios
se eleva. Vimos que a saturação dos ácidos graxos faz com que os fosfolipídios se agrupem em
conjuntos mais compactos, o que confere maior rigidez à dupla camada. O colesterol produz conseqüências similares.
Dizer que a dupla camada lipídica se comporta como uma estrutura líquida significa que seus )
componentes giram em tomo de seus eixos e se deslocam livremente pela superfície membranosa .
(Fig. 3.8). Além destes movimentos, os lipídios podem passar de uma camada para outra por meio r
de um movimento chamado "flip-flop" (por sua semelhança com o mo~mento desenvolvido em
~
Deslocamento lateral
Fig. 3.7 Moléculas de colesterol entre os
fosfolipídios das membranas celulares.
Fig. 3.8 Movimentos que sofrem os
fosfolipídios nas membranas da célula.
/
•
41
Fig. 3.6 Esquemas que ilustram
como as ligações duplas dos
ácidos graxos distanciam os
fosfolipídios nas duplas camadas
lipídicas.
42
•
AS MEMBRANAS CELULARES
uma cambalhota). Este movimento é pouco comum comparado com a rotação e o deslocamento
lateral.
Na Seção 3-7 veremos que alguns lipídios da membrana encontram-se associados a carboidratos sob a forma de glicolipídios.
3-4. As proteínas das membranas celulares são classificadas
em integrais e periféricas
As membranas celulares contêm importantes quantidades de proteínas. Em média, a proporção de lipídios e de proteínas é equivalente, embora varie nos diferentes tipos de membranas. Por
exemplo, a membrana das bainhas de miel.iri__;,possui 80% de lipídios e 20% de proteínas, enquanto na membrana interna das mitocôndrias essa relação se inverte.
As proteínas das membranas celulares exibem uma assimetria maior que os lipídios e são classificadas em periféricas e integrais (Fig. 3.9).
As proteínas periféricas encontram-sé sôbre as faces da membrana, ligadas às cabeças dos
fosfolipídios ou a proteínas integrais por ligações não-covalentes. Assim, podem ser extraídas com
certa facilidade mediante tratamento com soluções salinas. Da superfície das proteínas surgem os
resíduos dos aminoácidos polares (Fig. 2.25), que interagem com grupos químicos da própria
membrana e dos meios que a banham.
As proteínas integrais encontram-se embutidas nas membranas, entre os lipídios da dupla
camada, motivo pelo qual, para sua extração, são necessários procedimentos relativamente drásticos, mediante detergentes ou solventes especiais. Algumas se estendem da zona hidrófoba da
dupla camada até uma das faces da membrana, por onde emergem (Fig. 3.9). Outras, ao contrário,
atravessam a dupla camada totalmente, daí serem chamadas transmembrana (Fig. 3.9). A extremidade carboxila dessas proteínas pode encontrar-se no lado citosólico da membrana e a extremidade amina no lado não-citosólico. Essas extremidades se vinculam aos meios aquosos que banham as superfícies da membrana, por isso possuem um predomínio de aminoácidos hidrófilos.
Ao contrário, as partes das proteínas integrais que se encontram entre os ácidos graxos dos fosfolipídios apresentam maior proporção de aminoácidos hidrófobos. Comumente, a zona intramembranosa exibe uma estrutura secundária em hélice a, com sua superfície exterior hidrófoba em
contato com os ácidos graxos , também hidrófobos (Fig. 3.10).
Muitas proteínas transmembrana atravessam a dupla camada lipídica mais de uma vez - daí
serem chamadas de proteínas de passagem múltipla - e, por isso, formam uma sucessão de alças cujas curvas emergem por ambas as faces da membrana (Fig. 3.10).
Algumas proteínas transmembrana se associam a outras para formar estruturas cilíndricas ocas,
como as mostradas na Fig. 3.21. Seus aminoácidos se distribuem de tal maneira que a parede exterior do cilindro oco - em contato com os ácidos graxos - resulta apolar, enquanto a superfície
Fig. 3.9 Posições das proteínas
integrais e das proteínas
periféricas nas membranas
celulares.
Fig. 3.10 Esquemas de quatro
proteínas integrais, duas
transmembranas (uma delas de
passagem múltipla) e duas em
posições periféricas.
AS MEMBRANAS CELULARES
•
43
interna se acha coberta por grupos polares, os quais delimitam um túnel cujas bocas se abrem em
ambos os lados da dupla camada. Jviais adiante, analisaremos as características destes túneis e sua
importâr~g-~J2ara o transporte de solutos através das membranas.
'-Devemos lembrar também que existem proteínas que se comportam como integrais - pois
exigem métodos drásticos para serem removidas - porém que têm posições periféricás. Sua estabilidade na membrana decorre do fato de se encontrarem unidas por ligações covalentes a um
ácido graxo ou a um fosfatidilinositol , quer estejam no lado citosólico ou no lado não-citosólico,
respectivamente (Fig. 3.10).
Na Seção 3-7 veremos que muitas proteínas da membrana estão associadas aos carboidratos,
ou seja, são glicoproteínas. Além disso, na membrana plasmática, quase todas as proteínas pertencem a esta categoria.
3-5. As membranas celulares respondem ao modelo
chamado de mosaico fluido
Como os lipídios, as proteínas também podem girar em tomo de seus próprios eixos e se deslocar lateralmente no plano da dupla camada. Elas foram comparadas com "icebergs" que flutuam na dupla camada lipídica. A esta propriedade dinâmica das membranas biológicas chama-se
mosaico fluido.
A capacidade de migrar pela dupla camada indicaria que as inter-relações químicas entre proteínas e lipídios são e~ . Entretanto, na maioria dos casos elas exibem certa estabilidade.
Assim, os lipídios que rodeiam uma determinada proteína se mantêm associados a ela, o que parece ser importante para assegurar a configuração da proteína. Comumente, as proteínas da membrana mostram propriedades diferentes quando sã.o encontradas nas membranas e quando foram
isoladas e purificadas. Isto levou a reavaliar o ambiente lipídico no qual se encontram e a reconhecer ::.existência de movimentos combinados das proteínas com os lipídios. Ademais, as atividades
das proteínas poderiam variar por modificações nos lipídios anexos.
Algumas proteínas da membrana plasmática têm sua mobilidade lateral restringida por estarem unidas a componentes do citoesqueleto, os quais as imobilizam em determinados pontos da
membrana (Cap. 5-24) (Fig. 5.31). Por outro lado, a junção oclusiva (Cap. 6-11) (Fig. 6.9) impede
que as proteínas passem de um lado para outro do limite marcado por ela (Fig. 3.27).,
3-6. A fluidez das proteínas na dupla camada lipídica foi comprovada
mediante técnicas biológicas diferentes
Vimos que a fluidez da membrana faz referência ao deslocamento dos lipídios e das proteínas
no plano da dupla camada. Esta fluidez foi comprovada mediante anticorpos ligados a fluorocromos, que são fáceis de detectar pela microscopia de fluorescência (Cap. 23-25). Examinemos as
seguintes experiências:
Linfócitos foram tratados com anticorpos fluorescentes que se unem a receptores (proteínas)
localizados em suas membranas plasmáticas e assim foi possível observar o desenvolvimento de
uma espécie de capuz (Fig. 3.11). Este capuz é formado porque os receptores se deslocam pela
membrana e se agrupam em um pólo da célula. Ademais, ali a membrana plasmática pode se
invaginar para o citosol e formar vesículas de endocitose (Cap. 7-29) que também são detectadas
com o microscópio de fluorescência.
Se em um cultivo celular duas células de espécies diferentes (p.ex. , uma humana e outra de
rato) são fundidas, obtém-se uma célula com dois núcleos chamada heterocarionte, que compartilha os citoplasmas, os núcleos e as membranas plasmáticas das células participantes (Fig. 3.12)
Fig. 3.11 Linfócito tratado com
anticorpo fluorescente que se
une a receptores protéicos da
membrana plasmática. Observar
o deslocamento dos receptores e
seu agrupamento em um pólo da
célula (o próximo ao complexo
de Golgi), onde podem ingressar
por endocitose. (De S. de Pretris
e M. C. Raff.)
44
•
AS MEMBRANAS CELULARES
Fig. 3.12 Obtenção de um
heterocarionte ao se unir a duas
células de espécies diferentes
mediante o vírus Sendai
inativado.
Vírus
+
Célula humana
--+
Sendai
Célula de rato
Heterocarionte
(Cap. 21-4). A união das células é obtida com ajuda do vírus Sendai inativado ou do polietilenoglicol, cujas propriedades fusógenas propiciam o contato e a integração das membranas plasmáticas. Se previamente as células forem marcadas com outros anticorpos fluorescentes de cores diferentes (como a fluoresceína, que é verde, e a rodamina, que é vermelha), após a fusão podem ser
reconhecidas na membrana plasmática da heterocarionte as partes fornecidas por cada célula. No
entanto, devido aos receptores marcados se deslocarem pela membrana, logo as duas cores se
misturam em toda a superfície da célula.
Na Fig. 3.13 é representado o possível mecanismo molecular de fusão de membranas. Quando
se acham próximas entre si e sob a influência de elementos fusógenos (neste caso, o vírus Sendai
ou o polietileno glicol) sucedem-se os seguintes fenômenos: 1) são despejadas as proteínas da membrana, o que deixa as duplas camadas sem outro tipo de moléculas além dos lipídios; 2) as duplas
camadas estabelecem um contato íntimo através de suas respectivas monocamadas confrontadas;
3) essas camadas desaparecem e se desenvolve uma interfase de estruturas lipídicas hexagonais
entre as duas monocamadas restantes (esta interfase parece ser essencial em todos os processos de
fusão de membranas); 4) finalmente, a interfase desaparece e a fusão se completa. O mecanismo
descrito ocorre em todos os processos fisiológicos de fusão de membranas e neles intervêm agentes fusógenos presentes no citosol, descritos quando analisamos a dinâmica das vesículas transportadoras no sistema de endomembranas (Cap. 7-41) e a fusão do espermatozóide com o ovócito
(oócito) durante a fecundação (Cap. 19-19).
Outro método utilizado para estudar o deslocamento lateral das proteínas no plano das membranas é a técnica de recuperação da fluorescência após o fotobranqueamento, conhecida pela
sigla FRAP (do inglês, fluorescence recovery after photobleaching). Aqui, certas proteínas da
membrana são marcadas com fluorocromos e um pequeno setor da membrana é irradiado com
raios laser. Esse setor "se embranquece", ou seja, fica sem fluorescência. No entanto, logo é invadido por proteínas fluorescentes provenientes das regiões não irradiadas. A velocidade de recuperação da fluorescência pode ser calculada mediante o índice chamado "coeficiente de difusão''.
3- 7. Os carboidratos das membranas celulares fazem parte
de glicolipídios e de glicoproteínas
As membranas celulares contêm entre 2 e 10% de carboidratos. Estes se encontram ligados
covalentemente a lipídios e a proteínas da membrana, ou seja, sob a forma .de glicolipídios e.glicoproteínas (Fig. 3.14).
Os glicolipídios classificam-se em cerebrosídios e gangliosídios (Cap. 2-7). Os cerebrosídios
são formados pela união de uma galactose ou de uma glicose com a ceramida (Fig. 2.21). A estrutura dos gangliosídios é similar, porém o carboidrato não é um monossacarídeo e sim um oligossacarídeo que contém um a três ácidos siálicos (Fig. 2.22).
Por outro lado, as glicoproteínas da membrana contêm oligossacarídeos ou polissacarídeos.
Fig. 3.13 Esquema que ilustra o
possível mecanismo molecular
responsável pela fusão de duas
membranas celulares. (De R.
Schaier e P. Overath.)
AS MEMBRANAS CELULARES
•
Fig. 3.14 Presença de
carboidratos (integrantes de
glicolipídios e glicoproteínas)
na face não-citosólica das
membranas celulares.
Os oligossacarídeos estão ligados às proteínas por ligações N -glicosídicas ou 0-glicosídicas
(Cap. 2-6) (Figs. 2.7 e 2.8). Habitualmente, os monômeros que se localizam na periferia dos oligossacarídeos são ácidos siálicos. Uma proteína pode conter uma ou várias cadeias oligossacarídicas (Fig. 3.14).
Os polissacarídeos ligados às proteínas são glicosaminoglicanas (uma ou várias por proteínas) e são formadas glicoproteínas chamadas proteoglicanas (Cap. 2-6) (Figs. 2.10 e 2.11). Nos
Caps. 6-3 e 7-18, veremos que muitas proteoglicanas são transferidas para o meio extracelular,
onde são abundantes. No entanto, algumas regressam à célula e se instalam na membrana plasmática como glicoproteínas periféricas. Assim, podemos dizer que estas proteoglicanas são moléculas recuReradas pela célula.
3-8 ... Os carboidratos cumprem funções relevantes nas membranas celulares -.,_. ;!
Os carboidratos dos glicolipídios e das glicoproteínas que se localizam na superfície não-citosólica (ou luminal) da membrana das organelas que integram o sistema de endomembranas cumprem diversas funções. Os correspo!ldentes à membrana dos lisossomos, por exemplo, a protegem das enzimas hidrolíticas presentes no interior da organela (Cap. 7-33).
Os cárboidratos dos glicolipídios e das glicoproteínas que se localizam na face externa da
, membrana plasmática formam uma cobertura chamada glicocálice (Fig. 3.14). Suas funções são
as seguintes:
1) Protegem a superfície da célula de agressões mecânicas e químicas. Por exemplo, o glicocálice das células situadas na superfície da mucosa intestinal as protege do contato com os alimentos e dos efeitos destrutivos das enzimas digestivas.
2) Devido à presença de _ácidos siálicos em muitos dos oligossacârídeos do glicocálice, a carga
elétrica em sua suµerfície_é.negativa. Isso atrai os cátions do meio extracelular, que ficam retidos
na face externa da célula. Esta condição é importante particularmente nas células nervosas e nas
mu_SDllares, já que necessitam incorporar grande quantidade de Na+ de fácil disponibilidade durante a despolarização de suas membranas.
3) Alguns oligossacarídeos do glicocálice são necessários para os processos de r_ec9nhecimento e de adesão celular (Caps. 6-8 e 6-9).
- 4) A membrana plasmática que circunda várias vezes o axônio de alguns neurônios para formar a bainha de mielina contém quantidade abundante de glicolipídios que contribuem para o isolamento elétrico do axônio.
' 5) A.._e.sp_ecificidade-do_s~e grupos sangüíneos é determinada por certos oligossacarídeos muito curtos e parecidos entre si, presentes na membrana plasmática das hemácias. Estes
oligossacarídeos somente diferem por seus monômeros terminais e são ligados a uma proteína
transmembrana: ou a uma ceramida, como mostra a Fig. 3.15. Assim, nas hemácias pertencentes
ao grupo A, o monossacarídeo terminal da cadeia oligossacarídica é a N-acetilgalactosamina e
nas do grupo B é a galactose; quando estes monossacarídeos terminais estão ausentes, as hemácias pertencem ao grupo sangüíneo O (Fig. 3.15).
6) Nas células tumorais malignas foram observadas alterações em alguns oligossacarídeos da
membrana, ;-que levou a crer queis to influi na conduta anômala que elas assumem. Acredita-se
que alterem a r~cg?ção dos sinais que controla~ divi_sões_celulares.
7) Algumas toxinas, bactérias e vírus se unem a oligossacarídeos específicos presentes na
membrana plasmática das células que atacam. Por exemplo, sabemos que algumas bactérias unemse às manoses de oligossacarídeos da membrana plasmática das células que infectam, como uma
etapa prévia de sua invasão. Por outro lado, para inici-ar suas ações patogênicas, algumas toxinas
- como as que são elaboradas pelas bactérias do cólera, do tétano, do botulismo e da difteria unem-se seletivamente a oligossacarídeos de gangliosídios presentes na superfície celular.
45
46
•
AS MEMBRANAS CELULARES
Fig. 3.15 Oligossacarídeos da
membrana plasmática da
hemácia, determinantes dos
grupos sangüíneos O, A e B.
•
Glicose
•
Galactose
•
N-Acetilglicosamina
•
N-Acetilgalactosamina
•
Fucose
GRUPO SANGÜÍNEO:
•
I'\\
\\
f
( 1
1 \
'1
o
•
(
\
A
1\
8
8) Em algumas células, determinadas proteínas do glicocálice têm propriedades enzimáticas.
Por exemplo, diversas glicoproteínas pertencentes ao glicocálice das células que revestem o intestino são peptidases e glicosidases que têm por função completar a degradação das proteínas e
dos carboidratos ingeridos, iniciada por outras enzimas digestivas.
PERMEABILIDADE DAS MEMBRANAS CELULARES
3-9. Os solutos e as macromoléculas atravessam as membranas celulares
mediante mecanismos diferentes
Existe um fluxo contínuo de substâncias que entram e saem da célula e circulam por seu interior. Para tanto, os solutos (ou seja, os íons e as moléculas pequenas) devem passar através das
membranas celulares; tal fenômeno é denominado permeabilidade e será estudado nas próximas
seções deste capítulo.
No que diz respeito às macromoléculas, para atravessar as membranas algumas utilizam canais protéicos especiais chamados translócons, outras passam por poros de composição sofisticada e outras se valem de vesículas pequenas. Estas transferências serão analisadas nos capítulos
dedicados ao sistema de endomembranas (Caps. 7-1 e 7-12), à mitocôndria (Cap. 8-28), ao
peroxissoma (Cap. 10-5) e ao envoltório nuclear (Cap. 12-4).
3-1 O. A passagem de solutos através das membranas celulares
pode ser passiva ou ativa
O intercâmbio incessante de solutos entre o meio que rodeia a célula e o citosol e entre este
e o interior das organelas é realizado através da membrana plasmática e das membranas dessas .
organelas, respectivamente. Conforme o caso, a passagem ocorre sem gasto de energia ou por
mecanismos que necessitem de energia. Quando não há consumo de energia, o processo é
denominado transporte passivo; o processo que depende de energia é denominado transporte
ativo.
O transporte passivo ocorre por meio dos componentes da dupla camada lipídica ou pelas
estruturas especiais, constituídas por proteínas transmembi-anas organizadas para a passagem dos
solutos (Fig. 3.16); estas estruturas são de dois tipos: os canais iônicos e as permeases, chamados
também transportadores. O transporte passivo através da dupla camada lipídica é denominado
difusão simples, e o que é realizado através dos canais iônicos e das permeases leva o nome de
difusão facilitada .
O transporte ativo ocorre exclusivamente por meio de permeases (Fig. 3.16).
- 3-11. O transporte passivo dos solutos ocorre por difusão
Quando se dissolve o soluto em um solvente, as partículas do primeiro se dispersam de forma
progressiva por todo o solvente até ficarem uniformemente distribuídas. O movimento do soluto
- chamado difusão - é realizado dos locais em que está mais concentrado para os de menor
concentração, com uma velocidade proporcional à diferença entre as concentrações (Fig. 3.17).
Esta diferença é denominada gradiente de concentração. Se o soluto possui carga elétrica, ainda
se move pelo gradiente de voltagem ou potencial elétrico que se estabelece entre os diferentes
pontos da solução. A soma dos gradientes de concentração e de voltagem é conhecida como gra-
AS MEMBRANAS CELULARES
•••
•••••
••••
••••
•• •
Dupla
camada
lipídica
Canal
iôn ico
•
Permease
•
Permease
Difusão
simples
Difusão
facilitada
Difusão
facilitada
Transporte
ativo
•
47
Fig. 3.16 Diferentes mecanismos
e estruturas membranosas
utilizados pelos solutos para
atravessar as membranas da
célula .
Q)i.~
e E
.~
"O
'5
(.'.)
ãí
~
rr
e
Qi
••
Fig. 3.17 Difusão de uma
.... ----.
•••••
::.::•
•
• •
• •
• •
•
~
º\ \
•
•
•
•
•
•
•
•
•
substância dissolvida em um
solvente.
•
•
•
diente eletroquímico. A difusão a favor desses tais gradientes é um processo que ocorre espontaneamente, sem gasto de energia; daí resulta a denominação transporte passivo.
3-12 . A difusão simples ocorre através da dupla camada lipídica
O transporte ativo de solutos também pode ocorrer entre compartimentos aquosos separados l
por membranas semipermeáveis, como é o caso das duplas camadas lipídicas das membranas 1
celulares. Este tipo de transporte é denominado difusão simples. Essas membranas são chamadas 1o
semipermeáveis porque os solutos são obrigados a "driblar" a peneira fina que representa sua dupla camada de lipídios.
As substâncias que se dissolvem nos lipídios atravessam a zona hidrófoba das membranas com
certa facilidade. Existe uma relação linear direta entre a solubilidade nos lipídios de uma substância e sua velocidade de difusão através das membranas semipermeáveis. Tal relação se expressa
mediante o coeficiente de partição óleo-água, que é medido agitando o soluto em uma mistura de
ambos os líquidos. Quando as duas fases são separadas, a concentração da substância dissolvida é
determinada em cada uma delas . A relação concentração do soluto em óleo/concentração do soluto em água dá o valor do coeficiente de partição.
As moléculas não-polares pequenas - como 0 2, C0 2 e N2 - difundem-se livremente através}
das duplas camadas lipídicas (Fig. 3.18). Também o fazem compostos lipossolúveis de maior tamanho, como, por exemplo, os ácidos graxos e os esteróides. Apesar de serem moléculas polares,
o glicerol e a uréia· atravessam facilmente as membranas celulares porque são pequenas e não
.
possuem carga elétrica.
A dupla camada lipídica das membranas celulares permite a passagem de água por difusão
simples. Como a água constitui o solvente no qual estão dissolvidos os solutos e dispersas as
N
2
C~2
H0
2
Uréia
Esteróides
Acides graxos
Glicerol
,
Nucleotídeos
Aminoácidos
G\icose
lo ~
HHTIHHTIHTI1HHTITIHTIH~1TIHTITITIHHTITIHHHH
~~g~~g~gg~gg~gMgg~gg~~Qgg~y~g
Fig. 3.18 Solutos que atravessam
as membranas da célula por
difusão simples.
48
•
AS MEMBRANAS CELULARES
Fig. 3.19 Velocidades do fluxo
dos solutos ao atravessar uma
membrana por difusão simples e
difusão facilitada, segundo seus
gradientes de concentração.
- Difusão simples
- - - - - - - - --:--
-
-7''---1 - Difusão facilitada
Concentração do soluto
macromoléculas, o sentido do movimento das moléculas aquosas depende do gradiente osmótico entre ambos os lados da membrana. Na Seção 3-16, serão analisados outros aspectos vinculados à passagem de água através das membranas celulares.
A difusão das moléculas polares através da dupla camada lipídica é tanto menor quanto maior
for o seu tamanho; as hexoses, os aminoácidos ·e os nucleotídeos, por exemplo, praticamente não
se difundem. Quanto aos íons, dada a sua carga elétrica, unem-se a várias moléculas de água, o
que os impede de atravessar a dupla camada lipídica por menor que sejam (no Cap. 2-2 vimos que
a água se comporta como um dipolo).
A difusão simples ocorre de forma espontânea, com uma velocidade diretamente proporcional
à diferença de concentração (ou gradiente) do soluto entre um e outro lado da membrana, como se
observa no gráfico da Fig. 3.19. Devemos assinalar que a inclinação da reta depende do grau de
permeabilidade da membrana ao soluto. Como vimos , o sentido da difusão depende do lado em
que o soluto esteja mais concentrado.
3-13. A difusão facilitada ocorre através de canais iônicos e de permeases
A maioria das substâncias que atravessa as membranas celulares a favor dos gradientes - ou
seja, sem gasto de energia - o faz a uma velocidade maior que a esperada se sua passagem for
j por difusão simples. A diferença é explicada pela presença de certos componentes protéicos da
l membrana chamados canais iônicos e permeases, 1 pelos quais se facilita - embora também se
regule - a transferência dos solutos de um lado a outro da membrana.
O sentido da difusão é realizado sempre a favor dos gradientes de concentração e voltagem.
Assim , diante da intervenção desses gradientes, o sentido da difusão também se inverte. Como
vemos, na difusão facilitada, a força que impulsiona a mobilização das partículas do soluto é o
gradiente e, portanto, não consome energia. Desse ponto de vista, a difusão facilitada é similar à
difusão simples; a diferença reside em que na primeira participam estruturas protéicas regulado-as e na segunda não.
Durante o transporte passivo de solutos por difusão facilitada, os complexos soluto-canal iônico e soluto-permease mostram características de especificidade e saturabilidade similares às do
complexo enzima-substrato. Assim, se em um sistema de coordenadas representarmos a velocidade do fluxo em função da concentração de soluto, obtém-se uma curva hiperbólica, que marca
uma notável diferença com a relação linear direta da difusão simples (Fig. 3.19). A hipérbole é
semelhante à derivada da atividade enzimática em função_;ia concentração do substrato (Fig. 2.34 ).
Tal comportamento indica que o processo é saturável. Quando em um canal iônic9 ou em uma
permease se alcança a velocidade máxima de fluxo , esta já não aumenta por mais que se incremente
a concentração do soluto. /
Igualmente ao caso das enzimas, pode-se definir a constante Km como a concentração de soluto na
qual se alcança metade da velocidade máxima do fluxo. Na maioria das circunstâncias, o valor Km
tem uma relação inversa com a afinidade do transportador pelo soluto. Quanto menor o valor de K
maior é a afinidade e vice-versa. Em conseqüência, neste tipo de sistema a velocidade de fluxo do
soluto pode ser expressa mediante uma equação similar à empregada para as enzimas (Cap. 2-15):
~
l
.'
111
,
1máx [S]
] = ----
Km+ [S]
onde J é a velocidade de fluxo ; Jmáx• a velocidade máxima do fluxo; [S] a concentração do soluto
e Km a concentração de soluto na qual o fluxo é igual à metade do máximo.
1
N.T.: Também conhecidas como transportadoras ou , em inglês, carrier.
AS MEMBRANAS CELULARES
Como ocorre com as enzimas, existem substâncias que possuem estruturas moleculares semelhantes às dos solutos e que podem se unir aos canais iônicos e às permeases e produzir inibições
competitivas (Cap. 2-17). Também ocorrem inibições do tipo não competitivo.
3-14. Existem dois tipos de canais iônicos, os dependentes de ligante e os
dependentes de voltagem
Os canais iônicos são poros ou túneis hidrófilos que atravessam membranas, formados por '\
proteínas integrais transmembrana geralmente do tipo passagem múltipla.
Existem canais iônicos em todas as células, tanto na membrana plasmática como na membrana
das organelas. São altamente seletivos , de modo que existem canais específicos para cada tipo de '
íon (Na+, K+, Ca 2 +, c1- etc.). Os mais abundantes nas membranas plasmáticas são os canais
_;
para K+.
O flu xo de um íon é impulsionado pelo gradiente eletroquímico, resultante, como vimos, do
somatório dos gradientes de concentração e de voltagem entre ambos os lados da membrana. No
Quadro 3.1 estão informadas as concentrações dos principais íons dentro e fora da célula. Normalmente, o lado citosólico da membrana plasmática é eletronegativo com relação ao lado exterior, o que favorece a entrada- ou dificulta o escape- dos íons com carga positiva. Com os íons
negativos, se dá a situação inversa. Por exemplo, o gradiente de voltagem se opõe à saída de K+
da célula, enquanto o gradiente de concentração a favorece. Quando estas forças opostas se equilibram, o gradiente eletroquímico é igual a zero e o fluxo do íon é interrompido.
O potencial de equilíbrio de um íon pode ser calculado ao conhecer sua concentração no interior da célula e no meio extracelular mediante a equação de Nernst:
L
r
RT
Ce
V =- - - ln zF
Ci
RT
Ce
zF
Ci
= 2,303 - - ~ log -
'
onde V é o potencial de equilíbrio (em volts); R é a constante dos gases (1 .987 cal · mo1- 1 • ºK- 1);
Té a temperatura absoluta; F, a constante de Faraday (2,3 X 10- 4 cal· v- 1); z, a carga do íon e Ce
e Ci são as concentrações extracelular e intracelular do íon.
A maioria dos canais iônicos não está aberta de forma permanente, pois conta com um dispositivo de abertura e fechamento semelhante ao de uma "comporta", acionado por dois tipos de
fatores (Fig. 3.20): alguns canais abrem sua "comporta" em resposta a uma mudança no potencial
elétrico da membrana e outros quando lhes chega uma substância indutora (ligante) pelo lado citosólico ou pelo lado não-citosólico (Caps. 11-2e11-18). Aos primeiros dá-se o nome de canais
dependentes de voltagem; aos segundos, canais dependentes de ligante. A partir do exposto,
para que seja produzida a passagem de soluto através de um canal iônico não somente é necessária a existência de um gradiente eletroquímico, mas também um estímulo apropriado, o qual, conforme o caso, corresponde a uma alteração no potencial de membrana ou à chegada de uma substância indutora (ligante).
A estrutura de um canal iônico assemelha-se a um cilindro oco que atravessa a membrana. Seu l
dueto central estreita-se e dilata-se de forma semelhante a uma ampulheta, de modo que possui :'
bocas amplas de acesso e de saída. Em um ponto, o dueto alcança um diâmetro muito pequeno; 0
esta zona dá especificidade ao canal, uma vez que é nela que se produz o reconhecimento do íon
segundo seu tamanho e sua carga.
A parede do cilindro é formada por várias proteínas transmembrana, quatro nos canais regulados por alterações de voltagem e cinco nos canais dependentes de ligante (Fig. 3.21).
Os canais iônicos mais bem estudados são os das células nervosas; foram inclusive clonados
os genes que codificam suas proteínas e analisada a seqüência de seus nucleotídeos. Isso permitiu
Quadro 3.1 Concentração dos principais íons nos meios intracelular e extracelular
Na+
K+
Mg2+
Ca2 +
H+
c1 HC0 3 -
Intracelular
Extracelular
12
140
0,5
< 0,0005
pH7 ,2
10
145
4
1,5
1,5
pH7,4
110
27
10
•
49
50
•
AS MEMBRANAS CELULARES
•
•
Fig. 3.20 Esquemas que mostram os mecanismos
de passagem dos íons através dos canais iônicos
dependentes de voltagem (acima) e de ligante
(abaixo) .
Fig. 3.21 Esquemas tridimensionais dos canais iônicos dependentes de
voltagem (A) e de ligante (B).
estabelecer que são estruturas que foram conservadas com poucas modificações durante a evolução, já que existe uma notável homologia nesses canais em espécies filogeneticamente muito distantes.
3-15. Os ionóforos aumentam a permeabilidade das
membranas biológicas a certos íons
Existem substâncias - chamadas ionóforos - que têm a propriedade de se incorporar às
membranas biológicas e aumentar sua permeabilidade a diversos íons. São moléculas de tamanho
relativamente pequeno, com uma superfície hidrófoba que lhes permite inserir-se na dupla camada lipídica. São conhecidos dois tipos de ionóforos, os transportadores móveis e os formadores de
canais. Como os canais iônicos , permitem fluxos de íons baseados em gradientes eletroquímicos.
Os transportadores móveis aprisionam o íon em um lado da membrana, englobam-no no interior de suas moléculas, giram 180º na dupla camada lipídica e o liberam do outro lado da membrana
(Fig. 3.22A). A este grupo pertence o antibiótico valinomicina, um peptídeo cíclico que transfere
K+. Outro ionóforo desta classe é o chamado A 23187, que transfere Ca2+ e Mg2 +; é utilizado em
experiências nas quais se deseja aumentar rapidamente a concentração intracelular de Ca2+ .
Os ionóforos formadores de canais são duetos hidrófobos que permitem a passagem de cátions
rrionovalentes (H+, Na+, K+). A este grupo pertence a gramicidina A, um antibiótico oligopeptídico
composto por 15 aminoácidos; tem uma configuração helicoidal e o dueto que se encontra no interior da hélice constitui o poro. Seu curto comprimento toma necessária a participação de duas moléculas consecutivas para "construir" um poro transmembrana contínuo (Fig. 3.22B).
~1
1
3-1 Gj As aquaporinas são canais específicos que permitem a passagem
VLseletiva de água
Embora não se trate de canais iônicos, é oportuno analisar aqui um dispositivo molecular que
possibilita a passagem de água através de algumas membranas celulares.
Em vários tipos de células - particularmente nas hemácias e nas células epiteliais dos plexos
coróides, da vesícula biliar e do túbulo proximal do néfron - a membrana é excepcionalmente
permeável à água, muito mais do que o esperado se o seu transporte se realizasse exclusivamente
Fig. 3.22 A. Passagem'df íons
através de ionóforos
transportadores móveis. B.
Passagem de íons através de
ionóforos formadores de canais.
\.
AS MEMBRANAS CELULARES
mediante o mecanismo de difusão simples analjsado na seção 3-12. Isso é devido à presença de
canais de passagem especiais conhecidos com o nome de aquaporinas.
As aquaporinas são constituídas por quatro proteínas de 28 kDa iguais entre si (menos uma,
que é glicosilada), denomjnadas CHIP (do inglês, channel-fo rming integral protein), cada uma
das quais é composta de seis hélices a -transmembrana . Como mostra a Fig. 3.23, na formação da
parede do canal intervêm somente as duas a hélices intermediárias de cada CHIP. Embora se saiba que a passagem de água através das aquaporinas é realizada sem a companhia de íons nem de
outro tipo de solutos, não se conhecem as bases dessa especificidade.
3-17. Existem diferentes tipos de permeases passivas envolvidas nos
processos de monotransporte, co-transporte e contratransporte
Como nos canais iônicos , a parede das permeases é comumente composta por várias proteínas I
transmembrana de passagem múltipla. Cada permease possui locais de ligação específicos para
um ou dois tipos de solutos, acessíveis de uma ou de ambas as faces da dupla camada. A fixação
de soluto produz uma alteração conformacional na permease, graças a qual é transferido um material para o outro lado da membrana (Fig. 3.24) .
.-1
Nesta seção analisaremos somente as permeases que permitem a passagem passiva de solutos,
correspondente ao mecanismo de difusão facilitada. O esclarecimento se deve ao fato de que a
célula possui proteínas transportadoras similares , porém conformadas para a passagem ativa de
solutos com gasto de energia (Seção 3-18).
Existem três tipos de permeases (Fig . 3.25) : 1) a~ ue transferem um único tipo de soluto; esta
forma de transferência chama-se monotransporte (em inglês, uniport); 2) as que transportam c!.2_is
tipos de sol uto s.§ imultanearn~n te ambos no mesmo sentido; este meca_n_ismo é d~nominado_co­
ffansporte (symport) ; 3) as que transferem dois tipos de solutos em sentidos contrários; este tipo
de_trans:krência recebe o nome-de contratransporte (antiport) . Devemos assinalar que no cotransporte e no contratransporte, as transferências de todos os solutos se acham acopladas obrigatoriamente, quer dizer, uma não ocorre sem a outra.
São exemplos de-difusão facilitada mediante permeases: 1) o monotransporte de glicose e o
co-transporte de NQ gliÇ_Qt>e na membrana plasmática das células da mucosa intestinal (Seção ;.
3-21); 2) o cóntratránsporte de Na+ e H + através da membrana plasmática de quase todos os tipos
de células; 3) o contratransporte de c1- e HC0 3 - por uma permease da membrana plasmática das
hemácias, chamada banda 3 (Cap. 5-36); 4) o contratransporte de ADP e ATP pela membrana
interna da mitocôndria (Cap. 8-16) (Fig . 8. 10).
•
•• ••
••• • ••••
•• ••• •••
•• ••
Fig. 3.23 Aquaporina. Corte
transversal passando pelo plano
da membrana. Observar as
quatro CHIP e o canal aquoso
central. Cada ponto representa
uma hélice a transmembrana.
3-18. O transporte ativo necessita de energia
Quando o transporte de soluto é realizado no sentido contrário de seu gradiente de concentração ou de voltagem, isto só é possível com gasto de energia, motivo pel o qual este tipo de passagem é chamado transporte ativo.
Fig. 3.24 Esquema que
representa uma permease e o
modo como os solutos a
atravessam .
•
••
nm~
~wm
~ggg
ggg~
fimc)mn
~gg~
~gg~
Monotransporte
Co-transporte
•
rrmc)wm
~ggg
~~~g
•
Contratransporte
51
Fig. 3.25 Tipos de permeases
sendo atravessadas por um ou
por dois solutos e as direções
que eles tomam.
52
•
AS MEMBRANAS CELULARES
O transporte ativo ocorre por meio das permeases chamadas bombas, e neste caso, também
existem formas de monotransporte, co-transporte e contratransporte. Além dis so, o transporte
ativo de solutos apresenta as mesmas características de especificidade e saturabilidade assinaladas para a difu são facilitada , embora difira desta por ser realizado contra o gradiente do soluto.
Existem inúmeros exemplos de permeases envolvidas nos processos de transporte ativo. Nas
próximas seções descreveremos algumas delas, representativas da maioria.
3-19. A bomba de Na +K+ é um sistema de contratransporte
Um dos sistemas de transporte ativo mais importantes é o que estabelece as diferenças nas
concentracões de Na- e K- entre o interior da célula e o líquido extracelular, que por isso é responsável pela manutenção do potencial elétrico da membrana plasmática. É denominado bomba
de Na+K+ ou Na+K +-ATPase e tem por função expulsar Na+ para o espaço extracelular e introduzir K+ no citosol (Fig. 3.26). Levando-se em conta que transfere solutos diferentes em sentidos
contrários, trata-se de um sistema de contratransporte.
A bomba de Na+K+ é um complexo constituído por quatro subunidades - duas a e duas 13
(a 2 13 2) - que são proteínas integrais da membrana plasmática. Cada subunidade a possui uma
massa de cerca de 100 kDa e atravessa a membrana umas oito vezes. Ao contrário, cada subunidade 13 é uma glicoproteína de cerca de 45 kDa com várias cadeias oligossacarídicas na extremidade voltada para a face não-citosólica da membrana. Os lipídios da dupla camada vizinhos das
quatro cadeias polipeptídicas influenciariam no funcionamento da bomba, já que esta é inativada
quando, após isolada, são extraídos os lipídios que a acompanham.
As subunidades ex têm locais específicos para fixação do Na+ em suas extremidades citosólicas, além de locais reservados para a ligação de K+ em suas extremidades externas. As transferências de Na+ para o exterior e de K+ para o citosol estão acopladas: uma não pode ser realizada sem a outra. Conseqüentemente, o funcionamento da bomba provoca o intercâmbio de
Na+ intracelular por K+ extracelular; ambos os flu xos são realizados contra os seus respectivos
gradientes.
O sistema necessita de energia, que é obtida pela hidrólise de ATP. Para tanto , a Na+K+ ATPase catalisa essa hidrólise mediante um a reação que necessita da presença não somente de
Na+ e de K+ mas também de Mg2+ . O ATP se une a um sítio específico da subunidade a na
face citosólica da membrana e sua hidrólise se encontra acoplada ao transporte dos íons. Cada
ATP que é hidroli sado possibilita o transporte dê três Na+ para o espaço extracelular e de dois
K+ para o citosol. O resultado do funcionamento da bomba pode ser resumido mediante esta
equação:
onde os subscritos i e e junto aos símbolos Na+ e K+ indicam "intracelular" e "extracelular", respectivamente.
O sentido do flu xo pode ser revertido se as concentrações de Na\ e de K+i aumentam acima de
certos limites e ADP e P se agregam; neste caso, a Na+K+-ATPase atua como uma ATP sintase.
No entanto, normalmente, a bomba atua de acordo com a equação anteriormente escrita: expulsa
três Na+ para cada dois K+ que ingressam (Fig. 3.26). Isto cria a diferença de voltagem (ou potencial elétrico) que existe entre ambos os lados da membrana plasmática, onde o lado citosólico é
normalmente eletronegativo com relação ao lado extracelular (Fig. 3.26). As bombas que geram
potenciais elétricos de membrana são definidas como eletrogênicas .
•• • •
••••
••••••
+ + + + ++ +
ITITITITITIT~
~~~g~~g
- -- - --Fig. 3.26 Na+K+-ATPase ou
bomba de Na+K +.
••••
••
•••••
•• •
•
•
.
•
K+(x2)
fm
meitm
-f, m.. m
. . m
g~~ ~
e Na+(x3)
~gg
ug~
g~~
~gQ
~
•
MU
AS MEMBRANAS CELULARES
LUZ INTEST INAL
Junção
oclusiva
•
Durante seu funcionamento, a Na+K+-ATPase atravessa ciclos de fosforilação e desfosforilação que determinam mudanças alternadas em sua forma. Entre os mecanismos propostos para
explicar como a bomba atua, o que mais se aj usta aos resultados experimentais é o seguinte:
1) Nas subunidades a existem locais de alta afinidade por três Na+, um ATP e um Mg 2 +, facil mente acessíveis a partir da superfície citosólica da membrana plasmática. Quando ocorre a hidrólise do ATP, é liberado o ADP e o terceiro fosfato é transferido a um ácido aspártico de uma
das subunidades a, o que propicia a fixação de três Na+ no interior do transportador.
2) Logo ocorre uma alteração conformacional na estrutura da permease. Como resultado, os
Na+ ficam expostos para o lado externo da célula. Além disso, diminui sua afinidade pelas subunidades a, motivo pelo qual os Na+ são liberados no meio extracelular.
3) Entretanto, doi s K+ do líquido extracelular se unem à permease e se fixam em seus locais
nas subunidades a. Esta união provoca a liberação do fosfato ligado ao transportàdor.
4) Tal desfosforilação faz com que o transportador recupere sua configuração original e por
isso os K+ ficam expostos para o interior da célula. Visto que, além disso, diminui a sua afinidade
pelas subunidades a, estes íons entram no citosol, o que completa o ciclo.
3-20. Alguns fármacos cardiotônicos inibem a bomba de Na+K+
A Na+K+-ATPase é inibida por fármacos do tipo da ouabaína e da digitoxina - amplamente utilizados como cardiotônicos - que bloqueiam oco-transporte de Na+ e K+ em concentrações de 10- s M. Estas substânci as atuam nas superfícies das células unindo-se aos locais da subunidade a reservados para os K+. A inibição da bomba
de Na+K+ é devida ao fato de os cardi.
otônicos, ao competirem com o K+, impedirem a liberação do fosfato ligado à subunidade a do
transportador. Como conseqüência, o sistema é bloqueado e diminui a saída de Na+ para o meio
extracelular. Isto diminui o rendimento de um contratransportador passivo - o de Na+ e de
Ca 2 +- mediante o qual entra Na+ na célula e sai Ca 2 +. Tendo em vista a menor oferta de Na+
desde o líquido extracelular, o seu intercâmbio é inibido com o Ca 2 +, que é retido no citosol. A
maior concentração de Ca 2 + citosólico contrai as células musculares cardíacas com mais forç ª
(Caps . 5-33 e 5-34).
3-21. Diversos transportadores passivos, embora distantes da bomba de
Na+K+, funcionam sob sua dependência
A dependência do contratransportador de Na+ e de Ca2 + da atividade da bomba de Na+K+ é
somente um exemplo dos muitos que existem durante o funcionamento normal da célula. Com
efeito, uma ampla variedade de transportadores é impulsionada pelo gradiente de Na+ gerado por
esta bomba, o qual "arrasta" os demais. Conseqüentemente, se a bomba de Na+K+ for intenompida, os transportadores passivos que dependem dela deixam de funcionar.
O transportador de glicose e oco-transportador de Na+ e glicose, responsáveis pelo transporte
transcelular do monossacarídeo através do epitélio da mucosa intestinal, são outros exemplos representativos de transporte acoplado ao funcionamento da bomba de Na+K+(Fig. 3.27).
53
Fig. 3.27 Transporte transcelular
de glicose no epitélio intestinal.
Por conta das junções oclusivas
entre as células epiteliais (Cap.
6-11), a glicose deve atravessar
as células para chegar aos
capilares sangüíneos situados
debaixo do epitélio. Embora a
glicose ingresse na célula contra
o seu gradiente, o faz
passivamente. Isto se deve à
entrada conjunta de Na+ através
de uma permease cotransportadora passiva.
Entretanto, este transporte de
glicose consome energia, já que
o Na + deve ser expulso para a
matriz extracelular pelo lado
oposto da célula mediante uma
permease ativa, a bomba de
Na+K+.
!\
•
•
\
54
•
AS MEMBRArAS CELULARES
Assim também ocorre com o contratransporte de NaT e H - . O a+ ingressa no citosol a favor
de seu gradiente e se intercambia por H-, que é expulso da célula. Este mecanismo tem grande
importância na regulação do pH intracelular e se acha presente em quase todos os tipos celulares.
3-22. Uma bomba de K+H+ é responsável pela formação do HCI gástrico
1 a membrana plasmática das células parietais da mucosa gástrica existe uma bomba de K+H+
cuja estrutura não é muito conhecida. Dá lugar ao contratransporte de K + e H+ com gasto de energia. Faz ~om que sejam aumentados os níveis de K + no citosol e permite que sejam alcançadas
elevadas concentrações de H- na secreção gástrica. Secundariamente, o gradiente eletroquímico
do K - determina sua saída passiva da célula para a cavidade estomacal. Ela é acompanhada pela
saída de c1 - , que na luz do estômago une-se ao H+ e forma HCl (Fig. 3.28). Como podemos ver,
a formação de HCl no suco gástrico depende da atividade da bomba de K+H+.
O K- e o c1- saem da célula por outras permeases monotransportadoras. O c1 - provém do
sangue e ingressa na célula pelo lado oposto do epitélio gástrico por meio de um co-transportador
passivo de c1 - e HC0 3 - similar ao das hemácias (Seção 3-1 7).
3- 23. Diferentes bombas de Ca 2 + mantêm a concentração do
íon no citosol em níveis muito baixos
A concentração de Ca 2 + no citosol é mantida em níveis baixíssimos (mais de 1.000 vezes menores
que os existentes na matriz extracelular) pela existência de um sistema que o expulsa. Assim, tanto na
membrana plasmática quanto na membrana do retículo endoplasmático (ou do retículo sarcoplasmático, na célula muscular) existem bombas de Cai+ que transferem o cátion do citosol para o espaço
extracelular e para o interior desse retículo, respectivamente. A bomba de Ca2+ dispõe de locais específicos de alta afinidade para o Ca2+ na face citosólica de ambas as membranas. Do mesmo modo que
a bomba de Na T K ~, a bomba de Ca2 + necessita de Mgz+ e energia que retira do ATP.
3-24. Uma bomba de H+ diminui o pH dos lisossomos
Uma alta concentração de H+ no interior dos lisossomos é crucial para a ativação de suas enzimas hidrolíticas, que se encontram em condições de atuar somente quando o pH nessas organelas
é reduzido a 5,0 (Cap. 7-33). O transporte de H+ desde o citosol para o interior do lisossomo é um
processo ativo que depende de uma bomba de H+ herdada da membrana do endossomo precursor
(Caps. 7-28 e 7-30) (Fig. 7.22).
3-25. Existem dois tipos de transporte de H+ na mitocôndria,
um ativo e outro passivo
O transporte de H+ através da membrana interna da mitocôndria durante o avanço dos elétrons
pela cadeia respiratória é um outro exemplo de transporte ativo , embora nele a energia não seja
fornecida pelo ATP, mas sim pelo citado percurso de elétrons (Cap. 8- 15).
CAVI DADE DO ESTÔMAGO
if
K+
t
Junção
oclusiva
K+
H+
Ci-
\ !
t
HH
?
!
t \v=: )
H+.
Fig. 3.28 Fo1mação de HCI na
cavidade gástrica. Observar as
junções oclusivas, o transporte
transcelular de c1 - e de que
maneira a atividade da bomba
K+H+ combina com as funções
dos outros transportadores.
C02 + H2 0
C02
\
AS MEMBRANAS CELULARES
•
55
Acredita-se que o gradiente eletroquímico entre ambos os lados da membrana mitocondrial
interna seja utilizado para sintetizar ATP, ao retomarem os H- à matriz mitocondrial por meio de
um transportador passivo as sociado à ATP sintase (Figs. 8.10 e 8.12).
3-26. As proteínas MDR são transportadores que conferem às células
resistência a certos medicamentos
As proteínas MDR (do inglês, multidrug resistance) pertencem a uma fanu1ia de transportadores ativos que são identificados com a sigla ABC (do inglês, ATP-binding cassette) porque possui
um par de domínios ou "cassetes" com atividade de ATPase. Esta hidrolisa o ATP que fornece a
energia necessária para mobilizar determinados solutos contra seus gradientes.
Os transportadores ABC são encontrados normalmente nas membranas de muitos tipos celulares. Foram identificados na membrana plasmática, na membrana do retículo endoplasmático, na
do peroxissoma e na membrana mitocondrial interna.
Alguns desses transportadores têm por função eliminar substâncias tóxicas derivadas do metabolismo celular normal. Ao contrário, outros permitem a passagem de moléculas de tamanho maior
que o esperado, como os polipeptídeos pequenos (Caps. 7-14 e 7-24).
Às vezes , certos tipos de transportadores ABC aparecem em grande número na membrana plasmática de vários tipos de células cancerosas, o que lhes confere uma resistência indesejada contra
alguns medicamentos citotóxicos . Isto resulta de que as MDR bombeiam esses medicamentos para
fora das células cancerosas, o que faz com que estas se tomem resistentes à quimioterapia.
Por outro lado , foi observado um aumento similar de proteínas MDR na membrana plasmática
dos linfócitos infectados pelo vírus tipo 1 da imunodeficiência adquirida (HIV-1 ), o que contribuiria para sua resistência a medicamentos antivirais como o AZT.
Também ocorre um aumento de proteínas MDR na membrana plasmática das células de alguns Jíl<lrasitas que, por este motivo, se tomam resistentes aos medicamentos antiparasitários. Por
exemplo, a Leishmania (agente da leishmaniose) pode desenvolver resistência ao antimónio e a
outros compostos, enquanto o Plasmodium falciparum (agente da malária) pode fazer o mesmo
com a cloroquina, a halofantrina, a primaquina e a mefloquina. Como nos casos anteriores , aqui
também as MDR bombeiam os medicamentos para fora das células, o que anula seu poder terapêutico.
3- 27. Na fibrose cística um canal iônico para o c1- está alterado
A fibrose cística é um grave distúrbio causado pela produção de secreções muito viscosas que
obstruem a luz dos brônquios, os duetos de várias glândulas (como o pâncreas), o tubo intestinal
etc. Manifesta-se em indivíduos homozigotos que possuem mutação no gene codificador da proteína CFTR (do inglês, cystic fibrosis transmembrane conductance regulator) que, em algumas
células epiteliais se comporta como uma permease e, em outras, como um canal iônico dependente de ligante. A proteína CFTR encontra-se envolvida no transporte de c1 - através da membrana
plasmática e quando é defeituosa o mecanismo que leva à fibrose cística é o seguinte. Visto que o
transporte de c1- pela CFTR é bloqueado, o ânion na luz dos duetos afetados diminui e, conseqüentemente, diminui também o cátion Na+ (Fig. 3.29). Finalmente, a menor concentração destes
íons determina que a água seja retirada e isto aumenta a viscosidade das secreções.
Como a CFTR pertence à família de transportadores ABC, chama a atenção que em algumas
células ela não atue como uma pe1mease ativa e sim como um canal iônico dependente de ligante
c1-
Na•
LUZ DO DUCTO
t
1
c1-
r
t
c1-
-•
~
c1-
r
t
c1-
Fig. 3.29 A. Transporte de c1através da proteína CFTR, _
situada na membrana plasmática
que dá para a luz do dueto. B.
Bloqueio da passagem de c1como conseqüência de um
defeito na CFTR.
56
•
AS MEMBRANAS CELULARES
que, como se sabe, é passivo. Nessas células, uma cinase (quinase) ativada pelo AMP cíclico (Cap.
11-15) controla a abertura do canal iônico e, por conseguinte, a passagem de c1- a favor de seu
gradiente eletroquímico.
A MEMBRANA PLASMÁTICA E A PAREDE DA CÉLULA VEGETAL
3-28. A membrana plasmática da célula vegetal é rodeada
por uma espécie de exoesqueleto
As células das plantas são similares às dos animais, embora apresentem algumas diferenças
(Figs. 1.6 e 1.7). Por exemplo, a célula vegetal possui uma parede celular espessa que envolve a
membrana plasmática como se fosse um exoesqueleto.
Além de dar proteção e sustentação mecânica à célula e determinar sua forma, essa parede
participa da manutenção do equilíbrio entre a pressão osmótica .intracelular e a tendência da água
em penetrar no citosol.
Também o crescimento e a diferenciação das células vegetais dependem, em grande parte, da
organização da parede celular. Assim, a partir desta, ocorre a diferenciação das células do câmbio, dos tubos crivosos dofloema (que servem para o transporte do material desde as folhas) e dos
vasos do xilema (que se lignificam).
3-29. A parede celular contém um retículo microfibrilar
A estrutura da parede celular pode ser comparada com a de um plástico reforçado com fibras
de vidro, já que é constituída por um retículo microfibrilar incluído em uma matriz de moléculas
unidas entre si.
As microfibrilas da parede celular são compostas principalmente por celulose, o produto mais
abundante na terra. Trata-se de cadeias retas de polissacarídeos formados por unidades de glicose,
ligadas por enlaces (3 1-4 (Fig. 3.30). Estas são as cadeias de glicana, que mediante ligações de
hidrogênio intramoleculares e intermoleculares produzem a unidade estrutural ou microfibrila,
que tem 25 nm de diâmetro e é composta por quase 2.000 cadeias de glicana. As microfibrilas de
celulose associam-se entre si e compõem um emaranhado semicristalino que combina com proteínas e polissacarídeos não celulósicos para formar a parede celular.
A matriz da parede celular contém alguns polissacarídeos e lignina, principal componente da
madeira. Os polissacarídeos mais importantes são: 1) substâncias pécticas solúveis em água, que
contêm galactose, arabinose e ácido galacturônico, e 2) hemiceluloses, compostas por glicose,
xilose, manose e ácido glicurônico. A lignina é encontrada somente nas paredes das células maduras e é formada por um composto aromático derivado da polimerização dos fenóis.
Algumas paredes celulares podem ser substâncias cuticulares (ceras) e depósitos minerais, como
silicatos e carbonatos de sódio e de magnésio. Nos fungos e nas leveduras, a matriz da parede
celular contém quitina, um polímero da glicosamina.
3-30. A parede celular é composta de uma parede
primária e uma secundária
A parede celular é complexa e, em alguns vegetais, se acha muito diferenciada. Ela pode conter
dois componentes - a parede primária e a parede secundária - que se desenvolvem seqüencialmente e se distinguem pela composição de suas matrizes e pela disposição de suas microfibrilas.
A parede primária começa a se formar com a divisão celular, a partir de uma estrutura chamada placa celular, que aparece durante a telófase no plano equatorial entre as futuras células-
OH
Ú cH 0H
2
HO
13-glicose
Fig. 3.30 Elementos estruturais
da celulose em seus sucessivos
níveis de organização. (De D. K.
Mühlethaler.)
l
.,,
/
-
-
--- ~ --Celulose
Fibrila elementar
(micela)
Corte transversal de
uma microfibrila
Parte de uma
microfibrila
AS MEMBRANAS CELULARES
•
57
filhas (Cap. 18-21 ). A placa é composta por vesículas do complexo de Golgi que se alinham no
plano equatorial da célula e formam o primeiro rudimento ou camada intermediária da futura parede celular. Esta camada contém somente pectina, um composto amorfo dotado de ácido galacturônico. Posteriormente, cada célula-filha deposita outras camadas compostas por pectina, hemicelulose e um retículo frouxo de microfibrilas celulósicas orientadas transversalmente em relação
ao eixo maior da célula, cujo conjunto constitui a citada parede primária.
Somente quando a célula alcança sua maturidade aparece a parede secundária, que compreende materiais agregados sobre a superfície interna da parede primária, seja como espessamentos
localizados (vasos do xilema) ou como espessamento homogêneo (tubos crivosos do floema). Em
ambos os casos, a parede secundária é formada por celulose, hernicelulose e poucas substâncias
pécticas. A diferenciação posterior do xilema ocorre pela infiltração de lignina nos espessamentos localizados. Neste caso, o polímero substitui a água e infiltra a matriz e as microfibrilas celulósicas . Quando a parede se lignifica, a célula morre.
3-31. Os componentes da parede celular originam - se no complexo de Golgi
ou em relação com a membrana plasmática
·
Foram descritas duas vias principais para a biogênese da celulose e de outros componentes da
parede celular. Uma compreende o complexo de Golgi (Cap. 7 -44) e a outra está associada à
membrana plasmática.
A intervenção do complexo de Golgi é evidente em certas algas cujas paredes são formadas
por escamas. Estas têm um material amorfo e um retículo fibrilar radial associado a outro espiral.
As membranas do complexo de Golgi polimerizam cadeias de glicose para formar microfibrilas
de celulose por meio de glicosiltransferases. Em seguida, as microfibrilas se organizam em escamas e se liberam na superfície.
·
A m~brana plasmática é o sítio mais freqüente para a síntese de celulose. Isto não descarta as
funções essenciais desempenhadas pelo retículo endoplasmático e pelo complexo de Golgi, já que
as glicosiltransferases são sintetizadas em ribossomas associados a esse retículo , passam para o
complexo de Golgi e daí para a membrana plasmática, onde ocorre a síntese das microfibrilas
celulósicas.
Anteriormente assinalamos que nos fungos e nas leveduras, a parede celular é composta principalmente de quitina. Este polissacarídeo é sintetizado pela enzima quitina sintetase na presença
de UDP-acetilglicosamina. A enzima é ativada por proteólise e pela luz que acelera a síntese de
quitina. Foi encontrada quitina transferase nos quitissomas, organelas vesiculares de 40 a 70 nm
de diâmetro que parecem ser os veículos que entregam a enzima aos locais de síntes'e na superfície celular.
BIBLIOGRAFIA
Al-Awqati Q. (1995) Regulation of ion channels by ABC transporters
that secrete ATP. Science 269:805.
Carafoli E. (1992) The Ca2+ pump of the plasma membrane. J. Biol.
Chem. 267:21 15 .
Chrispeels M.J. and Agre P. (1994) Aq uaporins: water channel proteins
of plant and animal cell s. TIBS 19:421.
Cleves A.E. and Kelly R.B. (1996) Protein translocation: rehearsing the
ABCs. Curr. Biol 6:276.
Dean M. and Allikmets R. (1995) Evolution of ATP-binding cassette
transporter genes. Curr. Opin. Genet. Dev. 5:779.
Groot B. and Grubmüller H. (200 1) Water permeation across biological membranes : Mechanism and dynamics aquaporin-1 and GlpF.
Science 294:2353.
Gupta S. and Gollapudi S. (1993) P-glycoprotein (MDRI gene product)
in cells of the immune system: its possible physiologic role and alteration in aging and human immunodeficiency virus- 1 (HIV-1 ). J.
Cli n. Immunol. 13:289.
Jacobson K., Sheets E.D. and Simson R. (1995) Revisiting the fluid
mosaic model of membranes. Sc ience 268: 1441.
Lipowsky R. (1995) The morphology of lipid membranes. Curr. Opin.
Struc. Biol. 5:531.
·
Montai M. (1995) Molecular mimicry in channel-protein structure. Curr.
Opin. Struc. Biol. 5:501.
Monteith G.R. and Roufogal is B.D. (1995) The plasma membrane calcium pump. A physiological perspective on its regulation. Cell Calciui:n 18:459.
Nielsen S., Smith B.L. , Christensen E.I. and Agre P. (1993) Distribution of the aquaporin CHIP in secretory and resorptive epithelia and
capillary endothelia. Proc. Natl. Acad. Sei. USA 90: 7275.
Parisi M. et ai. (1995) Water pathways across a reconstituted epithelial
barrier formed by Caco-2 cells: Effects of medi um hypertonicity. J.
Memb. B iol. 143 :237.
Preston G.M.,JungJ.S., Guggino W.B . and AgreP. (1993) Themercurysensitive residue at cysteine 189 in the CHIP28 waterchannel. J. B iol.
Chem. 268:17 .
Reithmeier R.A.F. (1995) Characterization and modeling of membrane
proteins using sequence analysis . Curr. Opin. Struc. Biol. 5:491.
van Os C., Deen P.M.T. and Dempster J.A. (1994) Aquaporins: water
selective channels in biological membranes. Molecular structure and
tissue distribution. Biachem. Biophys. Acta 1197:291.
O citosol
4-1. Introdução
No Cap. 1-3 vimos que as células eucariontes possuem algumas semelhanças com as procariontes. Assim, o citosol - ou matriz citoplasmática - da célula eucarionte contém muitos dos
componentes_que se encontram no protoplasma da bactéria, como, por exemplo, complexos enzimáticos de diversas ordens e moléculas de RNA ribossômico, mensageiro e de transferência. As
diferenças entre ambos os tipos celulares são mostradas pela presença na célula eucarionte de várias
estruturas singulares, como o núcleo , o citoesqueleto, as organelas que integram o sistema de
endomembranas, as mitocôndrias , os cloroplastos (na célula vegetal) e os peroxissomas.
\Â célula eucarionte encontra-se dividida em numerosos compartimentos, entre os quais se sobr~sai o núcleo. A parte da célula que não corresponde ao núcleo - ou seja, o citoplasma - '
pode ser subdividida esquematicamente em dois espaços: um correspondente ao citosol e outro
que se encontra encerrado no interior das organelas. Neste esquema, o citosol é considerado como
um verdadeiro meio interno celular, que se estende do envoltório nuclear até a membrana.plasmática e que preenche o espaço não ocupado pelo sistema de endomembranas, pelas mitocôndrias e
pelos peroxissomas (Fig. 1.7).
O citosol representa, em média, 50% do volume do citoplasma, cifra que aumenta nas células
embrionárias e nas menos diferenciadas.
O pH do citosol é de 7
,2]
4-2. O citosol contém componentes muito variados
Pela técnica do fracionamento celular descrita no Cap. 23-28, obtém-se - além das frações
nuclear, mitocondrial e microssômica - uma fração fluida sobrenadante que contém os compoc
nentes citosólicos.
Nela são detectados os elementos do citoesqueleto - inclusive o centrossomo com os centrí- 1
olos - um grande número de enzimas (por exemplo, as que intervêm na glicólise ), a maioria das .
moléculas que conduzem sinais dentro da célula, os elementos que dirigem a síntese das proteínas p
celulares e extracelulares (ou seja, os ribossomas, os RNA mensageiros e os RNA de transferên-1
eia), as chaperonas, os proteassomos, as inclusões, etc.
J
4-3. O citosol pode conter inclusões
l Quando se acumulam no cito sol, em grandes quantidades, certas macromoléculas formam estruturas detectáveis ao microscópio - denominadas inclusões - que não têm membranas.
Por exemplo, tanto nos hepatócitos como nas células musculares estriadas, é com_um a presença no citosol de grânulos de glicogênio (Figs. 1.11e4.1). Chamam-se glicoss?mos,/medem entre 50 e 200 nm e são compostos por subpartículas de 20 a 30 nm de diâmetro. E preciso assinalar
que nas imagens ultramicroscópicas, os glicossomos não correspondem diretamente ao glicogênio; representam as proteínas enzimáticas que intervêm na síntese e na degradação do polissacarídeo, cuja molécula não capta os corantes eletrônicos de uso corrente. Os grânulos de glicogênio
constituem depósitos de energia para as células; isso é claramente visível na célula muscular, uma
4
60
•
O CITOSOL
Fig. 4.1 Eletromicrografia do
setor do citoplasma da célula
hepática. No citosol vizinho ao
retículo endoplasmático liso
(REL) observam-se numerosos
grânulos de glicogênio (G/).
Observar o retículo
endoplasmático rugoso (RER).
45.000X (Cortesia de G. E.
Palade.)
•••
Fig. 4.2 Esquema de uma célula
mamária ativa com numerosas
gotas de gordura no citosol.
Observar a saída das gotas de
gordura por secreção apócrina.
vez que os grânulos desaparecem durante as contrações em função da glicogenólise produzida
para fornecer glicose. Existem doenças congênitas provocadas por mutações nos genes que codificam as enzimas que regulam a síntese e a degradação do glicogênio, conhecidas como glicogenoses. Nelas, as células mostram o acúmulo excessivo de inclusões de glicogênio ou formas anormais do polissacarídeo.
Diversos tipos de células contêm gotículas de gordura (triglicerídios ou triacilgliceróis) no
citosol e que também constituem reservas de energia. São muito comuns nos hepatócitos e nas
células musculares estriadas. Nas células musculares , as inclusões de gorduras estão localizadas
próximo_das mitocôndrias, para as quais se dirigem os ácidos graxos dos triglicerídios para sua
oxidação (Cap. 8-8). As células chamadas adipóc~tos contêm uma grande gota de gordura- com
numerosas gotículas ao seu redor - que ocupa quase todo o citosol (Fig. 1.8).
No citosol das células secretoras da glândula mamária em atividade são produzidas gotículas
de gordura que se convertem em elementos importantes do leite. Durante a secreção mamária,
cada gota sai da célula envolvida por uma fina camada de citosol rodeada por uma fração da membrana plasmática (secreção apócrina) (Fig. 4.2).
Em alguns tipos celulares, o citosol contém pigmentos (substâncias com cor própria) que se
elaboram na mesma célula ou que provêm do exterior. O mais importante é a lipofuscina, de cor
marrom, composta por fosfolipídios combinados com proteínas. Pelo fato de aumentar com a idade, é conhecido como pigmento de desgaste (Cap. 7-33).
Finalmente, no citosol de algumas células, há cristais de proteínas, de significado geralmente
desconhecido.
4- 4. No citosol, os ribossomas sintetizam proteínas
A síntese de proteínas celulares ocorre nos ribossomas, de cujo estudo nos ocuparemos no Cap.
"'16. Trata-se de estruturas ribonucleoprotéicas muito complexas, a maioria das·quais está localizada no citosol (nos Caps. 8-11 e 9-15 veremos que também existem ribossomas nas mitocôndrias
e !1-ºs cloroplastos).
Somente uma parte das proteínas sintetizadas nos ribossomas citosólicos permanece no citoj sol, já que as restantes emigram para o núcleo, para o sistema de endomembranas, para as mitocôndrias e para os peroxissomas (Fig. 4.3).
L' Como é compreensível, para que as proteínas possam chegar a esses destinos, é necessário o
J, sistema de sinais específicos que sejam capazes de discriminá-los a fim de assegurar a chegada de
cada proteína ao lugar c01Tespondente. Tais sinais são encontrados nas mesmas moléculas protéi'--.
.
-~-
1
O CITOSOL
•
61
Fig. 4.3 Destinos das proteínas
sinteti zadas nos ribossomas
citosólicos .
CITOSOL
l~ ~~
Retículo endoplasmático
Núcleo
/~
Peroxissoma
Mitocôndria
cas que consistem em uma ou várias seqüências de alguns poucos aminoácidos , denominados
peptídeos sinalizadores e sinais de ancoragem (Cap. 7-12).
Segundo o destino da proteína que surge do ribossoma, essas seqüências se localizam na extremidade amina, na extremidade carboxila ou em um ou mais pontos intermediários da cadeia protéica. O Quadro 4.1 informa sobre os sinais mais comuns achados nas proteínas que se dirigem ao
núcleo, ao sistema de endomembranas, às mitocôndrias e aos peroxissomas. Naturalmente, as
proteínas que não emigram e permanecem no citosol não necessitam de nenhum tipo de sinal.
p
-r-
4- 5. As chaperonas ajudam as proteínas a se dobrar de
forma oportuna e adequada
Embora as proteínas adotem formas tridimensionais que dependem da seqüência linear dos
aminoácidos que as compõem (Cap. 2-9), nem sempre se dobram corretamente. Para que suas
dobraduras sejam corretas é necessário, entre outros requisitos, a sua produção no lugar adequado "
e no momento oportuno, o que é obtido pela intervenção de estruturas chamadas chaperonas, assim ,
designadas porque acompanham as proteínas e - sem exercer ações diretas sobre elas_:__ previnem suas dobraduras prematuras cuidando para.que sejam corretas. .
/
Existem três famílias de chaperonas, denominadas hsp60, hsp70 e hsp90 (do inglês, heat shock
protein). A sigla hsp é usada pelo fato de que nas células submetidas a golpes de calor a dobradura
das proteínas é perdida (elas se desnaturam) e aumenta consideravelmente o número d~chapero­
nas que ajudam as proteínas desnaturadas para que voltem a se dobrar. O número que acompanha
.
-·----'l
a sigla hsp corresponde ao peso molecular da primeira chaperona descoberta em cada grupo.,_
As chaperonas hsp70 são monoméricas e possuem um sulco no qual cabe apenas uma parte da
proteína assistida, de maneira que são necessárias várias chaperonas hsp70 para cada proteína (Fig.
4.4). Ao contrário, as chaperonas hsp60 são poliméricas e são compostas por 14 ou 18 polipetídeos
denominados chaperoninas, que compõem uma estrutura cilíndrica em tomo de um espaço central, _onde ingressa a proteína que vai ser assistida (Fig. 4.4).
Para exemplificar como as chaperonas hsp70 e hsp60 atuam analisaremos seus efeitos sobre as
proteínas do citosol. À medida que emana do ribossoma, cada proteína citosólica se associa às
sucessivas chaperonas hsp70, cuja função é prevenir a ~obradura prematur; ~ às vezes e1Tada- 1~
dos segmentos protéicos que vão saindo do ribossoma. Além disso, evitam que a proteína nascente combine com moléculas inapropriadas. Quando acaba de ser sintetizada e sua dobradura é con- "'
Chaperonina
hsp70
hs60
Fig. 4.4 Esquemas das
chaperonas hsp70 e hsp60. O
mecanismo de ação das
chaperonas hsp90 está ilustrado
na Fig. 11.3.
62
•
O CITOSOL
Quadro 4.1 Exemplos de peptídeos sinalizadores e sinais de ancoragem
Peptídeo sinalizador para o retículo
endoplasmático
- H31 - Met-Met-Ser-Phe-Val-Ser-Leu-Leu-Leu-Val-Gly-Ile-Leu- Phe-Trp-AlaThr-Glu-Ala-Glu-Gln-Leu-Thr-Lys-Cys-Glu-Val-Phe-Gln
-COO-
Sinal de ancoragem para o retículo
endoplasmático
+H3 NLys-Ile-Ile-Thr-Ile-Gly-Ser-Ile-Cys-Met-Val-Val- Gly-Ile-Ile-SerLeu-Ile-Leu-Gln-Ile-Gly-Asn-Ile-Ile-Ser-Ile-Trp-Ile-Ser-His
-COO-
· Peptídeo sinalizador para o núcleo
Peptídeo sinalizador para a mitocôndria
+H3 - --Lys-Arg-Pro-Ala-Ala-lle-Lys-LysAla-Gly-Gln-Ala-Lys-Lys-Lys-Lys
-COO +H3 -Met-Leu-Ser-Leu-Arg-Gln-Ser-Ile-Arg-Phe-Phe-Lys-Pro-AlaThr-Arg-Thr-Leu-Cys-Ser-Ser-Arg-Tyr-Leu-Leu---
Peptídeo sinalizador para o peroxissoma
+H3
1-
coo
Ser-Lys-Leu-COO
cluída, a proteína se desprende do ribossoma e das chaperonas hsp70 e fixa residência no citosol.
No entanto, se algumas de suas partes não se dobraram ou se dobraram mal, ela ingressa temporariamente em uma chaperona hsp60, dentro da qual - isolada dos demais componentes citosólicos - termina de se dobrar ou desfaz sua dobradura incorreta e se dobra novamente, tratando de
fazê-lo sem erroV
As proteínas' destinadas ao sistema de endomembranas, diferentemente das citosólicas, por
ingressarem no retículo plasmático à medida que saem do ribossoma, dobram-se na cavidade desta organela, que conta com chaperonas hsp7Õ (Cap. 7-12).
,-com relação às proteínas destinadas às mitocôndrias, desde o momento que saem do ribossoma são assistidas por chaperonas hsp70 citosólicas, que as mantêm desdobradas até que cheguem
a seu destino. No Cap. 8-28, veremos que se dobram depois de se incorporar às mitocôndrias, em
cuja matriz há chaperonas hsp70 e hsp60.
Contrariamente, as proteínas destinadas aos peroxissomas os abordam depois de ter se dobrado no citosol (Cap. 10-5), de onde se deduz que se dobram com assistência de chaperonas hsp70
e hsp60 citosólicas e que os peroxissomas não possuem chaperonas.
O mesmo ocorre com as proteínas destinadas ao núcleo, que tampouco possuem chaperonas.
No Cap. 11-6 analisaremos como estas proteínas - dobradas no citosol - atravessam os poros
do envoltório nuclear. Além disso, veremos que algumas ingressam no núcleo associadas a chaperonas da família hsp90.
!Devemos acrescentar que as chaperonas consomem energia derivada do ATP e que podem ser
utilizadas após concluírem suas funções .'
4- 6. No citosol, os prº"t~a.s.somos degradam as proteínas
que devem desaparecer
No citosol existem estruturas que desempenham funções opostas às dos ribossomas, já que
destroem as proteínas. Assim, quando uma proteína deve desaparecer - porque se dobrou mal,
porque foi danificada ou sua função foi concluída - é degrada por um complexo enzimático de
cerca de 700 kDa chamado proteassomo.
O proteassomo é de forma cilíndrica e composto de várias proteases dispostas em tomo de uma
cavidade central, onde ingressa a proteína que vai ser degradadã_(Fig. 4.5). Sua estrutura é mais
complexa, já que junto a cada extremo do cilindro acha-se um "capuz" protéico integrado por 20
polipeptídeos reguladores.
Para poder ingressar no proteassomo, as proteínas destinadas a desaparecer devem ser previamente "marcadas" por um conj unto de polipetídeos citosólicos iguais entre si, de 76 aminoácidos
cada um, chamados ubiquitinas. Na Fig. 4.5 está resumido o ciclo seguido por essas moléculas.
A primeira ubiquitina é ativada pela enzima El , que a transfere para a enzima E2. Em seguida,
com a ajuda da ligase E3, o complexo ubiquitina-E2 une-se à proteína que deve ser degradada. Já
que o processo de transferência entre as enzimas El e E2 se repete várias vezes, a proteína fica
conectada a uma curta cadeia de ubiquitinas·~
O CITOSOL
--+
Oligopeptideos
~~
~
§-O
--+
~
r..J
63
Fig. 4.5 Degradação de proteínas
no proteassomo.
i
i
~
•
~
Prote ína
i
o
h~~~S,.1
PROTEASSOM·o
Ubiquitina
Polipept ídeos
reguladores
De imediato, este complexo é reconhecido pelos polipeptídeos reguladores de um dos dois
capuzes , que separam as ubiquitinas, desfazem a dobradura da proteína e a introduzem na cavidade do proteassomo , onde é degradada pelas p.ro1eas~O.riginarn--s@-0li-§Gf>~f>t-Íàees-euFtBs-que-s.aem
do_prQte_as.s.om0-~ã0-l.ançados..no_cito.sol.
(
O processo descrito consome energia. Esta é fornecida por moléculas de ATP, cuja hidrólise é
, levada a· cabo por seis A TPases situadas nos capuzes do proteassomo.
Ao finalizar a degradação da proteína, o proteassomo e as ubiquitinas ficam disponíveis para a
sua
reutilizacão.
'-.___,
,
BIBLIOGRAFIA
Clarke A.R. (1996) Molecular chaperones in protein fo lding and
translocation. Curr. Opin. Struc. Biol. 6:43.
Craig E.A. (1993) Chaperones: helpers along the pathways to protein
fo lding. Science 260: 1902 .
Ellis R.J. (1996) The "bio" in biochemistry: protein fo lding inside and
outside the cell. Science 272: 1448 .
Frydman J. and Hartl F.U. ( 1996) Principies of chaperone-assisted protein foldin g: difference between in vitro and in vivo mechanisms.
Science 272: 1497.
Georgopoulos C. (1992) The emergence of the chaperone machines.
TIBS 17:295 .
Goldberg A.L. (1995) Functions of the proteasome: the lysis at the end
of the tunnel. Science 268:522.
Gorlich D. and Mattaj I.W. (1996) Nucleocytoplasmic transport. Science 271: 1513.
Hartl F.U. and Martin J. (1995) Molecular chaperones in cellular protein foldin g. Curr. Opin Struc. Biol. 5:92.
Hershko A. ( 1996) Lessons from the discovery of the ubiquitin system.
TIBS 21:445 .
Hiller M.M. et al. (1996) ER degradation of a misfolded luminal protein by the cytosolic ubiquitin-proteasome pathway. Science
273: 1725.
Hilt W. and WolfD.H. (1996) Proteasomes: destruction as a programme.
TIBS 21:96.
Kalderon D. (1996) Protein degradation: de-ubiquitinate to decide your
fate. Curr. Biol. 6:662.
Rassow J. and Pfanner N. (1996). Protein biogenesis: chaperones for
nascent polypeptides . Curr. Biol. 6: 115 .
Sue W. , Maurizi M.R. and Gottesman S. (1999) Posttranslational quality
control: folding, refolding, and degrading proteins. Science 286: 1888.
Verma R. et ai. (2002) Role of Rnp 11 metalloprotease in deubiquitination and degradation by 26S proteasome. Science 298 :6 11.
Yu H. et ai. (1996) Identification of a novel ubiquitin-conjugating
enzyme involved in mitotic cyclin degradation. Curr. Biol. 6:455.
O citoesqueleto
Forma e motilidade
5-1. O citoesqueleto é composto por três tipos de filamentos e
numerosas proteínas acessórias
As células eucariontes possuem uma armação protéica filamentosa espalhada por todo o citosol, que recebeu o nome de citoesqueleto. O citoesqueleto é composto por três tipos de filamentos - os filamentos intermediários, os microtúbulos e os filamentos de actina'(Fig. 5.1 ) - e um
conjunto de proteínas acessórias classificadas como reguladoras, ligadoras e motoras.
As proteínas reguladoras controlam o nascimentó , o alongamento, o encurtamento e o desaparecim_rnto dos três filamentos principais do citoesqueleto. Estes processos se baseiam nas propriedades moleculares dos filamentos, já que são polímeros integrados por unidades monoméricas - dispostas linearmente - que podem somar-se ou subtrair-se.
As proteínas ligadoras conectam os filamentos entre si ou. com outros componentes da célula.
As proteínas motoras servem para transladar macr_9.Il10léculas e O_!ganelas de um ponto a outro
do citoplasma. Também fazem com que c!oi§_ fitim~nto s contíguos e IJaralelos _entre_si_~em
em sentidos opostos, o que constitui a base da motilidade, da contração e das mudanças de forma
da célula. Esta propriedade confere uma função adicional ao citoesqueleto, a de ser o "sistema
muscular" da célula, ou seja, a citomusculatura. O exemplo mais estruturado de interação entre
filamentos e proteínas motoras encontra-se na miofibrila da célula muscular esquelética, na qual
compõem uma armação macromolecular adaptada para a contratilidade.
O citoesqueleto dá forma - estável ou mutante - às células, como resultado da interação dos
três tipos de filamentos com diferentes proteínas acessórias.
Em primeiro lugar serão analisados os filamentos intermediários; em seguida, os microtúbulos
e, finalmente, os filamentos de actina, cada um com suas respectivas proteínas acessórias.
FILAMENTOS INTERMEDIÁRIOS
5-2. O diâmetro dos filamentos intermediários é de 1O nm
No citoesqueleto da maioria das células existem filamentos de 10 nm de diâmetro; são denominados intermediários porqu«_ têm uma es essura menor que a dos microtúbulos e maior que a
dos filamentos de actina (Fig. 5.1).
Filamentos intermediários
Microtúbulos
Filamentos de actina
F ig. 5.1 Os três tipos de filamentos do citoesqueleto.
5
66
•
O CJTOESQUELETO
Fig. 5.2 Etapas na form ação dos
filamentos intermediários e sua
organização estrutural definitiva.
"'?!' abcdefg abcdelgabcde·g abcdefgabcdefg abcdelgabcdelgabcdelg
NH 2
0
Monômero
COOH
fN:;----------- ------.:;;êl
Dímero
~-N_T- __ -- ----------- -- _!L<.2 .~
f N :;--~--------------.:;;ê l
1 N--CS0 C 1
~---: e JI
.,'.g;'N" I
1 C -J!...
J;L. N _..
•-- -- - ___________________
Tetrâmero
l
Protolilamento
Filamento
A composição química dos filamentos intermediários é diversa. Por isso , embora também
por sua morfologia e sua distribuição nos diferentes tipos de células, são agrupados em seis tipos
chamados: 1) laminofilamentos; 2) filamentos de queratina; 3) filamentos de vimentina; 4) filamentos de desmina; 5) filamentos gliais e 6) neurofilamentos.
Todos os filamentos intermediários mostram a mesma organização estrutural. Trata-se dé polímeros lineares cujos monômeros são proteínas que apresentam uma estrutura em hélice.ex fibrogt (Fig. 5.2). Isto os diferencia dos microtúbulos e dos filamentos de actina que possuem monômeros globulares.
~
As proteínas fibrosas são compostas por uma sucessão de seqüências idênticas de sete aminoácidos cada uma ( ... abcdefgabcdefgabcdefg ... ), o que lhes permite combinar entre si lado com
lado e compor dímeros lineares. Em virtude dos dímeros voltarem a se combinai entre si - também de dois em dois, porém' de forma defasada e antiparalela - são gerados tetrâmeros como os
ilustrados na Fig. 5.2. Em seguida, os tetrâmeros se conectam por suas extremidades e dão lugar
a estruturas cilíndricas alongadas chamadas protofilamentos. Os filamentos intermediários são
formados com o concurso de quatro pares de protofilamentos, que se aderem por seus lados e compõem uma estrutura de fibrilas de 10 nm de espessura (Fig. 5.2).
Apesar das diferenças entre os monômeros dos diferentes tipos de filamentos intermediários,
todos se organizam da forma que acabamos de descrever. Os monômeros são codificados por
multigenes que se expressam de maneira diferente nos diferentes tipos de células. Além disso, às
vezes, em uma linhagem celular são expressos sucessivamente vários desses genes conforme sua
diferenciação avança.
Os filamentos intermediários formam uma rede contínua estendida entre a membrana plasmátiç_a_e_p enyoltório nuclear, ao redor da qual compõem uma malha-filamentosa compacta (Fig. 5.3A).
Outra malha como esta cobre a face interna do envoltório nuclear, de modo que se trata de filamentos intermediários não localizados no citoplasma e sim no interior do núcleo. A distribuição
dos filamentos intermediários pode ser vista na Fig. 5.3B, que mostra uma célula epitelial tratada
com anticorpos antiqueratina fluorescentes.
Fig. 5.3 A. Distribuição dos
filamentos inte1mediários no
núcleo e no citoplasma. Os
filamentos nucleares, chamados
laminofilamentos, formam uma
malha sobre a face interna do
envoltório nuclear. B.
Fotomicrografia de uma célula
tratada com anticorpos
antiqueratina fluorescentes. (De
R. D . .Goldman.)
O CITOESQUELETO
Os filamentos intermediários contribuem para a manutenção da forma celular e estabelecem as
pos ições das organelas no interior da célula. Todavia, sua função principal é de natureza mecânica, por isso são encontrados filamentos muito mais desenvolvidos nas células submetidas a grandes tensões.
5-3. Os diferentes tipos de filamentos intermediários são
caracterizados por diversas propriedades
A seguir oferecemos uma breve descrição das características principais dos seis tipos de filamentos intermediários:
Laminofilamentos. Em todas as células, apoiada sobre a face interna do envoltório nuclear,
existe uma malha delgada de fil amentos intermediários conhecida como lâ~i~a nuclear, composta por filamentos intermediários chamados larninofilainentos, que são os únicos que nãó se
localizam no citosol (Cap. 12-2) (Fig. _12. 1). Os laminofilamentos contêm três tipos de monômeros com pesos moleculares que variam de 65 a 75 kDa. Esses monômeros possuem domínios fibrosos mais longos que os dos filamento s intermediários citosólicos, e seu encaixe gera uma malha
achatada e não uma rede tridimensional. A lâmina nuclear é responsável pela forma e resistência
do envoltório nuclear.
Filamentos de queratina. Os filamentos de queratina (ou ceratina*) - chamados também
tonofilamentos - são encontrados nas ~_pjteliais, particularmente na epiderme e seus deri vados (pêlos, unhas etc.), nas mucosas e nas glândulas. Nos Caps. 6-7 e 6-13 veremos que se
associam aos hemidesmoss;mos e aos desmossomos, com os quais compõem uma trama filamen tosa q;:mtínua espalhada por todo o epitélio , aó qual conferem grande parte de sua resistência
mecânica.
Uma proteína ligadora denominada filagrina une os fil amentos de queratina no seu ponto de
cruzamento.
Os monômeros de filamento s de queratina são chamados cit()queratinas. Existem çerca de 30
citoqueratinas diferentes classificadas em dois grupos: as de classe l , que são ácidas, e as de classe II, que são neutras ou básicas.
Os diferentes tipos de células epiteliais contêm filamentos de queratina diferentes já que cada
um fabrica citoqueratinas de qualidade distinta. Por exemplo, as células epiteliais da bexiga contêm uma combinação particular de citoqueratinas, pertencentes às classes I e II. Algo similar ocorre
nos outros epitélios. Estas combinações particulares são apróveitadas para diagnosticar a origem
de alguns tumores cancerígenos e suas metástas"ês, já que as citoqueratinas não se modificam com
a formação cancerosa e podem ser identificadas com a ajuda de anticorpos específicos (Cap. 23 -
----------
"r
s
a
l-
).
l-
o
.a
26).
Filamentos de vimentina. Os filamentos de vimentina (do latim vimentus, ondulado) apresentam um aspecto
ondulado e seus monômeros têm um peso molecular de 54 kDa. São
muito
_,,_----comuns nas células embrionárias. No organismo desenvolvido localizam-se nas ~ las de origem mesodérmica, como os fibroblastos, células endoteliais, células do sangue etc.
- A proteína ligadora que une os filamentos de vimentina no seu ponto de cruzamento é a plactina.
Uma vez que os anticorpos contra os monômeros de vim,entina mostram reações cruzadas em
células de mamíferos, aves e anfíbios, podemos afirmar que são proteínas que se conservaram no
decorrer da evolução.
Filamentos de desmina. Os filamentos de desmina são formados por monômeros de 53 kDa e
se encontram no citoplasma de todas as células musculares , sejam estriadas (voluntárias e cardíacas) ou lisas. Nas células estriadas ligam ás miofibrilas por seus lados (Seção 5-33). Nas.células
cardíacas também se associam aos desmossomas dos discos intercalares (Seção 5-34 e Cap. 613). Nas células musculares lisas associam-sé aos filam\!n tos de actina (Seção 5-35).
Os filamentos de desmina unem-se entre si mediante uma proteína ligadora específica denominada sinamina.
*N.R.T.: Alguns autores preferem utilizar o termo ceratina, mas a maiori a opta por queratina.
•
67
68
O CITOESQUELETO
Neurofilamentos. Os neurofilamentos são os principais elementos estruturais dos neurônios,
incluindo dendritos e axônio. este formam uma rede tridimensional que converte o axoplasma
(o citosol do axônio) em um gel extremamente resistente e estruturado. Nos neurofilamentos são
reconhecidos três tipos de monômeros, com pesos que vão de 68 a 200 kDa.
Filamentos gliais. Os filamentos gliais encontram-se no citosol dos astr~citos e d~ alg_!!mas
células de Schwann . São compostos por monômeros ácidos de 50 kDa. Os oligodendrócitos não
contêm este tipo de filamentos intermediários .
MICROTÚBULOS
5- 4. O diâmetro dos microtúbulos é de 25 nm
.IJ
.' ,
~
r•
~
•
.
Os microtúbulos são filamentos do citoesqueleto encontrados em quase todas as células eucariontes e possuem um diâmetro de 25 nm (Fig. 1.9). São caracterizados por seu aspecto tubular e
porque são notavelmente retilíneos e uniformes. Nos cortes transversais apresentam uma configuração anular, com uma parede de 6 nm de espessura e uma luz central uniformemente clara (Fig.
5.1 ).
De acordo com sua localização, os microtúbulos se classificam em: 1) citoplasmáticos, presentes na célula em interfase; 2) mitóticos , correspondentes às f~bras do fuso m!!ótico; 3) ciliares,
localizados no eixo dos cílios e 4) centriolares, pertencentes aos corpúsculos basais e aos_centríolos. Embora todos tenham as mesmas características morfológicas, diferem em algumas propriedades. Por exemplo, os microtúbulos ciliares e os centriolares são muito estáveis comparados
com os citoplasmáticos e os mi.tóticos, :que mudam permanentemente de comprimento.
As proteínas acessórias dos microtúbulos (reguladoras, ligadoras e motoras) recebem o nome
de MAP (do inglês, microtubule-associated proteins).
5-5. Os microtúbulos citoplasmáticos têm origem no centrossomo, que
contém um par de centríolos e Lima matriz
Os microtúbulos citoplasmáticos nascem. em uma estrutura contígua ao núcleo chamado
centrossomo. Daí, estendem-se por todo o citoplasma para alcançar a membrana plasmática, na
qual se fixam ; conseqüentemente, exibem um aspecto de raios de roda que partem do centro para
a pe1iferia da célula (Fig. 5.4A). Esta disposiçã'o dos microtúbulos pode ser vista na Fig. 5.4B, que
mostra uma célula cultivada tratada cóm anticorpos antitubulina fluorescentes .
O centrossomo também é chamado centro organizador de niicrotúbulos ou MTOC (do inglês, microtubule-organizing centre). É composto por um par de centríolos ou diplossomo (do
grego, diplóos , duplo , e sôma, corpo) e uma substância, aparentemente amorfa, que os circunda,
a matriz centrossômica (Figs. 5.4 e 5.23). Esta matriz contém uma rede de fibras muito delgadas
e um complexo de proteínas reguladoras denominadas ')'-tubulinas.
Devido à semelhança dos centríolos com os corpúsculos basais dos cílios, estes serão descritos
juntos na: Seção 5-14.
Fig. 5.4 A. Distribuição dos microtúbulos no citoplasma. Todos nascem na matriz centrossôinica que,
além disso, contém o par de centríolos do diplossomo. B. Fotomicrografia de uma célula cultivada tratada
com anticorpos antitubulina fluorescentes. (De M. Osborn e K. Weber.)
O CITOESQUELETO
•
69
5-6. A tubulina é o componente monomérico dos microtúbulos
Os microtúbulos são polímeros compostos por unidades protéicas chamadas tubulinas. Por
sua vez, cada tubulina é um heterodímero de 110 a 120 kDa, cujas duas unidades -denominadas
a-tubulina e {J-tubulina- são proteínas do ti o globular (Fig. 5.5). Existem seis tipos diferentes
de a-tubulinas e seis tipos diferentes de 13-tubulinas, porém sempre uma a -tubulina é combinada
a uma 13-tubulina e nunca duas a -tubulinas nem duas 13-tubulinas entre si.
No Cap. 16-21 serão analisados os mecanismos que regulam a produção das a-tubulinas e das
13-tubulinas nos ribossomas.
Além de serem distintas, as duas subunidades das tubulinas são muito afins, o que permite que
a subunidade a de cada tubulina possa se combinar não apenas com a subunidade 13 do próprio
heterodímero, mas também - por meio de sua extremidade livre - com a subunidade 13 de outra
tubulina (Fig. 5.5). Além disso, os heterodímeros podem se unir entre si por seus flancos, e o fazem de modo tal que se fecham em círculo. Estas particularidades levam à formação de uma estrutura tubular cuja parede parece estar integrada por vários fil amentos que percorrem o eixo longitudinal do microtúbulo e são conhecidos como protofilamentos. Quando o ínicrotúbulo é observado em um corte transversal, podemos ver que ele contém 13 protofilamentos (Fig. 5.5).
A Fig. 5.5 permite comprovar que existe defasagem entre as a -tubulirías e as 13-tubulinas dos
protofilamentos contíguos. É por isso que nos cortes transversais dos microtúbulos não se observa uma alternância regular entre as a-tubulinas e as 13-tubulinas e sim duas ou três subunidades
contíguas (Fig. 5.5).
Graças à polaridade das tubulinas , o próprio microtúbulo acaba polarizado, já que em uma de
suas extremidades ficam expostas as subunidades a e na outra - as subunidade;:s 13. Os heterodímeros podem se agregar (polimerizar-se) ou se afastar (despolimerizar-se) por ambas as extremidades. Como é óbvio, durante a polimerização, o rnicrotúbulo se alonga e, durante a despolimerização ele se encurta.
Uma das extremidades do microtiibulo é chamada mais [ + ]; a outra, menos [ - ] (Fig. 5.6).
Estas designações são devidas ao fato de o microtúbulo se alongar pela extremidade [ + ] e se encurtar mais rapidamente pela extremidade [ - ] (Fig. 5.6).
)
l,
+
e:J --+
s
Protofilamento
Fig. 5.5 Formação e organização estrutural dos microtúbulos. É ilustrado o modo como se combinam as
cx-tubulinas e 13-tubulinas para formar a parede tubular, composta por 13 protofilamentos.
[-]
la
[+]
Fig. 5.6 Polimerização
(alongamento) e
despolimerização
(encurtamento) dos microtúbulos
por suas duas extremidades.
70
•
O CITOESQUELETO
•
Fig. 5.7 Surgimento de um
microtúbulo a partir da matriz
centrossômica, enquanto outros
se alongam, se encurtam ou
desaparecem.
Fig. 5.8 Representação do
complexo anelar de ')'-tubulinas.
Numerosos complexos como
este se localizam na matriz
centrossômica, onde atuam como
modelos para a gestação dos
microtúbulos.
5- 7. Os microtúbulos citoplasmáticos são estruturas dinâmicas
r--.....
l.AE tremidade [-] dos microtúbulos se localiza no centrossomo. Ali , os processos de polimeri zação e de despolimerização se acham bloqueados por influência de um componente
centrossôrnico (mais adiante veremos que se trata do complexo protéico de -y-tubulinas) .
Os microtúbulos citoplasmáticos são estruturas dinâmicas, já que incessantemente'se formam
microtúbulos novos , quando alguns se alongam e outros se encurtam até desaparecer (Fig. 5.7).
Os rnicrotúbulos se desenvolvem a partir da matriz centrossômica. Para isso,,algumas poucas
tubulinas (provenientes do depósito de tubulinas livres que se acham no citosol) conéorrem para
a matriz centrossômica e se nucleiam (polirnerizam-se). Esse núcleo constitui o primeiro esboço
do rnicrotúbulo e se forma por in fl uência do complexo protéico de ')'-tubulinas, que promove o
encaixe das primeiras 13 tubulinas da extremidade [-].Os centríolos não desempenham nenhum
papel neste processo. De imediato, o_rnicrotúbulo começa a cres~ er or sua extreJ.Q_iQ_ade [+ ],ao
serem agregadas novas tubulinas provenientes do depósito de tubulinas do citosol.j
O complexo de -y-tubuliniS"tem forma anular, seu diâmetro é similar ao do ~icrotúbulos, ~
comporta como um molde a partir do qual se nucleiam as primeiras 13 tubul§ . Sua forma Seria
como a da Fig. 5.8, que permite a defasagem existente entre as tubulinas dos protofilamentos contíguos.
z Além disso, o complexo de -y-tubulinas se comporta como um capuz que bloqueia o crescimento e o encurtamento do microtúbulo por sua extremidade [ - ].
Quando as tubulinas se despolimerizam dos microtúbu!os, passam a fazer parte do depósito de
tubulinas livres do citosol. Inicialmente, cada tubulina contém um GDP em sua subnidade 13, que
não tarda em se intercambiar por um GTR no mesmo citosol (Fig. 5 .9)'~ seguida, as tubulinas
com GTP são atraídas pelas extremidades + ] dos microtúbulos em crescimento e se unem a eles.
Diferentemente do que ,ocorre no citosol, a polimerização faz com que o GTP das tubulinas se
hidrolise em GDP e fosfato. Como vemos, a formação dos microtúbulos é um processo que consome energia.
As tubulinas com GDP tendem claramente a se despolimerizar da extremidade [+]dos próprios filamentos (Fig. 5.9), o que se deve ao encurvamento que essa extremidade sofre por influência
precisamente do GDP (Fig. 5.10).
Assim descrito, o processo de polimerização e despolimerização das tubulinas compreenderia
um círculo vicioso, já que a polimerização - com a conseqüente formação de GDP - levaria à
imediata despolimerização dos monômeros. Isto não ocorre, já que as tubulinas recém-incorporadas demoram um tempo para hidrolisar seu GTP e formam um capuz de tubulinas-GTP em uma
extremidade do microtúbulo, o que impede a saída das tubulinas chegadas com antecedência, apesar
de que, nelas , o GTP já se converteu em GDP (Fig. 5.1 O).
Por causa desta part'Ícularidade - denominada instabilidade dinâmica - quando um microtúbulo alcança o comprimento desejado, para mantê-lo deveria alternar breves períodos de polimerização com outros de despolimerização. Tendo em vista que em termos energéticos isso seria
muito oneroso, desconta-se a existência de proteínas regu ladoras que se unem à extremidade [-PJ
do microtúbulo para evitar esta instabilidade. 1
[+]
['-]
(- ]
(-]
Fig. 5.9 Intercâmbio das
tubulinas-GDP e das tubulinasGTP entre os microtúbulos e o
citosol.
Tubulina-GTP
« ) Tubulina-GDP
,.
O CITOESQUELETO
Capuz
,_.___.....
CJ Tubulina-GTP
•
71
Fig. 5.10 Formação de capuzes
de tubulinas-GTP na
extremidade do microtúbulo.
Observe-se que quando o GTP
se converte em GDP e não se
remove o capuz, as tubulinas se
desprendem.
C) Tubu lina-GDP
Mespolimerização do mkrotúbulo é muito mais rápid a_do_qm~_ª-J2 0limerizacão. A diferença
de velocidade se toma evidente quando o microtúbulo passa de uma fase de alongamento para
outra de encurtamento e vice-versa. No primeiro caso, a despolimerização é tão abrupta que é
conhecida como "catástrofe". Por óutro lado , quando o encurtamento cessa, e o microtúbulo começa a se alongar, o processo - por ser relativamente lento - le"'. a o nome de "salvamento".
No citosol existe uma ·roteína recruladora - chamada càtastrofina - que detém o érescimento dos microtúbulos e causa sua despolimerização depois da perda do capuz de tubulinas-GTP.
A colchicina, um medicamento utilizado para o tratamento da gota, atua de forma semelhante,
já que se une às tubulinas e impede sua polimerização; o que leva - pelo fato de o capuz não se
formar - ao desaparecimento dos microtúbulos. A colcemida é um derivado da colchicina que
possui os mesmos efeitos.
5-8. Os microtúbulos citoplasmáticos são necessários para o
transporte das organelas e das macromoléculas
Os microtúbulos citoplasmáticos constituem verdadeiras vias de transporte pelas quais se mobilizam ~acromoléculas e organelas (mitocôndrias, vesículas transportadoras etc.) de um ponto a
outro do citoplasma. Esta função é realizada com a assistência de duas roteínas f!10toras, a cinesina e a dineína. Quando elas estão "carregadas" com o material a transportar, a ci11~sin a desliza
Q_ara a extremidade [±] do microtúbulo e a _d~a pª ril a extremidade [ - ]_(Fig. 5.11 ).
Estas Jlroteí11~s motoras são compostas por quatro cadeias _polipeptídicas, duas pesadas· e duas
l~ves (Fig. 5.12). Cadá cadeia pesada contém um domínio globúlar (ou cabeça) e~ fibroso (ou
cauda) . Q_fib.roso se: conecta com o material a transportar e o globular se_une ao.__!):l~ bulo .
Na membrana das organelas celulares e das vesículas transportadoras foram identificadas as
pJoteínas transmen}Qranas cinectina e dinactina, com as quais se unem a cinesina e a dineína,
respectivamente.
A energia consumida pelo transporte é conhecida pelo ATP depois de sua hidrólise por ATPases
presentes nas cabeças das prote_ínas motoras. Foi calculado que a cinesina se desloca cerca de 8
nm por cada ATP hidrolisado.
Um exemplo de transporte através destas proteínas é observado nos melanócitos da pele, cujos
grânulos de melanina, diante de determinados ~stír11ulos, de_sliz'l.m à.o longo dos microtúbulos tanto
centrípeta como centrifugamente. Outro exemplo corresponde aos axônios , onde as cin ~sinas
c;onduzem moléculas e vesículas dQ_COfP-2 ~ai para a terminaç!o axônica, e as dineínas as
retomam.
Fig. 5.11 Utilização dos
microtúbulos como vias sobre as
quáis se deslocam as proteínas
motoras dineína e cinesina para
transportar materiais entre
diferentes pontos do citoplasma.
72
•
O CITOESQUELETO
!
..
[-]
-~Dineína_
[+]
!
Cinesina ~.11. . .
[-] -
[+]
Fig. 5.12 União das vesículas transportadoras com a cinesina e a dineína mediante as proteínas
transmembrana cinectina e dinactina, respectivamente.
-----
Os neurônios contêm outra proteína motora ligada aos microtúbulos. Chama-se dinamina e,
ªº contrário da cinesina e da dineína, possui atividade de GTPaS°B.' Ademais, como veremos no
\
Cap. 7-37, em todos os tipos celulares a dinamina provoca o desprendimento das vesículas transportadoras que são geradas através de envoltórios de clatrina.
5-9. Os microtúbulo.s citoplasmáticos contribuem para
estabelecer a forma celular
Os microtúbulos contribuem para o estabelecimento das formas que as células adquirem. Além
disso, mediante as proteínas acessórias, mantêm o retículo endoplasmático e o complexo de Golgi
em suas posições no citoplasma, o que determina a polaridade celular. Ficou comprovado que na
estabilização dessas organelas intervêm, respectivamente, a cinesina e a dineína, duas proteínas
motoras.
Nos neurônios, os microtúbulos se acham também nos dendritos e nos axônios (Fig. 5.13). Além
disso, o crescimento do axônio de ende do alongamento dos seus microtúbulos. Durante esse alongamento, ao nível do cone de crescimerito do axônio, foi descoberta, entre os microtúbulos, a
anteriormente mencionada dinamina que provoca o deslizamento de alguns microtúbulos sobre
outros, o que seria necessário para o processo de avanço do cone pela matriz extracelular (Seção
5-28).
No corpo neuronal e no axônio foi identificada U.!!la MAP reguladora chamada tau (em vista
da letra grega T) que !nibe a despolimerização das tubulinas nas extremidades dos microtúbulos e
que também exerce uma função ligadora, já que estabelece pontes entre os microtúbulos contíguos e lhes confere estabilidade. Outras MAP ligadoras, chamadas MAPl e MAP2, criam pontes
similares desses microtúbulos neuronais.
As tau contêm um número determinado de fosfatos, cujo aumento altera seu funcionamento
normal. O~o_dos fosfatos QQ.d.eria se produzir pela presença de cin.ases superativas ou de
fosfatases hipoativas. Isto ocorre na doença de Alzheimer, caracterizada por deterioração neuronal progressiva como conseqüência da instabilidade dos microtúbulos. Como vimos na seção
anterior, estes microtúbulos são imprescindíveis para o transporte intracelular de organelas e de
outros materiais vitais para a célula.
Fig. 5.13 Distribuição dos microtúbulos nos neurônios.
a
e
o
:a
e
í-
~s
to
:!e
0-
io
je
O CITOESQUELETO
•
73
5-10. Os microtúbulos mitóticos mobi lizam os cromossomos
durante a mitose e a meiose
A função dos microtúbulos mitóticos será analisada detalhadamente no Cap. 18-14.
A célula em mitose e em meiose conta com dois centrossomos em lugar de um, e os microtúbulos citoplasmáticos obser\lados na interfase são substituídos pelos microtúbulos mitóticos, chamados também fibras do fuso ·mitótico (Fig. 5.14). Ao contrário dos citoplasmáticos ri0s microtúbulos mitóticos , a ~dade [ - J não se acha bloqueada pela matriz centrossômica, cfe modo
que os microtúbulos podem se polimerizar e se despolimerizar também por essas extremidades.
Os microtúbulos mitóticos podem desaparecer mediante o uso de vimbtastina e de vincristina.
Esses medicamentos atuam de forma semelhante à colchiciria (Seção 5-7), embora não o façam
quase seletivamente sobre as fibras do fuso, daí a sua utilização para bloquear as divisões das células
neoplásicas no tratamento do câncer. O taxo[ (Paclitaxel) é um outro medicamento para tratar o
câncer, pois impede a despolimerização das fibras do fuso e induz seu crescimento descontrolado,
incompatível com a divisão celular.
Fig. 5.14 Distribuição dos
microtúbulos mitóticos (ou
fibras do fu so mitótico) durante
a divisão celular.
5-1 1. Os microtúbulos cilia res formam o eixo dos cílios e dos flagelos
Os cílios são apêndices delgados - de 0,25 µ,m de diâmetro e vários micrômetros de comprimento - que surgem da superfície de diversos tipos celulares (Fig. 1.7). Os de maior comprimento chamam-se flagelõs. Cada um é composto por um eixo citosólico - a matriz ciliar - envolto
por um prolongamento da membrana plasmática. Em meio a essa matriz, seguindo o eixo longitudinal,. do cílio, encontra-se uma armação filamentosa regular chamada axonema, o qual é composto por vários microtúbulos paralelos entre si associados com proteínas acessórias (Figs. 5 .15 e
5.16). Mais adiante descreveremos sua composição e suas funções.
Cada cílio nasce em um corpúsculo basal ou cinetossoma (do grego, kineetós, móvel, e sôma,
corpo) , que é uma estrutura idêntica a um centríolo do diplossomo. Os corpúsculos basais e os
centríolos serão analisados na Seção 5-14.
5-12. Os cílios se movem
Os cílios são estruturas que se movem. Segundo as células em que se encontram, seus movimentos servem para arrastar líquidos e partículas (como ocorre na árvore respiratória), para deslocar outras células (por exemplo, os espermatozóides, o ovócito (oócito) ou o zigoto na tuba uterina) ou para mobilizar as células autonomamente (por exemplo, os espermatozóides).
O movimento ciliar pode ser pendular, unciforme, infundibuliforme ou ondulante. No movimento pendular, o cílio parece rígido e se flexiona em sua base. No unciforme (o mais comum nos
metazoários) o cílio se dobra e adquire a forma de uma forq uilha. No infundibuliforme, o cílio
gira, descrevendo uma figura cônica. No ondulante, característico dos flagelos , o movimento se
desloca da extremidade proximal à extremidade distal do cílio.
Nas superfícies epiteliais cobertas por cílios pode se ver que estes se movem coordenadamente
e dão lugar a verdadeiras ondas que se deslocam pelo epitélio em uma determinada direção. Estas
ondas são produzidas porque cada cílio se move com pequeno atraso (ou adiantamento) com relação ao situado à frente (ou atrás) dele. A passagem da onda de uma célula à vizinha derivaria da
passagpm de certos solutos (sinais) através das junções comunicantes que regulam as células epiteliais entre si (Cap. 6-14) (Fig. 6. 12).
O movimento ciliar é produzido pelo axonem_a (Figs. 5 .1 5 e 5.16). Observados em um corte
transversal, os microtúbulos do axonema mostram uma configuração especial conhecida como "9
+ 2". Isso obedece ao fato de que na parte periférica dessa estrutura observam-se nove pares de
microtúbulos - os quais formam um círculo - e na parte central, dois microtúbulos mais. Dizse "9 + 2" porque os dois microtúbulos de cada par periférico estão firmemente unidos entre si formam uma dupla - e os do par central estão separados. Um dos microtúbulos de cada par periférico, identificado com a letra A, é complexo, quer dizer, possui 13 protofilamentos; o outro,
chamado B , é incompleto, pois conta com 10 ou 11 protofilamentos (Fig. 5.17). As duplas se dispõem em forma oblíqua, de modo que o microtúbulo A encontra-se mais próximo do centro do
Fig. 5.15 Microtúbulos ciliares.
Observar sua origem no
corpúsculo basal ou
cinetossoma.
74
•
O CITOESQUELETO
Fig. 5.16 Acima. Esquema de
um corte transversal do axonema
que mostra a configuração 9 + 2
característica dos microtúbulos
do cílio. A visão se dirige da raiz
para a ponta do cílio. Devemos
ressaltar a disposição dos
microtúbulos periféricos, que se
acham associados entre si em
pares, chamados duplas.
Observar os distintos tipos de
proteínas ligadoras e como as
proteínas motoras de dineína
formam "braços" orientados na
direção dos ponteiros do relógio.
Abaixo. Eletromicrografia de
um axonema revelado mediante
ácido tânico. (De D. W.
Fawcett.)
~----
Dupla
Nexina
Braço
externo
Proteína
radial
Bainha
interna
Microtúbulo A
Microtúbulo B
·I'
:1.
11'
...
Dupla
11
~
...
Braço
externo
•'
1r
Proteína
radial
~
Braço
interno
~·
Bainha
interna
Fig. 5.17 Disposição em dupla
de um par de microtúbulos
periféricos do axonema.
cílio que o microtúbulo B. Além disso, as extremidades [ - ] de ambos os microtúbulos apontam
para o corpúsculo basal (Fig. 5.18).
l:Qaxonema contém proteínas ligadoras e proteínas motoras (Fig. 5.16).
As proteínas ligadoras unem as duplas entre si e as sustentam em suas posições no interior do
cílio, o que mantém a integridade do axonema durante o movimento ciliar. Assim, as nexinas unem
o microtúbulo A de uma dupla ao microtúbulo B da dupla vizinha; a bainha interna envólve os
microtúbulos centrais, e as proteínas radiais unem os microtúbulos A com essa bainha.
As proteínas motoras são representadas pela dineína ciliar. Esta se diferencia da dineína citoplasmática porque é maior e tem três cadeias pesadas e três cadeias leves, em lugar de duas de
cada uma (Seção 5-8). As caudas da dineína ciliar estão ancoradas no microtúbulo A de uma dupla, enquanto as cabeças globulares - com suas respectivas ATPases - estabelecem junções
iD;-termitentes com o microtúbulo B da dupla vizinha. Assim, as dineínas formam pontes instáveis
entre as duplas contíguas.
As dineínas também são denominadas braços internos e externos do axonema (Fig. 5 ..16), o
que indica a origem de algumas no microtúbulo A em posições mais periféricas em relação a ou-
--
~---=----
-
-
- -
-
O CITOESQUELETO
[+!
•
75
Fig. 5.18 Origem do movimento
ciliar. Está baseada no
deslocamento das cabeças das
dineínas ciliares sobre o
microtúbulo B das duplas, na
direção da raiz do cílio.
tras. Se olharmos o axonema da raiz do cílio, esses braços se orientam no sentido dos ponteiros do
relógio.
O movimento ciliar ocorre porque as cabeças das dineínas percorrem um pequeno segmento
do microtúbulo B até sua extremidade [ - ] (Fig. 5 .18) (na Seção 5-8 assinalamos que esse tipo de
proteína motora se move sempre nessa direção). Como os microtúbulos do axonema se acham
fixos em suas posições dentro do cílio (mediante as proteínas ligadoras) e suas extremidades proximais estão ancoradas no corpúsculo basal, o deslocamento das dineínas sobre o microtúbulo B
faz com que ambas as duplas se curvem, uma vez que não podem deslocar-se linearmente em direções contrárias. Como isso ocorre com as dineínas localizadas entre várias das nove duplas, a
soma das forças faz com que todo o axonema se dobre, o que gera o movimento ciliar (Fig. 5.19).
O deslocamento das dineínas ocorre como conseqüência da formação e da ruptura alternadas das
pontes transversais de dineína. Esse processo necessita de energia, que é retirada do ATP.
Durante o movimento ciliar, nem todas as duplas operam de uma vez. Além disso, suspeita-se
que as duplas situadas de um lado do axonema flexionam o cílio e as do lado oposto intervenham
no movimento de retorno.
5- 13. Na síndrome de Kartagener, os cílios são imóveis
A síndrome de Kartagener é devida a uma ou mais mutações dos genes que codificam a dineína
ciliar ou outras proteínas acessórias do axonema. Em conseqüência, os cílios e os flagelos são
imóveis, o que provoca quadros de bronquites crônicas e esterilidade na mulher e no homem (os
cílios da árvore respiratória e das tubas uterinas e o flagelo dos espermatozóides são desprovidos
de movimento).
5-1 4. A estrutura dos corpúsculos basais é idêntica à dos centríolos
Os microtúbulos ciliares nascem no corpúsculo basal, que se localiza por baixo da membrana
plasmática, na altura da raiz do cílio (Figs. 5.15 e 5.22). A quantidade de corpúsculos basais e de
cílios é a mesma.
Os corpúsculos basais são estudados junto com os centríolos do centrossomo porque são estruturalmente idênticos. Constituem cilindros ocos abertos em suas extremidades e medem 0,2 µm
de diâmetro por 0,4 µm de comprimento. A parede do corpúsculo basal ou do centríolo é formada
por 9 unidades microtubulares , cada uma composta por três microtúbulos, fundidos entre si, chamados A, B e C (Figs. 5.20, 5.21e5.22).
Fig. 5.19 Movimento ciliar.
Ocorre diante da impossibilidade
de deslizamento das duplas do
axonema entre si, por isso, se
dobram.
76
•
O CITOESQUELETO
Fig. 5.20 Esquerda. Esquema
de um centríolo ou de um
corpúsculo basal, com sua
configuração característica 9 +
O. Direita. Está ilustrada a tripla
associação característica dos
microtúbulos centriolares,
conhecida como trinca.
Proteína ligadora
e
B
A
Fig. 5.21 Esquerda. Esquema de um corte transversal do centríolo no qual se ilustram as nove trincas e as
proteínas ligadoras. Direita. Eletromicrografia de um corte transversal de um centríolo revelado mediante
ácido tânico. (De V. Kalnins.)
Fig. 5.22 Esquerda.
Eletromicrografia de um corte
longitudinal da rai z do cílio (Ci)
com seu corpúsculo basal ou
cinetossoma (CB). Direita.
Cortes transversais de cílios e
corpúsculos basais. 70.000 X .
(Cortesia de J. André e E.
Fauret-Fremiet.)
O CITOES QUELETO
O microtúbulo A é completo, pois dispõe de 13 protofilamentos; ao contrário, os microtúbulos
B e C são incompletos, já que contêm 11 protofilamentos cada um (Fig. 5.20). Como as duplas no
axonema, estas trincas estão dispostas de forma oblíqua, de maneira que o microtúbulo A se acha
mais próximo do centro do centríolo do que o microtúbulo c (Fig. 5.21 ).
As nove trincas do corpúsculo basal estão conectadas entre si por dois tipos de proteínas ligadoras. Umas são fibras curtas que enlaçam o microtúbulo A de uma trinca com o microtúbulo C
da trinca vizinha. As outras são fibras longas que se unem às trincas de forma semelhante aos raios de uma roda (Fig. 5.2 1).
Vimos que cada cílio nasce de um corpúsculo basal que, como o cílio, situa-se perpendicularmente à membrana plasmática (Fig. 5.15). Cabe lembrar que os microtúbulos A e B das duplas do
cílio continuam com os microtúbulos A e B das trincas do corpúsculo basal. O significado do
microtúbulo C das trincas e o sítio de origem dos microtúbulos centrais do axonema ainda não
foram determinados.
Às vezes, a extremidade livre do corpúsculo basal mostra uma raiz fibrilar curta que se introduz no citoplasma e que tem por função sustentar o cílio.
Os corpúsculos basais se diferenciam dos centríolos do diplossomo pelas seguintes particularidades: 1) os primeiros localizam-se próximo da superfície celular (na raiz dos cílios) e os segundos próximos do núcleo (Figs. 5.4A e 5.15); 2) os corpúsculos basais não possuem a matriz
centrossômica que envolve os centríolos (Fig. 5.23); 3) os corpúsculos basais podem ser formados por apenas uma unidade, enquanto os centríolos apresentam-se de dois a dois, ambos perpendiculares entre si (Fig. 5.23).
Matriz
centrossômica
•
77
Centríolo
Fig. 5.23 Representação
esquemática do centrossomo,
que inclui a matriz
centrossômica e o par de
centríolos ou diplossomo.
5- 15. N.a ciliogênese, os microtúbulos do _
axonema se desenvolvem a
partir do corpúsculo basal
Na ciliogênese, os microtúbulos A e B do corpúsculo basal cumprem a função da :y.::Jubulina
do centrossomo, ou seja, atuam como moldes para a nucleação (polimerização) das primeiras tubulinas dos microtúbulos A e B do axonema. As tubulinas do axonema nascente se unem às extremidades [+ ]dos microtúbulos A e B do corpúsculo basal, que apontam para a superfície da célula. Portanto, as extremidades [ - ] dos microtúbulos dos cílios se localizam junto ao corpúsculo
basal. Depois da nucleação inicial, novas tubulinas são agregadas, alongando os microtúbulos do
axonema até que o cílio alcance o seu comprimento definitivo.
5-16. Os corpúsculos basais se derivariam dos centríolos
do centrossomo
Pelo que foi dito na seção anterior, deduzimos que antes que os cílios nasçam, formam-se os
respectivos corpúsculos basais. Estes apareceriam como conseqüência de uma reprodução dicocfunica por parte dos centríolos do diplossomo , mediante um processo baseado no desenvolvimento
de procentríolos similar ao que é mostrado na Fig. 18.5 . Outra teoria sugere que os corpúsculos
basais se formariam de novo, sem a participação dos centríolos.
FI LAMENTOS DE ACTINA
5- 17. O diâmetro dos filamentos de actina é de 8 nm
Os filamentos de actina ou microfilamentos possuem um diâmetro de 8 nm e são mais flexíYeis que os microtúbulos. Podem estar associados em feixes ou redes , de modo que raramente são
Yistos isolados (Fig. 1.9).
Com base na sua distribuição na célula, os filamentos de actina classificam-se em: 1) corticais, que se localizam por baixo da membrana plasmática, onde coRstituem o componente citosólico mais importante (Fig. 5.24) , e 2) transcelulares, visto que atravessam o citoplasma em todas
as direções (Fig. 5.25A). Da mesma forma que os microtúbulos tratados com anticorpos
antitubulina, os filamentos de actina podem ser localizados com a ajuda de anticorpos antiactina
fluorescentes (Fig. 5.25B).
Fig. 5.24 Distribuição dos
filamentos de actina corticais em
uma célula epitelial.
78
•
O CITOESQUELETO
Fig. 5.25 A. Distribuição dos
filamentos de actina
transcelulares (fibras de tensão)
em uma célula conjuntiva. B.
Célula cultivada tratada com
anticorpos antiactina
fluorescentes.
Como será descrito na parte final do capítulo , os filamentos de actina também formam o esdas microvilosidades e fazem Rarte da a~ação contrátil das células musculares.
Os filamentos de actina são polímeros constituídos pela soma linear de monômeros, cujo encaixe dá aos filamentos uma configuração helicoidal característica (Figs. 5.1e5.26). Os monômeros encontram-se livres no citosol, onde formam um depósito ao qual a célula recorre quando
necessita. Cada monômero é um polipeptídeo de 375 aminoácidos que se encontra associado a
um ADP ou a um ATP; sua estrutura terciária é globular, daí receber o nome de actina G.
Igualmente aos microtúbulos, os filamentos de actina possuem uma extremidade [ + ] e uma
extremidade [ - ] (S eção 5-6); pela primeira, alongam-se e se encurtam mais rapidamente que pela
segunda (Fig. 5.26). Esta bipolaridade deve-se a que os próprios monômeros a possuem.
gu~leto
5- 18. Os filamentos de actina se formam a partir de trímeros de actinas G
Cada filamento de actina começa a se formar a partir de um núcleo de três monômeros de actina G que se combinam entre si, em qualquer ponto do citosol onde a constituição de filamentos
de actina seja necessária (Fig. 5.26). O alongamento do núcleo original ocorre como conseqüência da agregação sucessiva de novos monômeros nas extremidades [ +] e [ - ] do filamento ainda
inacabado. Para a polimerização é necessário que as actinas G contenham um ATP.
Pouco tempo depois da polimerização, este ATP se hidrolisa em ADP e P, condição que induz
os monômeros a se despolimerizar. Entretanto, isso não acontece porque nas extremidades dos
filamentos de actina ocorre um fenômeno de instabilidade dinâmica análogo ao descrito para os
microtúbulos (Seção 5-7), derivado da formação de um capuz cujos monômeros demoram um tempo
para converter seus ATP em ADP.
Já que a manutenção desta instabilidade tem um alto custo em ATP, quando o filamento alcança o comprimento desejado, várias proteínas reguladoras se colocam em suas extremidades para
estabilizá-lo.
Supõe-se que, a polimerização dos monômeros de actina depende de uma proteína reguladora
chamada rofllina, embora isso provoque a hidrólise dos ATP nos monômeros já polimerizados.
No processo de despolimerização participam várias proteínas reguladoras, entre as quais se
destacam a t!wosina e o ADF (do inglês, actin-depolymerizingfactor). A timosina inibe a nucleação do trímero inicial de actinas G e sua polimerização no filamento em crescimento. Ao contrário, o ADF une-se ao filamento de actina e o despolimeriza prog~ s ivamente .
O medicamento citocalasina B provoca a despolimerização dos filamentos de actina porque se
une aos seus dois extremos e bloqueia _o seu crescimento, com o conseqüente desaparecimento
dos capuzes de actina com ATP.
F ig. 5.26 Formação e
organização estr!-Jtural do
filamento de actina. Também
estão ilustradas a polimerização
(alongamento) e a
despolimerização
(encurtamento) do filamento por
suas duas extremidades .
Nucleação
•
••
O CITOESQUELETO
•
79
5-19. Os filamentos de actina contribuem para estabelecer
a forma celular
Mencionamos que existem feixes de filamentos de actina que se concentram sob a membrana
plasmática (corticais) (Fig. 5.24) e outros que cruzam o citoplasma de lado a lado da célula
(transcelulares) (Fig. 5.25). Ambas as localizações contribuem, em outras funções , para o estabelecimento da forma celular.
As concentrações e as funções de ambos os filamentos diferem de acordo com as células, isto
é, se epiteliais ou conjuntivas. Nas primeiras, prevalecem os filamentos corticais, que são os que
estabelecem a forma celular. as segundas, tal prevalência e função correspondem às fibras
transcelulares.
Em ambos os tipos, os filamentos corticais são também responsáveis pela morfologia da parte
periférica da célula. Além disso, na Seção 5-32, veremos que eles formam o eixo das microvilosidades.
5-20. Nas células epiteliais os filamentos de actina corticais formam uma
malha sob a membrana plasmática
Nas células epiteliais, os feixes de filamentos de actina corticais se dispõem nas mais variadas
direções e compõem uma malha contínua por baixo da membrana plasmática. Os filamentós se
unem entre si e à membrana plasmática mediante a proteína ligadora fodrina (Fig. 5.27). Por sua
vez, esta se conecta a proteínas integrais da membrana - uma das quais é nada menos que o contratrarisportador de Na+ e K+ visto no Cap. 3-19 - por intermédio de outra proteína ligadora, a
anquirina. A fodrina é semelhante à espectrina que se encontra na membrana terminal das microvilosidades (Seção 5-32) e no citoesqueleto das hemácias (Seção 5-36).
5-21 . Nos epitélios, uma franja de microfilamentos de actina corticais
participa na formação do cinturão de adesão
O cinturão de adesão, que será analisado, no Cap. 6-1 2 é uma forma de junção intercelular
presente próxima da superfície apical das células epiteliais. Trata-se de uma franja reforçada de
filamentos de actina corticais, que compõem uma espécie de anel que circunda cada célula (Fig.
6.10). Estes filamentos se conectam com proteínas da membrana plasmática chamadas caderinas,
por meio das proteínas ligadoras placoglobina, catenina, cx-actinina e vinculina. O cinturão de
adesão é composto pelos filamentos de actina, pelas caderinas e pelas proteínas ligadoras.
Cinturão de adesão
.,_ .,_ ~-:;:-:;:_ ~ _l-.;: .,_·~ ~ .,_-.;:-~ 4
~-
~
-'!·
5-22. Em alguns epitélios embrionários, o cinturão de adesão
tem funções morfogenéticas
Nas células de alguns epitélios embrionários, os filamentos de actina do cinturão de adesão se
encurtam, motivo pelo qual, a esta altura, as células reduzem o seu diâmetro. Conseqüentemente,
as células perdem sua forma éilíndrica e adquirem um aspecto piramidal, o que gera uni sulco e,
em seguida, um tubo separado do epitélio de origem (Fig. 5.28).
:',-__j(
..
Fig. 5.27 Esquema dos filamentos de actina corticais nas células epiteliais , e de proteínas Jigadoras que os
sujeitam à membrana plasmática.
Tubo
Fig. 5.28 Filamentos de actina
do cinturão de adesão (ver Fig.
6.10). Graças a esses filamentos,
durante o desenvolvimento
embrionário alguns epitélios
pavimentosos originam
estruturas tubulares (por
exemplo, o tubo neural
primitivo).
80
•
O CITOESQUELETO
5-23. Nas células epiteliais, os filamentos de actina transcelulares
transportam organelas
Como em todas as células, nas epiteliais, os filamentos de actina transcelulares se acham estendidos entre pontos opostos da membrana plasmática e entre esta e o envoltório nuclear, de modo
que atravessam o citoplasma em várias direções (Fig. 5.25). Entretanto, próximo ao envoltório
nuclear, existe uma rede de filamentos de actina que descansa sobre a malha perinuclear de filamentos intermediários (Seção 5-2); a essa rede ligam-se os filamentos de actina que partem do
envoltório. Ao contrário, ao nível da membrana plasmática, os filamentos transcelulares se conectam com os filamentos de actina corticais ou se unem a proteínas de membrana especiais.
Os filamen_tos de actina transcelulares atuam como vias para transportar organelas pelo citoplasma. Este trans orte é mediado elas proteínas motoras mio sina I e mio sina V.
A miosina 1 tem uma cabeça e uma caud;,p;;is uma de suas extrem1 ades é globular e a outra,
fibrosa (Fig. 5.29). Quando esta proteína motora funciona , sua cauda se liga à membrana da organela que vai ser transladada - em geral, uma vesícula do sistema de endomembranas (Cap. 7-1)
- e sua cabeça se une intermitentemente a um filamento de actina vizinho, este último porque a
cabeça da miosina I muda de posição repetidamente. As junções e disjunções alternadas fazem
com que a miosina I deslize na direção da extremidade [+]do filamento de actina (Fig. 5.30).
As mudanças de posição da cabeça - responsáveis por esse deslizamento - consomem A TP,
que é hidrolisado a ADP e P por uma ATPase dependente de Ca2+ situada na própria cabeça. A
miosina I desloca-se, aproximadamente, 10 nm por cada ATP que consome.
A miosina V "caminha" sobre o filamento de actina e cada "passo" que dá avança cerca de 37
nm. Sua composição é analisada na Seção 5-28.
Miosina 1
Fig. 5.29 Representação esquemática da miosina I e da miosina II.
MiOsina 1
Miosina 1
Miosina li
Fig. 5.30 Esquemas que ilustram
o deslocamento das miosinas I,
II e V sobre os filamentos de
actina.
Miosina V
O CITOESQUELETO
5-24. Nas células conjuntivas, os filamentos de actina transcelulares são
chamados fibras de tensão
Nas células con 'untivas a distribuicão dos filamentos de actina transcelulares -denominadas
de te~ão - é semelhante à indicada na seção anterior, embora componham feixes mais
espessos e mais numerosos . Em cada fei xe, a proteína ligadora cx-actinina une os filamentos de
actina entre si.
Ademais, cada filamento se liga à membrana plasmática mediante uma estrutura conhecida com
o nome de contato focal (Fig. 5.31 ). A ~remid ade do filamento se conecta com uma proteína
transmembrana heterodimérica chamada integrina , por meio das proteínas ligadoras talina, cxactinina, paxilina e vinculina . O conjunto , composto pela extremidade do filamentó de actina,
as proteínas ligadoras e a integrina, constitui o contato focal. No Cap. 6-6 veremos que, por seu
domínio externo, a integrina se liga a uma proteína da matriz extracelular chamada fibronectina ,
~ est a_.a..11ma fibra de colágeno.
Entre os filamento s de actina das fibras de tensão encontram-se numerosas unidades da proteína motora miosina II, composta de dois polipeptídeos pesados , cada um combinado com dois
polipeptídeos leves (Fig. 5.29). Os seis polipeptídeos geram uma molécula fibrosa com duas cabeças em uma de suas pontas, já que nelas os polipeptídeos pesados têm uma estrutura globular.
Como na miosina I, as cabeças da miosina II possuem atividade de ATPase e são responsáveis
pelas propriedades mecânicas da molécula.
As miosinas II não funcionam isoladas. Para poder atuar associam-se e formam conj untos bipolares com as caudas das moléculas fundidas entre si e as cabeças dirigidas para outra extremidade 1_o conjunto (Fig. 5.30). As cabeças estabelecem junções intermitentes com filamentos de
actina adjacentes. Vi ~to_que deslizam sobre eles em sentidos opostos - para as respectivas extremjda®s [ +] - os tensionam e geram forças mecânicas nos contatos focais, o que, além de produzir deformações leves, porém contínuas, da superfície celular, contribui para o estabelecimento
da forma global da célula. É por estas propriedades que nas células conjuntiv as os filamentos de
actina transcelulares levam o nome de fibras de tensão. O mecanismo molecular que toma possível o deslizamento das miosinas II sobre os filamentos de actina será analisado na Seção 5-33 ,
que se refere à contratilidade muscular.
Devemos lembrar que as fibras de tensão e os contatos focais se form~_m mediante a indução
, a roteína Rh~ (da letra grega p), que é membro da família das GTPases que atuam associadas às
proteínas reguladoras GEF e GAP, de cuja análise nos ocuparemos no Cap. 7-38.
Da mesma forma que nas células epiteliais, as fibras de tensão servem como vias para transportar organelas pelo citoplasma, com intervenção da miosina I e da miosina V (Seções 5-23 e
5-28).
f~ras
Colágeno
- - - - Paxi lina
- - - - Vinculina
~--u-Actinina
CITOSOL
Fig. 5.31 Contato focal e sua conexão com elementos da matriz extracelular mediante a proteína
transmembrana integrina.
•
1
82
•
O CITOESQUELETO
5-25. Nas células conjuntivas, os filamentos de actina corticais sofrem
repetidas modificações
Nas células conjuntivas, os filamentos de actina corticais se distribuem de maneira característica e, além disso, mutante. Esta última origina modificações cíclicas na consistência da zona
periférica das células, o que, juntamente com as tensões nos contatos focais, produz os movimentos incessantes que são observados na superfície celular.
Assim , os filamentos de actina formam uma espécie de andaime que aumenta a viscosidade do
citosol e que diminui quando o andaime se desmonta por causa da despolimerização dos filamentos de actina (Fig. 5.32). Assim, na zona periférica das células conjuntivas se alternam estados de
maior viscosidade (gel) com outros de menor viscosidade (sol), o que provoca mudanças contínuas na forma da superfície celular.
a montagem do andaime intervém - além da profilina (Seção 5-18) - uma proteína ligadora chamada filamina ou ABP (do inglês, actin-binding protein), que une os filamentos de actina
entre si (Fig. 5.32). O andaime se desmonta sob ação da gelsolina - antes que o façam as proteínas despolimerizantes timosina e ADF. A gelsolina é uma proteína dependente de Ca2 + que
fragmenta os filamentos de actina (Fig. 5.32).
5-26. Os filamentos de actina desempenham importantes funções
durante a motilidade celular
A migração celular é um fenômeno muito comum durante o desenvolvimento embrionário,
decisivo não somente para a formação dos tecidos e dos órgãos, mas também para o ordenamento
e orientação espacial da maioria das estruturas corporais. No organismo desenvolvido, a migração celular cumpre importantíssimas funções vinculadas com sua defesa e com o reparo tecidual.
Ao contrário das células musculares, nas quais os filamento s de actina não se encurtam nem se
alongam , nas células locomotoras, o citoesqueleto apresenta um grande dinamismo, já que a motilidade celular é contínua em seus componentes, que incluem polimerizações e despolimerizações
por parte dos filamentos de actina.
A entrada em movimento das células epiteliais é algo mais complicado do que a das células
conjuntivas, pois para adquirir motilidade, as primeiras devem se tomar independentes do epitélio original e redistribuir seus filamentos de actina corticais e transcelular~ como
nas células conjuntivas.
Antes de se pôr em marcha, a célula mi ratória adquire ~aspec to poligonal. Em seguida,
co~giien~ápid~e extensas modificações nos filamentos de actina corticais formam-se, na
extremi <.:!_a~da céLula_c_orr_espondente ao futuro movimento, várias lâminas citopfasmátiCas horiz ntais chamadas lamelip_ócUos, de cujas borclas livres nascem m:o ! Qngfl~Os digitiformes denominados filõp6llt<Js-(Figs. 5.33 e 23.6). Tanto os lamelipódios como os filopódios alternam
periõaõSde-atongamento com períodos de encurtamento, que, como veremos , são essenciais para
a motilidade celular.
A formação dos lamelipódios é induzida pela 11roteína Rac, (do inglês , related to the A and C
kinases), que como a Rho (Seção 5-24) é membro de uma família de GTPases que são reguladas
pelas proteínas GEF e GAP (Cap. 7-38).
Os lamelipódios surgem e se alongam por obra da proteína reguladora Arp2/3 (do inglês, actin-related protein) , que induz a formação de armações especiais de actina no córtex celular. Como
i
Fig. 5.32 Intervenção das
proteínas filamina e gelsolina na
montagem e desmontagem,
respectivamente, dos andaimes
de actina .no córtex das células
conjuntivas.
-
~
i
Ca2+
Gelsolina
8::3
,...
~~
O CITOESQUELETO
•
83
Fig. 5.33 Representação de uma
célula em movimento.
Fi lopódio
' - - - - Lamelipódio
mostra a Fig. 5 .34, a groteína Am2 3 a com gue os filame to d act' na se ramifi uem e - em
colaboração com a profilina (Seção 5-18) - que novas actinas G se agreguem nas extremidades
dos filamentos , tanto nos preexistentes como em seus ramos. A Fig. 5.34, mostra também que
as armações são planas e-que cada ramo de actina compõe com o filamento de origem um ângulo
de 70º .
O encurtamento dos lamelipódios é devido ao desmonte dessas armações, causado pelas proteínas reguladoras timosina, ADF e gelsolina (Seções 5-1 8 e 5-25).
Além de alongar-se e de encurtar-se os lamelipódios se movem perm<:_nentemente, o que é
possível porque em suas raízes há moléculas de miosina II diméricas que fazem deslizar os filamentos de actina em direções opostas (Fig. 5.30).
A formação dos filopódios é induzida pela proteína Cdc42 (do inglês, cell-division cycle) , que
igualmente às proteínas Rho e Rac pertence a uma família de GTPases reguladas pelas proteínas
GEF e GAP (Cap. 7-38).
Devemos acrescentar que durante a migração celular as proteínas Rho, Rac e Cdc42 funcionam coordenadamente. Assim procedem depois de receber "ordens" de receptores localizados na
membrana plasmática, que' se ativam quando são induzidos por moléculas extracelulares implicadas na estimulação da motilidade. Podemos dizer, então, que as proteínas Rho , Rac e Cdc42 funcionam como elos entre os sinais extracelulares e os componentes do citoesqueleto envolvidos na
migração.
o~~ amentos e en~entos dos filopódios são explicados pela presença em seus eixos
e feixes de filam~o ~ de actina que alternam ciclos de polimerização com ciclos de despolimeri-
Fig. 5.34 Dinâmica dos
filamentos de actina nos
lamelipódios e nos filopódios .
Os pontos de ramificação e de
polimerização foram marcados
com círculos verdes e círculos
azuis, respectivamente. Em
ambos intervém a proteína
reguladora Arp2/3 que, ao nível
dos pontos de ramificação, faz
com que se formem ângulos de
70° entre os filamentos e seus
ramos.
84
•
O CITOESQUELETO
zação (Fig. 5.34). Os filamentos partem da borda livre dos lamelipódios e terminam na membrana
plasmática da ponta dos filopódios, na qual se ancoram mediante contatos focais. Além disso, unemse, entre si, por meio de uma proteína ligadora chamada fimbrina , e o_s mais periféricos se conectam com a membrana plasmática do filopódio por intermédio da miosina 1. Esta proteína motora
se une aos filamentos e à membrana através de sua cabeça e de sua cauda, respectivamente (Fig.
5.30). A miosina·I moveria o filop ódio ou cumpriria uma função reguladora durante o alongamento ou o encurtamento dos filamentos de actina . .
5-27. Os deslocamentos celulares são guiados por haptotaxia e quimiotaxia
A migração celular é conseqüência dos seguintes fenômenos. Em primeiro lugar, os filopódios
se alongam; em seguida, através de suas pontas - repletas de contatos focais - algumas se ancoram em fibras colágenas da matriz extracelular mediante moléculas de fibronectina (Caps. 6-4
e 6-5). Depois, enquanto os filopódios ancorados se encurtam - o que traciona a célula para os
pontos de ancoragem - outros filopódios se alongam e ancoram nas fibras colágenas situadas
mais adiante na matriz extracelular. Finalmente, os primeiros filopódios se desprendem das fibras
colágenas e os segundos se encurtam, de modo que a célula avança um pouco mais . A migração
celular resulta da reiteração destes episódios. Como se vê, a ancoragem dos filopódios nos elementos fixos da matriz extracelular - ou seja, nas fibras colágenas - é transitória, suficiente
para que a célula possa ser tracionada. Se a ancoragem persistisse, o avanço celular se deteria.
Longe de vagar sem rumo, as células se deslocam para seus pontos de destino seguindo itin~- ,
rários predeterminados, e não se detêm antes de alcançá-los e não avançam mais além. Os roteiros
são marcados por alguns componentes da matriz extracelular limítrofes da célula em movimento,
como, por exemplo, a concentração e a orientação das fibronectinas que se acham nos lugares de
passagem. Estas moléculas teriam funções relevantes durante a migração celular, pois fixariam os
itinerários ao se orientar adequadamente ou se concentrar em proporções crescentes ao longo das
rotas. A locomoção celular guiada por gradientes de concentração de moléculas não-solúveis no
meio extracelular - como ocorre com a fibronectina - é denominada haptotaxia (do grego,
háptein, enganchar, e taxis, colocação).
Os sinais posicionais sutis emanados das fibronectinas são avaliados pelas células em movimento , para onde seus filopódios se estendem e se retraem (crescem e encurtam) como se os estivessem "cheirando". Quando os filopódios "percebem" os sinais corretos, fixam-se ao colágeno;
caso contrário, continuam "explorando" o meio extracelular até encontrar-se com eles.
Os deslocamentos das células também são dirigidos por substâncias solúveis emitidas por outras células - às vezes distantes - que podem provocar sua atração ou repulsão . Se houver atração, o fenômeno leva o nome de quimiotaxia, que define a condução das células migratórias para
um lugar de maior concentração da substância solúvel. Ficou comprovado que as substâncias quimiotáticas estimulam - na membrana plasmática das células em movimento - receptores que
põem em marcha sinais intracelulares que ativam a proteína Arp2/3 . O fenômeno oposto à quimiotaxia, ou seja, a quimiorrepulsão , depende de uma proteína denominada semaforina.
Os mecanismos pelos quais as células migratórias reconhecem outras células em seus lugares
de destino e se estabelecem neles são analisados nos Caps. 6-8 e 6-9.
5-28. O avanço dos axônios apresenta algumas semelhanças com a
motilidade celular
Como sabemos, os neurônios se acham conectados entre si e com as células musculares e secretórias por meio de prolongamentos citoplasmáticos chamados axônios. As células assim conectadas podem estar separadas por distâncias consideráveis, e a maioria das conexões é estabelecida durante o desenvolvimento embrionário.
Qualquer que seja a distância que as separe, geralmente o neurônio não necessita migrar para
entrar em contato com a outra célula; somente cresce seu axônio, motivo pelo qual seu corpo per-- manece no sítio inicial. Para poder se alongar e avançar, o axônio desenvolve em sua extremidade
distal (que é a área que entra em contato com a outra célula) uma especialidade chamada cone de
crescimento, análoga à região frontal das células migratórias, porém com filopódios bastante mais
O CITOESQUELETO
Microtúbulos
1
IIl-Vm 53'
85
•
Fig. 5.35 Desenho que ilustra a
extremidade do axônio com seu
cone de crescimento.
F<g
Axônio
longos (Fig. 5.35). As raízes destes contêm miosina V, que, como vimos na Seção 5-23, é uma
proteína motora que no citoplasma transporta organelas. A miosina V é dupla como a miosina II,
porém possui doze polipeptídeos leves em lugar de quatro e não forma conjuntos bipolares (Fig.
5.30). A semelhança do cone de crescimento com a célula migratória alcança os fatores que regem o seu avanço pela matriz extracelular.
Na Seção 5-9, analisamos a função que desempenham os microtúbulos durante o alongamento
do axônio e a participação da proteína motora dinamina.na migração do cone de crescimento.
5-29. Durante a histog ênese do sistema nervoso central, alguns neurônios
migram conduzidos pelas células gliais radiais
Durante a histogênese do SNC, alguns neurônios do tubo neural primitivo devem migrar das
cercanias da luz do tubo até lugares próximos a sua superfície externa. Tais migrações ocorrem,
por exe..mplo, quando são formado s o córtex cerebral e o córtex cerebelar. .
Os mecanismos que tomam possível o traslado destes neurônios diferem dos descritos até aqui.
Como mostra a Fig. 5.36, intervêm elementos da neuroglia - as chamadas células gliais radiais
- que transitoriamente formam suportes filamentosos sobre os quais os neurônios "se arrastam"
até seu ponto de destino. Estes suportes são finos prolongamentos citoplasmáticos emitidos pelas
células gliais radiais, que como raios percorrem a parede do tubo neural primitivo da sua luz central até a sua superfície externa.
Não se conhece ainda o mecanismo migratório, embora tenha sido descoberta uma proteína
que permite o estabelecimento de junções inte1mitentes entre a membrana plasmática do neurônio
e a membrana plasmática da célula glial radial, imprescindíveis para o "arrastamento". A proteína
se chama astrotactina em virtude de as células radiais se converterem em astrócitos quando a
migração termina.
5-30. Nos cultivos de tecidos ocorre a chamada inibição por contato
À medida que vão ocupando os lugares vazios, as células que se reproduzem nas culturas de
tecidos migram e estabelecem contatos com suas vizinhas. No entanto, quando a célula fica rodeada por outra, deixa de se dividir e perde sua motilidade. Este fenômeno - denominado inibição
por contato - ocorre em todas as células de cultura, motivo pelo qual terminam formando uma
monocamada celular característica. Devemos assinalar que as células cancerosas cultivadas não
experimentam este tipo de inibição e, tendo em vista que continuam se dividindo e se movendo,
empilham-se umas sobre as outras até formar massas irregulares de várias camadas de profundidade (Fig. 5.37).
A
B
Superfície externa
do tubo neural
'
~
V\
\
\
\
\
\
t
\
\
\
'
t t
\
Neurônio
\
1t
\
\ t
t
t
t
t
,l:ttr
t
/
/
1
/
/
t
t
t
-11
.J•
Luz do tubo
neural
Fig. 5.36 Traslado de
determinados neurônios através
da parede do tubo neural
primitivo, guiados por células
gliais radiais.
Fig. 5.37 A. Crescimento normal
sobre um substrato sólido nas
células em cultivo. Quando estas
células entram em contato com
suas vizinhas perdem sua
motilidade, deixam de se
multiplicar e formam uma
monocamada característica. B.
Em circunstâncias similares, as
células cancerosas não se tornam
imóveis nem dei xam de se
multiplicar e, por isso, formam
multicamadas.
86
•
O CITOESQUELETO
-----
5-31 . Os filamentos de actina intervêm na citocinese
A citocinese ocorre no final da mitose, quando se forma um ~omposto por filade actina e miosinas II sob a membrana plasmática na zona equatorial da célula em divisão (Cap. 18-20) (Fig. 18.7). Da mesma forma que nas fibras de tensão, as miosinas II são diméricas e se acham entre os filamentos de actma do anel. - ç:·
cada mio ina II
de ·
e dois filamentos de actina em sentidos contrários. A soma destes deslizamentos faz
aparecer um sulco na superfície celular que, ao se aprofundar, gera um estrangulamento que culmina na partição da célula (Fig. 18.8).
Devemos assinalar que a redução progressiva do diâmetro do anel contrátil não é acompanhada por um aumento de sua espessura, o que indicaria que os filamentos de actina se despolimerizam
à medida que a célula se estrangula.
m~nto s
5-32. Nas microvilosidades existem filamentos de actina estáveis
-------
As microvilosidades são projeções citoplasmáticas nascidas na superfície celular,' rodeadas
por membrana plasmática (Figs. 1.7 e 5.38). São encontradas em muitos tipos celulares, porém
especialmente desenvolvidas em alguns epitélios. Como incrementam a superfície da membrana
plasmática, permitem uma maior absorção de água e de solutos por parte da célula.
O diâmetro das microvilosidades é de 0,08 µ,m e seu comprimento médio é de 1 µ,m. ~xo
ólico de cada microvilosidade é constituído or uma matrg_q_ue_contén:L2.Q-ª.l..Q filamentos
de actina paralelos, cujas extremidades [ - ] e [ + ] se acham na raiz e na ponta da microvilosidade,
respectivamente. Em virtude de não se alongarem e nem se encurtarem, diz-se que estes filamentos de actina são estáveis.
A ponta da microvilosidade é ocupada por um fluido citosólico amorfo no qual se acham imersas as extremidades [ + ] dos filamentos de actina. Ao contrário, na raiz da microvilosidade as
extremidades [ - ] se conectam com os filamentos de actina corticais, que aqui descansam sobre
uma delgada rede de filamentos intermediários (Fig. 5.38). Além disso, os filamentos de actina
corticais estão conectados entre si e com a membrana plasmática mediante moléculas de espectrina, equivalentes às fodrinas descritas na Seção 5-20.
Os filamentos de actina e os filamentos intermediários compõem uma reqe por baixo da membrana plasmática que leva o nome de membrana terminal, da qual nascem os filamentos de actina que ingressam nas microvilosidades (Fig. 5.38). É necessário acrescentar que nas células
epiteliais o perímetro da membrana terminal continua-se com os filamentos de actina do cinturão
de adesão (Seção 5-21 e Cap. 6-12) (Fig. 6.8 ).
.,.
'
---.--
- Substância
amorfa
,,..__,.____ Filamento
de actina
Fig. 5.38 Representação
esquemática de uma
microvilosidade. No córtex da
célula estão assinalados com
uma chave os componentes da
membrana terminal (ver Fig.
6.8).
•
1
amentos intermedjános
Espectrina
=
~}
O CITOESQUELETO
•
87
Voltando ao eixo da microvilosidade, seus filamentos de actina se unem entre si por meio das
próteínas ligadoras, a vilina e a fimbrina (Fig. 5.38) . Além disso, os filamentos de actina mais
periféricos se conectam com proteínas integrais da membrana plasmática por intermédio de moléculas de miosina 1. Não se sabe ainda por que esta proteína motora se localiza em uma estrutura
celular imóvel.
5-33. Na contratilidade das células musculares estriadas intervêm
filamentos de actina e várias proteínas acessórias
O músculo estriado é constituído por células (ou fibras) cilíndricas de 10 a 100 µ,m de diâmetro e vários milímetros ou centímetros de comprimento . Os componentes do citoesqueleto comprometidos na atividade mecânica destas células formam estruturas regulares e estáveis, adaptadas para encurtar-se durante a contração e alongar-se nos períodos de repouso.
O músculo constitui um dos exemplos mais claros de associação morfofuncional e de como,
em uma célula, a energia química pode ser traduzida no trabalho mecânico. O desenho das células
musculares estriadas é tão eficiente que elas são capazes de contrair-se e de relaxar-se cem ou
mais vezes por segundo e de produzir um trabalho mil vezes superior ao seu próprio peso.
A maquinaria contrátil das células musculares é representada por estruturas regulares derivadas do citoesqueleto, as miofibrilas (Fig. 5.39). Estas são tão longas quanto as próprias células e
se dispõem paralelamente uma ao lado da outra. A espessura de cada miofibrila é de 1 a 2 µ,m. Seu
comprimento e seu número dependem do comprimento e do diâmetro da célula muscular, respectivamente.
A miofibrila é composta por uma sucessão linear de unidades contráteis denominadas sarcômeros (Figs. 5.40 e 5.41), de 2,2 µm de comprimento e largura equivalente à da miofibrila, de 1
a 2 µ,m. Ao microscópio eletrônico observa-se que entre os sarcômeros existe uma estrutura ele-
Retículo sarcoplasmático
Membrana
plasmática
A
~r
.,,.......
-~t't"•t•'•ª~H
z
ili
•·
;....
Fig. 5.39 Fibras do músculo
estriado onde se ilustram as
miofibrilas com seus sarcômeros
(observar as bandas A e I e os
discos Z), o retículo
sarcoplasmático e a membrana
plasmática. Os túbulos T são
invaginações da membrana
plasmática, que se vinculam ao
retículo sarcoplasmático,
organizadas para conduzir
impulsos da superfície da célula
ao interior desta, a fim de que
todas as miofibrilas se contraiam
sincronicamente.
... .
............y .....,..
i!I
AA~
'li
...., .................
L__ ~__J
'•' t,,'N
z
<f-~~~~1----1~~~~~A~~~~--1~-t-~~~~~
Fig. 5.40 Acima. Representação
de um córtex longitudinal do
sarcômero. Abaixo. Cortes
transversais nas diferentes
regiões do sarcômero. Observar
que as bandas I têm somente
filamentos de actina, as bandas
H somente miosina II, e as
bandas A filamentos de actina e
miosina II.
88
•
O CITOESQUELETO
Fig. 5.41 Eletromicrografia de
quatro miofibril as nas quais se
observam os sarcômeros, com os
discos Z e as bandas H, A e I.
Vê-se também o retículo
sarcoplasmático (RS) entre as
miofibrilas. 60.000X . (Cortesia
de H. Huxley.)
trodensa, o disco Z (linha Z), localizada em meio a uma região pouco densa, a banda I (de isotrópica) (Fig. 5.41). Ao longo das miofibrilas , as bandas 1 se alternam com outras mais densas, as
bandas A (de anisotrópica) , e na parte média destas, se distingue uma zona de menor densidade
- a banda H (faixa H) - dividida por sua vez pela linha M, mais densa que a faixa H.
As diferentes bandas resultam da variação periódica na superposição das proteínas
citoesqueléticas ao longo das miofibrilas. Como em todas as miofibrilas cada banda se encontra
na mesma altura, elas geram, em conjunto, uma alternância de zonas de diferente densidade, que
é o que confere a designação de estriado a este tipo de músculo.
A Fig. 5.40 mostra a estrutura básica de um sarcômero, no qual se observam os filamentos de
actina originando-se dos discos Z e as fibras grossas bipolares - de miosina II - entre esses
filamentos. A extremidade dos filamentos de actina que se une ao disco Z é a [ + ]. Os cortes transversais comprovam que a banda I contém unicamente filamentos de actina, a banda H somente
fibras de miosina II, e a banda A ambos os componentes. Na banda A cada fibra grossa de miosina
aparece rodeada por seis filamentos de actina, e cada um destes por três fibras de miosina; por
conseguinte, o número de filamentos de actina é o dobro do das fibras de miosina. Por outro lado,
os cortes transversais ao nível da linha M revelam a existência de pontes protéicas entre as fibras
de miosina.
É necessário descrever como se associam os monômeros de miosina II para formar as fibras
grossas interpostas entre os filamentos de actina. Cada uma destas fibras está integrada por numerosas moléculas de miosina II, cuja combinação dá lugar a uma estrutura bipolar com forma de
bastão (Fig. 5.42). Esta exibe uma zona "lisa" - correspondente à banda H do músculo contraído
- em meio a duas regiões "rugosas" porque aparecem assim pela presença das cabeças das miosinas
II, as quais se projetam da fibra como se fossem braços. Na Fig. 5.42 podemos observar que as
Fig. 5.42 Estrutura bipolar em
forma de vara, integrada por
numerosas moléc ulas de miosina
II. Também estão ilustradas as
cabeças das miosinas surgindo
do eixo da vara a intervalos
regulares .
O CITOESQUELETO
cabeças das miosinas II estão orientadas opostamente nas duas regiões rugosas, o que dá à fibra
grossa sua condição bipolar.
As cabeças das miosinas II surgem do eixo fibroso a intervalos regulares de 7 nm e com uma
diferença angular entre elas de 60º, motivo pelo qual em conjunto descrevem, ao longo deste eixo,
uma trajetória helicoidal (Fig. 5.42). Esta é a razão pela qual cada fibra de miosina II interage com
seis filamentos de actina simultaneamente (Fig. 5.40).
As mudanças que ocorrem no sarcômero durante a contração da célula muscular podem ser
observadas com os microscópios de fase e de interferência (Caps. 23-7 e 23-8). A banda A não se
modifica, porém as hemibandas I se encurtam de forma proporcional ao grau de contração. O
encurtamento das hemibandas I se deve ao fato de os discos Z se aproximarem mutuamente. Ao
fazê-lo, empurram os filamentos de actina para o centro do sarcômero, de maneira que as áreas de
superposição dos filamentos de actina com as fibras de miosina II se ampliam (Fig. 5.43). Se a
contração se acentuar, as extremidades livres dos filamentos de actina podem chegar até a linha M
(Fig. 5.43). Todos esses fenômenos se revertem durante o relaxamento.
Os deslocamentos observados durante a contração devem-se ao fato de as cabeças das fibras
de miosina deslizarem ativamente sobre os filamentos de actina. Para isso, cada cabeça se flexiona em relação ao talo fibroso, como se entre ela e o talo houvesse uma dobradiça (Fig. 5.44).
No músculo em repouso, as cabeças das miosinas II estão separadas dos filamentos de actina.
Diante da chegada de estímulo apropriado ocorre a contração muscular como conseqüência dos
llllllllUllll
11111111111111
Contração
11111111111111
~111111111111
m1111111111•
111 11111111111
:::::::::~
"""'"""' Gi
Contração máxima
•
89
Fig. 5.43 Esquerda. Esquemas
que mostram, em um conjunto
de seis sarcômeros, o mecanismo
de relaxamento-contração do
músculo estriado. Durante o
relaxamento as bandas H se
ampliam. Durante a contração os
filamentos de actina deslizam
para as linhas M e a largura das
bandas H se redu z. Com a
contração máxima as
extremidades livres dos
filamentos de actina podem
chegar até as linhas M. Direita.
Esquemas tridimensionais de um
sarcômero do músculo estriado
em estados de relaxamento,
contração e contração máxima ..
Fig. 5.44 Interpretação
esquemática do deslizamento das
cabeças das miosinas II sobre o
filamento de actina. A. Durante
o relaxamento muscular as
cabeças não estão unidas ao
filamento. B. No começo da
contração as cabeças entram em
contato com o filamento. e.
Uma alteração na forma das
cabeças faz com que o filamento
de actina corra para o centro do
sarcômero. D. No final deste
movimento, as cabeças se
desprendem, se endereçam e
novamente entram em contato
com o filamento de actina, agora
com monômeros mais próximos
do disco Z.
90
•
O CITOESQUELETO
seguintes fenômenos moleculares (Fig. 5.44): 1) cada cabeça de miosina adere a um filamento de
actina; 2) ao se flexionar avança um pequeno segmento para a extremidade [+]deste filamento , o
qual se desloca - arrastando o disco Z de seu lado - para o centro do sarcômero; 3) em seguida,
a cabeça da miosina se desconecta do filamento de actina e recupera sua posição de repouso; 4)
em seguida, se une ao mesmo filamento de actina, porém em um ponto mais próximo do disco Z;
5) como volta a se flexionar, o filamento de actina corre um pouco mais para a parte central do
sarcômero, depois do que volta a se separar. Graças à bipolaridade da fibra de miosina e ao fato de
os episódios anteriormente mencionados se repetirem várias vezes, os filamentos de actina de ambas
as metades do sarcômero se aproximam mutuamente e, por isso, o sarcômero encurta seu comprimento (Fig . 5.43). A contração da célula muscular resulta da soma dos encurtamentos de todos os
seus sarcômeros.
A energia necessária para a atividade mecânica das cabeças da miosina II é proporcionada pelo
ATP que é hidrolisado por uma ATPase presente nessas cabeças. Calcula-se que a energia fornecida por um A TP seja suficiente para deslocar os fil amentos de actina entre 5 e 10 nm.
A fl exão das cabeças de miosina II é desencadeada pelo Ca2 + , cuja concentração aumenta no
citosol quando a célula muscular é induzida a se contrair (Cap. 7-26). Essa flexão é controlada
pelas proteínas reguladoras tropomiosina, troponina 1, troponina C e troponina T, que se encontram junto aos filamentos de actina (Fig. 5.45). As três troponinas formam um complexo que
se mantém unido graças à troponina T.
No músculo em repouso, a tropomiosina se encontra sobre os filamentos de actina em uma
posição tal que impede a união das cabeças de miosina II com esses fil amentos (Fig. 5.46). Esta
posição é controlada pela troponina 1, assim chamada porque inibe o deslocamento da tropomiosina.
O aumento da Ca2+ no citosol faz com que o íon se una à troponina C (esta é semelhante à
proteína calmodulina, que analisaremos no Cap. 11-18). O complexo Ca2 + -troponina C bloqueia
a ação da troponina 1, o que permite à tropomiosina mudar de posição com relação aos filamentos
de actina e, assim, as cabeças da miosina II podem se unir a eles. A Fig. 5.46 mostra essa reação;
observa-se a molécula de tropomiosina em suas duas posições, correspondentes aos estados de
relaxamento e de contração do músculo.
Nos discos Z, se encontra a proteína ligadora a-actinina. Nela se ancoram não somente os filamentos de actina, mas também os de titina, uma proteína ligadora que se estende até o centro do
sarcômero, ou seja, até a linha M (Fig. 5.47). A titina desempenha duas funções: mantém a fibra
de miosina II em sua posição e, por ter um segmento que se comporta como uma mola, restabelece o comprimento de repouso da célula durante o relaxamento muscular. A titina é a maior proteína detectada no organismo humano; pesa nada menos que 3.000 kDa e é composta por uma cadeia linear de quase 27.000 aminoácidos.
o
Actina
Fig. 5.45 Esquema que mostra a
estrutura molecular do filamento
de actina do sarcômero, junto a
algumas proteínas reguladoras
da contração muscular.
Fig. 5.46 Deslocamento da
tropomiosina antes da união da
cabeça da miosina II com o
filamento de actina (ver Fig.
5.44B).
T
Tropomiosi na
Fi lamento de actina
o
Qo
C
••
Troponinas
O CITOESQUELETO
-
A - - - - --+-- - 1 -
1
~--
z
Actina
H
--~
Miosina li
Titina
M
1
1
'
1
li
z,,
1
I
J
\.
111
I
li
,
I•
Comprimento da
molécula de nebulina
Ili
"I
\..
7
"'
Comprimento da
molécula de titina
Cada filamento de actina se acha associado a outra proteína gigante chamada nebulina, que
tem por função determinar o comprimento do filamento durante a rniogênese e conferir-lhe rigidez (Fig. 5.47).
As miofibrilas se acham unidas por seus lados mediante filamentos intermediários de desmina
(Seção 5-3). Graças a eles, evita-se a perda do alinhamento dos sarcômeros no interior das células
musculares diante de fortes tensões mecânicas a que estão submetidas .
Finalmente, por baixo da membrana plasmática, a célula muscular possui a proteína ligadora
distrofina, que é semelhante à espectrina (Seção 5-32) e conecta os filamentos de actina, localizados na periferia da célula com um complexo de proteínas membranosas chamadas distroglicanas
e sarcoglicanas. Por sua vez, este complexo se une à laminina da lâmina basal que rodeia a célu la
(Cap. 6-1). Diversas anomalias na distrofina ou em alguma das proteínas associadas - como
conseqüência de alterações genéticas - dão lugar a enfermidades conhecidas como distrofias
musculares, que se caracterizam pela degeneração progressiva dos músculos, o que pode fazer
claudicar as funções cardíaca e pulmonar e levar à morte.
5- 34. Na contratilidade das células musculares cardíacas participam
estruturas similares às do músculo estriado
Uma das diferenças mais notáveis entre as células musculares esqueléticas e as células musculares cardíacas é a presença nestas dos discos intercalares, encarregados de unir as células cardíacas por suas extremidades. Estes discos se comportam como se fossem discos Z, pois deles surgem os filamentos de actina e de titina.
Os discos intercalares contêm desmossomas (Cap. 6-13) ; estes se associam aos filamentos
intermediários de desmina, que se derivam daqueles que unem as miofibrilas entre si, mencionados na seção anterior. Além disso , possuem junções comunicantes (Cap. 6-14), necessárias para
sincronizar as contrações das células miocárdicas .
5-35. Nas células musculares lisas, o aparelho contrátil
relativamente simples
e
O aparelho contrátil das células musculares lisas se assemelha ao conjunto de fibras de tensão
transcelulares presentes nas células conjuntivas (Seção 5-24), com a diferença de que nas musculares os feixes de filamentos de actina são muito mais grossos e mais numerosos . Além disso, as
partes intermediárias dos filamentos de actina são substituídas por filamentos intermediários de
desmina (Fig. 5.48), cuja presença impede que seja comprimida a zona central da célula, onde se
encontra o núcleo e se refugiam os componentes citoplasmáticos mais delicados para se proteger
da contração.
5-36. O citoesqueleto da hemácia (eritrócito) possui
características singulares
A composição do citoesqueleto da hemácia apresenta diferenças na comparação com o citoesqueleto das outras células.
•
91
Fig. 5.47 Representação
esquemática parcial do
sarcômero, que inclui as
moléculas de titina. Assinalamos
o comprimento relativo das
moléculas de nebulina.
92
•
O CITOESQUELETO
Fig. 5.48 Citoesqueleto da célula
muscular lisa. Observar de que
maneira os filamentos
intermediários de desmina,
situados entre os filamentos de
actina, protegem o núcleo e os
componentes citoplasmáticos
durante a contração.
Como mostra a Fig. 5.49, imediatamente por baixo da membrana plasmática da hemácia, existe uma malha fibrilar integrada principalmente por filamentos de espectrina, que é uma proteína
similar à fodrina (Seção 5-20). Trata-se de um heterodímero composto por dois polipeptídeos longos entrelaçados, chamados ex e [3 (ou banda 1 e banda 2, respectivamente). Visto que os dímeros
se conectam por suas pontas, formam-se tetrâmeros cujas extremidades se unem a filamentos de
actina curtos (ou banda V) .
A Fig. 5.49 permite ver que cada filamento de actina se conecta com várias espectrinas
tetraméricas; tais conexões são mediadas pela proteína ligadora aducina. Vê-se também que os
filamentos de actina se ligam a uma glicoproteína transmembrana chamada glicoforina mediante
a proteína ligadora banda 4.1.
Além disso, o filamento de actina se acha associado a outras duas proteínas, a tropomodulina,
que determinaria seu comprimento, e a tropomiosina, cuja função se desconhece.
Próximo de sua parte média, cada tetrâmero de espectrina se conecta com a proteína transmembrana banda 3, que é o contratransportador de c1- e HC0 3 - descrito no Cap. 3-17. Nesta união
intervém a proteína ligadora anquirina.
É preciso assinalar que o conjunto deste sistema de proteínas citoesqueléticas e membranosas
confere à hemácia sua forma bicôncava e a flexibilidade necessária para poder circular pelos capilares sangüíneos de diâmetros menores que o seu.
Fig. 5.49 Ilustração dos
componentes principais do
citoesqueleto e da membrana
plasmática da hemácia.
BIBLIOGRAFIA
Adams D.S. (1992) Mechanisms of cell shape change: the cytomechanics
of cellular response to chemical environment and mechanical loading. J. Cell Biol. 117:83.
Allan V. (1996) Motor protein: a dynamic duo. Curr. Biol. 6:630.
A vila J. (1991) Microtubule functions. Life Sei. 50:327.
Belmont L. and Mitchison T. (1996) Catastrophic revelations about Op 18
stathmin. TIBS 21:197.
Bennett V. (1992) Ankyrins. Adaptors between diverse plasma
membrane proteins and cytoplasm. J. Biol. Chem. 267:8703.
Burton K. (1992) Myosin step size: estimates from motility assays and
shortening muscle. J. Muscle Res. Cell Mot. 13:590.
Carlier M.F. (1991) Actin : protein structure and filament dynamics. J.
Biol. Chem. 266:1.
Fuchs E. and Cleveland D.W. (1998) A structural scaffolding of
intermediate filaments in health and disease. Science 279:514.
Geisler N., Kaufmann E. and Weber K. (1985) Antiparallel orientation
of the two double-stranded coiled-coils in the tetrameric protofilament unit of intermediate filaments. J. Mo!. Biol. 182: 173.
Hib J. (2001) Histología de Di Fiore. Texto y atlas. El Ateneo, Buenos
Aires.
Hirokawa N. (1998). Kinesin and dynein superfamily proteins and the
mechanism of organelle transport. Science 279:519.
Isenberg G. and Goldmann W.H. (1992) Actin-membrane coupling: a
role for talin. J. Muscle Res. Cell Mot. 13:587.
Kashina A.S. et ai. (1996) A bipolar kinesin. Nature 379:270.
Kumar J. , Yu H. and Sheetz M.P. (1995) Kinectin, an essential anchor
for kinesin-driven vesicle motility. Science 267: 1834.
Labeit S. and Kolmerer B. (1995) Titins: giant proteins in charge of
muscle ultrastructure and elasticity. Science 270:293 .
Luna E.J. and Hitt A.L. (1992) Cytoskeleton-plasma membrane interactions. Science 258:955.
MacRae T.H. (1992) Towards an understanding ofmicrotubule functi-
O CITOESQUELETO
on and cell organization: an overview. Biachem . Cell Biol. 70:835 .
_ IacRae T.H . (1992) Microtubule organization by cross-li nking and
bundling proteins. Biachem. Biophys. Acta 1160:145.
_ fu rphy S.M. and Stearns T. (1996) Cytoskeleton: microtubu le
nuc leation takes shape. Curr. Biol. 6:642.
Palecek S.P. et ai. (1997) Integrin-ligand binding properties govem cell
migration speed through cel!- substratum adhesiveness . Nature
385:537.
Pantaloni D. , Le Clainche Ch. and Carlier M.F. (200 1) Mechanism of
actin-based motility. Science 292:1502.
Rodinov V.I. and Borisy G.G. (1997) Microtubule treadmilling in vivo .
Science 275:215.
Roush W. (1995) Protein studies try to puzzle out Alzheimer's tang les.
Science 267:793.
hwarzbauer J.E. (1997) Cell migration: May the force be with yo u.
Curr. Biol. 7:R292.
Shpetner H.S. and Vallee R.B. ( 1992) Dynamin is a GTPase stimulated
to high leveis of acti vity by microtubules. ature 355:733.
•
93
Terada S. et ai. (1996) Visualization of slow axonal transport in vivo.
Science 273:784 .
Tessier-Lavigne M. and Goodman C.S . (1996) The molecular biology
of axon guidance. Science 274: 1123.
Trinick J. (1994) Titin and nebulin: protein ru lers in muscle? TIBS
19:405.
Vale R.D. (1992) Microtubule motors: many new mode ls of th e
assembly line. TIBS 17:300.
Wang E. et ai. [eds.] (1985) lntermediate fil aments. Ann . N.Y. Acad.
Sei. Vol. 455.
Wang F. et ai. (1996) Function of myos in-V in filopodial extension of
neuronal growth cones. Science 273:660.
Waters J.C. and Salmon E.D. (1996) Cytoskeleton: a catastrophic
kinesin. Curr. Biol. 6:361.
Weeds A. and Yeoh S. (200 1) Action atthe Y-branch. Science 294: 1660.
Zheng Ch ., Heintz N. and Hatten M.E. (1996) CNS gene encodin g
astrotactin, which support neuronal migration along glial fibers. Science 272:4 17.
A junção das células
entre si e com a matriz
extracelular
6-1. As células se unem entre si e com elementos da matriz extracelular
Os organismos multicelulares são compostos não somente por células , mas também por elementos intercelulares . Estes últimos se agrupam sob o nome de matriz extracelular. Os tecidos
- e, por extensão, os órgãos e sistemas - são o resultado de associações de tipos diferentes de
célula~ e matrizes extracelulares; assim, para poder reconhecer um tecido devemos levar em conta tanto suas células quanto a qualidade e a quantidade de seus componentes intercelulares.
Nos tecidos conjuntivos, as células se encontram dispersas em meio de abundante matriz extracelular. Ao contrário, nos epitélios, as células podem estar aderidas sem que nenhum elemento
extracelular, praticamente, as separe. No entanto, nos epitélios de revestimento, existe uma delgada matriz extracelular, chamada lâmina basal, interposta entre as células e o teci_do conjuntivo
sobre o qual se apóiam. Lâminas basais similares se encontram em outros tecidos, como, por exemplo, em tomo das células musculares.
Neste capítulo analisaremos os componentes da matriz extracelular, como as células se vinculam a eles e os diferentes tipos de junções que existem entre as células.
MATRIZ EXTRACELULAR
6-2. A matriz extracelular contém elementos fluidos e fibrosos
As funções mais importantes da matriz extracelular são: 1) preencher os espaços não ocupados pelas células; 2) conferir aos tecidos resisJência _~ com_pressão e ~_ti['!.lpento; 3) constituir
um meio por onde cheguem os nutrientes e sejam eliminados os dejetos celulares; 4) fornecer
pontos fixos a diversos tipos de células pará que elas possam se ancorar; 5) ser um veículo por
onde migram as células quando se deslocam de um ponto a t:iutro no organismo; 6) ser um meio
pelo qual chegam às células as substâncias indutoras (sinais) provenientes de outras células (Cap.
11-2).
Quadro 6. 1 Principais glicosaminoglicanas e suas unidades dissacarídicas repetitivas
Glicosaminoglicanas
Unidade dissacarídica
Ácido hialurônico (hialuronana)
Condroitinsulfato
Dermatansulfato
Heparansulfato
Queratansulfato
Ácido glicurônico; N-acetilglucosam ina
Ácido glicurônico; N-acetilgalactosamina sulfato
Ácido idurônico; N-aceti lgalactosamina sulfato
Ácido idurônico; N-acetilglucosamina sulfato
Galactose; N-acetilglucosamina sulfato
6
96
•
A JUNÇÃO DAS CÉLULAS ENTRE SI E COM A MATRIZ EXTRACELULAR
Fig. 6.1 Esquema de um agregado molecular composto por numerosas proteoglicanas ligadas a um ácido
hialurônico.
Os componentes da matriz extracelular podem ser classificados em fluidos e fibrosos. Os fluidos correspondem principalmente a glicosaminoglicanas e proteoglicanas (Cap. 2-6), enquanto
os fibrosos se dividem em proteínas estruturais (colágeno) e proteínas adesivas (fibronectina, laminina).
1
1
6-3. As glicosaminoglicanas e as proteoglicanas são componentes
fluidos da matriz extracelular
A fase líquida da matriz extracelular contém um tipo especial de polissacarídeos chamados gli·
cosaminoglicanas, que podei;n estar associados entre si e às proteínas, com as quais compõem
grandes complexos glic.opro.téic9s denominados proteoglicanas (Cap. 2-6) (Figs. 2.10 e 2.11).
Mais de 100 cadeias de glicosaminoglicanas podem se associar a uma só proteína e, ocasionalmente, várias destas proteoglicanas se unem a uma molécula de hialuronana (ácido hialurônico)
- que é a glicosaminoglicana de maior tamanho - o que dá origem a agregados moleculares de
enormes proporções (Fig. 6.1 ).
As glicosaminoglicanas são carboidratos compostos por uma sucessão de unidades dissacarídicas
repetidas e alternadas, nas quais um dos monossacarídeos possui um grupo amina, posto·que é
uma N-acetilglicosamina ou uma N-acetilgalactosamina e o segundo é um ácido glicurônico, um
ácido idurônico ou uma galactose (Cap. 2-6).
No Quadro 6.1 mencionamos as principais glicosaminoglicanas e suas unidades repetitivas.
Como podemos perceber, à exceção do ácido hialurônico, todas são sulfatadas. Por causa dos
sulfatos e do fato de possuírem numerosos grupos carboxila, as glicosaminoglicanas são moléculas muito ácidas, com numerosas cargas negativas que atraem grandes quantidades de Na+- e,
portanto, de H 20 - , o que aumenta a turgidez da matriz extracelular.
6- 4. As proteínas estruturais mais abundantes da matriz
extracelular são as fibras colágenas
Na matriz extracelular, as proteínas estruturais mais importantes correspondem às fibras·colágenas, que são compostas por fibrilas que apresentam uma estriação característica, com uma-periodicidade de 67 nm (Fig. 6.2).
A unidade molecular básica da fibrila é o tropocolágeno, que é uma molécula protéica fibrosa
de cerca de 300 nm de comprimento e 1,5 nm de espessura (Fig. 6.2). O tropocolágeno é composto por três cadeias polipeptídicas do mesmo tamanho trançadas em forma helicoidal. A periodicidade de 67 nm nas estrias das fibrilas colágenas é porque tropocolágenos se agregam em paralelo
e se sobrepõem em uns três quartos do seu comprimento (Fig. 6.2).
Existem cerca de 25 tipos de cadeias polipeptídicas. Em todas elas, um terço dos aminoácidos
são glicinas, outro terço pode ser de prolinas e hidroxiprolinas, e o terço restante são aminoácidos
de tipos distintos.
A JU1 ÇÃO DAS CÉLULAS ENTRE SI E COM A MATRIZ EXTRACELULAR
~--Tropocoláge no-- ==&ii
Fig. 6.2 Fibras colágenas. São compostas de fibrilas e estas de tropocolágeno. A eletromicrografia pennite
ver sua estria característica, deri vada da disposição escalonada das moléculas de tropocolágeno nas
fibrilas.
Estas cadeias polipeptídicas se combinam de diversas maneiras, o que dá lugar a cerca de 15
tipos de colágenos . Estes são identificados por algarismos romanos e os principais correspondem
aos colágenos dos tipos I, II, III, IV, VII, IX e XI.
O colágeno do tipo I encontra-se na derme, na cápsula dos órgãos, no tendão, no osso, na córnea e na dentina; os do tipo II, IX e XI na cartilagem; e o do tipo III na derme fetal, no tecido
conjuntivo frouxo , na parede dos vasos sangüíneos, no útero, no rim e nos tecidos hematopoético
e linfático; os do tipo IV e VII são encontrados na lâmina basal e no tecido conjuntivo subjacente.
No Cap. 5-27, vimos que as fibras de colágeno (fibras colágenas) desempenham um papel crucial na migração das células , já que fornecem os pontos fixos de sustentação para a ancoragem
temporária dos filopódios.
6-5. A fibronectina e a laminina são proteínas adesivas da matriz
extracelular
A fibronectina é uma glicoproteína fibrosà de 440 kDa, composta por duas sub_unidades polipeptídicas ligadas entre si por uma ponte dissulfeto próxima às suas extremidades carboxila. Cada
subunidade possui dois domínios; como veremos na próxima seção, um se conecta a uma proteína
da membrana plasmáJ.ica da célula e o outro à fibra colágena (Fig. 5.31 ).
No Cap. 5-27 assinalamos que as moléculas de fibronectina estabelecem os itinerários seguidos pelas células migratórias e medeiam a conexão temporária dos filopódios com as fibras colágenas.
A laminina é uma glicoproteína fibrosa de cerca de 900 kDa, composta de três subunidades
polipeptídicas unidas por pontes dissulfeto . Tem forma de cruz, com um braço longo e três braços
curtos.
A laminina é abundante nas lâminas basais, onde se acha associada ao colágeno do tipo IV e a
uma proteoglicana rica em heparansulfato (Fig. 6.3). É a primeira proteína adesiva que aparece na
matriz extracelular do embrião, já que foi detectada nas últimas fases da segmentação da célula
ovo, quando a mórula se forma (Cap. 21-7).
~---L--+~-r-..
,,..-.-..,,...c...__,..,,(..1-- - - - - - -- - Laminina
'fllíliii!lllíiililllllll&.../ .._..,,,_~•u
-+------ Colágeno IV
/
Fig. 6.3 Representação
esquemática de um
hemidesmossoma.
•
97
98
•
A JUNÇÃO DAS CÉLULAS ENTRE SI E COM A MA TRIZ EXTRA CELULAR
UNIÕES DAS CÉLULAS COM A MATRIZ EXTRACELULAR
6-6. Os contatos focais unem as células de alguns tecidos
conjuntivos com componentes da matriz extracelular
As células de alguns tecidos conjuntivos, embora possam se mobilizar, podem permanecer em
seus locais por estabelecerem uniões mais ou menos duradouras com componentes fixos da matriz extracelular. Nessas uniões, intervêm, do lado das células, os contatos focais (Cap. 5-24),
enquanto os componentes fixos na matriz extracelular correspondem às fibras colágenas.
Devemos lembrar que cada contato focal consiste em_Q__ma proteína transmembrana ch_amada
~egrina, cujo domínio interno está unido - mediante várias proteínas ligadoras - a feixes de
filamentos de actina deno_!1Ünados fibras de tensão (Cap. 5-24 ). É precisamente a integrina- através
de seu domínio externo - o componente do contato focal que se conecta com a fibra colágena da
matriz extracelular. Como mostra a Fig. 5.31 , esta conexão se faz com a ajuda da proteína adesiva
fibronectina.
No Cap. 5-27 vimos que uniões similares a estas - porém fugazes - são estabelecidas durante a migração celular, quando os contatos focais dos filopódios se aderem a fibras colágenas presentes na rota da célula que se desloca pela matriz extracelular.
6-7. Os hemidesmossomas ancoram as células epiteliais na lâmina basal
As células da camada basal dos epitélios ligam-se a uma parte especializada da matriz extracelular conhecida como lâmina basal (Seção 6-1). A conexão entre a célula e a lâmina é bastante firme, já que ocorre através de certas estruturas denominadas hemidesmossomas (Figs. 6.3 e
6.7).
Como os contatos focais, o~ hemide~mossomas possu~m ~~t~grinas, porém estas encontramse agrupadas, seus domíQios citosólicos se un~m a filamentos intermedjários de queratina (ou
ceratina) (não a fibras de tensão de actina) e seus domínios externos se ligam a uma rede de1;ol_~g~!!Q_~ip_o_IY_qu ~e.xiste_som~nt~a lâmina basal. Esta última conexão é realizada por meio
da laminina (Fig. 6.3). Além disso, entre as integrinas e os filamentos de queratina interpõe-se
uma placa discóide de 12 a 15 nm de espessura que contém uma proteína ligadora similar às
desmoplaquinas do desmossoma (Seção 6-13).
.
,~ 1
;t
1
1
UNIÕES TRANSITÓRIAS ENTRE AS CÉLULAS
6-8. Em vários processos biológicos ocorrem adesões transitórias
entre tipos celulares diferentes
Durante as respostas imunes, o reparo das feridas e a cessação das hemorragias é necessário
que alguns tipos celulares estabeleçam junções transitórias com outros tipos de células. As ligações ocorrem graças aos fenômenós biológicos chamados reconhecimento e adesão celular.
Ambos ocorrem quando determinadas células do sangue (neutrófilos, monócitos, linfócitos,
plaquetas) se conectam transitoriamente com as células endoteliais dos capilares sangüíneos, o
que é um pré-requisito para poderem sair do sangue e passar aos tecidos (Fig. 6.4). A adesão ocorre porque na membrana plasmática das células sangüíneas existem glicolipídios e glicaproteínas
que interagem especificamente com glicoproteínas complementares - chamadas selectif!aS presentes na membrana plasmática das células endoteliàis. Inversamente, em outras ocasiões, os
Fig. 6.4 Passagem de uma célula
sangüínea entre duas células
endoteliais de um capilar e sua
saída para a matriz extracelular.
Neutrófilo
~}
O
Capilar
"
sangüí;;e~
}Matriz extracelular
A
Adesão heterófi la
Adesão homófila
ÇÃO DAS CÉLULAS ENTRE SI E COM A MA TRIZ EXTRA CELULAR
Adesão por meio de caderinas
;o·
glicolipídios e as glicoproteínas se localizam nas células endoteliais e as selectinas nas células
sangüíneas.
Estas interações são necessárias para que as células sangüíneas se detenham no lugar apropriado e passem entre duas células endoteliais contíguas, o que lhes pennite alcan~ar o tecido onde
- segundo o caso - participarão da re posta imune; da cicatrização da ferida ou na detenção da
hemonagia.
A especificidade da união é assegurada de um lado pelos oligossacarídios dÓs glicolipídios e
das glicoproteínas e, do outro, pelos oligossacarídeos das selectinas. Os oligossacarídeos
interatuantes são diferentes entre si, de modo que se estabelecem conexões entre moléculas de
composição distinta (adesões heterófi__Ú!:s) (Fig. 6.5). As selectinas devem seu nome às adesões
seletivas que medeiam e por serem lectinas, ou seja, moléculas que têm uma grande avidez por
~ J
-caroG-idratos.
Outras adesões celulares heterófilas transitórias oconem entre as células mielóides (durante
sua proliferação), entre os linfócitos B e T (durante a ativação dos primeiros) e entre os oligodendrócitos e as células de Schwann e os neurônios (durante a mielinização). Em todos os casos, os
oligossacarídeos de uma das suas células interatuantes reconhecem especificamente as glicoproteínas ehamadas sialoadesinas presentes na membrana plasmática da célula oposta.
No curso do desenvolvimento embrionário oconem adesões heterófilas similares às descritas,
ainda que sejam mais comuns as adesões homófilas que serão analisadas na próxima seção. Finalmente, outro exemplo de adesão heterófila é durante a fecundação do ovócito* pelo espermatozóide (Cap. 19-19.).
eio
-se
· às
6-9. Durante o desenvolvimento embrionário, antes de se formarem uniões
estáveis, as células se reconhecem e se aderem
,
a
e
a
a
n-
e-
:am-
3e
m-
ou
ário
iga-
itos,
IS, 0
corínas
sS, OS
•
99
Fig. 6.5 Adesões moleculares
heterófilas e homófilas. Nas
adesões homófilas mediadas
pelas caderinas intervém o Ca2 +
ilustrado como um retângulo de
cor amarela.
Durante o desenvolvimento embrionário, alguns epitélios são formados a partir de células,.que
ao final de várias divisões geram numerosas células descendentes que permanecem juntas (Fig.
6.6), conectadas entre si mediante uniões estáveis (estas uniões serão analisadas nas próximas
seções).
Ao contrário, outros tecidos são formados pela associação de dois ou mais tipos de células diferentes, que devem migrar para se encontrarem em algum lugar do organismo. Nele se reconhecem, aderem-se umas às outras e se unem por meio de junções estáveis.
O reconhecimento e a adesão celular são mediados por glicoproteínas transmembranas especiais chamadas CAM (do inglês, cell-adhesion molecules) , que se encontram na superfície das
células destinadas a se unir e têm a particularidade de interagir somente quando são idênticas (uniões
homófilas) (Fig. 6.5). Mediante essas CAM, a célula migratória enquanto se desloca em busca do
seu lugar de destino - onde entrará em contato com células que serão suas companheiras em um
novo tecido - "avalia" as propriedades químicas das CAM situadas nas membranas plasmáticas
das células que se encontram na sua passagem. Se reconhecer uma célula com uma CAM idêntica
à sua, adere-se a ela; em caso contrário, continua deslocando-se até encontrar a célula com a CAM
coneta.
Foram identificadas várias CAM denominadas - em consideração às células onde foram encontradas pela primeira vez - Ng-CAM (neurônios , células gliais), N-CAM (neurônios), L-CAM
ou caderina E (hepatócitos, células epiteliais) , caderina P (placenta), caderina N (neurônios) etc.
As caderinas são glicoproteínas assim denominadas por necessitarem de Ca2+ para poder ligar-se
entre si (Fig. 6.5).
*N.R.T.: Ovócito II ou oóciro II.
Fig. 6.6 Forrna-ção de um tecido
epitelial derivado de uma única
célula.
100
•
A JUNÇÃO DAS CÉLULAS El
RE SI E COM A .\•1ATRIZ EXTRA CELULAR
Disso se conclui que antes de se unir na forma estável, as células devem se reconhecer e se
aderir. Hoje se aceita que esses três processos correspondam a etapas sucessivas de um mesmo
fenômeno. as próximas seções veremos que algumas uniões estáveis contêm caderinas, ou sej a,
moléculas com propriedades idênticas às CAM dependentes de Ca2 + que atuam durante o reconhecimento e a adesão celular.
UNIÕES ESTÁVEIS ENTRE AS CÉLULAS
6-1 O. As células epiteliais se unem entre si por meio de
quatro tipos de estruturas
As células dos epitélios se ligam entre si de maneira estável por meio de quatro tipos de uniões.
Estas se denominam: 1) junção oclusiva; 2) cinturão de adesão; 3) desmossoma; e 4) junção comunicante (Fig. 6.7) .
6- 11. A junção oclusiva impede a passagem de substâncias
pelo espaço intercelular
~
A junção oclusiva (também chamada de junção estreita ou zônula de oclusão) adere firmemente às membranas plasmáticas das células epiteliais contíguas por meio de uma franj a de conexão não muito larga, situada imediatamente abaixo da superfície livre do epitélio (Fig. 6.7). Tendo em vista que nos epitélios cada célula se acha rodeada por outras , em uma célula individual a
junção oclusiva compõe um arwl q~J'.irc~d a suas paredes laterais (Fig. 6.8).
Ao nível da junção oclusiva, as membranas plasmáticas das células situadas defronte uma da
outra contêm, entre outras, dois tipos de proteínas integrais chamadas ocludinas e claudinas. Como
mostra a Fig. 6.9, estão dispostas de tal modo que formam três ou mais fileiras paralelas à superfície do epitélio. Em ç_adafileita, as ocludinas e as_clauclina~ .!!_nid as entre si como as contas
de um colar e cada proteína se adere firmemente a outra similar da membrana OJJOSta, o que bloqueia o espaç9 intercelular. Na Fig. 6.9 podemos ver que as fileiras de ocludina e de claudina
parecem "costuras" e que estas se acham interconectadas por pontes de igual composição.
1
n
Slíl
Junção comunicante - : :
Hem idesmossoma
!
\_
~-
F ig. 6.7 Representação esquemática das
estruturas que mantêm as células epiteli ais
unidas entre si e com a lâmina basal.
o
•º•
o
o
Fig. 6.8 Esquema u·idimensional que ilustra as estruturas
que mantêm unidas as células epiteliais entre si. É
mostrada também a membrana terminal (na altura do
cinturão de adesão) e o seu vínculo com as bases das
microvilosidades (Fig. 5. 38).
A
ºÇÃO DAS CÉLULAS ENTRE SI E COM A MA TRIZ EXTRA CELULAR
•
101
Fig. 6.9 Junção oclusiva onde se
observam três fileiras protéicas
paralelas entre si e as pontes que
as conectam. As fileiras e as
pontes são compostas de
ocludinas e claudinas.
Membrana plasmática
Quando se coloca sobre a superfície livre de um epitélio um marcador como a ferritina, suas
moléculas não podem atravessar o tecido epitelial pelos espaços intercelulares por serem detidas
pelas junções oclusivas . O mesmo ocorre com quase todas as substâncias, que, por isso, para atravessar o epitélio devam cruzar pelo interior de suas células . As Figs. 3.27, 3.28, 7 .25 , 7 .26, 7 .27 e .
7.28 mostram transportes transcelulares deste tipo.
O exposto no parágrafo anterior tem exceções. Por exemplo , o Mg 2 + pode passar pelos espaços
intercelulares do epitélio do túbulo reto distal do néfron porque entre as claudinas das junções
oclusivas desse epitélio existem canais diminutos que permitem a passagem do íon. Devemos
assinalar que o Mg 2+ se dirige do interior do néfron para o interstício renal e que sua transferência
é realizada sem a companhia de água.
Além de unir as células e de impedir a passagem de substâncias através dos epitélios, as jun, ões oclusivas determinam que as composições moleculares das regiões apical e basolateral das
membranas plasmáticas das células epiteliais sejam diferentes entre si. Esta assimetria é porque
as junções oclusivas formam barreiras que impedem a difusão lateral das proteínas e dos lipídios
da membrana (Caps. 3-3 e 3-5), ficando uma parte confinada de um lado das junções e outra parte
do outro. O transporte transcelular de solutos, ilustrado nas Figs. 3.27 e 3.28, é possível graças à
segregação - de ambos os lados das junções oclusivas - de proteínas da membrana que funcionam como canais iônicos e perrneases.
6-12. O cinturão de adesão contém glicoproteínas chamadas caderinas
O cinturão de adesão (chamado também desmossoma em cinturão, desmossoma em banda,
banda de adesão , barra terminal ou zônula de aderência) é outro tipo de junção que as células
epiteliais desenvolvem para se manter ligadas entre si.
Ele está localizado sob a junção oclusiva (Fig. 6.7) e, em sua composição, intervêm glicoproteínas transmembrana da família das caderinas (Seção 6-9) e a franja de filamentos de actina
orticais estudada no Cap. 5-21. Ali adiantamos que as caderinas se conectam com os filamentos
de actina mediante as proteínas ligadoras placoglobina, catenina, alfa-actina e vinculina.
Como mostram as Figs. 6.8 e 6.10, as caderinas dão lucrar a~ · a rotéicaque circunda as
paredes laterais da célula, da mesma largura que a franj a de filam.e tos de actina com a qual se
acham conectadas. As Figs. 6.8 e 6.10 mostram também que a união intercelular ocorre em vutude
de as caderinas se conectarem por meio de seus domínios externos. Segundo vimos na Seção 6-9,
trata-se de adesões homofílicas , pois as moléculas que interagem são iguais entre si (Fig. 6.5).
O nome cinturão de adesão refere-se às duas características mais notáveis desse tipo de junção:
a disposição circular das caderinas e dos filamentos de actina e a propriedade que têm as primeiras de se aderir mutuamente.
Q conjunto de cinturões de adesão forma uma tr:ama..transepitel.ial da qual se deriva parte da
resis.tência ateral dos epitélios.
(
102
•
A JUNÇÃO DAS CÉLULAS ENTRE SI E COM A MA TRIZ EXTRA CELULAR
Fig. 6.10 Cinturão de adesão .
_ _
___,_
_
Caderinas
6-13. O desmossoma é comparado com um rebite e, em sua formação,
também intervêm as caderinas
Os desmossomas (do grego, desmós, vínculo, e sôma, corpo) (chamados também de desmossomas puntiformes ou máculas de aderência) ao contrário da junção oclusiva ou do cinturão de
adesão, constituem junções puntiformes entre as células epiteliais contíguas e, por isso, são comparados a rebites (Figs. 6.8 e 6.11). São encontrados por baixo do cinturão de adesão, distribuídos
irregularmente nas paredes laterais das células. Cada desmossoma ocupa uma área circular de aproximadamente 0,5 µ,m de diâmetro e, ao seu nível, as membranas plasmáticas se encontram separadas por uma distância de 30 a 50 nm.
O desmossoma inclui um grupo de glicoproteínas transmembrana da família das caderinas,
denominadas desmogleína 1, desmocolina 1 e desmocolina II.
Da mesma forma que no cinturão de adesão, as caderinas das membranas adjacentes se unem
entre si por seus domínios externos (Fig. 6.11). Ao contrário, seus domínios citosólicos associamse a filamentos intermediários de queratina (e não com filamentos de actina). Esta última associação é mediada por uma placa discóide que inclui as proteínas ligadoras desmoplaquina 1, desmoplaquina II e placoglobina. Urna das faces da placa relaciona-se com as caderinas e a outra
com os filamentos de queratina que - como forquilhas - entram no disco, curvam-se e voltam
para o citosol (Fig. 6.11 ).
Filamentos
intermediários
Fig. 6.11 Desmossoma ~
A JUNÇÃO DAS CÉLULAS ENTRE SI E COM A MATRIZ EXTRACELULAR
•
103
Além de unir fortemente as células epiteliais entre si, os desmossomas e os filamentos de queratina compõem uma rede transcelular estendida por todo o epitélio que lhe confere uma grande
resistência mecânica. É por isso que nos diferentes tecidos , o número de desmossomas é proporcional ao grau de tensão ou de estiramento a que são submetidos. Por exemplo, no epitélio da mucosa
da bexiga urinária, os desmossomas são muito abundantes.
No Cap. 5-34 vimos que os discos intercalares que ligam as células musculares cardíacas contêm desmossomas associados a filamentos de desmina.
6-14. A junção comunicante é formada pela associação de conexões
fornecidas pelas células epiteliais contíguas
As junções comunicantes (chamadas também de junções emfenda,junções "gap" ou nexus)*
são canais que comunicam os citoplasmas das células epiteliais adjacentes.
Cada canal é composto por um 2ar de conexões que são estruturas cilíndricas ocas que atravessam as membranas plasmáticas das células que se encontram defronte uma da outra (Figs. 6.7 e
6.12).
A parede da conexão resulta da associação de seis proteínas .transmembranas idênticas que
delimitam um dueto central (Fig. 6.12). Estas proteínas são chamadas conexinas e se unem com
suas similares de conexão da membrana plasmática oposta, o que dá lugar a um canal que comunica as suas células. Devido ao fato de as conexinas sobressaírem no__es.pJlÇO intercelular entre 1 e
2 nm, as membranas plasmáticas dessas células ficam separadas por uma distância de 2 a 4 nm.
Por este motivo, a junção comunicante é chamada também junção em fenda...(Fig. 6.12).
Nas o;élulas epiteliais,~~x_õ~~m e11tre_os desmossomas. Não estão uniformemente distribuídas e sim agrupadas em conjuntos isolados, cada um composto por algumas poucas ou por centenas de conexões.
A Fig. 6.13 corresponde a uma imagem ultramicroscópica com coloração negativa de numerosas conexões na membrana plasmática de um hepatócito. As conexões aparecem como anéis que
formam uma trama hexagonal com uma periodicidade de 8,5 nm. No detalhe, observamos uma
representação obtida mediante o processamento densitométrico computadorizado das imagens
J
eletrônicas.
O dueto central da conexão tem um diâmetro de cerca de 1,5 nm. Por ele passam livremente
alguns solutos QQ.ns, monossacarídeos , nucleotídeos , aminoácidos etc.) do citoplasma de uma célula
Conexina
Fig. 6.12 Junção comunicante.
A figura ilustra, à direita, o
mecanismo de fechamento da
conexão.
--~
~ N. R.T.:
Também chamadas junções de intervalo e nexos.
104
•
A JlÍNÇÃO DAS CÉLULAS E TRE SI E COM A MATRIZ EXTRACELULAR
Fig. 6.13 Visão superficial
ultramicroscópica, com
coloração negativa, de
numerosas conexões na
membrana plasmática da célula
hepática. 425.000 X. No detalhe,
observa-se que cada unidade tem
a forma de um anel hexagonal
cujos lados conespondem a seis
conexinas. (Cortesia de G.
Zampighi.)
ao citoplasma da célula vizinha, porém não as macromoléculas. Tais passagens indicam que existem acoplamentos metabólicos e elétricos entre as células contíguas.
A estrutura das conexões é comparável à dos canais iônicos vistos no Cap. 3-14. Devemos lembrar que os canais dependentes de voltagem e de ligante são compostos, respectivamente, por 4 e
5 proteínas transmembrana em lugar das seis que existem nas conexões. Estes canais, como os
canais iônicos, não são estruturas estáticas, já que têm a capacidade de se abrir e se fechar. Comumente, estão abertos , e se fecham quando aumenta a con~l!.tragão_Q_e C-ª2+ no citosol. A Fig. 6.12
mostra que o fechamento obedece a uma mudança de inclinação das conexinas.
As conexinas contêm quatro domínios transmembrana, e suas extremidades amina e carboxila
estão voltadas para o citosol. O domínio contíguo à extremidade carboxila tem uma função importante porque sua fosforilação modifica a posição da conexina e leva ao fechamento da conexão.
Visto que em uma junção comunicante o fechamento de uma conexão ocorre independentemente da outra, o fechamento do canal pode ser conseqüência do fechamento de somente uma das
conexões.
O fechamento das junções comunicantes adquire grande importância nas mortes celulares, não
somente nas programadas, mas também nas acidentais (Cap. 22-4). Assim, nas células moribundas ocorre um aumento na concentração de Ca2+ citosólico que provoca o fechamento das conexões para que não passem às células vizinhas elementos que possam lhes causar danos.
Através das junções comunicantes circulam: 1) nutrientes; 2) dejetos metabólicos; 3) substâncias que atuam como sinais, como, por exemplo, os morfogênios durante a diferenciação celular
(Cap. 21 -1 2) ou as moléculas que sincronizam o movimento dos cílios nos epitélios (Cap. 5-12);
4) potenciais elétricos de ação, como os que são transmitidos pelos discos intercalares do músculo
cardíaco para sincronizar as contrações de suas células (Cap. 5-34) ou entre as células musculares
li sas de alguns órgãos tubulares (intestino e epidídimo) a fim de sincronizar suas contrações peristálticas.
AS CONEXÕES ENTRE AS CÉLULAS VEGETAIS
6- 15. Os plasmodesmas são pontes de comunicação entre células vegetais
Uma característica da maioria das células vegetais é a presença de pontes entre seus citoplasmas, o que as torna contínuas. Estas pontes - denominadas plasmodesmas - atravessam a parede celular pecto~sica descrita no Cap. 3-30 (Fig. 1.6).
A presença dos plasmodesmas permite a livre circulação de líquidos e solutos, tão importantes
para manter ~icidade da célula vegetal. É possível que deixem passar também algumas macromoléculas. Como vemos , as paredes pectocelulósicas não constituem septos intercelulares com-
A JUNÇÃO DAS CÉLULAS ENTRE SI E COM A MA TRIZ EXTRA CELULAR
•
105
pletos, de modo que as células compõem um vasto sincício sustentado pelo esqueleto formado
por suas próprias paredes.
O desenvolvimento dos plasmodesmas está relacionado com a formação da placa celular (Caps.
3-30 e 18-21 ), que é atravessada por componentes do retículo endoplasmático, e que, por fim, são
responsáveis pela formação e localização dos plasmodesmas (Cap. 7-44).
Foi sugerido que os plasmodesmas desempenham uma função na diferenciação celular. Assim, nas células vegetais que se alongam, o número de plasmodesmas se reduz ao longo de seus
eixos maiores e aumenta nos septos transversais.
BIBLIOGRAFIA
Anderson H . (1990) Adhesion molecules and animal development.
Experientia 46:2.
Citi S. ( 1993) The molecular organization of tight junctions. J. Cell Biol.
121:485.
Crocker P .R . and Feizi T. (1996) Carbohydrate recognition system:
functional triads in cell-cell interactions. Curr. Opin. Struc. Biol.
6: 679 .
Culotta E. (1995) Neuronal adhesion molecules signal through FGF
receptor. Science 267: 1263.
Green K.J. and Jones J.C.R. (1996) Desmosomes and hemidesmosomes:
structure and function of molecular components. FASEB J. 10:871.
Hib J. (2001 ) Histología de Di Piore. Texto y atlas. El Ateneo, Buenos
Aires.
Horwitz A.F. (1997) Integrins and health . Sei. Arn . 276 (5):46.
Kintner C. (1992) Regulation of embryonic cell adhesion by the cadherin
cytopiasmic domain. Cell 69:225 .
Luna E.J. and Hitt A.L. (1992) Cytoskeleton-plasma membrane interactions. Science 258:955.
r
.-
.s
1-
t-
Marchisio P .C. (19 91 ) Integrin s and ti s sue organization. Ad v .
euroimm. 1:214.
Pennisi E. ( 1997) Genes, junctions, and disease at cell biology meeting.
Science 274:2008 .
Rosen S.D. and Bertozzi C.R. (1996) Leukocyte adhesion: two selectins
converge on sulphate. Curr. Biol. 6:261.
Sharon . and Lis H. (1993) Carbohydrates in cell recognition . Sei. Am.
268 (1 ):82.
Snyder S .H. (1985) The molecular basis of communication between
cells. Sei. Arn. 253 (4): 114.
Weber K. and Osborn M. (1985) The molecules of the cell matrix. Sei.
Am. 253 (4):92.
Wong V. and Goodenough D .A. (1999) Paracellular channels . Science
285:62.
Yanagishita M. and Hascall V.C. (1992) Cell surface heparan sulfate
proteoglycans. J. Biol. Chem. 267:9451.
Yeager M. and Nic holson B.J. (1996) Structure of gap junction
intercellular channels. Curr. Opin. Struc. Biol. 6:183.
O sistema de
endomembranas
7
Digestão e secreção
7-1. Os componentes do sistema de endomembranas se
comunicam através de vesículas
No Cap. 4-1 descrevemos os compartimentos nós quais se divide a célula, e, dentre estes, citamos que o sistema de endomembranas é um dos mais volumosos. Ele se distribui por todo o cito1
plasma e ê comp.osto_PQr vários coml:)artimentos - cistemas, sacos, túbulos - que se comuniam entre si (Fig. 7.1). Em alguns lugares, a c~unicação é direta e em outros é mediada por
yeskulas transportadoras. Estas se origi~IB d~ um ~omRartiment~s.e_tr.ansfe.r.e_m par~utro
em_yirtude de processos que-envol-vem-a perda @-0.ganho-de-membr.anas.
~ As vesículas transportadoras funcionam da seguinte maneira (Fig. 7.2): 1) brotam da membrana de um compartimento, chamado doador; 2) viajam pelo citosol em busca .de outro compartimento chamado receptor, com cuja membrana se fundem. Em conseqüência, uma parte da membrana e uma parte do conteúdo do compartimento doador se transferem, respectivamente, para a
membrana e para o interior do compartimento receptor. .
A Fig. 7 .1 permite ver que o compartimento doador recupera a ~mbrana perdida graças a
Yesículas recicladoras.
7-2. O sistema de endomembranas é composto por
várias organelas
\
Fig. 7.1 Organelas que compõem
o sistema de endomembranas.
Também sã@ ilustradas as
diferentes vesículas
transportadoras (setas cheias) e
recicladoras (setas pontilhadas)
que o integram.
O sistema de endomembranas é composto pelas seguintes organelas (Fig. 7 .1):
1) o retículo endoplasmático, que compreende dois setores, denominados liso
~ rugoso (devemos acrescentar, alérri disso, o envoltório ·n uclear (ou carioteca),
que será analisado no Cap. 12-2); 2) o complexo de Golgi; 3) os endossomos;
e 4) os lisossomos.
As membranas destas organelas e as das vesículas transportadoras são cons- l
tituídas por uma dupla camada lipídica similar à da membrana plasmática. Como
é óbvio, uma das faces desta membrána se relaciona com o citosol e a outra
a cavidade das organelas. Denominam-se, respectivamente,face citosólicd e face \
luminal.
_)
lAs membranas têm glicolipídios e glicoproteínas intrínsecas e periféricas que 1
representam mais de 80% de seu peso (Fig. 3.14). Os carboidratos se orientam ~
empre para a cavidade das organelas.
.
~
O tamanho do sistema de endomembranas variá nos diferentes tipos de células. É muito pequeno nos oócitos (ovócitos) , nas células pouco diferenciadas e
nas que produzem proteínas para o citosol exclusivamente, como os reticulócitos.
com(
Retículo
endoplasmático
108
•
O SISTEMA DE ENDOMEMBRANA S
Fig. 7.2 Esquemas seqüenciais
que ilustram a formação de uma
vesícula na membrana de um
compartimento doador e a fusão
da membrana vesicular com a
membrana do compartimento
receptor.
Compartimento
doador
Formação de
uma vesícula
transportadora
Fusão de
membranas
(ver Fig. 3.13 )
Comparti mento
receptor
RETÍCULO ENDOPLASMÁTICO
7-3. Generalidades
O retículo endoplasmático (RE) foi descoberto quando se introduziu a microscopia eletrônica no estudo das células. As primeiras eletromicrografias mostraram um componente reticular que
não chegava à membrana plasmática - daí os termos "retículo" e "endoplasmático" - até que se
conheceu sua verdadeira forma tridimensional. Finalmente, com o uso da radioautografia e de
técnicas de análise citoquímica quase tod~s· os seus componentes foram identificados.
O RE se distribui por todo o citoplasma, do núcleo até a membrana plasmática. É composto
por uma rede tridimensional de túbulos e sacos achatados totalmente interconectados (Fig. 7 .3).
Apesar de sua extensão e de sua intrincada morfologia, constitui uma organela indivisível, já que
possui uma membrana contínua e uma só cavidade. O citoesqueleto se encarrega de manter seus
componentes em posições mais ou menos fixas dentro do citoplasma (Cap. 5-9).
Esta organela se divide em dois setores, que se diferenciam pela ausência ou presença dos ribossomas sobre seu lado citosólico. Denominam-se, respectivamente, retículo endoplasmático
liso (REL) e retículo endoplasmático rugoso CRER) (Figs . 1.7, 1.10, 7.3 , 7.4 e 7.6). Entre eles
há um setor de transição , em parte liso e em parte rugoso.
7-4. O REL não contém ribossomas
Como acabamos de assinalar, o REL não tem ribossomas . Pode compreender uma rede de
túbulos interligados, cujo volume e distribuição espacial diferem nos diversos tipos de células.
Essa diversidade depende de suas variadas funções. Por exemplo, a célula muscular estriada contém um REL absolutamente singular - o retículo sarcoplasmático - adaptado para desencadear a contratilidade do citoesqueleto (Seção 7-26).
Fig. 7.3 Esq uema tridimensional
que mostra os setores liso (REL)
e rugoso (RER) do retículo
endoplasmático.
O SISTEMA DE ENDOMEMBRANAS
•
109
7-5. O RER está associado a ribossomas
~
O RER é muito desenvolvido nas células que realizam síntese protéica ativa. Em sua composição predominam os sacos achatados , que quando são abundantes encontram-se separados por
1_um espaço citosólico estreito repleto de ribossomas (Fig. 7.4).
Estes ribossomas estão aderidos à face citosólica da membrana do RE (Fig. 7.6). Em geral,
~c.o.mplexos_chamado_s_polisso1)1__as~_olirribos110.!!1a~ ue consistem em grupos de
~rrn:t_s enlaçados por uma m?lécula de ~ (Figs. 7.3 e 16.7) (Cap. 16-11 ). A afinidaJi.e
do E,_ER_ pelo s. ribo_sso~as deve-se à existênci~d_e r~e tQreS\ espec!f!cos _9ll~l1a::.membrnn a (Seção 7-12), que não são encontrados no REL. '
COMPLEXO DE GOLGI
7-6. Generalidades
Em 1898, utilizando um método de coloração com prata, Camilo Golgi descobriu uma estrutura reticular nas células nervosas que, posteriormente, levou seu nome. Meio século depois , com o
advento da microscopia eletrônica, do fraciônamento celular e das técnicas de análise citoquímica, puderam ser reveladas sua estrutura e sua composição molecular.
t m uma célula idealizada, o complexo de Golgi posiciona-se entre o RE e a membrana plasmática, com os endossomos e os lisossomos situados entre esta e o complexo (Fig. 1.7).JEstas
relações espaciais são o reflexo de outras de natureza funcional, já que, po{ meio de vesículas transportadoras, as moléculas provenientes do RE alcançam ó complexo de Golgi, percorrem-no, desprendem-se dele e chegam à membrana plasmática ou aos endossomo.s (Fig. 7 .1). Estes flu xos
.
1
~compreendem tanto moléculas da membrana como moléculas lumin,ais. Assim, de acordo com a
via seguida, são transferido~ fragmentos demerribrana do ~para a membrana plasmática ou para
a membrana dos endQs~o s, enquanto as moléculas provenientes da cavidade do retíeulo sã9
lançadas no meio extracelular - a este evento denomina-se secreção - ou penetram na cavidade
dos~do-Ssomos.
·
.
Como veremos, em ambos os casos, o cotnplexo de Golgi desempenha um papel fundamental,
visto que as moléculas que o percorrem sofrem modificações necessárias para suas atividades l
biológicas. Por outro lado, algumas moléculas são sintetizadas diretamente no complexo de Gol-J
gi, sem a intervenção do retículo endoplasmático.
'/
7-7. O complexo de Golgi mostra uma poli merização que se
corresponde com seu funcionamento
[ o complexo de Golgi é composto por.uma ou várias unidades funcionais chamadas dictiossomofil (do grego, dfktyon, rede, e sôma, corpo). Na célula ;;;etora polarizada, organela tem um
a
Fig. 7.4 Eletromicrografia do
retículo endoplasmático rugoso.
Observam-se os ribossomas
unidos à membrana da organela
(um deles aparece marcado com
uma seta) 208.000X. (Cortesia
de G. E. Palade.) No detalhe são
distinguidas as subunidades
menor (Me) e maior (Ma) do
ribossoma. 410.000X. (Cortesia
de N. T. Florendo.)
110
•
O SISTEMA DE ENDOMEMBRANAS
Vesículas destinadas à
membrana plasmática ou aos
endossemos
Fig. 7 .5 Representação
tridimensional do complexo de
Golgi.
e
e
/o
,,J
Ef_,.t---.L.J...._-~_.__-z
_.--- --
-Rede trans
trans
~--Cisterna
e
...-.~----------------::>-----Cisterna
média
é~~;:=============::;? ~-8
---Cisterna eis
~----Rede
g
/
Ves ícu las
provenientes do
RE
g
eis
/'
granc:l~dic_ti.osso1119 J!mco que ocupa a posição intermediária entre o núcleo e a superfície celular
onde a secreção é liberada (Fig. 1.7). Complexos de Golgi com estas características são observados, por exemplo, em células da mucosa intestinal, da tireóide e do pâncreas exócrino. Ao contrário, outras células, como os plasmócitqs, os J_ie atócitos e os neur~s , possuem vários dict!_ossomos peq_uenos distribuídos por todo o citoplasma (Fig. 1.10). N9 hepatócito existem cerca de 50
dictiossomos que representam 2 % do volume citoplasmático.
@ mbora sua localização e seu número variem nos diferentes tipos de células, os dictiossomos
apresentam características morfológicas constantes. Podem adotar uma f<2!}11a cu1va, cQmJ!face
con vexa voltada 12ara o núcleo e a ace côncava orientada para a membrana plasmática. A primeira é denominada acede entrada ou eis , e a segunda, face de saída ou trans (Figs. 7 .5, 7 .6 e 7.7).
Cada dictiossomo é composto por:
1) Uma rede eis, formada por numerosos ~ e túbulos interconectados.
2) Uma cisterna eis ligada à rede eis.
3) Uma ou mais cisternas médias independentes, o que significa que não estão ligadas entre si
nem com os demais componentes do dictiossomo.
4) Uma cisterna trans ligada à rede trans.
5) Uma rede trans similar à rede eis.
A face de entrada do dictiossomo - representada pela rede eis e a cisterna eis - somente recebe vesículas transportadoras provenientes dod
(Fig. 7.1).
Fig. 7.6 Eletromicrografia da
célula hepática de um animal
exposto a uma dieta rica em
gorduras. Observam-se vesículas
que transportam lipoproteínas, o
retículo endoplasmático rugoso
(RER), o retículo endoplasmático
liso (REL), o complexo de Golgi
(G), uma mitocôndria (M) e um
peroxissoma (P). 56.000X.
(Cortesia de A. Claude.)
O SISTEMA DE ENDOMEMBRANAS
•
111
ffendo em vista que a rede eis e a cisterna eis formam um único compartimento, as
mÕléculas incorporadas à membrana e à cavidade da organela circulam da rede ara a
cisterna por sim les continuidade. Ao cont!árió, para passar da cisterna eis para as cisternas médias e destas para a cisterna trans, as m.oléculas se valem de vesículas transp~rai}Como podemos ver nas Figs. 7.1 e 7.5, ~s vesículas nascem na borda da
cisterna eis e, após um curto trânsito pelo citosol, se incorporam na borda da cisterna
média contígua. O mesmo ocorre entre as sucessivas cisternas médias e entre a última
delas e a cisterna trans. O percurso se completa quando as moléculas chegadas à cisterna trans passam à rede trans por simples continuidade.
•
Em seguida, as moléculas que chegam à rede trans são transferidas - também por
meio de vesículas transportadoras -para a memfaana pl'asmáticalou para os endossomq~(Eig._ 7 .1 ).
No primeiro caso, as moléculas contidas no interior da vesícula são levadas para fora da célula
- ou seja, são segregadas - e as da membrana se integram à membrana plasmática. O processo de
secreção leva o .nome de exocitose'e será analisadD na Secão 7-22.
No segundo caso, a vesícula le~a seu conteúdo - que, consiste de(enzimªs hidrolíticàil - na
luz de um endossomo. Na Seção 7-30 veremos que isso transforma o endossomo em um lisossomo.
Nas seções seguintes, descreveremos as funções do RE e do complexo de Golgi (algumas ocorrem pela ação complementar das duas organelas).
FUNÇÕES DO RETÍCULO ENDOPLASMÁTICO E DO COMPLEXO DE GOLGI
7- 8. No RE ocorrem as reações centrais da síntese dos triglicerídios
Os t~iglicerídios (triacilgliceróis)* são compostos por três ácidos graxos unidos a uma mólécula de glicerol (Cap. 2-7).
Sua síntese ocorre no citosol, onde os ácidos graxos se unem à coenzima A (CoA) - mediante
uma tiocinase - e são formadas moléculas de aeil CoA (Fig. 7.8).
~-
Ácido graxo
+ CóÂ + A TP
Tiocinase
Acil CoA
+ ADP + P
Por sua vez, o glicerol se fosforila em seu C3' através de uma glicerol cinase, o que produz
glicerol 3-fosfato.
Glicerol
+ ATP
Glicerol cinasé
)
GÚcerol 3-fosfato
+ ADP
Algumas células não contam com a enzima glicerol cinase, de modo que nelas, o glicerol 3fosfato forma-se pela redução da diidroxiacetona fosfato - um produto intermediário da glicólise - mediante o glicerol fosfato desidrogenase.
Diidroxiacetona fosfato
Glicerol fosfato desidrogenase
)
Glicerol 3-fosfato
Em seguida, outras acil CoA transferem seus ácidos graxos ao Cl' e ao C2' do glicerol 3-fosfato, o qual produz ácidó fosfatídico (Cap. 2-7) (Fig. 2.13) . A reação é catalisada por uma aciltransferase.
Glicerol 3-fosfato
+2
Acil CoA __
Ac_il_
tr_an_sfi_er_as_e---7 Áciâo fosfatídico
+2
CoA
O ácido fosfatídico se insere na monocamada citosólica da membrana do RE, onde se completa a síntese do triacilglicerol (Fig. 7 .8). No primeiro termo, o ácido fosfatídico perde o fosfato por
aÇão de uma fosfatase e se converte em 1,2-diacilglicerol (Fig . 2.13) (como veremos na próxima
seção, esta molécula também é necessária para a síntese dos licerofosfoli ídios).
Ácido fosfatídico
Fosfatase
*N.RT.: Atualmente, é a denominação mais aconselhável.
1, 2- diacilglicerol
+P
Fig. 7/7 Eletromicrografia do
complexo de Golgi que permite
observar as cisternas eis, média e
trans empilhadas. 35 .000 X.
(Cortesia de D. J. Morré.)
112
•
O SISTEMA DE ENDOMEMBRANAS
Fig. 7.8 Etapas metabólicas
necessárias à síntese dos
triacilgliceróis (1, 2, 3 e 4A ) e da
fosfatidilcolina (1 , 2, 3 e 4B). As
reações 1 e 2 ocorrem no citosol.
Já, as reações 3, 4A e 4B
ocorrem na monocamada
citosólica da membrana do RER.
CoA
rr
ll
+
CoA
Acil CoA
Ácidos graxos
rr
p
1
r~iCH- CH, + CoA
p
CH,-CH-CH
1
OH
1
OH
Glicerol 3-fosfato
2
CoA
\
Ácido fosfatídico (AF)
Oiacilglice rol (DAG) + p
AF
ITff~ITIT
1
Citosol
I
1
1 Membrana do RE 1
ITITnIT IT
gguuM
UUMUM
3
DAG
ITIT~ITIT
~--
UUUMM
+
! fTT
CoA
+ CoA
Triacilglicerol (TGL)
(traslad a-se para o citosol)
4A
DAG + COP-colina -
Fosfatidilcolina + CMP
1
IT ~IT IT
IT ITnITIT
IT
guuMM
MUUM
M
48
Finalmente, por intermédio da diacilglicerol aciltransferase, uma nova acil CoA transfere seu
ácido graxo ao C3' do 1,2-diacilglicerol. Isso completa a síntese do triacilglicerol que passa ao
citosol (Cap. 4-3).
1, 2- diacilglicerol
+ Acil CoA
Diacilglicerol aciltransferase
)
Triacilglicerol
+ CoA
É necessário advertir que nas células da mucosa intestinal, a maioria dos triacilgliceróis é sintetizada abolindo-se as etapas iniciais, já que o fazem a partir dos monoacilgliceróis e diacilgliceróis , que são as formas como as gorduras são absorvidas depois de sua digestão.
7-9. O RE é responsável pela biogênese das membranas celulares
A célula produz membranas novas de modo permanente. Ela o faz com a finalidade de atender demandas de natureza funcional , substituir as membranas desapareCidas por envelhecimento
ou para duplicá-las antes da mitose. Ocasionalmente, as membranas novas são produzidas para
possibilitar o desenvolvimento de partes do corpo celular (por exemplo, o axônio nos neurônios).
A_biQgênese-das membranas celular~_compr_eende_a síntese de seus li ídios, suas proteínas e
s~l!S carboidratos. Estes três tipos de moléculas não são ·sintetizados separadamente e em seguida
O SISTEMA DE ENDOMEMBRANAS
se integram para formar uma membrana nova, e sim que são incorporados a uma membrana preexistente, a membrana do RE. Depois, à medida que esta cresce, algumas de suas partes se desprendem como vesículas e se transferem às demais organelas do sistema de endomembranas ou à
membrana plasmática. Nos Caps. 8-24 e 10-5 veremos que o RE também fornece os fosfoli ídios
daun.emhi:.a~!_ocô~~oxiss0mas .
Nas próximas seções estudaremos os mecanismos de incorporação dos lipídios e das proteínas
à membrana do RE, e os processos de glicosilação de ambas as moléculas.
7- 1O. Os lipídios das membranas celulares são sintetizados
na membrana do RE
Fosfatidilcolina. Devemos lembrar que os glicerofosfolipídios são compostos por uma molécula de glicerol, dois ácidos graxos , um fosfato e um segundo álcool (Caps. 2-7 e 3-3) (Figs. 2.14
e 2.20).
A fosfatidilcolina é formada na monoca ada citosólica do RE pela ligação do 1,2-diacilglicerol (Seção 7-8) com a citidina difosfato-colina. A reação é catalisada por uma fosfotransferase
específica (Fig. 7.8).
Fosfotransferase
1, 2- diacilglicerol + CDP - colina - - - - ------ Fosfatidilcolina + CMP
Previamente, a CDP-colina é sintetizada em duas etapas. Na primeira, mediante UJ11a cinase, a
colina é fosforilada com um fosfato adquirido da adenosina trifosfato.
Cinase
Colina+ ATP
Fosforilcblina + ADP
Na segunda, a fosforilcolina combina-se com a citidina trifosrato mediante uma transferase.
~
Transferase
Fosforilcolina + CTP
CDP - colina +PP
Fosfatidiletanolamina. As reações que levam à formação da fosfatidiletanolamina são similares às da fosfatidilcolina , exceto pelo fato de que se agrega CDP-etanolamina no lugar da CDPcolina.
Fosfatidilserina. Na formação da fosfatidilserina, o ácido fosfátídico (Seção 7-8) não perde
seu fosfato e se combina - mediante uma transferase específica - com a CTP, o que gera CDP1,2-diacilglicerol.
,.
Acido fosfatídico + CTP
Transferase
- - - --->
CDP-1,2-diacilglicerol +PP
O fosfolipídio é formado após a combinação de CDP-1,2-diacilglicerol com o aminoácido serina por meio de outra transferase.
Transferase
Serina + CDP-1,2 - diacilglicerol
Fosfatidilserina + CMP
Fosfatidilinositol. As reações responsáveis pela síntese do fosfatidilinositol (PI) são similares
às da fosfatidilserina, exceto porque se acrescenta o poliálcool cíclico inositol em lugar da serina.
Este.fosfolipídio converte-se emfosfatidilinositolfosfato (PIP) , emfosfatidilinositol difosfato (PIP2) e emfosfatidilinositol trifosfato (PIP 3) pela agregação sucessiva de fosfatos (Fig. 2.16).
Estas fosforilações são catalisadas por cinases com fosfatos tomados de moléculas de ATP.
PI+ ATP
PI+ ATP
PIP2 + ATP
Cinase
Cinase
Cinase
PIP + ADP
PIP2 + ADP
PIP3 + ADP
Uma vez formadas, a maioria das fosfatidilcolinas passa, por meio do mecanismo de ~'fji,p~f/.op"
(Cap. 3-3),_dª monocamada citosólica para a monocamada luminal da membrana do R'.E. A trans-
•
113
114
•
O SISTEMA DE ENDOMEMBRANAS
locação é impulsionada por uma enzima denominada flip_ase, que toma possível a passagem da
cabeça polar do fosfolipídio pela região hidrófoba da dupla camada.
Por atuar menos eficientemente sobre a fosfatidiletanolamina, a fosfatidilserina e o fosfatidilinositol, em sua maioria esses fosfolipídios ficam retidos na monocamada citosólica (Cap. 3-3).
Assim, o processo de translocação tem dupla conseqüência: faz com que seja emparelhada a
quantidade de fosfolipídios em ambas as monocamadas e que seja distribuída assimetricamente.
Esfingomielina. A esfingomielina é um esfingofosfolipídio composto por ceramida unida à
fosforilcolina (Fig. 2.18) . No Cap. 2-7, vimos que a ceramida é formada pela agregação de um
ácido graxo com a esfing_9sina, que é um aminoálcool dõtãdo de uma cadeia hidrocarbonada longa (Fig. 2.19).
A ceramida é formada na monocamada citosólica da membrana do RE por meio de uma transferase.
Esfingosina
Transferase
+ Acil CoA
Ceramida
+ CoA
A s ínt~se da esfingomielina se completa no ladoJJJJn!~l do complexo de Golgi, de modo que a
se translocar - g!:_aças à flipase - abandonar a membrana do RE e se transferir para
a membrana do complexo. Como sabemos, esta transferência é realizada mediante vesículas transportadoras.
Em sua nova localização , a ceramida se combina com a fosforilcolina graças a outra transferase, que a converte em esfingomielina.
q~rqmida_deve
Ceramida
+ Fosforilcolina
Transferase
Esfingomielina
Colesterol. A membrana do RE incorpora moléculas de colesterol ingressadas na célula por
endocitose (Seção 7-42) e também as sintetiza. Como na transferência de fosfolipídíos, o colesterol se transfere para as membranas restantes da célula - especialmente a membrana plasmática
- por meio de vesículas transportadoras.
7-11. Os lipídios das membranas celulares se glicosidam
no complexo de Golgi
A~gliçolipídios o~ no complexo de Golgi. Na formação dos galactocerebrosídios
(Fig. 2.21) intervém uma transferase, que transfere a galactose da uridina difosfato-galactose para
a primeira hidroxila da ceramida.
Ceramida
+ UDP - galactose
Transferase
Galactocerebrosídio
+ UDP
A síntese dos glicocerebrosídios (Fig. 2.21) é similar, salvo pelo fato de que a glicose é transferida da UDP-glicose mediante outra transferase.
Ceramida
+ UDP- glicose
Transferase
Glicocerebrosídio
+ UDP
Os gangliosídios (Fig. 2.22) §_ão formados q_uando os monômeros das cadeias oligossacarídiçªs _se unem - um de cada vez - i!_~jda . O primeiro monômero que se agrega é a glicose;
depois o fazem-::- em diferentes quantidades e ordenamentos, segundo o tipo de gangliosídio a galactose, a N-acetilglicosamina, a N-acetilgalactosamina, o ácido siálico ou N-acetillleuramínico
e a fucose (Cap. 2-7).
Igualmente à galactose e à glicose dos cerebrosídios, os monossacarídeos que participam da síntese dos gangliosídios apresentam-se unidos a nucleotídeos (por exemplo, UDP-glicose, UDP-galactose, UD P-N-acetilglicosamina, UDP-N-acetilgalactosamina, CMP-ácido siálico e G DP-glicose).
7-12. As proteínas destinadas ao RE se inserem na membrana ou são
liberadas na cavidade da organela
8-~ P_!~eínas,
bos~mas
exceto algumas poucas pertencentes às mitocôndrias, são sintetizadas nquido citosol (Cap. 16~9). Apesar de todos os ribossomas citosólicos serem iguais, alguns
O SISTEMA DE ENDOMEMBRANAS
•
115
Fig. 7.9 União do ribossoma com a membrana do RER. Observar o receptor da PRS , o receptor do
ribossoma e a passagem da proteína através do translócon.
estão dispersos no citosol e outros se acham aderidos à membrana do RER (Fig. 16.8). Em seguida, veremos porquê e corria.
Os primeiros passos da síntese de uma proteína destinada ao RE ocorrem no ribossoma quando
este ainda se encontra livre no citosol. A união do ribossoma com a membrana do RE ocorre se a /
proteína que surge do ribossoma possuir um segmento peptídico com a informação apropriada, ou
seja, um peptídeo sinalizador (peptídeo-sinal) específico para essa membrana (Cap. 4-4). Nas
proteínas destinadas ao RER, o peptídeo sinalizador pode consistir de uma seqüência de cerca de
30 aminQácidos - 5 a 10 altamente hidrófobos - situada na extremidade amina oú próxima dela
(Quadro 4.1).
As proteínas que são liberadas na cavÍdade do RER possuem este sinal localizado somente no
extremo Jmina da molécula. Ao contrário, as que se inserem na membrana da organela contêm,
salvo rafas exceções, um peptídeo sinalizador próximo à extremidade amina e outros sinais, cujo
número depende da quantidade de vezes que a proteína cruza a dupla camada lipídica (Fig. 3.10).
Por exemplo, se a proteína transmembrana atravessar a dupla camada uma única vez (passagem
única), necessita apenas de um sinal ~dicional,' chamado sínal de arrcora em por motivos que'
veremos adiante. Quando se trata de uma proteína de passag~m ~últipla, esta contém tantos sinais quantas vezes ela cruze a dupla camada, consistentes no ~ e2tídeos _sinalizq_dores que se altem m com sinais de ancoragem. Os sinais de ancoragem contêm seqüências de aminoácidos muito
semelhantes às dos peptídeos sinalizadores (Quadro 4.1).
Quaisquer que sejam o número e a localização dos sinais, apenas o primeiro peptídeo sinalizador
que sai do ribossoma é reconhecido pela p ª-r~reconhecimento do sinal (ou PRS) (Fig. 7 .9),
que é um complexo ribonucléico composto por seis proteínas diferentes e uma molécula de RNA
denominada RNAcp (citosólico pequeno; ou scRNA , do inglês, small cytosolic) (Fig. 7 .1 O). As características e o processamento deste RNA serão analisados nos Caps. 13-2, 14-18 e 15-12.
Na Fig. 7.9 podemos observar como a: PRS ligada ao peptídeo sinalizador se dirige p<:µ"a o RER
e se une à sua membrana mediante receptor específico. Esta ligação consome energia, que é cedida por um O.TI hidrolisado por uma GTPase presente no receptor.
A mesma figura permite ver como a PRS arràsta o ribossoma para o RER (na Seção 7-5 disse::mos que a membrana desta organela possui receptores para os ribossomas) e cumpre outra importante função: detém a síntese da proteína para que esta não saia do ribossoma, já que fora dele se
dobraria e não poderia ingressar no RER.
.
Ainda naquela figura vê-se que quando o ribossoma se une ao seu receptor, a PRS se separa do
seu. Tendo em vista que a PRS se separa também do peptídeo sinalizador, é retomada a síntese da
proteína, cujo extremo sai do ribossoma e ingressa em um túnel protéico que cruza a membrana
do RER (Fig. 7.9). No Cap. 3-9 dissemos que os túneis deste tipo - utili z_a~_Qs_pe1ª.s_proteínas
para_atravessar as membranas das organelas - são denominados translócons. O translócon do
Fig. 7.10 Composição da
RER se diferencia dos translócons de outras organelas porque se associa ao receptor do ribosso- partícula de reconhecimento do
ma, com o qual forma um complexo unificado (Fig. 7.9).
sinal (PRS). Os círculos
Voltando à PRS, ao se separar de seu receptor (e do peptídeo sinalizador) pode ser usada nova- correspondem às seis proteínas
mente. Algo similar ocorre com o ribossoma no final da síntese da proteína (Fig. 7.9).
que acompanham o RNAcp.
r
b
116
•
O SISTEMA DE ENDOMEMBRANAS
7- 13. As proteínas destinadas ao RE contêm um ou mais sinais
dependendo de que sejam liberadas na cavidade da organela ou
inseridas em sua membrana
·--
)
Como dissemos na seção anterior, as proteínas destinadas à cavidade do RER têm um único
peptídeo sinalizador localizado na extremidade amina. Portanto, o segmento da molécula que ingressa primeiramente no translócon inclui, inevitavelmente, o peptídeo sinalizador, confo1me
mostra a Fig. 7.11.
Como o peptídeo sinalizador permanece no transiócon, quando os segmentos protéicos que o
seguem ingressam na cavidade, dobram-se como uma forquilha. Em seguida, visto que o peptídeo sinalizador é cindido por uma protease conhecida como Reptid_aS~l! Ín,!lliza_ctora (peptidase
sinal), o peptídeo se perde e é gerada na proteína uma nova extremidade amlna, @e passa à ca'dslade (FÍg. 7~l). Finalmente, esta rec~e os s.egmentos restantes da prote'ma, cuja sínte~on­
tinua no ribossoma pela incessante agregação de aminoácidos em sua extremidade carboxila (Cap.
16-13).
Ao término da síntese, a proteína é liberada na cavidade do RER (Figs. 7 .9 e 7 .11 ). Segundo a
natureza da proteína, esta permanecerá no RE ou se dirigirá, utilizando vesículas transportadoras,
ao complexo de GÓTgi , onde residirá de forma permanente mi se transferirá, também por meio de
vesículas transportadoras, para um endossamo ou para a membrana plasmática, no último caso
para sua secreção.
Na seção anterior, também dissemos que, salvo exceções, as proteínas destinadas à membrana do RER possuem um peptídeo sinalizador na extremidade amina e um ou mais sinais adicionais. Tais proteínas se inserem na membrana do RER por algum dos seguintes mecanismos (Figs.
7.12, 7.13 e 7.14).
Se a proteína possuir somente um sinal adicional , esta se ancora na dupla camada lipídica daí o nome de sinal de ancoragem - e o_peptídeo sinalizador é cindido pela peptida_'.'e sinalizadora
(peptidase sinal). Como conseqüência, forma-se umá proteína transmembrana de passagem única (cruza a dupla camada somente uma vez), ,com a extremidade amina dirigida para a êaVidade
d~ ~ extremidac:Le carboxila no lado citosólico (Fig. 7.12A).
Algumas proteínas transmembrana de passagem única estão orientadas ao contrário, ou seja,
com a extremidade amina para o lado citosólico. Este tipo de proteína conta apenas com o peptídeo sinalizadot, e não na extremidade amina, porém próximo a ela. A Fig. 7 .1·2B mostra a conversão do peptídeo sinalizador em sinal de ancoragem e os passos que deve seguir para se inserir na
dupla camada lipídica. O peptídeo sinalizador não é cindido pela peptidase sinal devido a sua posição
interna na cadeia protéica.
A formação de uma proteína transmembrana de passagem dupla exige um peptídeo si_!!ajizador-si.tuado nas-cercanias da_extremidade amina e de um sinal adicional (Fig. 7 .13). Dada a sua
posição interna na cadeia protéica, o peptídeo sinalizador tampóuco é afetado pela peptidase sinal, motivo pelo qual se comporta como um sinal de ancoragem fica retido na dupla camada
lipídica.
A formação de uma proteína de passagem múltipla necessita, além_dQ..pept:fdeo sinalizàdor, de
u~úmero variado de sinais adicionais, tantas (menos uma) quantas sejam as vezes que a proteína deva atravessar a membrana. Como nas proteínas de passagem múltipla, trata-se de sinais de
e
CITOSOL
Peptídeo
sinalizador
Fig. 7.11 Esquema que ilustra a
entrada das proteínas na
cavidade do RER.
CA VIDADE DO RE
-
------
-
--------
O SISTEMA DE ENDOMEMBRANAS
•
117
Fig. 7.12 Esquemas que
mostram como as proteínas se
incorporam à membrana do
RER. A extremidade amina da
proteína pode ficar na cavidade
da organela (A) ou no citosol
(B) .
NH 2
mmí!flm mmnnm
mmirnm YmRmm
COOH
ancoragem, a metade dos quais - alternadamente - atua como peptídeos sinalizadores antes de
se ancorar na dupla camada lipídica (Fig. 7.14).
Os sinais adicionais que atuam como peptídeos sinalizadores seriam dirigidos para a membrana do RER por sucessivas PRS, e todas abordam a membrana pelo mesmo translócon. Para isso,
à medida que os novos sinais ingressam rio translócon, os. sinais precedentes saem lateralmente e
se localizam entre os fosfolipídios da dupla camada lipídica (Fig. 7 .14). A saída lateral dos sinais
é possível porque a parede do translócon é incompleta.
No c ; p. 3-4, mencionamos que os segmentos das proteínas que atravessam a dupla camada
lipídica poss uem geralmente uma estrutura em hélice ex. Agora podemos acrescentar que no momento adequad~ atuarão como peptídeos sinalizadores ou como sinais de ancoragem.
De acordo c0m a natureza da proteína, esta permanecerá na membrana do RE ou passará para
a membrana de outra organela do sistema de endomembranas ou para a membrana plasmática.
Segundo a Fig. 7.2, qualquer que seja seu ?estino, a proteína terá a mesma orientação de quando
se encontrava na membrana do RE.
Algumas proteínas podem ficar retidas na membrana plasmática ou ser segregadas. Por exemplo, a imunoglobulina produzida pelo linfócito B primeiramente atua como um receptor de membrana e, em seguida, é segregada (ou seja, converte-se em um anticorpo). Em ambas as etapas, a
molécula é praticamente idêntica, salvo pelo fato de que na primeira, há um segmento adicional
que a mantém ancorada na membrana. Este segmento corresponde a um sinal de ancoragem próximo à extremidade carboxila da proteína, inexistente na imunoglobulina que é segregada (Cap.
15-7).
Fig. 7.13 Mecani smo de inserção
das proteínas de passagem dupla
na membrana do RER.
NH 2
COOH
Fig. 7.14 Mecanismo de inserção
das proteínas de passagem
múltipla na membrana do RER.
118
•
O SISTEMA DE ENDOMEMBRANAS
7-14. Polipeptídeos fabricados por ribossomas livres no citosol se
incorporam ao RE
Como exceção à regra, há polipeptídeos - geralmente de tamanho muito p·equeno - que ingressam no RE apesar de fabricados por ribossomas livres no citosol. Incorporam-se ao RE por
túneis constituídos por proteínas transportadoras da família ABC (Cap. 3-26), presentes normalmente na membrana desta organela.
7-15. As chaperonas hsp70 asseguram a dobradura normal das
proteínas na cavidade do RE
No Cap. 4-5 analisamos as funções das chaperonas hsp70 citosólicas. A cavidade do RER conta com ch~erQ1:1:ª~-~p70 similares.,_pois evitam o pregueamento prematuro ou incorreto das proteínas ingressadas nas organelas. Ademais, reconhecem nelas segmentos incorretamente dobrados e as ajudam para que o façam corretamente.
Se as chaperonas não obtiverem êxito, as proteínas mal dobradas passam do RER para o citosol depois de atravessar o translócon que usaram para ingressar na organela. Este fenômeno recebe o nome de retrotranslocação. No citosol, as proteínas se conjugam com ubiquitinas e são
degradadas por proteassomas (Cap. 4-6).
sín~
7-16. A
o processamento dos oligossacarídeos ligados a
proteínas mediante ligações N começam no RER e terminam no
complexo de Golgi
A maioria das proteínas que ingressam no sistema de endomembranas incorpora oligossacarídeos a suas moléculas, de modo que se convertem em glicoproteínas.
Como vimos no Cap. 2-6 os oligossacarídeos se unem às proteínas mediante ligações N-glicosídicas e 0-glicosídicas (Figs. 2.7 e 2.8).
A ~íntese do~QligQssacarídeos que se unem por ligações N-glicosídicas_começa.nu_RER_e ter.!!1.i!i~ .!!º complexo de Golgi. Dela participam enzimas chamadas glicosiltransferases, que tomam
monossacarídeos de moléculas doadoras e os transferem à cadeia oligossacarídica em crescimento. Como nos glicolipídios, a moléculas doadoras são nucleosídeos: UDP (par~ a glicose, a galactose, a N-acetilglicosamina e a N-acetilgalactosamina), GDP (para a manose e a fucose) e CMP
(para o ácido siálico) (Seção 7-10).
Além disso, intervém o dolicol fosfato (Cap. 2-7), um lipídio especial da membrana do RER
que a atravessa umas t,rês vezes (Figs. 2.2.4 e 7 .15). O p1imeiro monômero do futuro oligossacarídeo
é a N-acetilglicosamina e se liga ao fosfato do dolicol. Em seguida, um de cada vez, são agregados outros seis monossacarídeos, primeiro uma nova N-acetilglicosamina e, depois, cinco manoses.
Como mostra a Fig. 7 .15, a ligação do dolicol fosfato com a primeira N-acetilglicosamina se realiza por meio de outro fosfato - cedido pela UDP que doa a hexose - e, por isso, se forma uma
ponte pirofosfato.
Enquanto isso, outros dois dolicóis fosfato aceitam, respectivamente, quatro manoses e três
glicoses, que também se incorporam uma de cada vez.
Em seguida, no interior do RER, depois de se desprender de seus respectivos dolicóis, as cadeias de quatro manoses e três glicoses - nessa ordem - se somam ao heptassacarídeo do dolicol
difosfato que, portanto, se converte em um oligossacarídeo de 14 unidades, composto por duas Nacetilglicosaminas, nove manoses e três glicoses (Fig. 7 .15). Este oligossacarídeo se desprende
do dolicol difosfato e, mediante uma oligossacariltransferase, se liga a uma das asparaginas de
uma proteína da membrana do RER (Fig. 7.16).
Por seu turno, os três dolicóis livres podem ser utilizados de volta pelo RER para a síntese de
novos oligossacarídeos.
A cadeia oligossacarídica ligada à proteína se processa, ou seja, sofre uma série de mudanças.
Essas começam com a remoção das três glicoses e de uma a quatro das nove manoses. A glicose
distal é removida pela cx-glicosidase I, as outras duas pela cx-glicosidase II e as manoses pela cxmanosidase.
-
-
--
-----
O SISTEMA DE ENDOMEMBRANAS
CITOSOL
HHHF!;íl íl~fiftITITHtt~Hfiu11
HHITüRfiffHHHü W íl~HHIT
1
YllHYR~llMY~~~= ij }illlYYRMYgilYH~llllY
fosfato
CAVI DADE DO RE
•
119
Fig. 7.15 Começo da síntese dos
oligossacarídeos que se ligam a
proteínas da membrana do RER
mediante ligações N glicosídicas. Observar a
participação dos três dolicóis
fosfato .
.....
HHfiH 11 HfiftITUITftüüHIT11 HHHüffITHHHHü~
1HHHIT
MilYYli MilYMYRMMilYYY MllllYllililYllilYll YilliY
p
p
} N-acetilglucosaminas (2)
} ""º'" ,,,
cxg }
Glicoses (3)
A cadeia remanescente continua se processando no complexo de Golgi, a cuja membrana chega a glicoproteína mediante uma vesícula transportadora. No complexo de Golgi, a cadeia
oligossacarídica experimenta novos agregados e remoções de monossacarídeos, distintos segundo o tipo de glicoproteína a se formar. No entanto, em todos os casos a cadeia conserva as duas Nacetilglicosaminas e as três manoses proximais do oligossacarídeo original, e geralmente agrega
ácidos siálicos nas extremidades da molécula ramificada (Fig. 7.17) (Cap. 2-6) .
No complexo de Golgi, as enzimas responsáveis pelo processamento dos oligossacarídeos trabalham seqüencialmente e por isso se acham distribuídas entre a região de· en~rada e a região de
saída da organela seguindo a ordem em que atuam (Fig. 7 .18).
Fig. 7.16 Esquema que ilustra
como o oligossacarídeo
precursor (de quatorze hexoses)
se desprende do dolicol e se liga
a uma proteína da membrana do
RER. Asn, asparagina.
120
•
O SISTEMA DE ENDOMEMB RAl AS
Fig. 7.17 Uma vez formado , o
oligossacarídeo precursor (de
quatorze hexases) é processado
seqüencialmente no RER e nos
sucessivos compartimentos do
complexo de Golgi. Esta figura
ilustra três exemplos de
oligossacarídeos formados ao
fina l deste processamento. Asn ,
asparagina.
- - Asn - -
O
O
O
O
N-acetilglucosamína
Manose
Galactose
Ácido siálico
1
-~
- - Asn- -
Não são conhecidos os mecanismos reguladores que levam as glicoproteínas a sofrer um tipo
de processamento e não outro.
7-17. A síntese dos oligossacarídeos ligados a proteínas por
ligações O ocorre no complexo de Golgi
No Cap. 2-6 vimos que os o1igossacarídeos unidos a proteínas por ligações 0-glicosídicas se
ligam a uma serina ou a uma treonina. Sua síntese ocorre na cavidade do complexo de Golgi pela
agregação - por meio de glicosiltransferases específicas - de sucessivos monossacarídeos. Primeiramente, umà N-acetilgalactosamina se liga ~ma proteína da membrana da organela e, em
seguida - um por vez - são agregados os outros monossacarídeos. Geralmente, a cadeia
oligossacarídica incorpora ácidos siálicos em sua periferia.
7-18. A síntese das glicosaminoglicanas e das proteoglicanas
ocorre no retículo endoplasmático
As proteoglicanas são glicoproteínas formadas pela união de proteínas com glicosaminoglicanas (GAG). Como já assinalamos no Cap. 2-6 as GAG são polissacarídeos complexos constituídos por uma sucessão de unidades dissacarídicas (Fig. 2.10). Ligam-se às proteínas por intermédio de um tetrassacarídeo composto por uma xilose, duas galactoses e um ácido glicurônico
(Fig. 2.11 ).
A síntese das proteoglicanas ocorre na c_a'lidade do retículo endoplasmático. Ali, mediante uma
ligação 0 -glicosídica, a xilose do tetrassacarídeo se liga a uma serina de uma proteína localizada
na membrana da organela. Em seguida, na extremidade do tetrassacarídeó correspondente ao ácido glicurônico se incorporam, através de outras glicosiltransferases específicas, os sucessivos
monossacarídeos que se alternam na GAG, um de cada vez. Aparentemente, os grupos sulfato se
agregam às GAG à medida que estas se alongam.
Podem estar associadas mais de cem GAG a uma única proteína e, ocasionalmente, várias desc
tas proteoglicanas se ligam a uma molécula de ácido hialurônico - que é a GAG de'illaior tamanho - o que origina agregados moleculares de enormes proporções (Cap. 6-3) (Fig. 6.1).
As proteoglicanas passam para a membrana plasmática, onde fazem parte do glicocálice (Cap.
3-8) (Fig. 3.14). Daí, muitas são liberadas para o meio extracelular, para o qual suas moléculas
devem ser cindidas , já que se trata de glicoproteínas integrais (Cap. 3-4).
Nos tecidos conjuntivos, as proteoglicanas que são liberadas passam para a matriz extracelular
(Cap. 6-3) , enquanto em alguns epitélios de revestimento fazem parte do muco que protege e lu-
LADOTRANS
Fig. 7.18 Exemplos de
agregações e remoções de
moléculas em um
oligossacarídeo à medida que
passa pelos sucessivos
compartimentos do complexo de
Golgi.
_
õ
_F)_:
C
~e
Agregação de ácidos graxos
~'-----Agregação de galactoses
-----=::J
Agregação de N-acetilglicosaminas
Ü ,._~ C:-:: ~:
_ _ ?_
r-'
-" Ag- r-eg_a_ção e remoção de manoses
. ._. . L
~) L. ~
LADO CIS
Fosforilação de manoses
O SISTEMA DE ENDOMEMBRANAS
•
121
brifica sua superfície. Observa-se que, às vezes , retomam às células e são reintegradas no glicocálice, onde ficam aderidas como glicoproteínas periféricas.
7-19. Algumas proteínas são processadas no RE e no complexo de ~olgi
!la
Antes de serem segregadas, algumas proteína~ sofrem uma série de modificações.imprescindíveis ao seu funcionamento normal. Por exemplo , nas células 13 das ilhotas_do pân~as é sintetizada a p~lina, que é o pró-hormônio precursor da insulina (Fig. 7 .19). To RE, ao serremovido de sua extremidade amina, um segmento de 26 aminoácidos - correspondente ao peptídeo sinalizador - a pré-pró-insulina se converte em pró-insulina. Esta contém 81 aminoácido.s,
51 dos quais pertencem à insulina ativa e 30 a um peptídeo de conexão chamado peptídeo C. Por
meio de vesículas transportadoras, a_pIÓ.=iDS.!J.lina _Q<!Ssa do RE ao complexo de Golgi, onde uma
enzima hidrolítica específica separa a insulina do peptídeo C. Em seguida, por meio de outras
vesículas transportadoras, amba as moléculas são conduzidas até a membrana plasmática para a
sua secreção.
No Cap. 16-23 descreveremos o processamento pelo qual passa outro py3~hormônio , a pró-
'ri-
opiomelanocortina (POMC).
)()
e
!m
!ia
:li-
;tierico
ma
ida
tCl-
rns
1 se
7-20. No sistema de endomembranas, as proteínas são classificadas
segundo sua natureza química e seu destino
Na Seção 7- 13 , definimos as diferentes vias seguidas pelas proteínas depois de sua incorporação no RER. Estas molécul as, exceto as que se estabelecem cômo residentes permanentes no RE
ou n; complexo de Golgi , alcançam a extremidade de saída deste último , onde se classificam para
o seu posterior despacho. Segundo sua natureza, terão como des tino incorporar-se a um endossomo
ou se dirigir a uma superfície celular (Fig. 7 .1 ).
Os itinerários seguidos pelas proteínas dependem de certos sinais em suas moléculas e de receptores específicos nos lugares por onde passam.
O primeiro sinal foi descoberto nas enzimas hidroÍíticas destinadas aos endossomos. Como
veremos na Seção 7-30, depois de chegar a um setor específico da região de saída do complexo de
Golgi, estas proteínas são transferidas - por meio de vesículas transportadoras - a endossomos
carregados com substâncias endocitadas na superfície celu lar.
Por que as vesículas que transportam enzimas hidrolíticas destinadas aos endossomos se fundem com eles e não se dirigem para a membrana plasmática? Considere-se que, em um segundo
caso, poderiam ser segregadas para o meio extracelular e causar graves conseqüências. A resposta
lesna-
'.ap.
tlas
1lar
lu-
o
ü
Pré-pró -insulina
í=
· <(
::;;
(/)
5a..
oo
z
w
g
:::i
ü
'E;
a:
-
Peptídeo
sinalizador
Pró-insulina
a
_J
o
CJ
w
. . . . . . - - - - - - - - - Peptídeo C
o
oX
w
_J
a..
::;;
o
ü
Insulina
Fig. 7.19 Formação da insulina
como produto final do
processamento da pré-próinsulina no RE e no complexo de
Golgi das células 13 das ilhotas
pancreáticas.
122
•
O SISTEMA DE ENDOMEMBR ANAS
Fig. 7.20 Traslado das proteínas
provenientes do RE através das
organelas restantes do sistema de
endomembranas, sua
classificação no complexo de
Golgi e seus lugares de destino.
Na proteína (enzimática)
destinada ao endossamo ilustrase também o sinal (é uma
manose 6-fosfato) que determina
seu itinerário con-eto. EStão
incluídos os processos de
endocitose e de exocitose, este
último em suas duas
modalidades, a secreção
constitutiva e a secreção
regulada.
"
MEMBRANA
PLASMÁTICA
ENDOSSOMO
<-----e=>·----
@--+
DO RE
~ocitose
V.R.
~
--------------------.0--------------------· •
Secreção constitutiva
ReceP.tor
----------------
.; ,; ;-------- ·9
0 --
Sinal
~:~;::
~
-(
fC
lnâutor
I
Enzima hidrolítica
MP
Manose 6-fosfato
Receptor para a MP
V.R. Vesícula reciclad ora
•
Proteína de exportação
•
Proteína de exportação
envolve vários processos, porém a causa responsável pela condução das enzimas até o lugar adequado é a presença de grupos manose 6-fosfato em suas moléculas.
Estes grupos são os sinais que conduzem as enzimas até a região de saída do complexo de Golgi
e as colocam nos setores reservados para seu envio aos endossamos (Fig. 7.20).
A manose 6-fosfato se forma depois que a enzima hidrolítica - provéniente do RE - chega à
região de entrada do complexo de Golgi (Fig. 7.18). É gerada pela ação de duas enzimas, a Nacetilglicosamina fosfotransferase e a N-acetilglicosamina glicosidase. A primeira agrega uma Nacetilglicosamina fosfato ao C6' de uma das manoses dos oligossacarídeos da enzima hidrolítica
(como vemos, esta é uma glicoproteína). A segunda remove a N-acetilglicosamina, porém não o
fosfato, que fica retido no C6' da manose. Convém lembrar que durante o processamento das
enzimas no complexo de Golgi, as manoses fosforiladas nunca são removidas.
Uma vez chegada a enzima hidrolítica ao lugar correto da região de saída do complexo de Golgi,
ela se liga - pela manose 6-fosfato - a um receptor específico presente na membrana da organela, que corresponde a esse lugar. Depois a enzima é despachada para o endossamo mediante o
mecanismo seletivo que será analisado na Seção 7-40.
A importância da chegada das enzimas hidrolíticas aos lugares corretos do complexo de Golgi é
confirmada pela existência de uma rara doença lisossômica que é produzida pela falha dessa função.
Assim, na doença das células I (de inclusão) (ou enfermidade I), por causa dos transtornos genéticos, os fibroblastos não contam com N-acetilglicosamina fosfotransferases , de modo que não se
formam manoses 6-fosfato nas enzimas hidrolíticas destinadas aos endossamos. Como conseqüência, as vesículas que transportam essas enzimas se dirigem para a membrana plasmática e são segregadas no meio extracelular. A falta de enzimas nos endossamos impede a digestão das substâncias
endocitadas, que passam ao citosol e podem se acumular como inclusões (Cap. 4-3).
A descoberta da manose 6-fosfato e de seu receptor levou ao achado de outros sinais envolvidos na distribuição e na canalização das proteínas pelo sistema de endomembranas, fatos estes
mencionados no Quadro 7 .1.
7-21. As vesículas transportadoras originárias do complexo de Golgi se
unem aos endossomos
Na seção anterior assinalamos que o lado de saída do complexo de Golgi emite vesículas transportadoras destinadas aos endossamos e à membrana plasmática (Fig. 7.1).
As vesículas que se unem aos endossamos integram, dentro do sistema de endomembranas,
um subsistema importantíssimo para o funcionamento da célula, dedicado à digestão das substâncias que ingressam por endocitose, o que será analisado a partir da Seção 7-28.
O SISTEMA DE E DOMEMBRA AS
•
123
Quadro 7 .1 Alguns sinais envolvidos no transporte de proteínas pelo
sistema de endomembranas
Sinal
Transporte
KDEL
D o RE para o complexo de Golgi e retom o ao RE
KKXX
GPI
Manose 6-fo sfato
Várias L e Y
YQRL
NPXY
Do complexo de Golgi à membrana plasmática (secreção)
Do complexo de Golgi aos endossamos (enzimas hidrolíticas)
Da membrana plasmática aos endossamos (endocitose)
~
D , ácido aspártico; E. ácido glutâmico: K. lisina: L. leucina: N. asparagina: P. prolina: Q. glutamina: R. arginina: Y. tirosina: X.
qualquer ami noácido; GP/. glicosilfosfatidilinositol.
7-22. As vesículas transportadoras destinadas à superfície celular
descarregam seu conteúdo fora da célula mediante um processo
chamado exocitose
à
a
[)
i.
[)
é
t.
e
1-
:-
Uma boa parte das vesículas transportadoras oriundas da face de saída do complexo de Golgi
tem como destino a membrana plasmática.
De acordo com o estudado na Seção 7-1 deduzimqs que as membranas dessas vesículas são
transferidas para a membrana plasmática e que as moléculas solúveis contidas em suas cavidades
saem para o exterior (são chamadas "moléculas de exportação") .
A vesícula transportadora expulsa seu conteúdo para fora da célula por um processo denominado exocitose, que se dá com a fusão da membrana da vesícula com a membrana plasmática (Fig.
7.2) e a descarga do conteúdo vesicular no meio exterior (Fig. 7.20).
Às vezes, a quantidade de membrana transferida para a membrana plasmática alcança grandes
proporções. Isso é compensado pela formação simultânea de vesículas transportadoras que funcionam em sentido contrário, ou seja, que têm origem na membrana plasmática e se transferem para
o complexo de Golgi. Estas vesículas de recicla~são geradas por endocitose, um processo do
qual nos ocuparemos na Seção 7-29 e que é o inverso da exocitose. Como veremos , a endocitose
se vale de endossomos, que funcion am como verdadeiras estações de relevo entre a membrana
plasmática e o complexo de Golgi (Figs. 7.1e7.20) .
Uma reciclagem similar ocorre nas terminações axônicas dos neurônios, onde vesículas gera- \
das por endocitose são incorporadas a endOS$Omos com a finalidade de reciclar a membrana cedi- \
da para a membrana pl_asmática da terminação axônica durante a exocitose das vesículas sinápti'.d(
cas (Fig. 7.21) . Devemos assinalar que, neste caso, os endossomos não atuam como inte1mediários .entre a membrana plasmática e o complexo de Golgi, já que este se acha no corpo do neurônio ,
1
1
muito distante da terminação axônica. Além de receber as vesículas recicladoras, Oi_ endossomos
das termina ões nervosas geram as vesículas sinápticas g_ue se carregam de neurotransmissores , /
c_~citose com leta o ciclo. - - - ----- --- --
\
l-
7-23. A célula produz dois tipos de secreção, uma constitutiva
e outra regulada
O processo que provoca a descarga do conteúdo das vesículas transportadoras no meio extracelular é denominado secreção. Esta pode ser constitutiva ou regulada (Fig. 7.20) . .
Na secreção constitutiVa, as moléculas são segregadas de forma automática, conforme o complexo de Golgi emite as vesículas que as transportam.
Ao contrário, na secreção regulada, as moléculas são retidas no citoplasma - dentro de suas
respectivas vesículas transportadoras - até a chegada de uma substância indutora ou outro sjnal
ql}e ordene sua liberação. Esta secrtção de moléculas "por encargo" supõe que a célula as descarrega subitamente e no momento em que são demandadas. As vesículas transportadoras que
Fig. 7.21 Representação
esquemática da exocitose e da
reciclagem das membranas no
terminal axônico.
124
•
O SISTEMA DE ENDOMEMBRANAS
intervêm nas secreções reguladas são denominadas vesículas secretórias ou grânulos de secreção .
7-24. Alguns polipeptídeos são segregados por um mecanismo
diferente do anterior
Como exceção à regra, existem polipeptídeos pequenos fabricados em ribossomas livres que
são segregados por um mecanismo indiferente à exocitose. Cruzam a membr.ana plasmática através de túneis formados por proteínas transportadoras da família ABC (Cap. 3-26), presentes normalmente nesta membrana. Na Seção 7-14 analisamos uma passagem similar através da membra~
na do RE.
7-25. A membrana dos autofagossomos é fornecida pelo REL
Como veremos na Seção 7-35, as organelas envelhecidas são eliminadas da célula através de
certas organelas especiais chamadas autofagossomos, que geram um fenômeno biológico denominado autofagia (Fig. 7.30).
A Fig. 7.30 mostra que durante o seu desenvolvimento, os autofagossomos se envolvem com
uma membrana fornecida pelo REL.
7- 26. O REL é o principal depósito de Ca 2 + da célula
A concentração de Cai+ no citosol é muito inferior à existente na càvidade do retículo endoplasmático e no líquido extracelular. As diferenças são devidas à atividade de outras bombas.de
Ca2+ localizadas na membrana do REL e na membrana plasmática (Cap. 3-23). Ambas removem
o Ca2 + do citosol, que passa ao REL ou ao líquido extracelular. O translado do íon no sentido inverso é passivo, pois ocorre através de canais iônicos. Nas célul as em geral os canais de Ca2 + se
abrem por meio de um ligante, o IP3 (Cap. 11 -18). Por outro lado, nas células musculares estri adas, os canais de Ca 2+ do retículo sarcoplasmático (uma forma especializada de REL) são dependentes de voltagem, já que se abrem quando o potencial de membrana é modificado.
No Cap. 5-33, assinalamos que o aumento do Cai+ no citosol da célula muscular leva à união
do íon com a troponina C, o que desencadeia a contração.
7- 27. Em algumas células o REL cumpre funções especiais
Além das atividades mencionadas até aqui - comuns a todas as células - em alguns tipos
celulares o REL cumpre funções adicionais, como as seguintes:
Síntese de esteróides. Nas células pertencentes às gônadas e às glândulas supra-renais, o REL
contém várias enzimas que intervêm na síntese de esteróides. Este tema é mais detalhado no Cap.
8-22.
Síntese de lipoproteínas. No sangue, os lipídios circulam unidos a proteínas, ou seja, são parte de lipoproteínas. Ambas as moléculas se ligam no REL dos hepatócitos, onde se acham as enzimas que catalisam essa união.
Desfosforilação da glicose 6-fosfato. A membrana do REL dos hepatócitos possui a enzima
glicose 6-fosfatase, que extrai o fosfato da glicose 6-fosfato e a converte em glicose. Ao contrário
da glicose 6-fosfato, a glicose pode abandonar a célula e passar para a circulação sangüínea para
chegar aos tecidos, onde é utilizada como fonte de energia. Devemos assinalar que a glicose 6fosfato é formada a partir da glicose 1-fosfato ou da glicose, e que a primeira surge da degradação
do glicogênio depositado no citosol em forma de inclusões (Caps. 4-3 e 11-15).
Desintoxicação. Nos hepatócitos, o REL contém grupos de enzimas que intervêm na neutralização de várias substâncias tóxicas para a célula, algumas derivadas de seu metabolismo normal
e outras incorporadas do exterior. Assim, a administração de barbitúricos e de outros tóxicos produz um aumento das enzimas de uma família de citocromos presentes no REL - os citocromos
P450 - os quais , juntamente com outras enzimas, convertem as substâncias tóxicas em moléculas hidrossolúveis que saem da célula com facilidade.
O SISTEMA DE ENDOMEMBRANAS
•
125
ENDOSSO MOS
-
7-28. O endossamo possui uma bomba de H+ na sua membrana
[Os endossomos (do grego éndon , dentro, e sôma , corpo) são organelas localizadas funcionalmente entre o complexo de Golgi e a membrana plasmática (Fig. 7. 1). Suas formas e dimensões
ão variáveis, apesar de geralmente constituírem vesículas ou c"istemas relativamente pequenas.
A membrana do endossamo possui uma bomba de prótons (Cap. 3-24) que quando é ativada
transporta H+ do citosol para o interior da organela cujo pH desce a 6,0 ig. 7 .22). o Cap. 4-1,
vimos que o pH citosólico é de 7 ,2.
Antes de analisar as funções dos endossomos convém descrever o processo de endocitose.
7- 29. Existem duas formas de endocitose chamadas
pinocitose e fagocitose
No Cap. 3-10, estudamos a permeabilidade das membranas celulares e vj mos qne os so~uto s
a membrana plasrnátiGafer---tratts-porte passi vo ou ativo e ingressam na célula. As
macromoléculas e as partícul as entram por meio de um mecanismo completamente diferente,
denominado endocitose (Fig. 7.22). De acordo com o tamanho e as propriedades físicas do material que vai ser incorporado, esse mecanismo é chamado pinocitose ou fagocitose (Fig. 7.23).
A pinocitose (do grego pínein, beber) compreende o ingresso de líquidos junto com as macro- 1
moléculas e os soJl}tQS dissolvidos neles. Isto sucede porque porções circunscritas do líquido, que ~
e acham em contato com a supe1fície externa da célula, são captadas mediante invaginações da \
membn~na plasmática, o que dá lugar a fossetas e finalmente a vesículas que são liberadas nó ci-_.1
tosol.
O processo de pinocitose pode ser demonstrado experimentalmente pelo uso de uma solução
de proteínas marcadas com corantes fluorescentes; às vezes é tão rápido que parece que a solução
é "bebida" pela célula.
Segundo a qualidade da substância que será incorporada à célula, a pinocitose pode ser inespecífica ou regulada (Fig. 7 .23). Na pinocitose inespecífica, as substâncias ingressam automatica1
meQ!e,__Q_que ocolr.e e111 toc!os os tipos celu~res. Na pinocitose _reguladaJ>oréI'(I , as substânci as [
interagem com receptores específicos localizados na mem-br-ana-FJlasmática, o-que desencadeia a "'
formação das vesículas pinocític_as. Devido à seletividade deste mecanismo, uma substância pode
ingressar em algumas células porém não em outras, de acordo com os receptores presentes e".Y
uas membranas plasmátieas.
atra~am
ENDOSSO MO
Endocitose
pH
=5
Bomba de H'
M EMBRANA
PLASMÁTICA
- ( Receptor
Material incorporado
Fig. 7.22 Esquema que ilustra o
processo de endocitose e a
conversão do endossamo em
li sossomo.
126
•
O SISTEMA DE ENDOl\1EMBRANAS
•••
Fig. 7.23 Esquemas que ilustram
como os materiais são
incorporados na célula por
diferentes formas de endocitose.
PI NOCITOS E
INESPECÍFICA
Vesícula pi nocitótica
•••
y
'( '(
PINOCITOS E
REGULADA
e
Vesícula pinocitótica
TTT
FAGOCI TOSE
Fagossomo
A fagocitose (do grego phagefn, comer) ocotTe em poucos tipos celulares, particularmente nos
macrófagos e nos leucócitos neutrófilos. Segundo as circunstâncias, constitui um meio de defesa
ou de limpeza, capaz de eli minar pequenos parasitas, bactérias, células prejudiciais, danificadas
ou mortas, restos de células e todo tipo de partículas estranhas ao organismo. Como vemos, a
fagocitose permite a incorporação de llilrtículas relativamente grq_ndes e estruturadas.
Uma vez que o material se fixa sobre a superfície externa da célula, a membrana plasmática
mite prolongamentos envolventes que o rodeiam para deixá-lo englobado no interior do plasma,
que forma uma vesícula muito maior que a pinocítica, chamada de fagossomo (Fig. 7.23).
Para poder ser fagocitado , o material deve conter ou adquirir certos sinais que são reconhecidos por receptores localizados na membrana plasmática das células fagocitárias. Por exemplo,
algumas bactérias são "marcadas" por anticorpos denominados opsoninas (do grego ópson, manar), fornecidos pelo sistema imune.
~
t
7- 30. Acredita-se que os endossomos se convertam em lisossomos
O endossamo exerce suas funções de uma maneira singular. Tanto recebe o materi al ingressado por endocitose - trazido por vesículas pinocíticas ou por fagossomos - como incorpora enzimas hidrolíticas trazidas por vesículas provenientes do complexo de Golgi (Figs. 7.20 e 7.22).
No primeiro caso, o endossamo recebe tambérríporções de membrana plasmática e receptores
(os últimos , se a endocitose for regulada). Ambos são devolvidos por vesículas recieladoras que,
ao chegarem à membrana plasmática, integram-se a ela mediante um processo semelhante à exo'
.
citose (Fig. 7 .22). Uma vez na membrana plasmática, os receptores podem voltar a ser utilizados.
Com relação às enzimas hidrolíticas, qevemos lembrar.que_s.e_acha\l.a!]l_..!lniQ<is à membrana do
co.m
.1.12lexo de~ por meio do.xecepto da manose 6-fosfato. Como mostra a Fig ..7 .20, esta união
é }TI~ntid~tra_n_s~rtam as enzimas do complexo de Gol~~a o endossomo,
onde tambérrLpei:siste. Todavia, no endossamo, as enzimas se mantêm unidas à membrana somente transitoriamente, já que se desprendem do receptor da manose 6-fosfato q~ando o pH da
1 organela baixa a 6,0, quando sua bomba protônica é ativada (Seção 7-28) (Fig. 7.22). Além disso,
a manose 6-fosfato perde o fosfato por ação de uma fosfatase .
Aqui também são recicladas as membranas que juntamente com os receptores da manose 6fosfato regressam à região de saída do complexo de Golgi (Fig. 7.20). Esta reciclagem torna pos-
------
1
s_t,:tl~t.reutil-i-zação...dos.-i:ecepto.r-es.-
Na síntese, o endossamo é ó lugar da célula onde convergem tanto os materiai s que vão ser
digeridos - ingressados por endocitose - como as enzimas hidrolíticas encarregadas de fazê-lo
{ (Figs. 7.20 e 7.22). Acredita-se que a combinação destes elementos converte o endossamo em
lisossomo, de cuja análise nos ocuparemos em breve.
O SISTEMA DE ENDOMEMBRANAS
•
12
Pinocitose
7-31. Existem dois tipos de endossamos, os primários e os
secundários
1
~----~~-----
\
f'
\
I
I
É preciso lembrar que a análise morfofuncional realizada até aqui sobre os endossomos
"
Q
vesícula
evita um passo premeditadamente excluído para facilitár a descrição. É que existem dois
\
"'
recicladora
I
\
,
tipos de endossamos, os primários (ou precoces) e os secundários (ou tardios) (Fig. 7 .24).
I
Os endossomos primários se localizam próximo da_membrana__pJa-5filá..tica_e__1LL
end0ssomos secundários próxime-àe-c-em17le-x-O-Ele-Qel-g.i. Canse üentemente há um 1
fluxo unidi ecional de vesícula s~ortado_ras_para...transferu--e-materiaLendQcitado
da m_em._b_.rnua_plasmátic_a_ao endossamo primái:io._e_d_e.s.te_a0--ei:idGsseme--iH~GilllGlái:iG.
Devemos assinalar que esta organização morfofuncional corresponde às vesículas pinocíticas, já que o fagossomo - nos macrófagos e nos leucócitos neutrófilos - não
conta com o endossamo primário e se funde diretamente com um endossamo secundáEndossamo
rio que, ao receber enzimas hidrolíticas do complexo de Golgi, converte-se em um
secundário
~q
lisossomo de grande tamanho chamado fagolisossomo.
;T
AI~ de servir como estacão intermediária para canalização do material endocitado,
o endossamo p1imário - por meie-cl-as--ve-sfou.las-i:ecicladorns__analisada~n_Q_cj) meço da
seÇ~or - devol~e à membrana _plasmática as porções de membrana e os recepMP Enzima hidrolítica proveniente do
CF complexo de Golgi
tores .tr'!zidos _pelas vesículas pinocíticas.
Como no endossamo primário os receptores se acham unidos ao material endocitado, antes da Fig. 7.24 Dinâmica
reciclagem devem se separar dele. A separação ocorre como conseqüência da queda do pH no morfofuncional dos endossomos
endossamo, que começa a baixar quando a bomba de próton da membrana da organela é ativada. primários e secundários.
EJll seguida, o endosso mo primário gera dois tipos de vesículas transportadoras, uma recicladora
- que retoma à membrana plasmática - e outra que se dirige ao endossamo secundário e lhe
entrega o material endocitado (Fig. 7.24).
Para alguns autores, há um único tipo de endossamo que reside, alternadamente, nas proximi-}
dades da membrana plasmática, onde adquire o material endocitado, e nas cercanias do complexo
de Golgi, onde recebe as enzimas hidrolíticas. Esta organização faz com que o endossamo realize )
incessantes translados de ida e volta entre ambos os pontos.
©
v,ÀQ
-,.,.\
•
®/
nos
esa
,das
,a
tica
ma,
eci-
plo,
tan-
7-32. Na transcitose os endossamos cumprem funções
distintas das descritas
- aen12) .
lres
Em alguns epitélios ocorre um processo denominado transcitose, pelo qual materiais ingressados por endocitose por um lado· da célula atravessam o citoplasma e saem por exocitose pelo
lado oposto. O cruzamento através do citoplasma é realizado dentro da vesícula formada durante
a endocitose, apesar de que, em alguns casos, empregam um endossamo como compartimento ou
estação intermediária (Figs. 7 .25 a 7 .28).
1ue,
:xolos.
l dO
,-
ti ão
mo,
o[ da
o,
SANGUE
>OS-
er
ê-lo
em
CÉLULA
ENDOTELIAL
Fig. 7.25 Transcitose na célula endotelial do capilar sangüíneo.
128
•
O SISTEMA DE ENDOMEMBRANAS
CAVIDAD E DO ÓRGÃO
~
'
1
I~
'
1
1
!
!
.
U
\
! L _ J
'--~~~~~
SANGUE
\
~
~-~~~~
'
'1 lmunog lobu lina A (lgA) ,
Fig. 7.26 Transcitose da IgA em uma célula
epitelial secretora.
Fig. 7.27 Transcitose da IgA em uma célula
epitelial mamária.
No Cap. 6-11 dissemos que nos tecidos epiteliais as junções oclusivas impõem diferenças na
composição da membrana plasmática nas regiões apical e basolateral das células. Tais diferenças
parecem ser necessárias para o processo de transcitose.
O exemplo mais difundido de transcitose corresponde às células endoteliais dos capilares sangüíneos , já que são atravessadas por macromoléculas que passam do sangue aos tecidos (Fig. 7 .25).
Outros exemplos de transcitose são registrados nas células secretoras das glândulas lacrimais e
nas mucosas de alguns órgãos das vias digestórias, respiratórias e urinátias (Fig. 7.26). Por elas,
certos anticorpos - as imunoglobulinas A (lgA) - passam do tecido conjuntivo à luz dos órgãos
citados, onde exercem suas funções defensivas.
Durante a fase de lactação ocorre um fenômeno semelhante nas células secretoras da glândula
mamária. Aqui, as imunoglobulinas A se transferem para a luz glandular, quer dizer, para o leite
(Fig. 7.27).
Ao contrário das outras proteínas do leite, quando estes anticorpos chegam ao intestino do recém-nascido não são degradados imediatamente para sua absorção . Deste modo, o lactente - cujo
sistema imunológico ainda não produz anticorpos próprios suficientes -pod~se vª ler deles para
sua defesa. Este fenômeno foi observado em diversos roedores e ruminantes .
Na Fig. 7 .28 é mostrado o itinerário seguido pelos anticorpos depois de ingressarem na célula
intestinal por endocitose:-incorporam-se transitoriamente a um endossamo primário e, posteriormente, abandonam a célula por exocitose. Como vemos , nestes casos, o endossamo primário com;titui uma estação intermediária para o transporte transcelular, alheia à degradação de substâncias.
Devemos assinalar que na espécie humana, os anticorpos provenientes do leite materno aparentemente não são absorvidos no intéstino e, portanto, não ingressam no organismo do lactente. Suas
LUZ INTESTINAL
Endossamo
primário
Fig. 7.28 Transcitose da IgA em
uma célula do epitélio intestinal.
SAN GUE
O SISTEMA DE ENDOMEMBRANAS
•
129
funções defensivas estariam confinadas à luz intestinal , onde permanecem por um tempo antes de
ser degradados pelas enzimas hidrolíticas encarregadas de digeri-los.
Outro exemplo de transcitose se acha na placenta; CJJj-ªs células são atrave~sada s por anticorr.os da família das imunoglobulinas Q. Ao passarem do sangue matemo para o fetal, estes anticorpos conferem imunidade passiva ao feto - e por um determinado tempo, ao recém-nascido contra várias doenças infecciosas.
LISOSSOMOS
7- 33. Os lisossomos são organelas polimorfas '
ta
Il-
i).
,e
J
la
Je
e-
jo
ira
Todas as célul~s contêm Iisossomos (do grego lysis, dissolução, e sôma, corpo) que são as orga- \
nelas que diger~m 9s materiais incorporados por endocitose. Além disso , por um processo denomi- º
nado autofagia (que será analisado na Seção 7-35) também digerem elementos da própria célula.]
Como assinalamos, acredita-se que os lisossomos sejam formados a partir de endossomos que r
receberàm dois tipos de vesículas tran?portadoras, umas com material endocitado e outras cóm
enzimas hidrolíticas (Figs . 7.20 e 7.22).
.
j
A característica mais saliente dos lisossomos é seu polimorfismo, não apenas porque têm aspectos e tamanhos diferentes, mas também pela irregularidade de seus componentes (Figs. 1.11 e
7.29). A causa de seu polimorfismo é dupla; por um lado, deve-se à diversidade do material
endocitado e por outro ao fato de que cada tip~sosso mo possui uma combin~ção si11gular de
enzimas hidrolíticas, das quais existem cerca de 50 diferentes.
As ~nzimas lisossômicas tomam-se ativas em pH de 5 Q._Este grau de acidificação é alcançado ) ,, ;.
graças a uma bomba de H + p resente na membrana do hsossomo , herdada da membrana do r /
endossemo secundário (Cap. 3-2 e Seção 7-28) (Fig. 7.22).
_,
A membrana do lisossomo se acha protegida do efeito destruidor das enzimas hidrolíticas porque
seu lado luminal contém uma enorme quantidade de glicoproteínas (Cap. 3-8). De outro modo, se a (
membrana do lisossomo se romper, as enzimas que dele escapem não afetarão os demais compo- j
nentes celulares porque serão inativadas ao entrar em c_ontato com o citosol, c_µj.Q.P~7,2.
No interior dos lisossomos as proteínas e os carboidratos endocitados são digeridos transfor-j
mando-se, respectivamente, em dipeptídeos e monossacarídeos. Estes e outros produtos de degradação atravessam a membrana lisossômica e passám para o citosol, onde acabam por ser digeridos ou são aproveitados para gerar novas moléculas . Por seu lado, terminadas suas funções, as
1
LI.a
)f-
te-
Fig. 7.29 Eletromicrografia que
mostra dois lisossomos (L),
mitocôndrias (M), ribossomas
(R) e parte do núcleo (N).
60.000 X. (Cortesia de F. Miller.)
130
•
O SISTEMA DE ENDOMEMBRANAS
õ
V
enzimas lisossômicas também passam ao citosol, onde são degradadas por proteassomas (Cap.
4-6). Finalmente, livres das enzimas e do material digerido , os lisossomos se reconvertem em
endossamos.
_Jgumas substâncias endocitadas não terminam de ser digeridas e permanecem nos lisossomos, que por isso adquirem o nome de corpos residuais. Algumas vezes, as substâncias não digeridas são expulsas da célula por um processo comparável com a exocitose. Se isto não ocorre, com
o tempo convertem-se em pigmentos de desgaste depositados no cito~o}j(Cap. 4-3).
7-34. Os lisossomos também digerem proteínas não endocitadas
A célula conta com dois dispositivos para degradar as proteínas fabricadas em seu próprio citoplasma, ou seja, não endocitadas. Um atua no citosol e envolve a ubiquitina e os proteassomas
(Cap. 4-6). O outro compreende os lisossomos , que incorporam proteínas citosólicas destinadas a
desaparecer e as digerem em sua cavidade. Para tanto, os lisossomos contam com receptores
membranosos específicos que reconhecem as proteínas que ingressam na organela por um
translócon. Este se valeria de duas chaperonas da família hsp70 (Cap. 4-5), uma citosólica, qti'e
desenrolaria as proteínas, e outra luminal, que impulsionaria sua entrada na organela.
7- 35. A autofagia é essencial para o funcionamento da célula
A célula elimina organelas envelhecidas por um mecanismo denominado autofagia, que inclui a formação de autofagossomos . Na Seção 7-25 , mencionamos que os autofagossomos se
formam com a ajuda do REL. Este fornece uma porção de membrana para envolver a organela
obsoleta e formar o autofagossomo (Fig. 7.30).
Em seguida, o autofagossomo segue o mesmo caminho que o fagossomo, ou seja, funde-se com
um endossamo secundário, o qual recebe enzimas hidrolíticas do complexo de Golgi e se converte
em fagolisossomo. O processo culmina com a degradação da organela por paite dessas enzimas.
Nos neurônios, nos hepatócitos e nas células musculares cardíacas, os autofagossomos não
terminam de digerir alguns componentes das organelas e se convertem em corpos residuais. Com
o avançar da idade, estes corpos se acumulam no citosol como pigmentos de desgaste (Cap. 4-3).
A autofagia aumenta em certas condições. Por exemplo, diante de um jejum prolongado aparecem numerosos autofagossomos nos hepatócitos. Têm por objetivo conve1ter componentes da célula
em alimento para prolongar a sobrevivência do organismo.
7-36. Existem doenças produzidas por alterações lisossômicas
Diversas doenças congênitas ocorrem por mutações dos genes que codificam as enzimas li sossômicas. Caracterizam-se pelo acúmulo intracelular das substâncias que ess~s enzimas degradam.
!MP\ Proveniente do
\..:::;) complexo de Golgi
RETÍCULO
ENDOPLASMÁTICO
1
I
1
/
...
MP
?
Fig. 7.30 Componentes celulares
que participam da formação do
autofagossomo e do
fago lisossomo.
Autofagossomo
O SISTEMA DE ENDOMEMBRANAS
•
131
Por exemplo, na doença de Tay-Sachs alguns neurônios aparecem repletos de um gangliosídio.
O defeito se deve à ausência da enzima hexosaminidase A, que catalisa a hidrólise parcial do
glicolipídio. Em conseqüência, este se acumula nos neurônios, o que provoca graves alterações
neurológicas.
A doença de Gaucher é caracterizada pelo acúmulo de glicocerebrosídio em vários tipos celulares em função da ausência da glicosidase que catalisa a hidrólise do glicolipídio em ceramida e
glicose.
A doença de Niemann-Pick mostra um acúmulo de esfingomielina em vários tipos celulares
como conseqüência da falta de esfingomielinase, que é a enzima que hidrolisa o esfingofosfolipídio em ceramida e fosforilcolina.
Na Seção 7-20 estudamos o mecanismo que leva ao acúmulo de moléculas na doença das células l , produzida por um defeito no receptor da manose 6-fosfato, e não em uma enzima
lisossômica.
VESÍCULAS TRANSPORTADORAS
7-37. Durante sua formação, as vesículas transportadoras são envolvidas
por uma cobertura protéica
a
a
e
o
n
).
a.
Com exceção dos fagossomos, que podem ser muito maiores, as vesículas transportadoras têm
um diâmetro que varia entre 50 e 250 nm. A medida maior corresponde às vesículas secretoras .
A Fig. 7 .31 mostra que as vesículas transportadoras se originam na membrana plasmática e nas
membranas das organelas do sistema de endomembranas. Assim fazem com à concurso de uma
cobertura protéica da qual existem vários tipos , embora em alguns ainda não foram descobertas
suas proteínas. As mais estudadas são conhecidas com os nomes de cobertura de COP e cobertura
de clatrina.
A cobertura de COP (do inglês, coat protein) forma-se pela associação ordenada de múltiplas unidades protéicas. Existem dois tipos de coberturas de COP, que se identificàm não somente
porque são compostas de unidades protéicas distintas - denominadas COPI e COPII - mas também porque geram vesículas em lugares diferentes do sistema de endomembranas. Assim, a co~
bertura de CQEJJ_gera as vesículas que se formam no RE e se dirigem p~r~uLfl!_çe de entrada_do
ÇQID_pj~xQ~ lgi , enquanto a cobertura de COP/ gera tanto as vesículas que se formam no lado
de ent@da do_complexo de Golgi e retomam ao RE, quanto as que interconectam as cisternas do
complexo de Golgi.
Por sua parte, a cobertura de clatrina (do latim clathrun ou do grego kleter, trama de varetas)
resultá da associação de várias unidades protéicas chamadas trisquélions (do grego skelos, perna). Ela gera as vesículas que surgem da membrana plasmática durante a endocitose e as que se
formam no lado de saída do complexo de Golgi e se dirigem aos endossamos e à membrana plasmática durante a secreção regulada.
J
Cobertura de COPI
J
Cobertura de COP ll
J
Cobertura de clatrina
J
Cobertura não conhecida
Fig. 7.31 Esquema que ilustra a
participação das coberturas de
COP e de clatrina na formação
das vesículas surgidas da
membrana plasmática (por
endocitose) e das organelas do
sistema de endomembranas.
132
•
O SISTEMA DE ENDOMEMBRANAS
CAVI DADE DA ORGANELA OU LADO EXTRACELULAR
F ig. 7.32 Evolução seguida pela
membrana durante a formação
de uma vesícula. Está ilustrada
também a dinâmica das unidades
COP e dos trisquélions.
CITOSOL
Depósito de
unidades COP ou de
trisquélions
o
Apesar das numerosas investigações realizadas, não se conhece a composição das coberturas
protéicas das vesículas que se formam na face de saída do complexo de Golgi e se dirigem para a
membrana plasmática durante a secreção constitutiva, nem tampouco a das vesículas que nascem
dos endossamos.
A primeira cobertura de COP a ser revelada foi a das vesículas que interconectam as cisternas
do complexo de Golgi, composta por unidades COPI. Foi denominada cobertura de coatômer o
(do inglês, coat protomer) e, posto que se acreditou que todas as coberturas a ser descobertas eram
iguais a ela, foi dado esse nome a todas que não eram de clatrina, a qual havia sido identificada
muito tempo antes. A partir do descobrimento das unidades de COPII, somente retém o nome de
cobertura de coatômero a que se compõe de unidades COPI.
As vesículas transportadoras começam a se formar quando as unidades protéicas dà fatura
cobertura se apóiam sobre a face citosólica de uma área circunscrita de uma membrana celular
plana, que fornecem a força mecânica para que se curve para o citosol. Como mostra a Fig. 7 .32,
o progresso da curvatura desenvolve uma fosseta que finalmente se desprende da membrana convertida em vesícula.
No caso das vesículas cobertas de clatrina, o desprendimento se produz quando várias unidades da proteína motora dinamina rodeiam o colo das fossetas e o estrangulam até seccioná-lo (Cap.
5-8). Estas vesículas têm a forma esférica ao contrário das vesículas cobertas de COP, que em
alguns lugares podem ser poliedros irregulares e em outros exibir uma aparência tubular.
· 7-38. As coberturas de COP são construídas com o concurso das
unidades protéicas COPI e COPll
Na seção anterior foi dito que existem dois tipos de coberturas de C OP e que são construídas
mediante as coberturas compostas pelas unidades protéicas COPI e COPII. Devemos acrescentar
que cada unidade COPI é composta de sete subunidades protéicas, identificadas com as letras gregas
a , (3, W, -y , ô, se~ - Por outro lado, cada unidade COPII consta de duas subunidades protéicas
heterodiméricas, as quais são identificadas pelas siglas Sec 13/Sec31 e Sec23/Sec24 (do inglês,
seven transmembrane protein complex ). Na Fig. 7.32 observa-se que as unidades COPI e COPII
são construídas no citosol, se aderem à membrana e a curvam. Quando se rnne_çtaJJL~mem­
brana,Jazem-no-por-meio_ de_ um ~proteína ch ª-~RF (do inglês, adenosine diphosphate
ribosylation factor) e pelo domínio citosólico do receptor da molécula que vai ser transportada
pela vesícula em formação (Fig. 7.33).
Devemos lembrar que a COPI e a COPII ligam-se a proteínas ~RF específicas denominadas
ARF l e Sarl (do inglês, simil ARF) , respectivamente.
As ARF e as COP desempenham funções complementares, já que uma vez qll.e as ARF determinam em que lugar deve se formar a vesícula transportadora, recrutam as unidades COPI ou COPII
e estas se associam e compõem a cobertura protéica que provoca a curvatura da membrana.
O processo pelo qual as unidades COPI ou COPII se unem à membrana da vesícula em formação é o seguinte: 1) em sua estância livre no citosol das ARF l:iá um GDP e u111 ácido graxo oculto
em suas moléculas; 2) uma proteína reguladora chamada GE...F (do inglês, guanine-nucleotide
exchange factor) faz com que o GDP das ARF se i11tercambie com um GTP; 3) esta troca torna
visível o ácido graxo das ARF, insere-o na membrana, e, por isso, as ARF ficam unidas á ela; 4)
as ARF recrutam as COP que se acham no citosol e as colocam junto à membrana; 5) as COP se
O SISTEMA DE ENDOMEMBRANAS
•
133
Fig. 7.33 União da unidade COP
com a membrana. Vemos como
participam a ARF e o receptor
do material que vai ser
transportado.
ARF-GTP
CITOSOL
unem à membrana por meio das ARF e do domínio citosólico do receptor citado no parágrafo
anterior. Como esse domínio é sempre o mesmo em todos os receptores, as COP se unem a ele
inespecificamente, ao contrário do domínio não citosólico que varia e se une de maneira específic
ca a uma molécula que vai ser transportada.
Embora saibamos que na formação de uma vesícula transportadora intervêm múltiplas unidades COP, ignora-se como se encaixam entre si para curvar a membrana.
Depois que a vesícula se desprende da membrana, as ARF e·as COP se desligam desta e ficam
livres no citosol, onde podem ser reutilizadas (Fig. 7 .32). A saídá das ARF é devida à hidrólise do
GTP, contido dm suas moléculas, o que faz dobrar novaménte o ácido graxo que as une à membrana. As ARF hidrolisam o GTP - em GDP e P - ao serem estimuladas por uma proteína reguladora chamada GAP (do inglês, GTPase activating protein) .
Surge do mencionado que as ARF possuem, alternadamente, um GTP ou um GDP. Quando
têm um Gf P se ativam e isso as une a uma membrana. Ao contrário, quando possuem um GDP se
inativam, separam-se da membrana e ficam livres no citosol. Já que o GDP se deriva da
1
hidrólise do GTP que se acha nas próprias ARF, e como estas catalisam a reação, são
classificadas como GTPases.
Devemos lembrar que na célula existem - além das ARF - outras GTPases que
funcionam associadas às proteínas reguladoras GEF e GAP. Vale lembrar que a GEF
troca o GDP por um GTP e que a GAP estimula a hidrólise do GTP em GDP e P. As
ações reguladoras das proteínas GEF e GAP são ilustradas na Fig. 11.9.
As outras GTPases desta família são as proteínas Rho (Cap. 5-24), Rac (c:\p. 5-26),
Cdc42 (Cap. 5-26), Rab (Seção 7-40), Ras (Cap. 11-12) e Ran (Cap. 12-4). Igualmen2
te às ARF, são ativadas quando têm um GTP e se inativam quando o hidrolisam em
GDP e P.
7-39. As coberturas de clatrina são construídas a partir de
trisquélions
A série de eletromicrografias agrupadas na Fig. 7.34 mostra como a cobertura de
clatrina forma uma vesícula transportadora. Na Seção 7-37 dissemos que a cobertura de
clatrina é composta de múltiplas unidades protéicas denominadas trisquélions. Calculase que uma vesícula de 200 nm de diâmetro contenha cerca de 1.000 dessas unidades.
O trisquélion é formado por três cadeias polipeptídicas grandes e três pequenas, cujo
peso é de 180 kDa e de 35 kDa, respectivamente. Como mostra a Fig. 7 .35, essas cadeias
dão lugar a três braços flexíveis de 44,5 nm de comprimento, dobrados para o mesmo
lado.
Para gerar uma vesícula, os trisquélions são colocados sobre uma área circunscrita do
lado citosólico da membrana e encaixados entre si até formar um poliedro com aspecto
de cesta. A parede do poliedro é composta por hexágonos e pentágonos, cujos vértices
correspondem aos pontos de convergência dos braços dos trisquélions. Ao contrário, suas
arestas são formadas quando dois ou mais braços de outros tantos trisquélions vizinhos
são aderidos (Figs. 7 .35 e 7 .36).
A ligação dos trisquélions à membrana confere a ela a força mecânica que provoca a
sua curvatura. Inicialmente, forma uma fosseta, que ao se desprender da membrana,
3
Fig. 7.34 Seqüência de
eletromicrografias que mostram
o processo de formação de uma
vesícula de endocitose na
membrana plasmática (esta foi
marcada com fenitina).
130.000X. (Cortesia de M. S.
Bretcher.)
134
•
O SISTEMA DE ENDOMEMBRA NAS
Fig. 7.35 Esquema tridimensional de
uma vesícula coberta com clatrina.
Ressalte-se um trisquélion, composto
de seis polipeptídeos (três grandes e
três pequenos).
Fig. 7.36 Esquerda. Eletromicrografia de numerosas coberturas de clatrina isoladas e
coradas negativamente. 67.500X. (Cortesia de B. M. F. Pearse.) Direita. Eletromicrografias
de fragmentos isolados de clatrina corados negativamente. Observa-se um campo geral e
três de suas partes com maior aumento. 105.000 X e 195.000 X, respectivamente. (Cortesia
de R. A. Crowther e B. M. F. Pearse.)
converte-se em uma vesícula que é liberada no citosol. Igualmente às coberturas de COP, a cobertura de clatrina se desarma imediatamente e os trisquélions livres podem voltar a ser usados para
gerar novas vesículas (Fig. 7 .32).
A forma como os trisquélions se associam entre si permite que as membranas assumam curvaturas de raios diferentes e que sejam formadas vesículas de diferentes tamanhos. Todavia, quando
as vesículas são muito grandes - como nos fagossomos - não se formam coberturas completas
e sim áreas isoladas que cobrem parcialmente suas superfícies .
. A união dos trisquélions à membrana vesicular ocorre por uma proteína ARF semelhante às
que se unem às unidades COPI e COPII (Seção 7-38).
Ademais, na membrana plasmática, os trisquélions se unem também ao domínio citosólico dos
recei;>tores das substâncias que ingressam na célula i;>or endocitose regulada (ver o exemplo analisado na Seção 7-42). Algo similar ocorre na membrana da face de saída do complexà de Golgi nas zonas formadoras das vesículas que se dirigem aos endossámos e à membrana plasmática
durante a secreção regulada - onde, além de se unir à ARF, os trisquélions se ligàm ao domínio
cüosólico dos rece12tpres das moléculas ue vão ser transportadas (Fig. 7 .37) (um desses receptores é o da manose 6-fosfato, visto na Seção 7-20).
Como os domínios citosólicos dos receptores mencionados variam, para unir-se a eles, os
trisquélions se valem de certas prQteína_? i_n_!ermediárias heterodiméricas chamadas adaptinas (Fig.
7.37), que têm um domínio_esp.s:cífico que interatua oom cada tipo de receptor e um domínio comum que se liga aos trisquélions.
Quando a cobertura de clatrina se desconecta da membrana vesicular, as ARF e as adaptinas
- da mesma forma que os trisquélions - ficam livres do citosol para que possam ser usadas
novamente (Fig. 7.32).
CAVIDADE DO COMPLEXO DE GOLGI OU LADO EXTRACELULAR
CITOSOL
Fig. 7.37 União do trisquélion à membrana. Veja como participam a ARF, a adaptina e o receptor do
material que vai ser transportado.
O SISTEMA DE ENDOMEMBRANAS
7-40. As proteínas da membrana chamadas SNARE asseguram a
chegada das vesículas transportadoras a seus pontos de destino
•
135
1
/
\
/
\
I
MEMBRANAS DOADORAS
l_T l
1
'>,t'~:Y
v-SNARE
'>: _ - ""''/
Cada compartimento do sistema de endomembranas dispõe, em sua membrana e em seu
interior, de moléculas distintas das dos outros compartimentos. Como foi mencionado nas
1
1
Seções 7-1, 7-2, 7-22 e 7-29, esses compartimentos - juntamente com a membrana plasmática e com a matriz extracelular - trocam algumas de suas moléculas por meio de vesículas transportadoras que se transladam pelo citosol movidas pelo citoesqueleto (Caps .
5-8 e 5-23).
Quando uma vesícula transportadora emerge de um dos compartimentos doadores e se dirige
para o compartimento receptor com o qual se irá fundir, deve avançar pelo caminho adequado e não se extraviar em meio às múltiplas membranas que atravessam o citoplasma.
Isto é alcançado porque existe um mecanismo desenhado para assegurar a chegada da
vesícula transportadora ao compartimento correto. Depende de dois tipos de pIQteínas recepsoras mutuamente complementares, uma pertencente à membrana do compartimento
~e outra à membrana do compartimento receptor. Denominam-se, respectivamente,
MEMBRANAS RECEPTORAS
v-SNARE e1:SNARE (do inglês, vesicle- e target-SNAP receptor) (Fig. 7.38).
Fig. 7.38 Funções da Rab, das
Como mostra a Fig. 7.39, as t-SNARE nunca abandonam a membrana dos compartimentos v-SNARE e das t-SNARE no
receptores. Pelo contrário, as v-.SNARf\_abandonam a membrana_dos compastimentos doadores reconhecimento das vesículas
quando se t[fms(erem para a membrana das vesículas transportadoras. A Fig. 7 .39 mostra também pelas membranas receptoras
que as v-SNARE ficam expostas e em condições de atuar, uma vez que as vesículas se despren- corretas.
dem das coberturas protéicas de COP ou de clatrina.
Como ,este mecanismo requer especificidade, para cada parelha de compartimentos doador e
receptor existe uma parelha particular de proteínas v-SNARE e t-SNARE complementares. Isso
faz com que durante o translado de uma vesícula transportadora sua v-SNARE deva "tatear" várias t-SNARE antes de encontrar a sua complementar.
O retorno de uma vesícula recicladora ao compaitimento doador apropriado, e não a outro, se
deve a que sua membrana recupera a v-SNARE original e ao fato de que a membrana do compartimento de origem conta com uma t-SNARE idêntica à da membrana do compartimento receptor
(Fig. 7.39). Conseqüentemente, durante a reciclagem das vesículas transportadoras, os compartimentos invertem seus procedimentos, pois o doador se conduz como receptor e este como doador.
A união entre uma v-SNARE e sua t-SNARE complementar depende de uma proteína chamada Rab (do inglês, Ras proteinfrom brain), que atua sobre ambas (Fig. 7 .38). Foram identificadas
cerca de 30 Rab diferentes uma para cada parelha de v-SNARE/t-SNARE.
As proteínas Rab pertencem a uma subfamília de GTPases que dependem das proteínas GEF e
GAP (Seção 7-38). Assim, quando são influenciadas pela GEF substituem o GDP de suas moléculas por um GTP (Fig. 11.9) e se ativam, ou seja, se unem à membrana do compartimento doador
e fazem com que a v-SNARE e a t-SNARE se conectem entre si. Ao contrário, quando são influenciadas pela GAP hidrolisam o GTP (em GDP e P) e se inativam, o que as separa da membrana
do compartimento doador.
•
o
RabGTP~
-e:~)
MEMBRANA DOADORA
r-i--~ ~r-
i
1
1
O+
1
'
1
1
1
1
CITOSOL
o
{'\'
Vesícula
~ecicladora
t
1
1
1
'
v-SNAR E
Y
_
t_-s_N_
AR_E_
----*---.
11 . .! ------- ~~
____ . ,.~'.__f___fJ. ).______
---- -+
MEMBRANA RECEPTORA
Fig. 7.39 Esquema que mostra
de que forma a vesícula
transportadora é condu zida até a
membrana receptora e como a
vesícula recicladora é devolvida
à membrana doadora.
136
•
O SISTEMA DE ENDOMEMBRANAS
MEMBRANA DOADORA
~J1
'--' 12- v-SNARE
o
CITOSOL
I
' -SNAP
....:::.,__ NSF
1
Oi
t-SNARE::f.. .l: ~i_..._-_' - - MEMBRANA RECEPTORA
Fig. 7.40 Intervenção das três
SNAP e do NSF na fusão da
membrana receptora com a
membrana da vesícula.
7-41. No processo de fusão de membranas intervêm quatro
proteínas fusogênicas
Quando a v-SNARE se liga à t-SNARE, as membranas interatuantes se colocam a uma distância que toma possível o processo de fusão descrito no Cap. 3-6 e ilustrado na Fig. 3.13.
Neste processo intervém um conjunto de proteínas fusogênicas que se localizam no citosol. São
conhecidas quatro, três das quais identificadas com a sigla SNAP (do inglês, soluble NSF accessory
proteins) e a quarta com a sigla NSF (do inglês, NEM sensitivefactor; NEM, ou N-etilmaleimida, é
o nome do composto usado para revelar o NSF). Assim, as três SNAP e o NSF - que é uma ATPase
- são necessários pelo par de membranas para que se concretize a fusão (Fig. 7.40).
Qualquer que seja o par de membranas - e, portanto, a parelha de v-SNARE/t-SNARE sempre são unidas às mesmas quatro proteínas fusogênicas, pois são inespecíficas. Como vemos,
a especificidade da união depende unicamente das SNARE.
O processo de fusão de membranas consome energia fornecida por um ATP hidrolisado pela
ATPase do NSF. A energia é necessária para desarmar o complexo fusogênico depois da fusão e
separar as SNAP e o NSF das membranas.
As SNAP e o NSF regressam ao citosol e podem ser reutilizados. Por seu turno, a v-SNARE se
integra a uma vesícula recicladora e retoma ao compartimento doador - agora receptor - que é
identificado porque a membrana deste possui uma t-SNARE complementar (Fig. 7.39).
7-42. A entrada do colesterol na célula e seu destino posterior são
conhecidos em detalhes
Em virtude de se tratar de moléculas muito hidrófobas, o colesterol e seus ésteres circulam pelo
sangue como lipoproteírias. O exemplo mais conhecido corresponde ao colesterol-LDL (do inglês, low-density lipoprotein) que é um composto lipoprotéico originado no REL dos hepatócitos
(Seção 7-27). O colesterol-LDL entra nas células por endocitose, após ligação prévia a receptores
específicos situados na membrana plasmática. Esta união atrai trisquélions livres no citosol, os
quais - por intermédio de adaptinas específicas - se conectam com os receptores no lado citosólico da membrana e geram uma cobertura de clatrina (Fig. 7.41).
• Colesterol,LDL
MATRIZ EXTRACELULAR
1
1
~ Recep tor-LDL
O
----ir-('""'WL
Trisquélion
•
1
1
1
1
1
1
!
~
8
"
1
1
º
.Jf
1
1
/
1
1
Y
//
,.
;
;
Vesícula
recicladora
LISOSSOMO
0
t
Fig. 7:41 Esquema que ilustra o
mecanismo de entrada do
colesterol-LDL na célula, sua
passagem pelos endossomos
primário e secundário e seu
processamento no lisossomo.
Enzimas hidrolíticas
provenientes do ®
__ ,.
complexo de
MP - -- - Golgi
"?
O SISTEMA DE ENDOMEMBRANAS
•
137
Como sabemos, a cobertura se desprende da membrana da vesícula quando esta se forma. Na
luz vesicular, o colesterol-LDL continua unido aos receptores herdados da membrana plasmática.
A vesícula se conecta com um endossomo primário, cujo pH ácido faz com que o LDL-colesterol
se desprenda dos receptores , os quais retornam à membrana plasmática com uma vesícula
recicladora. O colesterol-LDL passa do endossomo primário para um endossomo secundário e
este se converte em lisossomo ao receber enzimas hidrolíticas do complexo de Golgi (Fig. 7.41).
As enzimas atuam sobre o cole.s_ternl~LDL e separam a LDL do colesterol, qu~ passa _ao_ci!.?sol e
é utilizada como matéria-prima para a síntese de outras moléculas ou se incorpora à membrana do
RE (Seção 7-10).
A hipercolesterolemiafamiliar é uma doença causada por uma mutação do gene que codifica
o receptor de colesterol-LDL, que é defeituoso ou ausente. Como conseqüência, o colesterol não
entra nas células e sua concentração se eleva no sangue, o que acarreta o aparecimento de quadros
precoces de arteriosclerose.
7-43. Nas membranas plasmáticas de algumas células existem
invaginações denominadas cavéolas
Na m~mbrana plasmática de muitos tipos celulares se desenvolvem invaginações muito pequenas chamadas c_ªy_é_oJas (do latim, caveo(ae , covas pequenas) (Fig. 7.42), cuja presença é particularmente abundante nas células endoteliais, nas musculares lisas e nos adipócitos.
As cavéolas se formam a partir de áreas circunscritas de membrana plasmática chamadas bals~idicas,_g11e são__ricas em colesterol e_esfingofosfolfilídios. A força mecânica que invagina
essas á'teas para que se formem as cavéolas não é gerada por uma cobertura protéica (com D ocorre
com as vesículas de endocitose), mas sim por proteínas que se distribuem entre os fosfolipídios da
própria membrana. Assim, em cada área de invaginação, na monocamada citosólica da membrana, localizam-se múltiplas unidades de uma proteína integral de 21 kDa chamada caveolina, que
é a 2roteína gue produz a in~agü~_(lção. A caveolina tem forma de forquilha e suas duas extremidades se orientam para o citosol (Fig. 7.43).
Membrana plasmática
CITOSOL
Fig. 7.42 Disposição das
cavéolas na membrana
plasmática.
-..'\\ln mmmmrimmmm
·"'
~YllUmuum~uummm
Memb rana plasmática
Caveolina
CITOSOL
Fig. 7.43 Representação
esquemática de uma cavéola,
com as caveolinas distribuídas
entre os fosfolipídios da
monocamada citosólica da
membrana plasmática.
138
•
O SISTEMA DE ENDOMEMBRANAS
Devido ao fato de, em suas luzes, se concentrarem substâncias indutoras e em suas membranas
se instalarem os receptores dessas substâncias·, as cavéolas tomam possível a existência de induções
celulares com mínimas demoras. As substâncias indutoras mais comum.1letectadas_nó interior das
cavéolas são a insulina o EGF e o PDGF (Cap. 11-12), enquanto em suas membranas serão achados vários tipos de receptores da membrana, alguns associados a proteínas G (Cap. 11-14).
As cavéolas servem também para a penetração de pe1meases e canais iônicos até o citoplasma
e "encurralar" solutos nas proximidades destes transpoitadores. Isso permite que os solutos diante de estímulos adequados - ingressem maciçamente na célula. Por exemplo, nas luzes de
algumas cavéolas foi detectado Cá2+ e em suas membranas foram encontrados canais e pe1meases
para o íon , o que levou a compará-los com os túbulos T do músculo estriado (Fig. 5.39).
O mecanismo que introduz solutos e seus transportadores através de cavéolas e permite que os
primeiros ingressem maciçamente na célula é denominado P-Otocitose (do grego potos, bebida) . .
O SISTEMA DE ENDOMEMBRANAS NA CÉLULA VEGETAL
7-44. Na célula vegetal o sistema de endomembranas dispõe de vac@!Qs
Consideraremos aqui algumas características especiais do sistema de endomembranas das cévegetais.
Nas células indiferenciadas do meristema, as membranas do RE são relativamente escassas e
estão mascaradas por numerosos ribossomas livres que preenchem o citosol. Ao contrário, nas
células vegetais diferenciadas, o RE é abm_1dante e forma túbulcis que ingressam no~ plasmodesmas
(Cap. 6-15). Nas células crivosas, sobre estes túbulos formain~se depósitos de calos.e, que é um
polissacarídeo composto por moléculas de glicose unidas por ligações l-3f3.
Do mesmo modo que nas células animais , nas células vegetais o complexo de Golgi é essencial para a secreção. Em suas cisternas se processam e se concentram os pr.o~ut~·es;ão,_q@
fin~mente são desc.arregados no exrell,or. Por ex~mplo , nas células que sintetizam mucílago observam-se abundantes vesículas secretoras surgindo do complexo de Golgi.
Ademais, componentes do complexo de Golgi serve·~ para o transporte de ce·rtas proteínas de
d~pósito ,_como a vinicilina e a legumina nos cotilédones de algumas leguminosas, e a zeína no
endosperma do milho. Essas proteínas se localizam em organelas especiais denominadas corpos
protéicos ou grãos de aleurona.
Na maioria das células vegetais existe um ou mais compartimentos chamados vacúolos, limitados por membranas (Fig. 1.6). Segundo o tipo celular, no total representam entre 10 e 90% do
volume do citoplasma. Quando são muito volumosos, o citosol fica reduzido a uma fina camada
por baixo da membrana plasmática. Existem dúvidas sobre sua origem, mas acredita-se y_ue se
\ formam p~la fusão entre si de vesículas surgidas do complexo de Golgi. As funçõ~s dos V<!.Ç_Úolos
~ sã9 vari<:tdas.Âlguns se comportam como lisossomQ_S, já que contêm enzimas hidrolíticas. Outr~s
servem de depósito para nutrientes e dejetos metabólicos. E, finalmente, outros guardam líquidos
~são usados para regular o volume e a turgência da célula.
Nos Caps. 3-30, 3-31e18-21 estudaremos a pàrticipàção do complexo de Golgi na formação
da parede da célula vegetal.
lu~as
BIBLIOGRAFIA
Anderson R.G.W. (1993) Caveolae: where ineoming and outeoming
messengers meet. Proe. Natl. Aead. Sei. USA 90:10909.
Andrews D.W. and Johnson A.E. (1996) The translocon: more than a
hole in the ER membrane? TIBS 21:365.
Balch W.E. (1990) Small GTP-binding proteins in vesicular transport.
TIBS 15:473.
Barinaga M. (1993) Seerets of secretion revealed. Science 260:487.
Bennett M.K. and Scheller R.H. (1993) The molecular
machinery for secretion is conserved from yeast to neurons. Proc. Natl.
Acad. Sei. USA 90:2559.
------
Blanco A. (2000) Química Biológica, 7a Ed . E! Atenea, Buenos Aires.
Bretscher M .S. and Munro S. (1993) Cholesterol and the Golgi
apparatus. Science 261: 1280.
Brodsky J.L. (1996) Post-translational protein translaeation: nat ali
hsc70s are created equal. TIBS 21 :122.
Chemomordik L.V. and Zimmerberg J. (1995) Bending membranes to
the task: structural intermediates in bilayer fusion. Curr. Opin. Struc.
Biai. 5:541.
Cleves A.E. and Kelly R.B. (1996) Protein translocatian: rehearsing the
ABCs. Curr. Biai 6:276.
-----
O SISTEMA DE ENDOMEMBRANAS
Cole N.B. et ai. (1996) Diffus ional mobility of Golgi proteins in membranes of living cells. Science 273:797.
Corsi A.K. and Schekman R. (1996) Mechanism of polypeptide
translocation into the endoplasmic reticulum. J. Biol. Chem. 271:
30299.
Cuervo A. and Dice J. (1996) A receptor for the selective uptake and
degradation ofproteins by lysosomes. Science 273:50 1.
Cukierman E., Huber I. , Rotman M. and Cassei D. (1995) The ARFl
GTPase-acti vating protein: zinc finger motif and Gol gi complex
localization. Science 270: 1999.
Deli ' Angelica E.C. et ai. (1998) Associ ation of the AP-3 adaptar
complex with clathrin. Science 280:431.
D'Souza-Schorey C. et ai. (1995) A regulatory role for ARF6 in receptor medi ated endocytosis. Science 267: 1175.
Esko J.D . and Zhang L. (1996) Influence of core protein sequence on
glycosaminoglycan assembly. Curr. Opin. Struc. Biol. 6:663 .
Fischer G. (1994) Rab proteins in regulated exocytosis. TIBS 19: 164.
Fukuda M. (199 1) Lysosomal membrane glycoproteins. Stru cture,
biosynthesis, and intracellular trafficking. J. Biol. Chem. 266: 21327.
Gahmberg C.G. and Tolvanen M. (1996) Why mamrnalian cell surface
proteins are glycoproteins. TIBS 21:308.
Hiller M.M. et ai. (1996) ER degradation of a misfolded luminal protein by· the cytosoli c ubiquitin -proteasome pathway. Science
273:1725.
Hughson F.M. (1995) Molecular mechan isms of protein-mediated
membrane fusion. Curr. Opin. Struc. Biol. 5:507.
Jones S.M. et ai. (1998) Role of dynamin in the formation of transport
vesicles from the trans-Golgi network. Science 279:573 .
Lamaze Ç. et ai. (1996) Regulation of receptor-mediated endocytosis
by Rho and Rac. N ature 382: 177 .
Lupashin V.V. and Waters M.G. (1997) t-SNARE activation through
transient interaction with a rab-like guanosine triphosphatase. Science 276:1255.
Marsh M. and McMahon H.T. (1999) The structural era of endocytocis.
Science 285:215 .
Marx J. (2001) Caveolae: A once-elusive structure gets some respect.
Science 294: 1862.
•
139
Parton R.G . and Simons K. (1995) Digging into caveo lae. Science
269 : 1398.
Pelham H.R.B. (1990) The retention signal for soluble proteins of the
endoplasmic reticulum. TIBS 15:483.
Powers T. and Walter P. (1996) The nascent polypeptide-associated
com pl ex modulares interactions between the signal recognition
particle and the ribosome. Curr. Bi ol. 6:33 1.
Rapoport T.A. (1992) Transport of proteins across the endoplasmic
reticulum membrane. Science 258:93 1.
Rassow J. and Pfanner N. (1996) Protein biogenesis: chaperones for
nascent polypeptides. Curr. Biol. 6: 11 5.
Rothman J.E. (1994) Mechanisms of intracellular protein transport.
Nature 372:55 .
Rothman J. E. and Orei L. (1996) Budd ing vesicles in living cells . Sei.
Am. 274 (3):50.
Rothman J.E. and Wieland F.T. (1996) Protein sorting by transport
vesicles. Science 272:227.
Sanders S.L. and Schekman R. (1992) Polypeptide translocation across
the endoplasmic reticulum membrane. J. Biol. Chem. 267:13791.
Schatz G. and Dobberstein B. (1996) Common principies of protein
translocation across membranes. Science 271: 1519.
Schekman R. (1992) Genetic and biochemical analysis of vesicular
traffic in yeast. Curr. Opin. Cell Biol. 4:587.
Schekman R. and Orei L. (1996) Coat protein and vesicle budding.
Science 271:1526.
Séillner T. et ai. (1993) . SNAP receptors implicated in ves icle targeting
and fu sion. Nature 362:318.
Subramaniam V. et ai. (1996) GS28, a 28-kilodalton Golgi SNARE that
participates in ER-Golgi transport. Science 272: 11 61.
Wan-en G. (1993) Bridging the gap. Nature 362: 297.
White J.M. (1992) Membrane fusion. Science 258:917.
Wickner W.T. (1994) How ATP drives proteins across membranes.
Science 266:1197.
Wilema n T., Hardin g C. and Stahl P. (1985) Receptor-mediated
endocytosis. Biachem. J. 232: 1.
Wu S.K. et ai. (1996) Structural insights into the function of the Rab
GDI superfamily. TIBS 21:472.
'
i·
'•
As mitocôndrias
8
Energia celular I
8- 1. A maior parte da energia usada pela célula é fornecida pelo ATP
As células necessitam de energia para realizar quase todas as suas atividades, algumas das quais
estão ilustradas na Fig. 8.1. A energia é obtida de moléculas de ATP , as quais, apesar do espaço
insignificante que ocupam, disponibilizam uma grande quantidade de energia que pode ser facilmente utilizada tão logo e onde for necessária. A energia encontra-se depositada nas ligações
químicas entre os fosfatos do A1'P - ligações de alta energia - embora possa ser utilizada apenas a que envolve o fosfato terminal (Figs. 2.3 e 8.2). Assim, quando o ATP se hidrolisa, juntamente.com a liberação de energia é gerado um ADP..--e um fosfato (Fig. 8.3) . Como vemos , o ADP
se comporta como uma pequena "bateria descarregada", que ao ser carregada pela ligação de um
fosfato se converte em ATP, a "bateria carregada''.
As usinas geradoras de moléculas de ATP são as mitocôndrias, que Q!Rtam a energia depositada nas ligaçQes covaLe tes das m.oléculas do ~ali_mentos e transferem -n a ~P. Uma vez formado, o ,t\TP sai da mitocôndria e se difunde pela célula, de modo que a sua energia pode ser usada
para as distintas atividades celulares. Quando a energia do ATP é removida, o_j\j)P é reconstituído e reingressa nas mitocôndrias para receber uma nova "carga" de energia.
As células têm uma enorme quantidade de mitocôndrias, cada uma das quais produz inúmeras
moléculas de ATP. Estas, como as mitocôndrias, se localizam próximo dos sítios de consumo.
8-2. A energia é retirada dos alimentos
A energia contida nos alimentos provém, em última instância, do sol. Nas plantas, a partir do
C0 2 e da H20, a luz solar dá lugar a uma série de reações que - além de produzir 0 2 - convertem a energia luminosa em energia química, que fica depositada nas ligações covalentes das mo-
FUNÇÕES DAS CÉ LULAS QUE EXIGEM ENERGIA
MITOSE - MEIOSE
MOTILIDADE - CONTRAÇÃO
BIOSSÍNTESE DE
MATERIAIS CELULARES
TRANSPORTE AT IVO
o
TRANSMISSÃO DE SINAIS
li
li
o
li
CH,-0-P-O-P-O-P-O-
ENDOCITOSE - EXOCITOSE
ADP+ P
o
I
o-
1
o-
1
o-
ATP
_)
02 /
CARBOIDRATOS
LIPÍDIOS
Fig. 8.1 Esquema que mostra a mitocôndria como a " usina" de
prod ução energética da célula. O ATP produzido é empregado,
entre outras, nas funções indicadas.
Fig. 8.2 Estrutura química da molécula de adénosina
trifosfato (A TP).
142
•
AS MITOCÔNDRIAS
Fig. 8.3 Hidrólise e síntese do
ATP.
o
R-
o
li
li
o-
li
li
O-P-0-P - O- P- O1
1
1
o-
o
o
+
o
li
R-O-P-O-P - 01
1
H20
o-
o
ATP
o
+
o-
ADP
li
HO-P-0-
+
H•
1
oPi
Quadro 8.1 Diferenças entre os processos energéticos das plantas (fotossíntese)
e dos animais (fosforilação oxidativa)
Fotossíntese
Fosforilação oxidativa
Nos cloroplastos
Reação endergônica:
Energia + C0 2 + H2 0-'> Alimentos
Hidrolisa água
Libera 0 2
Só em presença de luz
Periódica
Nas mitocôndrias
Reação exergônica:
Alimentos + 0 2 -'> Energia
Forma água
Libera C0 2
Independente da luz
Contínua
+ 02
+ C0 2 + Hp
léculas dos vegetais (Cap. 9-4) (Quadro 8.1). A energia dos alimentos vegetais é retirada pelos
animais herbívoros que, por sua vez, servem de alim~nto - e fonte de energia - aos animais
carnívoros.
As substâncias alimentícias são classificadas em carboidratos, gorduras, proteínas, minerais e
H20, aos quais o 0 2 deve ser agregado. Os alimentos entram no organismo pelo sistema digestório ,* salvo o 0 2, que o faz pelo sistema respiratório. Uma: vez que a energia foi extraída dos alimentos, ficam como produtos de dejetos C0 2 e Hp (Quadro 8.1), aos quais devem se somar algumas substâncias nitrogenadas derivadas do catabolismo das proteínas.
Nem toda a energi a depositada nas ligações químicas das moléculas alimentícias é transferida
para o ATP, já que durante as sucessivas reações que conduzem a sua formação , parte desta energia se converte em calor. Devemos assinalar que, do ponto de vista termodinâmico, o calor gerado
no cenário celular, como conseqüência das reações químicas, também é um produto de dejeto. No
entanto, as células são muito eficientes em termos de aproveitamento de energia para produzir
trabalho, pois, comparadas com a maioria dos motores , a relação consumo de combustível/produção de trabalho revela cifras muito mais favoráveis para as células. Assim, nas células, 40% da
energia liberada são para atividades proveitosas e 60% se dissipam sob a forma de calor, enquanto
nos motores essas cifras podem ser da ordem de 20 e de 80%, respectivamente.
O melhor rendimento obtido pela célula é devido à degradação dos alimentos de forma gradual, por meio de enzimas que ela mesma sintetiza. Isso permite que a energia liberada das moléculas alimentícias seja transferida para o ADP e se forme ATP com mínima geração de calor.
8-3. A energia das moléculas alimentícias é extraída mediante oxidações
A maior parte da energia contida nas moléculas dos alimentos é extraída através de uma sucessão de oxidações , ao final das quais o oxigênio atmosférico se une ao hidrogênio e ao carbono
liberados por essas moléculas e forma 8z O e C02 , respectivamente. A graduação mencionada resulta
de tais oxidações, já que estas são cumpridas passo a passo e, em alguns desses passos, são liberadas pequenas porções de energia. Se as oxida õe~ãs> fossem_graduais, a en~g ia ~uímica se
libe~afia-su.bitameute_e se..ili~i~c omo calor.
Devemos lembrar que uma molécula se oxida não somente quando ganha oxigênio (0), mas
também quando perde hidrogênio (H). Como este pode se dissociar em um elétron (e_:) e um pró-
*N.R.T.: Conforme a Nomina Anatômica, embora alguns autores ainda prefiram "sistema digestivo''.
AS MITOCÔNDRIAS
H
o
li
c
N
-o-~-O-wCH2
o
H
H
HO
l
1
H
OH
NH2
O
1
N~C.....C.-N,
11
°" CH
HC:::::N....-C-N'
1
-O-P
-O-Cci2
O
li
H
O
H
HO
H
H
OH
NAD•
FAD
ton (H+), em um sentido geral, toda a remoção do e - de qualquer átomo_Ol!...filOléculª--constitui
uma.r.eaç.ão_d~dação .
os
ris
;e
óli-
u-
da
::rdo
. O
zir
luda
!lto
fuu-
e smo
tlta
be1
e
nas
lfÓ-
Se o e- removido provier de um átomo de H, o H ~ resultante pode perman~na ~o~cu la
oxidada (que então fica com uma carga positiva) ou pode ser removi d~_passar ~io aquoso.
Posteriormente, os e- e os H + podem voltar a unir-se -para compor novos átomos de H-, como,
por @xemplo, quando são transferidos e - e H + ao 0 2 e se forma H 20.
Toda oxidação de um átomo ou de uma molécula está ligada à redução de outro átomo ou de
outra molécula, que então ganham hidrogênio ou e-, ou perdem oxigênio.
Durante o processamento dos alimentos , em algumas reações de oxidação e redução, intervêm
duas moléculas intermediárias importantes: as coenzimas nicotinamida adenina dinucleotídeo
(NAD) e flavina adenina dinucleotídeo (FAD) (Fig. 8.4). Em sua forma oxidada, a primeira é
representada pela sigla NAD +, e, em sua forma reduzida, com a sigla NADH. A segunda, com as
siglas FAD e FADH 2 , respectivamente.
8-4. Os alimentos são degradados por enzimas
Quando os alimentos são ingeridos , os polissacarídeos, os lipídios e as proteínas que fazem
parte deles começam a ser divididos em moléculas cada vez menores pela ação de uma grande
variedade de enzimas. Estes processos ocorrem de forma tal que as moléculas transformadas por
algumas enzimas são modificadas em seguida por outras e assim consecutivamente. Deste modo,
são estabelecidas verdadeiras cadeias metabólicas degradativas que, nas primeiras etapas , são
distintas para cada tipo de alimento, mas nas etapas finais confluem em uma via metabólica comum.
A cisão enzimática dos alimentos ocorre em três cenários orgânicos: o tubo digestório, o citosol e a mitocôndria (Fig. 8.5).
__,,
8-5. A degradação dos alimentos começa no sistema digestório
A primeira etapa da cisão enzimática dos alimentos ocorre na luz do tubo digestório, de modo
que é extracelular. Assim, mediante enzimas segregadas por diversas células desse tubo, os c~r­
boidratos se degradam em monossacarídeos - especialmente glicose - , os lipídios (em sua maioria triacilgliceróis) se convertem em ácidos graxos e glicerol, e as proteínas são degradadas em
aminoácidos (Fig. 8.5). Depois de absorvidas pelo epitélio intestinal, estas molêrnlas ingressam
no sangue e por ele chegam às células.
Para assegurar u_m abastecimento contínuo de energia, as células uardam no citosol earte da
~ · e_dos ácido_s graxos sob a forma de gUcogêniCil e de~ , respectivame~. No
Cap. 4-3 vimos que
hepatócitos e as células musculares estriadas podem conter importantes
reservas destas moléculas sob a forma de inclusões, de onde se mobilizam quando delas necessi-
os
143
Fig. 8.4 Estrutura química da
nicotinamida adenina
dinucleotídeo (NAD+) e da
flavina adenina dinucleotídeo
(FAD).
0- ~H2
H
•
144
•
AS MITOCÔNDRIAS
Fig. 8.5 Esquema geral da
degradação dos alimentos uma
vez incorporados ao organismo:
1) degradação enzimática no
tubo digestório; 2) glicólise no
citosol; 3) descarboxilação
oxidativa; 4) ciclo de Krebs; 5)
fosforilação oxidativa.
GARBO·
IDRATOS
i PROTEINAS 1
1
[
5
;
1Amm~aCldosi
[
3[
~cidos graxos
1 Glic; se 1
~\
2
LIPÍDlõS'
:
;
NAOH
} ......
.i
ATP
l . ._·········~~DH~1ruva:oo,
I
o
""'2
l -···-· Ã ·-·:\....
1
....
............
Oxalacetato
•
.~·
Citrato
"' i
Cis-aconitato
Maiato
4
lsocitrato
Á. co,
\
•t-Cetoglutaraío
Fum arato
co,
l
l
l
l
l
l
NAOH desidrogenase
FADH2
L... Ubiquinona
Complexo b-c,
5
Citocromo e
Citocromo oxidase
ATP
tam. Além disso, assinalamos que os adipócitos servem como depósito para grandes quantidades
de triacilgliceróis.
8-6. A glicólise ocorre no citosol
Mediante uma série de reações químicas reunidas com o nome de glicólise - na qual intervêm
10 enzimas consecutivas localizadas no citosol - cada molécula de glicose, contendo 6 átomos
de carbono, dá lugar a duas moléculas de piruvato, que consistem de 3 carbonos cada uma (Figs.
8.6 e 8.11).
(__
No começo desse processo - que constitui a segunda etapa da degradação dos glicídios inverte-se a energia de dois ATP. No entanto, devido ao fato de que, de imediato, são_gerados
®ªtro, são ganhos doi s ATP, um por cacla 12ir_y_vato.
Ademais , uma part~erg!<i__ liberada durante a glicólise_não é_transferida c!!I.~~nte ao
b TP, mas promove a redução de dois NAD+ (um por cada piruvato). Mais adiante, veremos como,
nas mitocôndrias, a energia contida nos dois NADH surgidos da glicólise é transferida ao ATP
(Seção 8-18).
Voltando aos piruvatos, deixam o citosol e entram nas mitocôndrias.
AS MITOCÔNDRIAS
-A-Tz-"p'~':?_',~·S-Ase-~:~ ~::
,,~~,_,_ f?~r
-F°_'~·~~-3·º~"'_"ªs-e
~
<Hi ;:;~
......
OH
H
H
Glicose
o
li
C-o-
OH
Glicose 5-losfato
o
li
C- o·
0
Foslogliceromutase
1
OH
1
HCOPO~-
HCOH
1
1
CH 1 0H
CH ~ OPO }-
2-Fostoglicerato (x2)
o
li
e-
3-Fos'og!:ceratocin;;:se
7
ATP
s
3-Fosfoglicsrato
(x 2)
CH 2 0POj-
NADH
(x2)
1.3-0ilosfoglicerato
C= O
1
5
HCOH
1
6
CH 1 0PO}"
Gliceraldeído
3-losfato (x 2)
{x2)
o
Dihidroxiacetona
losla!o (x 2)
o
li
c - 0-
Enolase
7 'SNAD
1
AOP
(X2)
des1drooenase
H
H
4
G cera deido!osfato
HCOH
Fig. 8.6 Etapas da glicólise e
enzimas intervenientes.
Frutose 1,6-difosfato
0
oPo~ -
1
145
~H bH
OH
H
Frutose ô-fosfato
0)
r:~~H, OPOl -
•
Piruvmocinase
1
~ 'Sl
C-O-P0~ -
11
::
CH,
ATP
(X2)
li
c-01
C: O
1
CH,
8-7. Nas mitocôndrias ocorre a descarboxilação oxidativa, o ciclo de
Krebs e a fosforilação oxidativa
Por ação de um complexo multienzimático chamado piruvato desidrogenase, presente nas
mitocôndrias, cada piruvato (3 C) se converte em uma acetila, que é uma molécula que contém 2
carbonos. A acetila se liga a uma coenzima - a coenzima A (CoA) - com a qual compõe a
acetil CoA (Figs. 8.7 e 8.11). O carbono do piruvato é removido junto com dois oxigênios, o que
produz C0 2 (Figs. 8.5, 8.10 e 8.11). O piruvato cede também um íon hidreto (H-), quer dizer, um
H+ e dois e- . Em conjunto, estas reações recebem o nome de descarboxilação oxidativa, que é a
terceira etapa da degradação dos carboidratos.
Durante a descarboxilação oxidativa é gerada energia suficiente para reduzir um NAD+ (que
recebe o H- mencionado no parágrafo anterior) , o qual se traduz na formação de .um..NA.l)H por
cada acetila produzida (Figs. 8 .5 e 8.11). Oportunamente, veremos como a energia depositada neste
NADH é transferida ao ATP.
Em seguida - sempre nas mitocôndrias - os átomos de carbono e hidrogênio da acetila (recordemos que se acha unida à CoA) são oxidados e, por isso, gerados C0 2 e H20 . As oxidações
são graduais e em seu transcurso é liberada energia depositada nas ligações covalentes entre esses
átomos, a qual passa ao ATP. Ambos os processos - as oxidações e a formação de ATP - ocorrem em dois tempos; no primeiro é gerado C0 2 e no segundo Hp (Fig. 8.5).
O primeiro desses tempos - que representa a quarta etapa da degradação dos glicídios engloba uma sucessão de oxidações durante o chamado ciclo de Krebs (Figs. 8.5 e 8.11 ). Da energia
liberada nesta etapa, uma pequena fração é aproveitada.para gerar um ATP de forma direta (ainda
n
!O
o.
1'
NH2
1
N""C' N
1
~CH
CH::, _);._N,
P-
N
b
O
O
.
H
1
H
H
HO
O
CH3 H
H
li
li
! I
1
CHz-O-P-O-P-O-CH2-C-C-C-N-(CHa)
O-
H
O
1
O=P-o1
OH
1
o-
1
1
u
CH 3 OH O
H
O
1
li
2 -C-N-(CH2) 2 -S-C-CH 3
li
O
ACETILA
'
Fig. 8.7 Estrutura química da
acetilcoenzima A (acetil CoA).
146
•
AS MITOCÔNDRIAS
que por via do GTP), porém a maior :Rarte é utilizada para reduzir 'três_NAD + - que então se
convertem em outros tantos NADH - e u~9, que passa a seu estado reduzido ou FADH 2 •
No segundo tempo , contemporâneo ao do ciclo de Krebs , os NADH e os FADH2 são oxidados
em outros pontos no começo de uma série de complexos moleculares que são agrupados com o
nome de cadeia transportadora de elétrons (ou cadeia respiratória) , de modo que os NADH e
os FADH2 voltam a se converter em NAD + e FAD, respectivamente. Quando ambos os dinucleotídeos_são oxidados, a en~rgia depositada em suas moléculas é liberada e transferida ao 6_DP que se
acha nas mitocôndrias , o qual, uma vez que se fosforila, se converte em ATP.
Esta etapa - quinta e última na degradação dos glicídios - dá lugar a oxidações acopladas a
fosforilações, recebendo , por isso, o nome de fosforilação oxidativa (Fig. 8.5).
8- 8. Os ácidos graxos são degradados nas mitocôndrias
Ao contrário da glicose, os ácidos graxos - provenientes dos alimentos ou da mobilização
das reservas de gordura nas células - não se degradam no citosol. Passam para as mitocôndrias,
onde uma série de enzimas específicas os desdobra até gerar entre oito e nove a~etilas cada um.
O processo degradativo é denominado ~-o x idação e compreende vários ciclos sucessivos, sete
quando se trata de um ácido gr<\XO de 16 carbonos e oito naquele de 18 carbonos. É que º-Il~ido
graxo_cede.umaacetilapor-Gido. Além disso, cada ciclo produz um NADH e uni E_ADH2 (Fig. 8.10).
A 13-oxidação dos ácidos graxos é realizada pelas enzimas acil CoA desidrogenase, enoil CoA
hidratase, hidroxiacil CoA desidrogenase e 13-cetoacil CoA tiolase. _
Da mesma forma que as acetilas derivadas da descarboxilação oxidativa do piruvato, as originárias da 13-oxidação dos ácidos graxos são cedidas à CoA e ingressam no ciclo de Krebs. Como
, vemos, as cadeias metabólicas que degradam os _glicídios-e-as-gorduras dão lugar a umá molécula
·' comum, a acetiLCoA. Antes dissemos que no ciclo de krebs, cada: acetil CoA gera um ATP, três
NADH e um FADH 2 , e que a energia contida nos NADH e FADH 2 é transferida ao ATP no final
da fosforilação oxidativa.
'- As gorduras fornecem mais energia que os carboidratos pela quantidade de NADH e FADH2
suplementares que são ger.ados durante a 13-oxidação dos ácidos graxos, proporcionalmente maior
que os produzidos pela glicose durante a glicólise e a descarboxilação oxidativa.
8- 9. Os primeiros produtos da degradação dos aminoácidos
são muito varia_dos
No que diz respeito aos aminoácidos, quando não são utilizados para ºsintetizar proteínas ou
outras moléculas e são necessários para gerar energia, convertem-se - por meio de enzimas específicas distintas - alguns emlp~ , outros em~ e outros em moléculas intermediarias
---------do ciclo de Krebs (Fig. 8.5).
- - -- -
DESCRIÇÃO GERAL E ESTRUTURA DAS MITOCÔNDRIAS
º 8-1 O. As mitocôndrias são encontradas em todos os tipos celulares
As mitocôndrias são encontradas em todos os tipos celulares e constituem um dos exemplos de
integração morfofuncional mais admiráveis, já que fornecem a estrutura sobre ,a qual se assentam
inúmeras moléculas que participam nas reações que transferem a energia depositáda nos alimentos para uma molécula extraordinariamente versátil como é o ATP.
-6s mitocôndrias são cilíndricas, embora sofram mudanças sutis de forma, derivadas de sua atividade. Medem 3 µm de comprimento e têm um diâmetro de 0,5 µm. Seu número varia segundo
o tipo celulai.'Nas células hepáticas , por exemplo, podem ser encontradas entre 1.000 e 2.000 mitocôndrias (Fi g. 1.11 )\ê,stão situadas nas regiões das células onde a demanda de energia-é' maior;
assim, se deslocam de um lado para outro do citoplasma até as zonas necessitadas ·de energia. Os
microtúbulos e as proteínas motoras associadas intervêm _n~~~§_9~_camentoj (Cap. 5-8). Em
alguns tipos celulares, como os espermatozóides, os adipócitos e as células musculares estriadas,
as mitocôndrias se acham imobilizadas em lugares fixos.
AS MITOCÔNDRIAS
•
147
Fig. 8.8 Eletromicrografia da
mitocôndria. Observar as cristas
(Cr), a matriz (Ma), o espaço
intermembranoso (EIM), a
membrana externa (ME) e a
membrana interna (MI).
207.000X. (Cortesia de G. E.
Palade.)
8-11. As mitocôndrias contam com duas membranas e dois compartimentos ·º
fA.s mitocôndrias têm duas membranas - uma interna e outra externa - que dão lugar a dois
compar1imentos, o e_sp.açQ intermembrana e a matriz mitoco~riaD(Figs. 8.8 e 8.9). Mencionaremos as características e as moléculas de maior interesse destes quatro componentes.
['.Ylatriz mitocondrial. A matriz mitocondrial contém numerosas moléculas, entre elas:
1) O complexo enzimático piruvato desidrogenase, responsável pela descarboxilação oxidativa (Fig. 8.11).
2) As enzimas evolvidas na [3-oxidação dos ácidos graxos (Fig. 8. lÕ).
3) As enzimas responsáveis pelo ciclo de Krebs, exceto a succinato desidrogenase (Fig. 8.11).
4) A coenzima A (CoA), a coenzima NAD +, ADP, fosfato, 0 2 etc.
5) Grânulos de diferentes tamanhos, compostos principalmente por Ca2 + (Fig. 8.9).
6) Várias cópias de um DNA circular (Seção 8-26) (Figs. 8.9, 8.16 e 8.18).
~---------
~--- ATP
DNA
sintase
Fig. 8.9 Esquema tridimensional
de uma mitocôndria cortada
longitudinalmente. As cristas
aparecem cobertas de moléculas
de ATP sintase.
148
•
AS MITOCÔNDRIAS
7) Treze tipos de RNAm, sintetizados a partir de outros tantos genes desse DNA.
8) Dois tipos de RNAr, que formam ribossomas parecidos com os citosólicos (Fig. 8.9).
9) Vinte e dois tipos de RNAt para os vinte aminoácidos.
,
1
Membrana interna. A membrana interna desenvolve pregueamentos para a matriz que dão
lugar às chamadas cristas mitocondriais, f~ com o objetivo de aumentar a superfície da
membranal ü número e a forma das cristas variam nos distintos tipos celulares.
mem~ana. int.erna das mitocôndria§}presenta um alto grau de especialização e as duas faces
de sua d1112la camada lipídica exibem uma acentuada assimetria. Nel se localizam, entre outros,
os seguintes elementos:
1) Um conjunto de l@léqil-ªLq_ue. compõem_a cadeia transportadora de elétrons (ou cadeia
respiratória) (Figs. 8.5, 8.10 e 8.12). Existem inúmeras cópias destes conjuntos no plano dá dupla
camada lipídica. Cada um é composto de quatro complexos protéicos relativamente grandes, chamados NADH desidrogenase (I), succinato desidrogenase (II), b-c1 (III) e citocromo oxidase
(IV), entre os quais se encontram dois transportadores de elétrons pequenos, denominados ubiquinona e citocromo
Devemos assinalar que a succinato desidrogenase é uma das enzimas do ciclo de Krebs e que
funciona associada a outra proteína da membrana mitocondrial interna, a coenzima FAD (Figs.
8.5 e 8.11). Além disso, que o citocromo c não é uma proteína intrínseca desta membrana e sim
uma proteína periférica que aponta para o espaço intermembrana (Fig. 8.1 O), e que a ubiquinona
é uma molécula não-protéica que pode se alojar na zona apolar da dupla camada lipídica graças a
sua cadeia de 10 isoprenos, que é hidrófoba (Caps. 2-7 e 3-2) (Fig. 2.24).
A ATP sintas~ que é um complexo protéico localizado nas imediações da cadeia transportadora de elétrons (Figs. 8.1 Oe 8.12), apresenta dois setores, um transmembrana (porção F 0 ), que
tem um túnel para a passagem de H+, e outro orientado para a matriz mitocondrial (porção F)
(Fig. 8.13). Este último ca~.f_ormaçãQde ATP a partir do ADP e fosfato, ou seja, é o responsável pelas fosforilações às quais se refere a expressão "fosfodlação oxidativa". A origem da energia
requerida pela porção F 1 da ATP sintase, para que se possam concretizar essas fosforilações, será
analisada mais adiante.
3) Um fosfolipídio duplo - o difosfatidilglicerol ou c~lustrado na Fig. 2.17 - que
impede a passagem de qualquer soluto através da dupla camada lipídica, exceto 0 2 , C0 2 , H2 0,
NH3 e ácidos graxos.
!SJ
@
Membrana
externa
CITOSOL
Fig. 8.10 Representação gráfica
da mitocôndria. Estão ilustradas
as reações correspondentes à
descarboxilação oxidativa (em
verde), ao ciclo de Krebs (em
vermelho), à [3-oxidação dos
ácidos graxos (em amarelo) e à
fosforilação oxidativa (em azul).
A acetil CoA se deriva tanto da
descarboxilação oxidativa
quanto da í3-oxidação dos ácidos
graxos e é o ponto de partida do
ciclo de Krebs. !, NADH
desidrogenase; II, Succinato
desidrogenase (e FAD); Ubi,
Ubiquitina; !II, Complexo b-c 1;
Cit, Citocromo c; IV, Citocromo
oxidase.
?i ?i
C~ 2
?i
Pi + GDP
.::;-
CH3-C-C-OH~CH3-c-CoA7
NAD+ NADH
Membrana
interna
GTP
2' 7
3NAD+ 3NADH
C02
FAD
CoA
Ácid
grax
NAD+ NADH
FAD
Pi
02
AS MITOCÔNDRIAS
4) Diversos ca~i s iônicos que pe1mitem a passagem seletiva de íons e moléculas do espaço
intermembranoso para a matriz mitocondrial e em sentido inverso (Fig. 8.10).
Membrana externa. A membrana externa é permeável a todos os solutos existentes no citosol, porém não é permeável às macromoléculas. Isso é porque a sua dupla camada lipídica possui
numerosas proteínas transmembrana de passagem múltipla chamadas_p_orinas, que formàm ·c.anais aquosos pelos quais passam livremente ions e moléculas de até 5 kDa. Nas porinas, os segmentos protéicos que cruzam a dupla camada lipídica exibem uma estrutura em folha dobrada 13.
Espaço intermembranoso. Dada a presença das p01inas na membrana externa, o conteúdo de
solutos no espaço intermembranoso é semelhante ao do citosol, embora tenham alguns elementos
próprios e uma ~levada concentração de H:r (Fig. 8.12).
FUNÇÕES DAS MITOCÔNDRIAS
8-12. A função principal das mitocôndrias é gerar ATP
Vimos que mediante a descarboxilação oxidativa, o ciclo de Krebs e a fosforilação oxidativa,
a mitocôndria traslada ao ADP - para formar ATP - a energia existente nas ligações químicas
das moléculas alimentícias.
Analisaremos estes três processos nas condições biológicas onde eles ocorrem, quer dizer, no
arcabouço estrutural fornecido pela mitocôndria.
8-13. A descarboxilação oxidativa do piruvato e a (3-oxidação dos ácidos
.. graxos ocorrem na matriz mitocondrial
Proveniente do citosol, o piruvato ingressa na matriz mitocondrial, onde por ação da piruvato
desidrogenase perde um carbono e se converte no grupo acetila da acetil CoA (Figs. 8.5, 8.7 , 8.10
e 8.11). Lembremos que nessa conversão, além de C0 2, é gerada energia suficiente para.formar
um NADH, de modo que, por cada molécula de glicose, originam-se_ dois desses nucleotídeos.
;--Às acetilas geradas a partir dos piruvatos devem se somar os derivados da 13-oxidação dos ácidos graxos e do metabolismo de alguns aminoácidos (Figs. 8.5 e 8. 10).
l,, Qualquer que seja sua origem, o grupo ~eti!a de cada acetil CoA ingressa no ciclo de Krebs. Isto
ocorre quando ele se combina com uma molécula de 4 carbonos - o ácido oxalacético - com o
qual f01ma uma molécula de 6 carbonos chamada ácido cítrico, que dá início e nome ao ciclo.
8-14. As reações do ciclo de Krebs ocorrem na matriz mitocondrial
Como mostra a Fig. 8.11, o ciclo de Krebs (também chamado ciclo do ácido cítrico ou ciclo
dos ácidos tricarboxílicos) compreende uma série de nove reações químicas mediadas por outras
tantas enzimas específicas. Estas atuam seqüencialmente e fazem-no de tal forma que o último de
seus produtos volta a ser o ácido oxalacético, o qual, ao combinar-se com o grupo acetila de outra
acetil CoA, gera um novo ácido cítrico. Com esta molécula, inicia-se outro ciclo de Krebs e assim
sucessivamente enquanto houver 0 2 e acetila disponíveis.
A___cada~ump.ri{ia-d0-eid.o-de_Ki:ebs~ · dos eis arbonos do ácido cítrico são liberados
com co2. Além disso, é gerada energia suficiente para fonnar um ATP, três_N-A.Q!I e. um FADM2.
Já que são necessárias duas voltas do ciclo de Krebs para processar as duas acetilas;,ien-ya~
~ggcólise de uma molécula de glicose, cada um destes monossacarídeos dá lugar a dois ATP,
s{is NADH e dois FADH2J Devemos lembrar que o ATP se forma a partir do GTP, que é o nucleosfaeu1:rifosfato surgido do ciclo.
Como podemos ver na Fig. 8.11, a enzima do ciclo de Krebs encarregada de transferir o H2 ao
FAD é a succinato desidro_gwase (vimos que a enzima e a coenzima se localizam na membrana
mitocondrial interna).
Na mesma figura podemos observar que juntamente ao primeiro e ao terceiro NADH surgidos
do ciclo de Krebs aparecem outros H+, pois os substratos oxidados, ao contrário do que acontece
na glicólise, na descarboxilação oxidativa e na formação do segundo NADH oriundo do ciclo de
Krebs, cedem um H2 em lugar de um H- .
•
149
150
•
AS MITOCÔNDRIAS
Fig. 8.11 A descarboxilação
oxidativa e o ciclo de Krebs (ou
ciclo do ácido cítrico) nas
mitocôndrias. Estão
representadas as reações, as
enzimas que intervêm e os
produtos de ambos os processos.
j
CH 3 - CQ - COOH
Ácido pirúvico
NAD'~/ CoA
NADH- J Piruvato desidrogenase
eH
3-
e o - s- e o A
Acetil CoA
+
e0 2
NADH H·
COOH
COOH
1
C= O
1
CH 2
1
Citrato
sintase
1
COO H
Ácido
oxalacético
CH 2
1
+ CoA
HO - C-COOH
1
~ conitase
?H 2
~
COOH
H2 0
COO H
1
CH 2
Ácido cítrico
1
C-COOH Ácido aconítico
li
HC
1
COOH
JAconitase
COOH~ H2 0
1
CH 2
1
.
HC- COOH Ácido isocítrico
1
C0 2
HOCH
1
COO H
NAD '
lsocitrato
desidrogenase
NADH
Succinil CoA
W
Ácido a -cetoglutárico
As moléculas de C02 formadas durante a descarboxilação oxidativa e o ciclo de Krebs passam
ao citosol, deste ao espaço extracelular, e, finalmente, ao sangue, que as transporta aos pulmões
para sua eliminação.
8-15. As oxidações da fosforilação oxidativa ocorrem na
membrana interna da mitocôndria
,
A energia contida nos NADH e no·FADH? formado s durante o ciclo de Krebs se transfere ao
ATP depoi s de uma série de processos que co~eçam com a oxidação Cle ambos os dinucleotídeos.
Os átomos de hidrogênio liberados dos NADH e do FADH 2, como conseqüência de ambas as
oxidações, se dissociam em H+ e e-, do modo expresso nas seguintes equações:
NADH ~ NAD+ + l .H+ + 2 eFADH2 ~ FAD
+ 2 H+ + 2 e-
É importante assinalar que os e- surgidos destes processos possuem um elevado potencial de
transferência, quer dizer, uma grande quantidade de energia. Assim, ingressam na cadeia trans·
portadora de elétrons, cujos componentes foram enumerados quando descrevemos a membrana
mitocondrial interna (Fig. 8.12).
'
AS MITOCÔNDRIAS
MAT RIZ MITOCONDRIAL
•
151
Fig. 8.12 Um setor da
mitocôndria que mostra os
complexos protéicos integrantes
da cadeia transportadora de
elétrons (ou cadeia respiratória)
e a ATP sintase. ! , NADH
desidrogenase; II, Succinato
desidi·ogenase (e FAD) ; !II,
Complexo b-c,; IV, Citocromo
oxidase.
Tendo em vista que cada componente da cadeia possui uma afinidade maior pelos e- do que
seu predecessor, os e- fluem por ela na seguinte ordem:
Para os e- cedidos pelo NADH, o ponto de entrada é a NADH desidrogenase (complexo 1).
Desta passam à ubiquinona, que os transfere ao complexo b-c 1 (complexo III). Os e- deixam este
complexo e ingressam no citocromo c, do qual passam ao último elo da cadeia, a citocromo oxidase (complexo IV). Durante este percurso, os e- consomem a maior parte de sua energia - já
veremos por quê- e ao concluí-lo retomam à matriz mitocondrial (Fig. 8.12).
Por sua vez, os e- cedidos pelo FADH 2 têm como ponto de entrada a succinato desidrogenase
(complexo II), que os transfere à ubiquinona, a partir da qual fluem pelos elos restantes da cadeia
na mesl1ffi ordem em que o fazem os e- cedidos pelo NADH.
O potencial de transferência dos e- vai diminuindo nas sucessivas reações de oxidorredução
que ocorrem ao longo da cadeia respiratória, de modo que, em cada etapa, os e- passam a um
estado de menor energia, que é bem reduzida quando os e- abandonam o último elo da cadeia.
A energia__cedida pelos_e::: é utilizadá para trªn§.Portar os_H + (procedentes dos NADH e dos
FADH 2 oxidados) da matriz mitocondrial para o espaço inte rIE~mbran~o (Fig. 8.12). A energia
é necessária porque este transporte é ativo, já que os H+ são transferidos de um meio em que se
acham menos concentrados para outro em que sua concentração é maior. O mecanismo que toma
possível a passagem dos H + não foi determinado _ainda. Somente sabemos que os H+ passam através dos complexos principais da cadeia respiratória - ver a Fig. 8.12 - que atuariam como verdadeiras bombas de H + (Cap. 3-25).
A existência de um gradiente de _ç; on ~entração_Q e H + (o gradiente de pH) entre ambos os lados
da membrana mitocondrial interna é acompanhada por um gradiente de voltagem ou potencial
elétrico (Cap. 3-11 ), bem mais positivo na face da membrana voltada para o espaço intermembranoso. O gradiente eletroquímico derivado da soma de ambas as forças se traduz na energia - chamada protonicomotora - que impulsiona os H+ a regressar à matriz mitocondri~l , agora por
transpmte_pas_sivo. Os H+ retomam pelo'túnel da ATP sintase (Figs. 8.10, 8.12 e 8.13).
Em síntese, à medida que a energia fornecida pelos e- é utilizada para transferir os H + para o
espaço intermembranoso, ela é absorvida pelos próprios H+, que a retêm como energia protonicomotora.
F,
MATR IZ MITOCONDRIAL
Fig. 8.13 Representação da ATP sintase na membrana mitocondrial intern a.
'
152
•
AS MITOCÔNDRIAS
Fig. 8.14 Modo como atua a
lançadeira de glicerol 3-fosfato
para transportar à mitocôndria os
elétrons dos NADH gerados
durante a glicólise.
MITOCÔNDR IA
CITOSOL
Diidroxiacetona 3-fosfato
Diidroxiacetona 3-fosfato
Glicerol 3-fosfato
desidrogenase
~ NADH
Glicerol 3-fosfato
desidrogenase
W
NAD+
Glicerol 3-fosfato
--------r ---•
Glicerol 3-fosfato
8-16. A fosforilação é mediada pela ATP sintase
1-
L
Na Seção 8-11 , dissemos que a ATP sintase é composta por duas unidades com localizações e
funções diferentes. Uma atravessa a dupla camada lipídica (porção transmembrana ou F0) e a outra
é voltada para a matriz mitocondrial (porção F 1) (Fig. 8.13). A ~ç_ão F0 fo1ma um túnel que permi_t_e 9 regresso dos H+ à matriz mitocondrial, enquanto a porção F 1 é responsável pela fosforilação, quer dizer, catalisa a síntese de ATP a partir de ADP e P. Como vemos, o regresso dos H+ e
a síntese de ATP, embora sejam processos acoplados, são cumpridos em dois lugares diferentes
da A TP sintase.
A energia necessária para ·a síntese de A TP é proveniente da energia protonicomotora contida
nos H+, que a vão perdendo à medida que regressam para a matriz mitocondrial.
Em síntese, a ATP sintase se comporta como uma turbina que converte um tipo de energia (a
protonicomotora, derivada do gradiente eletroquímico dos H+) em outra mais proveitosa para a
célula, a energia química depositada entre o segundo e o terceiro fosfato de ATP.
São gerados aproximadamente 2,5 ATP por cada NADH processado e 1,5 por cada FADH 2•
O ATP sai para o citosol por um contratransportador passivo ·localizado na membrana mitocondrial interna, a ATP-ADP translocase (Fig. 8.10). Por cada ATP que a atravessa, entra um
ADP na matriz mitocondrial.
A ATP sintase pode também se chamar A TPase, pois é capaz de hidrolisar ATP (a ADP e P)
e com a energia liberada bombear H+ para o espaço intermembranoso através da porção F 0 • No
entanto, recebe o nome de ATP sintase porque, na matriz mitocondrial, o quociente ATP/ADP
normalmente é inferior a unidade, o que leva à síntese e não à hidrólise do ATP.
8-17. Os H+ e os e- se combinam com o oxigênio atmosférico para
formar água
Cabe agora indagar sobre o destino dos e- , os quais, depois de perder uma parte substancial de
sua energia, abandonam a cadeia-respirntória e_r_egressam à matriz mitocondrial. Combinam-se
com os H+ vindos do espaço intermembranoso e com o 0 2 proveniente da atmosfera, o que dá
lugar à formação de Hp (Figs. 8.10 e 8.12). A atração dos e- pelo 0 2 deve-se ao fato de possuir
uma grande afinidade por este, maior que aquela pela citocromo oxidase, lugar por onde saem da
cadeia respiratória. Com a formação de H2 0 culmina a fosforilação oxidativa.
São necessários 4 e- e 4 H+ para cadà 0 2 para que se produzam 2 moléculas de H2 0 , que é um
dos produtos finais do metaboli smo (o outro é o C0 2). A Hp passa da mitocôndria ao citosol,
onde pode ficar retida ou sair para o espaço extracelular.
8-18. Os NADH gerados durante a glicólise não ingressam nas mitocôndrias
Até agora temos olhado de soslaio o destino dos NADH gerados durante a glicólise (Seção
8-6) (Fig. 8.6). Ao contrário dos NADH formados nas mitocôndrias, que rendem 2,5 ATP cada
um, os da glicólise às vezes geram 1,5 ATP e às vezes 2,5. O menor rendimento energético devido ao fato de o NADH citosólico não 12oder ingressar nJUillluc.ôndr-.ia,4l.i.s-to.q~mbrana
interna lhe é impermeável.
Para que o NADH citosólico possa ceder sua energia ao ATP, entram na mitocôndria somente
seus e- e H+, já que o próprio NADH não pode entrar. Isso é possível graças a certas moléculas
citosólicas que atuam como "lançadeiras". Assim, uma lançadeira, depois de captar os e- e um
e
AS MITOCÔNDRIAS
C ITOSOL
MITOCÔNDRIA
------ -----+
Maiato
Maiato
desidrogenase
tr+
~
AD+
NAD H H'
Maiato
NAD+
NADH
Oxalacetato
~
w-1
Oxalacetato
j
Aspartato
aminotransferase
Aspartato
Maiato
desidrogenase
+----- --------
Aspartato
aminotransferase
As partato
H+ do NADH (mais outro H+do meio), os conduz à mitocôndria, onde os transfere a outra molécula; depois retoma sem eles ao citosol e, por isso, fica disponível para uma nova operação.
Uma das lançadeiras é o_glicerol 3-fosfato, formado no citosol após a redução da diidroxiacetona 3-fosfato (Fig. 8.14). O glicerol 3-fosfato entra no espaço -intermembranoso e se coloca em
contat com a membrana mitocondrial interna, mais precisamente com o FAD, ao qual cede os
dois e- e os dois H+, quer dizer, a_molécula de hidrogênio (H 2) . Portanto, forma-se um_FADH2,
que como sabemos cede seus e- à ubiquinona. Na Seção 8-16 vimos que quando os e- ingressam
na cadeia respiratória pela ubiquinona dão lugar a 1,5 ATP em vez de 2,5.
Além disso, existem lançadeiras de malato-aspartato (Fig. 8. 15). Neste caso, os dois e- e o
H+ do NADH citosólico (mais outro H+ do meio) se reduzem a um oxaloacetato, que se converte
em maiato. Este ingressa na matriz mitocondrial e se reoxicfa como oxaloacetato. O H2 saído do
maiato é usado para reduzir um NAD+ a NADH (o H+ que sobra passa ao meio) que, como sabemos , produz 3 ATP. O oxaloacetato mitocondrial, uma vez que não pode atravessar a membrana
interna da mitocôndria, para passar ao citosol transforma-se em aspartato que a atravessa. No citosol, o aspartato se reconverte em oxaloacetato, o que encerra o ciclo.
8-19. Na presença de 0 2 , cada molécula de glicose gera 30 ou 32 ATP
Para efetuarmos o cálculo da energia ganha em unidades de ATP ao final da oxidação de uma
molécula de glicose devemos somar a energia produzida no citosol àquela gerada na mitocôndria.
A glicólise gera 4 moléculas de ATP. Como gasta 2, nesta etapa há um ganho final d~ ~ ./\ TP
(Fig. 8.6). Porém, além disso, gera 2 NADH que por serem citosólicos produzem 1,5 ou 2,5 ATP
cada um, 3 ou 5 no total. Assim, o aporte da glicólise é de 5 ou 7 ATP, 2 gerados no citosol e 3 ou
5 na mitocôndria.
Os dois piruvatos derivados da glicólise entram na mitocôndria, onde, por descarboxilação
oxidativa, convertem-se em duas acetilas. O processo gera 2 NADH, um por cada piruvato. Considerando-se que para cada NADH a fosforilação oxidativa produz 2,5 ATP, esta etapa rende 5
ATP
No ciclo de Krebs, cada acetila gera 1 ATP, 3 NADH e 1 FADH 2, e, por isso, ao final de duas
voltas necessárias para metabolizar as duas acetilas surgem 2 ATP, 6 NADH e 2 FADH2 • Como
por cada NADH a fosforilação oxidativa gera 2,5 ATP e por cada FADH 2, 1,5 ATP, aos 2 ATP
surgidos das duas voltas do ciclo de Krebs devem ser somados os 15 ATP fornecidos pelos 6 NADH
mais os 3 ATP fornecidos pelos 2 FADH 2 , o que perfaz um total de 20 ATP.
Somados aos 5 ou 7 ATP da glicólise e aos 5 ATP da descarboxilação oxidativa, o ganho de
energia por molécula de glicose é de 30 ou 32 ATP.
Compare-se essa produção com os exíguos 2 ATP gerados no citosol e teremos uma idéia da
importância da mitocôndria no fornecimento de energia para o funcionamento das células que
consomem oxigênio.
Com relação aos ácidos graxos, embora em sua degradação não existam processos equivalentes à glicólise e à descarboxilação oxidativa (Fig. 8.5), eles fornecem mais energia do que a glicose, o que se deve aos NADH e aos FADH 2 suplementares produzidos durante a 13-oxidação de
suas cadeias.
...
•
153
Fig. 8.15 Modo como atua a
lançadeira de malato-aspartato
para transportar à mitocôndria os
elétrons dos NADH gerados
durante a glicólise.
154
•
AS MITOCÔNDRIAS
8-20. Nas células musculares, o piruvato pode se converter em lactato
As células musculares, quando ultrapassam um determinado nível de atividade, esgotam o 0 2
atmosférico que lhes chega pelas hemácias; situação que é normal. Diante da falta de 0 2, o piruvato, em lugar de se converter no grupo acetil~a_cetil CoA) trªnsforma-se em lactato. ~ste processo metabólico é conhecido com o nome de\rermentação láctica. Como é óbvio, o ciclo de Krebs
e a fosforilação oxidativa se omitem.
O lactato produzido nas células musculares passa ao sangue e chega ao fígado. Nos hepatócitos - via piruvato - o lactato se converte em glicose, que utilizará a célula muscular se continuar demandando energia.
~~--
8-21. Nas mitocôndrias das células da gordura parda, a energia gerada
pelas oxidações se dissipa na forma de calor
Se a energia protonicomotora dos H+ situados no espaço intermembranoso' não se resgatar
para formar ATP, os H+, ao voltar à matriz mitocondrial, da mesma forma se uniriam aos e- e ao
0 2 para formar H 20, porém a energia protonicomotora, ao final da reação, se converteria em energia térmica, quer dizer, se dissiparia como calor. Isso é o que ocorre nas células adiposas da denominada gordura parda, cujas mitocôndrias são incapazes de transferir a energia protonicoDJ,Q.tor-a ao ATP. Na membrana interna destas mitocôndrias existe um transportador de H+ chamado termogenina , o qual, por não ter a porção F 1 - quer dizer, a função enzimática da ATP
sintase - , permite o retorno dos H+ à matriz mitocondrial sem que sua energia seja aproveitada
para formar ATP. Como conseqüência, a energia protonicomotora, pela reação dos H+ com os
e- e o 0 2 atmosférico durante a formação de H20 , se dissipa como calor.
A gordura parda é um tecido que os recém-nascidos possuem na região interescapular. Se a
criança_nascer_em um meio muito frio , os ácidos graxos dos triacilgliceróis depositados nas células de gordurª Qarda degradam-se e geram calor no lugar de ATP. Como vemos, a gordura parda
pode ser vital no momento do nascimento, ao permitir uma rápida adaptação dos recém-nascidos
às baixas temperaturas.
8-22. As mitocôndrias desempenham outras funções
J Remoção de Cai+ do citosol. Normalmente, esta função está a cargo do RE (Cap. 7-26). Não
obstante, quando a concentração do Ca2+ aumenta no citosol a níveis perigosos para a célula, entra em ação uma Ca2 + -ATPase localizada na membrana interna das mitocôndrias que, ao bombear
o Ca2 + para a matriz mitocondrial, o retira do citosol.
Síntese de aminoácidos. A partir de dete1minadas moléculas intermediárias do ciclo de Krebs,
nas mitocôndrias dos hepatócitos ocorrem algumas etapas metabólicas que levam à síntese de vários
aminoácidos.
" Síntese de esteróides. Em algumas células do córtex d?s s_up_ra-renaj§, dos ovái:ios_e dos testículos, a mitocôndria participa da síntese de diversos esteróiaes (funç,ão esteroidogênica). Em primeiro lugar, o colesterol captado pelas células é transportado para a mitocôndria, onde uma enzima, localizada na membrana mitocondrial interna, converte-o etnpregnenolona. Esta sai da mitocôndria e entra no RE (Cap. 7-27), onde continua seu metabolismo mediante diversas enzimas
que atuam seqüencialmente. No caso do córtex das supra-renais, dão lugar à desoxicorticosterona, ao desoxicortisol e ao andrógeno androstenodiona. Os dois primeiros esteróides, depois de
abandonar o RE, regressam à mitocôndria, onde a 1113-hidroxilase converte a desoxicorticosterona em corticosterona e o desoxicortisol em cortisol. Estes glicocorticóides são produzidos nas
células da zona fasciculada do córtex das supra-renais. Posteriormente, no citoplasma das células
da zona glomerular, por ação da 18-hidroxilase e da 18-hidroxiesteróide oxidase, a corticosterona
se converte no mineralocorticóide aldosterona. A maior parte das etapas metabólicas mencionadas são oxidações e, em seu transcurso, uma família de citocromos presentes na mitocôndria os citocromos P450 - atuam como receptores de e- .
Morte celular. No Cap. 22-4, analisamos a participação da mitocôndria na morte celular programada.
--
--
AS MITOCÔNDRIAS
•
155
REPRODUÇÃO DAS MITOCÔNDRIAS
8-23. As mitocôndrias se reprodu zem para duplicar seu número antes de
cada divisão ce lular e para substituir as que desaparecem
.
Nas células que não se multiplicam ou que têm interfases prolongadas , as mitocôndrias envelhecem e são degradadas por fagolisossomos (Cap. 7-35); no entanto , seu número se mantém
estável porque se formam outras mitocôndrias. Além disso, antes que as células se dividam, todos seus componentes se duplicam, inclusive as mitocôndrias. Em segu ida, descreveremos o
mecanismo que torna possível às mitocôndrias serem fabricadas em ambas as situações de demanda.
A reprodução das mitocôndrias não ocone como conseqüência de um encaixe espontâneo dos
componentes que as compõem e sim pela divisão de mitocôndrias preexistentes, para a qual previamente duplicam o seu tamanho. Esse processo é denominado f~são binária. Na Fig. 8.16 podemos observar as etapas de crescimento e de divisão mitocondrial.
A divisão das mitocôndrias ocone durante todo o ciclo celular, tanto na interfase como na mitose.
Além disso, nem todas as mitocôndrias se multiplicam e, por isso, algumas devem se dividir, repetidas vezes, no curso de um mesmo ciclo para compensar a falta de divisão por parte de outras.
8-24. Os fosfolipídios das membranas mitocondriais são
fornecidos pela membrana do RE
A gênese de novas mitocôndrias exige que seja duplicada a área de sua membrana interna e de
ua membrana externa, e para isso devem se somar novos fosfolipídios às suas duplas camadas
lipídicas. Da mesma forma como ocorre em outras membranas das células, os fosfolipídios são
fornecidos pela membrana do RE, onde são produzidos (Caps. 7-9 e 7-10).
Para extraí-los do RE, a mitocôndria recone a proteínas citosólicas chamadas intercambiadoras,
que os subtraem da membrana do retículo e os descarregam na monocamada citosólica da membrana mitocondrial externa, do modo ilustrado na Fig. 8.1 7. U_ma parte dos fosfolipídios passa
p <!f~QÇ.amada oposta graças a movimentos_def/ip-flop (Cap. 3-3 ). Finalmente, o transpasse
de fosfolipídios da membrana externa para a membrana interna ocone mediante pontos. de contato criado~.entre ambas as membranas para esta finalidade.
Alguns glicerofosfolipídios que chegam à membrana mitocondrial interna sofrem modificações. Por exemplo, se unem de dois a dois e formam difosfatidilglicerol (Seção 8-11 ).
~~
~~
~~
[l-
n-
~~
"""'~
~~
rv-
Membrana
do retículo
endoplasmático
de
ro-
~ ~
==
N
rroFig. 8.16 Reprodução das mitocôndrias.
~~
lt~
~,~'
r ·\
J
CITOSOL
~~ ~
I~
ma
na-
1'
l .
"'
IUI
~~
~~
:~
l!fjj
~~
~~
=- =
~~
~~
•
11
1
Proteína intercambiadora
"descarregada"
~'ªª
~~
Membrana
mitocondrial
externa
~~
~~
%
Fig. 8.17 Transferência de fosfo lipídios da dupla camada lipídica do retículo
endoplasmático para a dupl a camada lipídica da membrana mitocondrial
externa.
156
•
AS MITOCÔNDRIAS
8-25. Algumas proteínas mitocondriais são fabricadas na matriz
A maior parte das proteínas da mitocôndria provém do citosol, e outras poucas são produzidas
no território da própria organela, que conta com os recursos para elaborá-las.
A mitocôndria possui várias unidades idênticas de um DNA circular, a partir do qual são transcritos os genes de 13 RNAm (base para a síntese de outras tantas proteínas), de 22 tipos de RNAt
e de dois tipos de RNAr (um correspondente à subunidade maior dos ribossomas mitocondriais e
outro à subunidade menor). Todas estas moléculas encontram-se na matriz mitocondrial; as dos
DNA circulares estão aderidas à membrana interna da organela (Figs. 8.9 e 8.16).
Com os aminoácidos chegados do citosol, nos ribossomas mitocondriais são sintetizadas as
seguintes 13 proteínas, pertencentes, em sua maioria, à cadeia respiratória: sete subunidades do
complexo NADH desidrogenase, uma do complexo b-c 1, três do complexo citocromo oxidase e
duas subunidades da ATP sintase.
8-26. O DNA mitocondrial é diferente do DNA nuclear
Fig. 8.18 A. DNA circular da
mitocôndria humana onde estão
representados os 37 genes
presentes em suas duas cadeias.
Estão assinalados os genes dos
22 RNAt (em vermelho) , dos 2
. RNAr (em marrom) e dps 13
RNAm. Estes últimos
correspondem a 2 subunidades
da ATP sintase (em laranja) , a 7
do complexo NADH
desidrogenase (em verde), a 1 do
complexo b-c 1 (em azul) e a 3 do
complexo citocromo oxidase
(em violeta). Pode-se ver
também a área onde se acha a
origem da replicação
(acinzentado). B. DNA
mitocondrial de uma célula de
rato, observado com a técnica de
extensão e de sombreamento
metálico. (Cortesia de B.
Stevens.)
O DNA mitocondrial apresenta as seguintes particularidades que o diferenciam do DNA nuclear (Fig. 8.18):
l) É circular e não possui histonas.
2) Tem uma única origem de repl icação (Cap. 17-3), na qual uma das cadeias-filhas começa a
ser sintetizada antes da outra e o faz a partir de um ponto diferente do empregado pela segunda.
3) É muito pequeno, pois possui 37 genes somente. Em quase todos os tipos celulares, a soma
dos DNA retirados de todas as mitocôndrias representa não mais de 1% do DNA nuclear.
4) Conta com uma quantidade pequena de seqüências não-gênicas, isto é, que não se transcrevem , e que às vezes são muito curtas.
5) Gera 22 tipos de RNAt, em lugar dos 31 que transcrevem o DNA do núcleo.
6) Os dois tipos de RNAr (12S e 16S) que codificam dão lugar a ribossomas com um coeficiente de sedimentação de 55S , inferior ao dos ribossomas das células procariontes (70S) e do citosol (80S).
7) Em seu código genético existem 4 códons cujas instruções diferem das de seus pares do DNA
nuclear (Cap. 13-4). Trata-se dos códons AGA, AGG, AUA e UGA. No DNA nuclear, os dois
primeiros correspondem ao aminoácido arginina, enquanto no DNA mitocondrial se comportam
como códons de terminação. No DNA nuclear, o códon AUA determina a isoleucina, e no DNA
mitocondrial, a metionina. No DNA nuclear o códon UGA é um códon de terminação e no DNA
mitocondrial determina o triptofano.
8) São transcritas suas duas cadeias. Os genes dos 2 RNAr, de 14 RNAt e de 12 RNAm se
localizam em uma das cadeias do DNA mitocondrial, enquanto os genes restantes correspondentes a 8 RNAt e a 1 RNAm se localizam na outra cadeia.
Gln __
A:~a~
Cys~
Se r
l ys
A
\
Tyr )
/
~sp
[~~t
.-
Trp
AS MITOCÔNDRIAS
•
157
9) As moléculas de RNA que transcrevem o D A se processam enquanto se sintetizam.
O processamento corresponde à remoção de partes dos RNA.
10) Como assinalamos , a mitocôndria possui v~s....do mesmo D A e não duas
como o DNA nuclear. Devemos assinalar ainda que as mitocôndrias de qualquer indivíduo
são de origem materna, pois todas são provenientes dos ovócitos (Cap. 19-19).
8- 27. A síntese das proteínas mitocondriais necessita de uma
coordenação adequada
Embora a mitocôndria tenha DNA, RNAm, RNAt e ribossomas próprios, as proteínas
que fabrica são muito poucas, 13 no total. Por conseguinte, a maior parte das que necessita
para sua reprodução deve ser importada do citosol. Além disso , devido a essa dupla procedência, é necessária uma perfeita coordenação entre as atividades dos genomas mitocondrial e nuclear, a fim de que todos os componentes da mitocôndria sejam produzidos nas proporções adequadas.
As proteínas importadas são sintetizadas em ribossomas citosóli_f9s livres (não-associados ao RE). Entre as mais importantes encontram-se as enzimas do complexo piruvato desidrogenase, as responsáveis pelo ciclo de K.rebs e pela [3 -oxidação dos ácidos graxos, muitas das proteínas que participam da fosforilação oxidativa, os canais iônicos e as permeases
da membrana mitocondrial interna, a DNA polimerase, a RNA polimerase, as proteínas dos
ribossomas mitocondriais etc.
8-28 ... A incorporação de proteínas às membranas e aos compartimentos
mitocondriais é o resultado de um processo complexo
Conforme surgem ~os ribossomas, as proteínas mitocondriais 12roduzidaS-J10_citos.o lse
associam a chaperon~s da fªmília hsp70. Estas mantêm desdobradas as proteínas até que
cheguem à mitocôndria, a cujo corpo não poderiam se incorporar se chegassem pregueadas
(Cap. 4-5).
A passagem das proteínas através das membranas externa e interna da mitocôndria é um
processo complexo. Quando uma delas entra em contato com a membrana mitocondrial
externa, se desprende das chaperonas hsp70 citosólicas, atravessa ambas as membranas e se
associa a chaperon~ ligadas à_membrana mitocondrial interna. Estas chaperonas, que também pertencem à família hsp70, atraem a pro_teína para o interior da mitocôndria por um
mecanismo que consome ATP, talvez da maneira mostrada na Fig. 8.19. Uma vez na matriz mitocondrial, a proteína se dobra sem ajuda ou com assistência de uma chaperona da família hsp60
(Cap. 4-5).
As proteínas se incorporam à mitocôndria por meio dos translócons denominados pelas siglas
TOM e TIM (do inglês, translocase of the outer e of the inner mitochondrial membrane), presentes nas membranas mitocondriais externa e interna, respectivamente (Cap. 7-12). Como mostram
as Figs. 8.19 e 8.20, para que as proteínas possam ingressar é necessário que ambos os translócons
estejam juntos e suas luzes alinhadas , o que obriga as membranas externa e interna a se aproximarem mutuamente.
Todas as proteínas importadas do citosol incluem na sua extremidade amina um peptídeo si~alizador (peptídeo sinal) que as conduz até a mitocôndria e que é reconhecido por um receptor
e§pecífico associado ao translócon externo (Caps. 4-4 e 16-17) (Quadro 4.1 e Fig. 8.20). Se o destino
da proteína for a matriz mitocondrial, apenas atravessa os translócons, perde o peptídeo sinalizador, e se libera em seu interior (o peptídeo sinalizador é cindido por uma protease da matriz) (Fig.
8.20). Ao contrário, as~~ destinadas às~branªs exteIDa e interna possuem si11_ais..1ldicion.ais, distintos entre si, que retêm ambos os tipos de proteínas nas membranas correspondentes.
8-29. As mitocôndrias, provavelmente, derivam-se de bactérias aeróbicas
Vimos que as mitocôndrias se reproduzem podissão binária, como o fazem as bactérias. Esta
não é a única semelhança com os procariotas; assemelham-se, também, em suas formas e medidas
Fig. 8.19 Entrada das proteínas
na mitocôndria por meio de
translócons das membranas
mitocondriais externa e interna e
ação das chaperonas hsp70 da
matriz mitocondrial.
158
•
AS MITOCÔNDRIAS
Fig. 8.20 Modo como um a
proteína procedente do citosol
incorpora-se na matriz
mitocondrial.
Fixação ao - - - + Translocação - - - + Excisão do - -TOM
peptídeo sinalizador
• Pregueamento
Proteína
111------~I
MATRIZ
e porque possuem vários componentes comuns. Tais semelhanças levaram a sugerir que as mitocôndrias sejam um produto evolutivo de bactérias aeróbicas.
Outras teorias sustentam estas suposições. Assim, acredita-se que as primeiras células eucariontes eram anaeróbicas e que quando a atmosfera terrestre se tomou rica em oxigênio incorporaram em seus citoplasmas bactérias aeróbicas que, depois de sucessivas mudanças adaptativas ,
converteram-se nas mitocôndrias atuais. A simbiose permitiu as células eucariontes aproveitar o
oxigênio atmosférico, com o que começaram a produzir uma maior quantidade de energia a partir
da mesma quantidade de alimentos. Paralelamente, a membrana plasmática da célula eucarionte
ficou eximida de realizar processos energéticos e pôde se concentrar em outras atividades, como
controlar a transferência de solutos, possibilitar a entrada e a saída de macromoléculas, receber e
emitir sinais etc.
BIBLIOGRAFIA
Anderson S. , Barrei B., Sanger F. et ai. (198 1) Sequence and organization
of the mitochondrial genome. Nature 290:465.
Attardi G. and Schatz G. (1988) Biogenesis of mitochondria. Annu. Rev.
Cell Biol. 4:289.
Babcock G.T. and Wikstrõm M. (1992) Oxygen ac tivati on and the
conservation of energy in cell respiration. Nature 356:30 1.
Bereiter-Hahn J. (1990) Behavior of mitochondria in the living cell. Int.
Rev. Cytol. 122: 1.
B ianchet M. et ai. (1991) Mitochondrial ATP synthase. Quaternary structure of the F l moiety at 3.6 Á determined by X-ray diffraction anal ysis . J. Biol. Chem . 266:21197.
Boyer P.D. (1989) A perspective of the binding change mechanism for
ATP synthesis. FASEE J. 3:21 64.
Brodsky J.L. (J 996) Post-translational protein translocation: not ali
hsp70s are created equal. TIBS 21:122.
Capaldi R.A. (1990) Structure and function of cytochrome e oxidase.
Annu. Rev. Biachem. 59:569.
Clayton D.A . (1 99 1) Replication and transcripti on of vertebrate
mitochondrial DNA. Annu. Rev. Cell Biol. 7:453.
Cleves A.E. and Kelly R.B . (1996) Protein translocation: rehearsing the
ABCs. Curr. Biol 6:276.
Fergu son S.J. and Sorgato M.C. ( 19 82) Proton e lec trochemica l
gradi ents and energy transduction processes. Annu. Rev. Biochem.
51 :1 85.
Finkel E. (2001 ) The mitochondrion: Is it central to apoptosis? Science
292:624.
Gennis R. and Ferguson-Mi ller S. ( 1995) Structure of cytochrome e
oxidase, energy generator of aerobic life. Science 269 :1063.
Glick B.S. , Beas le y E.M . and Schatz G . (1992) Protein sorting in
mitochondria. TIBS 17:453.
Gray M.W. (1 989) Origin and evolution ofm itochondrial DNA. Annu.
Rev. Cell Biol. 5:25.
Grivell LA. (1983) Mitochondrial DNA. Sei. Am. 248 (3):60.
Hatefi Y. (1985) The mitochondrial electron transport and oxidative
phosphorylation system. Annu. Rev. Biochem. 45: 1015.
Hinkle P .C. , Kumar M .A. , Resetar A. and Harris D.L. (1991)
Mechanistic stoichi ometry of mitochondrial oxidative phosphorylation system. Annu . Rev. Biochem. 54: 1015.
Hofhaus G. , Weiss H. and Leonard K. (1991) Electron microscopic
analysis of the peripheral and membrane parts of mitochondrial
NADH dehydrogenase (complex l). J. Mo!. Biol. 22 1:1027.
Klingenberg M. (1990) Mechanism and evolution of the uncoupling
protein of brown adipose tissue. TIBS 15: 108.
Manella C.A. (1992) The "ins" and "outs" of mitochondrial membrane
channels. TIBS 17:315.
Manella C.A., Marko M. and Buttle K. (1997 ) Reco nsid ering
mitochondrial structure: new views of an old organelle. TIBS 22:37.
Nicholls D. and Ria! E. (1984) Brown-fat mitochondria. TIBS 9: 489.
Ostermeier C. , lwata S. and Michel H. (1996) Cytochrome e oxidase.
Cun-. Opin. Struc. Biol. 6:460.
Schatz G. (1996) The protein import system of mitochondria. J. Biol.
Chem. 271:31763.
Srere P.A. ( 1982) The structure of th e mitochondrial inner membranematrix compartment. TIBS 5:375.
Stryer L. (1995) Biochemistry, 4thEd. W.H. Freeman & Co, New York.
Stuart R.A. and Ne upert W. (1996) Topogenesis of inner membrane
proteins of mitochondria. TIBS 21 :261.
Wallace D.C. (1992) Diseases of the mitochondrial DNA. Annu. Rev.
Biachem. 6 1:1175 .
Wickner W.T. (1994) How ATP drives protei ns across membranes.
Science 266: 1197.
Wik strõm M. (1989) ldentification of th e electron tran sfers in
cy tochrome oxidase that are coupled to proton-pumping . Nature
338 :776.
Xia D. et ai. (1997) Crystal structure of the cytochrome bel complex
from bovine heart mitochondria. Science 277:60.
Yaffe M.P. ( 1999) The machinery of mitochondrial inheritance and
behavior. Science 283:1475.
Os cloroplastos
Energia celular II
9-1. Os plastídios são as organelas mais características da célula vegetal
Os plastídios são organelas especiais das células vegetais. Os mais comuns e de maior importância biológica são os cloroplastos (Fig. 1.6) que, juntamente com as mitocôndrias, constituem
as maquinarias bioquímicas que se encarregam de produzir as transf01mações energéticas necessárias para manter as funções das células. No caso dos cloroplastos, eles captam a energia eletromagnética derivada da luz solar e a convertem em energia química por um processo chamado
fotossíntese. Depois utilizam essa energia juntamente com o C0 2 atmosférico para sintetizar vários tipo~ de moléculas, algumas das quais servem de alimentos para as mesmas plantas e para os
organismos heterótrofos herbívoros (Cap. 1-4.) (Fig. 1.2).
Os cloroplastos caracterizam-se por possuir pigmentos (clorofilas, carotenóides) e, como dissemos, neles ocorre a fotossíntese. Por este processo produzem oxigênio e a maior parte da energia
química utilizada pelos organismos vivos. A vida se mantém graças aos cloroplastos. Sem eles não
existiriam plantas nem animais visto que os animais se alimentam dos cloroplastos produzidos pelos
vegetais. Desta fmma, pode-se dizer que cada molécula de oxigênio usada na respiração e cada átomo de carbono presente em seus corpos passaram em algum momento por um cloroplasto.
Além dos cloroplastos existem outros plastídios com pigmentos - os chamados cromoplastos. Nas pétalas, frutos e raízes de algumas plantas superiores há cromoplastos amarelos ou alaranjados. Em geral, estes têm menor conteúdo de clorofila e , portanto, menor atividade
fotossintética. A cor vermelha do tomate maduro é devida à presença de cromoplastos cujo pigmento vermelho, chamado licopeno, pertence ao grupo dos carotenóides. Nas algas vermelhas
existem cromoplastos que contêm, além de clorofila a e carotenóides, um pigmento vermelho e
um pigmento azul, a ficoeritrina e a ficocianina, respectivamente. _
Outros plastídios são incolores. Denominam-se leucoplastos e são encontrados tanto nas células embrionárias como nas células dos órgãos das plantas que não recebem luz. Devemos assinalar que os plastídios das células dos cotilédones e dos esboços foliáceos do caule inicialmente são
incolores, porém mais tarde começam a acumular clorofila e adquirem a cor verde característica
dos cloroplastos. Todavia, as células diferenciadas possuem leucoplastos verdadeiros que nunca
se tomam verdes. Alguns leucoplastos - que recebem o nome de amiloplastos - produzem e
acumulam grânulos de amido. São desprovidos de ribossomas , tilacóides e pigmentos e são muito
abundantes nas células das raízes e dos tubérculos.
9-2. As características dos cloroplastos variam segundo
os tipos celulares
Os cloroplastos localizam-se, principalmente, nas células do mesófilo, tecido que é encontrado
nas folhas das plantas superiores e nas algas. Cada célula contém um número considerável de cloroplastos de forma esférica, ovóide ou discóide. Seu tamanho varia consideravelmente, porém,
em média, têm um diâmetro de 4 a 6 µm . Esta medida pode ser constante para cada tipo celular,
embora seja muito maior nas células poliplóides do que nas células diplóides . Em geral , nas plantas que crescem à sombra, os cloroplastos são maiores e mais ricos em clorofila.
9
160 •
OSCLOROPLASTOS
Fig. 9.1 Acima. Esquema
tridimensional do cloroplasto,
com seus principais
componentes. Abaixo. Esquema
tridimensional de dois grana e de
tilacóides que atravessam o
estroma do cloroplasto.
Membrana
externa
Membrana
interna
Espaço tilacoidal
O número de cloroplastos se mantém relativamente constante nos diversos vegetais. As algas
possuem, às vezes, um único cloroplasto muito volumoso. Nas plantas superiores existem entre
20 e 40 por célula. Nas folhas de algumas espécies calculou-se que há cerca de 400.000 cloroplastos por mm 2 • Se seu número for insuficiente, aumenta por divisão; se for excessivo, reduz-se por
degeneração.
Em cloroplastos isolados de espinafre foram verificadas alterações de forma e volume por ação
da luz. O volume diminui acentuadamente quando são iluminados, embora este efeito seja reversível.
9-3. A estrutura dos cloroplastos inclui o envoltório, o estroma e os
tilacóides
O cloroplasto tem três componentes principais: o envoltório, o estroma e os tilacóides (Fig.
9.1).
O envoltório dos cloroplastos apresenta duas membranas - uma externa e outra interna pelas quais ocorrem os intercâmbios moleculares com o citosol. No cloroplasto maduro - ao
contrário do seu predecessor - não se observa continuidade entre a membrana interna e os tilacóides. Ambas as membranas são desprovidas de clorofila, porém têm cor amarela pela presença
de pigmentos carotenóides. Contêm unicamente 2% das proteínas do cloroplasto.
O estroma representa a maior parte do cloroplasto e nele se encontram imersos os tilacóides.
É composto, principalmente, por proteínas. Contém DNA e também RNA que intervêm na síntese de algumas das proteínas estruturais e enzimáticas do cloroplasto. É no estroma que se produz
a fixação do co2 - quer dizer, a produção de carboidratos - assim como a síntese de alguns
ácidos graxos e proteínas.
Os tilacóides são sacos achatados agrupados como pilhas de moedas. Cada pilha de tilacóides
recebe o nome de granum (plural grana), e a cada um dos elementos que formam as pilhas dá-se
o nome de tilacóides dos grana ou intergrana (Figs. 9 .1 e 9 .2). Além disso, há tilacóides que atra-
r
OS CLOROPLASTOS
Parede secundária
Membrana plasmática
Parede celular
vessam o estroma e que conectam dois grana entre si, denominados tilacóides do estroma (Figs.
9.1 , 9.2 e 9.3). No entanto, a descrição anteriormente citada é enganosa, pois a rigor existem tilacóides pequenos - com um diâmetro médio de 1 µ,m (a maioria dos tilacóides dos grana) e tilacóides grandes e alongados, compartilhados por dois grana. Nestes , distinguem-se três setores:
duas ex1remidades que aparentam ser tilacóides dos grana e um segmento intermediário que corresponde ao tilacóide do estroma.
A parede dos tilacóides - chamada membrana do tilacóide - é uma dupla camada lipídica
repleta de proteínas e de outras moléculas, quase todas envolvidas nas reações químicas da fotossíntese. Esta parede separa os compartimentos dos tilacóides - ou seja, o espaço tilacoidal - do
estroma. Algumas evidências parecem indicar que, direta ou indiretamente, as luzes de todos os
tilacóides estão interconectadas, de modo que existiria apenas um espaço tilacoidal (Fig. 9.4).
Portanto, o clbroplasto teria três compartimentos: o intermembranoso (entre a membrana externa e a membrana interna), o estroma (entre a membrana interna e a membrana do tilacóide) e o
espaço tilacoidal. Veremos que, do ponto de vista funcional , o espaço tilacoidal equivale à matriz
mitocondrial.
Fig. 9.3 Eletromicrografia do cloroplasto que mostra dois grana e os tilacóides do estroma que os
onectam. As setas indicam a cavidade do compartimento membranoso dos grana, ou seja, o espaço
tilacoidal. 240.000X. (Cortesia de I. Nir e D. C. Pease.)
•
161
Fig. 9.2 Eletromicrografia do
cloroplas to. Trata-se de um corte
longitudinal que mostra os grana
e os tilacóides do estroma
(intergrana). (Cortesia de M.
Cresti e M. Wurtz.)
162
•
OS CLOROPLASTOS
Fig. 9.4 Esquema que ilustra a
continuidade do espaço
ti lacoidal e como se encontra
separado do estroma.
Membrana
do tilacóide
9
f
w
Estroma
H
m
FOTOSSÍNTESE
9- 4. Na fotossíntese a energia luminosa se converte em energia química
A fotossíntese é uma das funções biológicas fundamentais das células vegetais. Por meio da
clorofila contida nos cloroplastos, os vegetais verdes são capazes de absorver a energia que a luz
solar emite como fótons e transformá-la em energia química. Esta se acumula nas ligações químicas entre os átomos das moléculas alimentícias que se formam com a ajuda do co2 atmosférico.
No Cap. 8-15 analisamos a fosforilação oxidativa que ocorre na mitocôndria, mediante a qual se
processa a energia contida nas substâncias alimentícias. A fotossíntese é, em certa medida, um
processo inverso, de modo que os cloroplastos e as mitocôndrias possuem muitas semelhanças
. estruturais e funcionais.
Na fotossíntese, a reação principal é:
n C0 2
+ n Hp -7 luz-clorofila -7 (CHp) + n 0 2 ,
0
(1)
que consiste na combinação de C02e H20 para formar carboidratos com liberação de 0 2.
Calculou-se que cada molécula de C0 2 da atmosfera incorpora-se a um vegetal a cada 200 anos,
e que o 0 2 do ar é renovado pelas plantas a cada 2.000 anos. Sem plantas não existiria 0 2 na atmosfera terrestre e a vida seria quase impossível.
É importante assinalar que na reação (1) a Hp é o doador de H2 (e- e H+) e de 0 2, enquanto
co2atua como receptor de 8i·
Os carboidratos formados pela fotossíntese são saca1ideos solúveis que circulam pelos diferentes tecidos da planta ou se acumulam como grãos de amido nos cloroplastos (Fig. 9.2) ou,
mai s freqüentemente, nos amiloplastos. Além disso, como resultado de diversas reações que envolvem a participação de diferentes sistemas enzimáticos, o material surgido pela fotossíntese pode
se converter - em geral fora dos plastídios - em um polissacarídeo estrutural ou em lipídios ou
proteínas da planta.
9-5. A clorofila é um pigmento capaz de ser excitado pela luz
A luz visível corresponde a uma pequena porção do espectro de radiação eletromagnética total
e compreende os comprimentos de onda de 400 a 700 nm. A energia contida nesses comprimentos é transmitida mediante unidades denominadas fótons. Um fóton contém 1 quantum de energia. Isto é expresso pela equação de Max Planck no ano de 1900:
E= hc
'A. '
onde h é a constante de Planck (1 ,585 X 1034 cal/s), c é a velocidade da luz (3 X 10 10 cm/s) e À é
o comprimento de onda da radiação. Desta equação deduzimos que os fótons com comprimentos
de onda mais curtos têm maior energia.
Os pigmentos, como a clorofila, estão particularmente adaptados para ser excitados pela luz.
Assim , os fótons que absorvem a clorofila excitam certos elétrons que, ao se deslocar da órbita de
seus átomos, adquirem um nível de energia maior, ou seja, um elevado potencial de transferência.
Esta energia pode ser dissipada em forma de calor ou de radiação luminosa (fluorescência), ser
transferida de uma molécula a outra por ressonância, ou se converter em energia química. Na fotossíntese predominam os dois últimos processos.
OS CLOROPLASTOS
•
163
9-6. A fotossíntese compreende reações fotoquímicas e
reações na ausência de luz
A fotossíntese compreende uma série complexa de reações, algumas das quais ocorrem exclusivamente na presença de luz e ocorrem na sua ausência (embora essas também possam ocorrer
na presença de luz). São chamadas, respectivamente, reações luminosas (ou fotoquímicas) e reações na ausência de luz.
Nas fases finais das reações fotoquímicas são formados NADPH (a partir de NADP+, e- e
H+) e ATP (a partir de ADP e fosfato). Ambos os processos imitam o que ocorre normalmente nas
mitocôndrias. Na fotossíntese, a formação de ATP é conhecida com o nome de fotofosforilação.
Devemos lembrar que na fosforilação oxidativa - nas mitocôndrias - o fluxo de elétrons se
desloca desde o NADH (ou o FADH2) até o 0 2 com produção de HzO (Cap. 8-17) . Na fotossíntese, ocorre o fenômeno oposto, pois os elétrons fluem da H20 - previamente dissociada em 0 2 ,
H+ e e- - até o NADPH.
As reações na ausência de luz completam o ciclo fotossintético. A energia contida nos ATP e
nos NADPH é aproveitada pela célula vegetal para elaborar diversas moléculas alimentícias com
o co2extraído da atmosfera.
9-7. Existem vários tipos de clorofilas
As reações fotoquímicas ocorrem na membrana do ti_lacóide, cuja dupla camada lipídica contém uma série de complexos protéicos transmembrana, alguns associados a pigmentos que são os
encarregados de capturar a energia luminosa do sol. Existem vários tipos , cada um deles capaz de
absorver"' uma gama pa1ticular de comprimento de onda do espectro luminoso.
Entre os pigmentos destacam-se as clorofilas, moléculas assimétricas que contêm
H 2C - CH
uma cabeça hidrófila integrada por quatro anéis pirrólicos unidos por um átomo de magnésio e uma cauda hidrófila (fito!) ligada a um dos anéis (Fig. 9.5).
H,C
Outros pigmentos presentes na membrana do tilacóide são os carotenóides (xantofilas e carotenos) (Fig. 9.5), que ficam ocultos pela cor verde da clorofila. Quando no
outono esta diminui, podem ser vistas as cores amarela, alaranjada e ve1melha dos ca- H, C
rotenóides.
Existem dois tipos de clorofila identificados com as letras a e b. Na clorofila b, um
grupo de-CHO substitui um-CH 3 da clorofila a (marcado com um círculo na Fig. 9.5).
Por outro lado, há vá1ios tipos de clorofila a, caracterizados por suas composições químicas, seus espectros de absorção da luz e suas funções , três dos quais se destacam: um
muito abundante, encarregado de captar energia luminosa, e outros dois especiais r
CH
menos numerosos - chamados P 680 e P 700 (P, pigmento; o número identifica o compri1
C-CH ,
mento de onda que cada pigmento absorve mais eficientemente).
1
CH 3
CH 2
1
9-8. Na membrana dos tilacóides encontram-se os complexos
moleculares responsáveis pelas reações fotoquímicas
CH,
1
CH,
1
CH-CH 3
CH 2 CH 3
CH,
r-'XCH,
)--<_
CH 3
'CH 3
CH
/
HC
"'
C-CH,
/
HC"'-._
CH
HC
/
"
c-cH 3
HC/
j ""'
CH
H
~,
1
Assim como na membrana interna das mitocôndrias há cadeias transportadoras de
elétrons que dão lugar à fosforilação oxidativa, na membrana do tilacóide dos cloroplastos também há cadeias de complexos moleculares que aqui são responsáveis pelas reações fotoquímicas. Cada uma das cadeias é composta pelos seguintes elos, mencionados na ordem em que são ativados (Fig. 9.6).
Fotossistema II. É um complexo molecular com dois setores claramente definidos:
a antena, que é o setor voltado para o estroma e se encarrega de captar a Illz, e o centro
de reação, que é voltado para o espaço tilacoidal. A antena é comparada a um funil e
sua parede se compõe de agregados de proteínas e pigmentos, especialmente de clorofila a, clorofila b e carotenóides. Por sua vez, o centro de reação contém várias proteínas associadas a moléculas de clorofila do tipo P680 .
Complexo b-f. Este complexo contém uma proteína de 17 kDa associada aos citocromos b e f, e uma proteína com um centro Fe-S.
CH 2
1
CH 2
1
CH i
1
CH - CH,
1
CH 2
1
CH,
1
CH 2
1
CH-CH,
1
CH ,
Clorofila a
~-Ca roteno
Fig. 9.5 Estrutura química da clorofila a
(observar o grupo CH 3 com um círculo) e
do j3-caroteno.
164
•
OS CLOROPLASTOS
Fig. 9.6 Estrutura molecular da
membrana do tilacóide. A linha
espessa marca o fluxo de
elétrons através de uma cadeia
de complexos moleculares. A
energia luminosa é captada pelo
fotossistema II. Ocorre a fotólise
da Hp no interior do tilacóide e
os elétrons são transmitidos à
plastoquinona (PQ). Dali passam
ao complexo b-f e, em seguida, à
plastocianina (PC). Esta
transfere-os para o fotossistema
I, que absorve luz. Em seguida,
os elétrons são transportados
para a ferredoxina (Fd) e para a
NADP redutase, que reduz o
NADP+ a NADPH. O acúmulo
de prótons (H+) no interior do
tilacóide cria um gradiente com
relação ao estroma, de modo que
os H+ saem através da ATP
sintase e ocorre a produção de
ATP. (Cortesia de L. Bogorad;
modificado.)
ESTROMA
H+
ESPAÇO TILACOIDAL
Fotossistema 1. É um complexo molecular que, como o fotossistema II, possui uma antena
captadora de energia luminosa, integrada por proteínas, clorofila a, clorofila b e carotenóides além
de um centro de reação, composto por proteínas e moléculas de clorofila do tipo P 700 •
NADP redutase. Este complexo reduz o NADP+ extraído do estroma e o converte em NADPH. Os H+ necessários para a redução pertencem ao estroma.
Como observamos na Fig. 9.6, entre estes complexos se encontram várias moléculas intermediárias: 1) a plastoquinona, entre o fotossistema II e o cc::implexo b-f (equivale à ubiquinona das
mitocôndrias); 2) uma pequena proteína chamada de plastocianina, entre o complexo b-f e o fotossistema 1 e 3) a ferredoxina, entre o fotossistema 1 e a NADP redutase.
9-9. A membrana dos tilacóides dispõe de ATP sintase
Nas imediações das cadeias responsáveis pelas reações fotoquímicas encontra-se a ATP sintase que - como na mitocôndria - possui uma porção transmembrana F0 pela qual passam prótons e uma porção F 1 que gera ATP a partir de ADP e fosfato (Cap. 8-16). A porção F 1 é voltada
para o estroma do cloroplasto (Fig. 9.6).
9-1 O. Os fótons excitam as clorofilas dos fotossistemas li e 1
Quando um fóton excita uma molécula de clorofila, um dos elétrons desta última é extraído de
sua órbita molecular para ser transferÍdo a outra de maior energia.
No caso das clorofilas situadas na antena do fotossistema II, a energia do elétron energizado é
transferida por ressonância a um dos elétrons da clorofila P680 , localizada, como vimos, no centro
de reação. O novo elétron energizado abandona o fotossistema II e passa ao seguinte elo da cadeia
de reações fotoquímicas , a plastoquinona. Enquanto isso, mediante uma reação química não muito bem compreendida (na qual intervêm átomos de manganês), duas moléculas de H 20 situadas
no espaço tilacoidal são cindidas e geram 4 H+, 4 e- e uma molécula de 0 2• Cada um destes elétrons passa ao centro de reação do fotossistema II e substitui o que saiu da clorofila P680 , transferido, como vimos, para a plastoquinona.
Em seguida, o e- passa da plastoquinona ao complexo b-f, onde parte de sua energia é utilizada
para transportar um H+ para o espaço tilacoidal de encontro ao gradiente eletroquímico (este H+
se soma aos gerados pela excisão da H 2 0). O e-, com um potencial energético menor, passa do
complexo b-f para a plastocianina e desta ao fotossistema 1. Para explicar seu destino, vejamos as
reações que acontecem no fotossistema 1.
Por ação da luz ocorrem processos equivalentes aos registrados no fotossistema II, com as seguintes particularidades: 1) o e- energizado no centro da reação corresponde à clorofila P700 (e
não a P680 ); 2) este e- é transferido para a ferredoxina (e não para a plastoquinona) e é substituído
pelo elétron de baixo potencial energético proveniente da plastocianina (e não da excisão de ~O).
O e- transferido para a ferredoxina, que como acabamos de ver foi revitalizado consideravelmente, deixa esta molécula transportadora e ingressa na NADP redutase onde parte de.sua energia
é utilizada para reduzir um NADP+ a NADPH na face da membrana do tilacóide voltada para o
estroma. Neste processo é utilizado um H+ extraído do estroma.
OS CLOROPLASTOS
•
165
A última etapa das reações fotoquímicas corresponde à formação de ATP a partir de ADP e
fosfato , ou seja, à fotofosforilação. Esta ocorre na ATP sintase que, por sua porção F0 , permite o
traslado passivo dos H+, desde o espaço tilacoidal, para o estroma. Durante esta passagem, a energia protonicomotora contida nos H+ é cedida à porção F , da ATP sintase. Finalmente, a ATP sintase utiliza a energia para sintetizar ATP (Fig. 9.6).
Por intermédio da fosforilação dos vegetais verdes pode ser produzida uma quantidade de ATP
30 vezes maior que a obtida nas suas mitocôndrias. Por outro lado, as células vegetais têm muito
mais cloroplastos que mitocôndrias.
São necessários oito fótons para liberar duas moléculas de 0 2 (mais 8 e- e 8 H+) da Hp. A
energia destes fótons , transferida para os e- , quando estes alcançam a NADP redutase, gera 2
NADPH, enquanto o gradiente de H+ - conseqüência também da energia cedida pelos elétrons
- possibilita a síntese de 3 ATP.
9-11. As reações na ausência de luz ocorrem no estroma do cloroplasto
Nas reações fotos sintéticas que ocorrem na ausência de luz, as moléculas da ATP e NADPH
- produzidas pelas reações fotoquímicas - proporcionam a energia necessária para sintetizar
carboidratos a partir de C0 2 e ~O. Tal síntese ocorre no estroma do cloroplasto mediante uma
série de reações químicas, agrupadas sob o nome de ciclo de Calvin ou ciclo C3, nas quais intervêm várias enzimas localizadas no estroma.
Como podemos observar na Fig. 9.7, a reação inicial pela qual ingressam o C0 2 e a Hp no
ciclo de Calvin é catalisada pela enzima ribulose 1,5-difosfato carboxilase. Trata-se de uma enzima de grande tamanho (500 kDa) que se supõe representar, aproximadamente a metade das proteínas do estroma.
Pela ação desta enzima, 6 ribuloses 1,5-difosfato (são pentoses) combinam-se com 6 C0 2 e
produzem 12 moléculas de 3-fosfoglicerato. Em seguida, estas 12 trioses são fosforiladas com
fosfatos fornecidos por outros tantos ATP, o que gera 12 moléculas de 1,3-difosfoglicerato. Cada
uma destas moléculas, de 3 carbonos, perde 1 fósforo e tem a capacidade de aceitar H+ e e- do
NADPH e, por isso, se converte em 3-fosfogliceraldeído. Duas das 12 moléculas de 3fosfogliceraldeído abandonam o ciclo e se conve1tem na matéria-prima a partir da qual - por
meio de enzimas específicas - são sintetizados os monossacarídeos, os ácidos graxos e os aminoácidos que formam as moléculas estruturais e alimentícias da célula vegetal. Por seu turno, as
dez moléculas de 3-fosfogliceraldeído restantes são reduzidas a 6 moléculas de ribulose 1,5-difosfato. Estas são fosforiladas (com fosfatos fornecidos por outros tantos A TP) a 6 ribuloses 1,5difosfato, com as quais se inicia - enquanto haja C0 2 - outra volta do ciclo de Calvin.
H,c-o-®
HO-tH
t ooH
Ci
O, y (
3-Fosfoglicerato
J~~:
H,t -o-©
·
H,O
Ribulo
carboxila
1-1,c- o-®
1-1,c- o-®
t~o
Ribulose 1,5·
difosfato
H
t-o
HO-t H
t
H
H/
3-fosfogliceraldeído
' O
1
HC - 0 11
J
H,t- o-©
Ciclo que compreende
compostos
e,, e, e,, e.. e,
H,C- OH
t
=0
/ À "'-..,.
1
HC - O H
1
HC-O H
H.t- o-®
Ribulose 5-fosfato
Hexases e outros
carboidratos
Fig. 9.7 Ciclo de Calvin (ou do
C3) da fotossíntese, no qual o
co2é reduzido e carboidratos
são sintetizados.
166
•
OS CLOROPLASTOS
9-12. A fotossíntese gera água, oxigênio e hexases
O balanço químico da fotossíntese é:
6 co2 + 128i0 ~ C6Hlp6 + 6 0 2 + 6Hp,
que representa um acúmulo de 686.000 calorias por mol. Esta energia é fornecida por 12 moléculas de NADPH e 18 de ATP, que contêm 750.000 calorias. Assim sendo, a eficiência do ciclo de
fo tossíntese chega a 90%.
Como vimos, os fótons absorvidos pela clorofila e por outros pigmentos são, primeiro, convertidos em energia química na forma de ATP e NADPH. Durante esta fase fotoquímica a Hp perde
seu 0 2 , o qual é liberado para a atmosfera como um subproduto. A redução da C0 2 ocorre na ausência de luz (não necessariamente) , sempre que haja ATP e NADPH. Os produtos desta fase são
hexoses, a partir das quais, em outros lugares da célula, são gerados diversos tipos de carboidratos , lipídios e proteínas.
9-13. Nas plantas tropicais ocorre um ciclo C4
O ciclo de Calvin ocorre nos vegetais superiores, porém em algumas células de plantas tropicais existe um ciclo cujo produto não é o 3-fosfoglicerato, mas sim uma molécula de 4 carbonos,
o oxalacetato. Uma das primeiras reações deste ciclo consiste na ligação do C0 2 com uma molécula de 3 carbonos, o fosfoenolpiruvato . A enzima atuante é a fosfoenolpiruvato carboxilase e o
produto é o citado oxalacetato. Este se converte em malato, que se dirige para as células da planta
que contam com o ciclo de Calvin. Nelas, o maiato perde um C0 2, que entra no ciclo de Calvin, e
se transforma em piruvato. Este composto de três carbonos retoma às primeiras células, onde se
converte em fosfoenolpiruvato e dá início a um novo ciclo C4 .
BIOGÊNESE DOS CLOROPLASTOS
9-14. Os plastídios se desenvolvem a partir de pró-plastídios
Os plastídios se desenvolvem a partir de estruturas precursoras chamadas pró-plastídios, que
se encontram nas células vegetais não diferenciadas. Segundo o tipo celular, os pró-plastídios se
convertem em leucoplastos - isentos de pigmentos - ou em cromoplastos, nos quais se encontram os cloroplastos. O desenvolvimento destes últimos é ilustrado na Fig. 9.8.
o
®
~
~
Fig. 9.8 Origem e
desenvolvimento dos plastídios
na presença da luz.
Fase de
pró-plastídio
OS CLOROPLASTOS
A primeira estrutura que aparece é o citado pró-plastídio, de forma discóide, com um diâmetro
de cerca de 1 µ,me uma parede integrada por duas membranas. Na presença de luz, a membrana
interna do pró-plastídio cresce e emite vesículas - na direção do estroma - que depois se transformam em sacos achatados. Estes são os futuros tilacóides que, em algumas regiões, se empilham
estreitamente até formar os grana. No cloroplasta maduro , os tilacóides já não se acham ligados à
membrana, porém os grana ficam unidos entre si pelos tilacóides do estroma.
Se colocarmos uma planta em um meio pouco iluminado, ocorre um fenômeno denominado
estiolação, no qual as folhas perdem sua cor verde e as membranas dos tilacóides se desorganizam. O agregado destas dá lugar aos corpos prolamelares, nos quais as membranas adquirem uma
disposição em forma de rede. Nas bordas destes corpos aparecem aderidas membranas de tilacóides jovens que são desprovidas de atividade fotossintética.
O cloroplasta, depois desta conversão dos tilacóides, muda seu nome para estioplasto. Quando as plantas estioladas são expostas à luz, os tilacóides reaparecem e as membranas do material
prolamelar são utilizadas para sua organização.
9-15. O cloroplasta comporta-se como uma organela semi - autônoma
Do mesmo modo que as mitocôndrias, os pró-plastídios e os cloroplastos multiplicam-se por
fissão binária (Cap. 8-23), processo que exige crescimento de pró-plastídios e de cloroplastos
preexistentes, os quais devem duplicar o seu tamanho. Como é óbvio, este crescimento, o mesmo
que é experimentado pelos pró-plastídios em vias de se converter em cloroplastos maduros , exige
que sejam sintetizados os componentes protéicos normais da organela. Em tal síntese, intervêm
dois sistemas genéticos, um próprio do cloroplasta e o nuclear.
Os cioroplastos contêm DNA, RNA e os demais componentes que intervêm na síntese protéica. Todavia, a maioria de suas proteínas é proveniente do citosol, de modo que são codificadas
por genes nucleares. Como vemos, os cloroplastos são semi-autônomos e dependem da cooperação de dois sistemas genéticos, um próprio e exclusivo da organela e outro pertencente a toda a
célula.
Os cloroplastos possuem um DNA circular de cerca de 45 µ,m de comprimento e em tomo de
135.000 pares de bases (é conhecida a seqüência da maioria de seus genes). Além disso, contêm
ribossomas pequenos que representam até 50% de todos os ribossomas das células fotossintéticas. Estima-se que cerca de 10% das proteínas do cloroplasta sejam sintetizadas na organela e que
as restantes - isto é, a grande maioria - sejam retiradas do citosol.
Uma das enzimas que participa na elaboração de sacarídeos a partir do C02 - a ribulose 1,5difosfato carboxilase (Fig. 9.7) - representa cerca de 50% das proteínas solúveis totais encontradas nos cloroplastos e, por isso, poderia ser a proteína mais abundante na natureza. Possui duas
subunidades, uma de alto peso molecular (de cerca de 400 kDa) e outra menor (de cerca de 100
kDa).
A subunidade maior é codificada por genes do DNA do cloroplasta, enquanto a menor é codificada por genes nucleares (Fig. 9.9) . Esta última é sintetizada no citosol (em ribossomas livres)
sob a forma de uma molécula precursora, que ingressa no estroma do cloroplasta e ali é clivada,
até alcançar seu tamanho definitivo. O envoltório do cloroplasta tem receptores que reconhecem
os peptídeos sinalizadores das proteínas que devem ser incorporadas à organela. No caso da subunidade menor da ribulose 1,5-difosfato carboxilase, depois de entrar no cloroplasta, seu peptídeo
sinalizador é excindido por uma protease presente no envoltório da organela e a subunidade é liberada no estroma.
A Fig. 9.9 resume um modelo que explica a síntese das duas subunidades da ribulose 1,5-difosfato carboxilase em proporções equimoleculares. O modelo sugere que a subunidade menor
controla o ritmo sintético da subunidade maior, com a qual logo se associa para formar a enzima
ativa.
9-16. O cloroplasta seria derivado de uma simbiose
O cloroplasto seria o resultado de uma simbiose entre um microrganismo autotrófico (uma
bactéria) suscetível de captar energia luminosa e uma célula hospedeira heterótrofa (de um
•
167
168
•
OS CLOROPLASTOS
Fig. 9.9 Modelo proposto para a
síntese da enzima ribulose 1,5difosfato carboxilase. (RD Case).
(De P. E. Highfield e R. J. Ellis.)
()
NÚCLEO
DNA
RNAm -
Precursor
/
CITO SOL
eucariota). Embora esta hipótese sirnbiótica seja atraente, vimos que o cloroplasto possui em seu
DNA uma quantidade de informação genética que somente permite codificar 10% de suas proteínas, além dos RNA ribossômicos, mensageiros e de transferência utilizados na síntese destas. Da
mesma fo1ma que na mitocôndria (Cap. 8-25), a maioria dos componentes do cloroplasto é elaborada sob a dependência de genes nucleares.
BIBLIOGRAFIA
Anderson J.M. (1986) Photoregulation of the composition, function, and
structure of thylakoid membranes. Annu. Rev. Plant Physio l. 37:93.
Barber J. (1987) Photosynthetic reaction centers: a common link. TIBS
12:321.
Bjorkman O. and Berry J. (1973) High-efficiency photosynthesis. Sei.
Am. 229 (4):80.
Cramer W .A., Widger W.R., Hermann R.G. and Trebs t A. (1985)
Topography and functi on of thylakoid membrane proteins. TIBS
10:125.
Fromm P. (1996) Structure and function of photosystem I. Curr. Opin.
Struc. Biol. 6:473 .
Knaff D.B. ( 1989) Structure and regulation of ribulose-1 ,5-biphosphate
carboxy lase/oxygenase. TIBS 14: 159.
Krauss N. et ai. (1993) Three-dimensional structure of system 1 of
photosy ntesis at  resolution. Nature 361 :326.
Prince R. C. (1996) Photosynthesis: the Z-scheme revised. TIBS 21: 12 1.
Stowell M.H.B. et al. (1997) Light- induced structura l changes in
photosynthetic reaction center: implications for mec hanism of
electron-proton transfer. Science 276:81 2.
Stryer L. (1988) Biochemistry, 3rd Ed. W.H. Freeman & Co, New York.
Youvan D. and Mar rs B .L. ( 1987) Molec ul ar mechanisms of
photosynthesis. Sei. Am. 256:42.
Os peroxissomas
Desintoxicação celular
10-1 . Os peroxissomas contêm enzimas oxidativas
:
,_
ki
1Õs
..... peroxissomas são organelas que se encontram em todas as células; sua forma é ovóide e
limitam-se por 1:!!]laJinica.rukmbrzna (Figs. 7 .6 e 10.1). Possuem um diâmetro médio de 0,6 µme
seu número varia entre 70 e 100/célul~';'êmbora nas células hepáticas e renais possam ser em quantidades muito maior.
._Os peroxissomas contêm enzimas oxidativas e cumprem variadas funções metabólicas. Recebem esse nome por serem capazes de formar e decompor peróxido de hidrogênio (H 2 0 2 ). Em
conjunto, há aproximadamente 40 enzimas nos peroxissomas.
E ~istem muitos tipos de peroxissomas, que se diferenciam entre si pela enzima ou pelo conjunto de enzimas presentes em seu interior. Devemos assinalar que cada tipo celular possui peroxissomas que contêm uma dete1minada enzima ou uma variedade particular de enzimas.
Entre as enzimas mais comuns detectadas nos peroxissomas encontram-se a catalase, a D-aminoácido oxidase, a urato oxidase e as responsáveis pela [?>-oxidação dos ácidos graxos (Cap. 8-82]
Os peroxissomas que contêm urato oxidase exibem um pequeno corpo cristalino composto por
múltiplos microcristais.
Com exceção da catalase - que converte H 20 2 em H 20 e 0 2 - as enzimas restantes oxidam
os seus substratos, representados por ácidos graxos, aminoácidos, purinas (adenina, guanina), uratos,
ácido úrico etc.
Ao contrário do que ocorre nas mitocôndrias - onde as oxidações produzem energia química
(ATP) - nos peroxissomas, as oxidações produzem energia térmica. No entanto, a [?>-oxidação
dos ácidos graxos conduz finalmente à formação de ATP, visto que os grupos acetila produzidos
nos peroxissomas se transferem às mitocôndrias e ingressam no ciclo de Krebs. É necessário lembrar que somente uma pequena porção dos ácidos graxos celulares é oxidada nos peroxissomas
(no Cap. 8-8 assinalamos que esta função é cumprida principalmente nas mitocôndrias).
10-2. Nos peroxissomas é produzido o H2 0 2 , que é neutralizado
pela catalase
Asi_xidaç~stratQs_ nos peroxissomas tem como conseqüência a formação de H2 0 2 , uma
molécula extremamente tóxica para a célula. Na seção anterior dissemos que a enzima encarregada de neutralizar o Hp 2 é a catalase, que o degrada mediante a seguinte reação:
2HO _
2
2
catalase
)
2HO
2
+ O2
10-3. A catalase também degrada o H2 0 2 produzido fora dos peroxissomas
A catalase não só degrada o H 2 0 2 produzido nos peroxissomas , como também o que é produzido em outros pontos da célula, particulannente nas mitocôndrias, no retículo endoplasmático e
no citosol. Nestes sítios, as oxidações dão lugar a pequenas quantidades de ânions superóxido
(0 2 -), amiúde conhecidos pelo nome de radicais livres. Estes radicais são muito reativos, e uma
enzima, a superóxido dismutase, se encarrega de eliminá-los mediante a seguinte reação:
10
170
•
OS PEROXISSOMAS
Fig. 10.1 Eletromicrografia de uma célula hepática corada por método imunocitoquímico para locali zar a
catalase nos peroxissomas (P). Observam-se várias mitocôndrias. 30.000X. (Cortesia de H. F. Fahimi e S.
Yokota.)
2 (o 2- )
+ 2 H ~'
superóxido dismutase
-~-------+
H 2O 2
+ O2
Por sua vez, nos peroxissomas, este 8i0 2 é convertido em H 2 0 e 0 2 pela ação da catalase.
Suspeita-se que o ânion superóxido produza rdas de sulfridilas nas roteínas, alte_rações na
dupla qun_ada lipídica das membranas celulares e mut~çQ_e s g_ênicas, o que poderia acelerar o envelhecimento orgânico e facilitar o aparecimento de quadros cancerígenos.
10-4. A catalase utiliza o H2 0 2 para neutralizar as substâncias
tóxicas da célula
Nas células hepáticas e renais, a catalase atua também como uma enzima desintoxicante. Para
tanto, diante da presença de certos produtos tóxicos, em lugar de converter o H 20 2 em H 20 e 0 2
utiliza o H 20 2 para oxidá-los e neutralizar sua toxicidade. A reação pode ser expressa mediante a
seguinte equação:
catalase
l
Fig. 10.2 Reprodução dos
peroxissomas.
)
2 H 2O
+T
A sigla TH2 simboliza a substância tóxica, e a T a mesma substância depois de sua oxidação.
Exemplos de substâncias tóxicas neutralizadas por este mecanismo são os fenóis, o formaldeído, o ácido fórmico e o etanol. Parte do etanol ingerido com as bebidas alcoólicas é neutralizado
pela catalase dos peroxissomas que o oxida em acetaldeído .
.. 10-5. Os peroxissomas se reproduzem por fissão binária
f"Zredita-se que os peroxissomas tenham uma vida média de 5 a 6 dias, ao fim dos quais são
eliminados por autofagossomos. Seu número é restabelecido do mesmo modo como o das mitocôndrias (Cap. 8-23), por meio da duplicação de peroxissomas "jovens", ou seja, por fissão binária de peroxissomas preexistente~ (Fig. 10.2). Como é óbvio, antes da mitose ocorre a duplicação
de todos os peroxissomas da célula. Para que a fissão binária se concretize, previamente devem
ser duplicadas as estruturas que integram o peroxissoma.
Assim, a dupla camada lipídica de sua membrana cresce pela agregação de fosfolipídios extraídos
do RE, que são transferidos de uma membrana para outra por proteínas intercambiadoras (Fig.
8.17).
OS PEROXISSOMAS
CH,
O~-S---CoA
COOH
1
CH,
Ho-t-cooH
tH,
1
COOH
COOH
t=O
Citrato
tH,
COOH
t ooH
Oxa lacetato
tHOH
NAOH~
Hooc--l-H
Maiato
tH,
desidrogenase
NAD -
tooH
COOH
tHOH
tH,
tooH
Maiato
CH,
CH , -COOH
1
O=t-s-CoA
CH,-COOH
Acetil CoA
Succinato
Fig. 10.3 Ciclo do glioxilato.
Por seu turno, as proteínas que se incorporam à membrana ou à matriz do peroxissoma provêm
de ribossomas livres no citosol e ingressam na organela depois de terem se dobràdo (Cap. 4-5) .
São conduzidas seletivamente ao peroxissoma porque, próximo da extremidade carboxila, contam com um peptídeo sinalizador (peptídeo sinal) específico composto por três aminoácidos (serina, lisina, leucina) (Cap. 4-4) (Quadro 4.1 ). O peptídeo sinalizador é reconhecido por um receptor protéico que reside no citosol, o qual, por sua vez, interage com uma proteína específica da
membrana da organela.
Os canais que atravessam a membrana do peroxissoma para a passagem das proteínas ainda
não foram identificados.
A mutação do gene que codifica a síntese de uma proteína pertencente à membrana dos peroxissomas - envolvida aparentemente na incorporação das enzimas oxidativas à matriz - acarreta um quadro chamado síndrome de Zellweger, caracterizado por peroxissomas "vazios". Estes
pacientes mo~em antes do primeiro ano de vida.
OS PEROXISSOMAS NAS CÉLULAS VEGETAIS
10-6. Os glioxissomas são peroxissomas vegetais relacionados com o
metabolismo dos triglicerídeos
A germinação das sementes pode necessitar da degradação de lipídios acumulados no endosperma (Cap. 19-20). Neste processo, intervêm os glioxissomas, que são peroxissomas relacionados com o metabolismo dos triglicerídeos.
O glioxissoma dispõe de enzimas que transformam os ácidos graxos da semente em carboidratos por meio do ciclo do glioxilato, que é uma versão diferente do ciclo de Krebs (Fig. 10.3). A
equação que se verifica ao final de suas reações é:
2 acetil CoA
------->
succinato
+ 2 H+ + 2 CoA
A diferença com o ciclo de Krebs é que no ciclo do glioxilato são necessárias duas moléculas
de acetil CoA e utilizadas duas enzimas exclusivas, a isocitrato liase e a malato sintase. As outras
•
171
172
•
OS PEROXISSOMAS
três enzimas deste ciclo, a aconitase, a malato desidrogenase e a citrato sintase, correspondem
também ao ciclo de Krebs (Fig. 8.11).
10-7. Certos peroxissomas vegetais intervêm no processo de
fotorrespi ração
As células das folhas verdes possuem um tipo de peroxissoma que, mediante uma oxidase específica, catalisa a oxidação de uma molécula de dois carbonos, o glicolato. Este é sintetizado no
cloroplasto nos dias secos de sol intenso. A oxidação do glicolato consome 0 2 e produz Hp 2 e
glioxilato. Em seguida, o Hp 2 é decomposto pela catalase do peroxissoma (em Hp e 0 2) e sempre no peroxissoma - o glioxilato converte-se em glicina, que se metaboliza na mitocôndria
e produz cor
Esse processo, do qual participam três organelas - o cloroplasto, a mitocôndria e o peroxissoma
- denomina-se fotorrespiração , visto que para a síntese e oxidação do glicolato há necessidade
de luz e 0 2 e de liberação de co2.
BIBLIOGRAFIA
Borst P. (1983) Animal peroxisomes (microbodies), lipid biosynthesis
and the Zellweger syndrome. TIBS 8:269.
Cleves A.E. and Kelly R.B. (1996) Protein translocation: rehearsing the
ABCs. Curr. Biol 6:276.
Jacobson M.D.-(1996) Reactive oxygen species and programmed cell
death. TIBS 21:83.
Kindl H. (1982) The biosynthesis of microbodies (peroxisomes and
glyoxysomes). Int. Rev. Cytol. 80:193.
Lehninger A.L, Nelson D.L. and Cox M.M. (1993) Principies of Biochemistry, 2nd Ed. Worth, New York.
Masters C. and Holmes R. (1977) Peroxisomes: New aspects of cell
physiology and biochemistry. Physiol. Rev. 57:816.
Monteith G.R. and Roufogalis B.D. (1995) The plasma membrane
calcium pump. A physiological perspective on its regulation. Cell
Calcium 18:459.
Rachubinski R.A. and Subramani S. (1995) How proteins penetrate
peroxisomes. Cell 83:525.
Rusting R.L. (1992) Why do we age? Sei. Am . 267 (6):86.
Sohal R.J. and Weindruch R. ( 1996) Oxida tive stress, caloric restriction,
and aging. Science 273:59.
Subramani S. (J 996) Protein translocation into peroxisomes. J. Biol.
Chem. 271 :32483.
A comunicação
intercelular e a transmissão
intracelular de sinais
11 - 1. Nos organismos pluricelulares as células são interdependentes
Nos organismos multicelulares complexos tanto a sobrevivência das células como as atividades que realizam dependem de estímulos externos provenientes de outras células.
A dependência recíproca entre os distintos tipos celulares responde à necessidade de adaptar a
atividade de cada um às necessidades globais do organismo , que deve ser considerado como uma
unidade projetada para funcionar integradamente e não como uma soma de células individuais.
Assim, em um organismo multicelular, cada célula depende de outras e às vezes as influencia.
Estas inter-relações celulares ocorrem desde as primeiras etapas do desenvolvimento embrionário e persistem até o fim da vida pós-natal.
De acordo com o tipo de estímulo emitido e o tipo de célula que o recebe, esta responde, entre
outras, com alguma das seguintes alterações: 1) mantém-se viva ou morre; 2) diferencia-se; 3)
multiplica-se; 4) degrada ou sintetiza substâncias; 5) segrega substâncias; 6) incorpora solutos ou
macromoléculas; 7) contrai-se; 8) mobiliza-se; 9) conduz estímulos elétricos.
11-2. As células afetam as atividades de outras células por meio de
substâncias indutoras
A ação de estimular a célula do exterior é chamada indução; é mediada por uma substância
indutora, conhecida como ligante.
A célula que produz o ligante é denominada célula indutora; a célula que o recebe é denominada célula induzida ou célula-alvo.
A substância indutora interage com a célula induzida mediante um receptor, que é uma proteína ou um complexo protéico localizado no citosol ou na membrana plasmática da célula-alvo.
Se o receptor estiver no citosol, a substância indutora deve ser pequena e hidrófoba pois, para
alcançá-lo, deve atravessar a membrana plasmática da célula-alvo. Ao contrário, se o receptor for
de membrana, não interessa o tamanho da substância indutora nem que seja hidrófoba.
11-3. Existem diferentes tipos de induções, dependentes das distâncias
entre as células indutoras e as células induzidas
Quando a célula indutora e a célula-alvo estão distantes entre si, a substância indutora, depois
de ser segregada pela primeira, entra no sangue e, por ele, alcança a célula induzida. As induções
desse tipo são chamadas endócrinas (do grego, éndon , dentro , e krínein , separar) (Fig. 11.lA).
A esta categoria pertencem também as secreções neuroendócrinas, já que a substância indutora que sai da terminação axônica do neurônio deve ser lançada no sangue para poder chegar à
célula induzida.
11
174
•
A COMUNICAÇÃO INTERCELULAR E A TRANSMISS ÃO INTRACELULAR DE SINAIS
CÉLULA
IND UZIDA
CÉLULA
INDUTORA
A
o.
•'
1
1
Sangue
1
//
'~~_k]
t
• 1r • • T •-'
1
1
'-+•
?/
Substância indutora
B
e
D
E
OD
Fig. 11.1 Formas de indução nos organismos
pluricelulares. A. Secreção endócrina. B. Secreção
parácrina. C. Sinapse nervosa. D. Secreção autócrina.
E. Por contato direto.
As substâncias indutoras veiculadas pelo sangue são denominadas hormônios e são produzidas pelas células das glândulas de secreção interna que
integram o sistema endócrino.
QuandÕ a célula indutora se acha próximo da célula induzida diz-se que a
indução é parácrina (do grego, pará, contigüidade). Aqui, a substância indutora deve recorrer a um curto trecho da matriz extracelular para alcançar a
célula-alvo (Fig. 11.1 B).
Um caso especial de proximidade entre a célula indutora e a célula induzida se dá nas sinapses nervosas. Nestas, a terminação axônica de um neurônio (célula indutora) se acha junto à membrana plasmática de outro neurônio
ou de uma célula muscular ou de uma célula secretora (células induzidas) . A
substância liberada pela te1minação axônica do neurônio indutor é chamada
neurotransmissor (Fig. 11.1 C). As sinapses permitem estabelecer uma comunicação quase instantânea entre o neurônio indutor e a célula induzida
mesmo quando esta se encontra muito distante do corpo da primeira.
Existe um tipo de indução na qual a substância indutora é segregada e recebida pela própria célula, de modo que esta induz a si mesma. Este tipo de
indução é chamado autócrino (do grego, autós, por si mesmo) e ocorre durante algumas respostas imunes (Fig. 11. lD).
Em outros casos, a substância indutora é retida na membrana plasmática
da célula indutora e não é segregada. Portanto, para que a substânci a indutora possa entrar em contato com o receptor é necessário que a célula indutora se traslade para o lugar da célula induzida (Fig. 11.IE). Este tipo de
indução se dá, por exemplo , durante algumas respostas imunes (Cap. 22-5)
(Fig. 22.4), a fecundação (Cap. 19-1 9) (Figs. 19.22 e 19.23) e o reparo de
feridas.
Como vemos, em que pese as diferenças entre os distintos tipos de induções,
todos atuam de modo similar: uma célula produz um intermediário químico
que interage com o receptor da outra célula, na qual se desencadeia uma resposta.
O caráter e a natureza da resposta dependem da identidade da célula induzida. Às vezes, uma mesma substância indutora produz respostas diferentes
por parte de dois ou mais tipos de células-alvo. Por exemplo, nas células
musculares estriadas, a epinefrina estimula a glicogenólise, enquanto nas
células adiposas estimula a lipólise. Outras vezes, diferentes substâncias indutoras produzidas por células indutoras diferentes produzem somente um tipo
de resposta por parte de um ou de vários tipos de células-alvo.
11-4. As substâncias indutoras unem-se aos receptores com uma
grande especificidade
Uma das propriedades mais notáveis das substâncias indutoras é sua especificidade. Assim,
cada substância indutora atua somente sobre certas células, que constituem seu objetivo ou alvo.
O caso mais significativo é o dos hormônios nas induções endócrinas, já que depois de serem lançados no sangue chegam a todos os tecidos do organismo, porém agem unicamente sobre um
número limitado de células.
A especificidade das substâncias indutoras corresponde-se com a especificidade dos receptores, que são moléculas ou associações moleculares - geralmente, glicoproteínas - às quais as
substâncias indutoras se unem seletivamente em virtude de uma adaptação conformacional mútua. Além disso, a substância indutora e o receptor integram um complexo com as seguintes características:
1) Adaptação induzida. De maneira similar à união enzima-substrato, a fixação da substância
indutora ao receptor exige uma adaptação estrutural recíproca entre ambas as moléculas (Cap. 214). Acredita-se que ocorra a adaptação conhecida como encaixe induzido, que seria mais provável que o modelo rígido representado por uma chave e sua fechadura (Fig. 2.33).
)
l-
o
A COMUNlCAÇÃO INTERCELULAR E A TRANSMISSÃO INTRACELULAR DE SINAIS
•
175
2) Saturabilidade. O número de receptores existentes em cada célula é limitado, de modo que
se representarmos em um sistema de coordenadas a quantidade de substância indutora unida aos
receptores, obteremos - em função de sua cor:centração - uma curva hiperbólica que delata a
saturabilidade do sistema (Fig. 2.34).
3) Reversibilidade; A ligação substância indutora-receptor é reversível, já que o complexo se
dissocia algum tempo depois de sua formação .
11-5. A interação substância indutora - receptor é a primeira de
uma cadeia de reações
A interação entre a substância indutora e o receptor é o primeiro elo de uma cadeia de reações
químicas que se propagam no interior da célula, cuja resposta é o último elo da série.
A resposta celular pode ocorrer em segundos ou horas depois da chegada da substância indutora. No primeiro caso, ocorre ao. final de reações que se dão exclusivamente no citoplasma. No
segundo, quando um produto químico da cadeia de reações entra no núcleo e induz a ativação de
um gene. Isso origina uma série de fatos sucessivos - a serem estudados nos Caps. 14, 15 e 16 ao final dos quais é elaborada uma proteína cuja presença provoca a resposta celular.
Nas próximas seções analisaremos diferentes vias de propagação de sinais. Como veremos, o
número e o tipo de reações de cada via dependem da natureza das células induzidas, de seus receptores e das substâncias emitidas pelas células indutoras.
Estas substâncias classificam-se em dois grupos, segundo sua interação com receptores localizados no citosol ou na membrana plasmática das células induzidas.
INDUÇÕES CELULARES MEDIADAS POR RECEPTORES CITOSÓLICOS
11-6. Os hormônios esteróides ligam-se a receptores citosólicos
Os hormônios esteróides, os hormônios tireóideos, a vitamina D e o ácido retinóico são
substâncias indutoras que se ljgam a receptores das células induzidas situados no citosol. Os três
primeiros produzem induções endócrinas, já que habitualmente são lançados no sangue. O ácido
retinóico, entretanto - uma substância que intervém principalmente durante o desenvolvimento
embrionário (Cap. 21 -16) - dá lugar a induções parácrinas.
Uma vez no citosol, a substância indutora liga-se a seu receptor específico e ambos formam
um complexo que entra no núcleo. Ali o complexo se combina com a seqüência reguladora de um
gene particular, que se ativa (Caps. 13-6 e 14-7). Sua transcrição conduz à síntese de uma proteína
cuja presença provoca a resposta celular (Fig. 11.2).
Os receptores citosólicos são proteínas com quatro domínios (Fig. 11.3): 1) um projetado para
se ligar ao indutor; 2) outro, flexível, que se dobra como uma dobradiça; 3) outro que se liga à
seqüência reguladora do gene, e 4) outro que ativa o gene.
Quando a substância indutora se liga ao receptor, este adquire uma forma característica que lhe
permite ingressar no núcleo e se ligar à seqüência reguladora do gene. Devemos assinalar que na
º-
•-- --. D
Substância
indutora
Receptor
1
1
1
~-----.~1DNA
Síntese de
RNAm
!
Síntese de
proteína
Fig. 11.2 Indução celular por
meio de um receptor citosólico.
É ilustrado o mecanismo de ação
dos hormônios esteróides e
tireóideos, da vitamina D e do
ácido retinóico.
176
•
A COMUNICAÇÃO INTERCELULAR E A TRANSMISSÃO INTRACELULAR DE SINAIS
Fig. 11.3 Esquema que ilustra
os quatro domínios de um
receptor citosólico. Observar a
interação do receptor com a
chaperona hsp90.
Substância
indutora
hsp90
'
~
Região ativadora
da transcrição
ri,
~ COOH
...------------.11
.
NH2 !
~
Região que se
associa ao gene
()
o
oI
ausência da substância indutora, o receptor permanece no citosol ligado à chaperona hsp90 (Cap.
4-5) , a qual o encurva. Ao contrário, quando a substância indutora se liga ao receptor, este se libera da chaperona e adquire uma configuração estendida porque seu domínio flexível se endireita.
Como conseqüência, o receptor pode ingressar no núcleo e se ligar à seqüência reguladora do gene
(Fig. 11.3) (Cap. 12-4).
11-7. O óxido nítrico interage com uma enzima citosólica
Quando é segregado por macrófagos, pelas células endoteliais dos vasos sangüíneos ou por
alguns tipos de neurônios, o óxido nítrico (NO) se comporta como uma substância indutora.
Na célula induzida, o óxido nítrico interage com uma enzima citosólica - mais especificamente com o grupo heme da enzima guanilato ciclase - cuja ativação converte o nucleotídeo
guanosina trifosfato (GTP) em guanosina monofosfato cíclico (GMPc) (Fig. 11.4), que é o desencadeador da resposta celular. Devemos assinalar que a ação do NO é muito breve, pois se converte em n!trato ou em nitrito em menos de 1O segundos.
O NO segregado pelas células endoteliais dos vasos sangüíneos tem como alvo as células
musculares lisas dos próprios vasos (secreção parácrina), que se relaxam e produzem vasodilatação. Em alguns casos, o processo se inicia antes, quando outra substância indutora - a acetilcolina - emerge das terminações axônicas que inervam as células endoteliais e interagem com receptores localizados em suas membranas plasmáticas (Fig. 11.5). Devido a isso, as células endo-
o
Óxido nítnco
o
o
"
li
li
-o-P-0-P
Fig. 11.4 Transformação do GTP
em GMPc quando o óxido
nítrico atua sobre a guanilato
ciclase.
L
o
rc~
Guan ilato ~
I_
ciclase
o
<N~NH
N.---llN~NH,
//
-O - P - 0 OH
li
o
GMPc
GTP
CÉLULA ENDOTELIAL
MÚSCULO LISO
( ·---·
''
Acetilcolina
'
+
w
:::J
NO sintase
(.9
z
<(
Fig. 11.S Formação de óxido
nítrico (NO) nas células
endoteliais e sua ação sobre as
células musculares lisas dos
vasos sangüíneos.
(/')
Argínina
NO -- ---- • NO ------ ---- •
Guanilato ciclase
p
+
p
A COMUNICAÇÃO INTERCELULAR E A TRANS MISSÃO INTRACELULAR DE SINAIS
•
177
teliais produzem óxido nítrico sintase, uma enzima que produz NO a partir do aminoácido arginina. Finalmente, o NO segregado pelas células endoteliais induz ao relaxamento das células musculares lisas dos vasos.
Um exemplo de indução deste tipo corresponde à dilatação dos vasos sangüíneos do pênis
durante a ereção. A vasodilatação é induzida pelo NO que as células endoteliais dos vasos penianos
segregam diante da chegada de estímulos nervosos especiais. Outro exemplo corresponde à nitroglicerina, que é um fármaco empregado para tratar as crises de angina de peito. Logo depois de
sua administração, os vasos coronários obstruídos se dilatam por períodos relativamente prolongados porque a nitroglicerina se converte em NO de forma lenta e gradual.
INDUÇÕES CELULARES MEDIADAS POR RECEPTORES
LOCALIZADOS NA MEMBRANA PLASMÁTICA
11-8. Nas induções mediadas por receptores de membrana, os sinais fluem
pelo interior da célula através de diferentes tipos de moléculas
As substâncias indutoras que se ligam a receptores localizados na membrana plasmática põem
em marcha nas células induzidas uma série de reações moleculares até que se obtenha a resposta
celular. Essas reações dão lugar a diferentes vias de condução, transdução e amplificação de sinais, algumas das quais serão analisadas nas próxim as seções.
A chegada da substância indutora - considerada o primeiro mensageiro da via de sinais produz mudanças no receptor, que são transmitidas à segunda molécula do sistema. Por sua vez,
esta afim sobre a terceira molécula do sistema e assim sucessivamente até atingir a resposta celular. Algumas dessas moléculas - comumente chamadas segundos mensageiros - são de tamanho pequeno e, por isso, difundem-se com rapidez e são muito eficientes em propagar os sinais
dentro da célula. Devemos acrescentar que as primeiras moléculas do sistema podem estar localizadas na membrana plasmática, cuja fluidez lhes permite deslocar-se e interagir com o receptor e
com as moléculas que lhes_,_ sucedem (Cap. 3-5).
Entre as moléculas que intervêm na maioria das vias de sinais as cinases (Cap. 2-12) são abundantes, já que muitas de suas reações são fosforilações catalisadas por esse tipo de enzimas. Existem diversos tipos de cinases (ou quinases), cada uma para um substrato específico, que pode ser
outra cinase, uma enzima diferente ou uma proteína não-enzimática. Quando se trata de outra cinase, às vezes esta fosforila uma terceira e assim, sucessivamente, até chegar ao último elo da
cadeia. Cabe acrescentar que em alguns casos a fo sforilação ativa o substrato e em outros o inativa, o que produz diferentes tipos de conseqüências no funcionamento celular. Como vemos, as
cinases são moléculas muito difundidas nos processos de transmissão de sinais, e que desempenham funções importantes dentro da célula.
Não obstante, as inúmeras substância indutoras produzidas pelo organismo e a enorme variedade de respostas que produzem, estas são obtidas por um número relativamente pequeno de vias
de transmissão de sinais. Isso é porque a maioria das vias se interconecta e compõe redes integradas semelhantes às dos computadores. Por esse motivo, o estudo deste tema apresenta dificuldades que, em um texto sucinto , obrigam a analisar somente as vias de sinais mais importantes e a
omitir seus elos menos representativos.
'
Substância indutora
11 - 9. Existem diferentes tipos de receptores de membrana que
produzem sinais intracelulares
Os receptores da membrana plasmática que dão origem a vias de sinais intracelulares compõemse de uma ou mais proteínas. Cada receptor possui um domínio externo, um domínio transmembrana e um domínio citosólico. Quando a substância indutora se liga ao primeiro, o receptor se
ativa e seu domínio citosólico sofre uma das seguintes alterações:
1) Adquire atividade enzimática ou ativa uma enzima independente do receptor (Figs. 11.6 a 11.12).
2) Ativa uma proteína localizada na membrana plasmática, chamada proteína G, a qual ativa
uma enzima (Figs. 11.13, 11.16, 11.19 e 11.21).
GTP
GMPc
Fig. 11.6 Receptor de membrana
cujo domínio citosólico tem
atividade de guanilato ciclase.
178
•
A COMUNlCAÇÃO INTERCELULAR E A TRAJ SMISSÃO INTRACELULAR DE SINAIS
RECEPTORES DE MEMBRANA QUE ADQUIREM ATIVIDADE
ENZIMÁTICA OU QUE ATIVAM ENZIMAS
Como acabamos de mencionar, existem receptores de membrana que ao serem induzidos adquirem atividade enzimática ou ativam uma enzima independente. A atividade enzimática que é
revelada nos primeiros pode ser de guanilato ciclase, de serina-treonina cinase ou de tirosinocinase,
enquanto a enzima que os segundos ativam é sempre uma tirosinocinase.
11-1 O. Existem receptores de membrana que, ao serem induzidos,
adquirem atividade de guanilato cinase
Quando a pressão arterial se eleva, as células musculares dos átrios cardíacos segregam um
hormônio chamado peptídeo natriurético atrial (ANP, do inglês, atrial natriuretic peptide), cujos alvos são as células renais que absorvem Na+ e as células musculares lisas dos vasos arteriais.
O ANP se liga a um receptor específico da membrana plasmática dessas células, cujo domínio
citosólico adquire atividade de guanilato ciclase, já que interage com moléculas de guanosina
trifosfato (GTP) presentes no citosol e as converte em guanosina monofosfato cíclico (GMPc)
(Figs. 11 .4 e 11.5).
Como mostra a Fig. 11.6, os GMPc ativam a enzima cinase G (do inglês, GMPc), que por sua
vez fosforila uma proteína citosólica específica. Com ela, é posta em marcha uma cadeia de reações químicas citoplasmáticas até que ocorra a resposta celular. Em nosso exemplo, trata-se da
excreção de Na+ por parte do rim e do relaxamento do músculo liso vascular, estados que causam
a diminuição da pressão arterial.
11-11. Existem receptores de membrana que ao serem induzidos adquirem
atividade de serina-treonina cinase
As substâncias indutoras que interagem nos receptores com atividade de serina-treonina cinase pertencem a uma família de moléculas chamadas TGF-/3 (do inglês, transforming growth
fa ctor-f3), cujos membros - alguns analisados no Cap. 21-16 - regulam diversas atividades
celulares.
A Fig. 11.7 mostra que a chegada da substância indutora à membrana plasmática da célula induzida reúne as quatro subunidades protéicas que integram o receptor, as quais estão agrupadas
duas a duas e seriam diferentes entre si.
Em seguida, por meio de fosfatos extraídos de moléculas de ATP, os domínios citosólicos de
duas das quatros subunidades fosforilam serinas e treoninas dos domínios citosólicos das outras
subunidades, que se ativam e fosforilam serinas específicas da proteína citosólica Smad (do inglês, seven mothers against dpp, um gene da Drosophila dos quais existem sete análogos nos
vertebrados).
Fig. 11.7 Receptor de membrana
cujo domínio citosólico tem
atividade de serina-treonina
cinase. Observar que o receptor é
composto de quatro subunidades
- aparentemente diferentes
entre si - que se reúnem com a
chegada das duas subunidades da
substância indutora e formam
um receptor heterotetramérico.
inativa
~~
f
~
Núcleo
'
/}
-
l-
5..
o
t-
ia
ill
i-
A COMUNICAÇÃO INTERCELULAR E A TRA SMISSÃO INTRACELULAR DE SINAIS
•
179
Em seguida, a Smad se liga a outra proteína de sua mesma família e ambas ingressam no núcleo, onde se combinam com fatores de transcrição que ativam os genes cujos produtos inibem o
crescimento celular, controlam a diferenciação ou funcionam como substâncias indutoras durante
o desenvolvimento embrionário inicial (Caps. 14-5 e 21-16).
11-12. Existem receptores de membrana que, ao serem induzidos,
adquirem atividade de tirosinocinase
9
subs.
indutora
As substâncias indutoras que interagem com os receptores que possuem propriedades de tirosinocinase pertencem a uma família de moléculas chamadas
Receptor
fatores de crescimento . Estes fatores - cujas funções serão analisadas no Cap.
18-28 -podem ser segregados por células indutoras próximas das células induzidas (secreção parácrina) .
Os fatores de crescimento mais conhecidos são o EGF (do inglês, epiderma! growthfactor), oFGF (fibroblast), oPDGF (p/ate/et-derived), oHGF (hepatocyte), o NGF (nerve), o VEGF (vascular endothelial) e a insulina. Esta
última estimula o crescimento de vários tipos celulares, como, por exemplo, os
fibroblastos.
Como mostram as Figs. 11.8, 11.10 e 11.11, a chegada das substâncias indutoras promove a reunião das duas subunidades que integram o receptor, o
que possibilita a fosforilação cruzada de seus domínios citosólicos mediante a
incorporaÇão de fosfatos procedentes de moléculas de ATP.
TITITITITITITITITITITIITTI
ITTIITTIITTITITITIITTIITTITITITITI
E~ta autofosforilação ativa o domínio citosólico do receptor, que origina três
tipos de vias de transmissão de sinais: uma na qual intervém a proteína Ras ,
outra da qual participa a enzima fo sfolipase C-"{ e outra na qual o faz a fosfatidilinositol 3-cinase.
Proteína Ras. A Fig. 11.8 mostra que a proteína Ras (do inglês, rat sarcome
',~
virus) está ancorada no lado citosólico da membrana plasmática mediante dois
ácidos graxos. Observe-se que quando ela se ativa, relaciona-se com o domínio citosólico do receptor mediante uma proteína adaptadora e da proteína GEF.
Isto é porque a Ras é membro da família das GTPases que estão associadas
às proteínas reguladoras GEF e GAP (Cap. 7-38) (Fig. 11.9). Igualmente às suas
análogas, quando é influenciada pela GEF, a Ras substitui o GDP presente em
sua molécula por um GTP. Ao contrário, quando é influenciada pelo GAP, a
Ras hidrolisa o GTP em GDP e P. Cabe acrescentar que o GTP ativa a Rase o
GDP a inativa (Figs. 11.8 e 11.9).
A Ras-GTP ativa a cinase Raf (do inglês, Ras-associated fa ctor), a qual
fosforila a cinase MEK (do inglês, MAP kinase!ERK kinase) e esta a cinase
ERK (do inglês, extracellular signa/-regulated kinase) (Figs. 11.8 e 11.22).
Finalmente, a ERK fosforila e ativa as outras cinases citosólicas ou ingressa no
núcleo e fosforila proteínas que ativam os genes cujos produtos regulam o crescimento e a diferenciação celular.
Cinase
Devemos assinalar que as proteínas Raf, MEK e ERK pertencem a uma faativa
mília de cinases chamadas MAP (do inglês, mitogen-activated protein kinases),
as quais - com fosfatos provenientes de moléculas de ATP - fosforilam serinas e treoninas de Fig. 11.8 Receptor de membràna
um grupo amplo de proteínas.
cujo domínio citosólico tem
Como vemos, a Ras-GTP desencadeia uma série de reações químicas cujo último substrato dá atividade de tirosinocinase. O
lugar à resposta celular. Quando esta termina, uma fosfatase específica remove os fosfatos do re- receptor é composto de duas
unidades idênticas que se
ceptor e a GAP induz a Ras a hidrolisar seu GTP a GDP e P.
reúnem com a chegada das duas
Fosfolipase C-'Y (PLC-')'). Na célula existem vários tipos de fosfolipases, um dos quais é a fossubunidades da substância
folipase C -"{ (PLC-"{), que é a que se liga a receptores com atividade de tirosinocinase (Fig. 11.10).
indutora e formam um complexo
Outra é a fosfolipase C-13 (PLC-13), que como veremos na Seção 11 -14 é ativada por meio de homodimérico. Observar que o
receptores acoplados à proteína G (Fig. 11.19).
receptor ativa a proteína Ras por
Como as vias de sinais que têm origem nas enzimas citosólicas PLC-)' e PLC-13 produzem efeitos meio de uma proteína adaptadora
similares, serão analisadas conjuntamente nas Seções 11-14, 11-17, 11-18 e 11-19 (Fig. 11.22).
(P.A. ) e da proteína GEF.
ggggggggggggg ~~~UM\UMMM
@)/
180
•
A COMUNICAÇÃO INTERCELULAR E A TRANSMISSÃO INTRACELULAR DE SINAIS
GDF'
~Q
~
INATIVA
w
~
w
ATIVA
~
p~
Fig. 11.9 Ativação e inativação da proteína Ras por intermédio das proteínas GEF e GAP,
respectivamente.
Sustância indutora
/,-ATP
Fig. 11.10 Receptor de membrana cuj o
doipínio citosólico tem atividade de
tirosinocinase. O receptor é composto de
du as unidades idênticas que se reúnem
com a chegada das duas subunidades da
substância indutora e formam um
complexo homodimérico. Observar que o
receptor ativa a fosfolipase C--y (PLC- y).
REL, Retículo endoplasmático liso .
----~
ADP
Fig. 11.11 Receptor de membrana cujo
domínio citosólico tem atividade de
tirosinocinase. O receptor é composto de
duas unidades idênticas, que se reúnem
com a chegada das duas subunidades da
substância indutora e formam um
complexo homodimérico. Observe-se que
o receptor se liga a uma fosfatidilinositol
3-cinase (PI 3-K) e a ativa.
Fosfatidilinositol 3-cinase (PI 3-K). Na célula existem vários tipos de fosfatidilinositol 3-cinases, entre elas uma que é ativada mediante receptores com atividade de tirosinocinase e outras
que o fazem por meio de receptores acoplados a proteínas G (Figs. 11.11 , 11.21 e 11.22).
Em função de seus efeitos serem similares - têm a ver com a morte celular - as vias de sinais
que têm origem nessas enzimas serão analisadas conjuntamente nas Seções 11-14 e 11-20 e no
Cap. 22-4.
11-13. Existem receptores de membrana que, ao serem induzidos,
ativam uma enzima alheia às suas moléculas
Existem receptores que quando são induzidos ativam uma tirosinocinase independente de suas
moléculas, localizada no citosol (Fig. 11.12). As substâncias indutoras mais conhecidas que se
unem a esses receptores são o hormônio do crescimento (GH) , a prolactina, a eritropoetina (Cap.
18-18), algumas citocinas e os antígenos quando se ligam aos linfócitos B ou T.
A via de sinais que tem origem nestes receptores começa quando a substância indutora interage com as duas ou três subunidades que integram o receptor. Em alguns receptores , essas subunidades são iguais entre si e em outros são diferentes. Como mostra a Fig. 11.12, a chegada
da substância indutora reúne as subunidades , o que ativa o receptor e origina uma via de sinais
A COMUNlCAÇÃO INTERCELULAR E A TRA 'SMISSÃO JNTR ACELULAR DE SINAIS
•
Substância indutora
•
181
Fig. 11.12 Receptor de
membrana cujo domínio
citosólico ativa uma
tirosinocinase independente do
receptor. Observar que quando o
receptor está inativo é composto
de duas subunidades separadas
idênticas, as quais se reúnem
com a chegada da substância
indutora e compõem um
complexo homodimérico . Em
outros casos, formam- se
receptores heterodiméricos ou
heterotriméiicos .
Dimerização
que chega ao núcleo muito rapidamente, pois se vale de um escasso número de moléculas intermediárias.
Uma das primeiras moléculas desta via de sinais é a tirosinocinase nomeada no começo da seção.
Entre as enzimas mai s importantes deste tipo encontra-se a tirosinocinase JAK (do inglês, Janu s
kinase) ,.que nos servirá de exempl o.
Assim, quando os domínios citosólicos das subunidades do receptor são ativados atraem outras JAK, que se fosforilam reciprocamente e se ativam (Flg. 11.12).
Depois que as JAK fosforilam os domínios citosólicos do receptor, voltam a se ativar e a atrair
certas proteínas citosólicas chamadas STAT (do inglês, signaf tran sducer and activators of
transcription), que são fosforiladas pelas JAK. Como se vê, as JAK primeiramente se autofosforilam
e em seguida fosforil am os domínios citosólicos do receptor e as proteínas STAT.
Uma vez fosforiladas , as STAT se dimerizam e ingressam no núcleo (Fig. 11.1 2), onde se combinam com proteínas especiais e formam complexos que ativam diversos tipos de genes. Estes e seus produtos - variam segundo as substâncias indutoras e as células induzidas. Por exemplo,
a prolactina faz com que as células da glândula mamária segreguem leite, enquanto outras induções
reg ulam a proliferação de alguns tipos celulares , o desenvolvimento embrionário etc.
RECEPTORES DE MEMBRANA ACOPLADOS A PROTEÍNAS G
Como dissemos na Seção 11 -9, existem receptores localizados na membrana plasmática que
ao serem induzidos ativam proteínas G. Nas próximas seções veremos que as proteínas G ativam
vários tipos de enzimas a partir das quais têm origem importantes vias de sinais intracelulares.
)
'
.e
).
J-
la
11-14. Existem recept ores de membrana que ao serem induzidos ativam
proteínas G e, através delas, diferentes tipos de enzimas
Os receptores que se acoplam às proteína G são proteínas integrais que cruzam sete vezes a
dupla camada lipídica da membrana plasmática (Fig. 11.13).
As proteínas G (do inglês, GTP-binding protein) também pertencem à membrana plasmática,
porém são heterotriméricas e se acham aderidas à face citosólica da membrana. Suas três subunidades são identificadas com as letras gregas a , f3 e 'Y . Como mostra a Fig. 11.13, as subunidades
a e 'Y se unem à membrana por meio de outros ácidos graxos. Ao contrário , a subunidade [3 se une
à membrana por meio da subunidade "f , com a qual forma um complexo.
A subunidade a compmta-se como uma GTPase que possui um GDP ou um GTP, o que a assemelha à proteína Ras (compare as Figs. 11.9 e 11.14). Quando a subunidade a tem um GDP,
tanto ela como o complexo f3'Y - ou seja, a proteína G completa - se inativam. Já a proteína G
se ativa quando o GDP é substituído por um GTP (Fig. 11.14).
1
182
•
A COMUNICAÇÃO INTERCELULAR E A TRANSMISSÃO INTRA CELULAR DE SINAIS
'
Substância indutora
Fig. 11.13 Receptor de membrana acoplado a uma proteína G. A. Em repouso. B. Em atividade.
'"
Fig. 11.14 Ativação da subunidade a e do complexo 13'Y das proteínas G por meio de GTP.
\
A ativação da proteína G ocorre quando a substância indutora se une ao receptor, pois este entra
em contato com a subunidade ex e faz com que seu GDP seja substituído por um GTP (Fig. l l .13B).
Contrariamente, quando a substância indutora se desliga do receptor e a transmissão do sinal é
concluída, a proteína G se inativa porque a GTPase da subunidade ex hidrolisa o GTP a GDP e P
(Fig. l 1.13A).
Existem vários tipos de proteínas G, que dão origem a diferentes vias de sinais intracelulares
depois de interagir com as seguintes enzimas:
1) Adenilato ciclase (AC) que, a partir da adenosina trifosfato (ATP) produz adenosina monofosfato cíclico (AMPc) (Figs. 11.15, 11.16 e 11.22).
2) Fosfolipase C-13 (PLC-13), que igualmente à PLC-)' catalisa a excisão do fosfatidilinositol
4,5-difosfato (PIP2 ) localizado na monocamada citosólica da membrana plasmática (Cap. 3-3) (Fig.
2.16) e forma inositol 1,4,5-trifosfato (IP) e diacilglicerol (DAG) (Figs. 2.13 , 11.10, 11. 18, 11.19
e 11.22).
·
3) Fosfatidilinositol 3-cinase (PI 3-K), que acrescenta um fosfato ao PIP2 e o converte em
fosfatidilinositol 3,4,5-trifosfato (PIO) (Figs. 11.20, 11.21 e 11.22).
Devemos assinalar que o AMPc, o IP 3 , o DAG e o PIP 3 são classificados como segundos mensageiros.
A COMUNICAç_ÃO U TER CELULAR E A TRANSMISSÃO INTRACELULAR DE SINAIS
/,,.,..
.........
,/ ~~N
-f
Adenilato .,
ciclase
Mg"
HO
OH
/
\
N~~
,
N
0 - CH 2 O
1
_O
0 - P-
- 0
li
o
ATP
1
1
p
+
p
OH
AMPc
H,O ~
!
Fosfodi esterase
(~N
N~
.. -:;:::: I
o
1
N~
HO- P0- C~ü
1
2
O-
'
. AMP
HO
183
Fig. 11.15 Transformação de
ATP em AMPc quando a
proteína G, atua sobre a
adenilato ciclase. Depois, a
fosfodiesterase converte o AMPc
em AMP.
NH 2
Proteína G5
•
OH
Volt~ndo às proteínas G, quando o receptor as ativa-e o GDP da subunidade a é intercambiado
por um GTP - a subunidade a e o complexo (3-y se separam (Figs. l l .13B e 11. 14 ). Em seguida,
a subunidade a, ou o complexo (3-y, entra em contato com a adenilato ciclase, com a fosfolipase
C-(3 ou com o fosfatidilinositol 3-cinase, que, em alguns casos, se ativam e em outros se inibem
(Figs. 11.16, 11.19 e 11.21).
Nas próximas seções analisaremos as diferentes conseqüências dessas ativações ou inibições,
que cessam quando a substância indutora se separa do receptor. É que a retirada da substância
indutora induz a GTPase da subunidade a a hidrolisar o GTP em GDP e P, ao fim do qual a proteína G se inativa e a subunidade a se reúne com o complexo (3-y (Figs. l 1.13A, 11.14 e 11.16).
Habitualmente, as proteínas G amplificam os sinais. Conseguem isso porque uma única delas
pode ativar muitas unidades da enzima, cada uma das quais, por sua vez, dá lugar a numerosos
segundos mensageiros.
Por outro lado, quando por alguma circunstância, os receptores acoplados às proteínas G são
estimulados de f01ma ininterrupta, intervêm dois tipos de proteínas citosólicas dessensibilizantes:
certas cinases específicas que fosforilam os receptores e os inibem, e as proteínas denominadas
arrestinas, que os bloqueiam.
11-15. A adenilato ciclase produz AMP cíclico que ativa a cinase A
O nucleotídeo adenosina monofosfato cíclico (AMPc) deve seu nome ao fato de seu fosfato
compor um anel ao se ligar simultaneamente com o C3' e o C5' da ribose. O AMPc é formado a
partir de ATP mediante a adenilato ciclase, uma enzima situada na membrana plasmática que
necessita de Mg 2 + para funcionar. A Fig. 11.15 mostra a reação e as fórmulas das moléculas envolvidas. Devemos acrescentar que a á.denilato ciclase é ativada pela subunidade a de uma proteína G específica chamada proteína G, (Fig. 11.16).
Por sua vez, o aumento do AMPc no citosol ativa a cinase A (do inglês, AMPc) , que em seu
estado inativo é um tetrâmero composto por duas subunidades reguladoras e duas subunidades
catalíticas unidas entre si (Fig. 11.17). Para que a cinase A seja ativada 2 AMPc devem se conectar com cada subunidade reguladora, de modo que sejam unidos quatro AMPc. A união dos AMPc
separa as subunidades reguladoras das catalíticas, que são ativadas, ou seja, manifestam suas propriedades enzimáticas.
Em seguida, parte das subunidades catalíticas ativadas transfere fosfatos retirados de moléculas de ATP a serinas e treoninas de diversas proteínas citosólicas, que se ativam e dão lugar ares-
184
•
A COMUNICAÇÃO INTERCELULAR E A TRANSMISSÃO INTRACELULAR DE SINAIS
Fig. 11.16 Reações produzidas a
partir da ligação de uma
substância indutora com um
receptor de membrana que ativa
a subunidade ex da proteína G,.
Observar como esta interage
com a adenilato ciclase.
-~u bstânci a indutora
,
1
.
~ \
~/ ',~
•
TIITftTIITftTITIITftTITIITTITITIITft
M~MM~~MMMUMMM ~l
postas celulares quase imediatas. Simultaneamente, outras subunidades catalíticas ingressam no
núcleo e produzem respostas celulares tardias. Mais adiante, descreveremos exemplos de ambos
os tipos de respostas.
Como o AMPc é um segundo mensageiro muito potente, as células possuem dois mecanismos
alternativos para regular sua concentração. O mais importante depende da enzima fosfodiesterase, que hidrolisa a ligação entre o fosfato e a hidroxila do carbono 3' na ribose do AMPc. Isto
converte o AMPc em AMP, que é um nucleotídeo inativo (Fig. 11.15). Várias metilxantinas, como
a cafeína, a teofilina e a aminofilina inibem a atividade da fosfodiesterase e, portanto, a queda do
AMPc.
O segundo mecanismo que regula a concentração de AMPc é mai s lento que o anterior, já que
depende da ligação de uma substância indutora a seu receptor e de uma proteína G que produza
efeitos contrários aos da proteína G, Trata-se da proteína Gi' cuja subunidade ex inibe a adenilato
ciclase e faz cair a concentração de AMPc. Por sua vez, a queda da AMPc inativa a cinase A suas subunidades catalíticas e reguladoras se reúnem - e a resposta celular é detida.
O AMPc é um segundo mensageiro polivalente que provoca respostas muito distintas segundo
o tipo de célula em que atua, a substância que induz esta última e o receptor que se ativa. No Quad ro
A COMUNICAÇÃO INTERCELULAR E A TRANSMISSÃO INTRACELULAR DE SINAIS
•
185
Quadro 11 .1 Exemplos de respostas celulares mediadas pelo AMP cíclico
Substâncias indutoras
Células induzidas
Efeitos
Adrenalina
Glucagon
Hepatócitos
Adrenalina
Adrenalina
Musculares estriadas
Musculares cardíacas
Adrenalina
Adipócitos
Degradação de glicogênio
Diminuição da síntese de
glicogênio
Degradação de glicogênio
Aumento da freqüência
cardíaca
Degradação de
triacilgliceróis
Diminuição da captação de
aminoácidos
Aumento da síntese de
estrógeno e de progesterona
Secreção de hormônio
tireóideo
Secreção de cortisol
Retenção de água
Reabsorção de Ca2+
Detecção de odores
Glucagon
Dos folículos ovarianos
Hormônios folículo-estimulante
(FSH) e luteinizante (LH)
Tireotrofina (TSH)
Tireóideas
Adrenocorticotrofina (ACTH)
Hormônio antidiurético
Parat_ormônio
Odorizantes
Supra-renais (córtex)
Renais
Ósseas
Neuroepiteliais do nari z
11.1 oftirecemos exemplos de respostas imediatas, mediadas pelo AMPc quando se une a cinases
A, que atuam no citosol.
A degradação do glicogênio e a detenção de sua síntese, que ocorre nas células musculares estriadas em situações de estresse, são dois exemplos de respostas imediatas mediadas pelas subunidades catalíticas da cinase A. O processo começa nas glândulas supra-renais, que como conseqüência
do estresse liberam adrenalina (epinefrina), uma substância indutora que é lançada no sangue e chega
às células musculares estriadas, unindo-se às suas membranas plasmáticas e conecta-se com um receptor de membrana chamado f3 2 -adrenérgico, que ativa a proteína G,. Visto que esta ativa a enzima adenilato ciclase, é produzida AMPc e é ativada a cinase A, cujas subunidades catalíticas fosforilam duas enzimas citosólicas: a glicogênio fosforilase cinase e a glicogênio sintase (Fig. 11 .17).
O glicogênio fosforilase cinase se ativa e fosforila outra enzima, a glicogênio fosforilase, que
degrada o glicogênio pela liberação progressiva de seus monômeros, representados por moléculas de glicose 1-fosfato (estimulação da glicogenólise).
ACinase A inativa
Cinase A ativa
(/
: ~~ -~~~~~--------------+ b:J~
l
DD
\
'
Núcleo
'-----0____/ ~ J?
D
,'
Glicogênio fosforilase
cinase inativa
Glicogênio fosforilas ] ''
cinase ativa
1
'
Glicogênio fosforilase
inativa
'
'
'
Glicogênio fosforilase
ativa
... ------ ...
B
...
,
D
-------
/
/
1Glicogên.io 1
/
Glicogênio sintase
ativa
/
Glicogênio sintase
inativa
',•
1 Glicose 1-P 1
Fig. 11.17 Unidades reguladoras
(R) e catalíticas (C) da cinase A.
Observar a união do AMPc com
as unidades reguladoras e como
as unidades catalíticas fosforilam
as enzimas citosólicas
responsáveis pela glicogenólise
(A) e glicogenogênese (B) e
ingressam no núcleo para
fosforilar a proteína CREB.
186
•
A COMUNICAÇÃO INTERCELULAR E A TRANSMISS ÃO INTRACELULAR DE SINAIS
Ao contrário , a glicogênio sintase é inibida e deixa de sintetizar glicogênio a partir de moléculas de glicose (suspensão da glicogenogênese).
Como vemos, nas células musculares estriadas a ativação do receptor [3 2 -adrenérgico eleva a
concentração de glicose 1-fosfato e de glicose. Cabe acrescentar que posteriormente estas duas
hexases se convertem em glicose 6-fosfato por ação das enzimas fosfoglicomutase e hexocinase,
respectivamente.
Já que para produzir ATP o organismo consome glicose 6-fosfato (Caps. 8-6 e 8-7) (Fig. 8.6),
em situações de estresse recorre a ela em grandes quantidades a fim de sustentar a contração
muscular (Cap. 5-33). Tal demanda faz com que parte da glicose 6-fosfato requerida pelos músculos seja fornecida pelo fígado . Para tanto , também pelo receptor [3 2-adrenérgico, a epinefrina
induz o hepatócito a produzir glicose 6-fosfato mediante as mesmas reações das células musculares estriadas. Em seguida, uma enzima situada na membrana do REL, a glicose 6-fosfatase, transforma a glicose 6-fosfato em glicose, que sai do hepatócito, passa para a circulação sangüínea (Cap.
7-27) e chega às células musculares, onde a hexocinase a reconverte em glicose 6-fosfato com a
finalidade de produzir ATP (Fig. 8.6).
Outro exemplo de resposta imediata mediada pela adrenalina se dá nas células musculares lisas do tubo digestório e brônquios. Neste caso, a adrenalina se liga a um receptor diferente, chamado a 2 -adrenérgico, que ativa a proteína Gi, que funciona de uma maneira distinta da esperada,
uma vez que não intervém sua subunidade a - que segundo vimos inibe a adenilato ciclase - e
sim seu ~ amplex o í3'Y · Além disso, este complexo não se une a uma enzima e sim a um canal de
K+ da membrana plasmática, que se abre e permite que o K+ escape da célula. Devido a isso, a
membrana plasmática se hiperpolariza e sua excitabilidade diminui, com conseqüente relaxamento das células musculares lisas mencionadas.
A Fig. 19.20 mostra um setor da membrana plasmática do espermatozóide no qual se ilustra
outro exemplo de resposta imediata distinta mediada por uma proteína G. Observe-se aqui que a
subunidade a se une à adenilato ciclase e que o complexo í3'Y o faz com um canal de Ca2+ localizado na membrana (Cap. 19-1 8).
Os dois últimos exemplos acrescentam um novo fato sobre as funções das proteínas G, já que
em alguns casos seus complexos í3'Y interagem com canais iônicos.
Em seguida analisaremos a atuação das subunidades catalíticas da cinase A que entram no núcleo
e produzem respostas tardias (Fig. 11.17). No nucleoplasma, mediante um fosfato tomado de um
ATP, cada subunidade catalítica fosforila uma serina de uma proteína chamada CREB (do inglês,
cAMP response element binding protein), que se ativa e se une a outra proteína nuclear denominada CBP (do inglês, CREB binding protein).
Em seguida, o complexo CREB-CBP se une à seqüência reguladora de alguns genes, mais
precisamente a um segmento chamado CRE (do inglês, cAMP response element). Tendo em vista
que isto estimula a expressão desses genes, podemos dizer que a CREB e a CBP são fatores de
transcrição ativadores (Cap. 14-7).
A seqüência CRE se acha em genes relacionados com a proliferação e a diferenciação celular. Além disso, encontra-se no gene da somatostatina um hormônio produzido pelas ilhotas de
Langerhans e pela mucosa do tubo digestório, que inibe a síntese de glicose e a secreção de
gastrina.
Po'-',oP-010
3
HO
OH
Proteína .Gq
OH
OH
1
o
...
o = l> - oo'
Fosfolipase
1
CH,- CH - CH 2
1
o1
Fig. 11.18 Divisão do PIP2 em
IP 3 e DAG quando a proteína Gq
atua sobre a fo sfolipase C-[3.
CH,-CH- CH,
1
1
o1
1
C-13
1
o
o
1
1
C=O C=O
1
1
(9 H,),.(?H,),.
CH,
+
CH,
C= O C= O
PIP2
1
1
1
1
CH,
CH3
(CH,),. (C H,),
DAG
IP3
•
e
e
A COMUNICAÇÃO INTERCELULAR E A TRA SMISSÃO INTRACELULAR DE SINAIS
•
187
11-16. Na coqueluche e na cólera, o funcionamento das
proteínas G é afetado
A coqueluche é uma doença produzida pela toxina do bacilo Bordetella pertussis. A toxina
atua nas células musculares lisas dos brônquios , onde impede que o GTP se acople à subunidade
a da proteína G;, fato que conserva a subunidade a unida ao dímero í3l' de forma permanente. Isso
impossibilita a ação inibidora da proteína G; sobre a adenilato ciclase, e por isso os níveis de AMPc
se mantêm altos e a cinase A permanece ativa. Como conseqüência, os canais de K+ mencionados
na seção anterior se fecham, a excitabilidade do músculo liso bronquial aumenta e, por isso, o
músculo se contrai de forma sustentada e causa a tosse que caracteriza a doença.
A cólera é uma enfermidade produzida pela toxina do bacilo Vibrio cholerae, caracterizada
por diarréia profusa, desequilíbrios iônicos e desidratação. Estes transtornos são devidos ao aumento dos níveis de AMPc nas células da mucosa intestinal. É que a toxina bloqueia a GTPase da
subunidade a da proteína G,, o que impede que o GTP se hidrolise em GDP e P. Como conseqüência, a proteína G, e a adenilato ciclase se mantêm ativas e a enzima produz AMPc de forma
sustentada. Uma vez que, nas células do epitélio intestinal , a AMPc se une a um canal de c1- da
membrana plasmática, esse canal se abre e o íon passa para a luz do intestino de forma maciça. A
diarréia é devida ao c1 - arrastar o Na+ e ambos os íons provocarem a saída de grandes quantidades de água.
11-17. A fosfolipase
. produz IP
C-13
3
e DAG a partir de PIP 2
Na membrana plasmática de diversos tipos celulares, a união de algumas substâncias indutoras
com seus receptores ativa a subunidade a da proteína Gq, que devido a isso substitui seu GDP
por um GTP. Por sua vez, a proteína Gq ativa a fosfolipase C-13 (PLC -J3) , uma enzima que se
acha no citosol próximo da membrana (Fig. 11.19).
Um exemplo deste tipo de indução corresponde à adrenalina (epinefrina) quando se liga a um
receptor distinto dos enumerados até aqui, chamado cx 1-adrenérgico.
No Cap. 3-3, dissemos que um dos fosfolipídios da dupla camada lipídica das membranas celulares é o fosfatidilinositol (PI). Na membrana plasmática localiza-se na monocamada citosólica e,
apesar de ser o mais escasso, tem um enorme significado funcional por intervir em importantes vias
de sinais intracelulares. Para isso, fosforila-se no C4' e no C5' do inositol mediante a interferência
de fosfatos retirados de moléculas de ATP, o qual o converte primeiramente em fosfatidilinositol 4fosfato (PIP) e, em seguida, em fosfatidilinositol 4,5-difosfato (PIP2) (Figs. 2.16 e 11.18).
Voltando à fosfolipase C-í3, uma vez ativada catalisa a hidrólise do PIP 2 , que como dissemos
na Seção 11-14 fraciona- se em duas moléculas relativamente pequenas, o inositol 1,4,5-trifosfato (IP 3) e o diacilglicerol (DAG) (Figs. 2.13, 11.18 e 11.19). Nas próximas seçõ,es veremos que
ambas as moléculas atuam como segundos mensageiros em vias de sinais de grande importância
para o funcionamento celular.
Devemos assinalar que estas vias cessam quando intervêm duas fosfatases específicas que
catalisam a remoção de dois dos três fosfatos do PIP 2 , o que o converte novamente em PI.
Cinase
CaM
Fig. 11.19 Ação da subunidade
ex da proteína G" sobre a enzima
fo sfolipase C-[3 (PLC-{3).
188
•
A COMUNICAÇÃO INTERCELULAR E A TRAt"<SMISSÃO INTRACELULAR DE SINAIS
Na Seção 11-12 dissemos que a célula tem vários tipos de fosfolipases. Entre os mais comuns,
está a fosfolipase C-'Y (PLC-"{) , que igualmente à PLC-[3 hidrolisa o PIP 2 e o fraciona em IP 3 e
DAG (Figs. 11 .10 e 11.22) . Como ambas as fosfolipases produzem produtos similares, seus efeitos serão analisados conjuntamente nas duas próximas seções.
Vale acrescentar que a estes efeitos devem se somar os da proteína Ras (Cap. 11-12), já que as
vias de sinais oriundas das duas fosfolipases passam pela proteína Raf (Fig. 11.22).
Outras duas fosfolipases relativamente comuns em diversos tipos de células são a fosfolipase
A (PLA) e a fosfolipase D (PLD). Elas estão ilustradas na Fig. 19.22, que mostra partes do espermatozóide e da membrana pelúcida do ovócito (oócito) no começo da fecundação.
11-18. O IP3 abre os canais de Ca 2 + situados na membrana do RE, e parte do
Ca2+ citosólico se liga à calmodulina, que ativa a cinase CaM
Quando o PIP 2 é fracionado em DAG e IP3 pela PLC-[3 ou pela PLC-')', o IP3 abandona amembrana plasmática e passa para o citosol. Logo se une a um canal de Ca2 + dependente de ligante
situado na membrana do REL, cuja abertura permite que parte do CaH que se acha nessa organela
seja transferida ao citosol (Cap. 7-26) (Figs. 11.10, 11.19, 19.22 e 19.23).
Normalmente, a concentração citosólica de Ca2 + é muito baixa (cerca de 10- 7 M) , mais de 1.000
vezes inferior à concentração no REL e na matriz extracelular. Estímulos de diversas naturezas
elevam o Ça2 + no citosol, que pode proceder de fora da célula ou de depósitos citoplasmáticos,
como o são o REL e as mitocôndrias (Caps. 7-26 e 8-22). Assim, em respostas que necessitam de
um aumento rápido da concentração de Ca2 + no citosol, o íon se mobiliza do exterior ou das organelas mencionadas (normalmente o faz do REL) em função da abertura transitória dos canais de
Ca2 + situados na membrana plasmática ou na membrana dessas organelas.
Nos Cap. 3-14 e 7-26, dissemos que os canais iônicos se abrem por meio de um ligante (acabamos de ver que o IP 3 é um deles) ou por uma alteração no potencial elétrico da membrana (Fig.
3.20). Um exemplo deste último mecanismo é dado pelas células musculares estriadas, nas quais
o Ca2 + sai do retículo sarcoplasmático por meio de um canal iônico dependente de voltagem.
No citosol, o Ca2 + atua como um segundo mensageiro em diferentes vias de sinais intracelulares. Para tanto, liga-se a uma proteína chamada calmodulina, embora em outras ocasiões permaneça como um íon livre (Figs. 11.10 e 11.19).
A parte média da calmodulina é alongada e cada uma de suas duas extremidades, que são globulares, contém dois lugares de ligação para o Ca2+ . Devemos acrescentar que a calmodulina é
ativada somente se os 4 Ca2 + que sua molécula é capaz de abrigar forem unidos a ela.
Uma vez formado, o complexo Ca2 +-calmodulina ativa a cinase CaM (do inglês, Ca2 + -calmodulin), que depois de se autofosforilar, fo sforila serinas e treoninas de outras cinases citosólicas.
A cinase CaM dá origem a várias vias de sinais intracelulares. Assim , em diferentes tipos
celulares inicia uma cadeia particular de ativações derivadas da fosforilação de sucessivas cinases ,
até que a última produza a resposta celular. Outro exemplo corresponde ao cérebro, onde em
alguns de seus neurônios, a cinase CaM-II se mantém ativa ainda depois da queda do Ca2 + citosólico , donde se estima que essa cinase se relaciona com a memória e os processos de aprendizagem.
No Cap. 5-33, vimos que a calmodulina da célula muscular estriada recebe o nome de troponina C. Além disso, analisamos a intervenção do complexo Ca2+ -troponina C durante a contração
muscular.
Com relação ao CaH livre, sua presença no citosol dá lugar a uma extensa variedade de respostas celulares. Por exemplo, participa do desmonte dos microtúbulos (Cap. 5-7), ativa a enzima
glicogênio fosforilase cinase nas células musculares estriadas e nas células hepáticas (Seção 1115) (Fig. 11.17 A), estimula a exocitose de insulina nas células B das ilhotas de Langerhans (Fig.
7 .20) e de neurotransmissores em algumas terminações axônicas (Fig. 7 .21) etc. Ademais, por unirse à cinase C, o Ca2 + livre toma possível a via de sinais intracelulares descrita na próxima seção
(Figs. 11.10 e 11.19).
Os sinais intracelulares mediados pelo Ca2+ terminam quando o íon retoma ao interior do REL
ou é extraído para a matriz extracelular por bombas de Ca2 + (Caps. 3-23 e 7-26).
A COMUN1CAÇÃO INTERCELULAR E A TRANSMISSÃO INTRACELULAR DE SINAIS
P0 2-
PO '-
I
_,,OP- 0
10
'
OH
HO
OH
o
1
O=P1 -0
o
1
CH-7H- 7H,
1
OH
o
1
O=P1 -0
"
b
Fosfatidilinositol
3-cinase
1
CH,-7H- yH,
o
o
o
C= O
C=O
C= O C=O
1
PI P2
HO
1
1
1
1
{CH,), (C H,)0
1
1
CH3 C H,
189
Fig. 11.20 Formação de PIP 3 a
partir de PIP2 quando a proteína
G 13 , ou a proteína Gi' atua sobre
a enzima fosfatidilinositol
3-cinase.
'
-',oP-OoO - Po,>Proteínas G13 ou G1
•
PIP 3
o
1
1
1
CH 3
CH,
<9H,).(9H,J.
11-19. O DAG ativa a cinase C
Uma vez que o PIP 2 é fracionado em DAG e IP 3 pela PLC-13 ou pela PLC-)', o DAG permanece na monocamada citosólica da membrana plasmática como o estava o PIP 2 (Figs. 11.10 e 11 .19).
Simultaneamente, parte do Ca2+ que é liberado do REL por ação do IP 3 se une a uma enzima
citosólica chamada cinase C (do inglês, Ca2+ ) . Depois, o complexo Ca2+ -cinase C se dirige à
membrana plasmática e se coloca junto ao DAG a fim de que este ative a cinase C (Figs. 11.1 O,
11.19, ll.22e 11.23).
Como vemos, o Ca2 + citosólico liberado pelo IP 3 toma possível a ativação da cinase C por meio
do DAG, o que demonstra que o IP 3 e o DAG se relacionam não somente por sua origem - o PIP2 mas tan'l:bém pela assistência que o p1imeiro presta ao segundo.
Quando se ativa, a cinase C fosf01ila serinas ou treoninas de proteínas citosólicas e nucleares,
as quais variam nos diferentes tipos de células .
Uma das proteínas citosólicas é a glicogênio sintase, que na célula hepática é fosforilada não
somente pela cinase A, mas também pela cinase C. Como vimos na Seção 11 -15 , o fo sfato impede a glicogênio sintas e de sintetizar glicogênio a partir de moléculas de glicose (Fig. l l. l 7B ).
Outra proteína citosólica que fosforila a cinase C é a Raf, e, nesse caso, a via de sinais se deriva
da ativação de genes que induzem o crescimento e a diferenciação celular (Seção 11 -12) (Fig. 11 .22).
A
Fig. 11.21 Ação da subunidade
a da proteína G 13 (A) e do
complexo 131' da proteína G; (B)
sobre a fosfatidilinositol 3-cinase
L
B
(PI 3-K) .
190
•
A COMUNICAÇÃO INTERCELULAR E A TRANSMISSÃO
TRACELULAR DE SINAiS
PLC- ~ c-------+t
Cinase C
a
a
G
Receptor
acoplado a uma
proteína G
Cinase A
Fig. 11.22 Algumas integrações das vias de sinais que têm origem em receptores com atividade de
tirosinocinase ou de receptores acoplados a proteínas G. PLC-{3, fosfolipase C-13; PLC-y, fosfolipase C--y;
AC, adenilato ciclase.
Outros dois exemplos nos quais a enzima cinase C fosforila proteínas citosólicas se dão durante a fecundação, nas etapas mostradas nas Figs. 19.22 e 19.23.
Por seu turno, as proteínas nucleares que se fosforilam mediante a cinase C são fatores de transcrição que ativam ou reprimem um grupo de genes relacionados com a proliferação celular. A importância da cinase C no controle da proliferação das células foi demonstrada ao se estudar a ação
tumorígena dos és teres de forbol, que têm estruturas similares ao DAG e igualmente a este ativam a
cinase C. Não obstante, como não se degradam - e, portanto, não se intenompe a atividade da cinase C - promovem uma proliferação celular sustentada, com a conseqüente f01mação de tumores.
Ressaltamos que, em alguns neurônios do cérebro, a cinase C não fosforila proteínas do citosol
nem do núcleo e sim canais iônicos da membrana plasmática, o que leva à abertura deles com
conseqüente alteração da excitabilidade da membrana.
A cinase C intenompe sua atividade quando o DAG se hidrolisa. Um dos produtos dessa hidrólise é o ácido araquidônico, que é um precursor de diversos eicosanóides, entre os quais estão
as prostaglandinas.
11-20. A via de transmissão de sinais que origina a enzima PI 3-K se
relaciona com a sobrevivência celular
Na Seção 11-12, dissemos que existem várias formas de fosfatidilinositol 3-cinases (PI 3-K),
entre elas uma que é ativada por receptores com atividade de tirosinocinase e outras que o fazem
mediante receptores acoplados a proteínas G (Figs. 11 .11 , 11.21 e 11.22). Devemos acrescentar
que as segundas são ativadas pelasubunidade a da proteína G 13 ou do complexo~)' da proteína
-e; (Figs. 11.20 e 11.21 ).
.
As PI 3-K se acham no citosol e todas produzem os mesmos efeitos: acrescentam um fosfato ao
fosfatidilinositol 4,5-difosfato (PIP2) da membrana plasmática e o convertem emfosfatidilinositol
3,4,5-trifosfato (PIP ). Assim, o PIP2 não somente é fonte de IP3 e DAG, mas também de PIP 3 •
Como mostram as Figs. 11.20~ 11.21, o PIP2 se localiza na monocamada citosólica da membrana plasmática e é fosforilado no sítio 3 do inositol.
O estudo das vias de sinais oriundas das PI 3-K se completa no Cap. 22-4 devido a que sua
intenupção conduz à morte celular.
A COMU ICAÇÃO INTERCELULAR E A TR ANSMISSÃO INTRACELULAR DE SINAIS
•
191
BIBLIOGRAFIA
Barridge M.J. ( 1985) The molecular basis of communication wi thin the
cell. Sei Am. 253 (4) :124.
Boume H.R. (1995) Trimeric G proteins: surprise witness tells a tale.
Science 270:933.
Casey PJ. (1995) Protein lipidation in cell signaling. Science 268: 221.
Clapham D.E. (1996) The G-protein nanomachine. ature 379:297.
Druey K.M. , Blumer K.J. , Hang V.H. and Kehrl J.H. (1996) Inhibition
of G-protein-mediated MAP kin ase activation by a new gene family.
Nature 379:742.
Ghosh A. and Greenberg M.E. (1995) Calcium signaling in neurons:
molecular mechanisms and cellular consequences. Science 268: 239.
Hib J. (2001) Histología de Di Fiore. Texto y atlas. El Ateneo, Buenos
Aires.
Hofer A.M. et al. (1996) ATP regulates calcium leak from agonistsensitive internai calcium stores. FASEE J. 10:302.
Home J.H. and Meyer T. (1997) Elementary calcium-release uni ts
induced by inositol trisphosphate. Science 276: 1690.
Iyengar R. (1996) Gating by ciclic AMP: expanded role for an old
signaling pathway. Science 271:461.
Kavanaugh W.M. and Williams L.T. (1994) An alternative to SH2
domains for binding tyrosine-phosphorylated proteins. Science
266:1862.
Linder M. and Gilman A. (1992) G proteins. Sei. Am. 267 (1):36.
Michell R.H. (1992) Inositol lipids in cellular signaling meehanisms.
TIBS 17:274.
Moehly-Rosen D. (1995) Loealization ofprotein kinases by anchoring
proteins: a theme in signal transduction. Science 268:247.
Nishi R. (1994) Neurotrophic fac tors: two are better than one. Science
265:1052 .
Pawson T. (1993) Signal transduction. A eonserved pathway from the
membrane to the nucleus. Develop. Gen. 14:333.
Roush W. (1996) Regulating G protein signaling. Science 27 1:1056.
Siderovsk i D.P. et al. (1996) A new famíly of regulators of G-proteincoupled reeeptors? Curr. Biol. 6:211.
Snyder S.H. and Bredt D.S. (1992) Biological roles of nitric oxide. Sei .
Am. 266 (5):28.
Taniguchi T. (1995) Cytokine signaling through nonreceptor protein
tyrosine kinases . Scienee 268:251.
Umemori H. et ai. (1997) Activation of the G prqtein Gq/11 through
tyrosine phosphorylation of the ex subunit. Science 276: 1878.
\
O núcleo
12
12- 1. O núcleo é um dos compartimentos essenciais da célula eucarionte
A presença do núcleo é a principal característica que di tingue as células eucariontes. O núcleo
ocupa 10% do volume total da célula e nele se encontra confinado o D A, exceto o das mitocôndrias. O núcleo é delimitado pela carioteca ou envoltório nuclear , que é composta por duas
membranas concêntricas que continuam com a membrana do RE (Fig. 12.1).
O envoltório nuclear tem inúmeras perfurações - chamadas de poros - que comunicam o
interior do núcleo com o citosol. Além disso , encontra-se reforçada por du as malhas de filamentos intermediários, uma que se apóia sobre a superfície interna do envoltório - a lâmina nuclear
vista no Cap. 5-3 - e outra que o faz sobre a superfície externa (Fig. 12.1 ).
No.compartimento nuclear estão localizados :
1) Quarenta e seis cromossomos, cada um formado por uma única molécula de DNA combinada com numerosas proteínas.
2) V~rias classes de RNA (mensageiro, ribossômicos, de transferência, pequenos) , que são
sintetizados no núcleo quando seus genes são transcritos. Estes RNA saem do núcleo pelos poros
do envoltório nuclear depois de seu processamento (Cap. 15).
3) O nucléolo , onde estão localizados os genes dos RNAr e os RNAr recém-sintetizados.
4) Diversas proteínas, como as que regulam a atividade dos genes, as que promovem o processamento dos RNA, as que se combinam com os RNAr no nucléolo, as DNA polimerases, as
RNA polirnerases etc. Essas proteínas são produzidas no citosol e mgressam no núcleo pelos poros do envoltório nuclear.
5) Os elementos mencionados se encontram dispersos na matriz nuclear ou nucleoplasma,
cuja composição é escassamente conhecida.
ENVOLTÓRIO NUCLEAR (CARIOTECA)
12-2. O envoltório nuclear é composto por duas membranas concêntricas
atravessadas por poros
Dissemos que o envoltório nuclear ou carioteca é composto por duas membranas concêntricas. Estas se unem ao nível dos poros, que se acham distribuídos mais ou menos regularmente por
todo o envoltório (Figs. 12.1 , 12.2 e 23.5).
1ntermed1ános
Fig. 12.1 Representação gráfica
do núcleo da célula. Observar a
lâmina nuclear (constituída por
fil amentos laminares) e o
envoltório nuclear como parte
integrante do sistema de
endomembranas.
194
•
O NÚCLEO
Fig. 12.2 Eletromicrografia do
núcleo de uma célula
pancreática. Np, nucleoplasma.
Parte da cromatina (C) se
encontra junto ao nucléolo (Nu)
e parte junto à face interna do
envoltório nuclear (EN), exceto
ao nível dos poros nucleares
(setas) . Observar a face externa
do envoltório nu clear coberta de
ribossomas. 24.000 X . (Cortesia
de J. André.)
O espaço entre a membrana externa e a membrana interna - ou espaço perinuclear - comunica-se com a cavidade do RE. A membrana externa continua com a membrana do RE e é
comum aparecer associada a um grande número de ribossomas (Fig. 12.2). As proteínas sintetizadas nestes ribossomas são incorporadas às membranas do envoltório ou lançadas no espaço
perinuclear.
A membrana nuclear interna é sustentada pela lâmina nuclear, que é uma malha delgada de
filamentos laminares (laminofilamentos) entrecruzados (Cap. 5-3). A lâmina nuclear se interrompe somente à altura dos poros (Figs . 12. 1 e 12.3) . Algumas proteínas integrais da membrana nuclear interna servem como pontos de ancoragem para os filamentos laminares.
A lâmina nuclear confere resistência ao envoltório nuclear e estabelece sua forma , geralmente
esférica. Como veremos no Cap. 18-18, ambas as estruturas se desarmam no começo da mitose e
reaparecem quando esta termina, ao se formarem os núcleos nas células-filhas.
12- 3. Os poros do envoltório nuclear são estruturas complexas
o
Os 3.000 a 4.000 poros que o envoltório nuclear tem são muito mais que simples canais entre
o nucleoplasma e o citosol. Neles existe um conj unto de proteínas chamadas nucleoporinas, que
compõem uma estrutura denominada complexo do poro e que consta dos seguintes elementos
(Figs. 12.3 e 12.4):
1) Oito colunas protéicas que formam uma parede cilíndrica em torno da qual a membrana
externa do envoltório nuclear continua com a membrana interna. No lado citos6lico, as extremidades das colunas protéicas compõem um anel ou boca interna do poro nuclear. No lado externo
ocorre algo similar.
2) Proteínas de ancoragem que amarram as colunas protéicas ao envoltório nuclear. Cada
proteína se liga a uma das colunas, attavessa a membrana do envoltório e sua extremidade se sobressai no espaço perinuclear.
3) Proteínas radiais que surgem das colunas e se orientam para o centro do poro. Como se
encurtam e se alongam, convertem o complexo do poro em um diafragma.
O NÚCLEO
•
195
Fig. 12.3 Esquema do envoltório
nuclear formado por duas
membranas que continuam ao
nível dos poros nucleares. Os
complexos do pôra apresentam
simetria radial octogonal. A
lâmina nuclear cobre a face
interna do envoltório, salvo nos
poros.
4) Fibrilas protéicas que nascem das aberturas intema e externa do complexo e se projetam
para o nucleoplasma e o citosol, respectivamente. Além disso, uma fibra circular une entre si extremidades distais das fibrilas que partem da abertura interna. Mais adiante, veremos que as fibrilas protéicas intervêm na passagem das proteínas através do poro (Fig. 12.6).
O complexo do poro mede cerca de 30 nm de altura e 100 nm de diâmetro. Entretanto, as proteínas radiais reduzem seu orifício, cujo diâmetro oscila entre 9 e 25 nm. Através dele passam
íons e moléculas pequenas e grandes em ambas as direções.
Ge1a1mente, os íons e as moléculas pequenas são transferidos de modo passivo, sem gasto deenergia. Ao contrário, as macromoléculas (proteínas e moléculas de RNA), antes de passarem
forçam o encurtamento das proteínas radiais, e por isso o complexo do poro se comporta como
um diafragma que adapta sua abertura às dimensões das moléculas que devem atravessá-lo.
r
12-4. A passagem de macromoléculas através do complexo do poro é
regulada
As macromoléculas que ingressam no núcleo são as proteínas enumeradas na Seção 12-1 e certos
RNA pequenos que retomam ao compartimento nuclear depois de tê-lo abandonado temporariamente (Cap. 15-12). As macromoléculas que saem do núcleo, no entanto, são proteínas envelhecidas ou que deixaram de funcionar - já que devem se dirigir ao citosol a fim de serem destruídas
por proteassomas - e diversos tipos de RNA combinados com proteínas.
Entrada de proteínas no núcleo. Ao contrário das proteínas destinadas às mitocôndrias e aos
peroxissomas - que, como vimos nos Caps. 8-28 e 10-5, se dobram depois de ingressar nessas
organelas - as proteínas destinadas ao núcleo ingressam estando pregueadas, já que adquirem
suas estruturas terciárias e quaternárias no citosol, após o término de sua síntese (Cap. 4-5 ).
A entrada das proteínas no núcleo se realiza mediante um mecanismo seletivo que permite o
ingresso somente das proteínas apropriadas , que têm um peptídeo sinalizador (ou peptídeo-siJ{\ (}..,
na!) específico que abre o caminho para que elas passem pelo complexo do poro.
í ;V
Os peptídeos sinalizadores mais estudados ·são chamados de NSL (do inglês, nuclear signal
localization) (Cap. 4-4). Como mostra a Fig. 12.5A, eles não interagem diretamente com o com- J
rre
e
CITOSOL
Coluna protéica
na
!llI10
Espaço
perinuclear
Diafragma
da
D-
e
Lâmina
nuclear
I•
100 nm
NÚCLEO
Fig. 12.4 Esquema do complexo
do poro com seus diferentes
componentes.
196
•
O NÚCLEO
Fig. 12.S A. Passagem de
proteínas do citosol para o
núcleo através do complexo do
poro.
CITOSOL
Ran
LS t
1
1
1
~ ! e:@
1
1
' \//
y
1
~ l
1
1
1
1
l,
)\
', _______ _____ iG~ ~ ---------- // . . _....
~
V
NÚCLEO
A
plexo do poro e sim mediante uma proteína heterodimérica denominada importina. Por ex istirem
diferentes tipos de NSL para diferentes grupos de proteínas destinadas ao núcleo, cada tipo de
NSL exige uma importina especial. Por outro lado, existem NSL que se ligam a proteínas diferentes das importinas, entre as quais se encontram certas proteínas que voltarão a ser mencionadas
mais adiante, chamadas transportinas.
A passagem de uma proteína do citosol para o núcleo , através do complexo do poro , ocorre em
várias etapas. São as seguintes e estão ilustradas na Fig. 12.SA:
1) A proteína se liga à importina por meio do NSL e ambas as moléculas são colocadas próximo do complexo do poro. Elas o atravessam antes da ampliação de seu diafragma, cujo diâmetro
pode alcançar os 25 nm.
2) A passagem exige que a importina seja guiada pelas fibrilas protéicas externas e internas do
poro, da maneira ilustrada na Fig. 12.6.
3) Durante a passagem é gasto um GTP, cuja hidrólise está a cargo de uma proteína chamada
Ran (do inglês, Ras-related nuclear protein ). Como vemos, trata-se de um transporte ativo.
4) A Ran pertence à família das GTPases que atuam associadas a proteínas reguladoras GEF e
GAP. Nos Caps. 7-38 e 11-12, dissemos que, quando são influenciadas pela GEF, estas GTPases
intercambiam o GDP incluído em suas moléculas por um GTP, enquanto que quando são influenciadas pela GAPhidrolisam o GTP a GDP e P (Fig. 11 .9) . A GEF e a GAP que se associam à Ran
estão localizadas no núcleo e no citosol , respectivamente.
S) Como mostra a Fig. 12.SA, quando o complexo importina-proteína ingressa no núcleo também o faz a Ran-GDP.
6) No núcleo, a GEF promove a substituição do GDP da Ran por um GTP, depois do que a
Ran-GTP se une ao complexo importina-proteína.
7) Essa união faz com que a importina se torne independente da proteína, que fica retida no
núcleo.
8) Ao contrário, a importina e a Ran-GTP permanecem unidas, atravessam o complexo do poro
e retornam ao citosol.
9) No citosol, a GAP induz a Ran a hidrolisar o GTP a GDP e P - é aqui onde o GTP é gasto
- do que resulta uma Ran-GDP e sua separação da importina.
10) Finalmente, a Ran-GDP e a importina livres podem ser reutilizadas para fazer ingressar
novas proteínas no núcleo.
Cabe assinalar que certas proteínas destinadas ao núcleo - em particular dos receptores dos
hormônios esteróides - depois de serem sintetizadas permanecem no citosol até a chegada desses hormônios (Fig. 11.2). Como vimos no Cap. 11-6, os receptores são retidos porque a eles se
unem chaperonas da família hsp90 e adquirem formas que lhes impedem de ingressar no núcleo.
Quando chegam os hormônios esteróides, separam-se das chaperonas e mudam a fonna dos receptores, o que lhes permite atravessar os poros do envoltório nuclear (Fig. 11.3).
Saída de proteínas e de moléculas de RNA. As proteínas que saem do núcleo dependem também da Ran e de sinais específicos para poder atravessar os poros do envoltório nuclear. Os peptíde-
O NÚCLEO
•
197
Fig. 12.5 B. Passagem de
proteínas do núcleo para o
citosol através do complexo do
poro.
CITOSOL
.. -.. , /,,.:. -------_... LS {]-------- ,,
.....
\
\(
\
1
1
1
1
1
-~ ! ~---~ ~
1
1
1
:
~ <---------;~--------- ~
~
NÚCLEO
...
:),;!,
~roteína
B
os sinalizadores são denominados NES (do inglês, nuclear export signal) e são reconhecidos por
proteínas equivalentes às importinas , chamadas exportinas. Além disso, existem NES que são
reconhecidos por transpo11inas.
A J;lassagem de uma proteína do núcleo para o citosol através do complexo do poro ocorre em
várias etapas. São as seguintes e estão ilustradas na Fig. l 2.5B:
1) A proteína se une à exportina por meio do NES . Simultaneamente, a GEF remove o GDP de
uma Ran-GDP ou o substitui por um GTP, de modo que se forma uma Ran-GTP.
2) A Ran-GTP se une à proteína por meio da exportina.
3) Unidas entre si, a Ran-GTP, a proteína e a exportina se aproximam do poro nuclear, atravessando-o após prévio alargamento de seu diafragma, cuj o diâmetro pode alcançar 25 nm .
4) Igualmente à importina, durante a passagem, a exportina é guiada pelas fibril as protéicas do
complexo do poro.
5) Ao ténnino da passagem induzida pela GAP, a Ran-GTP hidrolisa o GTP a GDP e P, do que
resulta uma Ran-GDP.
e
CITOSOL
~a
~
'\
o
-º
sar
lo
~
-
; e
eo.
re-
llll -
lde-
NÚCLEO
Fig. 12.6 Esquema do complexo
do poro no qual se ilustra a
função das fibrilas protéicas que
se projetam para o nucleoplas ma
e o citosol.
198
•
O NÚCLEO
Fig. 12.7 Esquema de um
cromossomo, com o centrômero,
os' telômeros e algumas origens
de replicação.
Telômero
&
Centrômero
•
1
Origem de replicação
1
6) Isso faz com que a Ran-GDP se tome independente da exportina que, por sua vez, se toma
independente da proteína.
7) A proteína fica retida no citosol. Ao contrário, a Ran-GDP e a exportina retomam ao núcleo
separadamente.
8) Finalmente, a Ran-GDP e a exportina livres podem ser reutilizadas para transferir novas
proteínas para o citosol.
Com relação às moléculas de RNA, saem do núcleo combinadas com proteínas, embora estejam impedidas de fazê-lo se não completarem seus processamentos (Cap. 15). Sua passagem através dos poros nucleares depende da Ran e de transportinas que reconhecem sinais específicos nas
proteínas.
CROMOSSOMOS
12- 5. O material de que são formados os cromossomos é a cromatina
Cada cromossomo é constituído por uma molécula! muito longa de DNA associada a diversas
proteínas . Segundo o cromossomo, o DNA contém entre 50 e 250 milhões de pares de bases. As
proteínas associadas são classificadas em dois grandes grupos: as histonas e um conjunto heterogêneo de proteínas não-histônicas.
O complexo formado pelo D A, as histonas e as proteínas não histônicas é chamado cromatina. Assim, a cromatina é o material que compõe os cromossomos.
12-6. O cromossomo tem um centrômero, dois telômeros e numerosas
origens de replicação
Nos cromossomos existem estruturas que são imprescindíveis para a replicação, ou seja, para
a duplicação que o DNA e suas proteínas associadas sofrem antes da divisão celular. São as seguintes (Fig. 12.7):
1) O centrômero ou constrição primária , que participa da repartição das células-filha das
duas cópias cromossômicas que são geradas como conseqüência da replicação do DNA (Cap.
18-9).
2) Os telômeros, que correspondem às extremidades dos cromossomos, cujo DNA se replica
de um modo diferente do restante do DNA . Na próxima seção e no Cap. 17-9, veremos que o DNA
telomérico contém uma seqüência especial de nucleotídeos que se repetem muitas vezes. Além
disso, devido a sua localização, está exposto aos seguintes riscos: pode se fundir com o DNA de
outros telômeros ou pode ser degradado por uma nuclease. Normalmente, estas contingências não
ocorrem porque o DNA telomérico se dobra sobre si mesmo (adota a forma de um laço) e é protegido por um capuz de proteínas denominadas TRF (do inglês, telomeric repeat bindingfactor)
(Fig. 17.12).
3) No Cap. 17-4 veremos que o enorme comprimento do DNA exige que sua replicação tenha
início em muitos pontos simultaneamente a fim de que sua duração seja relativamente curta. Esses pontos são denominados origens de replicação, e neles o DNA tem seqüências de nucleotídeos especiais. Além disso , todas as origens de replicação têm em comum seqüências conservadas
de cerca de uma dezena de nucleotídeos chamadas ARS (do inglês, autonomous replication sequence), das quais tornaremos a nos ocupar no referido capítulo.
12-7. Os cromossomos têm seqüências de DNA únicas e
seqüências de DNA repetidas
Nas moléculas de DNA estão depositadas as informações genéticas da célula, e todas as células
têm conjuntos virtualmente idênticos de moléculas de DNA. A totalidade da informação enética
de12ositada no DNA leva o no e_ill;_genoma. Podemos dizer que essa informação rege a atividade
do organismo do primeiro instante do desenvolvimento embrionário até a morte do indivíduo. Dela
também depende a imunidade ou a predisposição do organismo a determinadas doenças.
1-
O NÚCLEO
A capacidade ou incapacidade funcional do D A, ou seja, sua aptidão ou sua incompetência
para gerar moléculas de RNA (processo conhecido com o nome de transcrição do D A), baseiase na seqüência de seus nucleotídeos. Assim, em alguns setores, o D A exibe seqüências de nucleotídeos que se transcrevem - chamadas de genes - e em outros apresenta seqüências aparentemente prescindíveis, ao menos à luz do conhecimento atual.
O DNA se acha representado (em 75 %) por seqüências de nucleotídeos não repetidas (cópias
únicas) ou que se repetem poucas vezes. Nesta parte localizam-se os setores funcionais do D Aou seja, os genes - que englobam cerca de 10% do D A (representam 13% desses 75%). Um dos
maiores desafios para os biólogos moleculares é decifrar as funções do D A alheio aos genes.
Os 25 % restantes do DNA correspondem a seqüências de nucleotídeos que se repetem muitas
vezes, chamados DNA repetitivo. Suas funções são desconhecidas, embora não se descarte a ·
possibilidade de que desempenhem alguma função na manutenção da estrutura dos cromossomos.
Existem dois tipos de DNA repetitivo: o disposto em turnos (no qual o início de uma repetição
se acha imediatamente depois do final da outra) e o disperso (cujas cópia não se encontram agrupadas e sim dispersas em pontos diferentes dos cromossomos).
DN A repetitivo disposto em turnos . A esta categoria pertencem os D A satélites , os .JJ"'r'0
microssatélites e os minissatélites.
Nos DNA satélites, o comprimento da seqüência repetiçla, o número de vezes que se repete em
cada turno e o número de turnos variam. O D1 A satélite mais destacado localiza-se nos centrômeros, e, por isso, é encontrado em todos os cromossomos (Fig. 12.17). Inclui uma seqüência
repetida de 171 pares de bases a que se deu o nome de seqüência alfóide, que varia muito pouco
nos diferentes cromossomos. Outros D A satélites se localizam no braço longo do cromossomo
Y e na cromatina distante dos centrômeros dos cromossomos 1, 3, 9, 16 e 19 (mais adiante indicaremos o significado da numeração dos cromossomos).
Os.. microssatélites contêm seqüências de D A repetidas muito mais curtas que as dos DNA
satélites, e são igualmente encontrados em todos os cromossomos.
Os minissatélites também contêm seqüências de DNA curtas. A esta categoria pertencem o
DNA repetitivo dos telômeros (Seção 12-6 e Cap. 17-9) e o DNA hipervariável, assim chamado
porque é diferente em cada indivíduo. O D A hipervariável se localiza principalmente nas proximidades dos centrômeros e como a sua herança responde às leis mendelianas , a medicina forense
recorre a ele quando necessita realizar estudos de paternidade ou de identidade de pessoas.
DNA repetitivo disperso. Existem dois tipos de DNA repetitivo disperso, chamados SINE e
LINE (do inglês, short e long interspread nuclear elements).
O SINE mais estudado corresponde à farm1ia Alu , da qual existem cercas de 500.000 cópias
repartidas em todos os cromossomos. Cada cópia tem cerca de 300 nucleotídeos em um sítio que
pode ser cortado pela enzima de restrição A lu I (daí o nome desse DNA) . Como a seqüência Alu
tem uma extensa homologia com a seqüência do gene do RNApc, durante muito tempo acreditouse que as seqüências Alu correspondessem às cópias desse gene (Caps. 13-2, 13-11 e 14-18).
O LINE mais comum é conhecido com a sigla LI (do inglês, LINE-1). Sua seqüência repetida
é relativamente longa e corresponde ao gene de uma transcriptase reversa (Cap. 17-24).
12- 8. As células somáticas humanas têm 46 cromossomos
As células somáticas humanas têm 46 cromossomos - e, por conseguinte, 46 moléculas de
DNA- divididos em 22 pares de autossomas mais um par de cromossomos sexuais (Fig. 12.15).
Na mulher, os dois membros do par sexual são iguais, porém isto não ocorre no homem. Assim,
com exceção do par sexual do homem, podemos dizer que em cada célula existem dois jogos idênticos de 23 cromossomos, um fornecido pelo espermatozóide e o outro pelo ovócito (oócito) no
momento da fecundação (Cap. 19-19). Isso é o que define as células somáticas como células diplóides e os espermatozóides e os ovócitos como células haplóides.
Os DNA dos 46 cromossomos contêm em conjunto cerca 3 X 109 pares de nucleotídeos. Portanto, em média, uma molécula de DNA de um cromossomo humano, se estivesse completamente
estendida, mediria cerca de 4 cm de comprimento. Logicamente, se estivessem estendidas 46
moléculas de tal tamanho , não poderiam ser contidas no núcleo não somente pelo espaço que
demandariam, mas sim pelas tramas que acarretariam, o que afetaria seu funcionamento, inclusive sua integridade.
A célula resolveu o problema fazendo com que a molécula de DNA se enrolasse sobre si mesma. Antes de analisar o modo como ela o faz, devemos assinalar que o grau de enrolamento varia
segundo o momento do ciclo em que a célula se encontra: é mínimo durante a interfase (quando a
síntese de RNA é alta) e máximo quando a célula está prestes a se dividir. Assim, os cromossomos
'
199
•
l..G__'O\Ô-Vrfv
,
200
•
O NÚCLEO
Fig. 12.8 Os quatro pares de
histonas que compõem o núcleo
do nucleossoma.
--...
~ ---
~
~
~
~
H2A
H2B
se mostram como estruturas altamente variáveis.
mento do D A durante a divisão celular.
~ Q
~ Q
H3
H4
o Cap. 18-6 analisaremos o papel do enrola-
12-9. Existem cinco tipos de histonas comprometidas no
enrolamento da cromatina
As histonas desempenham um papel fundamental no enrolamento da cromatina. Trata-se de
proteínas básicas que têm uma alta proporção de lisina e arginina, quer dizer, de aminoácidos
carregados positivamente (Cap. 2-8). Isto contribui para a união das histonas às moléculas de DNA,
nas quais predominam as cargas negativas.
Existem cinco tipos de histonas chamadas Hl, H2A, H2B , H3 e H4. A Hl, da qual existem
seis subtipos, contém cerca de 220 aminoácidos, enquanto as restantes têm entre 103 e 135 aminoácidos cada uma. As quatro últimas levam o nome de histonas nucleossômicas porque a molécula de DNA se enrola em torno delas para formar os nucleossomas, que constituem as unidades
básicas do enrolamento cromatínico. Em cada nucleossoma, as histonas nucleossômicas associam-se e formam uma estrutma octamérica - o núcleo do nucleossoma- composta por duas H2A,
duas H2B , duas H3 e duas H4 (Fig. 12.8).
Vale acrescentar que as extremidades amina - ou "caudas" - das histonas projetam-se para
fora do nucleossoma, o que poderá ser avaliado no Cap. 14-12 dedicado ao estudo da regulação da
atividade dos genes.
O octâmero de histonas tem a forma de um cilindro baixo de 10 nm de diâmetro e está envolto
por um pequeno segmento de DNA que percorre sua circunferência quase duas vezes (Fig. 12.9B).
Cada volta equivale a 81 pares de nucleotídeos e, no total , o segmento de DNA associado ao nucleossoma contém 146 pares de nucleotídeos.
Como mostra a Fig. 12.9A, as duas voltas do DNA se fixam ao núcleo do nucleossoma graças
à hi stona Hl. O complexo formado pelo nucleossoma mais a histona Hl recebe o nome de
cromatossoma (Fig. 12.9C) e o segmento de DNA que a ele se associa é de 166 pares de nucleotídeos, 20 a mais que o nucleossoma.
Na cromatina existem duas proteínas acessórias - ambas ácidas - que ajudam as histonas
para que se liguem entre si. Denominam-se proteína Nl e nucleoplasmina. A primeira, associa
a H3 à H4; a segunda, associa a H2A à H2B.
Os nucleossomas estão separados por segmentos de DNA espaçadores de comprimento variável, que contêm entre 20 e 60 pares de nucleotídeos. Como mostram as Figs. 12.9A e 12.10, a
alternância dos nucleossomas com os segmentos espaçadores dá à cromatina a aparência de um
DNA espaçador
Fig. 12.9 A. Cromatina intacta
de 10 nm. B. Nucleossoma
liberado depoi s da digestão
intensa com uma nuclease, com
o núcleo histônico e 146 pares de
nucleotídeos. C. Cromatossoma
escindido depois da digestão
moderada com uma nuclease,
com o núcleo do nucleossoma, a
histona Hl e 166 pares de
nucleotídeos.
H1
A
Núcleo
1 .
B Nucleossoma
C Cromatossoma
O NÚCLEO
•
201
Fig. 12.10 Cromatina estendida
para a microscopia eletrônica
com aparência de colar de contas
e uma espessura de 10 nm .
,
colar de contas. Já que comumente um gene contém cerca de 10.000 pares de nucleotídeos, tem
em torr;o de 50 nucleossomas separados por outros tantos DNA espaçadores.
O tratamento da cromatina com enzimas que digerem o DNA (nucleases) provoca cortes somente nos DNA espaçadores. Se o tratamento for moderado, os cromatossomas se tom am independentes e tanto suas histonas como o DNA associado a elas permanecem íntegros (Fig. l 2.9C) .
Porém, quando a digestão enzim ática é intensa, obtêm-se nucleossomas (Fig. '12.9B).
Para que possa ser contida no pequeno espaço que o núcleo lhe oferece, a cromatina de cada
cromossomo deve sofrer novos e sucessivos graus de enrolamento, cada vez maiores. Estes novos
enrolamentos são induzidos por um complexo de proteínas nucleares chamadas condensinas.
Em um primeiro momento, os cromossomos se enrolam sobre si mesmo e dão lugar a uma
estrutura helicoidal chamada solenóide, de 30 nm de diâmetro (Figs. 12.11e l 2.12C). Como mostra
1
Núcleo do ~
nucleossoma ~- H 1
A
B
Fig. 12.11 A. Cromatina de 30
nm de diâmetro. (De F. Thoma,
T. Koller e A. Klug.) B.
Eletromicrografia de uma fi bra
de cromatina de 30 nm de
diâmetro. (Cortesia de J. B.
Rattner e B. A. Hamkalo.)
202
•
O NÚCLEO
a Fig. 12.11 , este enrolamento depende das histonas Hl - que se unem entre si - e cada volta do
solenóide contém seis nucleossomas.
Cabe assinalar que em intervalos mais ou menos regulares, o enrolamento das fibras de 30 nm
é interrompido, de modo que se observam - entre setores de 30 nm - segmentos de cromatina
mais delgada. Neles, o D A se encontra associado a proteínas não histônicas , em sua maioria
reguladoras da atividade gênica (Cap. 14-5).
o entanto, a cromatina cada vez mais se compacta. Assim, a fibra de 30 nm forma laços (ou
alças) de comprimento variado, que nascem de um eixo protéico constituído por proteínas nãohistônicas (Figs. 12.12D e 12.13). Visto que o conjunto de cordões protéicos compõe uma espécie
de armação, nos extremos de cada laço o D A associado ao cordão protéico recebe o nome de
SAR (do inglês. scaffold associated regions). Os laços encontram-se firmemente unidos ao cordão. porém não sabemos como as SAR se sujeitam a eles.
Considera-se que cada laço constituiria uma unidade de replicação do DNA (Cap. 17-3) e, provavelmente, uma unidade de transcrição , ou seja, um gene (Cap. 14-12).
12-1 O. A cromatina pode ser eucromática ou heterocromática
Em alguns setores, a cromatina sofre um grau de enrolamento ainda maior, como se observa na
Fig. 12.12E. Durante a interfase, a cromatina assim condensada recebe o nome de heterocromatina; já o nome eucromatina é reservado para aquela menos compactada (Fig. 12.2).
Existe uma relação direta entre o grau de enrolamento e a atividade transcricional do DNA. A
cromatina menos compactada é a que tem o D A transcricionalmente ativo, quer dizer, o DNA que
sintetiza moléculas de RNA. Este D A envolve cerca de 10% do genoma. Ao contrário, o DNA que
corresponde à cromatina mais condensada é inativo do ponto de vista transcricional. A esta categoria pertencem toda a heterocromatina e o setor da eucromatina onde o enrolamento se acha em um
grau inte1mediário entre a eucromatina transcricionalmente ativa e a heterocromatina.
As regiões eucromáticas experimentam ciclos de contração e extensão. No Cap. 14-12 analisaremos os mecanismos que regulam o enrolamento da cromatina e o papel que desempenham no
controle da atividade gênica.
1
f
t
1
12-11. A heterocromatina pode ser constitutiva ou facultativa
1
1
l
Durante a interfase, a cromatina altamente condensada que se encontra de maneira constante
em todos os tipos celulares, ou seja, como um componente estável do genoma, não conversível
em eucromatina, recebe o nome de heterocromatina constitutiva. A esta categoria pertencem a
cromatina dos setores cromossômicos que têm DNA repetitivo satélite - como o dos centrômeros , o do braço longo do cromossomo Y etc (Seção 12-7) - e a maior parte da cromatina que
forma os braços curtos dos cromossomos acrocêntricos (Seção 12-12).
Ao contrário, denomina-se heterocromatina facultativa àquela detectada em localizações que
variam nos diferentes tipos celulares ou nas sucessivas diferenciações de uma determinada célula,
Fig. 12.12 Graus sucessivos de
enrolamento da cromatina.
A
B
e
D
E
O NÚCLEO
•
203
de modo que setores que aparecem como heterocromatina em um tipo celular ou em uma etapa de
sua diferenciação, em outros tipos celulares e em outras etapas se apresentam como eucromatina.
O exemplo mais significativo de heterocromatina facultativa corresponde a um dos cromossomos X na mulher, que se acha totalmente compactado (salvo em alguns setores) e é conhecido
como cromatina sexual ou corpúsculo de Barr. Esta heterocromatina se apresenta durante toda a
vida da mulher (menos no começo do desenvolvimento embrionário), em todas as células do organismo (exceto nas ovogônias).
12-12. No cariótipo, os cromossomos se ordenam de acordo com seus
tamanhos e as posições de seus centrômeros
Como descobriremos nos Caps. 18 e 19 , durante o ciclo celular, dependendo do fato de a célula
estar atravessando a interfase ou estar se dividindo - por mitose ou por meiose - os cromossomos passam de estados de menor a maior compactação. O grau maior de enrolamento é alcançado
na etapa da divisão chamada metáfase, na qual a cromatina dos cromossomos mostra um estado
de condensação similar ao da heterocromatina interfásica (Fig. 12.14).
Tal grau de compactação faz com que os cromossomos cheguem a ser vistos como estruturas
individuais, as quais, uma vez fixadas e fotografadas , podem ser isoladas, classificadas e ordenadas com relativa facilidade. O conjunto de cromossomos ordenados segundo um critério preestabelecido recebe o nome de cariótipo (Fig. 12.15).
As 46 unidades normalmente presentes nas células humanas constam de 23 pares de homólogos. Como vimos, 22 deles estão presentes tanto na mulher como no homem e recebem o nome de
autossomos. O par restante - que é conhecido como par sexual - na mulher se acha composto
por dois cromossomos idênticos, os cromossomos X, e no homem, por dois cromossomos bastante difarentes , pois um deles é um cromossomo X e o outro é o pequeno cromossomo Y.
Os cromossomos metafásicos apresentam uma morfologia característica. São compostos por
dois componentes filamentoso s - as cromátides -unidos pelo centrômero (ou constrição primária).
l
Fig. 12.13 Eletromicrografia de
um cromossomo humano do qual
se extraíram as histonas. Certas
proteínas não histônicas formam
uma armação, da qual emergem
laços ou anéis de DNA de
diferentes comprimentos, como
ilustrado no detalhe acima à
direita. (Cortesia de U.
Laemmli.)
204
•
O NÚCLEO
Fig. 12.14 Eletromicrografia de
um cromossomo em metáfase.
(Cortesia de E. J. Dupraw.)
Como veremos no Cap. 18-9, o centrômero desempenha um papel essencial na separação das
cromátides irmãs durante a anáfase, que segue a metáfase. Em conseqüência dessa separação, uma
vez segregadas nas respectivas células-filhas, cada uma das cromátides se converte em um cromossomo.
A presença do centrômero divide as cromátides do cromossomo metafás ico em dois braços,
geralmente um mais longo que o outro. O braço curto é identificado com a letra p e o braço longo
com a letra q. Os extremos dos braços são denominados telômeros. De acordo com a posição do
centrômero, os cromossomos são classificados em três grupos (Fig. 12.16), a saber:
1) Os metacêntricos têm o centrômero em uma posição mais ou menos central, de modo que
existe pouca ou nenhuma diferença no comprimento dos braços das cromátides.
2) Nos submetacêntricos, o centrômero encontra-se afastado do ponto central, de modo que
as cromátides têm um braço curto e um longo.
3) os acrocêntricos, o centrômero se encontra próximo de um dos extremos do cromossomo,
de modo que os braços curtos das cromátides são muito pequenos.
Na Fig. 12.15 é mostrado um cariótipo humano no qual os cromossomos aparecem ordenados
de acordo com seu tamanho e o comprimento de suas cromátides. Os membros de cada par são
identificados com números correlativos.
Os cromossomos acrocêntricos correspondem aos números 13, 14, 15, 21 e 22 (Fig. 12.17).
Eles têm uma pequena massa de cromatina chamada satélite - não deve ser confundida com o
DNA satélite - localizada no extremo livre do braço curto. Os satélites se encontram ligados ao
resto do braço curto por uma haste delgada de cromatina denominada constrição secundária (para
diferenciá-la da constrição primária ou centrômero) (Fig. 12.16). À exceção da cromatina correspondente à constrição secundária - na qual se localizam os genes do RNA ribossômico 45S (Cap.
13-8) - o braço curto dos cromossomos acrocêntricos é composto por heterocromatina.
6
JJ
ll
6-G AI
13
14
15
li
li
t-1
!I
19
H
21
22
10
16
Fig. 12.15 Cariótipos humanos
normais. A. Masc uli no. B.
Feminino. (Cortesia de M.
Drets.)
1-1
J-1
11
17
(
(1 }·l
X
12
10
f i 6-c
,.,
13
16
18
•• ,.,.
11
''
·-·
19
20
A
21
14
1-ã
17
4-; 1-1
X
12
h-6
,.
15
18
1·1
20
1n
22
y
8
Cromátides
Satélite
Centrômero
Fig. 12.16 Tipos de
cromossomos segundo a posição
do centrômero.
e
Metacêntrico
Submetacêntrico
Acrocêntrico
O NÚCLEO
,_-
-• R;•- -• Tii•• -••
••
I·1
•
.. -- - ,. •
-•- ·• •• ':.•• -• ... -••• ~Hi.=
p.
.
~
,
.
•
•
•
•
ru
- )
~-
~
2
p
1
~. .
i• ·3 •
1
1
,.' 1
1
1 ,_
~
Q
1
2 :•
f-
~
, ·'
•JJ
1
....,
7
2
,
: .
•
X
I ' ,• •
·• ••
-••
1 ;•
'
2 ;•
.~
5
~
!i .
;mi
1
1
i1
'
2
3
1
~•
1J
•
4-
9
8
6
5
1
.. -
•• ,,_. -• hlã1
2
Q
3
;• .
4
•
1
11
1
2
3
~
3
2
1'
·~
1
~
p
•
p:
1-
11 3
1
.
.·-.••;li •
~·
,
3
10
11
-
3
~
p
8f••
1
Q
1
4
~
12
..
13
,,. 1
1
Q
'
18
1
19
1
·- 1
,,_
2
•
14
2 ·3 -
,,
"• •
~
20
15
.
2i-
3
- ~•- !
1
16
17
22
y
f!i •~
2
21
12-13. As técnicas de bandeamento cromossômico revelam detalhes
estruturais dos cromossomos
Quando os cromossomos metafásicos são submetidos a certas técnicas de coloração, exibem
bandas claras e escuras intercaladas ao longo de seus eixos longitudinais (Fig. 12.1 7) . A distribuição destas bandas é constante em cada cromossomo, o que - ao se analisar um cariótipo - facilita sua identificação. Além disso, nos casos em que as localizações não coincidem com os padrões normais, as bandas constituem um guia muito valioso para diagnosticar transtornos genéticos, como, por exemplo , deleções, duplicações, inversões e translocações cromossômicas (Cap.
20-10). As técnicas de bandeamento cromossômico mais utilizadas são as seguintes:
Bandeamento G. Os cromossomos são tratados com tripsina (para desnaturar suas proteínas)
e corados com o corante de Giemsa. As bandas G que aparecem escuras contêm DNA ricos em
pares de nucleotídeos A-T.
•
205
Fig. 12.17 Representação
esquemática do cariótipo
humano com bandeamento
mostrando os 22 autossomos e
os cromossomos X e Y. p. braço
curto; q, braço longo . Os setores
de heterocromatina constitutiva
(incluídos os dos centrômeros)
aparecem em cor vermelha. Os
números correspondem às
regiões e às bandas. Os
cromossomos 13, 14, 15, 21 e 22
contêm satélites e constrições
secundári as. Nestas últimas estão
localizados os genes do RNAr
45S .
206
•
O NÚ CLEO
Bandeamento Q. Se os cromossomos forem tratados com quinacrina desenvolvem um padrão
específico de bandas escuras intercaladas com outras brilhantes (Q), as quais são identificadas com
a ajuda de microscópio de fluorescência (Cap. 23 -25). As bandas Q coincidem quase exatamente
com as bandas G e, por isso, também são ricas em pares de nucleotídeos A-T.
Bandeamento R. este caso, os cromossomos são submetidos a calor antes da coloração pelo
Giemsa, o que lhes dá um padrão de bandas escuras (bandas R) e claras, inverso ao obtido com os
bandeamentos G e Q. A análise molecular das bandas R mostra uma maior proporção de pares de
nucleotídeos G-C.
Bandeamento C. Este método cora de maneira específica os segmentos de cromatina que permanecem condensados na interfase, como , por exemplo , a heterocromatina constitutiva dos
centrômeros.
12-14. Os componentes nucleares encontram - se ord enados espacialmente
É desconhecida, no núcleo, a existência de uma armação de filamentos equivalente à do citoesqueleto, projetada para sustentar os cromossomos. Entretanto, durante a interfase, os cromossomos ocupam regiões especiais denominadas territórios cromossômicos, que estão separados por
espaços chamados domínios intercromossômicos, onde se encontram moléculas de RNA em
trânsito para os poros nucleares ou se processando (Cap. 15) .
Os padrões de distribuição dos telômeros, dos centrômeros e da heterocromatina variam nos
diferentes tipos de células e se modificam ao longo do ciclo celular, embora geralmente os centrômeros e a maior parte da heterotromatina tendam a se congregar próximo do envoltório nuclear e
do nucléolo.
A localização dos genes que codificam os RNA ribossômicos constitui o caso mais aparente de
ordenamento nuclear, pois eles se agrupam em um setor do núcleo facilmente identificável, como
o é o nucléolo (Cap. 13-8).
1
l
t
BIBLIOGRAFIA
Bickmore W .A. and Sumner A.T. (1989) Mammalian chromosome
banding- an ex pression of genome organization. Trends Genet.
5:144.
Britten R.J. and Kohne (1968) Repeated sequences in DNA. Science
16 1:529.
Burlingame R .W. et al. (1985) Crystallographic structure of the
octameric histone core of th e nucleosome at a resolution of 3.3 Â.
Science 228 :546.
DePamphilis M .L. (1993) Origins of DNA replication that fun ction in
eukaryotic cells. Curr. Opin. Cell Biol. 5:434.
Dingwall C. and Laskey R. (1992) The nuclear mem brane. Science
258:942.
Edmondson D.G. and Roth S.Y. (1996) Chromatin and transcription .
FASEB J. 10:1173 .
Feath erstone C. ( 1997) Re searchers get the first good look at the
nucleosome. Science 277: 1763.
Felsenfeld G . (1985) DNA. Sei. Am. 253 (4) :58.
Felsenfeld G. and McGhee J.D. (1986) Structure ofthe 30 nm chromatin
fiber. Cell 44:375.
Gall G. ( 198 1) Chromosome structure and C-value paradox. J. Cell Biol.
91:35.
Gasser S.M. (2002) Visualizing chromatin dynamics in interphase nuclei. Science 296: 1412.
Gerace L. and Burke B. (1988) Functional organization ofthe nuclear
envelope. Annu. Rev. Cell Biol. 4:335.
Goldfarb D.S . (1997) Nuclear transport: proliferating pathways . Curr.
Biol. 7:R13.
Gõrlich D. and Mattaj I.W. (1996) Nucleocytoplasmic transport. Science 271:1513.
Heald R. and McKeon F. (1990) Mutations of phosphorylation sites in
lamin A that prevent nuclear lamina dis assembly in mitosis. Cell
61 :579.
Isenberg I. (1979) Histones. Ann. Rev. Biochem. 48:159 .
Izaurralde E. and Mattaj I.W. (1992) Transport ofRNA between nucleus
and cytoplasm. Semin. Cell. Biol. 3:279.
Jeffreys A. J., Wilson V. and Thein S.C. (1985) Individual-specific fin gerprints of human DNA. Natu re 316:76.
Kahana J.A. and Cleveland D.W. (200 1) Some importin news aboaut
spindle assembly. Science 291: 171 8.
Kitsberg D ., Selig S. and Cedar H. (199 1) Chromosome structure and
eukaryotic gene organi zation. Cun. Opin. Genet. Dev. 1:534.
Komberg R.D. and Klug A. (1981) T he nucleosome. Sei. Am. 244
(2):52.
Krontiris T.G. (1995) Minisatellites and human disease. Science 269: 1682.
Lohe A.R. and Hilliker A.J . (1995) Return of the H-word (heterochromatin). Curr. Opin. Genet. Dev. 5:746.
Manuelidis L. ( 1990) A view of interphase chromosomes . Science
250:1533.
Moore M.S. (1996) Protei n translocation: nuclear export-out of the
dark. Curr. Biol. 6:137.
Moore M .J. and Rosbash M. (200 1) TAPpi ng into mRNA export. Science 294: 184 1.
Nagele R., Freeman T. , McMorrow L. and Lee H. ( 1995) Precise spatial
pos iti oning of chromosomes during prometaphase: evidence for
chromosomal arder. Science 270:1831.
Panté N. and Aebi U. (1996) Sequenti al binding of import ligands to
dist inct nucleopore regions during their nuclear import. Science
273:1729 .
Price C.M. (1992) Centromeres and telomeres. CUIT. Opin. Cell Biol.
4 :379.
Richards S.A., Carey K.L. and Macara I.G. (1997) Requirem ent of
guanosine triphosphate-bound Ran for signal-mediated nuclear protein export. Science 276 : 1842.
Schm id C.W. and Jelin ek W.R. (1982) The Alu family of dispersed
repetitive sequences . Science 2 16: 1065 .
Stewart A. (1990) The fun ctional organization of chromosomes and the
nucleus. Trends Genet. 6:377.
Stewart M. and Clarkson D. (1996) Nuclear pores and macromolecular
assemblies involved in nu cleocyto plasmic transport. Curr. Biol.
6: 162.
O NÚCLEO
Sunkel C.E. and Coelho P. (1995) The elusive centromere: sequence
divergence and fun ctional conservation. Curr. Opin. Genet. Dev.
5:756.
Swedlow J.R. , Agard D.A. and Sedat J.W. (1993) Chromosome structure inside the nucleus . Curr. Opin. Cell Biol. 5:412.
Wen W. et al. (1995) Identification of a signal fo r rapid export of proteins
from the nucleus. Cell 82:463.
D
e
L
•
207
Wolffe A. P. and Pruss D. (1996) Chromatin: hanging on to histones.
Curr. Biol. 6:234.
Zapp M.L. (1995) The ins and outs of RNA nucleocytoplasmic transpor!. Curr. Opin. Genet. Dev. 5:229.
Zlatanova J. and Yaneva J. (199 1) Histone Hl-DNA interactions and
their relation to chromatin structure and function. DNA Cell Biol.
10:239.
Os genes
13
13-1. Os genes são os segmentos funcionais do DNA
\_conforme o objetivo do estudo, os genes podem ser analisados por três ângulos diferentes: o
molecul ar, o mendeliana e o populacional. A biologia celular - que os estuda do ponto de vista
molecular - define os gene como "a seqüência de DNA que contém as informações necessárias
para produzir uma molécula de RNA e, se esta corresponder a um RNA mensageiro, a partir dele
elaborar uma proteína".
Calcula-se que existam cerca de 30.000 genes distribuídos nos 46 cromossomos das células
humanas. Cada gene está localizado em um local particular do cromossomo chamado locus. No
Cap. J2-9 vimos que cada laço, formado quando a cromatina de 30 nm se dobra, poderia corresponder a um gene. No total, os genes envolvem cerca de 10% do DNA nuclear, mas o significado
da maior parte do DNA restante é ignorado.
ll)s genes não dirigem apenas a síntese das molécul as de RNA. Como o restante do DNA, antes
que as células somáticas se dividam, eles se replicam, isto é, sintetizam moléculas de DNA complementares que se repartem nas células-filha com a finalidade de se autoperpetuar. De modo
complementar, pela forma como as células de DNA se replicam durante a meiose e se distribuem
nas células germinativas, os genes constituem as entidades biológicas pelas quais são transmitidos os caracteres físicos dos pais aos filhos. Além disso, as mutações que os genes acumulam ao
longo do tempo podem resultar benéficas para a evolução da espécie2
Como as informações genéticas depositadas nas moléculas de DNA estão localizadas no núcleo (à exceção do DNA mitocondrial, descrito no Cap. 8-26) e a síntese protéica - baseada nessa informação - ocorre no citoplasma, é necessário que essa informação seja transferida do núcleo ao citosol (Fig. 13.1). Tal transferência é um processo complexo que necessita da interven-
J
DNA ~
l
1
Transcrição
Transcrito ~
primário
Processamento
RNAm ~
Ribossoma~
j
Tradução
Proteína
Fig. 13.1 Fluxo de informações
genéticas em uma célula
eucarionte.
210
•
OS GENES
Fig. 13.2 Transferência das
informações genéticas contidas
na seqüência de nucleotídeos do
DNA que passa ao RNArn
(transcrição) e deste à proteína .
(tradução) .
(5') ATG G TTAA C .... .. .. .. ...... .... .. .... .. .. CTCTAA (3')
DNA
(3' ) TACCAATTG ... .... ... .. .. .. .. ..... . . ..... GAGATT (5')
1
•
•
Transcrição
RNAm
(5') ~~~ .... .. .. .. .. .. ...... .... .... CUCUAA (3')
+
(! n1c. )
PROTEÍNA
•--------"-+
1
Tradução
(Térm .)
(H2 N) Me t • V a l ·Asn ........ .. ..... ... ....... .. . .. Leu (COOH )
ção de uma molécula intermediária. Trata-se do RNA mensageiro (RNAm) que copia a informação contida no D A e sai para o citosol, onde dirige a síntese da proteína. Desta forma, no núcleo,
o DNA determina a seqüência dos nucleotídeos do RNAm e, no citoplasma, o RNAm estabelece
a ordem dos aminoácidos da proteína (Fig. 13.2).
A síntese do RNA, que como acabamos de ver usa como molde um DNA, é denominada transcrição do DNA, enquanto a síntese da proteína, cujo molde é o RNAm leva o nome de tradução
do RNAm. Este flu xo de informações é conhecido como o "dogma central" da biologia molecular (Fig. 13.3).
As metáforas utilizadas para definir ambas as etapas são bastante adequadas , já que transcrição
significa "cópia ou reprodução literal de um original" (o RNA se parece com o DNA) e tradução
indica "escritura ou expressão em uma linguagem daquilo que anteriormente foi escrito ou expressado em outra" (é o que ocorre entre a proteína e o RNAm). Com relação a replicação do
DNA, significa "cópia que reproduz com exatidão o original", que é o que faz o DNA quando se
duplica (Cap. 17-1 ) .
Ao definir o gene como uma região do DNA que gera um caráter físico hereditário, sugere-se .
que cada gene dá lugar a uma única classe de proteína. Embora a maioria dos genes que produzem
RNAm se conduza dessa maneira, alguns dão origem a poliproteínas, ou seja, produtos transitórios que se escindem em várias proteínas, cada uma determinante de um traço físico singular.
1
'•
13-2. A célula produz vários tipos de RNA
Existem três tipos de RNA principais: os já mencionados RNA mensageiros ou RNAm, que
recolhem a informação dos genes e dirigem a síntese das proteínas; os RNA ribossômicos ou
RNAr, que são fundamentalmente estruturais, e os RNA de transferência ou RNAt, que atuam
como adaptadores.
A síntese protéica (ou tradução do RNAm) ocorre no interior de ce11as estruturas citosólicas
pequenas chamadas ribossomas, que constam de quatro RNAr diferentes entre si e numerosas
proteínas (Fig. 16.5). Sob a direção de um RNAm ocorrem nos ribossomas as reações químicas
que ligam os aminoácidos de cada proteína. A tradução necessita da participação dos RNAt, dos
quais existem vários tipos, todos de tamanho pequeno, que se encarregam de transladar os aminoácidos para o iibossoma, seguindo a ordem que marca as informações genéticas do RN,Am.
Além desses três tipos de RNA existem os seguintes , o primeiro e o último localizados no citosol e os restantes no núcleo:
ORNA citosólico pequeno ou RNAcp (em inglês, small cytosolic RNA), que, como vimos no
Cap. 7-1 2, pertence à partícula PRS.
Os RNA nucleares pequenos ou RNAnp (em inglês, small nuclear RNA) que fazem parte de
certas ribonucleoproteínas chamadas RNPnp. Como veremos no Cap. 15-5, estas moléculas desempenham funções importantes durante o processamento dos RNAm.
Fig. 13.3 Fluxo de informações
genéticas.
_.------.....,.
Transcrição
Replicação
DNA - - - - - - . RNA
,,..____.......
Transdução
- ---------<..
Proteína
D
D
OS GENES
Os RNA nucleolares pequenos ou RNAnop (em inglês, small nucleolar RNA), que fazém parte
de certas ribonucleoproteínas chamadas RNPnop. Como veremos no Cap. 15-8, estas moléculas
intervêm no processamento dos RNAr.
ORNA de inativação do cromossomo X ou RNAxist (em inglês , X-inactivation specific
transcript RNA), cujas funções são descritas no Cap. 14-12.
ORNA da telomerase ou RNAte (em inglês, telomerase RNA), que faz parte de um complexo
ribonucleoprotéico cujas funções serão analisadas no Cap. 17-9.
Os microRNA (em inglês, microRNA ou miRNA ), cujas prováveis funções são analisadas no
Cap. 23-44.
13-3. Os transcritos primários são processados no núcleo
As moléculas de RNA surgidas da transcrição do DNA são chamadas de transcritos primários.Convertem-se em RNA funcionais antes de sair do núcleo, ao fim de várias modificações que
serão analisadas no Cap. 15, conhecidas pelo nome de processamento do RNA.
O processamento mais conhecido é o dos transcritos primários dos _RNArn, que contêm segmentos não funcionais intercalados com segmentos que contêm a informação genética que codifica a proteína. Os primeiros são denominados íntrons, os segundos éxons (Fig. 15.1).
O processamento remove os íntrons e conecta os éxons entre si, dando lugar a um RNArn com
informações genéticas contínuas, apto para dirigir a síntese da proteína.
13-4. Cada aminoácido é codificado por uma trinca de nucleotídeos
Devi.do ao fato de um gene ser um segmento de DNA que contém a informação necessária para
gerar um RNA ou uma proteína, dizemos que ele codifica essas duas moléculas. O termo "codifica" é empregado porque as instruções que se trasladam do DNA para o RNA e-no caso do RNArn
- deste à proteína são transmitidas sob a forma de código.
As características químicas das moléculas que representam os processos genéticos foram analisadas no Cap. 2. Recordemos que tanto os ácidos nucléicos (DNA, RNA) como as proteínas são
moléculas formadas por seqüências de monômeros (nucleotídeos nos ácidos nucléicos e aminoácidos nas proteínas) dispostos em linha.
O sistema de códigos se baseia na disposição ordenada dos nucleotídeos no DNA, os quais
determinam o ordenamento dos nucleotídeos no RNA. Por sua vez, os nucleotídeos do RNAm
determinam o ordenamento dos aminoácidos na proteína (Fig. 13.2).
Como no processo das info1mações genéticas, cada nucleotídeo é representado por uma letra
(A, G, C ou T no DNA; A, G, C ou Uno RNA) o alfabeto contido nas moléculas de DNA ou de
RNA - por ter quatro letras somente - não é suficiente para simbolizar os 20 tipos de aminoácidos que podem ser encontrados numa proteína.
As células resolvem o problema utilizando grupos de três nucleotídeos - em diferentes combinações - para codificar cada aminoácido. Estas trincas de nucleotídeos são denominadas códons. Tendo em vista que há quatro tipos de nucleotídeos, o número de t1incas possível, ou seja,
de códons, é de 64 (4 3 = 64). O conj unto de 64 códons leva o nome de código genético (Fig.
13.4).
13-5. Existem 61 códons para codificar os 20 tipos de
aminoácidos
Como se utilizam 61 dos 64 códons para codificar os 20 tipos de aminoácidos, a maior parte
deles pode ser codificada por mais de um códon, condição que levou a se dizer que existe uma
"degeneração" no código genético. Os códons que codificam o mesmo aminoácido chamam-se
"sinônimos". Somente a metionina e o triptofano, que são os aminoácidos menos comuns das
proteínas, são especificados por um único códon. Os três códons que não codificam aminoácidos
(UAA, UGA e UAG) têm como função - uma vez que a cadeia polipeptídica incorporou o último aminoácido - sinalizar a conclusão da síntese da molécula protéica; eles recebem o nome de
códons de terminação (Fig. 13.4).
•
211
212
•
OS GENES
Fig. 13.4 Código genético. O
códon AUG marca o começo da
síntese protéica (códon de
iniciação) e codifica as
metioninas restantes da proteína.
Segunda base
Primeira
base
u
e
A
G
u
uuu
uuc
UU A
UU G
cuu
cuc
e
Phe
Phe
Leu
Leu
ucu
ucc
UCA
UCG
Terceira
base
G
A
UAU
UAC
UAA
UAG
Tyr
Tyr
Term.
Term.
UGU
UGC
UGA
UGG
Cys
Cys
Term.
Trp
His
His
Arg
Arg
e
Arg
Arg
A
G
u
e
Le u
Le u
Leu
Leu
ccu
ccc
Pro
Pro
Pro
Pro
CA U
CAC
CAA
CAG
Gln
Gln
CGU
CGC
CGA
CGG
ll e
ll e
--
Met
AC U Thr
ACC Thr
ACA Thr
ACG Th r
AA U
AAC
AAA
AAG
Asn
Asn
Lys
Lys
AG U
AGC
AGA
AGG
Ser
Ser
Arg
Arg
GU U
GUC
GUA
GUG
Vai
Vai
Vai
Vai
GC U
GCC
GCA
GCG
Ala
Ala
Ala
Ala
GAU
GAC
GAA
GAG
Asp
Asp
GGU
GGC
GGA
GGG
Gly
Gly
Gly
Gly
CUA
CUG
AU U
AUC
AUA
AUG
ll e
CCA
CCG
u
Ser
Ser
Ser
Se r
Glu
Glu
e
A
G
u
A
G
u
e
A
G
As instruções do código genético emanadas do DNA constam, basicamente, de uma série de
trincas de nucleotídeos, cuja seqüência determina o alinhamento dos códons no RNA, que são os
que especificam o ordenamento dos aminoácidos na proteína.
Uma vez que a maior parte dos transcritos primários conta com seqüências de nucleotídeos
supérfluos que são suprimidos, estes - e por extensão os do DNA - não são representados no
RNA processado nem na molécula protéica.
Excetuando os segmentos supérfluos, de tudo o que foi mencionado até aqui, deduzimos que,
em cada série DNA----7 RNA---? proteína, as unidades que integram estas moléculas - códons no
DNA e no RNA, e aminoácidos na proteína - são colineares, já que os códons do DNA se correspondem com os do RNA e estes com os aminoácidos da proteína.
13- 6. O gene tem várias partes funcionais
Até agora, ao falar do gene, referimo-nos exclusivamente a seu segmento codificador. Contudo, o gene conta com outros componentes alheios a este segmento e que são:
1) O promotor, que inicia a transcrição e assinala a partir de qual nucleotídeo o gene deve ser
transcrito e que pode estar localizado próximo da extremidade 5' do segmento codificador, onde
começa a síntese do RNA.
2) Seqüências reguladoras, que determinam quando o gene deve ser transcrito e quantas vezes deve fazê-lo. Na maioria dos genes , estes segmentos estão localizados longe do codificador.
Existem dois tipos de reguladores , os amplificadores e os inibidores. Os primeiros são mais numerosos e por isso os mais estudados .
Cada gene tem uma combinação particular de vários amplificadores e vários inibidores. Algumas seqüências amplificadoras e inibidoras se repetem em genes diferentes, porém nunca os genes distintos têm uma mesma combinação destas seqüências reguladoras. Foi comprovado que
quando se elimina uma seqüência amplificadora de um gene, a velocidade de transcrição dimimü.
Em contrapartida, quando se elimina uma seqüência inibidora, a velocidade aumenta.
3) Finalmente, nas proximidades da extremidade 3' do segmento codificador, o gene conta com
um segmento de DNA denominado seqüência de terminação - que não deve ser confundido
com o códon de terminação do RNAm - o que marca a conclusão da síntese de RNA.
Em seguida, analisaremos - separadamente - a composição dos genes que codificam os difere ntes tipos de RNA .
3-
<
e.
~--
OS GENES
•
213
COMPOSIÇÃO DOS GENES
13-7. Estrutura dos genes que codificam os RNA mensageiros
A Fig. 13.5 mostra os diversos componentes dos genes que codificam os RNAm.
O promotor pode contar com dois elementos. A combinação mais comum inclui as seqüências
chamadas TA TA e CAAT , situ adas perto do codificador. A caixa TA TA com os 25 nucleotídeos
posiciona-se "corrente acima" do primeiro nucleotídeo do codificador. A caixa CAAT se localiza
no mesmo lado, porém um pouco mais distante, a cerca de 75 nucleotídeos ou seja, a 50 nucleotídeos da seqüência T ATA.
A seqüência de nucleotídeos mais comuns que se encontram na caixa TATA é a TATAAAA,
embora, às vezes, dois T substituam os A nas quinta e sétima posições. A seqüência da caixa CAAT
pode ser GGCCAA TCT. Devemos lembrar que muitos promotores contêm a seqüência TA TA,
porém não a seqüência CAAT. Às vezes estão ausentes as duas , caso no qual o promotor pode
representar seqüências com uma concentração não usualmente alta de citosinas e guaninas , chamadas regiões CG.
Os reguladores - amplificadores e inibidores - também podem ser encontrados "c01Tente
acima" com relação à extremidade 5 ' do segmento codificador, embora muito distante, freqüentemente a milhares de nucleotídeos. Diferentemente do promotor, nos reguladores a seqüência de
nucleotídeos - tanto em número quanto em qualidade - é específica, quer dizer, varia nos diferentes genes.
No segmento codificador alternam-se segmentos de DNA utilizáveis como segmentos não
funcionais. Como nos transcritos primários, são chamados éxons e íntrons , respectivamente (Se-·
ção 13-3j. A maioria dos ge~es que codificam o RNAm contém entre um e 60 íntrons e são muito
poucos os genes desprovidos deste tipo de seqüência.
A seqüência de terminação não pôde ser identificada ainda. No entanto, em um setor anterior
a ela, é comum a presença da seqüência AATAAA, que é necessária para a conclusão da síntese
do transcrito primário (Cap. 15-4).
A imensa maioria dos genes que codificam o RNAm é representada por cópias únicas (mais
exatamente por duas cópias, o que se deve a condição diplóide das células somáticas). Uma das
exceções corresponde aos genes que codificam as cinco histonas (Cap. 12-9). Os cinco genes são
encontrados no cromossomo, alinhados um atrás do outro, separados entre si por seqüências de
DNA que não se transcrevem e que se chamam espaçadores (Fig. 13.6). Neste jogo de cinco genes
existem entre 20 e 50 cópias dispostas erri fila, separadas entre si por novos DNA espaçadores.
V
13-8. Estrutura do gene que codifica o RNA ribossômico 45S
Os ribossomas são formados por duas subunidades, cada uma composta por RNA ribossômicos combinados com proteínas. Os RNAr são identificados tendo em conta seus tamanhos,
expressos como coeficientes de segmentação (Cap. 16-9). Desta forma, existem quatro tipos de
RNAr, chamados 28S, 18S, 5,8S e SS (Fig. 15.9). Os três primeiros derivam-se de um transcrito
primário comum denominado RNAr 45S (Fig. 15.9). Existem, portanto, dois genes codificadores
de RNAr, o correspondente ao RNAr 45S (Fig. 13.7) e o que codifica o RNAr SS. Aqui nos ocuparemos do primeiro.
A célula tem cerca de 200 cópias do gene do RNAr 45S. Estão localizadas nas constrições secundárias dos cromossomos 13, 14, 15, 21e22, que se situam no nucléolo. Em média, cada constrição secundária conta com cerca de 20 cópias do gene. Como observamos na Fig. 13.7, as 20
cópias do gene estão alinhadas em fila, separadas entre si por segmentos de DNA espaçadores
que não se transcrevem. Em cada um desses espaçadores estão localizados o regulador e a maior
parte do promotor. Vejamos os elementos encontrados em cada cópia do gene (Fig. 13.8) :
CAAT
TATA
Éxon 1
intron 1
GT
5'
-75
1
REGULADOR
"--.
- 25
/
PROMOTOR
+1
AG
Íntron 2
Éxon 2
-----
GT
Éxon 3
AG
AATAAA
1 - - - - - - - - - CODIFICADOR - - - - - - - - - - !
3
Fig. 13.S Estrutura geral dos
genes que codificam os RNA
mensageiros, com seus diversos
componentes.
214
•
OS GENES
F ig. 13.6 Eletromicrografia de um segmento de D A parcialmente desnaturado que contém os cinco
genes das hi stonas. Estes genes estão separados por segmentos espaçadores ricos em A-T. A molécula foi
clonada em um plasmídio da Escherichia coli. (Cortesia de M . L. Birnstiel e R. Portman.)
18S
5,8$
28$
3'
5' -
5' -
Fig. 13.7 Sucessão de cópias do gene do RNAr 45S . Observar os espaçadores que são transcritos (barras
claras) e os que não são transcritos (linhas) .
5'
28$
REGULADOR PROMOTOR
SJ
3'
CODIFICADOR
Fig. 13.8 Estrutura geral do gene que codifica o RNA ribossômico 45S.
Igualmente aos genes dos RNAm , o promotor do gene do RNAr 45S encontra-se "corrente
acima" com relação à extremidade 5' do segmento codificador. Trata-se de uma seqüência em
torno de 70 nucleotídeos, 20 dos quais são também os 20 primeiros nucleotídeos do setor codificador. Portanto, lida na direção 5'~3' , a última parte do promotor é a parte inicial do segmento
codificador.
O regulador, que atua como amplificador, é uma seqüência de cerca de 100 nucleotídeos. Está
situado a uns 50 nucleotídeos "corrente acima" do promotor, isto é, a uns 100 nucleotídeos da
extremidade 5' do segmento codificador.
No segmento codificador, as seqüências de DNA correspondentes aos RNAr 18S, 5,8S e 28S
- nessa ordem - se acham separadas entre si por espaçadores. Estes, diferentemente dos espaçadores intercalados entre as cópias, transcrevem-se, de modo que aparecem no transcrito primário ou RNAr 45S (Fig. 15.9).
A seqüência de terminação , na extremidade 3' de cada cópia, aparece depois do setor que
codifica o RNAr 28S. Caracteriza-se por conter várias T seguidas.
•,
OS GENES
PROMOTOR
5'
TTTT
- - - -- -- -- - -- - - - 3'
1---- -- - CODIFICAOOR - - - ---1
REGULADOR
13- 9. Estrutura do gene que codifica o RNA ribossômico 55
Do gene do RNA SS existem - uma depois da outra - cerca de aproximadamente 2.000 cópias separadas por segmentos espaçadores de D A. Todas as cópias se localizam na extremidade distal do braço longo do cromossomo 1, de modo que não pertencem ao nucléolo.
Cada cópia do gene tem duas seqüências especiais de nucleotídeos que constituem o promotor, situadas no interior do segmento codificador, do qual também fazem parte (Fig. 13.9). Devido a isto, as duas seqüências do promotor são transcritas. Além disso, têm uma seqüência situada
"corrente acima" do codificador- quer dizer, no espaçador precedente - cuja função parece ser
reguladora.
A seqüência de terminação na extremidade 3' de cada cópia apresenta vários T contíguos, como
no gene do RNAr 45S.
13-1 O. Estrutura dos genes que codificam os RNA de transferência
Existem entre 1Oe 100 cópias de cada um dos genes que codificam os diferentes RNAt, alguns
dos quais se acham alinhados em fila - cópia depois de cópia - como os genes do RNAr SS .
O promotor destes genes é constituído por duas seqüências de nucleotídeos separadas, ambas
no interior do segmento codificador, do qual também fazem parte (Fig. 13 .10). Assim, tais seqüências , além de.cumprir a função de promotor, se transcrevem.
Alguns genes dos RNAt apresentam um íntron de 4 a 15 nucleotídeos em meio ao segmento
codificador e, por conseguinte, dois éxons. Não foram descritas seqüências reguladoras.
A seqüência de terminação é semelhante à das cópias dos genes dos RNAr 45S e SS .
13-11. Estrutura dos genes que codificam os RNA pequenos
nre
em
ifiato
Existem múltiplas cópias do gene do RNAcp, dispersas nos cromossomos. Cada cópia teria seu
próprio promotor, aparentemente em meio ao segmento codificador. Como vimos no Cap. 12-7, o
gene do RNAcp tem uma extensa homologia com o DNA repetitivo disperso da família Alu.
A maioria dos RNAnp deriva-se de genes independentes que têm um promotor composto por
três seqüências separadas situadas "corrente acima" com relação ao segmento codificador (Fig.
13 .11 ). A seqüência mais próxima do segmento codificador é uma caixa TA TA, e as outras duas
são identificadas com as siglas PSE (do inglês, proximal sequence elements) e OCT (do inglês,
octamer sequence).
Os demais RNAnp e todos os RNAnop não se derivam de genes convencionais e sim das informações contidas em alguns íntrons de genes de várias proteínas ribossômicas (o que desmente
a qualificação de "DNA não funcional" que se aplica a todos os íntrons). Como é óbvio, estes
. - - - --
5'
; tá
da
·(
1
i - - - -- - -
ROMOTOR \ _
____
S2)
...;i;TT.
3'
CODIFICADOR _
_ _ ___,
Fig. 13.10 Estrutura geral dos genes que codificam os RNA de transferência.
-s
;pamá-
que
PROMOTOR
5'
/
1
OCT
PSE
\
TATA
--------3'
I+- CODI FICADOR--+!
Fig. 13.11 Estrutura geral dos genes que codificam os RNA nucleares pequenos.
•
Fig. 13.9 Estrutura geral do
gene que codifica o RNA
ribossômico SS.
215
216
•
OS GENES
íntrons são segmentos de D A sem promotor nem reguladores e são transcritos quando o gene ao
qual pertencem o faz .
13-12. Estrutura dos genes que codificam o RNAxist, o RNAte e os
microRNA
:o
gene que codifica o RNAxist é de tamanho relativamente grande e se localiza no braço longo do cromossomo X , em uma região próxima do centrômero chamado Xic (do inglês , Xinactivation center) . Verificou-se que contém numerosas seqüências repetidas expostas em fila,
com pelo menos 8 éxons, e que apresenta outras características que o assemelham aos genes dos
RNAm.
Com respeito ao gene que codifica o RNAte , localiza-se no braço longo do cromossomo 3.
Apenas é conhecido o seu segmento codificador, com cerca de 450 nucleotídeos.
Finalmente, os genes dos microRNA têm um segmento codificador, de apro ximadamente 70
nucleotídeos que inclui um par de repetições invertidas (Cap. l 7 -24)~ Com o veremos no Cap. 1513 , estas determinam a fo rma da forquilha que os transcritos primários adquirem ao final da transcrição. Calcula-se que existam cerca de 200 genes que codificam um número bem menor de diferentes tipos de niicroRNA - até esta data foram identificados 20 tipos diferentes de microRNA,
porém esse número cresce à medida que aumentam as investigações - o que indica que para cada
tipo de microRNA existem várias cópias iguais de um mesmo gene]
BIBLIOGRAFIA
Adhya S. (1989) Multi parti te genetic control elemen ts: communication
gene Jocated in euchromatin is acti ve in transcription and nucleolus
formation . Genes Dev . 2:1745 .
by DNA looping. Annu . Rev. Genet. 23:227.
Allison D ., Goh S.H. and Hall B.D. (1 983) The promoter sequence of a Kerppola T.K. and Kane C.M. (199 1) RNA polymerase : regulation of
transcript elongation and termination . FASEE J. 5:2833.
yeast tRNA-tyr gene. Cell 34:655.
Lagos-Quintana M. et al. (2001 ) Identification of novel genes coding
Benzer S. (1962) The fine structure of the gene. Sei. Am. 206 ( 1):70.
Brown C.J. et ai. (199 1) Local ization of the inactivation centre on the · fo r small expressed RNAs . Science 294:853 .
Lewin B. (1990) Genes, 4th Ed. Wiley, New York.
human X chromosome in Xq13. Natu re 349:82.
Brown C.J. et ai. (1992Whe human XIST gene: analysis of a 17 kb Long E.O. and Dawid I.B. (1980) Repeated genes in eukaryotes. Annu-:.
Rev. Biachem. 49:727.
inactive X-specific RNA that contains conserved repeats and is highly
Miller O.L. (1981 ) The nucleolus, chromosomes, and visualization of
localized within the nucleus. Cell 71 :527.
genetic activity. J. Cell Biol. 91 :15s.
Brown D.D . (1984) The role of stable transcription complexes that
Mitchell P.J. and Tijan R. (1989) Transcriptional reg ulat ion in
repress and activate eukaryotic genes. Cell 37 :359.
Brown D.D. and Gurdon J.B. (1978) Cloned single repeating units of ·
mammalian cells by sequence-specific DNA binding proteins. Sci5S DNA direct acc urate transcription of 5S RNA when injected into
ence 245:VJ.
Nevins J.R. (1983) The pathway of eukaryotic mRNA formation. Annu.
Xenopu s oocytes. Proc. Natl. Acad. Se i. USA 75:2849.
Rev . Biachem. 52:441.
Bucher P. and Trifono v E. N. ( 1986) Compi lation and analysis of
eukaryotic Pol II promoter sequences. Nucleic Acids Res. 14: 10009. Reddy R. and Busch H . ( 1981 ) U snRNA ' s ofnuclear snRNP ' s. ln: The
Cell Nucleus. Academic Press, New York.
Crick F.H.C. (1968) The origin of the genetic code. J. Molec. Biol.
Reeder R.H. (1984) Enhancers and ribosomal gene spacers. Cell 38: 349.
38:367.
Sakonju S. , Bogenhagen D.F. and Brown D.D. (1 980) A control region
Crick F. (1979) Split genes and RNA spliçing. Science 204:264.
in the center of th e 5S RNA gene directs spec ific initiati o n of
Dreyfuss G., Philipson L. and Mattaj I.W. (1988) Ribo nucleoprotein
transcription. I: The 5' border of the region. Cell 19: 13.
particles in cellular processes . J. Cell Biol. 106: 1419.
Dynam W.S. (1986) Promoter~ for housekeeping genes. Trends Genet. Serfling E .M., Jasin M. and Schaffner W. (1985) E nh ancers and
eukaryotic gene transcription . Trends Genet. 1:224.
2:196.
Tems M.P. and Dahlberg J.E. (1994) Retention and 5' cap trimethylation
Federoff N. (1979) On spacers. Cell 16:697.
Galli G., Hoefstetter H. and Bimstiel M .L. (1981) Two conserved seof U3 snRNA in the nucleus. Science 264: 959.
quence blocks within eukaryotic tRNA genes are major promoter Thompson C.C. and McKnight S.L. (1992) Anatomy of an enhancer.
Trends Genet. 8:232.
elements. Nature 294:626.
Gilbert W. (1976) Starting and stopping sequences for the RNA poly- Tollervey D . (1996) Small nucleo lar RNAs guide ri bosomal RNA
methylation. Science 273: 1056.
merase. ln: RNA Polymerase. Cold Spring Harbor Laboratory, New
Verrijzer C.P. and Tjian R. (1996) TAFs mediate tra nsc riptional
York.
acti vation and promoter selectivity. TIBS 2 1:338.
Guthrie C. and Patterson B. (1988) Spli ceosomal snRNAs . Ann u. Rev.
Wellaurer P.K . and Daw id I.B. (1979) Isolati on and sequence
Genet. 22:387 .
Hentschel C.C. and Birnstie l M.L. (1981 ) The organization and expresorganization of human ribosomal DNA . J. Mol. Biol. 128:289.
Worton R.G. et al. (1988) Human ribosomal RNA genes: orientation of
sion of histone gene families. Cell 25 :301.
the tandem array and conservation of the 5' end. Science 239: 64.
Horikoshi M., Hai T., Lin Y.S ., Green M.R. and Roeder R.G. (1988)
Transcription fac tor ATF interacts with the TATA factor to fac ilitate Yanofsky C. (1967 ) Gene structure and protein structure. Sei. Am.
216:80.
establishment of a preini tiation complex. Cell 54: 1033.
Karpen G.H., Schaefer J.E. and Laird C.D . (1988) A D1:osophi/a rRNA
A transcrição do DNA
14-1. Definição
Recebe o nome de transcrição a síntese de moléculas de RNA a partir de moléculas de DNA
como modelo. A síntese ocorre pela união entre si dos nucleotídeos A, U, C e G, que
se alinham seguindo a ordem marcada pelos nucleotídeos complementares do DNA. Essa complementaridade determina que as bases A, U, C e G do RNA se pareiem, respectivamente, com as
bases T, A, G e C do DNA. Como veremos , o emparelhamento é obtido pelo estabelecimento de
ligações transitórias (não covalentes) das bases do DNA com as bases do RNA em formação, o
que permite que ocorram as verdadeiras reações de síntese, ou seja, a ligação dos nucleotídeos do
RNA entre si.
A ligação entre dois nucleotídeos consecutivos corresponde a uma ligação fosfodiéster (Fig.
14.1). Visto que nela um grupo fosfato liga o C5 ' da ribose de um nucleotídeo ao C3' da ribose do
nucleotídeo contíguo, a molécula de RNA sempre acaba polarizada, com um fosfato na sua extremidade 5' e uma hidroxila na sua extremidade 3' . As ligações fosfodiés ter não ocorrem espontaneamente; são dirigidas e catalisadas por enzimas específicas chamadas RNA polimerases.
gu~
f -
14-2. A molécula de RNA é sintetizada pela agregação de
um nucleotídeo de cada vez
r
r
Teoricamente, uma molécula de RNA poderia ser construída a partir de um modelo de DNA e
de ribonucleotídeos livres seguindo estas cinco etapas. Primeiro, as duas cadeias de DNA se separariam em toda a sua extensão. Segundo, os 4 ribonucleotídeos se emparelhariam com os desoxirribonucleotídeos complementares do DNA, todos simultaneamente. Terceiro, cada ribonucleotídeo se uniria com seus dois vizinhos. Quarto, os ribonucleotídeos se separariam dos desoxirribonucleotídeos do DNA e a molécula de RNA seria liberada. Quinto, as duas cadeias do DNA voltariam a se unir. Visto que nesta hipótese as duas cadeias do DNA estariam por igual, ambas poderiam ser transcritas .
Na célula, o RNA é construído de outra maneira. Em primeiro lugar; porque é copiada apenas
uma das duas cadeias de DNA, a que corre na direção 3' -7 5'. Isto permite antecipar que o RNA
é sintetizado a partir de sua extremidade 5' e progride para a sua extremidade 3' (Fig. 14.1). Em
segundo lugar, porque os ribonucleotídeos se agregam um de cada vez, o que torna desnecessária
a separação das duas cadeias de DNA em toda a sua extensão. Somente se separa um segmento de
cerca de 10 pares de nucleotídeos, o qual, como mostra a Fig. 14.2, forma no DNA uma bolha de
transcrição que se desloca à medida que os seus nucleôtídeos são "lidos".
Embora se transcreva a cadeia 3' -7 5' do gene, convencionalmente se diz que a transcrição
avança na direção 5' -7 3' porque o RNA sintetizado se corresponde - em sua polaridade e na
seqüência de seus nucleotídeos (substituindo o U pelo T)- com a cadeia não transcrita do DNA.
Além disso, a seqüência do gene se define por sua cadeia 5' -7 3' (Fig. 14.2).
14-3. Uma RNA polimerase une os nucleotídeos entre si
Os monômeros com os quais são construídas as moléculas de RNA se apresentam no nucleoplasma como ribonucleosídeos tiifosf~to (ATP, UTP, CTP e GTP) (Fig. 14.1). O começo da trans-
14
218
•
A TRANSCRIÇÃO DO DNA
Fig. 14.1 Ligação fosfodiéster
entre os nucleotídeos do RNA
durante a transcrição de DNA.
-
3'
5'
D
N
N
R
A
A
1
O =P- 0 -
1
Ti mina
1
o
1
--e,-,---,,-~
Adernna~ o~ H,
IHYH
HO
.
\
o
1
u
+
O =P-O-
1
1'
o-
o
Guanina
···I
1
o
n
HO - P-O - P-0-
Citosina~o~ H,
1
o-
ti---?H
1 HO
OH
3' .
-o
o
,
n
o
o .
li
o
n
P - O-P-0-P-O<" j
1
1
o o
o0 -
Adenina 1
... 1
uraci'ªlQ'
CH,
H H
H H
1 HO
OH
3·
-o,
Citosina
tt
P-O-P - 0-P - O<"j
1
1
!
o o
o-
o-
Guanina n lCH,
~-.-
H H
j
~
5'
HO
H H
OH
3
crição ocorre quando, por meio de sua base, um desses. ribonucleosídeos estabelece uma ligação
transitória com a base complementar do primeiro nucleotídeo do gene. Neste processo intervém o
promotor do gene, depois de ser ativado por fatores que mencionaremos mais adiante.
O promotor se une à RNA polimerase e faz com que esta interaja com o DNA no local em que
deve ser iniciada a transcrição (a extremidade 5' do segmento codificador do gene), o qual é marcado pelo próprio promotor. Ali, a RNA polimerase forma uma "bolha'', pois determina a separação localizada das duas cadeias de DNA e deixa exposto - junto com outros poucos - o primeiro desoxirribonucleotídeo que vai ser lido (Fig. 14.2).
Em seguida, à frente deste desoxirribonucleotídeo se acomoda um ribonucleosídeo trifosfato
complementar__:_ será o primeiro nucleotídeo da molécula de RNA - e sua base estabelece uma
ligação não covalente com a base do desoxirribonucleotídeo (Fig. 14.2). Em seguida, aproximase um segundo ribonucleosídeo trifosfato - complementar do segundo desoxirribonucleotídeo
exposto no DNA - e suas bases se ligam. Porém, o mais importante é que os dois ribonucleotídeos que concorreram para a bolha ficam juntos, o que permite que entre eles ocorra - mediante
a RNA polimerase - uma ligação fosfodiéster e que seja gerado um dinucleotídeo (Figs. 14.1 e
14.2), com o qual se inicia a síntese do RNA que prossegue na direção 5'--? 3' à medida que se
aproximam - e se unem entre si - os ribonucleosídeos trifosfato indicados pelo DNA.
O alongamento progressivo do RNA é conduzido pela mesma RNA polimerase. Esta, além de
catalisar as ligações fosfodiéster, desliza sobre o DNA na direção 5'--? 3' e faz avançar a bolha.
Isto é obtido pela separação dos nucleotídeos no lado frontal da bolha, enquanto os da retaguarda
voltam a se unir (Fig. 14.2), o que é possível porque, ali, o DNA se desliga dos ribonucleotídeos.
A TRANSCRIÇÃO DO DNA
5'
3' -
Ge A e T e A G A T G e
c,- ..
A__..G_,.....,........,....,......,.."""'""'""
G Te TA e G GA T
-~--~~'~'-~G:~C
CG
A.
c
T
c
A_ G A T G
e e TA
A
•
219
Fig. 14.2 Síntese de RNA.
Podemos observar a RNA
polirnerase (em vermelho) e urna
"bolha" de DNA que se desloca
porque suas cadeias se separam
em urna extremidade à medida
que se juntam na outra.
G
'7
ç UCAG A
A
AG T CTACGGA T TC
A C
v C AGA AG.
G T CTACGGATTC
e I e A G A T G e e TA A G T ct
-'-"c
~ ·~~
·~~-~-~ ~~~~~~,_,G
CU
e A G A U G Ç G._..,__,.,,__,_ n..
TCTACGGAJTCA
':)A
/1
Todavia, o RNA - cada vez mais longo - segue unido à cadeia modelo de DNA por meio dos
últimos ribonucleotídeos incorporados.
A transcrição é concluída quando a RNA polimerase alcança a seqüência de terminação na
extremidade 3' do gene. Neste ponto, a enzima é liberada. Também o faz RNA, que adquire o
nome de transcrito primário.
Na extremidade 5 ', o primeiro nucleotídeo do RNA retém os três fosfatos, enquanto na extremidade 3', o último nucleotídeo apresenta um grupo OH livre (Fig. 14.1 ). _
No Cap. 17-11 analisaremos como a enzima topoisomerase 1 desenrola o DNA durante a transcrição.
o
14-4. A célula pússui três tipos de RNA polirnerases
Existem três tipos de RNA polimerase - chamadas I, II e III - responsáveis pela síntese dos
diferentes tipos de RNA. A RNA polimerase II sintetiza os RNAm e a maioria dos RNAnp; a
RNA polimerase 1, o RNAr 45S; a RNA polimerase III, o RNAr SS , os RNAt, o RNAcp e alguns RNAnp.
Estas polimerases respondem de maneira distinta ao efeito de um veneno produzido pelo fungo Amanita phalloides, denominado a-amanitina. Desta forma, a RNA polimerase II é muito ·
sensível ao veneno, a RNA polimerase III é medianalnente sensível e a RNA polirnerase I é insensível.
TRANSCRIÇÃO DOS GENES DOS RNA MENSAGEIROS
14-5. Os genes que codificam os RNAm são ativados por fatores de
transcrição
A síntese de um determinado RNAm ocorre quando o gene respectivo, melhor dizendo, suas
seqüências reguladoras e o promotor são ativados por proteínas especiais chamadas fatores de
transcrição, os quais se classificam em específicos e basais.
220
•
A TRANSCRIÇÃO DO D1 A
Os fatores de transcrição específicos interagem com o regulador do gene (Fig. 14.3) e, segundo
o façam com seqüências amplificadoras ou inibidoras do regulador (Cap. 13-7) dividem-se em ativadores e repressores. As funções destes fatores de transcrição são analisadas na Seção 14-7.
Os fatores de transcrição basais são necessários para o promotor, pois se unem à seqüência
TA TA para começar a síntese do RNAm (na Seção 14-7 veremos que antes o regulador deve ser
ativado). Devido a sua natureza inespecífica, os fatores basais são mais conhecidos que os específicos. Existem vários - denominados TFIID, TFIIA, TFIIB, TFIIF, TFIIE, TFIIH etc. - os
quais atuam seqüencialmente na ordem em que foram escritos. O TFIID é composto por várias
subunidades, uma chamada TBP (do inglês, TATA.binding protein) e as outras, TAF (do inglês,
TBP-associated factor ).
O processo se inicia quando o TFIID se une ao promotor por meio da TBP. Esta união altera a
estrutura da cromatina no promotor que abandona sua forma retilínea e se dobra até formar o ângulo de cerca de 100°. A mudança atrai tanto os fatores de transcrição basais restantes como a
RNA polimerase II, com a qual esses fatores se uniram previamente.
Uma vez unida ao promotor, a RNA polimerase II é fosforilada pelo TFIIH que contém uma
cinase. Um ATP doa um fósforo, depois de ser hidrolisado pelo TFIIB. Em seguida, a RNA polimerase II fosforilada desprende-se dos fatores de transcrição e abre a dupla hélice do DNA no
setor do gene contíguo ao promotor - forma-se a bolha de transcrição ~ com o que se inicia a
síntese de RNAm.
Para alongar o RNAm, a RNA polimerase II necessita de dois fatores adicionais, os fatores de
alongamento Sll (ou TFIIS) e SIII (ou alonguina). O fator SII é uma proteína monomérica de .
38 kDa. O fator SIII é um heterotrímero composto pelas alonguinas A, B e C, de 11 OkDa, 18 kDa
e 15 kDa, respectivamente.
Estima-se que durante a fase de alongamento a RNA polimerase II agrega à molécula de RNA
cerca de 50 nucleotídeos por segundo.
Como assinalado, nos genes que codificam RNAm ainda não foi identificada a seqüência de
nucleotídeos responsável pelo término da transcrição (Cap. 13-7).
O conjunto de transcritos primários dos RNAm é conhecido como RNA heterogêneo nuclear
ou RNAhn. Estes transcritos não se encontram livres no nucleoplasma e sim combinados com
diversas proteínas básicas que se unem aos RNAm à medida que se sintetizam. O conjunto de
transcritos primários e proteínas associadas leva o nome de ribonucleoproteína heterogên,ea
nuclear ou RNPhn. Considera-se que as proteínas atuam como chaperonas que mantêm os RNAm
desdobrados. Isto evita que sejam formados - em uma mesma molécula - emparelhamentos
entre seqüências de nucleotídeos complementares.
REGULAÇÃO DA ATIVIDADE DE GENES QUE CODIFICAM RNA MENSAGEIROS
14- 6. Os mecanismos mais importantes para controlar a atividade dos
genes ocorrem ao nível da transcrição
Sabendo-se que, nos organismos pluricelulares, todas as células possuem o mesmo genoma,
surgiu a necessidade de responder à seguinte pergunta: por que um gene é selecionado para sua
transcrição em um tipo celular e em outros não? A resposta apresenta várias facetas , cujos conteúdos se desenvolvem em lugares diferentes deste livro. Assim, no Cap. 11 analisamos como as células
respondem ao ser influenciadas por outras; e já nas seções seguintes deste capítulo são descritos
os mecanismos moleculares que levam à diferenciação celular. Finalmente, nos Caps. 15, 16 e 21
serão agregados dados complementares sobre o assunto.
Os mecanismos celulares que determinam qual proteína deve ser sintetizada - e em qual quantidade - operam em vários níveis, apesar de os mais importantes serem os que controlam a atividade transcricional dos genes. Todavia, podem produzir-se regulações depois de o RNA ser sintetizado, durante o processamento do transcrito primário, e inclusive, mais tarde, mediante o controle da
exportação de RNAm ao citoplasma ou de sua sobrevida no citosol (Fig. 13.1). Finalmente, em alguns casos, as regulações ocorrem durante a tradução dos RNAm em proteínas ou pela degradação
das segundas. O controle da atividade transcricional do gene será analisado nas seções seguintes deste
capítulo e as regulações pós-transcricionais serão estudadas nos Caps. 15 e 16.
A TRA SCRIÇÃO DO DNA
Regulador
Promotor
Codificador
RNA polimerase li
§á
----111 8
Fig. 14.3 A. Fatores de transcrição específicos e basais unidos ao regulador e ao promotor do gene,
respectivamente. B. O DNA se dobra sobre si mesmo para que o regulador e o promotor interaja.m, o que
estimula a transcrição do setor codificador do gene pela RNA polimerase II.
É oportuno assinalar que o RNA de aproximadaménte a metade dos transcritos primários não
completa sua síntese. Ignora-se se isto é devido à existência de alterações nos processos de transcrição ou se ocorre em função de um mecanismo generalizado de regulação de atividade gênica
que opera abortando a transcrição antes que a polimerase II chegue ao sinal de terminação.
São conhecidos pouquíssimos casos de regulação gênica derivados da conclusão prematura da
transc1ição. Como veremos, os mecanismos prevalecentes operam no começo d~ síntese dos RNAm,
já que atuam sobre as seqüências reguladoras dos genes. Estas seqüências são influenciadas por
fatores ê!e transcrição específicos que ingressam no núcleo para ativar ou inibir os genes.
14-7. Os fatores de transcrição específicos desencadeiam ou
freiam a transcrição do DNA
Recordemos que a polimerase II po!· si mesma não pode iniciar a transcrição do segmento codificador do gene, pois tem de ser at~vada pelos fatores de transcrição basais unidos ao promotor.
Por sua vez, esta união depende da ativação prévia das seqüências reguladoras por fatores de transcrição específicos.
Como os fatores de transcrição basais são os mesmos para quase todos os genes, diz-se que são
constitutivos. Em contrapartida, os fatores de transcrição específicos, por serem particulares para
cada gene, são qualificados como facultativos.
Embora os fatores de transcrição específicos se contem aos milhares, são muito menos numerosos que as seqüências reguladoras que têm de controlar. Entretanto, conseguem a especificidade mediante a criação de múltiplas combinações entre eles, o que aumenta o número de possibilidades de forma extraordinária. Deste modo, cada tipo de célula elabora apenas uma seleção destes
fatores , nada mais que os imprescindíveis para criar as combinações capazes de regular seus próprios genes. Como cada gene pode ter vários amplificadores e vários inibidores, dois ou mais genes
distintos podem possuir alguns reguladores comuns, embora nunca a mesma combinação.
Uma vez que os fatores específicos foram unidos às seqüências reguladoras, como eles atuam
sobre o promotor? (Convém lembrar que ambas as partes do gene podem estar muito distanciadas.) Simplesmente, o gene se curva e f01ma uma forquilha , como mostra a Fig. 14.3. Observe-se
o modo como os fatores específicos unidos às seqüências reguladoras interagem com os fatores
basais situados no promotor. Isto é possível porque os fatores específicos contam com dois domínios, um que se conecta ao DNA regulador e outro que o faz com os fatores basais, mais precisamente com as subunidades TAF do fator TFIID.
Quando o complexo fica integrado, os fatores basais ativam a RNA polimerase II e esta inicia
a transcrição do gene. Por sua vez, os fatores específicos determinam o número de polimerases
que - uma depois da outra - farão o trabalho, o que regula a quantidade de RNAm a ser fabricado.
Nas Seções 14-20 a 14-26 são analisados mecanismos reguladores da atividade gênica nas
células procariontes.
•
221
222
•
A TRANSCRIÇÃO DO DNA
Fig. 14.4 Eletromicrografia que
mostra dois genes sendo
transcritos. 35.000 X . (Cortesia
de O. L. Miller e B. R. Beatty.)
1
~ · ..
· :f
~~-
14-8. A transcrição dos genes dos RNAm pode ser visualizada com a ajuda
do microscópio eletrônico
A microscopia eletrônica convencional não mostra como são transcritos os genes. No entanto,
quando se dispersa o conteúdo do núcleo sobre uma lâmina, são postos em evidência detalhes
reveladores. Assim, se um gene se transcrever a um ritmo acelerado - quer dizer, associar-se
simultaneamente com várias RNA polimerases II - pode ser visto junto com muitas cadeias de
RNAm que surgem perpendicularmente de sua molécula.
O conjunto se assemelha a uma árvore de natal, cujo tronco con-esponde ao gene e os ramos
aos RNAm (Fig. 14.4). O alongamento dos ramos -que são mais longos à medida que se distanciam da ponta da árvore - indica a direção da transcrição. No ponto em que cada ramo se une ao
tronco localiza-se uma RNA polimerase II (pode ser visualizada nas eletromicrografias) e, portanto , forma-se uma "bolha". Se pudéssemos realizar um filme, veríamos as bolhas deslocando-se
da ponta da árvore para o "solo", cada uma com seu RNAm que se desprende do tronco quando
alcança seu comprimento máximo.
Os genes que produzem RNAm a uma velocidade tão alta não são muitos, pois a maioria é
transcrita a um ritmo relativamente moderado. Os mais lentos iniciam uma nova transcrição depois de concluir a anterior. Nestes casos, o gene seria visto como um tronco com um só ramo o RNAm - cujo comprimento e posição no tronco dependeriam do instante em que se fizesse a
fotomicrografia.
14-9. São conhecidas as bases moleculares da interação dos fatores de
transcrição com o DNA das regiões reguladoras e promotora do gene
Os fatores de transcrição e o DNA dos reguladores e do promotor contêm em suas moléculas
informações suficientes para se unirem entre si de forma específica. Os fatores de transcrição es-
A TRA SCRIÇÃO DO DNA
tabelecem contato com o D A através de grupos químicos complementares, de um lado fornecidos pelos aminoácidos e do outro pelas bases dos nucleotídeos. Dessa forma, a especificidade da
união depende da complementaridade estrutural entre as partes interatuantes.
Originariamente, acreditava-se que os fatores de transcrição abriam a dupla hélice do DNA e
reconheciam os grupos qufrnicos participantes da formação das pontes de hidrogênio entre as bases
dos nucleotídeos. Isto foi descartado , apesar de ter sido confirmado que os fatores de transcrição
reconhecem o DNA dos promotores e dos reguladores por suas bases e nelas identificam grupos
químicos localizados na parte exterior da dupla hélice ao nível dos sulcos maior e menor. esse
local, sem necessidade de romper as pontes de hidrogênio , os aminoácidos dos fatores de transcrição interagem com as bases e se unem a elas.
14-1 O. Os fatores de transcrição se associam aos reguladores e ao promotor
do gene através de átomos expostos nos sulcos do DNA
••
Visto do sulco maior do DNA (Fig. 2.4), cada par de nucleotídeos - nas quatro combinações
possíveis (A-T, T-A, G-C e C-G) - mostra um átomo de oxigênio, um de hidrogênio e um de
nitrogênio (Fig. 14.5), que são capazes de estabelecer ligações não covalentes (como pontes de
hidrogênio) com átomos dos aminoácidos dos fatores de transcrição. Em cada par de bases, esses
três átomos se apresentam combinados de maneira diferente. Por exemplo, o par A-T mostra a
combinação N-H-0, e o par T-A, a combinação 0-H-N; como vemos, uma é a imagem invertida
(no espelho) da outra. Algo semelhante ocorre com os pares G-C e C-G, nos quais os átomos formam as combinações N -0-H e H-0-N, respectivamente.
A iniormação cifrada no sulco menor do DNA (Fig. 2.4) é menos ampla que a do sulco maior,
talvez porque resulte estreita para a entrada de alguns aminoácidos.
Além destas associações específicas, entre os fatores de transcrição e o DNA, ocorrem ligações inespecíficas; em uma delas participa o esqueleto dos fosfatos do DNA e, apesar de não conferir especificidade à ligação, estabiliza-a.
Em geral, cada fator de u·anscrição faz cerca de 20 contatos c?m o DNA, o que significa que
aproximadamente 20 aminoácidos interagem com outros tantos pares de nucleotídeos, seja no
promotor ou no regulador do gene. Considerando-se que as combinações de pares de bases são
quatro (A-T, T-A, G-C, C-G), podem ocorrer aproximadamente 160.000 (20 4 ) possibilidades de
combinações teóricas, quantidade desproporcionalmente alta para o número de fatores de transcrição que existem na célula.
SULCO MAIOR
SU LCO MAIOR
H
t-
'
HYN
CH3
~~N·· ·H - 0-ÇH
l)
r-
N==<
H
íe
lo
,
}--N
O
(Õ. · · H_ /
:-{0_
N-{
J' A'\
N
)=N
H
-~
H
H.. · N(c)_H
N=<
r-N
N- H · ··O
/
H
SULCO MENOR
,_,~y'
- H...
SULCO MAIOR
H
N')
H
SULCO MENOR
SULCO MAIOR
H
+>:º
H
O
SULCO MENOR
é
ea
N-H ···º
' ,_, ~~y'
H~ ··· H-N ~
N-{
)=N
O.. · H-N
H
"
SULCO MENOR
Fig. 14.S Posições e combinações dos átomos de oxigênio, hidrogênio e nitrogênio que estão expostos no
sulco maior da moléc~ l a de DNA ao nível dos pares de bases A-T, T-A, G-C e C-G.
•
223
224
•
A TRANSCRIÇÃO DO DNA
14-11. Os fatores de transcrição contêm estruturas diméricas especiais
Analisadas as singularidades estruturais do DNA, vamos nos ocupar agora daquelas que caracterizam os fatores de transcrição. Em geral, as proteínas dos fatores de transcrição contêm estruturas diméricas simétricas que se encaixam nos sulcos da dupla hélice do DNA . Assim, os dímeros ocupam as voltas da dupla hélice com um monômero em cada volta. Nesse par de voltas, o
DNA também apresenta simetria, já que suas duas metades mostram seqüências de nucleotídeos
repetidas em palíndromo (termo tomado da lingüística que designa a palavra ou frase que se lê
igualmente da esquerda para a direita ou da direita para a esquerda). Cada metade do palíndromo
ocupa uma das voltas do DNA.
A dimerização dos fatores de transcrição e a simetria do DNA são condições necessárias para
que os aminoácidos dos primeiros possam interagir com as bases do regulador e do promotor.
Apesar de existirem milhares de fatores de transcrição diferentes, os setores diméricos de suas
moléculas formam estruturas secundárias e terciárias com desenhos comuns , o que permite
classificá-los em um número limitado de famílias. Cada fator de transcrição pode ter uma, duas
ou mais dessas estruturas, desenhadas para ingressar nos sulcos da dupla hélice ao nível do regulador e do promotor do gene.
A denominação das estruturas se baseia nas formas que têm, daí serem chamadas hélice-girohélice, dedos de zinco, cremalheira de leucina e hélice-anel-hélice.
Hélice-giro-hélice. Esta estrutura consiste em duas cadeias de aminoácidos com forma de hélice, separadas por uma "volta" ou cadeia mais curta (Fig. 14.6). Uma das hélices "lê" a seqüência
de nucleotídeos no setor regulador do gene - ao qual se une se o reconhecer - e a outra mantém
a hélice leitora na posição adequada. Obviamente, a seqüência de aminoácidos da hélice leitora
(chamada também hélice de reconhecimento) varia nos diferentes fatores de transcrição.
Quando uma hélice-giro-hélice é acompanhada por oun·a simétrica, entre ambas forma-se um
dímero. As respectivas hélices de reconhecimento se encaixam em outros sulcos do DNA que
correspondem aos dois lados do palíndromo.
Foram identificadas estruturas hélice-giro-hélice em diversos fatores de transcrição. Por exemplo, em alguns fatores envolvidos na formação do plano corporal durante o desenvolvimento
embrionário (Cap. 21 -22), nos fatores implicados na diferenciação das células musculares etc.
Cremal heira de leucina. Consiste em duas cadeias polipeptídicas dispostas em paralelo, ambas com forma de hélice. Cada cadeia possui dois setores, um que se une ao DNA e outro que o
faz com seu homólogo, com o qual se forma um dímero (Fig. 14.7). Os setores unidos entre si
apresentam , cada sete aminoácidos - que correspondem a duas voltas da hélice - uma leucina
que dá para o interior do dímero. Estas leucinas se encaixariam como os dentes do zíper, daí o
nome de cremalheira. Os setores não dimerizados possuem uma alta proporção de aminoácidos
básicos, que são os que geram a união específica de fatores de transcrição com o DNA.
Entre outros que têm cremalheiras de leucina estão os fatores de transcrição que regulam a atividade dos protooncogenes myc, fos e jun (Cap. 18-31).
Dedos de zinco. Cada domínio do fator de transcrição é composto por uma seqüência de alguns aminoácidos e um átomo de zinco, o qual se li ga tetraedricamente a quatro cisteínas ou a
F ig. 14.6 Estrutura com form a de hélicegiro-hélice.
Fig. 14.7 Estrutura com forma de cremalheira
de leucina.
A TRA SCRIÇÃO DO DNA
Fig. 14.8 Estrutura com form a de dedos de
zmco.
•
225
Fig. 14.9 Estrutura com forma de héliceanel-hélice.
duas cisteínas e duas histidinas (Fig. 14.8) . Esses domínios se projetam como dedos, cujo número
e seqüência de aminoácidos variam nos diferentes fatores de transcrição. Além disso, os dedos de
zinco se associam dois a dois para formar dímeros.
Os dedos de zinco são as estruturas mai s difundidas entre os fatores de transcrição. Encontramse, por exemplo, nos receptores citosólicos mencionados no Cap. 11-6. Estes ingressam no núcleo
e atuam como fatores de transcrição específicos quando se unem a eles as substâncias indutoras.
Outro exemplo conesponde ao TFIIIA, um dos fatores de transcrição do RNAr 5S (Seção 14-16).
Hélice-anel-hélice. Esta estrutura tem uma configuração dimérica muito parecida com acremalheir,il de leucina, pois conta com duas cadeias polipeptídicas com dois setores funcionais em
cada uma: o específico - reservado para a união do fa tor d.e transcrição com o DNA - e o responsável pela dimerização (Fig. 14.9). O primeiro é rico em aminoácidos básicos. Este desenho
se diferencia da cremalheira porque suas partes dirnerizadas não se encaixam.
tt
11
'
)
i
()
•1
14-12. O enrolamento da cromatina influencia a atividade do gene
li
No Cap. 12-10 foram descritas as diferenças entre a eucromatina e a heterocromatina. Embora
possa não ser absolutamente certo que a transcrição ocona somente na eucromatina, quase todos
os dados sugerem que durante a interfase o armazenamento altamente condensado da cromatina
- quer dizer, a heterocromatina- indica ausência de atividade transcricional no seu DNA. Isso
não implica que na eucromatina relativamente estendida ocorra automaticamente a transcrição , já
que nas células a maior parte dessa cromatina se acha inativa, pois são transcritos somente genes
que recebem a ordem de fazê-lo - via fatores de transcrição - como vimos na seção anterior.
Por outro lado, no Cap. 12-9 dissemos que alguns laços da fibra de cromatina de 30 nm poderiam constituir verdadeiras unidades de transcrição, de modo que cada gene englobaria o DNA
pertencente a um laço.
Além disso, neste capítulo, analisamos o papel que as histonas desempenham no enrolamento
da cromatina. Aqui veremos como regulam a transcrição dos genes, sem esquecer que esta função
exige que o DNA esteja relativamente desenrolado e livre de moléculas aderidas que possam criar
obstáculo ao contato da RNA polimerase com o segmento codificador do gene.
Embora se aceite que a cromatina de 10 nm seja a mais apta para a transcrição (Fig. 12.10), a
RNA polimerase não pode atuar se não se desenrolarem os segmentos de DNA dos nucleossomas,
pelo menos localmente e enquanto durar a transcrição.
li
Fig. 14.10 Metilação da citosina
(observar o grupo C3H na
metilcitosina).
a
Citosina
-------
--
---
Metil citosina
-
-
-
Ili
ill
..
'
li
1
226
•
A TRANSCRIÇÃO DO D A
Foi sugerido que os fatores de transcrição basais não somente ativam o promotor do gene, mas
também a "desorganização'· dos nucleossomas na parte inicial do segmento codificador, o que permite
a separação local das duas cadeias de D A para que a RNA polimerase possa começar a transcrição.
Parece então que os fatores de transcrição atuam direta ou indiretamente sobre as histonas H4, que
se modificam e desencadeiam a remoção das outras histonas, começando pela H2A e pela H2B .
Mais adiante, à medida que avança pelo segmento codificador do gene, a própria RNA polimerase seria a responsável por desenrolar o D A dos nucleossomas , os quais se "recompõem" conforme a enzima os deixa para trá .
Diversos dados revelam que o grau de enrolamento da cromatina é reg ulado pela agregação ou
remoção de grupos acetila, grupos metila e grupos fosfato nas "caudas" das histonas , que estão
expostas a estas mudanças porque se projetam para fora dos nucleossomas (Cap. 12-9).
Por exemplo, a acetilação de algumas lisinas das histonas H3 e H4 diminui o enrolamento da
cromatina, o que favorece o acesso dos fatores de transcrição basais ao promotor do gene, com a
conseqüente colocação em marcha da atividade genética. Ao contrário , a desacetilação provoca
o efeito oposto, já que incrementa o enrolamento da cromatina e pode chegar a convertê-la em
heterocromatina. Devemos assinalar que a agregação e a remoção dos grupos acetila são catalisadas, respectivamente, por acetilases e desacetilases localizadas na matriz nuclear.
Com relação à metilação e desmetilação, os efeitos produzidos são opostos aos da acetilação
e desacetilação , respectivamente. Desta forma, a agregação de grupos metila a uma das enzimas
(lisinas) da histona H3 aumenta o enrolamento da cromatina, enquanto sua remoção a diminui .
Por último, a fosforilação e a desfosforilação de certas serinas e treoninas localizadas na "cauda"
da histona Hl também produzem efeitos opostos aos da acetilação e da desacetilação, respectivamente.
Em síntese, a acetilação, a desmetilação e a desfosforilação de diferentes histonas diminuem o
enrolamento da cromatina e propiciam a atividade dos genes . Em contrapartida, a desacetilação, a
metilação e a fosforilação aumentam o enrolamento e bloqueiam a atividade genética.
Cabe assinalar que em diversos tipos celulares os promotores dos genes contêm histonas que
apresentam - em relação a seu número e distribuição - uma combinação particular dessas alterações quúnicas, o que sugere que algumas combinações estimulam e outras silenciam a atividade
dos genes. Isso fez com que os que trabalham neste assunto dessem o nome de código histônico
ao conjunto de tais combinações.
Além disso, nos tipos celulares diferenciados que se dividem, as células-filha herdam a mesma
heterocromatina das células predecessoras, o que se repete de geração em geração (Cap. 21-21).
Esta estabilidade da heterocromatina deve-se ao fato de que os fatores que a causam se duplicam
nas células próximas a se dividir e se repartem entre as células-filha.
Em alguns casos, a atividade gênica se inativa e a cromatina se compacta em função da interferência de causas adicionais às citadas, como sucede no cromossomo X compactado das células da
mulher, descrito no Cap. 12-11 com o nome de cromatina sexual ou corpúsculo de Barr. Embora
o cromossomo X se compacte e seus genes se inativem devido à desacetilação de suas histonas e
pela metilação de seu DNA (esta metilação será analisada na Seção 14-1 3 e não deve ser confundida
com a metilação das histonas), ambas as alterações são precedidas pela ativação do gene Xist (do
inglês, X-inactivation specific transcript), que, como vimos no Cap. 13-12, se localiza no próprio
cromossomo X, em uma região próxima do centrômero chamada Xic. Quando é ativado, o gene Xist
gera múltiplas cópias de um RNA especial denominado RNAxist (Cap. 13-2), as quais, a partir do
Xic, unem-se ao DNA dos dois braços do cromossomo X e inativam quase todos os seus genes. Cabe
acrescentar que mediante técnicas especiais, as cópias do RNAxist aparecem em forma de pontos ao
longo do cromossomo X compactado, o que sugere sua associação a proteínas.
14-13. A metilação do DNA influencia a atividade gênica
Além das quatro bases conhecidas (A, T, C e G), em alguns pontos o DNA contém uma quinta,
a metilcitosina ou mC , que é gerada ao se agregar um grupo metila (CH 3) à citosina (Fig. 14.10).
A metilação do DNA está restringida a citosinas seguidas por guaninas (não estamos dizendo
"emparelhadas") de modo que se em um ponto uma das cadeias do DNA contiver o dinucleotídeo
mC-G, a cadeia oposta exibirá o dinucleotídeo G-mC. Como é óbvio, a mC do dinucleotídeo mCG se pareia com a G do dinucleotídeo G-mC, e a G com a mC.
.
-
U
o
a
a
a
D
-
o
o
e
e
l)
A TRANSCRIÇÃO DO DNA
•
Do mesmo modo que ocorre com a metilação das histonas, existe uma estreita relação entre o
grau de metilação dos genes e sua inatividade transcricional. Entretanto, na metilação do DNA
seu número influencia menos do que a sua localização. Com efeito, a metilação do DNA ao nível
do promotor pode anular a atividade de um gene, enquanto muitas metilações em sua região codific adora podem não afeta-la.
Recordemos que existem genes com promotores que apresentam setores chamados regiões CG
por conterem uma alta proporção desse dinucleotídeo (Cap. 13-7). Ratificando , nas células da
mulher, numerosos genes inativos pertencentes ao cromossomo X compactado apresentam alto
grau de metilação nos dinucleotídeos CG.
Conseqüentemente, um gene pode estar metilado em um tipo celular, porém não estar em outro. Por exemplo, o gene da 13-globina se encontra metilado nas células que não produzem essa
proteína e não metil ado nas células eritropoéticas, onde a 13-globina é produzida em grandes quantidades.
Nas sucessivas gerações celulares, as células dos tecidos diferenciados apresentam em seus DNA
um padrão de citosinas metiladas virtualmente idêntico ao de suas predecessoras. A herança das
mC acontece porque durante a replicação , depois de se duplicarem as duas cadeias de DNA, as C
das cadeias filhas - as complementares das G dos nucleotídeos mC-G e G-mC, exclusivamente
- adquirem um grupo metila. Esta metilação é dirigida· por uma enzima chamada meti.lase de
manutenção, que atua apenas quando o DNA se duplica (Fig. 14.11).
Em contrapartida, nas células que se diferenciam depois de se dividir, os padrões de metilação
se modificam. Assim, os genes inativos - portanto, muito metilados - perdem parte de sua
metilação ao se ativarem.
O ruecanismo que modula a substituição das mC por C - e vice-versa - e o modo como as
primeiras previnem a transcrição são temas que aguçam os pesquisadores dedicados ao estudo da
diferenciação celular.
14- 14. A impressão genômica resulta da metilação diferente dos
alelos de alguns genes, conforme a origem do cromossomo
seja do pai ou da mãe
Um fenômeno muito nítido relacionado com a metilação do DNA é observado na denominada
impressão genômica. Esta envolve um grupo de genes cujos dois alelos possuem normalmente
padrões de metilação das citosinas di stintos entre si, ao se comparar o alelo fornecido pelo pai
com o alelo fornecido pela mãe. Até o momento, foram identificados mais de 40 genes com esta
característica que, ressaltamos, é absolutamente nonnal.
Para que a impressão - ou a "marca de procedência" paterna ou materna - desses genes possa
se manter de geração em geração, os genes com impressão materna devem perdê-la nas células
germinativas masculinas e adquirir o padrão de metilação dos genes com impressão paterna, os
quais não se modificam. Obviamente, nas células germinativas femininas deve ocorrer o contrário. Ignora-se como no testículo os genes com impressão materna adquirem o padrão de metilação
de seus homólogos paternos e no ovário os genes com impressão paterna adquirem o padrão de
metilação de seus homólogos matemos.
No testículo, a modificação ocorre na etapa perinatal e tem lugar nas células predecessoras das
esperrnatogônias (Cap. 19-3). Já no ovário ocorre durante a meiose I, e por isso tem lugar no ovócito I (Cap. 19-4).
CH 3
1
CG
GC
CH 3
1
CG
GC
1
CH 3
CG
GC
1
CH 3
CH 3
1
CG
GC
1
CH 3
Fig. 14.11 Metilação de citosinas
depois da replicação do DNA.
228
•
A TRANSCRIÇÃO DO DNA
Fig. 14.12 Representação do
gene do RNAr 45S associado a
RNA polimerase I e aos fatores
de transcrição UBF e SL 1.
RNA polimerase 1
TTTT
5'
_ __ _ _ _ _ _ _ __,)
285
1 3'
Devemos assinalar que para que a embriogênese seja nmmal, para cada par de alelos com impressão é necessário que um tenha a impressão paterna e o outro a materna. Por conseguinte, se
em uma célula ge1minativa de um dos pais oconer uma falha na reprogramação da impressão, o
embrião formado com a participação dessa célula terá uma proporção inadequada de alelos paternos e matemos e se desenvolverá defeituosamente.
Recebem o nome de dissomias uniparentais as afecções congênitas que ocorrem quando os
dois alelos de um gene com impressão possuem a impressão do pai ou a impressão da mãe e não
cada alelo a impressão de um dos pais. Por exemplo, uma malformação congênita muito grave, a
síndrome de Angelman, é devida à presença de dois alelos paternos ou à falta do alelo materno de
um gene com impressão pertencente ao cromossomo 15 . Sua contrapartida é a síndrome de Prader-Willi, na qual os alelos são matemos. Devemos assinalar que embora ambas as síndromes sejam
conseqüência da alteração da impressão do mesmo gene - a do alelo m aterno e a do alelo paterno, respectivamente - seus quadros clínicos diferem entre si .
TRANSCRIÇÃO DO GENE DO RNA RIBOSSÔMICO 45S
1lq
l ti
• 11
• 11
IH
n 11
Ili
' li
14-15. O RNAr 455 é sintetizado no nucléolo por meio dos
fatores de transcrição
No Cap. 13-8, assinalamos que as 200 cópias do gene do RNAr 45S se localizam no nucléolo.
A iniciação da síntese do RNAr 45S pela RNA polimerase I necessita dos fatores de transcrição chamados SLl (do inglês , selectivity f actor) e UBF (do inglês , upstream binding factor) (Fig.
14.12). Os estudos sobre o SLl revelaram que ele contém três T AF e uma subunidade idêntica ao
TBP do TFIID (apesar de que o promotor do gene para o RNAr 45S não conta com a seqüência
TATA).
O SLl associa-se ao promotor do gene e o UBF ao regulador (amplificador) (Cap. 13-8). Depois, o SLl e o UBF se comunicam entre si - e ambos com a RNA polimerase I - e fÕrmam um
complexo cooperativo que dá início à transcrição.
A transcrição de cada urna das cópias do gene do RNAr 45S é concluída com a chegada da
RNA polimerase I à seqüência de terminação, rica em timinas. Levando-se em conta que várias
cópias do gene se acham alinhadas em fila , é possível que exista algum tipo de associação entre a
zona de te1minação de uma cópia e o regulador da cópia seguinte, apesar de estarem separados
por uma seqüência de DNA espaçador que não se transcreve. A valizam esta idéia experiências
nas quais a transcrição de urna cópia não se inicia se a que estiver situada precedentemente não
finalizar a sua.
O estudo ultramicroscópico do nucléolo , antes estendido de seus componentes , mostra uma
sucessão de cópias do gene do RNAr 45S dispostas em fila , cada urna associada a numerosos transcritos primários. São vistas imagens semelhantes a árvores de natal como as produzidas pelos
genes que sintetizam RNArn a alta velocidade (Fig . 14.13).
TRANSCRIÇÃO DO GENE DO RNA RIBOSSÔMICO 5S
14-16. O gene do RNAr 55 se acha fora do nucléolo e se ativa
mediante três fatores de transcrição
As aproximadamente 2. 000 cópias do gene que codifica o RNAr 5S estão fora do nucléolo (Cap.
13-9). Sua transcrição é dirigida pela RNA polimerase III , que atua quando três fatores de trans-
1
A TRANSCRIÇÃO DO DNA
•: k
~
•...,.
; ··
...
~ --
_!-
-~
- . .....
.. .
..
. ..
.
Se[ltido da franstcição _:_:___:_.
l.
-
~ .
-
.
.
.
..._·
..
"
.·•
...
""
-·..
, '-
Local de terminação
Promotor
18S
58S
28S
1--------1
Espaçadores
transcritos
•
229
Fig. 14.13 Na parte superior da
figura observa-se um estendido
com 11 genes consecutivos do
R Ar 45S, separados por
segmentos espaçadores que não
se transcrevem_. Na parte média
aparece um desses genes com
maior aumento, em pleno
processo de transcrição; contém
múltiplas moléculas de RNAr
455, o que lhe confere um
aspecto de "árvore de natal''. Na
parte inferior é apresentado um
esquema do gene com as partes
correspondentes aos RNAr 185,
28S e 5,SS, juntamente com os
segmentos espaçadores que se
transcrevem. (Cortesia de U.
Scheer, M. F. Trendelemburg e
W. W. Franke.)
J+-------l
Espaçador
não transcrito
Espaçador
transcrito
Espaçador
não transcrito
crição ciistintos - chamados TFIIIA, TFIIIB e TFIIIC - se unem ao promotor do gene (Fig.
14.14). O TFIIIB contém vários TAF e a subunidade TBP do TFIID.
A síntese do RNAr 5S cessa quando a RNA polimerase III chega à seqüência de terminação ,
rica em timinas.
TRANSCRIÇÃO DOS GENES DOS RNA DE TRANSFERÊNCIA
14- 17. Os genes que codificam os RNAt são ativados mediante
dois fatores de transcrição
A transcrição das 10 a 100 cópias de cada um dos genes que codificam os diferentes RNAt
(Cap. 13-10) é dirigida também pela enzima RNA polimerase III, que necessita da união dos fatores de transcrição - os recém-nomeados TFIIIB e TFIIIC (Fig. 14.15).
Em função da presença de várias timinas consecutivas na extremidade 3' do gene, a finalização da síntese destes RNA é similar à dos RNAr 45S e 5S.
TRANSCRIÇÃO DOS GENES DOS RNA PEQUENOS
14-18. Os fatores de transcrição que ativam os genes dos RNA pequenos
são parcialmente conhecidos
Os RNAnp são, na maior parte, sintetizados pela RNA polimerase II e uns poucos pela RNA
polimerase III. Foi descoberto um fator de transcrição chamado SNAPc (do inglês, small nuclear
RNA polimerase Ili
5'--
/
- ~
7
~~~~~~
TF lllC
J
~T
Fig. 14.14 Representação do
gene do RNAr SS associado à
RNA polimerase III e aos fatores
de transcrição TFIIIA, TFIIIB e
TFIIIC.
230
•
A TRANSCRIÇÃO DO DNA
Fig. 14.15 Representação do
gene de um RNAt associado à
RNA polimerase III e aos fatores
de transcrição TFIIIB e TFillC.
RNA polimerase Ili
~
3'
activator protein complex) que se vincula a ambas as polimerases; ele tem uma subunidade TBP
e se une à seqüência TATA ou à seqüência PSE do promotor (Cap. 13-11).
A formação do restante dos RNAnp e dos RNAnop não depende de polimerases nem dos fatores de transcrição próprios, já que está subordinada à síntese de RNAm onde se acham os íntrons que lhes dão origem (Cap. 13-11). Como vimos na Seção 14.5, a síntese dos RNAm é dirigida pela RNA polimerase II.
Com relação ao gene do RNAcp, suas múltiplas cópias são transcritas pela RNA polimerase
III. Os fatores de transcrição deste gene ainda não são conhecidos.
TRANSCRIÇÃO DOS GENES DO RNAxist, DO RNAte E DOS
miRNA (microRNA)
14-19. Não se sabe exatamente como os genes dos RNAxist, do
RNAte e dos miRNA são transcritos
Embora durante o desenvolvimento inicial do embrião feminino o gene do RNAxist se transcreva nos cromossomos X mais tarde, por causas ainda desconhecidas, isso se faz somente nos
cromossomos X compactados (corpúsculo de Barr).
Com relação ao gene da RNAte, existem estudos que sugerem que é transcrito pela RNA polimerase II.
Até esta data não existem referências sobre a transcrição dos genes dos miRNA.
TRANSCRIÇÃO DOS GENES NAS CÉLULAS PROCARIONTES
14-20. A regulação da expressão dos genes bacterianos pode ocorrer no
início ou no término da transcrição
As bactérias possuem milhares de genes, entre os quais se encontram os que codificam as proteínas enzimáticas, tanto as que participam da degradação dos alimentos provenientes do meio
como as que intervêm na síntese das moléculas que compõem a célula bacteriana. Em alguns casos, a expressão desses genes é controlada no começo da transcrição e em outros, tanto no começo
como no término.
14-21. O operon lac é induzido pela lactose
Sabendo-se que as bactérias obtêm seu alimento diretamente do meio em que vivem, os mecanismos que regulam a atividade de seus genes devem adaptar-se, rapidamente, às mudanças na
qualidade e quantidade das moléculas (alimentos) nesse citado meio.
Um bom exemplo de controle transcricional é proporcionado pelo gene das enzimas que intervêm quando a bactéria Escherich ia coli utiliza a lactose como alimento. A síntese destas enzimas
pode aumentar até 1.000 vezes se a lactose for agregada ao meio de cultura. Desta forma, a disponibilidade de um substrato estimula a produção das enzimas que intervêm em sua degradação.
Esta regulação - por indução enzimática - também se cumpre no caso das enzimas que degradam outros açúcares e diversos aminoácidos e lipídios.
A TR A SCRIÇÃO DO DNA
%11111111111"
1
o
p
1 - - -- -
z
\; .: 'li
1111: llllllllll'llllllllllllf
----+--
y ---+- a---!
l
l
RNAm i
111111111111111111111 1111
RNAm lac
111111111111111111111111111111111111111111111111111111 1111 1111111 1111111111 111111111
l
l
ffi
ffi
Repressor lac
l
l
8
Pe9ease
Tran sacetilase
J3·Galactosidase
231
Fig. 14.16 Representação do
operon lac, com o gene inibidor i
(que codifica o RNAm do
repressor lac), o promotor (p), o
operador (o) e o segmento
codificador composto pelos
genes ::, y e a. Estes codificam o
RNAm policistrônico lac que dá
lugar às proteínas ~­
galactosidase, permease e
transacetilase.
Codificador
'I
lllllllllllllllllllllllll
•
IBP
i
fa-
' ín-
füi-
rase
msnos
po-
As três enzimas necessárias para o aproveitamento da lactose como alimento são a (3 -galactosidase, a permease e a transacetilase, cuja codificação corresponde a uma unidade genética comum denominada operon lac (Fig. 14.16).
Um operon é um grupo de genes que se encontram muito próximos entre si e que são regulados
(ativados ou inibidos) de forma conjunta por um operador (o) e por um promotor (p). Além disso, pode intervir um gene inibidor (i), que codifica uma proteína denominada repressor. Os genes se acham no segmento codificador e são transcritos em um só RNAm, que, por isso, recebe
a denominação de RNA policistrônico. Isto explica por que as proteínas derivadas de um operon
são sintetizadas em quantidades equivalentes.
Vottando ao operon lac, seu segmento codificador conta com três genes - chamados z, y e a
- que codificam as três enzimas mencionadas . É regulado pelo repressor lac, um complexo protéico com quatro subunidades idênticas de 40 kDa , codificadas pelo gene inibidor (Fig. 14.16). O
repressor lac se une ao operador, que está situado próximo do começo do gene z (da (3-galactosidase).
Como se observa na Fig. 14.17 , a união do repressor lac ao operador impede a síntese do RNAm
policistrônico. O repressor lac se une· a uma seqüência de 21 pares de bases do operador que tem
regiões com simetria dupla (em palíndromo), de modo que alguns setores localizados do lado
esquerdo encontram-se também no lado direito , porém na cadeia oposta e dispostos em "espelho"
(Fig. 14.18).
Foram encontradas seqüências semelhantes nos operadores de outros operons e nos reguladores dos genes das células eucariontes (Seção 14-11 ). As seqüências simétricas representam locais
de reconhecimento para as diferentes subunidades do repressor.
JfO-
~'
teiO
caeço
:ca-
RNA pollmecMo
p
llllllllllllllllllll'lllllll!llllllllll
1
o
z
y
a
111! 11f f illlllll!lllllllllilllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllflllll!llllllllllllllllllllHll!lllllllllllllllll
1
I_ -
:t
Repressor
lac
•
_..]
, na
ernas
poão.
~-
(X) }
W
Complexo substância indutora
(alolactose)-repressor lac
/'
º
@~,~,~~'~'~'~'~'~'~lil'~'~,~~,~~'~'~,~~,~~,~,~~W'
I
,,lil,,,,,,,,lllillliillllilll
Fig. 14.17 Regul ação do operon
lac na ausência e na presença de
uma substância indutora. No
primeiro caso, o repressor lac que é um tetrâmero - une-se ao
operador e interfe re na
transcrição dos genes. A união
simultânea da RNA polimerase
com o promotor e do repressor
com o operador é impossível, já
que a enzima é incapaz de unirse ao promotor quando o
repressor ocupa o operador. No
segundo ca.so, a substância
indutora se une ao repressor e
produz uma modificação
conformacional que impede sua
união com o operador. Desta
maneira, a RNA polimerase fica
em liberdade e pode ativar a
transcrição dos genes. Na
Escherichia coli , a RNA
polirnerase possui 5
subunidades: duas ex (de 40 kDa
cada uma), duas ~ (de 160 kDa
cada uma) e uma cr (de 95 kDa).
Vale a pena lembrar que uma
vez in iciada a transcrição, a
subunidade cr se libera do
complexo.
232
•
A TRANSCRIÇÃO DO D A
14- 22. A substância indutora se une ao repressor e
este sai do operador
A afinidade do repressor pelo operador é regulada pela substância indutora, que é uma molé. cula pequena que se liga ao repressor. A substância indutora natural do operon lac é a alolactose,
um metabólito da lactose (em experiências de laboratório é usado o isopropiltiogalactosídio ou
IPTG , que é um indutor mais potente).
Cada subunidade do repressor tem um local de união para a substância indutora. Esta provoca
uma alteração conformacional e então o repressor abandona o operador. Como vemos, a presença
da substância indutora toma possível a transcrição do operon. O efeito da presença da lactose _:____
e, portanto, da alolactose - no meio é espetacular. Enquanto na ausência de lactose a E. coli contém em média somente três moléculas de ~ - galactosidase, depois da indução do operon lac passa
a ter cerca de 3.000 moléculas, as quais representam 3% de suas proteínas. Além disso, esta adaptação é muito rápida, já que a maioria dos Rt~Am bacterianos embora seja sintetizada em grande
velocidade, tem uma vida média de poucos minutos.
14- 23. A RNA polimerase se une ao promotor quando o
repressor é liberado do operador
O promotor é o segmento do gene onde a RNA polimerase se coloca quando a transcrição é
iniciada. A Fig. 14.18 mostra a seqüência do nucleotídeo do promotor no operon lac. Para a uni ão
da RNA polimerase são importantes dois setores: 1) a seqüência conservada TATGTTG, situada
entre 6 e 12 nucleotídeos antes do local de começo da transcrição, presente em quase todos os
promotores, e 2) uma seqüência necessária localizada a 35 nucleotídeos deste local, importante
porque sofre uma mutação se a expressão do operon lac for inibida.
A RNA polimerase se une a uma região do gene de aproximadamente 80 nucleotídeos, correspondente ao promotor. A presença do repressor no operador bloqueia a ligação da RNA polimerase com o promotor. Assim, os repressores funcionam de maneira muito simples: quando estão
unidos ao operador impedem a fixação da RNA polimerase ao promotor.
14-24. A transcrição do operon lac está sujeita a um controle
positivo por parte do AMP cíclico
Fig. 14.18 Seqüência de
nucleotídeos no promotor e no
operador do operon lac. No
promotor, aparece a seqüênci a
cônservada TATGTTG e uma
seqüência necessária, cujas
mutações afetam a transcrição do
gene. (De R. Dickson e col.)
O AMP cíclico (AMPc) participa da regulação da transcrição dos operons. Como veremos,
sua concentração no protoplasma bacteriano é controlada indiretamente pela glicose.
A E. coli possui uma proteína receptora para o AMPc chamada CAP (do inglês, catabolite
activator protein). Trata-se de uma proteína dimérica, que se une ao promotor do operon quando
a ele se associa o AMPc. Isso faz com que a RNA polimerase também se uma ao promotor (Fig.
14.18). Assim, a RNA polimerase reconhece o promotor sempre que o complexo AMPc-CAP se
encontre nele. Como vemos, no operon lac , além do controle negativo exercido pelo repressor lac,
existe o controle positivo mediado pelo complexo AMPc-CAP.
O controle positivo é registrado na expressão de muitos.outros operons, como os que intervêm
na utilização da maltose, da galactose e da arabinose. No entanto , este controle não é necessário
para a expressão dos genes que atuam durante a utilização da glicose como alimento. Isso é importante porque quando as bactérias crescem na presença de glicose têm menos moléculas de AMPc
do que quando o fazem por exemplo em um meio rico em lactose, que, como sabemos, proporciona menos energia que a glicose. Em conseqüência, se a E. coli se desenvolve na presença de glicose e lactose, usará somente a primeira. Este mecanismo permite à E. coli adaptar-se a seu habitat natural mutante, o interior do intestino .
1
p
o
CCOU:.ttCCClClÇlCUCUCC et. t t l l TtIClCI THC' CIC 1uJJit;CU.tt CCH CC 1illOCI11 t 1eeT1 CCCCCTCU UCTl 'TCTC
tCJTTCHCCCfC&CittCCT TC CC TTUTTH l tJCUICCiCTtlCIUl(CCTC "' TCC~H UHCCCCHC~itlC ~=-:l'lYl:l
União do
AMPc·CAP
Seqüência
necessária
Seqüência
conservada
União do
repressor lac
A TRANSCRIÇÃO DO DNA
•
233
14-25. A transcrição do operon Trp é regulada por dois mecanismos
Na E. coli, as cinco enzimas necessárias para a síntese do aminoácido triptofano são codificadas pelo operon Trp (Fig. 14.19), cuja atividade é controlada por dois mecanismos conhecidos
como repressão enzimática e interrupção prematura da transcrição. Em seguida, veremos que a
atividade do operon Trp depende, primordialmente, da concentração do aminoácido na bactéria e
que ambos os mecanismos de controle fazem com que as cinco enzimas sejam produzidas somente quando necessárias.
Na repressão enzimática, a síntese do R!"l"Am que codifica essas enzimas é bloqueada quando
a concentração do triptofano - ou seja, do produto das enzimas - ultrapassa certos níveis . Para
tanto , o repressor Trp derivado do gene inibidor ingressa no operador e impede que a RNA polimerase se una ao promotor, o que detém a transcrição do gene e, por conseguinte, a produção
das enzimas. Devemos acrescentar que para que o repres or ingresse no operador é necessário
que ative um co-repressor, que no caso do operon Trp é o próprio aminoácido triprofano quando
se encontra em excesso.
A Fig. 14.19 mostra como funcion a o operon Trp quando o triptofano bacteriano é insuficiente. Observe-se que o repressor e oco-repressor se separam do operador, a RNA polimerase retorna ao promotor e o RNArn que é gerado dirige a produção das cinco enzimas necessárias para
sintetizar o aminoácido.
Devemos assinalar que mediante o mecanismo de repressão enzimática, a bactéria controla
também a síntese de outros aminoácidos e das moléculas precursoras dos ácidos nucléicos.
Como dissemos, a bactéria possui um mecanismo adicional para regular a atividade do operon
Trp, baseado na interrupção prematura da transcrição. Desta forma, quando a concentração
de triptofâno supera certos níveis, o operon Trp interrompe sua transc1ição e gera um RNAm curto, incapaz de produzir as enzimas que são necessárias para a síntese do aminoácido. O RNAm
acaba sendo cmto porque sua molécula forma um anel que põe fim à transcrição.
Por outro lado, quando o Trp bacteriano é in suficiente, esse anel não se fonna, a transcrição
não é interrompida e é gerado um RNAm completo.
14- 26. Existe também um controle pós - transcricional para
regular a síntese de moléculas
ANA ~
,
1
1
1
+
p
I
#
•
•
~", ......... - +
Repressor Trp
Co-repressor (triptofano)
,1/
1
a
b
111::1111ll!ll''li:lll!llll Ili ll!IUll li 11'!1!; 111111 1.
DNA
RNAm Trp
e
l11il!h li
d
~ 11 .llll·
e
IJ'ill Ili lll:lllllWilll 1·1q li Jl '.lil
Jllllllf llllflf lllll fllll ll lf llllllllllllll lllllll llllllf llllllllll lllllllllllllllllJllJlllllllllll lllllll li lillllfllllll
+
Antranilato
sintetase
+
Fosforribosil
antranilato
transferase
+
Fosforribosil
antranilato
isomerase
+
Triptofano
sintetase j3
!
'•
1
o
....
•
,.•'
11
A indução e a repressão enzimáticas proporcionam um controle geral do metabolismo nos procariotas, ao ativar ou inibir a síntese das enzimas bacterianas de acordo com as necessidades (Fig.
14.20). Contudo, as células dispõem de mecanismos de regulação mais apurados, pois controlam
a atividade, e não a síntese das enzimas. Os mai s comuns são: 1) a inibição por retroalimentação (jeedback) , pela qual o produto final de um ciclo metabólico atua como inibidor alostérico da
primeira enzima da cadeia, de modo que quando for sintetizada uma quantidade suficiente do pro-
polimerase ~
••
+
Triptofano
sintetase j3
Fig. 14.19 Regulação por repressão enzimática da atividade do operon Trp da Escherichia coli. Quando
há triptofano suficiente, o repressor Trp inibe o operador, e, por isso, é suspensa a síntese do RNAm
·policistrônico Trp que codifi ca as cinco enzimas requeridas para produzir o aminoácido. Devemos
lembrar que o repressor é induzido pelo próprio trip rofano que, quando se encontra em excesso, atua como
co-repressor. Ao contrário, qu ando a bactéria é privada de triptofano, este e o repressor se separam do
operador e se inicia a síntese do RNAm Trp. (De K. Bertrand e col.)
234
•
A TRANSCRIÇÃO DO DNA
Fig. 14.20 Na inibição por
retroalimentação (feedback), o
produto final (Z) de uma cadeia
metabólica atua como inibidor
alostéric o da primeira enzima da
cadeia. Na ativação por
prec ursor, o primeiro produto da
cadeia (A) atua como ativador
alostérico da última enzima da
cadeia.
.,., .... --- ----
,
'
'
/
,,,. .... -- ~:
'
Inibição por reiroalimentação
---- --- ----- - -- -- --- -- ',
Ativação por precursor
----
- - - - - - - - - - - - - - - - - - - - - - - - -- ,,
11
l
1
1
E.
+
'\\
E"
E,
A--+B --:....+C------+ X--+
t E.
1
Y~
Z
1
1
Enzimas
t
RNAm
,,
lnducão
_______
;;: ____ _..
t
ONA
-
1
1
1
I
I
Repressão
----------
,,/
duto toda a cadeia entra em repouso e se evita o acúmulo inútil de metabólitos; 2) a ativação por
precursor, na qual o primeiro metabólito da via sintética atua como ativador alostérico da última
enzima da cadeia (Fig. 14.20).
O controle genético (por indução ou por repressão) é um tipo grosseiro e relativamente lento
de regulação, enquanto a inibição por retroalimentação e a ativação por precursor são formas mais
precisas e quase instantâneas de regulação. O controle genético economiza energia, já que evita a
síntese de enzimas desnecessárias. Por outro lado, o controle da atividade enzimática permite uma
adaptação quase instantânea do metabolismo celular.
BIBLIOGRAFIA
Aso T. , Lane W.S., Conaway J.W. and Conaway R.C. (1995) Elongin
(SIII): a mu ltisubunit regulator of elongation by R 1A polymerase
II. Science 269:1439.
Barlow D.P. (1995) Gametic imprinting in mammals. Science 270: 16 l O.
Beckwith J. and Zipser D. (1968) T he Lactose Operon. Cold Spring
Harbor Laboratory, New York .
Bell S.P. , Learned R.M., Jantzen H.M. and Tjian R. (1988) Functional
cooperativity between transcription factors UBFl and SLl mediares
human rRNA synthesis. Science 241: 11192.
Bird A. (200 1) Methylation ta lk between histones and D 1 A. Science
294:2113.
Bird A.P. (1993) Genomi c imprinting: imprints on islands. Curr. Biai.
3:275 .
Bourc 'his D. et ai. (2001 ) Dnmt3L and the establishment of maternal
genomic imprints. Science 294:2536.
Brown C.J. et ai. (199 1) A gene from the reg ion of the hu man X
inactivation ce ntre is expressed exclusively from the inacti ve X
chromosome. Natu re 349:38.
· Comai L. et a!. ( 1994) Recon stitution of transc ription factor SLl :
Exclusive binding of TBP by SLl or TFIID subunits. Science
266 :1 966 .
Conaway J.W. and Conaway R.C. (199 1) Initi at ion of eukaryo tic
messengerRNA synthesis. J. Biol. Chem . 266:1772 1.
Delihas N. and Anderson J. (l 982) Generalizated structures of the 55
ribosomal RNAs. Nucleic Ac ids Res. 10:7323.
Drapkin R. , Merino A. and Reinberg D. (1993 ) Regulation of R A
polymerase II transcription. Curr. Opin . Cell Biol. 5:469.
Dynan W.S. and Tjian R. ( 1985) Contrai of eukaryotic messenger RNA
synthes is by sequence-specific DNA-binding protein. Nature 316:
774.
Edmondson D.G. and Roth S.Y. (1996) Chromatin and transcription.
FASEE J. 10: 1173.
-Garre! J. and Campuzano S. ( 1991 ) The helix-loop-helix domain: a common motif for bristles, muscles and sex. Bioessays 13:493.
Gei du schek E.P. and Kassavetis G .A . (1992 ) RNA polymerase III
transcription complexes. ln: Transcriptional Regu lation. Cold Spring
Harbor Laboratory, New .York.
Gilbert W. and Müller-Hill B. (1 967) The lac operator is DNA. Proc.
Natl. Acad. Sei. USA 58:2415 .
Grunstein M. (1 992) Histones as regulators of genes . Sei. Am. 267
(4) :68 .
Harrison S.C. ( 1991 ) A structural taxonomy ofDNA-binding domains.
ature 353 :7 15.
Harrison S.C. and Aggarwal A.K. (1990) DNA recognition by proteins
with the helix-tum -heli x motif. Annu. Rev. Biachem. 59: 933 .
Heintz N. , Sive H.L. and Roeder R.G. (1983) Regulation ofhistone gene
expression. Mol. Cell Biai. 3:539.
Heix J. and Grummt I. (1995) Species specificity of transcription by
RNA polin1erase I. Curr. Opin. Genet. Dev . 5:652.
Hernández . (1993) TBP, a universal eukaryotic transcription factor?
Genes Dev. 7: 1291.
Jackson M.E. (1991) Negati ve regulation of eukaryotic transcription. J.
Cell Sei. 100: 1.
Jacob F. and Monod J. (1961) Geneti c regulatory mechanisms in the
synthesis of proteins. J. Mo lec. Biol. 3:318.
Jacobson R.H. and Tjian R. (1996) Transcription factor IIA: a structure
with multiple function s. Science 272:827 .
Kornb erg R.D. and Lorch Y . ( 1992 ) Chromatin structure and
transc ription. Annu. Rev . Cell Biol. 8:563 .
Lamb P. and McKnight S.L. (1991) Di vers ity and specificity in transcriptional regulation: the benefits of heterotypic dimerization . TIBS
16:417.
Lyon M.F. (1999) X-chromosome inactivation. Curr. Biol. 9:R235.
Maniati s T. and Ptashne M. ( 1976) A D A operator-repressor system.
Sei . Am. 234 (1):64.
Martienssen R .A . and Richards E.J. (1995) DNA meth ylat ion in
eukaryotes. Curr. Opin. Genet. Dev . 5:234.
McKn ight S.L. (1991 ) Molecular zippers in gene regulation . Sei. Am.
264 (4):54.
Meller J.H. and ReznikoffW.S. (1978) The Operon. Cold Spring Harbor
Laboratory, New York.
Nakajima N., Horikoshi M. and Roeder R.G . ( 1988) Factors involved
in specific transcription by mammalian RNA polymerase II: functi onal analys is of initiation factors IIA and IID and identification of a
A TRAl'\TSCRIÇÃO DO DNA
new facto r operating at sequences downstream of the initiation site.
J. Biol. Chem. 262:3322.
Pabo C.O. and Sauer R.T. (1992) Transcriptions factor s: strucrural
famili es and principies of DNA recognition. Annu. Rev. Biochem.
61:1053 .
Reeder R .H. (1992) Regulation of transcription by Rt'\IA pol ymerase I.
In: Transcriptional Regulation. Cold Spring Harbor Laboratory, _Tew
York.
Reik W., Dean W. and W alter J. (2001 ) Epigenetic reprogramming in
mamm alian development. Science 293: 1089.
Reines D ., Conaway J.W. and Conaway R.C. (1996) The R.'\/A polymerase II general elongation factors. TIBS 21:3 51.
Rhodes D. and Klug A . (1993 ) Zinc fingers . Sei. Am. 268 (2):5 6.
Rippe K., von Hippel P .H. and Laugowski J. (1995) Action at a di stance:
D A-looping and initiation of transcription. TIBS 20 : 500.
R oeder R .G. ( 1991 ) The complexities of eukaryotic transcription
initiation: regulation of preinitiation complex as embl y. TIBS
16:402.
SchleifR. (1992) D A looping. Annu. Rev. Biochem. 61 :199 .
Shaffer C.D., Wallrath L.L. and Elgin S.C.R . ( 1993) Regulating genes
by packaging domains: bits of heterochromatin in euchromatin?
Trends Genet. 9:35.
Siegfried Z. and Cedar H . (1997) D TA methylation: A molecular lock.
Curr. Biol. 7 :R305.
Steitz T .A. (1990) Structural stu dies of protein-nucleic acid interaction:
e
J_
s-
IL.
in
lL
~
tia
•
235
the sources of sequence-specific b inding. Q. Rev. Biophys. 23:205.
Stemglanz R. (1996) Histone acetylation: a gateway to transcription al
activation. TIBS 21:357 .
Struhl K. (1989) Helix-tum-helix, zinc-finger, and leucine-zipper motifs
for eukaryotic transcriptional regulatory proteins. TIBS 14: 137.
Struhl K. (1994) Duality of TBP, the un iversal transcription factor.
Science 263:1103 .
Surridge C. (1996) The core curriculum. Narure 380:287.
Tems M.P. and Dahlberg J.E. (1994) Retention and 5' cap trimethylation
of U3 snRNA in the nucleus. Science 264:959.
Tjian R. (1995) Molecular machines that control genes. Sei. Am. 272
(2):38.
Tollervey D. ( 1996) Small nucleo lar R N As guide ribosomal RNA
methylation . Science 273 : 1056.
Verrijzer C.P. and Tji an R . (1996 ) T AF s mediate transcriptional
acti vation and promoter selectivity. TIBS 21:338 .
White R.J. and Jackson S.P . (1 992) The TATA-binding protein: a central role in tran scription by RNA pol ymerases I, II and III. Trends
Genet. 8:284 .
W olffe A. P. (1996) Histone deacetylase: a regulator of transcription.
Science 272:371.
Wolffe A.P. and Pruss D. (1996) Chromatin: hanging on to histones.
Curr. Biol. 6:234.
Yanofsky C. (1 981) Attenuation in the control of expression ofbacterial operons. Tature 289 :751.
O processamento do RNA
15
15-1 . Os RNA são processados no núcleo
Recebe o nome de processamento do RNA o conjunto de modificações que os transcritos
primários sofrem para se convener em RNA funcionais.
Vemos que alguns transcritos primários contêm segmentos de RNA sem significado funcional
aparente, como os íntrons no RNAm e os espaçadores do RNAr 45S . Um episódio saliente do
processamento do RNA é a remoção desses segmentos não utilizados, embora os transcritos primários sofram outras mudanças. Considerando-se que são diferentes nos di stintos tipos de RNA,
serão estudados separadamente no RNAm, nos RNAr 45S e 5S e nos RNAt e nos RNA pequenos.
PROCESSAMENTO DOS RNA MENSAGEIROS
15-2. O processamento dos RNAm compreende várias alterações
O processamento dos RNAm compreende a remoção dos íntrons e a agregação de duas estruturas, chamadas cape poli A, a primeira na extremidade 5' e a segunda na extremidade 3' da
molécula (Fig. 15.1). Também algumas de suas adeninas são metiladas. Estas modificações são
necessárias para que os RNAm possam sair do núcleo e funcionar no citosol.
15-3. Na extremidade 5' do RNAm agrega-se um nucleotídeo
metilado chamado cap
Ao nucleosídeo trifosfato situado na extremidade 5' do RNAm nascente se une o nucleotídeo
metilado , a 7-metilguanosina. Recebe o nome de cap (de capuz) e se agrega à extremidade 5'
mediante as seguintes etapas (Fig. 15 .2):
Em primeiro lugar, uma enzima específica incorpora uma guanosina trifosfato (GTP) a extremidade 5' do transcrito. Esta reação difere das geradas pela RNA polimerase II em três aspectos:
1) o nucleotídeo se agrega na extremidade 5' da cadeia e não extremidade 3 '; 2) entre os nucleotídeos se estabelece uma ligação trifosfato e não uma ligação fosfodiéster (um dos Pé fornecido
pela GTP e os outros dois pelo nucleosídeo trifosfato do RNAm); 3) a ligação trifosfato liga o C5'
DNA
1
1
Exon 1
intron 1
Exon 2
Íntron 2
1
X
-
Transcnçao
!
Transcrito primário
Exon 1
Íntron 1
Éxon 2
Íntron 2
Exon 3
1
Processamento
l
on 1
Éxon 2
Exon 3
TraLção
Proteína
1
HN••••••••••••••••••.....•••...• COOH
2
Poli A
V' .rv-v A.A.
Fig. 15.1 Esquema dos genes
que codificam RNA
mensageiros. São mostrados os
segmentos correspondentes ao
regu lador, ao promotor e ao
codificador, este último com
seus éxons e íntrons . Observemse as mudanças que sofre o
RNAm no final do
processamento do transcrito
primário.
.
•
f
•"
238
•
O PROCESSAMENTO DO RNA
Fig. 15.2 Formação e estrutura
química do cap na extremidade
S' do RNAm. Podemos observar
que a 7-metilguanosina se liga
ao primeiro nucleotídeo do
RNAm mediante uma ligação 5' S' trifosfato.
O
H..._
H2N~N
N
H
7
'
N+
Ligação
·..-- - - trifosfato
5' -5'
>
~
º
N
.
O
u
O
11
-----.;
O
n
Cadeia de RNA
s·
OH ~ H 2 - 0 - ~ - o - ~ - o -~-O-C~H2
o
BASE 1
o-
o-
o-
7-metilguanosina
3'
O
O CH,
1
-o-P=O
1
o
1
s · ~o~BASE2
H .
o
OH
1
-o-P=O
1
o
de uma pentase ao C5 ' de outra, e não um C5 ' com um C3 ' como na síntese dos ácidos nucléicos.
Ademai s, ao ficar invertido o nucleotídeo do cap, a extremidade 5' do RNAm se converte em um
segundo extremo 3 ' .
Em seguida, outra enzima, a metiltransferase, retira dos grupos metila de uma molécula doadora - a S-adenosilmetionina - e os transfere ao RNAm, um à guanina do cap - forma-se assim a 7-metilguanosina - e o outro ao que passou a ser, depois da incorporação da guanosina, o
segundo nucleotídeo do RNA mensageiro.
Devemos assinalar que o cap se une ao transcrito primário apenas quando este começa a ser
sintetizado - quando sua cadeia não alcança os 30 nucleotídeos - e por isso sua incorporação
não é pós-transcricional e sim co-tra!lscricional.
O cap evita a degradação do extremo 5 ' do RNAm por fosfatases e nucleases e é necessário
durante a remoção dos íntrons (Seção 15-5). Também é necessário para conectar o RNAm ao ribossoma no começo da tradução (Cap. 16-12).
15-4. O extremo 3' do RNAm se poliadenila
Leva o nome de poliadenilação, a agregação de uma seqüência de aproximadamente 250
adeninas - chamada poli A - na extremidade 3' do RNAm. Sempre que no extremo 3' dos genes
que codificam o RNAm não existe uma seqüência de terminação de 250 timinas seguidas que gere
a poli A, esta se soma ao RNAm da seguinte maneira (Fig. 15.3):
Antes que a RNA polimerase II alcance a seqüência de terminação do gene, vários fatores específicos reconhecem no transcrito primário uma seqüência chamada de sinal de poliadenilação,
formada pelos nucleotídeos AAUAAA (Cap. 13-7). Os fatores são denominados CPSF (do inglês, cleavage and p olyadenylation specificity factor) , CSTF (do inglês, cleavage stimulation
fac tor), CFI e CFII (do inglês, cleavagefactor). Um deles-não se sabe qual- corta o RNAm
cerca de 20 nucleotídeos depois do sinal de poliadenilação e o transcrito primário se desconecta
doDNA.
Notadamente, o resto dos genes se transcreve até a seqüência de terminação (como assinalamos no Cap. 13-7, nos genes dos RNAm esta seqüência não é conhecida). O segmento adicional
de RNAm que resulta da continuação da transcrição não tarda a ser degradado por fosfatases e
nucleases pois sua extremidade 5' é desprovida de cap.
Voltando ao transcrito primário, uma enzima chamada poli A polimerase agrega as 250 adeninas
em sua extremidade 3 ', uma de cada vez. Para isso, é necessária a presença do CPSF e de outro
fator, o PABII (do inglês, poli-A-binding protein). Diferentemente da RNA polimerase II, a poli
A polimerase não necessita de um modelo de DNA para realizar o seu trabalho.
A poli A é necessária para proteger a extremidade 3' do RNAm da degradação enzimática e
ajuda o RNAm a sair do núcleo.
O PROCESSAMENTO DO RNA
•
239
F ig. 15.3 Poliadenil ação da
extremidade 3' do RNAm antes
que termine a transcrição. Notar
que a extremidade 5' do RNAm
já tem o cap.
5'
cap
5'
cap
----+
ONA :===========~l:======~A~
A!T!A!A~A~=4t:==========~C:::==========~I:======
RNA polime rase
li /
Sinal de poliadenilação
Sentido da transcrição
--+
A extremidade 3' dos RNA m das histonas não se poliadenila. Ao contrário, desenvolve uma
estrutura que também protege a molécula, consistente em uma seqüência curta de nucleotídeos
que se dobra e forma um anel (Fig. 15.4).
15-5 .. A molécula dos RNAm sofre cortes e emendas
A remoção dos íntrons do transcrito primário é realizada em duas etapas: na primeira, o RNA m
é cortado entre os íntrons e os éxons; na segunda, os íntrons são expulsos e os éxons se emendam
entre si. Antes de analisar estas etapas, faremos uma breve descrição dos agentes responsáveis por
sua execução e dos sinais-que devem reconhecer no transcrito primário.
Os agentes responsáveis pelos cortes e emendas no RNAm são as RNPnp mencionadas no
Cap. 13-2. Cada uma destas ribonucleoproteínas nucleares dispõe de umRNA np rico em uridinas
- de 250 nucleotídeos ou menos - e diversas proteínas (Fig. 15.5). Devemos assinalar que a
atividade enzimática das RNPnp depende do RNAnp e não das proteínas (como vimos no Cap. 212, os RNA com propriedades catalíticas são chamados ribozimas) .
cap~J----------illL
5'
3'
Fig. 15.4 Formação de um anel na extremidade 3' do RNAm das histonas.
Fig. 15.5 Esquema de uma das
ribonucleoproteínas pequenas
nucleares (RNPnp), com seu
RNA peq ueno nuclear rico em
uridinas unido a várias proteínas.
240, •
O PROCESSAMENTO DO RNA
Existem várias RNPnp. São diferentes não somente na sua composição, mas também nas suas
funções, algumas alheias aos cortes e emendas dos transcritos primários. As RNPnp que participam desses cortes e emendas são as chamadas Ul, U2, U4, US e U6 (V por serem ricas em uridinas),
que concorrem ao setor do transcrito primário que vai ser processado, e formam um complexo
macromolecular denominado espliceossorna (do inglês, splicing, emenda) .
Entre as Rl\TPnp que não participam dos cortes e emendas dos transcritos primários se acha a
U7, cuja presença é necessária para que seja gerado o anel que protege a extremidade 3' dos RNAm
das histonas (Seção 15-4).
O transcrito primário contém uma série de sinais que marcam onde sua molécula deve ser cortada (Figs. 15. 1 e 15.6). Assim, no limite entre a extremidade 3' dos éxons e a extremidade 5' dos
íntrons aparece a seqüência G GU, na qual o dinucleotídeo GU assinala o começo do íntron. No
outro limite, ou seja, na extremidade 3' dos íntrons e na extremidade 5 ' dos éxons, aparece a seqüência AGIG, na qual o dinucleotídeo AG marca o término do íntron.
Sempre que dentro e fora dos íntrons possa haver outros dinucleotídeos GU e AG , por si só não
servem como sinais e devem ser complementados por marcas adicionais. Deste modo, próximo
da extremidade 3' do íntron, existe um segmento rico em pirimidinas e, um pouco mais distante,
os dinucleotídeos YNYURA Y, nos quais Y representa uma pirimidina, Ruma purina e N qualquer dos quatro nucleotídeos. A U e a A se apresentam de forma constante. Este A se chama ponto de ramificação e, como veremos, desempenha um papel central na remoção dos íntrons.
A eliminação dos íntrons e a emenda dos éxons ocorrem em duas etapas (Fig. 15.7):
Na primeira, a Ul se combina com a extremidade 5' do íntron e a U2 com o segmento de RNA
que contém o ponto de ramificação. Esta última combinação depende do segmento rico em pirimidinas e consome energia, que é extraída do ATP. A U l corta o RNA entre a extremidade 3' do éxon
e o GU da extremidade 5' do íntron. Depois do corte, o íntron se dobra sobre si e forma um laço.
Isso se deve ao fato da U6 - ajudada pela U4 - se combinar com a extremidade 5' (livre) do
íntron e induzir a G dessa extremidade a se ligar com a A do ponto de ramificação, antes do conta-
Segmento de
pirimidinas
Ponto de
corte 5'
5'
3'
15·
G GU
Éxon 1
Ponto de
ramifiição
j
Ponto de
corte 3'
(g)n
AG G
3'
YNYURAY
intron
15'
3'
Éxon 2
Fig. 15.6 Seqüências curtas de nucleotídeos nos íntrons e éxons, responsáveis pelos cortes e pelas
emendas (splicing) no transcrito primário.
s,
Fig. 15.7 Remoção de um íntron
e de uma emenda nos éxons
vizinhos por ação das RNPnp
UI, U2, U4, U5 e U6.
5'-l.__ _ _ _ _
G.,_lG~-----'1- 3'
Éxon 1
Éxon 2
(
r
I
f
r:
li
d
e
O PROCESSAMENTO DO RNA
to da U6 e da U4 com a U2. A U6 catali sa a formação de uma ligação fosfodiéster não usual, já
que o C5' da G não se liga ao C3 ' da A e sim ao C2 ' .
Tendo em vista que a A retém em seus lados as duas ligações fosfodiéster originais, ela apresenta três dessas ligações e não duas, e por isso recebeu o nome de ponto de ramificação. Quando
esta etapa culmina, de um lado fica o primeiro éxon com sua extremidade 3' livre e do outro um
laço composto pelo íntron e pelo éxon seguinte (Fig. 15.7).
A segunda etapa é dirigida pela U5 e também necessita de energia. Essa ribonucleoproteína,
depois de se combinar com a AG da extremidade 3' do íntron, o corta no ponto em que se une com
o éxon e emenda esse outro com o éxon separado na etapa anterior. O íntron removido, que persiste como um laço, é finalmente digerido.
Recentemente, foram descobertos íntrons que são eliminados de forma similar, porém por intermédio de outras RNPnp (exceto a U5, que participa). Estes íntrons carecem do segmento rico em
pirimidinas e em suas extremidades 5' e 3' contêm os dinucleotídeos AU e AC em lugar dos GU
e AG dos íntrons convencionais.
As RNPnp que substituem as U l , U2 , U4 e U6 denominam-se U11, U12, U4atac e U6atac• respectivamente (o subíndice "atac" faz referência aos dinucleotídeos ATe AC no DNA, que correspondem aos dinucleotídeos AU e AC no RNA).
Para que as RNPnp dêem lugar aos cortes e às emendas é necessária a presença do cap na extremidade do 5 ' do transcrito primário. Por outro lado, já que estas reações podem ocorrer sem que se
tenha completado a síntese do transcrito, não exigem a poliadenilação de sua extremidade 3'.
Em alguns RNAm, os cortes e as emendas se completam em segundos porém, em outros, esta
duração excede 20 minutos. Devemos assinalar que o RNAm não pode atravessar os poros do
envolwrio nuclear (carioteca) e sair para o citoplasma se não forem removidos todos os seus íntrons.
Uma das doenças auto-imunes que afetam o homem - o lúpus eritematoso é gerado pela produção de anticorpos contra várias proteínas das RNPnp do espliceossoma.
15-6. Algumas adeninas do RNAm se metilam
Antes de abandonar o núcleo, a maioria dos RNAm se metila. Os grupos metila incorporam-se
ao N6 ' de algumas adeninas (a 0,1% destas) . Tendo em vista que esse tipo de metilação ocorre
exclusivamente nos éxons, é possível que os grupos metila tenham uma função protetora dos segmentos funcionais no transcrito primário.
REGULAÇÃO DO PROCESSAMENTO DOS RNA MENSAGEIROS
15-7. O processamento dos RNAm é regulado em vários níveis
No Cap. 14-6, dissemos que o controle da transcrição dos genes, operado por meio do promotor e dos reguladores, é o mecanismo mais importante que a célula utiliza para determinar quais
os tipos de proteínas deve produzir e em qual quantidade. No entanto, para controlar a produção
de algumas proteínas, existem mecanismos acessórios - pós-transcricionais - da mesma importância.
Cronologicamente, os primeiros funcionam no interior do núcleo, em alguns casos mediante a
,regulação do processamento do transcrito primário e em outros mediante controle da saída do
RNAm para o citoplasma. Destes mecanismos, nos ocuparemos de imediato e deixaremos para o
próximo capítulo a análise dos processos regulatórios posteriores a esta saída, quer dizer, os que
ocorrem a partir do momento em que os RNAm chegam ao citosol.
Corte e poliadenilação diferencial da extremidade 3' do transcrito primário. Alguns genes, por exemplo, os que codificam anticorpos nos linfócitos B, geram um transcrito primário que
pode dar lugar - alternativamente - a duas proteínas semelhantes embora uma um pouco mais
longa que a outra. Isso ocorre porque um fator regulatório (não conhecido) determina que o corte
do RNA na extremi dade 3' do transcrito primário - e por conseguinte, a agregação da poli A realize-se de acordo com as necessidades do organismo, em dois lugares diferentes da molécula,
o que gera dois RNAm de comprimentos diferentes.
•
241
242
•
O PROCESSAME TO DO RNA
No exemplo citado, um dos RNAm dá lugar a uma proteína que se agrega (anticorpo), e o outro a uma proteína de maior comprimento, cuja parte suplementar serve para ancorar o anticorpo
à membrana plasmática do linfócito B, onde cumpre funções de receptor (Cap. 7-13).
Cortes e emendas em lugares alternativos do transcrito primário. Os cortes no transcrito
· primário devem ser realizados com absoluta precisão, pois bastaria que o ponto de incisão corresse
um único nucleotídeo para que os códons do RNAm fossem alterados e sua mensagem inutilizada.
Por outro lado , a presença de íntrons converte o transcrito primário em uma molécula bastante
versátil, que pode ser cortada e emendada de diferentes maneiras e produzir RNAm distintos , ou
seja, vários tipos de proteínas . Desta maneira, pode ocorrer que um ou mais éxons sejam removidos (resultando em RNAm mais curtos), que um ou mais íntrons não sejam excluídos (e que fiquem como partes dos RNAm definitivos) ou que ambos os fatos se combinem. Os casos de cortes e conexões alternativos são muito freq üentes, já que se estima que mais de 55 % dos transcritos
primários sejam cortados e emendados de diferentes maneiras.
Recentemente, foram descobertas seis proteínas, chamadas ASF (do inglês, alternative splicingfactors), que intervêm na seleção dos lugares de corte alternativos . Por serem ricas em serinas
e argininas, também são conhecidas como proteínas SR (a Fig. 2.25 informa que esses aminoácidos são identificados com as letras Se R , respectivamente).
Um fenômeno singular é observado nas células parafoliculares da tireóide e em um tipo de
neurônio do hipotálamo, uma vez que ambas produzem, entre outros, um transcrito primário praticamente idêntico (Fig. 15.8). o entanto, segundo a célula, os lugares do transcrito em que os
cortes e as emendas ocorrem variam, de modo que em ambas as células determinados éxons são
removidos , porém não os mesmos. Como resultado, nas células parafoliculares da tireóide é produzido o RNAm do hormônio calcitonina e, nos neurônios hipotalâmicos, o RNAm da proteína
CGRP (do inglês, calcitonin gene-re/ated product).
Controle da saída dos RNAm para o citoplasma. Foi postulado, apesar de ainda não comprovado , que certos RNAm não passam para o citoplasma porque são degradados seletivamente
no núcleo ou porque - seletivamente também - sua saída se acha impedida pelos poros do envoltório nuclear. Este mecanismo regulatório se produziria nas célul as cujos citoplasmas finalmente não necessitam desses R Am apesar de se terem sintetizado.
•
tt
•'
1
"""
PROCESSAMENTO DO RNA RIBOSSÔMICO 45S
15-8. O processamento do transcrito primário do RNAr 455 é diferente
daquele dos RNAm
O transcrito primário do RNAr 45S não forma um cap na sua extremidade 5' nem uma poliadenilação em sua extremidade 3'. Seu processamento - ilustrado na Fig. 15.9- oc01re no nucléolo
Gene da
calcitonina e
da CG RP
5'
A
e
B
Calcitonina
CGR P
D
E
Calcitonina
CGR P
D
E
1
•
3'
Transcrição
Transcrito
primário
5'
A
e
B
3'
Processamento
Fig. 15.8 Processamento
alternativo do transcrito primário
do gene da calcitonina e da
proteína CGRP. É sinteti zado
um ou outro produto segundo o
tipo celular amplificado. (De S.
Amara e col.)
NA TIREÓIDE
RNAm
5' ---1..__ _..__
A
Pré-hormônios
N
B
NO HIPOTÁLAMO
_..__....__c_a_1c_i1_on_in_a__.~ 3'
C I
Tradução
•
5'
--1
1
A
D
B
CGRP
C I
•
~3'
E
Tradução
~ COOH
H2 ---1..__...__.....__c_a_
1c_
ito_n_
in_
a .......
H2 N
~ COOH
O PROCESSAMENTO DO RNA
3'
5'
+
45$
l
20$
1
18$
1
•
5 .8S
32$
1
28$
e começa com uma série ordenada de cortes para eliminar as seqüências espaçadoras e fazer com
que os RNAr 28S, 18S e 5,8S fiquem como urudades independentes. A ongem desses RNAr a partir
de um mesmo transcrito primário assegura sua produção eqüitativa. As seqüências espaçadoras do
transcrito primário são digeridas por enzimas quando se separam das seqüências utilizáveis.
Devemos assinalar que seqüências dos futuros RNAr 28S, 18S e 5,8S são metiladas antes do
transcrito primário ser cortado. Por exemplo, 43 grupos metila se unem às bases ou às riboses de
outros tantos nucleotídeos do RNAr 18S . Algo semelhante ocorre com o RNAr 28S, ao qual se
unem 74 grupos metila. Igualmente à metilação do RNArn (Seção 15-6), é possível que no RNAr
45S os grupos metila tenham por função proteger os setores utilizados do transcrito primário.
O processamento do RNAr 45S inclui a formação 'das duas subunidades do ribossoma - a
maior.e a menor- cuja composição é descrita no Cap. 16-9 (Fig. 16.5). Para tanto, os RNAr 28S,
18S e 5,8S (mais o RNAr 5S) se unem com várias proteínas. este processo, intervêm três
RNPnop (Cap. 3-2) chamadas U3, US e U22. Sabe-se que algumas proteínas ribossômicas associam-se ao RNAr 45S enquanto este é sintetizado, ou seja, antes de ser cortado e de que sejam
separados seus três componentes.
Os RNAr desenvolvem alças em vários pontos de suas moléculas (Fig. 15.11 ). Isso assegura o
estabelecimento de suas configurações tridimensionais normais, o que é imprescindível para que
as proteínas ribossômicas se encaixem corretamente. As alças se formam porque os RNAr contêm seqüências de nucleotídeos complementares que se emparelham entre si (Fig. 15.11). Devemos acrescentar que os segmentos emparelhados formam duplas hélices similares à do DNA.
Finalmente, um grupo especial de RNPnop faz com que algumas A, C, G e Use convertam em
nucleotídeos não usuais. Desta forma, várias A, C e G se metilam - ou seja, se transformam em
mA, mC e mG - e uma parte das U se converte em pseudo-uridinas ( !/J).
A enorme quantidade de ribossomas de que a célula necessita é abastecida folgadamente pelas
200 cópias do RNAr 45S (e pelas 2.000 cópias do gene do RNAr 5S). Além disso, a síntese de
RNAr 45S é realizada numa velocidade constante, o que sugere a existência de uma baixa regulação transcricional. Com efeito, ficou comprovado que o número de ribossomas que a célula constrói é regulado principalmente através do controle do processamento do RNAr 45S.
15-9. A síntese e o processamento do RNAr 455 têm lugar no nucléolo
Tanto a síntese como o processamento do RNAr 45S ocorrem no nucléolo, cujo estudo
,ultramicroscópico mostra uma estrutura característica, com duas regiões perfeitamente distinguíveis (Fig. 15.10):
1) A região fibrilar, localizada na parte central, onde o RNAr 45S é sintetizado e são produzidas as primeiras etapas de seu processamento. Contém as 200 cópias do gene do RNAr 45S , moléculas deste RNAr, os fatores UBF e SLl, RNA polimerase I, parte das RNPnop etc. Às vezes
mostra zonas isoladas mais claras que correspondem às cópias inativas do gene.
2) A região granular, localizada na periferia, na qual se encontram subunidades dos ribossomas em diferentes estágios de processamento. Esta região - e, portanto, o nucléolo - não se
encontra envolvida por membrana alguma.
Como indicado no Cap. 13-8, as 200 cópias do gene do RNAr 45S estão distribuídas nas constrições secundárias dos cromossomos 13, 14, 15, 21e22 (Figs. 12.15 e 12.16). Dada a condição
•
F ig. 15,9 Processamento do
RNAr 455 , que dá lugar aos
R Ar 185 , 5,85 e 285.
243
244
•
O PROCESSAMENTO DO R A
Fig. 15.10 Eletromicrografia de um nucléolo com suas porções fibril ar (j) e granular (g) . A seta aponta
para materiais saindo em direção ao citopl asma através de um poro nuc lear. Aumento: 70.000 X. (Cortesia
de O. Mi ller. )
diplóide dos cromossomos, há 1Odessas constrições, razão pela qual existem, em média, 20 cópias do gene em cada uma. Os segmentos de DNA em que se acham esses genes emanam como
alças das constrições secundárias e em tomo delas se constrói o nucléolo. Cada alça - e, por
conseguinte, as cópias do gene contidas nela - representa uma unidade chamada de organizador
nucleolar. O tamanho do nucléolo varia com a necessidade de a célula gerar ribossomas. A variação depende da região granular, que se expande ou se retrai segundo o ritmo em que as subunidades ribossômicas são processadas.
Quando estas subunidades estão por terminar seu processamento, abandonam o nucléolo, passam ao citosol e saem do núcleo pelos poros do envoltório nuclear. Como o diâmetro das subunidades supera o diâmetro dos poros, deve ocorrer uma modificação conformacional em uma das
duas estruturas - ou em ambas - para que a passagem possa se concretizar.
O processamento das subunidades ribossômicas se completa no citoplasma. Isso evita a formação de ribossomas completos no nucleoplasma e o risco de serem sintetizadas proteínas no
interior do núcleo.
PROCESSAMENTO DO RNA RIBOSSÔMICO SS
15- 1O. O RNAr SS entra no nucléolo
Uma vez sintetizado , o RNAr SS in gressa no nucléolo e se incorpora à subunidade ribos sômica maior. Não se sabe por que este RNAr é sintetizado em um lugar diferente dos ou tros RNAr.
Como os outros RNA ribossômicos, o RNAr SS estabelece sua configuração tridimensional graças a emparelhamentos de seqüências complementares de sua própria molécula (Fig.
15.11 ).
O PROCESS AMENTO DO RNA
•
Fig. 15.11 Forma como se
emparelham as seqüências
complementares nos RNA
ribossômicos.
PROCfSSAMENTO DOS RNA DE TRANSFERÊNCIA
15-11. O processamento dos RNAt inclui modificações em alguns
de seus nucleotídeos
Os RNAt contêm entre 74 e 95 nucleotídeos. Seu processamento inclui a remoção de um íntron, que é eliminado por um mecanismo diferente do utilizado pelos RNAm, pois prescinde do
espliceossoma.
Ademais, em cada tipo de RNAt, um determinado grupo de nucleotídeos sofre alterações químicas (Fig. 16.3). Assim, algumas U são transformadas empseudo-uridinas (i.f;), outras são metiladas a ribotimidinas (T) e outras reduzidas a diidrouridinas (D). Também é comum que algumas A, C e G sejam metiladas (mA, mC e mG) e que uma ou mais A sejam convertidas em inosinas
(l).
Como mostram as Figs. 16.3 e 16.4, os RNAt contêm seqüências de nucleotídeos complementares que se emparelham entre si, o que faz com que adquiram a forma de uma folha de trevo e
depois a forma da letra L.
O processamento culmina com a substituição do trinucleotídeo AAA - presente na extremidade 3' dos transcritos primários de todos os RNAt - pelo trinucleotídeo CCA. No Cap. 16-6,
avaliaremos a importância desta substituição.
PROCESSAMENTO DOS RNA PEQUENOS
1·5-12. Os RNA pequenos associam-se a proteínas
Tão logo os RNAnp acabam de ser sintetizados, os nucleotídeos complementares de suas próprias moléculas se pareiam entre si (Fig. 15 .5). Em seg uida, os RNAnp saem para o citosol, são
trimetilados na extremidade 5' e combinados com um complexo de sete proteínas denominadas
Sm (do inglês, small protein) , que têm a forma de anel, igual para todos os RNAnp. Finalmente,
os RNAnp unidos às Sm retornam ao núcleo e se associam a outras proteínas, desta vez específicas para cada tipo de RNAnp. Convém lembrar que o descrito até aqui vale somente para os RNAnp
que intervêm nos cortes e nas emendas dos RNAm, pois do processamento dos restantes muito
pouco é conhecido; como, por exemplo, o fato de que a trimetilação da extremidade 5' de alguns
destes RNAnp não ocorre no citosol e sim no núcleo.
245
246
•
O PROCESSAMENTO DO R1 A
Antes de sair do núcleo, o RNAcp sofre algumas das seguintes alterações: 1) várias seqüências
complementares de sua molécula se pareiam entre si; 2) associa-se a seis proteínas diferentes, o
que dá lugar ao complexo nucleoprotéico PRS (Cap. 7-1 2). Na Fig. 7.10 estão indicados os pesos
moleculares das seis proteínas e se vê como se associam com os RNAcp e entre si.
PROCESSAMENTO DO RNAxist, DO RNAte E DOS miRNA
15-13. O RNAxist e o RNAte permanecem no núcleo e os miRNA
saem para o citoplasma
miRNA
5':
r~-,,____1
§)
3': : = = = =
Fig. 15.12 Forma dos RNA
precursores dos miRNA.
O RNAxist permanece no núcleo, já que como dissemos no Cap. 14-12, une-se ao cromossomo X compactado das células da mulher (corpúsculo de Barr).
O RNAte também permanece no núcleo. Uma das etapas salientes de seu processamento o
associa com um grupo de proteínas que participam da formação da telomerase.
Por seu turno, os miRNA são gerados a partir de transcritos primários de cerca de 70 nucleotídeos que saem para o citoplasma. Cada transcrito inclui um par de seqüências complementares
- estas derivadas das repetições invertidas do gene (Cap. 13-1 2) - , que se pareiam entre si e
produzem um RNA duplo com a forma de forquilha (Fig. 15.12). Finalmente, o miRNA definitivo -que tem 21 nucleotídeos e, como mostra a Fig. 15.12, é uma molécula de RNA simplesse desprende da forquilha depois de ser escindido pela endonuclease citoplasmática Dicer (do verbo
inglês to dice , que significa "cortar em cubos de tamanho uniforme"). No Cap. 23-44, analisamos
as prováveis funções dos miRNA nas células humanas.
BIBLIOGRAFIA
Anderson K. and Moore M.J. (1 997) Bimolec ul ar exon ligation by the
human spliceosome. Science 276: 1712.
Bachellerie J.P. and Cavaillé J. (1997) Guiding ribose methylation od
rRNA. TIBS 22:257.
Breitbart R.E., Andreadis A. and Nadal-Ginard B. (1987) Altemative
splicing: a ubiquitous mechanism for the generation of multiple protein isoforms from single genes. Annu. Rev. Biachem. 56:467 .
Cech T.R. (2000) The ribosome is a ribozyme. Science 289:878 .
Darnell J.E. Jr. (1983) The processing of RNA . Sei. Am. 249:90.
Draper D.E. (1996) Strategies for RNA folding. TIBS 21 :145 .
Green M.R. (1991) Biochemical mechanism s of constitu tive and
regulated pre-mRNA splicing. Annu. Rev . Cell Biol. 7 :559.
Guo Z. and Shennan F. (1 996) 3' -end-forming signals of yeast mRNA.
TIBS 21:477.
Guthrie C. and Patterson B. (1988) Spliceosomal snRNAs . Ann u. Rev.
Genet. 22:387.
Hutvágner G. and Zamore P.D. (2002) A mícroRNA in a multiple-turnover RNAi enzyme complex. Science 297 :2056.
· Kreivi J.P. and Lamond A.I. (1996) RNA splicing: unexpected spliceosome diversity. Curr. Biol. 6:802.
Lindahl T. et ai. (1995 ) Post-translational modification of poly
(ADP-ribose) pol ymerase induced by DNA strand breaks . TIBS
20:405.
McDevitt M.A., Gilmartin G.M. and Nevins J.R . (1988) Multiple fact~rs are required for poly(A) addition to a mRNA 3' end. Genes Dev .
2:588.
Nilsen T .W. (1996) A parallel spliceosome. Science 273:1813.
Nishikura K. and De Robertis E.M. (1981) RNA processing in microin-
jected Xenopus oocytes: Sequential of base modifications in a spliced transfer RNA. J. Mol. Biol. 145 :405.
Padgett R.A. et ai. (1986) Splicing of messenger RNA precursors. Annu.
Rev. Biachem. 55:1119.
Peculis B. (1997) RNA processing: Pocket guides to ribosomal RNA.
Curr. Biol. 7:R480.
Pellizzoni L., Yong J. and Dreyfu ss G. (2002) Essential role for the SMN
complex in the specificity of snRNP assembly. Science 298: 1775.
Rio D.C. (1992) RNA binding proteins, splice site selection, and
alternative pre-mRNA splicing. Gene Express. 2: 1.
Rossi J.J. (1999) Ribozymes in the nucleolus. Science 285:1685.
Shatkin A.J. (1976) Capping of eukaryotic mRNAs . Cell 9:645.
Smith J.D. (1976) Transcription and processing of transfer RNA precursor. Prog. Nucleic Acid Res. 16:25.
Terns M .P. and Dahlberg J.E. (1994) Retention ahd 5' cap trimethylation
of U3 snRNA in the nucleus. Science 264:959.
Tollervey D. (1996) Small nucleolar RNAs guide ribosomal RNA
methylation. Science 273:1056.
Valcárcel J. and Green M.R. (1996) The SR protein family : pleiotropic
functions in pre-mRNA splicing. TIBS 21:296.
Wahle E. and Keller W. (1996) The biochemistry of polyadenylation.
TIBS 21:247 .
Will C.L. et ai. (1 999) Identification of both shared and distinct proteins in the major and minor spliceosomes. Science 284:2003.
Wise J. A. (1993) Guides to the heart of the spliceosome. Science
262 : 1978 .
Wu Q. and Krainer A.R. (1996) Ul-mediated exon definition interactions between AT-AC and GT-AG introns. Science 274:1005.
A tradução do RNAm
Síntese de proteínas
16-1. Os RNAt desempenham uma função básica na síntese das proteínas
A síntese proté ica ocorre no ribossoma, montado no citosol a partir de duas s ubunidades
ribonucleoprotéicas provenientes do nucléolo. o ribossoma, o RNA mensageiro (RNAm) se
traduz em uma proteína, para o que é necessária também a intervenção dos RNA de transferência (RNAt). O trabalho dos R Até extrair os aminoácidos do citosol e conduzi-los ao ribossoma
na ·ordem marcada pelos nucleotídeos do RNArn , que são os modelos do sistema.
A síntese de uma proteína começa com a união entre si de dois aminoácidos e continua pela
agrega~ão de novos aminoácidos - um de cada vez - em uma das extremidades da cadeia protéica.
Como vimos no Cap. 13-4, a chave da tradução reside no código genético, composto por combinações de três nucleotídeos consecutivos - ou trincas - no RNAm. As diferentes trincas relacionam-se especificamente com os 20 tipos de aminoácidos usados na síntese das proteínas.
Cada trinca constitui um códon; há um total de 64 códons , 61 dos guais servem para cifrar
aminoáciâos e três para marcar o ténnino da tradução. Esta quantidade s~eriva âe uma relação
matemática simples : os quatro nucleorídeõS(A, U, C e G) combinam-se três a três e, por isso,
podem gerar 64 (4 3) combinações. O código genético, com as 64 trincas e os aminoácidos que
especificam, pode ser consultado na Fig. 13.4.
Visto que existem mais códons (6 1) do que tipos de aminoácidos (20), quase todos podem ser
reconhecidos por mais de um códon, e por isso algumas trincas atuam como "sinônimos". Somente o triptofano e a metionina - dois dos aminoácidos menos freqüentes nas proteínas - são codificados , cada um por um único códon.
Geralmente, os códons que representam um mesmo aminoácido se parecem entre si e é freqüente que difiram somente no terceiro nucleotídeo (Fig . 13.4). A baixa especificidade deste nucleotídeo levou a dizer que existe uma "degeneração" na terceira base da maioria dos códons.
Resta acrescentar que o número de códons no RNAm determina o comprimento da proteína.
~
-·
16-2. Existem 31 tipos diferentes de RNAt
As moléculas intermediárias entre os códons do RNAm e os aminoácidos são os RNAt, os quais
um domínio que se liga especificamente a um dos 20 aminoácidos e outro que o faz, especificamente também, ao códon apropriado. O segundo domínio consta de uma combinação de três
nucleotídeos - chamada anticódon - que é complementar da combinação do códon (Fig. 16. l ).
Cada tipo de RNAt leva antes dele o nome do aminoácido que transporta; por exemplo, leucinilRNAt para o aminoacil-RNAt da leucina, lisinil-RNAt para o da lisina, fen ilalanil-RNAt para o
da fenilal anina, metionil-RNAt para o da metionina etc.
Por sua vez, o RNAt unido ao aminoácido compatível com ele é designado aminoacil-RNAtAA,
no qual o "AA" corresponde à sigla do aminoácido. Por exemplo, leucinil-RNAtLeu, lisinil-RNAtLys,
fenilalanil-RNAtPhe, metionil-RNAtMec etc.
Embora, teoricamente, possam existir 61 tipos de RNAt diferentes, só há 31. O déficit ocorre
pela capacidade de alguns RNAt reconhecer mais de um códon. Conseguem esta proeza porque
t~m
16
248
•
A TRADUÇÃO DO RNAm
Fig. 16.1 Os desenhos ilustram
quatro de seis códons que
codificam o aminoácido leucina
(Leu) . Os dois da esquerda
emparelham-se com o mesmo
anticódon, igual ao par de
códons da direita. Isso é possível
porque a terceira base dos
códons pode ser "adaptada",
quer dizer, pode estabelecer
uniões com uma base não
complementar.
f
uu
Leu
GAG
cuc
5' ..LLL. 3•
Leu
Leu
GAG
cuu
5' ..LLL. 3'
RNAm
u
Leu
5'
GAU
CUA
GAU
CUG
5•..LLL. 3'
5•.LLJ.. 3•
seus anticódons podem possuir a primeira base "adaptáveI'', quer dizer, que pode unir-se a uma
base não complementar situada na terceira posição do códon (lembre-se da "degeneração" desta
base).
Desta forma , a G na primeira posição do anticódon pode ser emparelhada tanto com uma C que é o habitual- quanto com uma U do códon (Fig. 16.1). Similarmente, a Una primeira posição do anticódon pode fazê-lo com uma A - o que é o habitual - ou com uma G. Por outro lado,
a inosina (I) - uma das bases não usuais mencionadas no Cap. 15-11 - encontra-se na primeira
posição do anticódon, em vários RNAt, e é capaz de se emparelhar com qualquer base (exceto
com uma G) localizada na terceira posição do códon.
~16-3. O códon de iniciação é a trinca AUG VAH JUi
O primeiro códon traduzido nos RNAm é sempre a trinca AUG, cuja informação codifica o
aminoácido metionina (Figs. 13.4 e 16.2). Portanto, este códon cumpre duas funções: assinala o
local do começo da tradução - caso no qual recebe o nome de códon de iniciação - e quando
se acha em outras localizações no R Am codifica as metioninas do interior da molécula protéica.
Ao especificar o primeiro aminoácido da proteína, o códon AUG de iniciação determina o
enquadramento das sucessivas trincas, o que assegura a síntese correta da molécula. Tome-se
como exemplo a seqüência AUGGCCUGUAACGGU. Se o RNAm for traduzido a partir do códon AUG, os códons seguintes serão GCC, UGU, AAC e GGU, que codificam respectivamente
os aminoácidos alanina, cistina, asparagina e glicina. Em contrapartida, se fosse omitida a A do
códon de iniciação, o enquadramento das trincas seria o seguinte: UGG , CCU, GUA e ACG, que
se traduzem nos aminoácidos triprofano, prolina, valina e treonina, respectivamente. Algo semelhante ocorreria também se fosse omitida a U, pois resultaria um terceiro tipo de enquadramento:
GGC, CUG, UAA e CGG. Neste caso, depois de codificar os dois primeiros códons aos aminoácidos glicina e leucina, a tradução se deteria, já que UAA é um códon de terminação.
16- 4. Os aminoácidos se ligam por meio de ligações peptídicas
A união dos aminoácidos entre si para construir uma proteína ocorre de modo que o grupo
carboxila de um aminoácido se combina com o grupo amina do aminoácido seguinte, com a perda
de uma molécula de Hp (Fig. 2.26). No Cap. 2-8 vimos que essa combinação é chamada ligação
peptídica.
Qualquer que seja seu comprimento, a proteína mantém o caráter anfotérico dos aminoácidos
isolados , já que contém um grupo amina livre em uma de suas extremidades e um grupo carboxila
na outra extremidade. A proteína é sintetizada a partir da extremidade que leva o grupo amina
livre. Isso se corresponde com a direção 5' ~3 ' usada para a tradução do RNAm, a mesma com a
qual o DNA é transcrito (Fig. 16.9).
Antes de descrever os processos que dão lugar à síntese das proteínas, analisaremos como os
RNAm chegam ao citoplasma, que configurações possuem os RNAt e qual a estrutura dos ribossomas.
3'
Fig.16.2 Esquema de um RNA
mensageiro (RNAm) , com seus
diferentes éomponentes.
cap
l
Proteín....a_ _ _ _ _ _ _ _....
A TRADUÇÃO DO RNAm
•
249
16-5. Os RNAm que chegam ao citoplasma se conectam com os ribossomas
Como vimos no Cap. 14-5, no núcleo os transcritos primários dos RNAm se acham combinados com diversas proteínas com as quais formam as ribon ucleoproteínas heterogêneas nucleares
ou RNPhn. No entanto, muitas dessas proteínas se desprendem dos RNAm à medida que estes
abandonam o núcleo.
Os RNAm saem para o citoplasma pelos poros do envoltório nuclear. Já no citosol, cada RNAm
se combina com novas proteínas e com ribossomas , o que o habilita para exercer sua função codificadora entre a síntese protéica. Entre as proteínas está a chamada CBP (do inglês, cap binding
protein), que se combina com o cap na extremidade 5' do RNAm. Seu papel será analisado na
Seção 16- 12.
Alguns RNAm estão localizados em locais prefixados no citoplasma, de modo que as proteínas que codificam são sintetizadas e se concentram nesses locais. Um exemplo é o RNAm da actina,
que se situa na zona periférica das células epiteliais, onde está depositada a maior parte da actina
(Cap. 5-20).
A extremidade 5 ' dos RNAm contém uma seqüência de cerca de 10 nucleotídeos antes do códon de iniciação - entre este e o cap - que, como é lógico, não se traduz (Fig. 16.2). Em alguns
RNAm , esta seqüência participa do controle da tradução e, em outros, reg ula a estabilidade do
RNAm, ou seja, sua sobrevivência.
Outra seqüência especial do RNAm, de até milhares de nucleotídeos , pode ser encontrada depois do códon de terminação, entre este e a poli A (Fig. 16.2). Sua função é controlar a sobrevivência do RNAm.
16-6. Às moléculas dos RNAt adquirem uma forma característica
Já vimos que os códons do RNAm não selecionam os aminoácidos diretamente. Durante a tradução, essa função é reali zada pelos RNAt , algumas moléculas intermediárias desenhadas para
discriminar os códons e os aminoácidos compatíveis com eles. Desta forma, a principal função
dos RNAt é alinhar os aminoácidos seguindo a ordem marcada pelos códons do RNAm.
A fim de exercer suas funções , os RNAt adquirem uma forma característica, primeiro parecida
com uma folha de trevo e, em seguida, com a letra L. Como mostram as Figs. 16.3 e 16.4, os
Códon
,
5
RNAm - - U U C
y
u
mC
A
'!' -
A
mC UG-
G
A
C
AG -
e
AlçaT
'1' T
G
mA
G
1
u e
e
u
1
A
u
1
1
A
Alça anticódon
C
mG
e
e
G U mC
e
.
A A mG
Anticódon
Alça variável G
mG
3
--+
1
mG
A
1
G
GG
G A G A
1
1
e u e
G
Alça D
1
A
D
G D
u
AU
A-U
UA
U
G
C-
G
GC-
C
G s'
A
@ Extremidade aceptora
3' ~
Fig. 16.3 Modelo em folha de
trevo dos RNAt.
250
•
A TRADUÇÃO DO RNAm
quatro braços da folha de trevo são gerados porque os RNAt possuem quatro pares de seqüências
complementares - de 3 a 6 nucleotídeos cada uma - que se emparelham como o fazem as duas
cadeias do D A.
As extremidades 5' e 3' dos RNAt encontram-se juntas na ponta de um dos braços , que recebe
o nome de extremidade aceptora (ou aceptor) por acolher o aminoácido. Este se conecta com o
último nucleotídeo da extremidade 3' do RNAt, ou seja, com a adenina do trinucleotídeo CCA
formado durante o processamento (Cap. 15. 11) (Fig. 16.4).
Os outros braços da fo lha de trevo apresentam em suas partes distais seqüências de 7 a 8 nucleotídeos não emparelhados, com forma de alças, cuj as denominações derivam-se dos nucleotídeos
que as caracterizam. Uma delas, por contar com o trinucleotídeo Tt!JC , é conhecida como alça T
(no Cap. 15- 11 dissemos que a letra T simboliza a ribotimidina e a t!J simboliza a pseudo-uridina).
Outra, em virtude de conter diidrouridinas (estas se identificam com a letra D), denomina-se alça
D. A terceira contém a trinca de nucleotídeos do anticódon e por isso se chama alça anticódon
(obviamente sua composição varia nos diférentes tipos de RNAt).
Existe uma alça adicional entre a alça Te a alça anticódon. Devido ao fato de seu comprimento
diferir em cada tipo de RNAt, recebe o nome de alça variável.
O dobramento posterior dos RNAt faz com que deixem de se parecer com uma folha de trevo,
passando a adquirir a fo rma da letra L. Isto é devido a alguns nucleotídeos estabelecerem emparelhamentos não usuais entre si, como, por exemplo , a combinação de um nucleotídeo com dois
simultaneamente. A Fig. 16.4 mostra que ao final deste dobramento, a alça anticódon se encontra
em uma das pontas do L , a extremidade aceptora na outra ponta, e as alças D e T ficam juntas na
zona de união de ambos os braços.
16- 7. Um aminoacil-RNAt sintetase une o aminoácido ao RNAt
O aminoácido é ligado ao seu correspondente RNAt pela ação de uma enzima chamada de
aminoacil-RNAt sintetase, que catal isa a união em duas etapas.
Durante a primeira, o aminoácido se liga a um AMP, com o qual forma um aminoacil-AMP.
Por exemplo, leucinil-AMP, lisinil-AMP, fenil alanil-AMP, metionil-AMP etc. Tendo em vista que
o AMP se deriva da hidrólise de um ATP , é liberado um pirofosfato (PP) e energia, que também
passa para o aminoacil-AMP.
u
1
Il
a
o
p
o
d
1
aJ
lll
Fi
id
s
c
AA + ATP-'_sin1e1
mi_"º'ase
-''1- - . AA -AMP + PP
Na segunda etapa, essa energia é utilizada pela aminoacil-RNAt sintetase para transferir o
aminoácido do aminoacil-AMP para a A da extremidade aceptora do RNAt compatível, com o
qual se forma uma molécula essencial à síntese protéica: o aminoacil-RNAtAA que reconhece o
códon complementar no RNAm (Fig. 16.4) .
AA -AMP + RNAt - -'sintetase
m_ino_"'-1 ~ AA -RNAt AA + AMP
Devemos assinalar que a energia do ATP, usada na primeira reação, fica depositada na ligação
química entre o aminoácido e a A do trinucleotídeo CCA.
Anticódon
Alça anticódon
Fig. 16.4 Estrutura terciária dos
RNAt, que acaba em uma
configuração em L. A moléc ula
da direita é um aminoacilRNAtAA porque a extremidade
aceptora do RNAt contém um
aminoácido (AA). Observar que
este se encontra conectado à
adenina do trinucleotídeo CCA.
Alça variável
Alça D
AlçaT
Extremidade
aceptora
da
A TRADUÇÃO DO RNAm
•
16- 8. Existem 20 aminoacil - RNAt sintetases diferentes
A célula possui 20 aminoacil-RNAt sintetases diferentes, cada uma desenhada para reconhecer um aminoácido e o RNAt compatível com ele. Ambos os reconhecimentos permitem que cada
um dos 31 tipos de RNAt se ligue somente a um dos 20 aminoácidos usados na síntese protéica.
Isso é possível porque cada aminoacil-RNAt sintetase identifica o RNAt pelo anticódon, a parte
mais específica do RNAt (Fig. 16.3). Todavia, nos RNAt existem outros sinais que são reconhecidos pela enzima, geralmente segmentos de nucleotídeos próximos ao anticódon .
Como é óbvio , a existência de 11 tipos de RNAt em excesso - ou redundantes - faz com que
alguns aminoácidos sejam reconhecidos por mais de um RNAt.
Um dos RNAt redundantes é o chamado RNAt iniciador ou RNAt[i] , pois transporta a metionina destinada exclusivamente ao códon AUG de iniciação (Fig. 16.9). É muito provável que
próximo desse códon ex istam sinais que diferenciem o metionil-RNAt[i]Me• - portador da metionina dirigida a ele - dos me t ionil - RNAt~1e, comuns, portadores das metioninas destinadas aos
demais códons AUG do R Am.
16- 9. Os ribossomas são compostos por duas subunidades -il<
Os mecanismos para alinhar os aminoacil-RNAr1A de acordo com a ordem dos códons do RNAm
são um pouco complicados. Necessitam dos ribossomas, cuj a primeira tarefa é localizar o códon
AUG de iniciação e acomodá-lo corretamente para que o enquadramento dessa trinca e das trincas seguintes seja adequado (Seção 16-3) .
Depois o ribossoma desliza para a extremidade 3' do RNAm e traduz sucessivas trincas em
aminoáêidos. Estes são trazidos - um de cada vez - pelos respectivos RNAt. As reações que
ligam os aminoácidos entre si - ou seja, as ligações peptídicas - ocorrem dentro do ribossoma.
Finalmente, quando o ribossoma chega ao códon de terminação - na extremidade 3' do RNAm
- cessa a síntese protéica e a proteína é liberada. Como vemos, os ribossomas constituem as "fábricas" das proteínas.
Cada 1ibossoma está composto por duas subunidades - uma rrienor e outra maior - que são
identificadas pelas siglas 40S e 60S, respectivamente (Figs. 7.4 e 16.5) . A letra S se refere à unidade
Svedberg de sedimentação e os números correspondem aos coeficientes de sedimentação das partícul as que são an ali sadas, ou seja, às vel ocidades com qu e se sedim entam qu ando são
ultracentrifugadas . Desta fo1ma, das duas subunidades do ribossoma, a 60S é a que migra mais rapidamente até o fundo do tubo por ação da força centrífuga. Juntas, as subunidades 40S e 60S formam
33 proteínas diferentes
50 proteínas diferentes
~
RNAr 5,8S
RNAr 28S
RNAr 18S
Subunidade
menor
RNAr 5S
Subunidade
maior
Ribossoma
Fig. 16.5 Moléculas que
participam da formação dos
ribossomas citosólicos .
251
252
•
A TR ADUÇÃO DO Rl'l"Am
a unidade SOS que representa o ribossoma completo (os números não se adicionam porque os coeficientes de sedimentação, embora se relacionem, não equivalem aos pesos das partículas).
Cada subunidade ribossômica é composta por uma ou mais moléculas de RNAr mais um determinado número de proteínas. Assim, a subunidade maior contém os RNAr 28S, 5,88S e 5S mais
50 proteínas; a subunidade menor contém o RNAr 18S mais 33 proteínas (Fig. 16.5). As proteínas
da subunidade maior são denominadas Ll , L2 [ ... ] L50 (do inglês, L de large), e as da subunidade
menor Sl , S2 [ .. .] S33 (do inglês, S de small).
Devido as 83 proteínas ribossômicas serem construídas a partir de outros tantos RNAm , podemos dizer que os componentes do ribossoma se derivam de 85 genes (83 correspondem às proteínas, um ao RNAr 45S e outro ao RNAr 5S).
16-1 O. As estruturas e funções das duas subunidades do
ribossoma são conhecidas
A subunidade menor do ribossoma tem a fo rma muito irregular. Em uma de suas faces - a
que se relaciona com a subunidade maior- existe um canal por onde desliza o RNAm (Fig. 16.6).
Junto ao canal, observam-se três áreas escavadas contíguas - denominadas sítio A (de aminoacil), sítio P (de peptidil) e sítio E (do inglês, exit, saída) - , cujas funções serão analisadas na
Seção 16-12. A Fig. 16.9 mostra as localizações relativas aos sítios A, P e E.
A subunidade maior também é muito irregular. De uma de suas faces - a que se relaciona
com o canal e os sítios A, P e E da subunidade menor - nasce um canal desenhado para que a
proteína saia do ribossoma à medida que é sintetizada (Fig. 16.6).
Ambas as subunidades repartem o trabalho que o ribossoma realiza. A subunidade menor coloca juntos os RNAt para que os aminoácidos que transportam se liguem entre si, quer dizer, para
que ocorram as ligações peptídicas. Por outro lado , a subunidade maior catalisa essas ligações e
ajuda os fatores que regulam a síntese protéica (Seções 16-12 a 16-14). Devemos assinalar que a
função catalítica da subunidade maior não está a cargo de uma de suas proteínas e sim de um de
seus RNAr, que funciona como um~ ribozima (Cap. 2-12).
16-11. Os polirribossomas são formado s quando uma molécula de
RNAm se associa a muitos ribossomas
Cada RNAm pode ser traduzido por vários ribossomas simultaneamente, que deslizam por ele
na direção 5 ' ~ 3' em fila indiana, separados entre si por uma distância de cerca de 30 códons.
Como descrevemos no Cap. 7-5 , a associação de um RNAm com vários ribossomas é chamada de
polissoma ou polirribossoma (Fig. 16.7). As Figs. 1.10 e 7.3 mostram que é claramente detectável nas imagens ultramicroscópicas.
Os ribossomas estão livres no citosol ou ligados à membrana do RE (Figs. 1.1 O, 7.4, 7 .6 e 16.8).
Os primeiros elaboram proteínas destinadas ao citosol, ao núcleo , às mitocôndrias e aos
Subunidade menor
Fig. 16.6 Esquema das duas
subunidades do ribossoma, com
as localizações do RNAm
(cortado transversalmente) e do
RNAt ligado ao aminoácido
(AA). A cadeia polipeptídica
percorre um canal situado na
subunidade maior.
Subunidade maior
NH 2
A TRADUÇÃO DO RNAm
---.º
NH 2
NH 2
NH2
•
253
Fig. 16.7 Formação do
polirribossoma pela associação
de vários horm ônios a um só
RNAm.
COOH
/
NH 2
peroxissomas. Os segundos elaboram proteínas que se inserem na membrana do RE ou se lançam
na luz da organela (Cap. 7-1 3); estas proteínas permanecerão no RE ou se transferirão - através
de vesículas de transporte - ao complexo de Golgi, de onde poderão passar aos endossamos, à
membrana plasmática ou sair para o exterior.
AS ETAPAS DA SÍNTESE PROTÉICA
A síntese das proteínas é dividida em três etapas, chamadas de iniciação, alongamento e terminação (Fig. 16.9).
~
6-12 . O começo da síntese protéica exige vários fatores de iniciação
A etapa de iniciação da síntese protéica é regulada por proteínas citosólicas denominadas fatores de iniciação (IF), que provocam dois eventos separados, porém concon-entes, um na extremidade 5' do RNAm e outro na subunidade menor do ribossoma.
O primeiro envolve o cape uma seqüência de nucleotídeos distantes, localizada entre o cape
o códon de iniciação (Seção 16-5). Estas partes do RNAm são reconhecidas pelo fator IF-4,-que
se liga a elas se o RNAm estiver unido à proteína CBP (Seção 16-5). A conexão do IF-4 com o
RNAm consome energia, que é provida por um ATP.
No segundo, o metionil-RNAt[i]M• 1 coloca-se no sítio P da subunidade menor do ribossoma.
Esta reação exige o fator IF-2 e gasta a energia de um .'.:fJ2.,\
Cumpridas as condições, outro fator de iniciação, o IF-3, w m a ajuda do IF-4, coloca a extremidade 5 ' do RNAm sobre a face da subunidade menor o ribossoma que tem os sítios E, P e A.
S' ~
Ô ~
tn ©
~tp
~~~~~
1~
~ - 3'
(
o
o
ººº
o
º~º QS,0 o<;]io
Fig. 16.8 Formação dos
polirribossomas li vres no citosol
e dos assoc iados ao retículo
endoplasmático rugoso.
254
•
A TRADUÇÃO DO RNAm
De imediato , a subunidade menor desliza pelo RNAm e detecta o códon AUG de iniciação,
que se coloca no sítio P. Como é lógico, o segundo códon do Rt"\IAm fica colocado ao lado, quer
dizer, no sítio A .
Entretanto , o metion il -RNAt[if 1e•, localizado no sítio P da subunidade menor, une-se ao códon
AUG de iniciação através de seu anticódon CAU (ÜÃC) . O acoplamento correto entre estas duas
trincas é imprescindível para assegurar o enquadramento normal dos códons seguintes do RNAm
nos sítios E , P e A da subunidade menor do ribossoma.
A etapa de iniciação acaba quando a subunidade maior se une à subunidade menor e o ribossoma é formado . ele se encontram os dois primeiros códons do RNAm : no sítio P, o códon Al.JG
de iniciação - unido ao metionil-RNAt[iY1e' - e no sítio A, o códon que o segue.
A união entre si das duas subunidades ribos ômicas ocorre à custa do fator IF-5, que atua depois que os fato res IF-2 e IF-3 se desprendem.
16- 13. O alongamento da cadeia protéica é promovido por
fatores de elongação
A etapa de alongamento da síntese protéica é regulada por fatores de elongação (EF). Começa
com o ingresso no ribossoma de um aminoacil-RNAt-,\A cujo anticódon é complementar do segundo
códon do RNAm, o qual, como mencionamos na seção anterior, está localizado no sítio A . Em seguida, o aminoacil-RNAt--1..A se localiza neste local e seu anticódon se liga ao segundo códon do RNAm,
o que é feito mediante o fator de alongamento EF-1 e a energia fornecida por um GTP.
A Fig. 16.9 mostra que o aminoacil-RNAtAA recém-chegado e o metionil-RNAt[i] Met do sítio P
ficam um do lado do outro , igualmente aos seus aminoácidos. Esta vizinhança é necessária para
que ambos os aminoácidos possam se ligar entre si por meio de uma ligação peptídica, fato que
ocorrerá em breve tempo.
Previamente, o ribossoma corre três nucleotídeos na direção da extremidade 3' do RNAm, e
por causa disso o códon de iniciação (e o metionil-RNAt[i]M<') transfere-se do sítio P para o sítio
E, o segundo códon (e o aminoacil-R AtAA) se transfere do sítio A para o sítio P, e o terceiro códon do RNAm se localiza no sítio A vago. Esta " caminhada", que se denomina translocação,
depende do fator de elongação EF-2 e da energia fornecida por um GTP.
Quando o metionil-RNAt[i]Me• ingressa no sítio E, sua metionina se desacopla do RNAt[i] e se
liga - por meio de uma ligação peptídica - ao aminoácido do aminoacil-RNAtAA situado no
sítio P. Como é lógico, o dipeptidil-RNAt que se forma substitui o aminoacil-RNAtAA no sítio P.
Depois de perder a metionina, o RNAt[i] se desconecta do códon de iniciação, abandona o sítio
E e se encaminha para a saída do ribossoma, o que determina o fim do primeiro episódio de alongamento da proteína.
O segundo começa quando um novo aminoacil-RNAtAA ingressa no ribossoma, localiza-se no
sítio A e seu anticódon se conecta com o terceiro RNAm , outra vez por meio do fator de alongação
EF- 1 e da energia de um GTP.
Depois , como o ribossoma volta a se translocar, o dipeptidil-RNAt e o aminoacil-RNAtAA se
trasladam dos sítios P e A para os sítios E e P , respectivamente, e o quarto códon do RNAm se
localiza no sítio A vago.
Ao final da translocação oc01Te a segunda ligação peptídica, agora entre o dipeptídeo do dipeptidil-RNAt e o aminoácido do terceiro aminoàcil-RNAtAA . Como mostra a Fig. 16.9, o tripeptidilRNAt que se forma fica localizado no sítio P.
Enquanto isso, o RNAt que cedeu o dipeptídeo abandona o sítio E e se dirige para a saída do
ribossoma, o que determina o final do segundo episódio do alongamento da proteína.
O que ocorre durante os primeiros episódios da etapa de alongamento da síntese protéica se
repete nos seguintes. Conseqüentemente, durante o terceiro episódio forma-se um tetrapeptidilRNAt, e, em seguida, peptidil-RNAt cada vez mais longos, cujas localizações alternam-se nos
sítios P e E à medida que ocorrem as translocações e se sucedem as ligações peptídicas. Calculase que , por segundo , são agregados à cadeia peptídica cerca de cinco aminoácidos.
A energia gasta durante a formação de cada ligação peptídica provém da ruptura da ligação
química entre o RNAt localizado no sítio E e seu aminoácido . Na Seção 16-7, dissemos que ao ser
A TRAD UÇÃO DO RNAm
u~
Mel
5'
1 1 f l
1 1 •
CUG U
GA
._,.....,
cap
{Term.)
3'
rTTT1
AAAAP
Poli A
3'
rTTT1
AAAAA
ALONGAM ENTO
A
3'
5'
3'
3'
5'
3'
CCUG
TERMINAÇÃO
......,3'
AAAAA
255
Fig. 16.9 Etapas de iniciação, de
alongamento e de terminação da
síntese protéica no ribossoma.
INICIAÇÃO
p
5'
•
. ___,
256
•
A TRADUÇÃO D O R.t\TAm
formado cada aminoacil-RNAr\'\ a união do aminoácido com a extremidade aceptora do RNAt
- mais precisamente com sua últim a adenina - consome a energia fornecida por um ATP. Portanto, a energia que a subunidade maior do ribossoma emprega para unir os aminoácidos é fornecida, em última instância, por esse ATP.
O cálculo da energia que se gasta por cada aminoácido que se incorpora a uma proteína em
formação mostra que a síntese protéica é um processo muito custoso, já que exige não somente o
ATP recém-mencionado, mas também os dois GTP mencionados anterionnente: o que é consumido no sítio A para que o aminoacil- Ar-~-\ se conecte com o RNAm e o que é gasto na translocação .
Como dissemo , com cada translocação o ribossoma se distancia da extremidade 5' do RNAm
e se aproxima da extremidade 3' . Vale a pena acrescentar que quando o ribossoma se encontra
cerca de 30 códons do códon de iniciação, este é abordado por um segundo ribossoma e começa
a síntese de uma nova cópia da proteína. Tendo em vista que isso se repete muitas vezes, ao final
de um tempo encontram-se múltiplos ribossomas ao longo de todo o RNAm, separados entre si
por períodos de 30 códons (Figs. 1.10, 7.4, 7.6, 16.7 e 16.8). Na Seção 16-11 , dissemos que essa
associação recebe o nome de polirribossoma.
16-14. A síntese protéica se conclui quando o ribossoma alcança o
códon de terminação
A etapa de terminação da síntese protéica é regulada por fatores de terminação - identificados com a sigla eRF (do inglês, eukaryotic releasing factor) - e oco!l'e depois da última translocação, isto é, quando o códon de terminação do RNAm (UAA, UGA ou UAG, indistintamente)
chega ao sítio A do ribossoma. Devido ao fa to de ele deixar o sítio A sem o aminoacil-RNAtAA
esperado, é ocupado pelo fator eRF-1, que é capaz de reconhecer os três códons de terminação
(Fig. 16.9).
Diante da ausência de um novo aminoacil-RNAtAA, o polipeptídeo do peptidil-RNAt- situ ado no sítio P - se desliga do último RNAt e se torna independente do RNAm e do ribossoma. O
desprendimento do polipeptídeo depende do fator eRF -3 e também requer energia, que é retirada
de um GTP.
De imediato, as subunidades maior e menor do ribossoma se separam do RNAm. No citosol,
passam a integrar um fundo comum qUe abastece de subunidades 1ibossômicas para a fo1mação
de novos ribossomas no mesmo RNAm ou em outros que estão sendo traduzidos ou que vão começar a fazê-lo (Fig. 16.8).
O número de ribossomas no polill'ibossoma, ou seja, a soma de sítios nos quais ocoll'e a síntese
de uma proteína, se mantém de forma relativamente constante. É que quando um ribossoma abandon a a extremidade 3' do RNAm, outro se encaixa na extremidade 5' (Fig. 16.8).
Como veremos nas Seções 16-20 e 16-21 , esta síntese continuada de uma proteína a partir de
um mesmo RNAm - pelo trabalho simultâneo de vários ribossomas - é inteITompida, no momento oportuno, pela ação de fatores reguladores.
16-15. Dois temas médicos·vinculados com a atividade dos ribossomas
Ao serem invadidas por bactérias, as células de alguns organismos inferiores elaboram substâncias chamadas antibióticos para se defender da infecção. Em muitos casos, os antibióticos alcançam os seus objetivos interferindo na síntese protéica dos ribossomas das bactérias, o que as
mata. Por exemplo, o cloranfenicol impede as ligações peptídicas, a tetraciclina não permite que
os aminoacil-RNAtAA ingressem no sítio A, a kirromicina inibe a atividade dos fatores de elongação, a estreptomicina afeta o início da tradução e distorce a fidelidade da síntese. A eritromicina bloqueia a translocação do RNAm e apuromicina usurpa o sítio A do ribossoma, de modo
que a cadeia peptídica se liga ao antibiótico e não a um am inoacil-RNAtAA, o que inteITompe
sua síntese.
A medicina trasladou esses efeitos a outras condições biológicas, particularmente ao organismo humano. Deste modo , quando determinadas bactérias o infectam , essas podem ser destruídas
mediante administração de antibióticos.
A TRADUÇÃO DO RNAm
Ferro suficiente cap
---- AUG -~º
~-a
~--a
r-<<----- AAAA
:~connase
Ferroinsuficiente Ci!P
AUG - - -- -- - -- - - AAAA
Devemos advertir que a puromicina também afeta os ribossomas das células eucariontes e, por
esse motivo, seu uso farmacológico é muito restrito. o que diz respeito, o cloranfenicol, a eritromicina, a tetraciclina e a kirrornicina, embora interfiram levemente na síntese protéica dos ribossomas eucarióticos citosólicos, afetam muito mais a dos ribossomas das mitocôndrias, o que reflete a possível origem procariótica destas organelas (Caps. 8-26 e 8-29).
Outro tema médico vinculado aos ribossomas corresponde ao mecanismo e ação da toxina
diftérica, que ingressa na célula por endocitose e ribosila o fator de elongação EF-2, o qual o anula. Isso conduz em pouco tempo à morte celular.
16-16. A metionina situada na extremidade amina da proteína
pode ser removida
o
1:-
[)
L
o
Várias vezes assinalamos que a tradução do RNAm ocorre na direção 5' ~3' e que o aminoácido cifrado pelo códon de iniciação, na extremidade 5' do RNAm, é uma metionina. Portanto, a
ela pertence o grupo amina livre da cadeia protéica em fo1mação. Esta metionina geralmente é
removida de maneira que o segundo aminoácido passa à primeira posição.
Na extremidade oposta da proteína encontra-se o aminoácido que leva o grupo carboxila livre
da cadeia protéica, determinado pelo trinca prévia ao códon de terminação.
Destes dados deduz-se que, em cada ligação peptídica que ocorre no ribossoma,. o grupo carboxila é fornecido pelo último aminoácido da cadeia peptídica em crescimento (situada no sítio P)
e o grupo amina é cedido pelo aminoácido aminoacil-RNAtAA (localizado no sítio A) .
16-17. As proteínas provenientes dos ribossomas portam sinais que as
conduzem_para seus lugares de residência
~
1-
e
t-
le
1-
e
Teoricamente, uma célula dispõe dos recursos necessários para sintetizar cerca de 15.000 proteínas diferentes. Emanadas dos ribossomas, essas proteínas podem permanecer no citosol ou ter
como destino o núcleo, as mitocôndrias, os peroxissomas ou o retículo endoplasmático.
Por exemplo , as tubulinas e as enzimas da glicólise permanecem no citosol, as histonas e as
proteínas ribossômicas cruzam os poros nucleares e ingressam no núcleo , as enzimas do ciclo de
Krebs atravessam as duas membranas da mitocôndria e alcançam a matriz mitocondrial, a catalase passa através da membrana do peroxissoma e chega a sua matriz etc. As proteínas destinadas
ao retículo endoplasmático situam-se na membrana ou no interior da organela depois que os ribossomas estabelecem uma íntima relação com ele no setor do RE chamado rugoso (Cap. 7-5).
Um tráfego tão seletivo obriga as proteínas surgidas dos ribossomas - exceto as que ficarão
no citosol - a portar sinais que as conduzam às organelas apropriadas, e estas devem ter os re.ceptores específicos que reconheçam esses sinais. Nas proteínas, os sinais são representados por
determinadas seqüências curtas de aminoácidos denominadas peptídeo sinalizador (ou peptídeo
sinal) (Quadro 4.1 ).
t-
io
16-18. A existência de chaperonas assegu ra a correta formação das
estruturas secundárias e terciárias das proteínas
le
Quando os polipeptídeos surgem dos ribossomas, seus átomos tendem a estabelecer as combinações químicas que dão lugar à fmmação das estruturas terciárias e quaternárias que caracterizam as proteínas (Cap. 2-9). Esses processos são controlados pelas proteínas chaperonas que foram
mencionadas nos Caps. 4-5, 7-15, 8-28 e 10-5.
•
257
Fig. 16.10 Regulação da
tradução do RNAm da ferritina.
258
•
A TRADUÇÃO DOR 1Am
REGULAÇÃO DA TRADUÇÃO DOS RNA MENSAGEIROS E DA
DEGRADAÇÃO DAS PRO TEÍNAS
;}(. 16-19. A síntese protéica, a sobrevivência dos RNAm e a degradação das
proteínas são reguladas
Nos dois capítulos anteriores assinalamos os mecanismos de regulação mais amplos para decidir quais proteínas a célula deve sintetizar operando ao nível da transcrição do DNA'e do processamento do R Am.
Embora menos generalizadas, depois que o RNAm sai para o citoplasma são produzidas outras
regulações , agora para controlar o tempo e o ritmo de produção das proteínas e para decidir quando e a qual velocidade devem ser degradadas.
16-20. Existem mecanismos gerais e específicos que regulam o tempo e o
ritmo de produção das proteínas
A existência de um controle sobre os RNAm que especifique quais devem ser traduzidos (quer
dizer, quais proteínas devem ser sintetizadas), e os que não o terão, ainda não foi provada.
Todavia, existem mecanismos que controlam quantas vezes um R Am deve ser traduzido e a
qual velocidade. Como é lógico, estes mecanismos atuam no mom ento em que a tradução é iniciada.
As células em mitose oferecem evidências claras sobre este ponto, já que, quando não sintetizam RNAm, a produção de proteínas - a partir de RNAm já fo rmados - cai abruptamente. Indicativa desta queda é a aparência dos polirribossomas durante a mitose, nos quais os ribossomas
aparecem mais espaçados que na interfase.
Há um controle geral ou inespecífico da tradução, que parece depender do fator de iniciação
IF-2, cuj a fosforilação por uma cinase específica o torna inoperável. Como conseqüência, a síntese de todas as proteínas celulares d~clina.
O controle particular ou específico da tradução dos RNAm opera de outra maneira. Depende
de substâncias reguladoras que podem modificar a configuração de um segmento de nucleotídeos
não traduzíve is, localizados entre o cap e o códon de iniciação (Seção 16-5).
Um exemplo deste controle é oferecido pela fe rritina, uma proteína citosólica que se une ao
ferro e constitui sua forma de depósito. Sua concentração vari a com a quantidade de ferro no citosol, e sua síntese é regulada por esta quantidade. Assim, quando a quantidade do ferro cai, uma
proteína chamada aconitase, ou IRF (do inglês, iron responding factor), se une à seqüência não
traduzível da extremidade 5' do RNAm da ferri tina e bloqueia sua tradução. Isso se deve ao fato
de a aconitase dobrar o RNAm e formar um anel (Fig. 16.10), o que impediria a ação do IF-4 e,
portanto, o início da tradução.
16-21. A degradação dos RNAm pode ser regulada por fatores que atuam na
extremidade 3' de suas moléculas
Outra estratégia utilizada pela célula para controlar a quantidade de proteína que tem de sintetizar opera sobre a sobrevivência dos RNAm no citosol. Os mecanismos que regulam a degrada-
Tubulina insuficiente
Fig. 16.11 Regulação da
estabilidade do RNAm da
tubulina.
cap -- AUG --.,,6
.,...c--:fó;l"lf'i,,.--p
~f::----- AAAA
A TRADUÇÃO DO RNAm
J·
•
ção dos RNAm são muito mais variados. Ta maioria dos casos, relacionam-se com seqüências de
nucleotídeos próximas à extremidade 3 ' dos RNAm, localizadas entre o códon de terminação e a
poli A (Seção 16-5). Ao contrário, em alguns RNAm se vinculam com seqüências próximo à extremidade 5' . Finalmente, em outros RNAm, embora não se tenham·estabelecido as seqüências
responsáveis pela degradação, são conhecidas as substâncias que as induzem . Analisaremos alguns exemplos desses mecanismos , começando pela citada por último.
A caseína é uma proteína do leite produzida pelas células da glândula mamária em resposta a
certos hormônios, principalmente a prolactina. Observou-se que a concentração do RNAm da
caseína cresce consideravelmente no citosol ante a presença desse hormônio, não porque aumente
sua síntese no núcleo , mas sim porq ue aumenta sua estabilidade no citoplasma. Contrariamente,
quando a prolactina desaparece, a degradação do RNAm da caseína se acelera. ão são conhecidos os mecanismos moleculares que produzem esses efeitos.
É interessante o modo como a degradação dos RNAm da tubulina dimérica é regulada, já que
se baseia na concentração de seus produtos protéicos, quer dizer, de suas subunidades a e 13 (Cap.
5-6). Quando no citosol o nível dessas proteínas é suficiente, uma molécula-provavelmente um
dímero a l3 - se une aos primeiros aminoácidos das cadeias protéicas que emanam dos ribossomas, o que ati va uma nuclease específica que degrada os RNAm das tubulinas (Fig. 16.11 ). Como
vemos , trata-se de um mecanismo auto-regulador. A zona receptora do sinal de saturação envolve
os primeiros nucleotídeos do R Ame uma pequena seqüência não traduzível prévia ao códon de
iniciação.
No sangue, o ferro é transportado por uma proteína chamada transferrina. Esta, juntamente com
o ferro, entra no citoplasma por endocitose após prévia interação com o receptor da transferrina,
locali za~ o na membrana plasmática. Quando a concentração de ferro aumenta no citosol, o número de receptores para transferrina diminui. Os receptores caem porque os RNAm que os codifica
é degradado por um a nuclease específica. Neste mecanismo regulador também intervém a
aconitase, já que ao se uni r a um sinal localizado na extremidade 3' do RNAm, que consta de
cinco anéis de RNA com uma seqüência CAGUG em cada um , impede a atividade da nuclease.
Isso ocorre quando a concentração de ferro diminui (Fig. 16.12).
'
Como vemos, quando o ferro diminui no citosol, dois mecanismos reguladores simultâneos
atuam, um que reduz a concentração da ferritina (Seção 16-20) e outro que aumenta o número de
receptores para a transferrina. No primeiro, a tradução do RNAm é bloqueada e, no segundo, a
degradação de outro é impedida. Em ambos intervém uma mesma molécula - a aconitase embora em setores difeTentes dos RNAm.
A curta sobrevivência dos RNAm de muitas proteínas - como, por exemplo, alguns fatores
de crescimento (Cap. 18-28) - que não supera os 30 minutos deve-se à presença em sua extremidade 3' de seqüências de cerca de 50 nucleotídeos ricas em A e U, localizadas entre o códon de
terminação e a poli A (Seção 16-5). Foi sugerido que essas seqüências atraem certas nucleases , as
quais, mediante a remoção gradual das A da poli A, desestabilizam o RNAm e isso propicia a
degradação desse último por outras nucleases (Fig. 16.13).
A vida média do RNAm da {3-globina, que é de cerca de 10 horas, depende da integridade de
sua poli A. Diversas experiências demonstraram que o encurtamento gradual desta seqüência,
mediante nucleases , reduz o tempo de vida do RNA mensageiro.
A sobrevivência dos RNAm que codificam as hisü!nas depende do momento do ciclo em que
a célula se encontra (Fig. 16.14). Na fase S, a vida média destes RNAm é de uma hora, porém
Ferro suficiente cap - - AUG
ôôô
l1fUU1Il AAA A
;I
6-- Nuclease
AconitaseO
Ferro insuficiente cap - - AUG
Ü
0
0
000
AAAA
Fig. 16.12 Regulação da
estabilidade do RNAm da
proteína receptora da
transferri na.
259
260
•
A TRADUÇÃO DO RNAm
6
6
0
RNAm
do cap - AUG -~\J-&---~,__.,.__..,__
,.--....
íatorde
crescimento
Ao final de cap 30 minutos
____ AUAU - - AAAA
AUG
F ig. 16.13 Regulação da estabilidade dos RNAm dos fatores de crescimento.
Du rante a fase S cap - - AUG
Depois da fase S cap -
AUG
-fj-r-«----::a-:--fJr-o,..-----)1_
aô 6
JIfL
Nuclease _____()
Fig. 16.14 Regulação da estabilidade do RNAm das proteínas hi stônicas.
quando a replicação do DNA termina, se reduz a uns poucos minutos. Não se conhece o mecanismo pelo qual a replicação do DNA se vincula com a menor velocidade da degradação destes RNAm.
Somente sabemos que sua estabilidade é influenciada por uma cmta seqüência de nucleotídeos
que forma um anel em sua extremidade 3' (Cap. 15-5) (Fig. 15.4).
Como se vê, na maioria dos exemplos citados, o tempo de vida dos RNAm depende de seqüências especiais presentes em suas extremidades 3' , onde pode começar a degradação.
Devemos acrescentar que as célufas geram alguns RNA pequenos que, provavelmente, participam da destruição do RNAm. Denominam-se microRNA ou miRNA e são analisados nos Caps.
13-12, 15-13 e 23 -44.
16-22. A degradação das proteínas também é regulada
A sobrevivência de certas proteínas de vida breve depende de sinais presentes em suas moléculas. Até pouco tempo acreditava-se que o tempo de vida dessas proteínas estava vinculado à
identidade do primeiro aminoácido da extremidade amina (na Seção 16-16 indicamos que em todas
as proteínas essa posição inicialmente é ocupada por uma metionina e que quando esta é removida toma seu lugar o segundo aminoácido da cadeia protéica). Hoje sabemos que os sinais utilizados para degradar muitas proteínas de vida curta são seqüências de aminoácidos chamadas PEST,
ricas em prolina (P) , ácido glutâmico (E) , serina (S) e treonina (T) (as letras entre parênteses identificam esses aminoácidos , segundo informamos na Fig. 2.25). Estes sinais são reconhecidos pela
ubiquitina, cuja intervenção é imprescindível para que as proteínas se degradem nos proteassomas
(Cap. 4.6).
16- 23. As poliproteínas são processadas de maneira diferente segundo
o tipo celular que as produz
No Cap. 13-1 , assinalamos que alguns RNAm codificam proteínas. Estas são processadas de
maneira diferente segundo a célula que as produz.
Um exemplo de poliproteína é o pró-hmmônio pró-opiomelanocortina (POMC), que nas células adrenocorticotróficas do lobo anterior da hipófise gera cmticotrofina (ACTH) e 13-lipotrofina
(13-LPH), e nas células da parte intermediária da mesma glândula produz 13-endorfina (13 -EP), -ylipotrofina (-y-LPH) e duas formas do hormônio estimulante dos melanócitos, identificadas com
as siglas a -MSH e 13-MSH (Fig. 16.15).
A TRADUÇÃO DO RNAni
H2N 1
Pró-opiomelanocortina
i cooH
j
CJ
Peptídeo
sinalizador
AqTH
1
!
8
: Jl-~H
li
I
,----------,
! \
r-
y-LPH I ~-MSH
L__;
f)- EP
•
261
Fig. 16.15 Processamento da
pró-opiomelanocortina nos
diferentes tipos de células
hipofisárias que a elaboram.
ACTH, corticotrofina; {3-LPH,
{3-lipotrofina; y -LPH,
y-lipotrofina; a -MSH e {3-MSH ,
hormôn ios estimulantes dos
melanócitos; {3-EP , {3-endorfina.
BIBLIOGRAFIA
Agard D.A. (1993) How molecular cbaperones work. Science 260: 1903.
Brawerman G. (1987) Determinants of messenger RNA stability. Cell
48:5.
Burbaum J.J. and Schimrnel P. (1991) Strucrural relationships and the
classification of aminoacyl -tR A syntbetases . J. Biol. Chem .
266:16965.
Caskey T.H. (1980) Peptide chain termination . TIBS 5:234.
Cavarelli J. and Moras D. (1993) Recognition oftRNAs by aminoacyltRNA synthetases. FASEE J. 7:79 .
Craig E.A. (1993) Chaperones: helpers along the patbways to protein
folding. Science 260: 1902.
Dahlberg A.E. (2001 ) The ribosome in action. Science 292:868.
Delarne M. (1995) Aminoacyl-tRNA synthetases. Curr. Opin. Struc.
Biol."'5:48.
Garen A. (1968) Sense and non-sense in the genetic code. Science
160: 149.
Gay D.A. , Yen T.J., Lau J.T. Y. and Cleveland D.W. (1987) Sequences
that confer ~-tubulin autoregulation through modulated mRNA
stability reside within exon 1 of a~ - tubulin mRNA. Cell 50:671.
Guyette W.A., Matusik R.J. and Rosen J.M. (1979) Prolactin mediated
transcriptional and post-transcriptional control of casein gene expression. Cell 17:1013 .
Hale S.P. et ai. (1997) Discrete determinants in transfer RNA for editing
and aminoacylation . Science 276: 1250.
Ibba M., Curnow A.W. and Scill D. (1997) Aminoacyl-tRNA synthesis: divergent routes to a common goal. TIBS 22 :39.
Illangasekare M. et ai. (1995) Aminoacyl-RNA synthesis catalyzed by
an RNA. Science 267:643.
Kerppola T.K. and Kane C.M. (199 1) RNA polymerase: regulation of
transcript elongation and termination. FASEE J. 5:2833.
Kozak M. (1991) Structural features in eukaryotic mRNAs that modulate
the initiation of translation. J. Biol. Chem. 266: 19867.
Lindahl L. and Hinnebusch A. (1992) Diversity of mechanisms in the
regulation of translation in prokaryotes and lo wer eukaryotes. Curr.
Opio. Genet. Dev. 2:720.
McCarthy J.E.G. and Kollmus H. (1995) Cytoplasmic mRNA-protein
interactions in eukaryotic gene expression. TIBS 20: 191.
McClain W.H. (1993) Transfer RNA identity. FASEE J. 7:72.
Merrick W.C. (1 990) Overview: mechanism of translation initiation in
eukaryotes. Enzyme 44:7.
Merrick W.C. (1992) Mechanism and regulation of eukaryotic protein
syritbesis. Microbial. Rev . 56:291.
Mullner E.W. and Kuhn L.C. (1988) A stem-loop in the 3' untranslated
region mediates iron-dependent regulation of transferrin receptor
mRNA stability in the cytoplasm. Cell 53:815.
ierhaus K.H. (1996) An elongation factor turn-on. Nature 379:491.
issen P. et ai. (1995) Crystal structure of the ternary complex of PhetRNAPhe, EF-Tu, anda GTP analog. Science 270:1464.
Nissen P. et ai. (2000) The structural basis of ribosome activity in peptide bond synthesis. Science 289:920.
Oh S.K. and Sarnow P. ( 1993) Gene regulation: translational initiation
by internai ribosome binding. Curr. Opin. Genet. Dev. 3: 295.
Powers T. and Walter P. (1996) The nascem polypeptide-associated
complex modulates interactions between the signal recognition
particle and the ribosome. Curr. Biai. 6:33 1.
Rassow J. and Pfanner N. (1996) Prateio biogenesis: chaperones for
nascent polypeptides. Curr. Biol. 6: 115.
Rhoads R.E. (1993) Reg ulation of eukaryotic protein synthesis by
initiation factors. J. Biol. Chem. 268:3017.
Rich A. and Kim S.H. (1978) The three-dimensional structure of transfer
RNA. Sei. Am. 240 (1):52.
Sachs A B. (1993) Messenger RNA degradation in eukaryotes. Cell
74:413.
Schimrnel P.R. (l 987) Aminoacyl-tRNA synthetases : general scheme
of structure-function relationships in the polypeptides and recognition
of transfer RNAs. Annu. Rev. Biachem. 56:125.
Stansfield 1. , Jones K.M. and Tu ite M.F. (1995) The end in sight:
terminating translation in eukaryotes. TIBS 20:489.
Tate W.P. and Brown C.M. (1992) Translational termination: "stop" fo r
prateio synthesis or "pause" for regulation of gene expression. Biochemistry 29:5 88 1.
Theil E.C. (1 990) Regul ation of ferritin and transferrin receptor mRNAs. J. Biai. Chem. 265:4771.
Yo nath A. , Leonard K.R. and Wittman H.G. (1987) A tunnel in the large
ribosomal subunit revealed by three-dimensional image reconstitution. Science 236:8 13.
Yoshizawa S., Fourmy D. and Puglisi J.D . (1999) Recognition of the
codon-anticodon heli x by ribosomal RNA. Science 285: 1722.
A replicação do DNA
Mutação e reparo
17
REPLICAÇÃO DO DNA
17-1. A replicação do DNA ocorre na interfase
Ao final da divisão celular, as células-filh as herdam as mesmas informações genéticas conti das na célula progenitora. Como essa informação se encontra no D A, cada uma das moléculas
de DNA deve gerar outra molécula de D A idêntica à originária para que ambas sejam repartidas
nas duas cé lulas-filhas. Esta duplicação , graças a qual o DNA se propaga nas células de geração
em geração , é denominada replicação.
A vi<'!a das células que se div idem passa por duas etapas que se alternam cicli camente, conhecidas com os nomes de interfase e mitose (Cap. 18-2). A interfase se subdivide em três períodos
chamados G 1, Se G2 (Fig. 17 . 1). a fase Gl ocorrem as diversas atividades da célula (secreção ,
condução, contração, endocitose etc.). É seguida pela fase S, em cujo transcurso ocorre também a
replicação do DNA. Depois , tem lugar a fase G2, transição que se estende até o início da fase M
- correspondente à mitose - ao final da qual as moléculas de DNA duplicadas são segregadas
nas células-filhas.
Devemos assinalar que, desde o té1mino da fase S até que sejam segregados na mitose, os DNAfilhos derivados de um mesmo DNA progenitor permanecem juntos, unidos na altura do centrômero
mediante um complexo de proteínas chamadas coesinas (Fig. 17.2). Enquanto estão unidos, esses
DNA levam o nome de cromátides-irmãs. O centrômero se evidencia durante a mitose, quando a
cromatina de ambas as cromátides alcança o grau máximo de compactação e desempenha uma função crucial na separação das cromátides-irmãs, pois graças a ele cada célula-filha recebe uma única
cromátide, que passa a se chamar cromossomo depois da separação (Cap. 18-9) (Fig. 17.2).
Metáfase
Fig. 17.1 Ciclo vital de uma célula que compreende a
interfase e a mitose. A primeira inclui as fases G 1, S
e G2. A replicação do DNA ocorre durante a fase S.
Fig. 17.2 Ciclo de condensação-descondensação dos cromossomos.
A replicação ocorre na fase S. A condensação do DNA é máxima
na metáfase e na anáfase.
264
•
A REPLICAÇÃO DO DNA
Fig. 17.3 A replicação do DNA
ocorre antes do desenrolamento
das duas cadeias da dupla hélice,
cada uma das quais é usada
como modelo para sintetizar as
cadeias novas. Observe-se que a
síntese ocorre somente na
direção 5 ' ~ 3'.
s·
e
I
e
Para que duas moléculas de DNA possam se formar a partir de uma, primeiro as duas cadeias
da dupla hélice do DNA progenitor têm de se separar, pois são utilizadas como modelo para a
construção de outras cadeias complementares. Já que as cadeias recém-sintetizadas não se separam das respectivas cadeias modelo , formam-se duas novas duplas hélices de DNA idênticas à
anterior (Fig. 17 .3).
Vimos que o DNA não está sozinho e sim combinado com proteínas (histona etc.) e que a integração de ambas as moléculas leva o nome de cromatina (Fig. 12.9). A presença das proteínas complica o estudo da replicação, por um lado por intervir no enrolamento da cromatina e, por outro, porque
elas também se duplicam. Com o objetivo de simplificar as descrições, estes aspectos serão ignorados nas primeiras seções do capítulo, a menos que suas menções se tornem imprescindíveis.
17-2. A replicação tem algumas semelhanças com a transcrição
A síntese do DNA (replicação) apresenta algumas semelhanças com a síntese do RNA (transcrição do DNA). Da mesma forma que o RNA, o DNA é sintetizado na direção 5'~3' e utiliza
como modelo uma cadeia de DNA preexistente. Além disso, enzimas equivalentes às RNA polimerases, chamadas DNA polimerases, agregam os sucessivos nucleotídeos - também um por
vez - na extremidade 3' da cadeia em crescimento. As DNA polimerases catalisam as ligações
fosfodiéster que se produzem entre o OH do C3' da desoxirribose de um nucleotídeo e o fosfato
ligado ao CS' do nucleotídeo recém-chegado (Fig. 17.4).
DT
PDA
p
Fig.17.4 Ação da DNA
polimerase durante a replicação
do DNA. A enzima se situa no
lugar de um nucleosídeo
trifosfato e catalisa a ligação
fosfodiéster, com liberação de
um difosfato. Observe-se que a
DNA polimerase somente pode
agregar nucleotídeos na direção
5'~3'.
,
5
--DNA polimerase
~ OH
p-c:::G~P-P-P
PD TOOA-<t
PJ>:::~·p
---
p h _ A --- T / ' f ' OH
~
~ P-P-P
!)-c;; G
-<!OH
p
/'f p + P-P
ph _
~-T -- -A~
P-
<['p
p~
_/'fp
G---
5
5
ph _
A-J
__/f'p
Ao:: T~
- - DNA polimerase
kJA ::: T~
A REPLICAÇÃO DO DNA
•
265
As diferenças entre a replicação e a transcrição são devidas, em parte, ao fato de que o D A é
uma molécula dupla e não simples como o RNA. Ta síntese do RNA, o D A é transcrito somente
nos setores que correspondem aos genes ativos, enquanto na replicação não fica nenhum setor do
DNA sem duplicar-se. Para a síntese do R1 A, as dua cadeias do D A se separam transitoriamente na zona onde se produz a transcrição, e por is o se forma uma espécie de "bolha" que se
desloca na direção S '~3 ' . O RNA copia somente uma das duas cadeias do DNA e, conforme
progride a transcrição , se destaca da cadeia que lhe serve de modelo. Por outro lado, na replicação, as duas cadeias do D TA são utilizadas como modelo e uma vez separadas não voltam a se
juntar (porque as cadeias-filhas ficam unidas às progenitoras). Finalmente, a replicação exige um
número consideravelmente maior de enzimas do que a transcrição .
Em síntese, a partir de uma molécula dupla de D A originam-se duas moléculas duplas de
DNA - duas duplas hélices - cada uma composta por uma cadeia herdada do DNA progenitor
e uma cadeia recém-sintetizada. Sempre que as moléculas de D A recebidas pelas células-filhas
contêm uma cadeia original (preexistente) e uma cadeia nova (recém-sintetizada), dizemos que o
mecanismo de replicação do D A é semiconservador (Fig. 17 .5).
17- 3. A replicação ocorre setorialmente
Se a célula abordasse a replicação do DNA, considerando-o como uma longa, uniforme e
delicadíssima fibra composta por milhões de pares de nucleotídeos emparelhados que devem se
separar em um determinado momento em toda a sua extensão, a tarefa, por um problema elementar de espaço, não poderia se concretizar. Apesar de, do ponto de vista teórico, a molécula de DNA
exibir as características que acabamos de mencionar, esta situacão
não ocorre do modo como se
,
associa às histonas e se enrola sobre si mesma.
Recordemos que o DNA integra os nucleossomas de 10 nm e se enrola até gerar uma estrutura
helicoidal de 30 nm de diâmetro (solenóide), que ao voltar a se enrolar forma laços de diferentes
comprimentos, os quais emanam de um eixo constituído por proteínas não histônicas (F.ig. 12.2).
As duas extremidades de cada laço estão sujeitas a esse eixo por seqüências de DNA chamadas
SAR (Cap. 12-9).
Além de proteger o DNA de eventuais embaraços, nós e rupturas , essa disposição da cromatina o organiza setorialmente, já que cada ~aço representa uma unidade de replicação. Nos Caps.
12-9 e 14-12 dissemos que provavelmente alguns laços também constituam unidades de transcrição, ou seja, genes.
Ao falar de unidades de replicação queremos dizer que o DNA não é sintetizado globalmente
e sim a partir de múltiplos setores ao longo de sua molécula, cada um dos quais c01Tesponde a um
laço. Por conseguinte, cada unidade envolve o DNA compreendido entre os pontos ele origem e
ele chegada do laço à sua base, ou seja, entre as SAR. É necessário advertir que tal setorização não
supõe a existência de algum tipo de interrupção na continuidade do DNA, já que a condição unitária de sua molécula não se perde. A estratégia de setorizar a replicação do DNA poderá ser avaliada nas próximas seções, onde são analisadas as múltiplas complicações que a célula deve superar para que este processo se concrtetize.
.
Molécula
paterna
Fig. 17 .5 Replicação
Moléculasfilhas
Moléculasnetas
semiconservadora do DNA. São
mostradas as cadeias de DNA
paterno e as cadeias-filhas em
duas gerações sucessivas.
266
•
A REPLICAÇÃO DO DNA
17-4. A duplicação do DNA é gerada a partir de múltiplas
origens de replicação
Se para sua síntese o D A começasse a fazê-lo a partir de uma das extrem idades do cromossomo e avançasse até chegar a outra extremidade, a replicação tardaria em média cerca de 30 dias.
No entanto, a duração da fase S - tempo que o DNA demora em se duplicar- é de aproximadamente 7 horas , o que é devido ao fato de que ao longo de cada cromossomo aparecem no DNA
múltiplas origens de replicação, entre 20 e 80 por cada laço de cromatina, ou seja, por cada unidade de replicação.
As origens de replicação são geradas quando se separam localmente as duas cadeias de DNA
(Figs . 17 .6 e 17 .7). ão surgem todas simultaneamente e sua aparição mais precoce ou mais tardia depende do grau de emolamento e de outras características da cromatina nos lugares onde se
formam.
As origens de replicação contêm segmentos de D A especiais, compostos por centenas de
nucleotídeos. Apesar de serem diferentes entre si, todos possuem uma seqüência comum denominada ARS (do inglês, autonomous replication sequence), de cerca de 11 nucleotídeos (Cap.
12-6).
O DNA das origens de replicação está associado a um complexo de seis proteínas chamadas
ORC (do inglês, origin recognition complex), o qual se une à origem porq ue - como ocorre com
os fatores de transcrição - invade sulcos do DNA e reconhece certas singularidades químicas em
suas superfícies externas (Cap. 14-9).
- - - - - - - - - - Origens
dl
replicação ---------------
Fig. 17.6 Esquema que mostra duas origens de replicação contíguas em um setor de um cromossomo.
:..
-;-··
.
'
. ..
..
~
...
. .-
..
..
•
,
.
..
'
.... ·.·.-
il~
..
. .....
... , J. • '. •• '":···. .
• ,,. · : •
• : i.r.
.>~-
. •
Jr.)
: ~ - .. ',,:
"•',.
·,•
.;. ""
Fig. 17.7 Um setor cromatínico
durante a replicação. (Cortesia
de S. L. McKnight e O. L. Miller
·... . .
...
~'t~.; ;:~ ~::·.:~~.'-t
·.
· · ·~ -
i :
:{·:..
.. .·. ..
A REPLICAÇÃO DO DNA
•
267
O ORC é necessário durante a ativação das origens de replicação. Apesar de ignorarmos como
atua, sabemos que no começo da fase S recruta outras proteínas - como, por exemplo, as denominadas MCM (do inglês, minichromosome maintenance proteins) e Cdcbp (do inglês, ce /l
division cycle protein ) - com as quais integra um complexo maior chamado pré-RC (do inglês,
pre-rep lication complex). Este catalisa o início da replicação depois de ser induzido pelo fa tor
SPF (do inglês, S-phase promoting fa ctor), que, como veremos no Cap. 18-24, aparece na célula
no começo da fase S.
· Além de participar da ativação das origens de replicação, o ORC impede que o DNA se redu plique durante a fase G2 e, por isso, evita que a célula comece a mitose com um número de moléculas de D A acima do normal (Cap. 18-24).
17-5. A replicação do DNA é um processo bidirecional
Quando em uma origem de replicação se abre a dupla hélice do D A forma-se a chamada bolha
de replicação, cujo tamanho aumenta à medida que avança a separação das cadeias nas duas extremidades da bolha (Fig. 17 .6). Isso dá lugar - em cada extremidade - a uma estrutura em forma de Y denominada forquilha de replicação, ilustrada na Fig. 17 .8. Seus ramos representam as
duas cadeias de DNA separadas, e o tronco, a dupla hélice em vias de separação.
As duas forq uilhas que nascem em cada origem avançam em direções opostas. Desaparecem
quando colidem com suas similares das bolhas contíguas, ao culminar a aproximação progressiva
entre elas (Fig. 17 .9). Como é óbvio , isso não ocorre com a forquilha que percorre o segmento
distal do telômero.
O s..egmento de DNA que é sintetizado a partir de uma origem de replicação recebe o nome de
réplicon. A replicação é concluída qu ando se conectam entre si todos os réplicons. A ação cooperativa de milhares deles é o que permite ao D A ser sintetizado em um tempo relativamente breve para o ciclo vital da célula.
17-6. Existem diferenças no modo como são sintet.izadas as duas
cadeias novas de DNA
Embora até o momento tenha sido analisada a estratégia geral usada pela célula para replicar
seu DNA no menor tempo possível, pouco temos dito sobre a própria síntese do DNA e menos
ainda sobre os detalhes moleculares que dão lugar à separação de suas cadeias. Somente adiantamos que a síntese necessita de um modelo de DNA preexistente e das enzimas chamadas DNA
polimerases, e que ocorre pela agregação de nucleotídeos na extremidade 3' das cadeias-filhas .
Esta última condição, e porque as duas cadeias da dupla hélice são antiparalelas (Fig. 17 .3),
cria uma primeira dificuldade durante a síntese de DNA. Com efeito, tendo em vista que em cada
forquilha os nucleotídeos de uma das cadeias correm na direção 5'-+3' e os da outra o fazem na
direção 3' -+5', a primeira, ao se copiar, teria de gerar uma cadeia-filh a na direção 3' -+5', feito
que nenhuma DNA polimerase pode realizar.
5•
''
''
'
'
' , 5'
3'
~--------• 3's·
3'
3'
5'
Fig. 17.8 A replicação é
bidirecional. Além disso, é
contínua na cadeia adiantada e
descontínua na cadeia atrasada.
268
•
A REPLICAÇÃO DO DNA
A célula resolve o problema recorrendo a estratégias diferentes para produzir as duas cadeias
novas.
Assim, o segmento da cadeia-filha que cresce na direção 5' ~ 3 ' - cujo modelo é a cadeia
progenitora 3' ~5 ' - se constrói sem maiores complicações, mediante a agregação contínua de
nucleotídeos em sua extremidade 3' à medida que a forquilha se desloca (Fig. 17 .8) .
Por outro lado, a outra cadeia-filha - que usa como modelo a cadeia progenitora que corre na
direção 5' ~3' - é sintetizada de um modo singular, já que para poder crescer deve fazê-lo na
direção contrária ao avanço da forquilha. Isto é obtido porque ela é produzida de maneira descontínua, o que significa que são construídos pequenos fragmentos de D A - chamados fragmen tos de Okazaki - que se ligam entre si à medida que vão se formando (Fig. 17.8).
A Fig. 17.8 mostra como um fragmen to de Okazaki é sintetizado. Pode-se ver que é copiado
um segmento da cadeia progenitora relativamente distante do ângulo da forqu ilha, situado "por
trás" do que deu origem ao fragmento de Okazaki construído com antecedência. Isto significa que
o segmento de D A progenitor mais próximo da forquilha permanece sem ser copiado, embora a
essa altura a outra cadeia progenitora já tenha sido copiada pela cadeia contínua. É por isso que a
cadeia contínua é conhecida como adiantada e a descontínua, atrasada.
Dissemos que a replicação do DNA é um processo bidirecional não somente porque as duas
cadeias são sintetizadas em direções opostas, mas também porque as duas forquilhas avançam em
direções divergentes.
Além disso, é assimétrica, já que uma mesma cadeia se replica em forma contínua de um lado
da bolha e de forma descontínua do outro lado (Fig. 17 .9).
Assim , cada bolha representa quatro áreas geradoras de DNA, duas que o fazem de maneira
contínua e duas de maneira descontínua, as primeiras cruzadas com as segundas (Fig. 17 .9). Como
vimos, a síntese contínua ocorre na direção das forquilhas e a descontínua no sentido contrário .
Em seguida, analisaremos de que modo o D A é sintetizado na cadeia contínua (adiantada) e
na cadeia descontínua (atrasada). Por motivos didáticos, o faremo s em seções separadas, embora
estes processos - como os já explicados e os que faltam explicar - ocorram simultaneamente.
17- 7. A cadeia de DNA sintetizada de forma contínua começa a se replicar a
partir de um primer
Para iniciar a síntese da cadeia contínua do DNA, a DNA polimerase necessita, além de urn a
cade ia de D N A 3 ' ~5 ' mode lo , um a ex tremi dade 3 ' para p oder coloc ar o primeiro
desoxirribonucleotídeo . Essa extremidade dispõe de uma pequena peça de RNA, com 10 nucleotídeos, chamada primer (ou iniciador) (Fig. 17.8). A formação do primer é catalisada por uma
RNA pol imerase específica, a DNA primase. Ela se diferencia das RNA polimerases porque gera
um RNA curto que fica unido ao DNA copiado.
Uma vez formado o primer, a síntese do DNA ocorre pela ação da DNA polimerase e pela
provisão de desoxirribonucleotídeos. Estes se encontram no núcleo como desoxirribonucleosídeos trifosfato (dATP, dTTP, dCTP, dGTP) e são agregados seqüencialmente na extremidade 3' da
cadeia de crescimento seguindo a ordem marcada pelos nucleotídeos da cadeia de DNA que serve
de modelo (Fig. 17.4).
~~-~
3
========:::::::~
~
3':' ======:::
0 ::::·========
---4 1 ~
:-....:-.... ___ _ J
1
5'
3'
Fig. 17.9 Esquema que mostra
dois réplicons contíguos e os
lugares onde a replicação se
origina. Além disso, mostra o
caráter bidirecional da replicação
e os setores onde o DNA é
sintetizado de f01ma contínua e
descontínua.
/ - +-+-"'
3'
5'
5'
3'
3'
5'
5'
3'
3'
5'
A REPLICAÇÃO DO DNA
5'
11111111111111111
11111111111111111
3'
~
Braçadeira deslizante
J
'
1 1 1 1 1 li 1 li li li li li 1 li
5'
1
DNA polimerase
A energia necessária para a replicação do D A é retirada dos próprios desoxirribonucleosídeos trifosfato, que liberam dois fosfatos quando se ligam entre si (Fig. 17.4).
Dada a natureza bidirecional da replicação, quando a síntese contínua do D A é iniciada, formam-se, em cada origem, dois primers diferentes, um em cada cadeia da dupla hélice aberta (Fig.
17.9).
Seguidamente, a DNA polimerase ô, que é a enzima que catalisa a síntese da cadeia contínua,
agrega um desoxirribonucleotídeo na extremidade 3' do primer e depois os sucessivos nucleotídeos na extremidade 3' da cadeia em crescimento. A Fig. 17 .11 mostra ·que a DNA polimerase ô
se localiza próximo do ângulo da forquilha de replicação.
Quando a forquilha chega à extremidade de replicação, a cadeia contínua entra em contato com
a cadeia descontínua do réplicon vizinho - que avançava na direção contrária - e outra enzima,
a DNA ligase, une a extremidade 3' da primeira com a extremidade 5' da segunda (Fig. 17.9).
Além disso, onde teve início a síntese da cadeia contínua, o primer é removido por uma nuclease
reparadora - o que será descrito na Seção 17-21 - e substituído por uma peça equivalente de
DNA, gerada com a ajuda de uma enzima especial, a DNA polimerase p. Finalmente, esta peça
de DNA se conecta com o resto da cadeia contínua mediante a DNA ligase.
Uma característica das DNA polimerases é sua tendência a se desprender do DNA da cadeia
modelo. Todavia, enquanto fazem isso, permanecem unidas a ele uma vez que são sustentadas
por uma braçadeira deslizante. Como mostra a Fig. 17 .10, a braçadeira se une à polimerase e
rodeia o DNA, o que impede o desprendimento da enzima, porém não seu deslizamento. Liberase das DNA polimerases 13 e ô quando estas se detêm, ou seja, quando a 13 completa o segmento de
DNA que substitui o primer e a ô alcança a extremidade do réplicon, quando então as enzimas se
desprendem do DNA. Em função do pequeno tamanho do primer, a DNA polimerase f3 se mantém unida ao DNA por um período muito curto.
A braçadeira deslizante forma-se com o concurso de três subunidades protéicas iguais entre si
denominadas PCNA (do inglês, proliferating cell nuclear antigen), cada uma integrada por dois
domínios topograficamente idênticos.
17-8. A cadeia de DNA sintetizada de forma descontínua
necessita de muitos primers
Como acabamos de ver, a cadeia contínua necessita de um só primer, o qual se instala quando
a replicação começa. A cadeia descontínua, no entanto, necessita que a DNA primase fabrique
múltiplos primers, um para cada fragmento de Okazaki (Figs. 17.8 e 17.11).
A enzima responsável pela síntese dos fragmentos de Okazaki é a DNA polimerase <X, que
se encontra unida à DNA polimerase ô e por isso se localiza próximo do ângulo da forquilha de
replicação.
De maneira similar à DNA polimerase ô na cadeia contínua, a DNA polimerase a. coloca o
•primeiro desoxirribonucleotídeo junto à extremidade 3' do primer do fragmento de Okazaki , ligaa ele e agrega os sucessivos desoxirribonucleotídeos na extremidade 3' do fragmento em crescimento. Logicamente, isso é feito seguindo a ordem marcada pelos nucleotídeos da cadeia de
DNA que serve de modelo para formar a cadeia descontínua (Fig. 17.4).
Na Seção 17-6 dissemos que a cadeia descontínua também é conhecida como atrasada porque
cada fragmento de Okazaki começa a ser constituído depois de um segmento da cadeia contínua
haver sido sintetizado. Dado que o atraso é de cerca de 200 nucleotídeos, o DNA modelo do fragmento de Okazaki tem esse comprimento quando começa a se replicar. Cabe acrescentar que a
DNA primase e a DNA polimerase a. precisam de mais ou menos 4 segundos para anexar os 10
ribonucleotídeos do primer e cerca de 200 desoxirribonucleotídeos do fragmento de Okazaki respectivamente.
º
•
269
Fig, 17.10 União da braçadeira
deslizante com a DNA
polimerase. À direita estão
ilustradas as três subunidades
protéicas que compõem a
braçadeira.
270
•
A REPLICAÇÃO DO D TA
Fig. 17.11 Cadeias adiantada (ou contínua) e atrasada (ou descontínua) do DNA durante a rep licação . A
primeira é sintetizada pela DNA polimerase 8; a segunda, pela DNA polimerase a. As figuras da direita
mostram, na cadeia atrasada, a evolução do anel que é gerado durante a síntese de cada fragm ento de
Okazaki . As proteínas SSB mantêm essa cadeia estirada para evitar que suas bases complementares se
emp arelhem entre si.
Como mostra a Fig. 17 .1 1, à medida que a forquilha de replicação avança, encurta-se o DNA
modelo e se alonga a dupla hélice que resulta da síntese do fragmento de Okazaki. Além disso ,
cria-se um segundo DNA modelo , o do fragmento de Okazaki que será sintetizado no próximo
ciclo. Observe-se que dois dos três elementos mencionados - a dupla hélice e o segundo DNA
modelo - formam um anel que cresce entre a DNA polimerase C\' e o ângulo da forquilha de replicação.
O anel se forma porque a DNA polimerase C\' não pode deslizar ativamente sobre o DNA modelo uma vez que, como vimos, se acha no ângulo da forquilha de replicação unida à DNA polimerase o. Conseqüentemente, compe.te ao DNA modelo deslizar em relação à enzima, o que gera
um anel de comprimento crescente que toma possível que o DNA modelo se converta em uma
dupla hélice sem que a DNA polimerase C\' se mova de seu lugar. Cabe acrescentar que existem
outros modelos teóricos de anel que propõem evoluções distintas ao que acabamos de descrever.
O modelo apresentado aqui é um dos mais difundidos e, como o restante, deriva de estudos efetuados em células procariontes.
Outro dado que revela a Fig. 17.11 é que os dois DNA modelos - o que se encurta e o que se
alonga-estão associados a múltiplas unidades de uma proteína chamada SSB (do inglês, singlestrand DNA binding), cuja função é manter relativamente retos esses DNA simples para evitar
que sejam pareadas as bases complementares de suas próprias cadeias, o que impediria o trabalho
da DNA polimerase C\'. É bom assinalar que uma vez que a célula produz as SSB necessárias, estas
são reutilizadas enquanto durar a replicação, já que suas unidades se transferem dos DNA modelo
que se encurtam, para os DNA modelo que se alongam .
Igualmente às DNA polimerases oe~ , a DNA polimerase C\' não se desprende do DNA modelo
porque se associa a ele uma braçadeira deslizante, cujas partes se separam - e a braçadeira se
desarma - quando o fragmento de Okazaki é sintetizado (Figs. 17. 10 e 17.11). Em seguida, o
anel se endireita e seus dois componentes - o fragmento de Okazaki e o novo DNA modelo ficam situados no lado oposto da enzima (FÍg. 17.11). Isso cria as condições para que comece a se
formar um novo fragmento de Okazaki, o qual ocorre uma vez que se forma o primer e a DNA polimerase CI' se une ao DNA modelo como conseqüência da remontagem da braçadeira deslizante.
Como vimos na Seção 17-6, a partir das origens de replicação, cada uma das duas cadeias da
bolha dá origem a duas cadeias divergentes, uma que cresce de forma contínua e outra de forma
descontínua (Fig. 17.9). Pela forma como a cadeia descontínua é construída, sua extremidade 3'
corresponde à extremidade 3' do primeiro fragmento de Okazaki sintetizado, e sua extremidade
S' , à extremidade S' do último fragmento. Além disso, o primeiro fragmento se liga à extremidade
S' da cadeia contínua do réplicon, enquanto o último se liga à extremidade 3' da cadeia contínua
do réplicon contíguo.
A REPLICAÇÃO DO DNA
•
271
A DNA polimerase a interrompe sua atividade depois que agrega o último nucleotídeo do fragmento de Okazaki, cuja extremidade 3' fica junto à extremidade 5 ' do primer formado precedentemente (Fig. 17 .8). Do mesmo modo que na cadeia contínua, os primers da cadeia descontínua são remov idos por um a nuclease reparadora e substituídos com peças de D A construídas
pe la DNA polimerase 13. Em seguida, entra em ação a DNA Iigase, que solda a extrem idade 3'
dessas peças com a extremi dade 5 ' dos fragmentos de Okazaki preced~n tes.
17-9. A replicação do DNA nos telômeros é dirigida pela telomerase
No Cap. 12-6, dissemos que o D1 A dos telômeros, apesar de sua localização, pode fundir-se
ao DNA de outros telômeros ou degradar-se mediante uma nuclease; em condições normais não
corre esse risco porque se dobra sobre si mesmo e as proteínas TRF formam um capuz protetor.
Tanto a dobra como o capuz estão ilustrados na parte inferior da Fig. 17.12. Observe-se que o
DNA se do bra porque uma de suas cadeias é mais longa do que a outra e invade um segmento
próximo da dup la hél ice, o que dá lugar a uma tripla hélice de D A em cerca de 150 nucleotídeos
de extensão.
Vale a pena acrescentar que a cadeia descontínua do DNA telomérico é sintetizada de uma
mane ira singular. É que a D A polimerase 13 não pode produzir o segmento de D A que deve
substituir o último primer que é eli mi nado dessa cadeia porque não tem uma extrem idade 3' a
partir da qual possa começar a se fo rm ar. Em conseqüência, em cada uma das sucess ivas divisões
celulares, com a eliminação do último primer se perde um segmento do DNA te lomérico, o que
provoca o seu encurtamento progress ivo.
Na1uralmente, se ao fi nal de um determinado número de divisões os cromossomos não reverterem esse enc urtamento, não somente perderão os telômeros, mas também começarão a perder
inform ação genética. Na maioria das células isto não ocorre porque depo is de cerca de 50 divisões
~
y .
TT AGGGTT AGGGTT AGGGTT AGGGTT AGG G - +
3.
AA T CC C AATCC~ ·
h===:::s s·
~AU C C~~ "\
3· ~
_J
Telomefâse
3'
s~· TTAGGGTTAGGGTTAGGGTTAGG G TTAG GGTTAG
3.
.
({
...- - - - - - - - - -
3'
/J TTAGGGTTAGGGTTAGGGTTAG GGTTAG GGTTAGGG TT AG - +
~ ~ AATCCCAATCCC
,&AUCCCAAUÇ v
) ---
f
.
5
3· ~
..._ _ _ _ _ __._
5·
~
~ ~
,,;:=== s·
3·~
5'
~ ~
-+
~AU CCC ~ )
AATCCCAATCCC
y
n TTAGGG TTAGGGTTAGGGTTAG GGTTA GGG TTAGGG TTAGGGTTAG
~ ~ AATC C CAATCCC
5'
+- A.AT CCCAATC C CAAU CC C
3•
5' 3'
5'
Fig. 17.12 Replicação do DNA
nos telômeros. Na fi gura
inferiormente situ ada estão
ilustradas as proteínas TRF e o
laço que é formado na
extrem idade livre dos telômeros.
272
•
A REPLICAÇÃO DO DNA
o encurtamento telomérico chega a um nível que lhes impede de iniciar uma nova divisão. Além
disso, essas células envelhecem e morrem, porqge dos seus telômeros esgotados surgem sinais
que ativam o gene da proteína P53, o que, como veremos nos Caps. 18-29 e 22-6, bloqueia a divisão e determina a morte das células. Assim, a morte sobrevém antes que as células percam informação genética.
Em algumas células pertencentes às linhagens gerrninativas do testículo e do ovário (Cap. 193), o exposto anteriormente não ocorre, apesar de se dividirem repetidamente, por conter um complexo enzimático ribonucleoprotéico desenhado para recuperar o DNA telomérico que perdem durante as divisões. Esse complexo, chamado telomerase, é composto por várias proteínas e um RNA
de cerca de 450 nucleotídeos chamado RNAte (Cap . 13 -2), que inclui a seqüência d'o
A UCCCAA UC (Fig. 17 .12). Vejamos como a telomerase atua, lembrando que suas propriedades
catalíticas se derivam de sua função protéica.
Nos telômeros , a cadeia 3' ~5 ' do D A é composta por numerosas seqüências AATCCC
consecutivas que, junto com sua complementares TTAGGG da cadeia 5' ~3 ', vão se perdendo
durante as divisões celulares sucessivas. A recuperação do DNA telomérico começa em um ciclo
celular posterior, quando a seqüência AUCCCAAUC do RNA da telomerase une-se à extremidade 3' da cadeia 5' ~3 ', colocando-se no lado da cadeia 3' ~5 ' do modo ilustrado na Fig. 17.12.
A partir desse momento, a cadeia 5' ~3' reúne os requisitos que lhe permitem crescer: tem sua
própria extremidade 3' livre e uma seqüência de nucleotídeos que lhe serve de modelo, a do RNA
da telomerase. Tendo em vista que à medida que cresce provoca o deslocamento da telomerase, o
processo se repete várias vezes e é concluído quando a cadeia 5' ~3 ' recupera seu comprimento
e o telômero é liberado da telomerase.
Como vemos, a telomerase é uma DNA polimerase que copia uma seqüência de RNA , de modo
que se comporta como uma transcriptase reversa (Cap. 17-24).
Resta descrever como a cadeia 3' ~5 ' recupera seu comprimento. É restaurada pela DNA polimerase ex, que utiliza como modelo o DNA 5' ~3 ' recém-sintetizado e agrega os nucleotídeos
complementares a partir da extremidade 3' do RNA de um primer previamente produzido pela
enzima DNA primase. Finalmente, o primer é removido e a enzima DNA ligase une a antiga extremidade 5' da cadeia com a extremidade 3' do segmento recém-formado.
Como não há um balanço exato entre as perdas teloméricas e suas recuperações periódicas, o
comprimento dos telômeros varia nos diferentes cromossomos.
Suspeita-se que os telômeros não sejam estruturas desenhadas unicamente para evitar o encurtamento progressivo das extremidades dos cromossomos. Em estudos sobre envelhecimento celular ficou comprovado que, em meios de cultura, as células provenientes de embriões e de indivíduos jovens se dividem mais vezes que as células provenientes de indivíduos de mais idade, as
quais , além disso , morrem muito antes. Este fenômeno celular é conhecido com o nome de senescência replicativa. Muitos pesquisadores acreditam que as células jovens cultivadas vivem mais
porque seus telômeros recuperam o DNA perdido a uma velocidade maior que os telômeros das
células envelhecidas, o que estaria relacionado com a redução progressiva da síntese da telomerase que ocorre nas células à medida que suas divisões se vão sucedendo.
Este último fato não ocorre nas células cancerosas, cuja telomerase não se reduz ou está aumentada, o que explicaria por que estas células podem se dividir de forma permanente quando são
cultivadas (Cap. 21 -3). Coincidentemente, vários estudos demonstraram que a telomerase é sintetizada na maioria dos cânceres humanos.
Fig. 17.13 Separação das duas cadeias do DNA ao nível da forquilha de replicação e sua conseqüência
mecânica, evitada pelas topoisomerases .
1·
da
pl
ca
ht
(F
Cll
cc
cc
cc
e
ru
to
S{
di
to
qt
UI
li
'
CI
A REPLICAÇÃO DO DNA
•
273
17-10. A topoisomerase 1 e a girase diminuem a tensão torcional produzida
na dupla hélice do DNA quando suas duas cadeias se separam pela
ação da helicase
Como o DNA é uma molécula composta por duas cadeias helicoidais emparelhadas e enroladas entre si, sua síntese apresenta uma dificuldade adicional não abordada até agora para não complicar a análise dos pontos anteriores.
Temos visto que as D A polirnerases copiam os nucleotídeos do D A depois que as duas
cadeias da dupla hélice se separam. A separação é produzida por uma enzima específica chamada
helicase, que está situada no ângulo da forquilha de replicação à frente das DNA polimerases 8 e
a e corta as pontes de hidrogênio entre as bases complementares das duas cadeias da dupla hélice
(Fig. 17 .11 ). Esse processo exige energia, que é retirada do ATP.
Conforme a forquilha de replicação avança, a helicase deixa atrás de si segmentos das duas
cadeias de DNA com seus nucleotídeos expostos. Recordemo que pàra dar lugar à cadeia descontínua, os nucleotídeos da cadeia progenitora 5' ~ 3 ' permanecem um tempo sem se replicar,
combinados com as SSB.
Em função da natureza helicoidal do D A, a helicase não pode abrir a dupla hélice do DNA
como se abriria um zíper. O modelo que é mostrado na Fig. 17 .13 ajuda a compreender o motivo.
Conforme as cadeias de DNA se separam ao nível da forquilha , se vai acumulando diante desta na dupla hélice ainda não aberta - uma torção cada vez maior. Como é de supor, essa torção
tomaria inviável a separação das cadeias pela helicase. Portanto, para que a ação da enzima não
seja "freada", é necessário evitar o superenrolamento com um desenrolamento equivalente, a fim
de prevenir excessivas tensões torcionais nos segmentos da dupla hélice ainda não replicados.
O desenrolamento é produzido por duas enzimas específicas, a topoisomerase I e a girase (ou
topoisomerase II). Ambas utilizam energia e evitam as voltas em excesso mediante um processo
que é realizado em três etapas.
Na primeira, a topoisomerase 1 corta uma das cadeias da dupla hélice; na segunda, a cadeia
cortada gira em tomo de seu próprio eixo; na terceira, as extremidades cortadas voltam a se unir.
Ao contrário, a girase não corta uma, mas sim as duas cadeias do DNA, que restabelecem suas
uniões depois de haver girado.
Como se vê, ambas as enzimas se comportam como nucleases (cortam o DNA ao nível das
ligações fosfodiéster) e DNA ligases (reconectam as peças cortadas depois de o DNA haver rodado).
A girase é uma das proteínas que integra a armação protéica na qual se sustentam os laços de
cromatina de 30 nm (Cap. 9-9); associa-se ao DNA do laço, colocando-se próximo das suas extremidades, onde comporia um tipo de articulação giratória similar à mostrada na Fig. 17 .14. Com
relação à topoisomerase I, existiriam várias em cada laço , pois operariam entre as bolhas de replicação.
A topoi somerase I e a girase diferenciam-se não somente porque a primeira corta uma única
cadeia do DNA e a segunda corta as duas , mas também pela magnitlide dos seus efeitos, já que o
r~~
I
r8
l .
\
,~
i
-1. . . .... . . . . . 6. . . ..
Fig. 17.14 Efeito hipotético da
girase para evitar o
superenrolamento que seria
produzido no DNA como
conseqüência da se paração de
suas duas cadeias.
274
•
A REPLICAÇÃ O DO D A
Histonas preexistentes
Fig. 17 .15 Agregação de
histonas novas durante a
replicação do DNA.
Origem
, ~~..___,__.__~.;r C C 1g
"-....5,
3'
e:::::;;>
"-7
Hístonas novas
G ~--,.,. . ,_,.c.__..
:> c=-·..--<>-.
"'
"'--"~
"'-.
3
~; e:> f ' c:>l i c:>ÍI c:>1 5'
~~P-1
1::::1 ~
z:::::::7 C::::::./ c:;i e:;;
Origem
desenrolamento que a topoisomerase I produz é de curto alcance e o da girase envolve uma extensão de DNA muito maior.
Por outro lado , é possível que ambas as enzimas sirvam para prevenir emaranhados nas moléculas de cromatina fora da replicação , já que poderi am atuar - recorrendo a uma analogia imperfeita - como tesouras e mãos que para desembaraçar um extenso filamento emaranhado primeiro o cortam e depois o emendam.
er;
17-11. A topoisomerase 1 é necessária durante a transcrição
H
Durante a transcrição do DNA, quando a RNA polimerase avança e abre o lado frontal da
bolha (Fig. 14.2), forma-se um superen rolamento na dupla hélice simi lar ao que ocorre durante
a replicação. Contudo, o superenrolamento da transcrição é aliviado somente pela topoisomerase 1.
L:
17- 12. A compactação da cromatina atrasa a replicação
e
O enrolamento extremo da cromatina, derivado de sucessivos graus de compactação causados
pela associação do DNA com as histonas (Cap. 12-9), impede a replicação. No Cap. 14-12, foram
analisados alguns mecanismos por meio dos quais , durante a transcrição, a RN A polimerase escapa de parte da compactação da cromatina. Até o momento, não possuímos dados certos sobre
mecanismos análogos na repli cação. Apesar disso, não há dúvida de que a compactação do DNA
afeta a replicação , já que a heterocromatina, ao contrário da eucromatina (Cap. 1O~J2) , replica-se
mui.to tardiamente na fase S.
Esta diferença pode ser percebida quando se compara a replicação do cromossomo X ativo com
a de seu homólogo compactado (corpúsculo de Barr); a replicação deste último é muito mais tardia apesar de ambos os cromossomos X serem praticamente idênticos.
Também há diferenças na replicação quando comparamos o DNA das bandas R (ricas em G-C
emparelhadas) com o DNA das bandas G e Q (ricas em A-T emparelhadas) (Fig. 12.17): as bandas R se replicam durante a primeira metade da fase S e as bandas G e Q o fazem durante a segunda metade. O signifi cado destas bandas foi analisado no Cap. 12-13.
17-13. Como o DNA, as histonas também são sintetizadas na fase S
Dissemos que o DNA se replica de forma semiconservadora, ou seja, que as duas cadeias progenitoras, ao se separarem para sua replicação, repartem-se em ambos os cromossomos-filhos
(Seção 17-2) (Fig. 17.5).
Com relação aos nucleossomas, sabemos como se agregam suas histonas. Ao fim da replicação se repartem - aparentemente aleatoriamente - entre ambas as cromátides-filhas e, por isso,
estas devem ser providas de histonas de formação recente. Os nucleossomas novos formam -se
com hi stonas preexistentes e histonas novas (Figs. 17.7 e 17.1 5).
Fig. 17.16 Participação da
proteína N l e da nucleoplasmina
na armação dos nucleossomas.
DNA
i
,--~N_
uc_1e_o~
p_
1a_sm_i_
na_~ H 2 A +H B
NUCLEOSSOMA
2
A REPLICAÇÃO DO DNA
\
N -H--0~"1
nN----H-~
r -N
Desam inação
FN \
0- - - H- N\
Citosina
H Guanina
Uracila
Adenina
H
/
\
:--f. n
( N
N-
H - - -0
CH
H '
\~- -- -H-N, ')
N=f
}-N
o
\
Ade nina
Timina
275
Fig. 17.17 Conseqüências de
mutações gênicas espontâneas
produzidas por desaminação.
H
}~
•
oesaminação
Hipoxantina
Citosina
Os nucleossomas são montados em duas etapas. Na primeira. as hi stonas H3 e H4 se ligam
entre si por meio da proteína Nl (Cap. 12-9) e "são entregues'· ao DNA por um complexo protéico chamado CAF-1 (do inglês, chromatin assemb/yfactor). Na segunda etapa, as hi stonas H2A e
H2B, ajudadas pela nucleoplasmina (Cap. 12-9), se unem às histonas H3 e H4 e completam o
octâmero (Figs. 12.8 e 17 . 16).
A maioria das histonas novas é sinteti zada na fase S e se incorpora aos nucleossomas somente
quando o DNA é dupli cado (Fig. 17. 15).
DuraJJte a fase S, quase todas as cópias - entre 20 e 50 - dos genes das cinco histonas (Cap.
13-7) são transcritas simultaneamente. Portanto, na fase S. a concentração dos RNAm das hi stonas é muito alta, não somente por aumentar sua síntese, mas também por diminuir sua degradação
(Cap. 16-21 ).
A pequena quantidade de histonas que é sintetizada fora da fase S serviria para substituir as
que envelhecem. Isso é incomum porque as histonas são bastante longevas e podem se manter
durante toda a vida da célula.
17- 14. A replicação constitui o prólogo da divisão celular
Como salientamos no começo do capítulo, quando a replicação termina, os cromossomos con têm uma dupla dotação de DNA e as moléculas gêmeas - ou seja, o par de cromátides - ficam
unidas pelo centrômero até a anáfase da divisão celular. Deste modo, a replicação do DNA constitui o prólogo da divisão e, por isso, parte do que analisamos neste capítulo terá que ser retomado
no próximo, dedicado à mitose e seu controle.
MUTAÇÃO DO DNA
17- 15. As alterações do DNA podem ser devidas a mutações gênicas ou a
aberrações cromossômicas
O material genético encontra-se em constante de perigo de ser alterado, não somente pela ação
de.agentes ambientais, mas também espontaneamente, como, por exemplo, em conseqüência de
erros que ocorrem durante a replicação.
Quando as alterações do genoma envolvem um ou poucos nucleotídeos , denominam-se mutações gênicas.
Outras vezes, as alterações são de tal magnitude que afetam o cariótipo e, por isso, levam o
nome de aberrações cromossômicas. Podem ser estruturais ou numéricas. Nas aberrações estruturais, estão afetadas partes extensas do cromossomo, que podem se perder, inverter, duplicar ou
translocar. Nas numéricas , ao contrário, o cariótipo exibe um número de cromossomos menor ou
maior que o normal.
Neste capítulo vamos nos ocupar exclusivamente das mutações gênicas, já que as aberrações
cromossôm icas serão analisadas no Cap. 20.
276
•
A REPLICAÇÃO DO DNA
17-16. As mutações gênicas têm diversas conseqüências
As mutações gênicas mais comuns são a substituição de um nucleotídeo por outro, a perda (ou
deleção) de um ou vários nucleotídeos, ou a inserção (intercalação) de um ou vários nucleotídeos
em uma molécula de D A. Qualquer que seja o tipo de mutação , há uma mudança na informação
conhecida no gene, o que determina a produção de uma proteína diferente da esperada ou a ausência de sua produção.
Como sabemos , a mudança de um nucleotídeo em um gene dá lugar a um códon diferente e,
conseqüentemente, provoca a presença na proteína de um aminoácido que não corresponde (a menos
que o novo códon seja "sinônimo" e, portanto, codifique o mesmo aminoácido). Muitas vezes, a
mudança de um único aminoácido produz alterações substanciais nas funções da proteína, já que
a modificação de sua estrutura primária modifica as estruturas secundária e terciária da molécula.
_A deleção ou a intercalação de um nucleotídeo em um gene altera o enquadramento dos códons no RNAm desde o local da mutação até o códon terminal (Cap. 16-3). Isso pode ser traduzido na produção de uma proteína aberrante ou, mais comumente, na interrupção de sua síntese, ao
aparecer um códon de terminação antes do lugar correspondente.
As mutações podem ocorrer nas célu las somáticas ou nas células germinativas. No primeiro
caso, embora sejam capazes de afetar o fenótipo dos indivíduos, não passam para a descendência.
No entanto, quando se instalam nas células germinativas podem ser transmitidas à descendência
e ser herdadas de geração em geração.
Para os indivíduos, as mutações podem ser prejudiciais. Por exemplo, quando correspondem a
proteínas envolvidas na morfogênese, as mutações se traduzem em malformações congênitas
anatômicas.
Outras vezes, as proteínas modificadas dão lugar a alterações funcionais ou a transtornos
metabólicos. Como exemplo das primeiras, podemos mencionar as hemoglobinopatias, nas quais
a presença de um aminoácido errado na hemoglobina pode gerar graves disfunções sangüíneas.
Ao contrário, nos transtornos metabólicos as enzimas que participam dos processos de síntese e
degradativos de diversas moléculas são alteradas.
As mutações também podem afetar genes necessários à sobrevivência das células ou genes
envolvidos no controle da multiplicação celular. No último caso, a proliferação das células pode
se descontrolar com a conseqüente aparição de quadros cancerígenos (Cap. 18-30). Consideradas
de um ângulo biológico global, as mutações gênicas têm um lado positivo, já que às vezes o seu
acúmulo no genoma forj a as condições para o aparecimento de indivíduos melhor adaptados ao
meio ambiente, base da evolução das espécies.
17-17. Existem vários tipos de mutações gênicas espontâneas
A maior parte das mutações gênicas que afetam as células ocorre espontaneamente, durante a
replicação do DNA. Isso ocorre porque quando são sintetizadas as cadeias-filhas podem ser inseridos nucleotídeos incorretos ou nucleotídeos de menos ou de mais. Como veremos nas seções
seguintes, a célula desenvolveu mecanismos especiais para corrigir esses erros e obter a maior
fidelidade possível na duplicação do DNA. Esses mecanismos eliminam 99,9% dos erros produzidos durante a replicação, de modo que, dos numerosos nucleotídeos incorretamente inseridos
cada vez que se copiam os milhões de pares de nucleotídeos do genoma humano, em média persistem errados somente três.
Também há mutações gênicas espontâneas alheias à replicação. Algumas aparecem em conseqüência da desaminação das bases dos nucleotídeos, dada a facilidade com que perdem seus grupos
amina. Como mostra a Fig. 17 .17, quando a citosina se desamina, converte-se em uracila, que se
emparelha com a adenina e não com a guanina. Se a célula não corrigir o erro substituindo a uracila
por uma citosina, na próxima replicação - quando assumir a cadeia-filha alterada no papel de cadeia progenitora - irá inserir uma adenina no lugar de uma guanina, e esta mutação se instalará no
genoma. Algo análogo ocorre - espontaneamente também - quando a adenina é desaminada e
uma vez convertida em hipoxantina emparelha-se com a citosina em vez de fazê-lo com a timina.
Outros tipos de mutações gênicas espontâneas aparecem com base na apurinização, ou seja,
quando uma base - particularmente uma purina - se desprende da desoxirribose do nucleotídeo
A REPLICAÇÃO DO DNA
CGATAACTAG
1 1 1 1 1 1 1
li
1
GCTATTGATC
Apurini zação
CGATAACTAG
li
1 1 1
GCT
1 1 1 1
TTGATC
A
•
277
Fig. 17.18 Conseqüência da
mutação gênica espontânea
produzida por apurinização.
(Fig. 17.18). Portanto, nesses pontos - chamados sítios AP (de apurínico ou apirimidínico) os genes são desprovidos de informação.
17- 18. Vários agentes ambientais provocam o aparecimento de
mutações gênicas
Há três grupos de agentes ambientais que ao atuar sobre as células provocam o aparecimento
de mutações: 1) os químicos, que são os mais difundidos; 2) as radiações. ionizantes, por exemplo,
a radiação ultravioleta da luz solar, os raios -y e os raios X, e 3) certos vfrus capazes de introduzir
segmentos de DNA estranhos nos genes.
Alguns destes agentes estimulam o aparecimento de mutações espontâneas no DNA (substituição de bases, deleções, intercalações, desaminações e apurinizações). Outros dão lugar a outros tipos de alterações . Por exemplo , os raios -y e os raios X produzem ruptura na dupla hélice,
enquanto a luz ultravioleta forma dímeros entre pirimidinas contíguas em uma das duas cadeias
do DNA. Os mais comuns são os dímeros de timina (Fig. 17 .19). A união entre duas timinas
vizinhas distorce seu pareamento com as adeninas da cadeia oposta, o que altera a replicação normal do DNA e conduz ao aparecimento de mutações.
REPARAÇÃO DO DNA
17-19. Existem vários mecanismos para reparar o DNA
Para cada tipo de alteração do DNA existe um mecanismo de.reparação especial_dirigido por
uma combinação de enzimas específicas. Em seguida, analisaremos os mecanismos mais freqüentes
utilizados pela célula para corrigir os errns no DNA. Na maioria dos casos, baseiam-se na informação genética complementar existente entre as duas cadeias da dupla hélice, de modo que se
uma delas sofrer alguma alteração (mutação) pode ser reparada a partir da informação normal
contida na outra. Como em qualquer processo biológico, os mecanismos reparadores de erros no
DNA podem falhar, com o conseqüente aparecimento de mutações gênicas.
17-20. A DNA polimerase corrige os erros que ela mesma comete
Durante a replicação do DNA, para que um nucleotídeo possa ser agregado na extremidade 3'
da cadeia-filha em crescimento é imprescindível que o nucleotídeo incorporado precedentemente
seja o que lhe corresponde. Além disso, se a DNA polimerase inserir acidentalmente um nucleotídeo incorreto, "percebe" o erro e não agrega novos nucleotídeos , de modo que o crescimento da
cadeia é interrompido temporariamente. O erro é corrigido pela própria enzima mediante o exercício de uma função adicional conhecida como "leitura de provas".
Assim, a DNA polimerase, ante a presença de um nucleotídeo inserido incorretamente, retrocede e o elimina. Para isso, utiliza a atividade exonucleolítica 3' ~5' de uma de suas subunidades.
Uma vez eliminado o nucleotídeo, a síntese do DNA progride normalmente.
Como vemos, durante a replicação, a DNA polimerase controla os erros que ela mesma comete e, além disso, os corrige. No entanto, dada a importância da integridade do DNA para a vida
F>.
CGATAACTAG
1 1 1 1 1 1 1 1 1 1
GCTATTGATC
;
Luz UV
A
CGA\ l iPTAG
1 1 1
GCT
1 1 1
ln\
"1 Ti(::,
ATC
Fig. 17.19 Formação de dímeros
de timina por ação da luz
ultravioleta.
278
•
A REPLICAÇÃO DO DNA
celular, se esta .. leitura de provas" falhar. entra em ação um segundo si stema de reparação que
fun ciona da maneira descrita na próxima seção.
17.21. Existe um segundo sistema de reparação a cargo de uma
nuclease reparadora
Em primeiro lugar. o ou os nucleotídeos errôneos são removidos por uma nuclease reparadora, a mesma que remove os primers na síntese contínua e descontínua do DNA (Seções 17-7 e 178). Para tanto, a nuclease corta a ligação fosfodiéster que conecta o nucleotídeo incorreto com o
nucleotídeo contíguo. A reparação é completada quando a D A polimerase 13 sintetiza a peça que
fal ta e a D A ligase une essa peça ao D A cortado.
Deve existir algum sinal que permita à nuclease reparadora distinguir em qual das duas cadeias
de DNA encontra-se o nucleotídeo incorreto. os procariotas, tal reconhecimento se basearia na
existência de uma diferença transitória na ínetilação de certas adeninas entre as duas cadeias depois da replicação . Como transcorre um tempo entre a síntese da cadeia-filha e a metilação, os
erros seriam reparados du rante esse período.
17-22. As desaminações e as apurinizações são reparadas
com as mesmas enzimas
O aparecimento de uracilas no DNA em lugar de citosinas - como conseqüência de desaminações
espontâneas - dá lugar a um mecanismo de reparação que utiliza uma DNA glicosidase específica.
Esta reconhece e corta a conexão entre a base errônea - a uracila - e a desoxirribose, de modo que
deixa o nucleotídeo sem sua base (Fig. 17 .20). De forma similar, outra DNA glicosidase específica
remove a hipoxantina que é produzida quando se desamina a adenina.
Os sítios AP que são gerados evoluem do seguinte modo: a desoxirribose sem base é removida
pela AP endonuclease e uma fosfodiesterase que cortam, respectivamente, a extremidade 5' e a
extremidade 3' do sítio AP e remov.em o açúcar. Depois a DNA polimerase 13 coloca o nucleotídeo correto no lugar vazio e a DNA ligase encerra a reparação.
Estes três últimos passos são utilizados também para reparar os sítios AP que são produzidos
como conseqüência das apurinizações espontâneas (Seção 17-17).
17- 23 . Na reparação dos dímeros da timina, intervêm duas nucleases
Geralmente, as mutações induzidas por agentes ambientais são reparadas pelos mesmos mecanismos utilizados para a correção das mutações espontâneas. Ao contrário, os dímeros de timina
(Fig. 17 .19) - produzidos pela luz ultravioleta - são removidos por um sistema de enzimas especiais, que hidrolisam simultaneamente duas ligações fosfodiéster uma a cada lado da lesão.
Assim , depois de reconhecer a distorção provocada pela presença do dímero, outras nucleases
cortam, na cadeia afetada, a quinta e a vigésima quarta ligação fosfodiéster, contadas a partir do
AGTG AC TTAG
TCA C TGAATC
°'"
mmação
DN A ligase
5
11
4
AGTGACT T AG
TCA U T GAATC
Fig. 17.20 Ação das enzimas que
reparam o DNA que sofreu
mutação por desami nação.
ON'~
AGTGACTTAG
T CA C TGAATC
r
ON' [.\
polimerase
AGTGACTTAG
TCA TGAATC
glicosidase
AGTGACTTAG
TCA - TGAATC
_Â
endonuclease
Fosfodiesterase
A REPLICAÇÃO DO DNA
•
279
dímero na direção 3' e 5', respectivamente. Em seguida. o segmento de 29 nucleotídeos - que
obviamente inclui o dímero - é separado da cadeia normal pela helicase, que corta as pontes de
hidrogênio entre as bases do segmento a ser removido e as bases da cadeia normal. A reparação se
completa quando a D A polimerase [3 substitui a peça ausente por um segmento de D A novo e
a DNA ligase o une ao DNA anterior.
Se uma das nucleases que removem os dímeros de timina for deficiente - como ocorre em
indivíduos homozigotos nos quais o gene da enzima tenha sofrido mutação - ocorre a doença
chamada xeroderma pigmentoso, caracterizada por uma extrema sensibilidade da pele aos raios
ultravioletas da luz solar. A exposição da pele a essas radiações dá lugar a uma alta incidência de
câncer cutâneo.
TRANSPOSIÇÃO DE SEQÜÊNCIAS DE DNA
17-24. Os transposons são segmentos de DNA que saltam de um lugar a
outro do genoma
Durante muitos anos acreditou-se na existência de uma estabilidade absoluta no ordenamento
dos nucleotídeos nos cromossomos e, portanto, dos próprios genes. o entanto, para alguns segmentos de DNA isso não é certo. Nó final da década de 40, Bárbara McC!intock descobriu segmentos de DNA que têm a propriedade de passar de um lugar a outro do genoma em cepas de
milho cujas espigas apresentam grãos de cores diferentes. Baseando-se em observações citogenéticas propôs que os grãos de cor clara eram produzidos por segmentos de DNA que mudam de
posição.e inativam o gene do grão pigmentado. Sua hipótese foi recebida com total descrença e
ignorada durante 20 anos, até que se fizeram observações equ ivalentes na Escherichia coli.
Foi observado que estes segmentos de D A transponíveis - ou transposons - são capazes
de codificar uma proteína denominada transposase e que em suas extremidades têm seqüências
de nucleotídeos iguais que foram unidas em sentidos opostos.
O número de nucleotídeos nestas repetições invertidas é fixo par<). cada transposon. No tranposon
hipotético ilustrado na Fig. 17 .21 observa-se o gene da transposase - que é uma enzima derestrição - com as seqüências de nucleotídeos repetidas em seus flancos. A transposase reconhece
estas seqüências de forma específica, corta-as e insere-as em um local diferente do genoma.
As seqüências repetidas presentes nos flancos do transposon são causa e conseqüência do
mecanismo pelo qual os transposons são extraídos de um lugar do genoma e inseridos em outro.
Como ilustra a Fig. 17 .22, durante esse processo a transposase efetua cortes espaçados, insere o
transposon e realiza as reparações necessárias no DNA.
Os transposons têm grande semelhança com o RNA dos retrovírus. As semelhanças são tão
grandes que os retrovfrus podem ser considerados transposons especializados que aprenderam a
saltar de uma célula eucarionte para outra. No ciclo dos retrovírus, a informação genética contida
no RNA é copiada no sentido retrógrado (RNA--7DNA) por uma enzima chamada transcriptase
reversa, e o DNA resultante é inserido no genoma da célula infectada.
Na mosca Drosophila melanogaster a maior parte do DNA repetitivo é representada por cerca
de 15 famílias de elementos transponíveis. Existem no genoma entre 20 e 80 cópias de cada família. Sabe-se que estas seqüências tendem a saltar de um lado a outro do genoma porque nas diferentes cepas de moscas os transposons estão localizados nos cromossomos em posições diferentes. Na cepa de olhos brancos, por exemplo, encontrou-se o elemento transponível em meio do
gene codificador da enzima que determina a cor vermelha do olho. A maioria das mutãções espontâneas na Drosophila é causada por transposons que saltam dentro de um mesmo gene.
No homem, os elementos transponíveis mais abundantes coITespondem aos DNA repetitivos
dispersos das famílias Alue Ll (Cap. 12-7), cujas seqüências constituem aproximadamente 10%
do genoma. A mudança de seqüências Alu pode acarretar conseqüências genéticas importantes.
Seqüência
repetida
Gene da transposase
Seqüência
repetida
Fig. 17.21 Transposon com o
gene da transposase e as
seqüências de nucleotídeos
inversamente repetidas em suas
extremidades.
280
•
A REPLICAÇÃO DO DNA
Cortes de DNA por meio da transposase
Fig. 17.22 Cortes espaçados no
DNA efetuados pela transposase.
Observe-se a inserção do
transposon e a reparação do
DNA.
'' / '
i 1 IJ ll .I i1tii
itdiilitdit
li "
lf f! 1 [ i ; ,
111~-.iil t ·
11J1I11111li111
''''''''''' ~''''''''\ '''''
11
1 !
ltlillldl\lililltiliJ
1 .. 1
1
!tttqr11•j!!i!'
!
!
""'"" f.. ''"""r;; ·~:·~: ':'.':~':'.",º,';':';;;i " ' ' " " .! ' ' '" " ' "
1
!! li
!
IJ
f 1 f 1f
li
1
li
1 !
!
'
{
t 1
j
1 t t
t j 1
tl
1 t f tt
tf
lf "
li
1 1 lf
1 '
!
1 1 1
li
! t
!!
'l 1
Reparação do DNA
Sabe-se, por exemplo, que ocorrem deleções (Cap. 20-10) em regiões não essenciais do DNA flanqueadas por outras seqüências Alu, e por isso a recombinação entre seqüências Alu dentro de alguns íntrons poderia criar genes novos.
Outro mecanismo capaz de criar genes novos é derivado da transposição de éxons, que ao combinar setores funcionai s de dois genes preexistentes pode levar à formação de um terceiro gene.
Por isso, considera-se que a flexibilidade genômica introduzida pelos elementos transponíveis foi
fundamental para a evolução. No entanto, a maioria dos genes novos apareceu pelo mecanismo de
duplicação genética (Cap. 20-1O) seguido por uma mutação na segunda cópia do gene. Isso é o
que ocorreu com os genes das globinas cx e Ri, que se formaram a partir de um gene ancestral comum.
17-25. As duplicações genéticas podem produzir pseudogenes
Muitos dos genes duplicados não se converterão em genes novos e sim nos chamados pseudogenes, que são incapazes de gerar RNA. Visto que não sofrem nenhum tipo de pressão seletiva,
esses pseudogenes - relativamente freqüentes no genoma dos mamíferos - acumulam mutações, o que pode conve11ê-los em genes funcionais.
17-26. Os pseudogenes processados originam-se pela transcrição inversa de
moléculas de RNA
O genoma também contém pseudo genes que não surgem por duplicação genética e sim a partir
dos RNA que foram copiados para DNA pela transcriptase reversa e inseridos no genoma. Esses
segmentos de DNA- que são conhecidos como pseudogenes processados - encontram-se normalmente nas células de todos os marrúferos. São ladeados por seqüências repetidas de DNA si milares às descritas nos transposons e poderiam ser "marcas" deixadas no genoma por alguns vírus portadores de RNA (retrovírus). A inatividade funcional dos pseudogenes é devida à falta de
substâncias reguladoras. Por outro lado, descobriram-se pseudogenes processados cujas composições são muito parecidas com as dos genes das imunoglobulinas, das globinas e da tubulina Ri.
BIBLIOGRAFIA
Autexier C. and Greider C.W. ( 1996) Telomerase and cancer: revisiting
the hypothesis. TIBS 21 :387.
Eramhill D. and Komberg A. (1988) A model for initiation at origins
of DNA replication. Cell 54:915.
Calos M. and Miller J. (1980) Transposable elements. Cell 20:579.
Chase J.W. and Williams K.R. (1986) Single-stranded DNA binding
protein required for DNA replication. Annu. Rev. Eiochem. 55: 103.
Chong J.P.J., Thommes P. and Blow J.J. (1996) The role of MCM/Pl
proteins in the licensing of DNA replication. TIBS 21: 102.
Dillin A. and Rine J. (1998) Roles for ORC in M phase and S phase.
Science 279:1733.
Drake J.W. (1991) Spontaneous mutation. Annu. Rev. Genet. 25: 125 .
Dubey D.D. et ai. (1996) Large, complex modular structure of a fission
yeast DNA replication origin. Cun. Eiol. 6:467.
Edmondson D.G. and Roth S.Y. (1996) Chromatin and transcription.
FASEE J. 10: 1173.
Gierl A. and Frey M. (1991) Eukaryotic transposable elements with short
terminal inverted repeats. Curr. Opin. Genet. Dev. 2:698 .
Greider C.W. and Elackburn E.H. (1996) Telomeres, telomerase and
cancer. Sei. Am. 274 (2):80.
Grossman L. , Caron P.R., Mazur S.J. and Oh E.Y. (1988) Repair of
DNA-containing pyrimidine dimers. FASEE J. 2:2629.
Harley C.E. and Yilleponteau E . (1995 ) Telomeres and telomerase in
aging and cancer. Curr. Opin. Genet. Dev. 5:249.
Huberman J.A. and Tsai A. (1973) Direction of DNA replication in
mammalian cells. J. Mo!. Eiol. 75:5.
A REPLICAÇÃO DO DNA
Jackson V. (1988) Deposition of newly synthesized histones: hybrid
nucleosomes are not tandemly arranged on daughter D TA strands.
Biochemistry 27:2109 .
Kaguni L.S. and Lehman I.R. (1988) Eukaryotic D1 A polymeraseprimase: structure, mechanism and function . Biachem. Biophys. Acta
950:87.
Karlseder J., Smogorzewska A. and de Lange T. (2002) Senescence
induced by altered telomere state, not telomere loss. Science 295: 2446.
Kolodner R.D. (1995 ) Mismatch repair: mechanisms and relationship
to cancer susceptibility. TIBS 20:397.
Lange T . (1998) Telomeres and senescence: Ending the debate. Science 279:334.
Lange T. (2001 ) Telomere capping: One strand fits all. Science 292 : 1075 .
Laskey R .A. , Fairman M.P. and Blow J.J. (1989) S phase of the cell
cycle. Science 246:609.
Leffell D .J. and Brash D.E. (1996) Sunligth and skin cancer. Sei. Aro.
275 (1):38 .
Li R. , Han non G.J. , Beach D . and Stillman B. ( 1996) Subcellular
distribution of p2 1 and PCNA in normal and repair-deficient cells
following DNA damage. Curr. Biol. 6:189 .
Lingner J., Cooper J. and Cech T.P. ( 1995) Telomerase and DNA end
replicati on: No longer a lagging strand problem? Science 269 : 1533.
Lingner J. et ai. (1997) Reverse transcriptase moti fs in the catalytic
subunit of telomerase. Science 276 :561.
Loeb L.A. (1985) Apurinic sites as mutagenic intermediares. Cell 40: 483.
Lohman T.M. (1993) Helicase-catalyzed DNA unwinding . J. Biai.
Chem. 268:2269.
Marx J. (1994) New link fou nd between p53 and RNA repair. Science
266: 1321.
•
281
Marx J. (1995) How DNA replication originates . Science 270:1585 .
Muzi-Falconi M., Brown G.W. and Kelly T.J. (1996) DNA replication:
controlling initiation during the cell cycle. Curr. Biai. 6:229.
Ogawa T. and Okazaki T. (1980) Discontinuous DNA replication. Annu.
Rev. Biachem. 49:42 1.
Prelich G. and Stillman B. (1988) Coordinated leading and lagging strand
synthesis during SV40 replication in vitro req uires PCNA. Cell
53:117.
Romanowski P. et ai. (1996) The Xenopus origin recognition complex
is essential fo r D A replication and MCM binding to chromatin.
Curr. Biai. 6: 1416.
Sa near A. (1994) Mechanisms of DNA excisio n repair. Sc ience
266:1954.
Sanear A. and Sanear G.B. (1988) DNA repair enzymes. Ann u. Rev.
Biachem . 57:29.
Seeberg E. , Lars E . and Bjorãs M. (1995) The base excision repair
pathway. TIBS 20:39 1.
Sharma A. and Mondragon A. (1995) DNA topoisomerases. Curr. Opio.
Struc. Biol. 5:39.
Sharp P.A. (1983) Conversion of RN A to DNA in mammals: Alu-like
elements and pseudogenes. Nature 301 :471.
Shinohara A. and Ogawa T. (1995) Homologous recombination and the
roles of double-strand breaks. TIBS 20:387.
Stillman B . (1996) Cell cycle contrai of DNA replication. Science
274: 1659 .
Wang J.C. (1991) DNA topoisomerases: why so many? J. Biol. Chem.
266:533.
Wevrick R. and Buchwald M . (1993) Mamrnalian DNA-repair genes.
Curr. Opio. Genet. Dev. 3:470.
A mitose
Controle do ciclo celular
MITOSE
18-1. Um indivíduo adulto é formado por cerca de 10 13 células
A capacidade de se reproduzir é uma propriedade fundamental da célula. Podemos ter uma idéia
da magnitude da reprodução celular se considerarmos que o indivíduo adulto é formado por bilhões de células ( 10 13 ) todas derivadas de apenas uma, o zigoto. A multiplicação continua sendo
notável ainda em um ser adulto que deixou de crescer. Um exemplo marcante é dado pelas hemácias (ou eritrócitos), cuja vida média é de apenas 120 di as. Deste modo , o organismo deve produzir aprÔximadamente 2,5 milhões de hemácias por segundo para manter seu número relativamente constante. Essa reprodução celular deve ser regulada de maneira perfeita para que a formação
de novas células compense as perdas e o equilíbrio seja mantido.
18-2. No ciclo celular intercalam-se períodos de
com divisões celulares
int~rfase
Como adiantamos no Cap. 17-11, as células passam por um ciclo que compreende dois períodos fundamentai s: a interfase e a di visão celular. Esta última ocorre por mitose ou meiose. Por
causa das profundas mudanças que o microscópio óptico permitia observar," o período de divi são
constituiu durante muitos anos o ponto de interesse primordial para os citologi stas, já que a interfase foi considerada como uma etapa de "repouso", apesar de ser o período no qual ocorrem as
funções mais importantes do ciclo celular, tanto no núcleo como no citoplasma. A maioria das
células passa a maior parte de sua vida em interfase, durante a qual - no caso de virem a se divi dir - todos os seus componentes se duplicam. Devemos assinalar que alguns tipos celulares diferenciados raras vezes se dividem, já que as células nervosas, depois do nascimento, não se divi dem em absoluto; assim, nos neurônios, o período de interfase dura toda a vida do indivíduo.
O ciclo celular pode ser considerado como uma série complexa de fe nômenos que culminam
quando o material celular duplicado se distribui nas células-filhas. A divisão celular é somente a
fase final e microscopicamente visível de modificações prévias em nível molecular. Assim , antes
que a célula se divida por mitose, seus principais componentes já se duplicaram. Neste aspecto, a
qivisão celular representa a separação final das uni dades moleculares e estruturais previamente
duplicadas.
18-3. A interfase compreende os períodos G1, Se G2
O uso de métodos citoquímicos forneceu os primeiros indícios de que a duplicação do DNA
ocorre durante a interfase. Mais tarde, a radioautografia com timidina marcada permitiu determinar o período exato em que ocone a duplicação do DNA e demonstrou que a síntese ocorre somente durante um período limitado da interfase, denominado fase S (por síntese de DNA) , que é
precedido e seguido pelas fases Gl e G2 (do inglês, gap , intervalo), nas quais não há síntese de
DNA. Isto levou a dividir o ciclo celular em quatro fases sucessivas: Gl, S, G2 e M (do inglês,
18
284
•
A MITOSE
Fig. 18.1 Alterações no conteúdo
do DNA nuclear durante as fases
do ciclo vital da célula. A letra e
representa a quantidade de DNA
contido em um jogo haplóide de
23 cromossomos. 2c, conteúdo
diplóide de DNA. 4c, conteúdo
tetraplóide de DNA.
«:
z
o
=r
/
G1
s
Duplicação
do DNA
G2
M
G1
s
G2
M
G1
Mitose
Tempo
mitosis) (Fig. 17.1 ). G2 é o tempo que transcorre entre o final da síntese de DNA e o começo da
mitose.
Como mostra a Fig. 18.1 , durante a fase G2 a célula contém o dobro (4c) da quantidade de
DNA presente na célula diplóide original (2c). Depois da mitose, as células-filhas entram na fase
G 1 e recuperam o conteúdo de D A das células diplóides (2c ).
18- 4. O período G1 é o mais variável do ciclo celular
A duração do ciclo varia muito de um tipo celular para outro. Em uma célula cultivada de
mamífero , com um tempo de vida total de 16 horas, a fase Gl dura 5 horas; a fase S, 7 horas; a
fase G2, 3 horas e a fase M, 1 hora (Fig. 18.2). Os períodos S, G2 e M são relativamente constantes na maioria dos tipos celulares. O mais variável é o período G 1, que pode durar dias, meses ou
anos. As células que não se dividem (como as nervosas ou as do músculo esquelético), ou que se
dividem pouco (como os linfócitos) encontram-se no período G 1, que nestes casos se denomina
GO porque as células se retiram do ciclo celular.
18-5. Descrição geral da mitose
Dissemos que a divisão celular compreende uma série de fenômenos pelos quais os materiais
primeiro se duplicam e, depois, se repartem em proporções virtualmente iguais entre as duas células-filhas. Todos os componentes da célula - não só os que estão relacionados com a transmissão da herança genética - duplicam-se antes que a célula se divida por mitose. Nos capítulos
respectivos são analisados os mecanismos pelos quais ocorre um aumento no número de algumas
organelas e o aumento de volume de outras. A mitose compreende também o problema da continuidade dos cromossomos como entidades capazes de se autoduplicar e de manter suas características morfológicas através das sucessivas divisões, o que torna necessário repassar os processos vinculados com a replicação do DNA e os que dão lugar ao enrolamento da cromatina.
Entre os processos que ocorrem no citoplasma, o mais notável é a formação do fuso mitótico,
que se organiza cada vez que a célula começa a se dividir e desaparece ao final da divisão. Veremos que é uma armação estrutural composta por microtúbulos que controlam a posição dos cromossomos e sua repartição entre as células-filhas. Os microtúbulos do fuso nascem de um par de
centrossomos que se formam durante a interfase quando o centrossomo se duplica como ilustrado
na Fig. 5.23(Sec,:ão18-12).
Fig. 18.2 Ciclo celular com a
duração de cada fase em uma
célula que se divide a cada 16
horas.
A MITOSE
•
Fig. 18.3 Esquema geral da
mitose.
PRÓFASE
PRÓFASE
METÁFASE
ANÁFASE
PROMETÁFASE
TELÓFASE
Como corolário da mitose ocorrem a partição do citoplasma e sua distribuição eqüitativa nas
fenômeno conhecido pelo nome de citocinese.
Os processos que dão lugar às mitoses são, em geral , semelhantes em todas as células do organismo. As Figs. 1.12 e 18.3 mostram as diferentes etapas da mitose que são consideradas como
fases de um ciclo que começa no final da interfase- o período intermitótico - e termina quando
se inicia a interfase seguinte. As etapas em que a mitose se_divide são: prófase, prometáfase,
metáfase, anáfase e telófase. A partir da penúltima começa a citocinese - ou separação dos dois
territórios citoplasmáticos-filhos - que culmina quando a telófase é concluída.
Primeiramente, as diferentes fases da mitose serão consideradas de maneira eminentemente
descritiva, dando uma idéia global dos fenômenos que ocorrem tanto no núcleo como no citoplasma. Nas seções posteriores serão abordadas a ultra-estrutura e a bioquímica de alguns destes fenômenos .
células-~lhas,
18-6. Durante a prófase, as cromátides se condensam, o fuso mitótico é
formado e o nucléolo se desintegra
A detecção dos cromossomos como filamentos delgados indica o começo daprófase. O termo
mitose (do grego mitos, filamento) expressa este fenômeno , que se toma mais evidente à medida
que os cromossomos continuam se condensando pelo enrolamento (ou espiralização) da cromatina. Como vimos no Cap. 17-1 , depois da duplicação do DNA na fase S cada cromossomo é composto por duas moléculas de DNA denominadas cromátides (Fig. 17.2). À medida que a prófase
avança, as c~omátides se tomam mais curtas e grossas . Além disso, os centrômeros (ou constrições primárias) tomam-se claramente visíveis pela associação , a elas (cromátides) , de duas placas
pr9téicas chamadas cinetócoros, os quais são voltados para os lados externos das crQIIlátides (Fig.
18.6). No início, os cromossomos são distribuídos homogeneamente no nucleoplasma, porém depois
se aproximam do envoltório nuclear, de modo que aparece um espaço vazio no centro do núcleo.
Este movimento centrífugo dos cromossomos indica que se aproxima o momento da desintegração do envoltório nuclear. Também podem ser observadas as constrições secundárias dos cromossomos 13, 14, 15 , 21e22. Outra modificação é a redução do tamanho do nucléolo até o seu desaparecimento.
Devido à desintegração do citoesqueleto, a célula tende a se tomar esférica; além disso, perde
seus contatos com as células vizinhas ou com a matriz extracelular. Simultaneamente, o RE e o
complexo de Golgi fragmentam- se em vesículas pequenas. Porém, o que mais se destaca no citoplasma é a formação do fuso mitótico. Trata-se de conjuntos de feixes de microtúbulos que sur-
285
286
•
A MITOSE
gem de ambos os centrossomos, os quais se distanciam reciprocamente pois se dirigem aos pólos
opostos da célula.
Mais adiante veremos como - e em que fases do ciclo celular - a célula fo rma o segundo
centrossomo. Como assinalamos no Cap. S-S, o centrossomo é integrado pela matriz centros sômica - que é o lugar de nascimento dos microtúbulos - e um par de centríolos. Dos centrossomos , as fibras do fuso irradiam-se em todas as direções, porém as mais significativas
são as que se estendem para o centro da célula, onde dão lugar a associações de importância
funcional.
18-7. Durante a prometáfase o envoltório nuclear se desintegra
Leva o nome de prometáfase a transição entre a prófase e a metáfase. Trata-se de um período
muito curto, durante o qual o envoltório nuclear (ou carioteca) se desintegra e os cromossomosalgo mais condensados - ficam em aparente desordem. Os centrossomos chegam aos pólos das
células e - já desaparecido o envoltório nuclear - as fibras do fuso invadem a área que o núcleo ocupava. Por suas extremidades livres , algumas fibras do fuso se conectam com os cinetócoros dos cromossomos; estas fibras são denominadas cinetocóricas. Outras fibras - chamadas
polares - estendem-se mais além do plano equatmial da célula e seus segmentos distais se entrecruzam com os segmentos provenientes do pólo oposto. Existe um terceiro tipo de fibras surgidas
dos centrossomos, as fibras do áster; são mais curtas, irradiam-se em todas as direções e suas
extremidades se acham aparentemente livres (Fig. l 8.4A).
Voltando às fibras cinetocóricas, é lógico pensar que, ao tratar de conectar- se com os cromossomos, não se unam aos cinetócoros todas ao mesmo tempo. Deste modo, considerando-se um
cromossomo em particular, quando se unem primeiramente a ele as fibras que vêm de um dos
pólos e depois as provenientes do pólo oposto, irá apresentar durante um tempo mov imentos de
distanciamento e de aproximação com relação ao plano equatorial da célula. Finalmente, quando
ambas as forças se equilibram, o cromossomo se mantém neste plano.
A
METÁFASE
~\'/~Z,
~!~~""
Fibras do áster
B
ANÁFASE A
Fig. 18.4 Fibras do fuso mitót ico
e seu comportamento na
metáfase (A), na anáfas e A (B),
na anáfase B (C).
A MITOSE
18-8. Durante a metáfase os cromossomos se colocam no
plano equatorial da célula
Na metáfase, os cromossomos - que chegaram a sua condensação máxima - aparecem ordenados no quadro da célula. Acomodam-se de modo tal que as duas placas cinetocóricas de cada
centrômero ficam orientadas para os pólos opostos da célula, "olhando" para os respectivos
centrossomos (Fig. l 8.4A).
18-9. Durante a anáfase, os cromossomos-filhos se dirigem
para os pólos da célula
Durante a anáfase, ocorre a partição das coesinas dos centrômeros (Cap. 17-1), fato que ocorre
quase simultaneamente em todos os cromossomos (Fig. 18.3). De imediato, as cromátides - ou
cromossomos-filhos - separam-se e começam a migrar para os pólos; fracio nadas pelas fibras
cinetocóricas do fu so. Os cromossomos podem adotar a forma de um V. Os braços do V nos cromossomos metacêntricos têm o mesmo comprimento, porém nos submetacêntricos e nos acrocêntricos
são desiguais (Cap. 12-16). O centrômero, no ângulo do V, precede as partes restantes do cromossomo em sua "corrida" até o centrossomo. Como é óbvio. neste processo os microtúbulos das fibras cinetocóricas se encurtam progressivamente (Fig. 18.4B). Ao contrário, aumenta o comprimento das fibras polares devido a um mútuo distanciamento dos pólos da célula, que por isso perde
sua forma esférica e adquire um aspecto ovóide (Figs. 18.3 e 18.4C).
18-1 a.. Durante a telófase formam-se os núcleos-filhos
A chegada dos cromossomos-filhos aos pólos - com o conseqüente desaparecimento das fibras cinetocóricas do fuso - assinala o início da telófase. A célula se alongou um pouco mais, de
modo que as fibras polares exibem um maior comprimento comparadas com as da anáfase. Os
cromossomos começam a se desenrolar e se mostram cada vez menos condensados; assim, de certa
forma, este processo representa a recapitulação do que aconteceu na prófase, porém em sentido
inverso.
Quando os cromossomos se convertem em fibras de cromatina desenroladas, estas são rodeadas por partes do RE, que se integram até formarem os envoltórios nucleares definitivos em tomo
dos núcleos-filhos. Além disso, nos núcleos reaparecem os respectivos nucléolos.
18-11. A citocinese reparte o citoplasma entre as células-filhas
A citocinese, quer dizer, a partição do citoplasma, inicia-se na anáfase. O citoplasma se
constringe na região equatorial pela formação de um sulco na superfície, que se aprofunda à medida que a célula se divide. Tanto as fibras do áster como as polares se reduzem até desaparecer.
Só sobrevivem os segmentos das fibras polares localizados na zona equatorial da célula; compõem
o chamado corpo intermediário, que analisaremos mais adiante (Fig. 18.7). Como é óbvio, estas
fibras ficam perpendiculares ao sulco que divide o citoplasma.
Finalmente, o citoesqueleto se restabelece e por isso as células-filhas adquirem a forma original da célula predecessora e se conectam com outras células (se pertencerem a um epitélio) e com
a matriz extracelular. Dirigidos pelo citoesqueleto, os componentes citoplasmáticos (mitocôndri~s, RE, complexo de Golgi etc.) se distribuem nas células-filhas como estavam na célula-mãe.
18- 12. O ciclo dos centrossomos compree nde a duplicação dos centríolos e
da matriz centrossômica
Os centrossomos começam a se duplicar durante a interfase, mais completamente ao final da
fase Gl ou no começo da fase S. Para se duplicar, os centríolos do diplossomo se separam e próximo de. cada um aparece um procentríolo, que se situa em ângulo reto com relação ao centríolo
preex istente (Fig. 18.5). Os procentríolos crescem lentamente durante as fases Se G2 e alcançam
seu tamanho definitivo no começo da prófase, que possui dois pares de centríolos. Cada par de
•
287
288
•
A MITOSE
Fig. 18.S Duplicação dos
centríolos antes do início da
mitose.
Procentríolo
cr
in
ta
nl
d<
ill
centríolos se acha em meio de sua matriz centrossômica proveniente da matriz centrossômica
original, que também se duplicou.
Como vemos, os centríolos não se duplicam por divisão nem a partir de um molde. Como os
procentríolos surgem a certa distância dos centríolos predecessores (não estão em contato), estima-se que estes últimos atuem como indutores e que organizem o material dos primeiros.
18-13. Os cinetócoros são os sítios de implantação dos microtúbulos
Como dissemos, as fibras do fuso mitótico que se unem aos cromossomos implantam-se nos
cinetócoros (Figs. 18.4 e 18.6). Estes estão aderidos ao centrômero, quer dizer, ao segmento mais
estreito do cromossomo (constrição primária). Assim, o centrômero não é somente o setor pelo
qual as cromátides-irmãs se unem entre si através das coesinas (Cap. 17-1 ), mas também o lugar
onde os microtúbulos do fuso se conectam - mediante cinetócmos - com os cromossomos. Nos
Caps. 12-7 e 12-11 vimos que a maior parte do centrômero conté!il DNA-satélite repetitivo e que
está em uma zona de heterocromatina constitutiva.
Os cinetócoros estão situados nos lados do centrômero voltados para as cromátides, de modo
que na metáfase - que é quando são mais bem visualizados - "olham" para seus respectivos
pólos celulares. Nos cortes transversais, o microscópio eletrônico revela que cada cinetócoro é
uma estrutura trilaminar composta por duas camadas densas de cerca de 50 nrn de espessura e
uma camada intermediária, mais clara, de 25 nm de espessura (Fig. 18.6).
A face externa do cinetócoro é convexa e nela se implantam entre 30 e 40 microtúbulos. Sua
face interna, no entanto, é plana e está em contato com a cromatina do centrômero. Foram observadas fibras de cromatina surgidas deste último , que ingressam na camada densa interna do cinetócoro e que depois de se dobrarem sobre si mesmas retornam ao cromossomo. Aparentemente,
mantêm os cinetócoros ligados ao centrômero. Voltando a face externa, ela tem uma espécie de
coroa fibrosa e as extremidades dos 30 a 40 microtúbulos que se ancoram em sua superfície estão
associadas a proteínas motoras das famílias da dineína e da cinesina (Cap. 5-8) (Fig. 18.6).
Fig. 18.6 Estrutura do
centrômero em um cromossomo
metafásico. Observam-se os
cinetócoros, nos quais estão
implantadas as fibras
cinetocóricas do fuso mitótico.
ro
D
<lf
p1
qt
c
e
di
ci
1
iI
a
A MITOSE
Mais adiante analisaremos o papel que os cinetócoros desempenham durante a separação dos
cromossomos-filho s na anáfase.
A esclerodermia é uma enfermidade humana que gera auto-anticorpos chamados CREST (pelas
iniciais de calcinosis, Raynaud' s phenoinenon, esophageal dysphagia, sclerodactyly e telangiectasia), os quais reagem contra os cinetócoros. Isso permitiu usá-los como marcadores para reconhecer e estudar as proteínas cinetocóricas, especialmente as motoras das famílias da cinesina e
da dineína e as que estabilizam a união do cinetócoro com a cromatina do centrômero.
Os auto-anticorpos CREST permitiram identificar as proteínas cinetocóricas em todas as etapas do ciclo celular, apesar de aparecerem associadas aos centrômeros a partir da fase S, que é
quando começariam a ser formados os cinetócoros .
Com a ajuda dos auto-anticorpos CREST foram localizados os genes que codificam as proteínas cinetocóricas e determinaram-se suas seqüências. Eles encontram-se nos próprios centrômeros , entre o DNA repetitivo satélite que os caracteriza. Assim, além de serem compostos por esse
DNA- que possui a seqüência alfóide mencionada no Cap. 12-7 - os centrômeros contêm os
genes das proteínas cinetocóricas.
Nos cinetócoros dos cromossomos humanos foram identificadas, entre outras, seis proteínas
denominadas CENP-A, CENP-B, CE~TP -C , CENP-D, CENP-E e CENP-F (do inglês, centromere
protein) . A CENP-A e a CENP-B estão associadas às fi bras de cromatina do centrômero, de modo
que não estão localizadas no cinetócoro e sin1 na heterocromatina vizinha. A CENP-C encontrase na camada densa interna do cinetócoro entre as fibras de cromatina que a une ao centrômero.
Com relação à CENP-D sua localização e suas funções não são conhecidas. Finalmente, tanto a
CENP-E como a CENP-F encontram-se na camada densa externa do cinetócoro com a finalidade de ref orçar a ancoragem dos microtúbulos do fus o mitótico. A CENP-E, que é a cinesina mencionada anteriormente, encontra-se também na face externa do cinetócoro.
18-14. Os microtúbulos do fuso mitótico são estruturas
dinâmicas
No citosol, normalmente existe uma quantidade abundante de tubulinas livres que estão em
equilíbrio dinâmico com as tubulinas dos microtúbulos (Cap. 5-7). Quando a célula começa a
prófase, os microtúbulos interfásicos se despolimerizam e são construídos os do fuso mitótico.
Assim, na mitose, só existem túbulos pertencentes ao fuso. Na anáfase, com o deslocamento dos
cromossomos para os pólos, o fu so começa a se despolimeri zar, pelo menos suas fibras
cinetocóricas. Na telófase, o mesmo ocorre com as fibras do áster e as fibras polares, embora estas
últimas não o façam em toda sua extensão, pois persistem os segmentos pertencentes ao corpo
inte1mediário (Seção 18-11 ). Finalmente, antes da citocinese se completar, começam a reaparecer
os primeiros microtúbulos interfásicos.
No Cap. 5-6, vimos que as duas extremidades dos microtúbulos mostram polimerizações e
despolimerizações diferentes, já que na extremidade [ + ] o crescimento e o encurtamento são mais
rápidos do que na extremidade [ - ] (Fig. 5.6). Diferentemente dos citoplasmáticos, nos microtúbulos mitóticos , a extremidade [ - ] não está bloqueada pela matriz centrossômica, de modo
que os microtúbulos do fu so podem se polimerizar e polimerizar também por essa extremidade
(Cap. 5-10).
18- 15. Os microtúbulos deslocam os centrossomos na prófase e os
cromossomos na prometáfase e na metáfase
Os microtúbulos são capazes de gerar forças mecânicas - de impulso e de tração - sobre os
cinetócoros e, por conseguinte, sobre os cromossomos. O impulso e a tração são conseqüências,
respectivamente, do alongamento e do encurtamento dos microtúbulos (Fig. 18.4B).
Durante a prófase, a migração dos centrômeros para os pólos se deve ao fato de eles serem
empurrados pelo alongamento dos microtúbulos esticados entre eles. Como entre os segmentos
entrecruzados dos microtúbulos polares - na zona equatorial da célula - foi detectada uma proteína motora bipolar da família das cinesinas, não se descarta que o deslizamento de uns sobre
outros em sentidos opostos seja um mecanismo adicional usado pela célula para trasladar os
•
289
290
•
A MITOSE
centrossomos para os pólos. os fibroblastos, a separação dos centrossomos é realizada a uma
velocidade de 0,8 a 2,4 µm/minuto.
a prometáfase, tão logo começa a desintegração do envoltório nuclear e a região do núcleo é
invadida pelos microtúbulos, as pontas das fibras cinetocóricas estabelecem contato com os cinetócoros e os cromossomos começam a se mobilizar para o equador da célula. Este traslado é conseqüência do alongamento e do encurtamento simultâneos dos microtúbulos cinetocóricos provenientes dos pólos opostos. Durante a metáfase existe um tipo de equilíbrio entre as forças exercidas pelos microtúbulos de ambos os pólos, que mantém os cromossomos imobilizados no equador celular.
18-16. Outros tipos de força mobili zam os cromossomos
na anáfase
Na anáfase rompe-se este equilfbrio, o que provoca a partição dos centrômetros e, por conseguinte, a separação das cromátides-filhas e a mobilização dos novos cromossomos para os pólos.
Isto é feito a uma velocidade de 1 µm/minuto.
A forma característica em V adotada pelos cromossomos indica que as forças responsáveis pela
tração - como resultado do encurtamento dos microtúbulos cinetocóricos - são transmitidas
aos cinetócoros. Um momento antes essas forças foram suficientemente intensas para provocar a
partição dos centrômetros.
Existem duas teorias para explicar a migração dos cromossomos durante a anáfase: a do equilíbrio dinâmico e a do deslizamento.
A teoria do equiffbrio dinâmico sustenta que a despolimerização dos microtúbulos - em suas
duas extremidades - é a responsável exclusiva pelo traslado; assim, a força mecânica derivada
do desmonte dos microtúbulos bastaria para trasladar os cromossomos.
A teoria do deslizamento , mesmo reconhecendo a despolimerização dos microtúbulos, considera que estes se comportam como "trilhos" sobre os quais os centrômeros se deslocam mediante
alguma proteína motora associada aos cinetócoros.
18-17. Durante a anáfase, o alongamento da célula agrega um fator
adicional para a migração dos cromossomos até os pólos
Na anáfase, o traslado dos cromossomos inclui dois processos distintos, porém concomitantes,
que permitem dividir este período em duas etapas , a anáfase A e a anáfase B. Durante a anáfase
A, o traslado dos cromossomos para os pólos corresponde aos movimentos descritos na seção
anterior, vinculados aos microtúbulos cinetocóricos. Ao contrário, na anáfase B, o mútuo distanciamento dos conjuntos cromossômicos ocorre como conseqüência do alongamento que a célula
sofre e, por isso , está vinculado ao crescimento dos microtúbulos das fibras polares (Fig. 18.4C).
Na Seção 18-15 , vimos que entre os segmentos entrecruzados destas fibras existe uma proteína
motora bipolar do tipo cinesina e, por este motivo, é possível que o deslizamento de alguns microtúbulos polares sobre outros constitua um recurso complementar para afastar os cromossomos da
região equatorial da célula.
18-18. O envoltório nuclear é reconstituído durante a telófase
No Cap. 12, descrevemos o envoltório nuclear com suas duas membranas , os componentes dos
poros e a lâmina nuclear.
Ao finalizar a prófase, a lâmina nuclear se desmonta (pela despolimerização dos filamentos
laminares), o envoltório nuclear (carioteca) se desintegra em vesículas (como ocorre com o RE)
e os complexos do poro ficam ligados a elas.
Quando a célula chega à telófase, as vesículas derivadas da desintegração do envoltório nuclear se fundem entre si e constroem os envoltórios dos núcleos das células-filhas , com seus respectivos complexos do poro. Simultaneamente, os filamentos laminares se repolimerizam e formam
as lâminas nucleares.
A MITOSE
•
291
18- 19. Durante a mitose, o RNA não é sintetizado e diminui a
produção de proteínas
A síntese de RNA (ou transcrição do D A) se detém na mitose. Deste modo , a velocidade
desta síntese declina rapidamente na prótase tardia e desaparece na metáfase e na anáfase. Assim ,
como ocorre na interfase com os setores heterocromáticos, o D A não pode ser transcrito porq ue
se acha muito compactado (Cap . 14-12).
Por seu turno , a síntese protéica - a partir de moléculas de RNA formadas com antecedência
- diminui drasticamente durante a mitose, quase a 25 % da que ocorre durante a interfase.
A síntese dos RNA e das proteínas começa a se recuperar a partir da telófase.
18-20. A citocinese é gerada quando se forma um anel contrátil
composto por actina e miosina li
Apesar de na telófase os microtúbulos do fuso tenderem a se despolimerizar e a desaparecer, as
fibras polares persistem na zona equatorial da célula, onde sua quantidade aumenta. Essas fibras
remanescentes do fu so mitótico , junto com vesículas e material denso que se lhes associam , compõem uma estrutura chamada corpo intermediário (Fig. 18 .7).
A citocinese - ou clivagem celular - é deri vada de um sulco no equador da célula que aparece na segunda metade da anáfase (Fig. 18.3). Na telófase, o sulco equatorial se aprofunda até
alcançar o corpo intermediário, o que indica que a partição do citoplasma está por terminar (Fig .
18.8).
O .desenvolvimento do sulco equatorial é o resultado da formação de um anel contrátil no córtex
da célula (Fig. 18.7). Ele consta de um feixe de aproximadamente 20 filamentos de actina circunferenciais situados por baixo da membrana plasmática, perpendiculares aos microtúbulos do corpo intermediário. Esses filamentos deslizam uns sobre os outros em sentidos opostos pela presença de proteínas motoras do tipo da miosina II (Cap. 5-31). Considerando-se que o anel não aumenta de espessura à medida que seu diâmetro é reduzido, acredita-se que os filamentos de actina
vão perdendo monômeros por despolimerização.
O lugar onde se forma o anel contrátil seria determinado - ao finalizar a anáfase - pelos
microtúbulos do áster, cujas extremidades livres se trasladariam para o equador da célula e induziriam a polimerização de monômeros de actina debaixo da membrana plasmática.
A MITOSE NAS CÉLULAS VEGETAIS
18-21. Nas células vegetais, a mitose é um pouco diferente da
observada nas células animais
Existem diferenças entre animais e vegetais na divisão das células somáticas. Aqui somente
assinalaremos as diferenças, já que a maioria dos processos registrados na divisão celular mitótica
é comum a ambos os tipos de células.
N os vegetais superiores - como os angiospermas e a maioria das girnnospermas - as mitoses são anastrais, isto é, faltam os centríolos e as fibras do áster (Fig. 18.9). Isto é o que levantou
a suspeita de que os centríolos não sejam indispensáveis para a formação dos microtúbulos.
Para dar lugar à citocinese, a região intermediária do fu so mitótico se transforma no fragmoplasto, que equivale ao corpo intermediário das células animais (Fig. 18.9).
Anel contrátil
Fig. 18.7 Citocinese. O corpo
intermediário e o anel contrátil
estão desenhados em separado,
embora ambas as estruturas
apareçam simultaneamente.
292
•
A MITOSE
Fig. 18.8 Eletromicrografia de uma célula no final da citocinese. As futuras células-filhas se encontram
unidas por uma pequena ponte que contém os microtúbulos do corpo intermediário, eletronicamente muito
denso. 1O.OOO X e 30.000 X. (Cortesia de B. R. Brinkley.)
O fragmoplasto começa a se formar em meados da anáfase. No plano equatorial da célula, o
microscópio eletrônico permite ver que os microtúbulos das fibras polares do fuso se associam a
um material denso e a vesículas derivadas do complexo de Golgi.
No início, o fragmoplasto se dispõe como um anel na periferia da célula, porém depois, pela
agregação de novos microtúbulos e vesículas, cresce centripetamente até se estender por todo o
plano equatorial. As vesículas aumentam de tamanho e se fundem entre si. Dão lugar - nas células-filhas - a membranas plasmáticas relativamente contínuas, fenômeno que coincide com a transformação do fragmoplasto em uma estrutura chamada placa celular (Cap. 3-30). Esta assenta as
bases para a formação da parede celular (Cap. 6-15) que é atravessada por túneis muito pequenos
denominados plasmodesmas, que permitem a passagem de líquidos e .solutos entre os citoplasmas
das células contíguas.
A MITOSE
•
293
Fig. 18.9 Esquema da mitose na
célula vegetal. Observe-se a falta
. de centríolos e de fibras do áster.
Prótase
Prometáfase
~~ Fi brapolar
~~ l ~~---
~ Fibracinetocórica
Metáfase
Anáfase
Anáfase
M
Fragmoplasto
~
~
Telóíase
CONTROLE DO CICLO CELULAR
18-22. Existem mecanismos que controlam a dinâmica dos ciclos celulares
As células se reproduzem para possibilitar o crescimento corporal e substituir as que desaparecem por envelhecimento ou morte programada (Cap. 22-1). Também o fazem durante certas situações patológicas, como a reparação de feridas. Para poder se reproduzir, a célula primeiro duplica o conteúdo de seu núcleo e de seu citoplasma e em seguida divide estas estruturas em duas.
A multiplicação celular aparece ao se iniciar a vida embrionária, com a segmentação da célula-ovo (Cap. 21-7). Em função da rapidez com que as divisões de segmentação se sucedem, somente os materiais nucleares dessa célula se duplicam (Fig. 19.3). Portanto, os componentes de
seu enorme citoplasma se vão repartindo entre as sucessivas células-filhas. Esta forma de divisão
termina quando nas células do blastocisto se recupera a relação nucleocitoplasmática das células
somáticas (Caps. 1-14 e 21-7).
No Cap. 17, vimos que o DNA e as moléculas que o acompanham se duplicam durante a fase
S do ciclo celular. A duplicação dos componentes citoplasmáticos engloba as fases G 1, S e G2.
Na célula, há mecanismos especiais para coordenar os processos de síntese no núcleo e no citoplasma e determinar o início e a conclusão das fases do ciclo celular. As próximas seções destinam-se ao estudo desses mecanismos.
18-23. No controle do ciclo celular intervêm ciclinas e cinases
dependentes de ciclinas
Pouco antes de finalizar afase Gl - cuja duração varia nos distintos tipos celulares - há um
momento em que a célula toma a decisão de se dividir. Recebe o nome de ponto de partida ou de
ponto de controle Gl (Fig. 18.10) . Oportunamente, veremos que a decisão é tomada diante da
presença de substâncias indutoras provenientes de outras células.
No controle das divisões celulares-, intervêm dois tipos de moléculas: 1) as ciclinas, cujo nome
se deve a que, no curso de cada ciclo celular, alternam um período de síntese crescente seguido
por outro de rápida degradação; 2) as cinases dependentes de ciclinas, que ao interagir com as
ciclinas fosforilam e ativam as moléculas responsáveis pela divisão celular.
Há várias classes de ciclinas, cujas concentrações se elevam e descem em diferentes momentos do ciclo celular. As principais correspondem a dois grandes grupos: as ciclinas G 1 e as ciclinas
M. Por sua vez, nas espécies superiores são identificadas duas cinases dependentes de ciclinas, a
294
•
A MITOSE
Fig. 18.10 Diagrama que ilustra
as mudanças de concentração
das ciclinas G 1 e mitótica
durante o ciclo celular. A
primeira se associa com a cinase
Cdk2, com a qual forma o
complexo SPF. Ao contrário , a
segunda se associa à cinase Cdc2
e forma o complexo MPF.
Cdk2
SPF
MPF
....................................................................................................................
,......................... ....
.........................................................................
······················· ............. ·············· ........................
Cdc2
Ciclina G1
Ciclina M
s
G1
~
~
M
G
Ponto de partida
Cdk2 (do inglês , cyclin -dependent protein kinase) e a Cdc2 (do inglês, cell-division cycle). Todavia, a existência no genoma de uma numerosa farm1ia de genes relacionados com estas cinases
indica que intervêm ainda várias mais na regulação das diferentes etapas do ciclo celular.
18-24. A fase Socorre quando a ciclina Gl ativa a Cdk2
Tomada a decisão de se dividir, a célula deixa para trás a fase G 1 e entra na fase S, ou seja,
começa a replicar seu DNA. Isso acontece quando uma ciclina Gl ativa a cinase Cdk2, a qual
inicia uma cadeia de fo sforilações em proteínas intermediárias sucessivas. A cadeia culmina com
a ativação das moléculas responsáveis pela replicação do DNA.
A Cdk2 é ativada somente quando a ciclina G 1 alcança um determinado limiar de concentração, já que este é um requisito indispensável para que a ativação ocorra (Figs. 18.1 Oe 18.11 ). Além
disso, a partir desse momento, a Cdk2 e a ciclina G 1 se unem e compõem um complexo protéico
denominado SPF (do inglês , S phase-promoting fa ctor).
O SPF provoca a abertura das origens de replicação e ativa as moléculas envolvidas na síntese
do DNA, como as DNA polimerases, a helicase etc. Como assinalamos no Cap. 17-4, a SFP atua
por meio do complexo pré-RC.
Como em certo momento da fase ~ a concentração da ciclina G 1 começa a declinar, quando
fica abaixo do limiar anteriormente citado separa-se da Cdk2, com o que o SPF deixa de existir.
As ciclinas são degradadas por proteassomas (Cap. 4-6).
Das duas moléculas, a ciclina G 1 é a única cuja concentração varia, já que os níveis da Cdk2 se
mantêm constantes ao longo do ciclo celular. Por outro lado , a ciclina G 1 começa a ser sintetizada
a partir do ponto de partida, aumenta durante grande parte da fase S, em um momento em que esta
começa a declinar e desaparece na fase G2 (Fig. 18.10).
Em uma fase S normal, o DNA se replica somente uma vez, pois se assim não fosse, as célulasfilhas teriam um número de cromossomos maior que o normal. O impedimento para o aparecimento de novas duplicações do DNAjá replicado depende do complexo protéico ORC (Cap. 17. 4). Os quadros derivados de alterações no controle deste processo são denominados poliploidias
e serão analisados no Cap. 20-8.
18-25. Na fase G2 atuam mecanismos de segurança
A pausa imposta pela fase G2 dá à célula um período de tempo durante o qual atuam mecanismos de segurança para controlar - antes que a célula se divida - se as moléculas de DNA completaram a sua replicação e, quando for o caso, se foram reparadas (Cap. 17-19). Além disso, na
fase G2, a duplicação dos componentes citoplasmáticos se completa.
18- 26. A fase M ocorre quando a ciclina M ativa a Cdc2
Superados esses controles, começa afase M. O mecanismo que desencadeia a mitose é similar
ao que inicia a fase S, apesar dos diferentes protagonistas, pois na mitose intervêm a Cdc2 e a
ciclina M. A segunda começa a ser sintetizada a partir da fase G2, antes que desapareça a ciclina
G 1 (Fig. 18 .10). Quando a ciclina alcança um determinado limiar de concentração, une-se à Cdc2
e ambas as moléculas compõem um complexo denominado MPF (do inglês, M phase-promoting
factor) (Figs. 18.10 e 18. 11).
A MITOSE
,,. ..... ..... -~
G2
M
G1
[ICiclina G 1
295
Fig. 18.11 Formação dos
complexos SPF e MPF durante o
ciclo celular.
/
s
•
o
Cdk2
Em seguida, ativada pela ciclina M, a Cdc2 fosforila - diretamente por cinases intermediárias
- diversas proteínas citosólicas e nucleares, em particular as que regulam a estabilidade dos filamentos do citoesqueleto, as que compõem os filamentos laminares da lâmina nuclear, as histonas
Hl etê . Vejamos algumas conseqüências destas fo sforilações :
1) A rede de filamento s de actina se desintegra, de modo que a célula perde contato com as
células vizinhas (ou com a matriz extracelular) e se toma esfé rica.
2) Os microtúbulos se desmontam , embora os do fuso mitótico se formem.
3) A lâmina nuclear se desagrega, e com ela o envoltório nuclear.
4) A associação da histona Hl com o DNA se modifica, o que aumenta o enrolamento da cromatina e a compactação dos cromossomos.
Quando a divisão celular termina, estes e outros fenômenos se revertem porque as proteínas
que os produzem se desfosforilam por causa da desativação da Cdc2. Por sua vez, a Cdc2 se desativa
porque a concentração da ciclina M cai a um nível inferior àquele necessário para que ambas as
moléculas se mantenham unidas formando o MPF.
A dissociação do MPF ocorre no começo da anáfase e tem lugar unicamente se todos os cromossomos chegarem ao plano equatorial das células e todos os cinetócoros se ligarem aos microtúbulos cinetocóricos do fuso mitótico, o que então assegura a segregação normal dos cromossomos-filhos e seu deslocamento para os respectivos pólos celulares.
Ficou comprovado que os cinetócoros que não se ligam aos microtúbulos do fuso produzem
um sinal que impede a queda da ciclina M - quer dizer, a dissociação do MPF - para que a
célula detenha a mitose antes que comece a anáfase.
Em condições normais, esse sinal não é gerado e a célula entra em anáfase. Ela o faz depois de
formar um complexo protéico chamado ciclossoma ou APC (do inglês, anaphase-pi·omoting
complex) , que induz a degradação da ciclina Me das coesinas que unem as cromátides entre si
(Cap. 17-1 e Seção 18-9).
18- 27. Se a fase G1 for muito prolongada passa a se chamar GO
As células-filhas derivadas da mitose ingressam na fase Gl da interfase e, se induzidas por
certos fatores (Seção 18-28), repetem o ciclo seguido pela célula predecessora e voltam a se dividir. Caso contrário, a fase G 1 se prolonga - às vezes indefinidamente - e a célula "se retira" do
ciclo, motivo pelo qual a fase Gl passa a se chamar fase GO (Fig. 18.2).
Uma situação diametralmente oposta ocorre nas divisões celulares da segmentação da célulaovo, nas quais a fase G 1 praticamente não existe. Dado que a fase 02 tampouco existe, a interfase
se reduz à fase S, o que explica sua curta duração (Seção 18-22).
296
•
A MITOSE
18-28. Diversas substâncias induzem a proliferação celular
O ritmo com o qual as células se reproduzem depende de diversos fat~res que variam nos diferentes tipos celulares. Por exemplo, as células que surgem da segmentação da célula-ovo, parecem ter um mecanismo intrínseco, que, de forma automática, desencadeia uma divisão quando se
conclui a precedente. Por outro lado, as células que não se dividem permanecem na fase GO porque em seus citoplasmas não há ciclinas nem cinases dependentes de ciclinas, provavelmente pela
presença de fatores que inibem sua produção.
as células restantes - cujo ritmo de reprodução varia de acordo com o caráter particular de
cada uma - as mitoses dependem de substâncias indutoras provenientes do exterior, seja de
células vizinhas (secreção parácrina) ou de grupos celulares distantes (secreção endócrina). No
Cap. 11-2, assinalamos que esses indutores atuam sobre receptores específicos. As substâncias
que induzem a proliferação celular o fazem no momento do ciclo chamado ponto de partida. A
alteração que provocam no receptor promove a síntese da ciclina G 1.
Entre as moléculas indutoras da multiplicação celular se encontram:
1) A somatomedina, que estimula a proliferação das células cartilaginosas durante o crescimento ósseo. Esta substância é sintetizada no fígado , em resposta ao hormônio do crescimento
(produzido pela hipófise).
2) Vários indutores chamados fatores de crescimento , em sua maioria, segregados por células
localizadas na vizinhança das células-alvo (secreção parácrina). Assim, os fatores de crescimento
fibroblástico (FGF), epidérmico (EGF) e o fato r derivado das plaquetas (PDGF) estimulam a proliferação de muitos tipos celulares, não somente os sugeridos por seus nomes. Outros exercem
ações mais específicas; trata-se dos fatores de crescimento dos hepatócitos (HGF), dos nervos (NGF)
e do endotélio vascular (VEGF) . No Cap. 11-12, descrevemos os receptores celulares para estes
fatores e o modo como são conduzidos seus sinais no interior das células.
3) Vários tipos de fatores hemopoéticos, cada um responsável pela proliferação de um tipo
particular de célula sangüínea. Assim, a interleucina 2 (IL-2) estimula a multiplicação dos linfócitos T; o fator estimulante das colônias de granulócitos e macrófagos (GM-CSF) faz o mesmo
com os elementos progenitores destas·células etc. Finalmente, a e1itropoetina, originada nos rins,
é o fator hemopoético encarregado de estimular a proliferação das hemácias na medula óssea. A
IL-2 e o GM-CSF são produzidos por células vizinhas às células-alvo (secreção parácrina), enquanto a eritropoetina chega à medula óssea através do sangue (secreção endócrina).
A secreção das substâncias indutoras é regulada por mecanismos que tendem a manter um
número adequado ou mais ou menos constante de células de cada um dos tipos celulares. Por
exemplo, a quantidade de eritropoetina segregada pelos rins é proporcional à destruição das hemácias no sangue e alcança níveis consideráveis no caso de hemorragias. Uma situação similar
ocorre com a ablação parcial do fígado, na qual são segregadas grandes quantidades de HGF; este
fator estimula a multiplicação dos hepatócitos próximos à ferida, que cessa quando o órgão recu---~
pera o seu tamanho normal.
18-29. A proteína P53 controla o estado do DNA antes que a
célula ingresse na fase S
Antes de ingressar na fase S, a célula controla o estado de suas moléculas de DNA. O controle
é exercido por uma proteína citoplasmática chamada PS3 (por sua massa molecular de 53 kDa),
que é sintetizada pela própri a célula em resposta ao aparecimento de alterações em seu DNA. O
gene p53 que a codifica pertence a uma categoria de genes conhecidos como supressores de tumores , chamados assim por causas que veremos mais adiante.
A P53 comporta-se como um fator de transcrição que promove a expressão dos genes de outras
proteínas reguladoras - chamadas P21 e P16 - que têm por missão bloquear a atividade da Cdk2.
Uma vez que este efeito se opõe ao das ciclinas G 1, a célula não replica suas moléculas de DNA
e permanece na fase G 1. Finalmente, se for comprovado que o dano no DNA é perigoso para as
futuras células-filhas, a proteína P53 volta a atuar, porém agora para provocar a morte da célula e
com ela o desaparecimento do DNA danificado (Cap. 22-6).
No que diz respeito à proteína P21, se não for suficiente para bloquear a Cdk2, resta-lhe outro
A MITOSE
recurso para irrwedir a mitose: no começo da replicação do D A ela se une à braçadeira deslizante de PCNA (Cap. 17-7) e anula sua função.
Na célula, existem outras proteínas reguladoras da proliferação celular, como a proteína Rb (a
sigla Rb se deriva do tumor da retina chamado retinoblastoma), codificada pelo gene rb , que também é supressor de tumores. A proteína Rb inibe a proliferação celular, quando está fosforilada, e
o faz mediante o bloqueio dos genes de certas proteínas necessárias à replicação.
18-30. Muitos tipos de câncer são produzidos pelo acúmulo de
alterações genéticas
Embora existam múltiplas causas ambientais envolvidas no aparecimento de quadros cancerígenos, sabe-se que, em algumas famílias, apresentam-se certos tipos de câncer com uma incidência maior que a habitual, o que levou à investigação das possíveis bases genéticas da doença. Foram
descobertos dois tipos de genes ligados ao câncer, os protooncogenes e· os genes supressores de
tumores. A alteração dos primeiros produz um aumento da proliferação celular, enquanto a falta
dos segundos leva à perda dos mecanismos normais que detêm a proliferação .
O câncer não é gerado a partir de células normais que se transformam exclusivamente em células malignas. Pelo contrário , surge ao final de sucessivas gerações de células que passam por
estados pré-cancerosos cada vez mais acentuados. Estes estados são conseqüência da soma progressiva de mutações em protooncogenes e em genes supressores de tumores - que ativam os
primeiros e inativam os segundos - o que, depois de certo tempo, instala a doença nas células
descendentes.
Alé.m disso, nas células cancerosas, os cromossomos às vezes parecem rotos ou com partes
translocadas e alguns se encontram várias vezes repetidos. Parece que estas alterações não são
conseqüência do desenvolvimento tumoral e sim que estejam associadas as suas causas.
18-31. Os protooncogenes são genes normais, e os oncogenes,
suas versões defeituosas
Os protooncogenes são genes normais que codificam proteínas implicadas no controle da proliferação celular e da morte celular. Até o momento foram caracterizados aproximadamente 100,
entre eles os que codificam as seguintes proteínas (os nomes dos genes figuram entre parênteses):
1) Os fatores de crescimento PDGF (sis), EGF (Cap. 11-12) e GM-CSF (Seção 18-28).
2) Os receptores dos fatores de crescimento PDGF, EGF (erb-B) (Cap. 11-12) e GM-CSF (fms).
3) A proteína Ras (ras) , que é fosforilada por receptores com atividade de tirosinocinase (Cap.
11-12).
4) A serina-treonina cinase Raf (raf) que é ativada pela proteína Ras (Cap. 11 -J1) .
5) As tirosinocinases Src (src) , Fes (fes) e Abl (abl).
~6) O receptor do hormônio tireóideo (erb-A) , localizado no citosol (Cap. 11-6).
7) Várias proteínas nucleares que atuam como fatores de transcrição, por exemplo, as proteínas Myc (myc), Myb (myb), Fos (fos) e Jun Uun). Os produtos dos genes que ativam promovem
a proliferação celular.
8) A proteína Bcl-2 (bcl-2) está incluída nesta categoria não porque se encontre implicada no
,controle da proliferação, mas sim na sobrevivência das células (Cap. 22-4).
A denominação de protooncogenes é devida ao fato de que, como o resultado de mutações,
podem dar lugar a suas versões defeituosas: os oncogenes. Estes se diferenciam dos normais porque são transcritos desmesuradamente, e geram quantidades excessivas de seus produtos, ou porque sua transcrição origina produtos aberrantes. Em ambos os casos trazem como conseqüência
um aumento descontrolado da proliferação celular ou uma diminuição da morte celular (Cap . 22).
Diversos vírus são portadores de oncogenes. Acredita-se que entraram no genoma virai como
protooncogenes quando - em alguma ocasião remota - esses vírus infectaram células de animais e os "removeram"; uma vez instalados no genoma vira!, os protooncogenes se transformaram em oncogenes. Respalda essa hipótese o fato de que nos vírus os óncogenes não cumprem
nenhuma função. Na atualidade, quando esses vírus infectam diversas espécies animais, os on-
•
297
298
•
A MITOSE
cogenes que lhes transferem são causa de quadros cancerígenos (por exemplo, o sarcoma de Rous
no frango, provocado pelo oncogene src) .
Embora vários cânceres que afetam a espécie humana estejam assóciados a infecções virais
(por exemplo, o vírus da hepatite B aumenta a incidência de carcinoma hepático; o papilomavírus
aumenta o aparecimento de câncer do colo do útero; o vírus da AIDS faz o mesmo com o sarcoma
de Kaposi etc.) felizmente nenhum dos cânceres humanos é gerado por oncogenes transferidos
por vírus. A presença de oncogenes nas células cancerosas humanas se deve ao aparecimento de
defeitos nos próprios protooncogenes, quando o DNA se altera por mutações gênicas ou por aberrações cromossômicas estruturais (Caps. 17-16 e 20-10).
Um só alelo alterado de um protoonconcogene é suficiente para transformar a célula normal
em uma célula cancerosa ou que pode chegar a sê-lo. Vejamos alguns exemplos de alterações de
protooncogenes na espécie humana.
Foram observadas mutações no protooncogene ras , em muitos tipos de tumores, e ficou comprovado que esse gene pode ser alvo de diversos carcinógenos, o que confirma a função de seu
análogo alterado - o oncogene ras - no desen.volvimento do câncer. Como conseqüência da
superexpressão do oncogene ras são geradas grandes quantidades de proteína Ras, que ativa outras moléculas envolvidas na proliferação celular (Cap. 11 -12).
a leucemia mielogênica crônica, o protooncogene abl , presente normalmente no cromossomo 9, é translocado ao cromossomo 22, onde se funde com o gene bcr (Cap. 20-17). A união
dá lugar a uma tirosinocinase Abl híbrida, cuj a atividade é manifestamente maior que a da Abl
normal.
Finalmente, em alguns neuroblastomas, o protooncogene myc pode estar amplificado cerca de
300 vezes.
18-32. Os genes supressores de tumores previnem a multiplicação
anormal das células
Enquanto os produtos dos protoor:cogenes promovem o crescimento celular, os derivados dos
genes supressores de tumores inibem a reprodução excess iva das células. Assim, os defeitos dos
genes supressores de tumores - com base em mutações gênicas ou aberrações cromossômicas
- deixam a célula sem esses "freios" naturais. Por conseguinte, se a célula adquire outros defeitos genéticos - agora estimulantes da atividade mitótica - gera um quadro cancerígeno.
Como os genes supressores de tumores são recessivos , o defeito se manifes ta quando os dois
alelos do gene são alterados (Cap. 20-3).
Até o momento foram caracterizados cerca de 10 genes supressores de tumores . Entre eles se
encontram:
O gene p53, situado no braço curto do cromossomo 17. A mutação de seus ale los - com a
conseqüente falta de proteína P53 - explica a gênese de muitos tumores. As células sem proteína
P53 não controlam o estado de suas moléculas de DNAantes da replicação (Seção 18-29). Isto
provoca o acúmulo de alterações genéticas nas sucessivas gerações celulares - por exemplo, nos
protooncogenes - o que propicia o aparecimento de muitos tipos de câncer.
Algo similar ocon-e quando são alterados os dois alelos do gene rb , pertencente ao braço longo
do cromossomo 13. Neste caso, devido a fal ta de proteína Rb , é produzido um tumor maligno na
retina dos meninos, embora também se tenham detectado defeitos do gene rb em cânceres de muitos
outros tecidos. Os defeitos nos dois alelos são variados, já que se pode encontrar mutação em ambos,
ambos ausentes (por deleção), um com mutação e um ausente etc.
Outros genes supressores de tumores são: 1) o gene mcc (do inglês, mutated in colon carcinoma), pertencente ao cromossomo 5; 2) o gene dcc (do inglês, deleted in colon carcinoma ), localizado no cromossomo 18; 3) o gene apc (do inglês, adenomatous polyposis of the colon) localizado no cromossomo 5 (não aparentado com o complexo protéico APC visto na Seção 18-26) e 4) o
gene wt (do inglês, Wilms' kidney tumor), residente no cromossomo 11 .
A MITOSE
•
299
BIBLIOGRAFIA
Bailly E. and Bomens M. (1 992) Centrosome and cell div ision. ature
355:300.
Bishop J.M. (1981 ) Enemies wi thin: the genesis of retrovirus oncogenes. Cell 23 :5.
Bishop J.M. (1 982) Oncogenes. Sei . Am. 246 (3):69.
Bishop J.M. (1991 ) Molecular themes in oncogenesis. Cell 64 :23 5.
Cantley L.C. et ai. (1 99 1) Oncogenes and signal transduction. Cell
. 64:281.
Cao L.G. and Wang Y.L. (1 990) Mechan ism of the format ion of
contracti le ring in di viding cultu red animal cells . II. Cortical
movement of microinjected actin filaments. J. Cell Biai. 11 1: 1905.
Cavenee W.K. and White R. (1 995) The genetic basis of cancer. Sei.
Am. 272 (3):50.
Cobrinik D. et al. (1992) The retinoblastome protein and the regulation
of cell cycling. TIBS 17:312.
Cross F. , Roberts J. and Weintraub H. (1989) Simple and complex cell
cycles . Annu. Rev. Cell Biai. 5:341.
Cross M. and Dexter T.M. (1991 ) Gro wth factors in development,
transformation, and tumorigenesis. Cell 64:27 1.
Culotta E. and Koshland D.E. Jr. (1993) p53 sweeps thro ugh cancer
research. Science 262 : 195 8.
Dunphy W.G. , Brizuela L., Beach D. and ewpo rt J. (1988) The
Xenopus cdc2 protein is a component of MFP , a cytoplasmic
regulator of mitosis. Cell 54:433.
Dupree P. (1996) Cell division fo1ms a pattem. Curr. Biol. 6:683 .
Fang F. and Newport J.W. (1991 ) Evidence that the Gl -S and G2-M
tl'ansition s are contro ll ed by di ffe rent cdc2 prateio in higher
eukaryotes. Cell 66:73 1.
Gerace L. and Blobel G. (1 988) The nuclear lamina is reversibly
depol ymerized during mitosis. Cell 19:277 .
Glotzer M., Murray A.W and Kirschner M.W. (1991) Cyclin is degraded
by_!he ubiquitin pathway. Nature 349: 132.
Johnston L.H. (1990) Periodic events in the cell cycle. Curr. Opin. Cell
Biai. 2:274.
.
Kaufmann W.K. and Paules R.S. (1996) D 1A damage and cell cycle
checkpoints. FASEB J. 10:238.
Kirschner M. (1992) The cell cycle then and now. TIBS 17 :281.
Li R., Hannon G.J., Beach D. and Stillman B. (1996) Subcellular
distribution of p2 1- and PCNA in normal and repair-deficient cells
follo wing DNA damage. Curr. Biol. 6: 189.
Liao H. , Li G. and Yen T.J. (1994) Mitotic regulation of microtubule
crass-linking activity of CENP-E kinetochore pratein. Science
265:394.
Lucocq J.M. and Warren G. (1987) Fragmentation and partitioning of
the Golgi apparatus during mitosis in HeLa cells. EMBO J. 6:3239.
Mann D.J. and Jones N.C. (1995) E2F-1 but not E2F-4 can overcome
pl6-induced G 1 cell-cycle arrest. Curr. Biai. 6:474.
Mazia D. (1987) The chromosome cycle and the centrosome cycle in
-th~rnJtotic cycle. Int. Rev. Cytol. 100:49.
Mcintosh J.R. and McDonald K.L. (1989) The mitotic spindle. Sei . Am.
261 (4):48.
McNeill P.A. and Bems M.W. (1981) Chromosome behavior after laser microirradiation of a single kinetochore in mitotic PtK2 cells. J.
Cell Biol. 88:543 .
Murray A.W. and Szostak J. W. (1985) Chromosome segregation in
mitosis and meiosis. Annu. Rev . Cell Biol. 1:289.
Murray A.W. and Kirschner M.W. (1989) Cyclin synthesis drives the
early embryonic cell cycle. Nature 339:275.
Murray A.W. , Solomon M.J. and Kirschner M.W. (1989) The role of
cyclin synthes is and degradation in the contra! of maturation
promoting fac tor acti vity. Nature 339:280.
Murray A.W. and KirschnerM.W. (1991 ) What contrais the cell cycle?
Sei. Am. 264 (3):56.
Murray A. and HuntT. (1 993) The Cell Cycle. Oxford University Press,
Oxford.
Muzi-Falconi M. , Brown G. anáKelly T. (1996) DNA replication:
controlling initiation during the cell cycle. Curr. Biol. 6:229.
icklas R.B.. ( 1997) How cells get the right chramosomes. Science
.275:632.
Nigg E.A. (1 993) Targets of cyclin-dependent protein kinases. Curr.
Opin. Cell Biol. 5:1 87.
islow C. , Lombillo V.A., Kuriyama R. and Mcintosh J.R. (1992) A
plus-end-directed motor enzyme that moves antiparallel microtubules
in vitro localizes to the interzone of mitotic spindles. Nature 359:543.
urse P. (1990) Universal contrai mechanism regulating onset of Mphase. Nature 344:503 .
Perry M.E. and Levine A.J. (1993) Tumor suppressor p53 and the cell
cycle. Curr. Opin . Genet. Dev. 3:50.
Peter M. et al. (1990) ln vitro disassembly of the nuclear lamina and M
phase specific phosphorylation of lamins by cdc2 kinase. Cell 61 :591.
Pluta A.F. et ai. (1995) The centromere: Hub of chromosomál activities.
Science 270: 159 1.
Ridley A.J. (1995) Rho-related proteins: actin cytoskeleton and cell
cycle. Curr. Opin. Genet. Dev. 5:24.
Rosenblatt J. , Gu Y. and Morgan D.O. ( 1992) Human cyclin-dependent
kinase 2 is ac tivated during the S and G2 phases of the cell cycle
and associates with cyclin A. Proc. Natl. Acad . Sei USA 89:2824.
Ro wley J .D. (19 83) Human oncogene locations and chramosome
aberrations. Nature 30 1:290.
Sherr C.J. (1993) Mammalian G 1 cyclins. Cell 73: 1059.
Straight A.F. (1997) Cell cycle: Checkpoint proteins and kinetochores.
CmT. Biol. 7:R613.
Sunkel C.E. and Coelho P. (1995) The elusive centromere: sequence
divergence and functional conservation. Curr. Opin. Genet. Dev.
5:756.
Theriot J.A . and Satterwhite L.L. (1997). New wrinkles in cytokinesis .
Nature 385:388.
Vafa O. and Sullivan F. (1997) Chramatin containing CENP-A andasatellite DNA is a major component of the inner kinetochore plate.
Curr. Biol. 7:897 .
Vallee R. (1990) Dynein and the kinetochore. Nature 345:206.
Weinberg R.A. (1990) The retinoblastoma gene and cell growth contra!. Trends Biachem. Sei. 15:199.
Weinberg R.A. (1991) Tumor suppressor genes. Science 254:1138.
Winey M. (1996) Genome stability: keeping the centrosome cycle on
track. Curr. Biol. 6:962.
Yu H. et al. (1996) Identification of a novel ubiquitin-conjugating
enzyme involved in mitotic cyclin degradation. Curr. Biai. 6:455.
A meiose
Fecundação
MEIOSE
19-1. A meiose e a reprodução sexual
A meiose é um tipo especial de divisão celular, exclusiva dos organismos que se reproduzem
de forma sexuada. Em muitos protozoários, algas e fungos, a reprodução é assexuada, ou seja, por
divisão celular simples ou mitose. este caso, todos os descendentes têm uma herança que provém de um só antecessor. Na maioria dos organismos multicelulares (animais e vegetais), no entanto, a reprodução é realizada por meio de gametas ou .células sexuais geradas por meiose espe~matozóides e ovócitos (oócitos) nos animais - os quais se unem por um processo denominado fecundação. Isso dá origem ao zigoto ou célula-ovo, que porta o material hereditário dos
progenitores e se reproduz por mitose até formar um novo indivíduo multicelular.
As Figs. 1.12 e 19.1 mostram os fenômenos básicos da meiose (do grego, meioum, diminuir).
O genoma humano possui 46 cromossomos (44 + XY no homem; 44 + XX na mulher). Se a
divisão fosse por mitose, cada gameta teria 46 cromossomos e o zigoto 92. Visto que isto se repetiria por gerações sucessivas, o número de cromossomos se duplicaria de geração em geração. A
meiose é o mecanismo usado pelos organismos para evitar que isso ocorra. Assim, mediante duas
divisões celulares consecutivas, as células sexuais reduzem à metade o número de seus cromossómos, com geração de gametas haplóides (quatro espermatozóides no homem, um ovócito e corpúsculos [ou glóbulos] polares na mulher). Os processos que levam à produção de gametas chamados espermatogênese e ovocitogênese (oocitogênese) - ocorrem nas gónadas, ou seja,
nos testículos e nos ovários.
É oportuno lembrar que para entender os aspectos mais importantes da citogenética (Cap. 20)
o leitor deve ter uma clara compreensão da meiose, tanto de sua dinâmica estrutural como de sua
bioquímica .
. Neste capítulo descreveremos a meiose como um tipo especial de divisão celular. Nela são
prodmidas: 1) a redução do número de cromossomos à metade; 2) a recombinação genética, ou
seja, o intercâmbio de segmentos cromossômicos, e 3) a segregação aleatória dos cromossomos
homólogos paternos e matemos.
Define-se como cromossomos homólogos os dois cromossomos praticamente idênticos - um
fornecido pelo pai e outro pela mãe - que convivem nas células diplóides. Como nas células
somáticas humanas existem dois jogos haplóides de 23 pares de cromossomos cada um - um
jogo haplóide proporcionado pelo espermatozóide e outro proporcionado pelo ovócito - diz-se
que há 23 pares de homólogos (Fig. 12.15).
19-2. Diferenças entre a mitose e a meiose
Muitos dos fenômenos que ocorrem na mitose também ocorrem na meiose. Por exemplo, a
seqüência de alterações no núcleo e no citoplasma, os períodos de prófase, prometáfase, metáfase, anáfase e telófase, a formação do fuso mitótico, a condensação dos cromossomos, a evolução
dos centrômeros etc. Existem, no entanto, diferenças essenciais :
19
302
•
A MEIOSE
Fig. 19.1 Esquema da
espermatogênese e da
ovocitogênese na espécie
humana. Observam-se três
divisões mitóticas sucessivas por
parte das espermatogônias e das
ovogônias, as ryspecti vas
divisões meióticas e a
fecundaçãó do ovócito II (22 +X)
pelo espermatozóide (22 +X ou
22+Y).
HOME M
cf
e
8
e<:m"og~e
/\
Sj? MU LHER
~'"''";~8
/\
Mitose r f
\
/\
8/ \ 8/ \ 8/ \ 8/ \ o/ \ 8/ \ 81\ 81\
8888
8 88888888
l
l
l
l
j
l
i
!
j
Espermatócito 1 8
Espermatóci tos li
I
Espermátides
8
8 8
,/
\
\
I
888
l
l
l
Meiose/
,/
e
Meiose li
I
P,
'-..___./
1
''"~'"'';'1jJ~
~+xx
!
l
o vócitol
\
(:::} 8"J
'-..___./
\
l
j
Ovócito li e
primeiro corpúsculo polar
\
8
óvuloe
segundo corpúscu lo polar
/
--e
0 Zigotos ,,....x
:i: (células-ovo) V
1) A mitose ocorre nas células somáticas e a meiose nas células sexuais.
2) Na mitose, cada replicação do DNA é seguida por uma divisão celular; em conseqüência, as
células-filhas apresentam a mesma quantidade de DNA que a célula-mãe e um número diplóide
de cromossomos. Por outro lado, na meiose, cada replicação do DNA é seguida por duas divisões
celulares - a meiose I e a meiose II - das quais resultam quatro células haplóides que contêm
a metade do DNA (Figs. 1.12 e 19.2).
3) Na mitose, a síntese de DNA ocorre durante a fase S, que é seguida pela fase 02. Na meiose,
a fase Sé mais longa e a fase 02 é curta ou ausente (Fig. 19.3) .
4) Na mitose, cada cromossomo evolui de forma independente. Na meiose - durante a primeira de suas divisões - os cromossomos homólogos se relacionam entre si (se emparelham) e
intercambiam partes de suas moléculas (se recombinam) (Figs. 1.12 e 19.2).
5) A duração da mitose é curta (aproximadamente 1 hora), enquanto a meiose é bastante longa
(no homem consome 24 dias e na mulher vários anos).
6) Outra diferença fundamental é que na mitose o material genético permanece constante nas
sucessivas gerações de células-filhas (a menos que ocorram mutações gênicas ou aberrações cromossômicas), enquanto a meiose gera uma grande variação genética.
19- 3. Descrição geral da meiose
Como se observa na Fig. 19 .1, as divisões meióticas começam depois de várias divisões mitóticas das espermatogônias e das ovogônias, ou seja, das células germinativas menos diferenciadas do testículo e o ovário.
Ao término das divisões mitóticas, parte das espermatogônias e das ovogônias se diferenciam,
respectivamente, em espermatócitos I e em ovócitos I , os quais levam a cabo a meiose 1. Como
corolário da primeira divisão meiótica, são gerados os espermatócitos II e o ovócito II , que são
as células que realizam a meiose II. Finalmente, a segunda divisão meiótica culmina com a formação das espermátides e do óvulo.* Devemos acrescentar que as espermátides se convertem
*N.R.T.: Isto quando o ovócito (oócito) II, uma vez fecundado, completa a sua divisão de maturação.
A MEIOSE
Leptóteno
Zígóteno
Prófase
Paquíteno
Diptó teno
'""""
B
e
'" " ' ~*
ll~)
'"'~'" ~:~
~
"-~ : ~
G•m•••
~~
~
A
~~ e} ~
e
c
):.1
~~ ,:
Fig. 19.2 Esquema geral da meiose que ilustra o emparelhamento dos cromossomos homólogos, o
intercâmbio de alguns de seus segmentos e a segregação dos cromossomos. Os cromossomos procedentes
de cada progenitor estão representados em azul e em vermelho, respectivamente.
em espermatozóides e que - pelas causas que assinalaremos na Seção 19-15 * - na mulher o
ovócito II recebe o nome de óvulo.
A Fig. 19.3 mostra as divisões mitóticas e meióticas das células germinativas, a formação do
zigoto e as duas primeiras divisões de segmentação (as características gerais das divisões de segmentação são estudadas nos Caps. 18-22 e 21-7). Além disso, assinala também a condição haplóide ou diplóide e o conteúdo do DNA nuclear das células que realizam estes processos, de cuja
análise se ocupam as próximas seções.
'''N.R.T.: Em nota anterior, e mais adiante, explica-se tal impropriedade.
•
303
304
•
A MEIOSE
19-4. A meiose compreende duas divisões celulares
Já dissemos que a meiose compreende duas divisões celulares. A meiose I se distingue da meiose
II (e da mitose) porque sua prófase é muito longa e em seu transcurso os éromossomos homólogos
se pareiam e se recombinam para intercambiar material genético .
Os períodos da mitose são insuficientes para descrever os fenômenos que ocorrem na meiose,
cujos estágios progridem na seguinte ordem:
l
Prófase I
MEIOSE I
Pré-leptóteno
Leptóteno
Zigóteno
Paquíteno
Diplóteno
Diacinese
Prometáfase I
Metáfase I
Anáfase I
Telófase I
Interfase
MEIOSE II
l
Prófase II
Metáfase II
Anáfase II
Telófase II
Em primeiro lugar analisaremos detalhadamente as mudanças que ocorrem durante a meiose 1
- começando pelos estágios da prófase 1 - que, como vimos, têm lugar nos espermatócitos 1
e nos ovócitos 1.
19-5. Durante o pré-leptóteno os cromossomos são difíceis de ser
observados
Fig. 19.3 Células germinativas
diplóides (D) e haplóides (H) e
alterações no conteúdo do DNA
nuclear durante as mitoses que
precedem as divisões meióticas,
no transcurso destas últimas, nos
gametas, na célula-ovo (zigoto) e
nas duas primeiras divisões de
segmentação. Espermatogônias e
ovogônias (marrom).
Espermatócitos I e ovócitos I
(amarelo). Espermatócitos II e
ovócitos II (azul).
Espermatozóides (vermelho) (o
·óvulo* não existe na espécie
humana). Zigotoj v{,·de). Células
embrionárias derivadas da
primeira divisão de segmentação
(violeta). Fase G 1 do ciclo
celular (GI). Fase G2 (G2) . Fase
S ou duplicação do DNA (S).
Conteúdo simples do DNA (1 e).
Conteúdo duplo do DNA (2c).
Conteúdo quádruplo do DNA
(4c).
*N.R.T. : Só quando o ovócito II é fecundado, pois o que é expelido pelo
ovário não é o óvulo e sim o ovócito
II.
O pré-leptóteno corresponde à prÓfase inicial da mitose. Os cromossomos são muito delgados
e difíceis de ser observados.
19-6. Durante o leptóteno os cromossomos parecem ser simples
Ao começar o leptóteno (do grego leptós, delgado, e nêma, filamento) o núcleo aumenta de
tamanho e os cromossomos se tomam visíveis (Figs. 19.2 e 19.4A). Além disso, apresentam uma
grande diferença com relação aos cromossomos da prófase mitótica: apesar de seu DNA ter-se
duplicado (durante a fase S) e, portanto, conter duas cromátides cada um, parecem ser simples em
vez de duplos. Com freqüência, a maioria dos cromossomos se dobra e suas duas extremidades
(os telômeros) se fixam em uma área circunscrita do envoltório nuclear próxima do centrossomo.
D
D
H
D
H
D
4c
<(
z
o
Q)
LJ
Q)
LJ
"'
02 2c
e:
o"'
::l
1c
G1
t
Meiose 1
t Meiose
t li
lnterfase
Seqüência das divisões celulares
R
t
Mitose
R
t
Mitose
A MEIOSE
A L EPTÓTENO
e
B PAQUÍTENO
•
•
305
DIPLÓTENO INICIAL
..
- r'c
D DIPLÓTENO TARDIO
E DIACINESE
/
•
-
I
I f
F METÁFAS E 1
Fig. 19.4 Etapas da meiose na lagosta Laplatacris dispar (2n
G ANÁFASE li
=
22
.'
,
+ X). O cromossomo X aparece ass inalado por uma seta. (De F. A. Sáez.)
306
•
A MEIOSE
19-7. Durante o zigóteno ocorre o emparelhamento dos cromossomos
homólogos, entre os quais se forma o complexo sinaptonêmico
Durante o zigóteno (do grego zygón, parelha) ocorre o primeiro fenômeno essencial da meiose: os cromossomos homólogos se alinham entre si mediante um processo.denominado emparelhamento ou sinapse (Fig. 19.2) . O emparelhamento compreende a formação de uma estrutura
complex a - observada com a aj uda do microscópio eletrônico - conhecida com o nome de complexo sinaptonêmico (CS) (Figs. 19.5, 19.6 e 19.7) . O processo pode começar em qualquer ponto
dos cromossomos. Assim , em alg uns casos, os homólogos se unem primeiro ao nível de uma de
suas extremidades e a união progride até a outra extremidade, como um zíper. Em outros, no entanto, a associação ocorre simultaneamente em vários pontos ao longo dos homólogos. O emparelhamento é muito exato e específico, pois ocorre ponto por ponto entre os homólogos. Contudo,
os cromossomos ficam separados por uma distância de 200 nm, que é ocupada pelo complexo
sinaptonêmico . Em termos moleculares , essa separação é considerável, pois o diâmetro do DNA
é de 2 nm e algumas partes de ambos os DNA devem deslocar-se 100 nm para poder se encontrar
e se recombinar em meio a esse espaço.
O CS é formado por dois componentes laterais e um componente central (Figs. 19.5 , 19.6 e
19.7). Os componentes laterais se desenvolvem ao final do leptóteno e o central aparece durante
o zigóteno. Sobre cada componente lateral aplicam-se as duas crom átides-irrnãs de um dos cromossomos homólogos.
Em um corte transversal , os componentes laterais estão separados do componente central por
espaços regulares de largura idêntica. Em conjunto , o CS tem o aspecto de uma escada, com degraus que a cruzam em intervalos de 20 a 30 nm. Tais degraus, formados por filamentos muito
delgados, parecem cruzar toda a largura do CS , desde um componente lateral ao outro (Fig. 19.6).
Tanto os filamentos transversais como os componentes laterais contêm proteínas fibrilares.
Nas cromátides-irrnãs, as fibras de 30 nm formam alças, cada uma das quais contém 5 e 25 µm
de DNA. Como ilustra a Fig. 19.8 , du rante o leptóteno, as alças de cromatina têm uma disposição
frou xa no eixo do cromossomo. Depois, à medida que a cromatina se condensa, as alças aparecem
cada vez mais juntas ao lado dos componentes laterais do CS. Além disso, do mesmo modo que
nos cromossomos mitóticos , nos cromossomos meióticos há um arcabouço de proteínas não histonas para sustentar as alças de cromatina (Fig. 19.8); a diferença com os meióticos é que a estes
são agregados os componentes do CS .
Fig. 19.S Eletromicrografia que
mostra os componentes laterais
(/)e o componente central (e) do
complexo sinaptonênÍico entre
os cromossomos homólogos.
Observe-se a maneira pela qual
os telômeros se fixam ao
envoltório nuclear (EN).
A MEIOSE
•
307
A fixação dos telômeros ao envoltório nuclear ordena espacialmente os cromossomos ,
o que favorece o alinhamento dos homólogos. Uma vez formados os CS , suas extremidades também se inserem no envoltório nuclear (Fig. 19.5). os P<?ntos onde o fazem aparecem espessamentos chamados placas de fixação.
Uma das funções do CS é estabilizar o emparelhamento dos homólogos e faci litar sua
recombinação . Assim , as moléculas protéicas de seus componentes laterais permitem que
os DNA dos cromossomos homólogos se disponham de maneira tal que o intercâmbio entre
eles acabe favorecido . Em conseqüência. o CS deve ser considerado uma armação protéica que é construída para que se produza o alinhamento e a recombinação dos homólogos .
Quando começa o emparelhamento, o encurtamento dos cromossomos já é muito pronunciado e existe pelo menos uma relação 300: 1 entre o comprimento do D A e o comprimento do cromossomo. Isto significa que somente 0,3% do D A dos cromossomos
homólogos está em contato direto com os componentes laterais do CS.
~,,,.___
19-8. Durante o paquíteno, as cromátides homólogas se recombinam
Durante o paquíteno (do grego pachys, grosso), os cromossomos se encurtam e o emparelhamento dos cromossomos homólogos se completa (Figs. 19.2 e 19.4B) . Porém, o
mais importante deste período é que ocorre o intercâmbio de segmentos de DNA entre as
cromátides homólogas, fenômeno que leva o nome de recombinação genética (em inglês, crossing-over) (Fig . 19.9).
A sucessão de eventos que conduzem à recombinação é muito complexa, pois acredita-se que
esta ocorr..a no final das etapas mostradas na Fig. 19 .1 O. No entanto, em essência ocorre o processo
ilustrado na Fig. 19 .11 , ou seja, são produzidos cortes nas duas cromátides seguidos pelo cruzamento e emenda dos segmentos que se intercambiam.
O paquíteno é um processo relativamente prolongado. Sua duração se mede em dias , diferentemente do leptóteno e do zigóteno , que são medidos em horas.
No paq uíteno, o núcleo parece conter um número haplóide de cromossomos, porém não é assim, já que cada uma das unidades visíveis é composta de dois cromossomos independentes, embora
intimamente emparelhados . Por tal motivo, cada um dos 23 pares de cromossomos recebe o nome
de bivalente. Como cada conjunto é composto por quatro cromátides, também se chama tétrade
(Fig. 19.9).
As duas cromátides-irmãs de cada cromossomo se acham conectadas pelo centrômero e por
isso em um bivalente ou tétrade existem dois centrômeros, um por cromossomo. Igualmente na
mitose, cada centrômero contém dois cinetócoros , um por cada cromátide-irmã. No entanto, até a
finalização da meiose I os cinetócoros-irmãos se comportam como uma unidade (Fig. 19.15). ·
Ao longo do bivalente, no CS aparece uma sucessão de nódulos densos de cerca de 100 nm de
diâmetro, denominados nódulos de recombina ção (Fig. 19.7). Seu número e suas localizações
coincidem com.os sítios de recombinação genética, o que sugere que ao nível deles ocorre o intercâmbio dos segmentos de DNA entre as cromátides homólogas.
Para que a recombinação ocorra, as moléculas de DNA das cromátides homólogas devem situar-se a uma distância de aproximadamente 1 nm no componente central do CS . Acredita-se que
esse contato virtual ocorra ao nível dos filamentos transversais que unem os componentes late-
_
_ Cromátide
(é mostrada
somente
uma das duas
cromátidesirmãs)
Fig. 19.6 Esquema do complexo
sinaptonêmico com os
componentes laterais, os
fil amentoslransversais e o
componente central. Os
fil amentos transversais são
dímeros protéicos que nascem
dos componentes laterais e se
estendem até o plano sagital do
complexo. Ali suas extremidades
li vres se sobrepõem e dão lugar à
linha de alta densidade eletrônica
do componente central, onde
também existiriam proteínas
longitudinais. A ilustração do
detalhe mostra que as duas
proteínas dos dímeros são
fibrosas, que estão entrelaçadas e
que suas extremidades
globulares estão orientadas como
no dímero da Fig. 5.2.
Nódulo de
re combinação
irmãs
Fig. 19.7 Visão tridimensional
do complexo sinaptonêmico com
um nódulo de recombinação.
308
•
A MEIOSE
Componente lateral
Cromátide
Fig. 19 .8 Formação de alças de cromatina cada vez mais compactas à medida que a prófase da meiose I
avança.
+
Fig. 19.9 Esquemas que mostram como se forma o bivalente (tétrade), o desenvolvimento do quiasma e a
separação dos cromossomos.
rais, pelos quais as seqüências de nucleotídeos homólogos se buscariam , fato imprescindível para
que ocorra o intercâmbio dos segmentos de DNA. O nódulo de recombinação poderia ser considerado a expressão morfológica desse intercâmbio. Além disso, o nódulo seria um complexo
multiprotéico que reúne as cromátides paternas e maternas e produz os cortes e as emendas necessários para a recombinação.
Entre as proteínas que atuam no começo da recombinação está a RadSl (de radiation sensitive),
cuja intervenção é essencial para que ocorram as modificações mostradas na Fig. 19.12, que ocorreriam entre as etapas 2 e 3 do modelo de recombinação genética ilustrado na Fig. 19 .1 O. Observe-se como a cadeia invasora se combina com a dupla hélice da cromátide homóloga e dá lugar a
uma tripla hélice transitória. Considera-se que a cadeia invasora se acomoda no sulco maior da
dupla hélice e que suas bases se unem com as da cromátide homóloga por meio de pontes de hidrogênio não usuais.
19- 9. Durante o diplóteno, os cromossomos emparelhaqos se separam,
embora em alguns pontos permaneçam unidos
Durante o diplóteno (do grego diplóos, duplo), os cromossomos homólogos começam a se
separar, de modo que as cromátides da tétrade se tornam visíveis e o complexo sinaptonêmico se
desintegra (Figs. 19.2 e 19.4C, D). Entretanto, a separação não é completa já que as cromátides
homólogas permanecem conectadas nos pontos onde teve lugar o intercâmbio (Figs. 19.4D, 19.9
e 19.13). Tais conexões - chamadas quiasmas (do grego khíasma , cruz) - expressam a etapa
final da recombinação, pois mostram os cromossomos homólogos em vias de se separar, ligados
contudo por esses pontos. O número de quiasmas é vari ável, já que podem aparecer pares de cromossomos homólogos com um só quiasma (é o número mínimo) e outros com vários. Além disso, a quantidade de quiasmas e suas localizações podem coincidir com as dos nódulos de recombinação.
A MEIOSE
5'
3'
(1
§
b;
3'
g 5'
5'
3'
3'
5'
2
7
...l:i-
B
e
[)
il
~
"
i;j
3 ~
=>ÇX
4
10
A
6
li.
11
B
eva=
-a--s- -c""Acr-
T
B
e
h
ç
D
A
R
ç
d
ª
h
ç
D
A
5
------ª
11
Fig. 19.10 Modelo teórico de recombinação genética entre as cromátides homólogas. 1. Emparelhamento
das cromátides. Os pares de letras Aa, Bb, Cc e Dd simboli zam os dois alelos dos quatro genes
representados (Cap. 20-3). 2: Corte das duas cadeias de DNA de uma das cromátides e ampliação das
separações mediante exonucleases. Visto que estas removem nucleotídeos na direção 5' --7 3' , forma-se
- em cada cadei a cortada - uma extremidade 3' li vre (não emparelhada). 3. Uma dessas extremidades
invade a cromátide homóloga e se coloca no lugar de uma de suas cadeias que, por sua vez, se desloca
para o sítio que a cadeia invasora deixa vago. 4. Síntese de DNA nas cadeias cortadas, para reconstruir os
segmentos que faltam. Intervêm polimerases que usam as du as cadeias da cromátide homóloga como
moldes, moti vo por que os segmentos que faltam são sinteti zados por um mecanismo similar ao da
reparação do DNA (Cap. 17-21). As etapas anteriores conduzem à form ação de dois cruzamentos ou
estruturas de Holliday (chamadas assim em homenagem ao geneticista Robin Holliday, que descreveu
esses entrecruzamentos em 1964). 5. Corte das duas cadei as ao nível de um dos cruzamentos (setas) . 6.
Emenda lateral das cadeias cortadas na etapa anterior. 7. Encurvamento de ambas as cromátides na altura
do segundo entrecruzamento e rotação de 180° de uma das cromátides. 8. Formação de uma estrutura de
Holliday isométrica. 9. Corte ~m uma das cadeias de cada cromátide (setas) . 10. As cromátides se
endireitam. 11. Emenda lateral das cadeias cortadas na etapa 9.
Na mulher, o diplóteno é um período extraordinariamente longo. Todos os ovócitos 1 chegam
a esta fase do ciclo celular antes do sétimo mês da vida intra-uterina e assim pennanecem pelo
menos até a puberdade (S eção 19-15).
No diplóteno, diversos setores da cromatina apresentam um acentuado desenrolamento. Situações extremas deste fenômeno são observadas nos peixes, anfíbios, répteis e aves, nos quais o
desenrolamento é tanto que os bivalentes podem assumir uma configuração especial - emitem
finas projeções laterais - motivo pelo qual são chamados cromossomos plumosos ou em escova (Fig. 19.14). Essas projeções são alças de cromatina muito desenroladas, cujo DNA é transcri/
./
•
309
310
•
A MEIOSE
,
5
Cromátide f aterna
,
,
Cromátide materna
,
3, 111
11. 1 I_ ! 1 l 153,
3
;, 1111111 111 11 111 1 11 15'
!
5'3 lllIWJ: 1 11
3'
1 11
ITC1IJ5,
'
5'3 lllIWJ: 1 11
'
5'
3, '111111
1 1
3'
,rrr=IIJ s'
!
l 1 f f 111 11 153',
;: 111 11 11 1111 1 11 11 ~:
to em grande velocidade. Assim, tal configuração cromossômica expressa uma intensa síntese de
RNA por parte da célula, que é a causa do enorme crescimento que o ovócito apresenta antes de
ser expulso do ovário.
Em algun s dos tipos zoológicos ·nomeados , ao longo dos cromossomos podem ser detectados
espessamentos de cromatina dispostos entre as alças - chamados cromômeros - com um aspecto de colar de contas (Fig. 19.14). Os cromômeros correspondem a setores de cromatina altamente condensada, ao contrário da cromatina das alças, que como acabamos de ver se encontra
bastante desenrolada. Os cromômeros começam a ser vistos a partir do leptóteno.
19- 1O. Durante a diacinese a crom'atina volta a se condensar
1
Fig. 19.11 Modelo simplificado
de cortes e emendas entre as
moléculas de DNA das
cromátides homólogas durante a
recombinação genética.
Durante a diacinese (do grego diá, através) a condensação dos cromossomos volta a se acentuar (Fig. 19.4E). As tétrades se distribuem homogeneamente por todo o núcleo e o nucléolo desaparece. À exceção do aspecto dos cromossomos , este breve estágio mostra semelhanças com a
prófase tardia da mitose.
19-11. Nas etapa s restantes da divisão meiótica 1, os cromossomos
homólogos se separam e se dirigem para os pólos opostos da célula
' ~ ~:
;LJL"
;:1!111111111 11 11 : 11 1111 ;:
!
~:lillll'' '? ~:
19-12. Entre as dua s divisões meióticas há uma interfase de curta duração
~: 11 1 111 1 1 1 1 1 t1 11 1111 111 ;:
A telófase 1 é seguida pela partição do citoplasma, e as duas células-filhas passam por um
curto período de interfase no qual não há replicação do DNA (não há fase S) . Por conseguinte, as
células-filhas derivadas da meiose I possuem um número haplóide de cromossomos, cada um destes
composto por duas cromátides-irmãs (Figs. 19.2 e 19.3).
No homem , o resultado da meiose 1 é a formação de duas células-filhas iguais, denominadas
espermatócitos II. Na mulher, porém, como a repartição do citoplasma do ovócito 1 é desigual,
formam-se duas células de tamanho muito diferente: o ovócito II, que é relativamente volumoso,
e o primeiro corpúsculo polar, que é pequeno e desaparece (Fig. 19.1).
Os espermatócitos II e o ovócito II começam a meiose II, cujas etapas, como veremos em seguida, são similares às da mitose.
1
1
Durante a prometáfase 1, a condensação dos cromossomos alcança seu grau máximo. O envoltório nuclear desaparece e os microtúbulos do fuso se conectam com os cinetócoros. Esta conexão é diferente da registrada na mitose, porque as fibras do fuso provenientes de cada pólo celular associam-se aos dois cinetócoros-irmãos e não com um (na Seção 19-8 vimos que na meiose
1 os cinetócoros-irmãos se comportam como uma unidade) .
Durante a metáfase 1 os bivalentes se dispõem no plano equatorial da célula (Fig. l 9.4F). Pelo
modo como se ligam às fibras do fuso , os cinetócoros de cada cromossomo homólogo "olham"
para o mesmo pólo (Fig. 19.15). Os bivalentes continuam exibindo seus quiasmas. Quando os
cromossomos são curtos, os quiasmas se localizam nas extremidades dos homólogos (quiasmas
terminais) ; quando os cromossomos são longos, os quiasmas aparecem em vários pontos ao longo
dos eixos cromossômicos (quiasmas intersticiais).
Durante a anáfase 1, os cinetócoros opostos são tracionados para os respectivos pólos, de modo
que os homólogos de cada bivalente - cada um composto por duas cromátides-irmãs - se separam entre si e se mobilizam em direções opostas (Figs. 19 .2 e 19 .15). A observação dos bivalentes
nesta fase permite comprovar que, freqüentemente, a recombinação gênica ocorre entre as cromátides dos dois pares de homólogos (Fig. 19.13). Assim, em alguns segmentos do cromossomo a
recombinação ocorre entre um par de cromátides homólogas - não estamos dizendo "irmãs" e em outros segmentos ocorre entre as cromátides do outro par. Conseqüentemente, quando os
cromossomos homólogos se separam por completo , nas células-filhas as duas cromátides de cada
cromossomo são mistas, pois têm segmentos cromossômicos tanto paternos como maternos (Fig.
19.16).
Durante a telófase 1, os grupos cromossômicos haplóides chegam a seus respectivos pólos e
em tomo dele são construídos os envoltórios nucleares.
!
S'rw11
3'.l..l.-.1..J...
~
I
1 . 3'
5'
1
3'
5'
5' 11111111 ~ 3·
Fig. 19.12 Formação de uma
tripla hélice transitória no
começo da recombinação
genética. Ocon-e entre as etapas
2 e 3 da Fig. 19.10.
A MEIOSE
•
311
Fig. 19.13 Eletromicrografia de
um bivalente e sua interpretação.
Observam-se dois quiasmas e a
posição dos centrômeros-irmãos
que estão unidos entre si.
19-13. Na divisão meiótica li, as cromát ides-irm ãs se separam
A prófase II é muito breve, embora suficiente para permitir o reaparecimento das fibras do
fuso e o desaparecimento do envoltório nuclear.
A metáfase II leva os cromossomos ao plano equatorial da célula. As fibras do fuso se unem
aos cinetócoros, que se colocam como nos cromossomos mitóticos , ou seja, um apontando para
um pólo, o outro para o pólo oposto da célula (Fig. 19 .15).
Na anáfase II, com a tração que as fibras do fuso exercem sobre os cinetócoros, o centrômero
se divide e as cromátides-im1ãs de cada cromossomo são separadas e tracionadas para os pólos
opostos da célula (Figs. 19.2, 19.4G e 19.15).
Na telófase II, cada um dos pólos da célula recebe um jogo haplóide de cromátides que passam a se chamar cromossomos. A formação de um novo envoltório nuclear em tomo de cada
conjunto cromossômico haplóide - seguida pela repartição do citoplasma - põe fim à meiose
(Figs. 19.2 e 19.3).
Como· acabamos de ver, a meiose II assemelha-se à mitose, exceto porque na primeira as células-filhas recebem uma única cópia de cada cromossomo e não os dois homólogos.
A Fig. 19.1 mostra que no homem o resultado da meiose II é a formação de duas células-filh~s
iguais - denominadas espermátides - que ao final de um tempo se diferenciam em espermatozóides. Ao contrário, na mulher, como a repar1ição do citoplasma do ovócito II é desigual, formam-se duas células de tamanho muito diferente: o óvulo/ que é volumoso, e o segundo corpúsculo polar que, como o primeiro corpúsculo polar, é pequeno e desaparece.
Em síntese, a meiose gera quatro espermatozóides a partir de cada espennatócito I, e somente
um óvulo a partir de cada ovócito I (Fig. 19.1 ).
\.
*N.R.T.: Ao ser fecundado o ovócito (oócito) II.
Fig. 19.14 Cromossomos
plumosos ou em escova. A
figura da esquerda é um
esquema de pouco aumento que
mostra dois quiasmas e as alças
de cromatina laterais. A figura
de cima ilustra duas alças
laterais com maior aumento e a
compactação das cromátides ao
nível do cromômero. (Cortesia
de O. L. Miller Jr.) A
eletromicrografia (contraste de
fase) permite observar a
sucessão de cromômeros, que
gera uma imagem com aspecto
de colar de contas. (Cortesia de
U. Scheer.)
312
•
A MEIOSE
Fig. 19.15 Evolução seguida
pelas cromátides-irmãs e os
cinetócoros durante a meiose I e
a meiose II:
Cinetócoros das
duas cromátidesirmãs
(unidos entre si)
METÁFASE 1
Cinetócoro de urna
das cromátides- irmãs
ANÁFASE 1
Cinetócoro do
cromossomo
-tm•
l
METÁFASE li
ANÁFASE li
19- 14. Conseqüências genéticas da meiose
Na Seção 19-1, dissemos que os processos essenciais da meiose são: 1) a redução do número
de cromossomos à metade (Fig. 19.3); 2) a recombinação genética; 3) a segregação dos cromossomos paternos e maternos. Deste modo, do ponto de vista genético, se pode considerar a meiose
um mecanismo destinado a distribuir aleatoriamente os genes paternos e maternos nos gametas,
tanto pela recombinação genética como pela segregação dos cromossomos homólogos.
Na Fig. 19.17 podemos observar as conseqüências genéticas da meiose em uma célula hipotética que contém três pares de cromossomos homólogos , nos quais foram produzidas uma, duas e
três recombinações , respectivamente ..
As recombinações são assinaladas pelos quiasmas, e podemos notar que vão ocorrendo somente em um dos dois pares de cromátides homólogas. No entanto, como assinalamos na Seção
19-11, a recombinação ocorre não entre um, mas sim entre dois pares de cromátides homólogas,
de modo que ao concluir a meiose todos os cromossomos dos gametas apresentam segmentos
maternos e paternos alternados (Fig. 19.16).
A segregação aleatória dos cromossomos paternos e maternos durante as anáfases 1 e II também contribui para a diversidade genética dos gametas, porém em grau distinto. Isto não é visto
na Fig. 19.17, que mostra o caso (teoricamente possível) no qual os cromossomos maternos e
paternos são segregados em bloco em ambas as anáfases. Como o homem possui 23 pares de cromossomos homólogos nas células predecessoras dos gametas, as combinações de segregação
possíveis alcançam o número de 8.388 .608 (223 ). A elas se devem somar as incontáveis possibilidades de segregação dos genes mediante a recombinação.
Em síntese, ao se examinar as conseqüências derivadas da associação de ambos os processos
- a recombinação genética e a segregação dos homólogos - podemos observar que cada um dos
gametas que a meiose produz herda conjuntos de genes diferentes.
Acidentalmente, a segregação dos homólogos pode falhar, de maneira que os dois homólogos
de um par não se separam e passam juntos a uma de suas células-filhas . Este fenômeno - chama-
Fig. 19.16 Resultado da
recombinação genética ao final
da anáfase I.
A MEIOSE
a
DIPLÓTENO
METÁFASE 1
DIPLÓTENO
a
b
e
e
b
a
1 /\
ANÁFASE I"
j
e
b
~
V//
ANÁFASE li
do não disjunção - pode ocorrer na anáfase I ou na anáfase II da meiose (Cap. 20-9) e por sua
causa um dos gametas conterá um cromossomo a mais (24) e outro um a menos (22). Se um desses gametas participa da fecundação, as células somáticas do novo indivíduo possuem um número
an01mal de cromossomos (47 e 45 , respectivamente). Estes quadros levam o nome de aberrações
cromossômicas numéricas, das quais a síndrome de Down é o exemplo mais conhecido. Na síndrome de Down, as células contêm 47 cromossomos, já que existem três unidades do cromossomo 21 em vez de duas (Cap. 20-13).
19-15. Na mulher a meiose pode durar ce rca de 50 anos
No embrião humano as células germinativas primitivas aparecem na parede do saco vitelino
aos 20 dias da fecundação. Dali, emigram para os esboços gonadais onde-no embrião feminino
- se dividem e se transformam em ovogônias. Entre o terceiro e o sétimo meses da vida prénatal, as ovogônias entram em meiose e se convertem em ovócitos I; permanecerão no período
diplonêmico até o começo da puberdade.
Durante este_diplóteno tão prolongado, os cromossomos passam por um tipo especial de desenrolamento que os assemelha - embora distantemente - aos cromossomos plumosos (Seções
19-9 e 19-14).
' A partir da puberdade, em cada ciclo menstrual, vários ovócitos I reiniciam a meiose I, porém
esta se completa em apenas um , que se converte em ovócito II. Os ovócitos I restantes se degeneram no ovário. Devemos assinalar que, às vezes, dois ovócitos I completam a meiose I, e com
menos freqüência são mais de dois .
Quando o ovócito II é liberado do ovário (ovocitação)':' (oocitação) e ingressa na tuba uterina,
já foi iniciada a meiose II, porém esta prossegue somente se o ovócito for fecundado por um espermatozóide; além disso, a falta de fecundação faz com que o ovócito II morra em poucas horas.
*N.R.T.: Impropriamente conhecida no meio médico como ovulação.
•
313
Fig. 19.17 Conseqüências
genéticas da meiose em três
pares de cromossomos, um com
um quiasma (a), outro com dois
quiasmas (b) e outro com três
quiasmas (e). Os cromossomos
paternos são representados em
azul e os maternos em vermelho.
Os círculos marcam as
localizações dos centrômeros.
314
•
A MEIOSE
Entretanto, a fecundação ativa no ovócito II alguns mecanjsmos que impulsionam a continuação
da meiose II, ao final da qual são gerados o zigoto* (ou célula-ovo) e o segundo corpúsculo polar.** Como vemos, o óvulo não se forma em nenhum caso, embora às vezes seu nome seja empregado quando se menciona o ovócito II.
Na recém-nascida, o número de ovócitos I é de cerca de um milhão. Aos 12 anos de idade, esse
número se reduz a 300.000, dos quais cerca de 400 alcançarão a maturidade total entre essa idade
e a menopausa. Portanto. na mulher, a meiose pode durar cerca de 50 anos , o que explica por que,
à medida que aumenta a idade materna, a proporção de aberrações cromossômicas na descendência é cada vez maior (Cap. 20-13).
19-16. No homem a meiose começa a partir da puberdade
o embrião masculino. as células germinativas primitivas proveruentes do saco vitelino chegam aos esboços gonadais e se incorporam aos túbulos seminíferos em formação, onde se convertem em espermatogônias . Estas entram em meiose a partir da puberdade. Como vimos, cada uma
gera quatro espermatozóides. A prófase I dura cerca de 14 dias e a meiose se completa em cerca
de 24 dias. Ao contrário da ovocitogênese (oocitogênese), a espermatogênese prossegue até uma
idade relativamente avançada.
FECUNDAÇÃO
19-17. Características dos gametas no momento da fecundação
A fertilização do ovócito II (oócito II) pelo espermatozóide - ou fecundação - é o passo que
inicia o processo do desenvolvimento embrionário e, por esse motivo, é analisada nos livros de
embriologia. Aqui somente ofereceremos um breve resumo de seus aspectos celulares e moleculares.
A fecundação deve ocorrer no terço externo da tuba uterina (oviduto, trompa de Falópio), onde
o ovócito II chega - sem haver completado a meiose II - depois da ovocitação (Fig. 19.18).
O ovócito é uma célula de tamanho extremamente grande, que possui numerosíssimas microvilosidades, e está envolto pela membrana pelúcida e pelas células foliculares da carona radiata
(coroa radiada) (Fig. 19 .18). A membrana pelúcida contém uma quantidade abundante de glicoproteínas, entre as quais se destacam a ZP2 e a ZP3 (de zona pellucida) . Por sua vez, as células da
carona radiata estão unidas entre si por um material muito rico em hialuronana (ácido hialurônico).
O espermatozóide possui uma cabeça, um colo e uma cauda. A Fig. 19 .1 9 mostra a cabeça e
parte do colo com seus respectivos componentes. Na cabeça, devemos ressaltar a presença do
acrossomo , que é um derivado lisossôrllico que contém vários tipos de enzimas hidrolíticas, duas
das quais, a hialuronidase e a acrosina, desempenham importantes funções durante a fec undação.
As duas últimas etapas da diferenciação dos espermatozóides - chamadas maturação e capacitação - ocorrem no epidídimo e no trato genital feminino , respectivamente. Em seu transcurso se afinam, ao nível molecular, certos detalhes de algumas estruturas dos espermatozóides,
imprescindíveis para que um deles fecunde o ovócito II e seja formada a célula-ovo ou zigoto.
19-18. Os espermatozóides adquirem movimentos de hiperativação
Entre outras mudanças, a capacitação dá lugar ao aparecimento de movimentos muito enérgicos na cauda dos espermatozóides, os quais se distinguem com o nome de hiperativação. Assim,
*N.R.T. : Entenda-se o óvulo e depo is o zigoto.
**N.R.T.: É preciso que fique claro, de uma vez por todas, que chamar o ovócito TI de óvu lo é uma prática méd ica que
deve ser abol ida definiti vamente não só pelos leitores como por todos os profissionai s da área de saúde. Os erros devem
ser corrigidos e não perpetuados . Quanto à não forma ção do óvulo, o autor se refere em relação ao ovário e não à fecundação.
A MEIOSE
Tuba uterina
Corpo lúteo
Ovócito li
/
\~/Carona
radiata
""'/r
-
~ ~~embrana
e
pelúcida
~~ -;::::::~0p~:~:~tica
~~ "'
\
/ \
Fig. 19.18 Corte frontal da tuba uterina que mostra o encontro dos espermatozóides com o ovócito II.
Membrana
in t erna---~
Memb rana _ _~
plasmática
Fig. 19.19 Esquema que mostra algumas estruturas da cabeça do espermatozóide. Observe-se o acrossomo
e o aparecimento de áreas de fu são entre a membrana acrossômica externa e a membrana plasmática, com
a conseqüente formação de poros (reação acrossômica).
abruptamente, os espermatozóides passam de um tipo de movimento delicado e linear a outro
vigoroso e errático, embora intercalado com breves episódios de deslocamentos lineares.
Os mecanismos moleculares desencadeantes da hiperativação podem ser observados na Fig.
19.20. Como vemos, uma substância indutora desconhecida (ou fator capacitante) interage com
um receptor da membrana plasmática do espermatozóide - situado provavelmente à altura de
seu colo - e o domínio citosólico do receptor ativa uma proteína G (Cap. 11 -14). Esta, por sua
vez, abre um canal de Ca2+ e induz a entrada do íon do meio extracelular para o citosol. Visto que
a proteína G também ativa a enzima adenilciclase, que provoca um aumento do AMPc citosólico
e a ativação da cinase A (Cap. 11-15). Por seu turno , a cinase A desencadeia uma cascata de reações que culmina com a fosforilação de uma proteína de 15 kDa associada aos microtúbulos do
axonema (Cap. 5-12). Finalmente, ante a presença de ATP - que fornece energia- tanto o Ca 2+
como a proteína de 15 kDa ativam o deslizamento das dineínas entre os microtúbulos, e com isso
os movimentos de hiperativação na cauda do espermatozóide.
19- 19. A fecundação divide- se em várias fa ses
A fecundação tem início a partir do momento em que não mais de cem espermatozóides completamente diferentes - esse é o número que chega ao terço externo da tuba uterina - estabelecem
contato com as células foliculares que envolvem o ovócito II.
Para uma melhor compreensão, o processo da fecu ndação pode ser dividido nas seguintes fases (Fig. 19.21):
•
315
316
•
A MEIOSE
Fig. 19.20 Mecanismo molecular
que desencadeia a hiperativação
do espermatozóide.
Substância induiora (fator capacitante)
1) Penetração da corona radiata . Uma vez que entra em contato com a carona radiata, cada
espermatozóide - com seu acrossomo intacto - trata de alcançar a membrana pelúcida avançando entre as células fo liculares (Fig. 19.21 A) . Para isso, constrói uma espécie de túnel no ácido hialurônico que as une, com a ajuda de pequenas quantidades de hialuronidase que leva em
sua membrana plasmática (esta enzima é quimicamente idêntica à contida no acrossomo ). A força mecânica derivada dos movimentos de hiperativação impulsiona o avanço do espermatozóide. Deste modo , enquanto a hialuronidase digere localmente o cemento intercelular, os movimentos de hiperativação fazem o espermatozóide avançar. É possível que este mecanismo atue
como um filtro seletivo para que apenas os espermatozóides mais aptos cheguem à membrana
pelúcida.
2) Reação acrossômica. Quando o espermatozóide alcança a membrana pelúcida e entra em
contato com ela, em sua parte frontal se desencadeia um processo, chamado reação acrossômica,
que dá lugar a múltiplas áreas de fusão entre a membrana externa do acrossomo e a membrana
plasmática do gameta. Isso acarreta a formação de poros - pelos quais as enzimas acrossômicas
escapam - e depois o desaparecimento de ambas as membranas (Figs. 19.19 e 19.21B, C).
Conseqüentemente, na região frontal do espermatozóide, na substituição da membrana plasmática desaparecida, fica exposta ao exterior uma nova membrana, a acrossômica interna (Fig. 19 .21 C).
O mecanismo molecular que leva à reação acrossômica é o seguinte (Fig. 19.22):
A ZP3 da membrana pelúcida interage com um receptor da membrana plasmática do espermatozóide, que ativa uma proteína G. Esta faz o mesmo com a enzima fosfolipase C, que gera
inositol trifosfato (IP) e diacilglicerol (DAG) a partir de fosfatidilinositol difosfato (PIP2).
Como vimos no Cap. 11 -1 8, o IP 3 abre canais de Ca2 + na membrana do REL e permite que o
íon passe dessa organela ao citosol. Como no espermatozóide a maior parte do IP 3 se converte no
inositol tetrafosfato (IP) e como este abre canais de Ca2 + na membrana plasmática, o íon penetra
do exterior e aumenta ainda mais sua concentração no citosol. O pH citosólico também aumenta
porque a entrada de Ca 2 + do exterior se acha acoplada à saída de H +.
Por seu turno, o DAG ativa a cinase C, que desencadeia uma sucessão de fosforilações em várias
proteínas.
A Fig. 19 .22 mostra a ativação das fosfolipases A e D por meio da proteína G. Já que a primeira elimina um ácido graxo da fosfatidilcolina e a segunda remove a colina, geram lisofosfatidilcolina
e ácido fosfatídico (Fig. 2.13), respectivamente.
Embora não esteja ilustrado na Fig. 19.22, a proteína G também ativa a enzima adenilciclase,
que forma AMPc a partir de ATP. Por sua vez, o AMPc ativa a cinase A, que fosforila várias proteínas.
A MEIOSE
A
Membrana pelúcida -
- --
B
Membrana pelúcida -
---
Membrana plasmática
Membrana plasmática _ _ _ _ _ _ _ __,,,.
---~.
Membran~~·
acrossômica r
i
-
e
D
Membrana plasmática
do ovócito li
----~
Segunda divisão meiótica
E
F
G
Metáfase da
primeira divisão
meiótica
H
Fig. 19.21 Fases da fecundação. A. Penetração da carona radiata. B. Reação acrossômica. C.
Desnudação. D. Penetração na membrana pelúcida. E. Fusão das membranas plasmáticas dos gametas e
reinício da meiose II por parte do ovócito II. F. Formação dos pronúcleos masculino e fem inino. G. União
dos pronúcleos (singamia). H. Metáfase da primeira divisão mitótica (anfimi xia). 1. Começo da primeira
divisão de segmentação da célula-ovo.
•
317
318
•
A MEIOSE
Fig. 19.22 Mecanismo molecular
que desencadeia a reação
acrossômica. PLC , PLA e PLD ,
fosfolipases C, A e D,
respectivamente; PC ,
fosfatidilcolina; AF, ácido
fosfatídico; LPC,
lisofosfatidilcolina.
Membrana
pelúcida
do ovócito
Ca2 "
>
pH
.
Proteinas
iostoriladas
1/
Ca 2-
REAÇÃO ACROSSÔMICA
Finalmente, todas as mudanças mencionadas fazem com que se formem múltiplas áreas de fusão
entre a membrana acrossômica externa e a membrana plasmática do espermatozóide, e que essas
fusões dêem origem a orifícios de diâmetros crescentes que eliminam as membranas. Em síntese,
essas mudanças desencadeiam a reação acrossômica (Figs. 19.19 e 19.21B, C).
Devemos acrescentar que antes da reação acrossômica ocorrem dois processos biológicos, o
reconhecimento e a adesão dos gametas. Ambos são conseqüência da interação da ZP3 da membrana pelúcida com o receptor da membrana do espe1matozóide.
Nos pontos a seguir veremos como a reação acrossômica toma possível o desprendimento da
carona radiara do ovócito II, a passagem do espe1matozóide através da membrana pelúcida e a
fusão das membranas plasmáticas dos gametas.
3) Desnudação. A desnudação consiste no desprendimento da carona radiara do ovócito II.
As células foliculares da carona são separadas por hialuronidase que sai dos acrossomos, já que
esta enzima hidrolisa o ácido hialurônico que as mantém unidas (Fig. 19.21BC).
4) Penetração da membrana pelúcida. Como vimos, a membrana acrossômica interna fica
exposta quando a membrana plasmática e a membrana acrossômica externa da cabeça do espermatozóide desaparecem. Ela conta com o receptor PH20 (do inglês, posterior head) que interage
com a ZP2 da membrana pelúcida. Isso permite ao espermatozóide atravessar a membrana pelúcida
em busca da membrana plasmática do ovócito II. Ele consegue este feito graças à acrosina, pois
esta enzima hidrolisa o material que compõe a membrana pelúcida e fabrica nela um túnel que
segue uma trajetória diagonal (Fig. 19.21D).
Da mesma forma com que na penetração da carona radiara, o avanço do espermatozóide se
deve à força mecânica gerada pelos movimentos de hiperativação. Essa força é da ordem de 3.000
microdinas , suficiente para romper qualquer ligação côvalente.
Voltando à acrosina, ela não hidrolisa maciçamente a membrana pelúcida, como caberia esperar de uma enzima hidrolítica liberada abruptamente no meio. Dissemos que fabrica um túnel, o
que se explica por hidrolisar pequenas e sucessivas porções da membrana pelúcida à frente do
espermatozóide. A hidrólise controlada deve-se ao fato de a enzima ser liberada como um precursor, a pró-acrosina, que, à medida que o PH20 interage com novas ZP2 encontradas no caminho,
dá lugar, em duas etapas, às formas ativas da enzima, a cx-acrosina e a [3-acrosina. Como vemos,
da mesma forma que na penetração da carona radiara , o espermatozóide realiza esta tarefa delicadamente e avança pelo trajeto que ele mesmo vai criando.
5) Fusão. Embora sejam muitos os espermatozóides que atravessam a membrana pelúcida,
somente um estabelece estreito contato com a membrana plasmática do ovócito II. Quando isto
ocorre, desaparecem seus movimentos de.hiperativação.
A MEIOSE
Em seguida, as partes das membranas de ambos os gametas em contato se fundem e, por isso ,
entre os dois citoplasmas é estabelecida uma continuidade que toma possível a entrada do conteúdo do espermatozóide no interior do ovócito (Fig. 19.2 1E).
Por parte do espermatozóide, a membrana plasmática envolvida na fusão corresponde à região
equatorial da cabeça (Fig. 19.19). Por parte do ovócito intervém qualquer zona de sua extensa superfície, exceto a distante do núcleo (este se acha detido na meiose Il). Recordemos que amembrana plasmática do ovócito possui inúmeras rnicrovilosidades, e é precisamente com elas que se
funde a região equatorial da cabeça do espermatozó ide.
Uma vez estabelecida a continuidade entre ambos os citoplasmas, penetram - na seguinte ordem
- a parte posterior da cabeça, o colo e a cauda do espermatozóide. Depois o faz a parte anterior
da cabeça, que é introduzida no ovócito mediante um processo semelhante à fagocitose. O material incorporado tem uma evolução desigual. Assim , enquanto o D A e o centríolo do espermatozóide sobrevivem, as mitocôndrias e as fibras axonêmicas não tardam a desaparecer.
A fusão das membranas é mediada por proteínas fusógenas presentes nas duas camadas lipídicas duplas (Cap. 7-41 ). Foram descobertas várias destas proteínas na membrana do espermatozóide como, por exemplo, as denominadas DE e PH30, encontradas no rato e na cobaia, respectivamente. A DE é composta por duas proteínas de 37 kDa (D e E), adquiridas durante a passagem
do espermatozóide pelo epidídimo. A PH30 também é composta por duas proteínas - ambas
transmembrana - uma que se liga à proteína complementar do ovócito e outra que é responsável
pela fusão.
Sabe-se muito pouco sobre as proteínas fusógen as da membrana plasmática do ovócito; elas
não são encontradas na região distante do núcleo , onde tampouco existem microvilosidades.
6) BZ2queio da polispermia. Um único espermatozóide deve se fundir com o ovócito. Para que
assim seja, depois da fusão dos gametas ocorrem alterações em algumas estruturas do ovócito, a
fim de neutralizar a entrada de novos espermatozóides e evitar a polispermia. A origem destas
alterações se encontra em um processo denominado reação cortical, que consiste na exocitose
das enzimas hidrolíticas contidas nas inúmeras vesículas de secreção - chamadas grânulos corticais - que a célula-ovo tem * por sob a sua membrana plasmática. Como todas as vesículas de
secreção, elas são geradas também no complexo de Golgi.
Entre as enzimas expulsas dos grânulos corticais encontra-se uma protease que modifica a ZP3
e hidrolisa a ZP2 . Estas modificações alteram a estrutura da membrana pelúcida, o que provoca a
imobilização e a posterior expulsão dos espermatozóides pegados a ela.
Outro impedimento à polispe1mia reside na membrana da célula-ovo que perde a capacidade
de se fundir com as membranas dos novos espermatozóides que dela se acercam. A inabilitação
dependeria da presença de alguns componentes recebidos das membranas dos grânulos corticais,
que se integram à membrana plasmática da célula-ovo quando ocorre a exocitose.
A secreção dos grânulos corticais é regulada (Cap . 7-23) e produzida conseqüentemente a um
aumento da concentração de Ca2+ no citosol. Como mostra a Fig. 19.23, este aumento é induzido
pelo IP 3 , que libera o Ca2 + do REL (Cap. 11-18). Observe-se que este processo se desencadeia no
momento em que ocorre a fusão entre os gametas e que a substância indutora que ativa o receptor
da membrana plasmática do ovócito é uma proteína pertencente à membrana plasmática do espermatozóide. O receptor estimula uma proteína G associada à fosfolipase C que, como se sabe, atua
sobre o PIP 2 e produz o DAG e o citado IP 3 (Cap. 11-17). No próximo tópico analisaremos o significado funcional do DAG.
, O aumento de Ca2+ no citosól começa a ocorrer 10 segundos após a fusão dos gametas, enquanto a exocitose dos grânulos corticais se desencadeia quase 2 minutos depois.
7) Reinício da segunda divisão meiótica por parte do ovócito II. Enquanto bloqueia a polispermia, o ovócito II reinicia a meiose II. Esta gera duas células haplóides, o óvulo - que não
chega a se formar** porque o ovócito II fecundado se converte diretamente em célula-ovo - e o
segundo corpúsculo polar (Fig. 19.21EF).
*N.R.T.: Leia-se que o óvulo e depois a cé/11/a-ovo têm ..
MN.R.T.: Na realidade, ele chega a se formar, só que sua duração é curta, pois com a anfimixia (fu são dos pronúcleos)
toma-se célula-ovo.
•
319
320
•
A MEIOSE
Fig. 19.23 Mecanismo molecular
que desencadeia a reação cortical
e o reinício da meiose II no
ovócito II. .
ESPERMATOZÓIDE
Ca 2+
1
OVÓCITO
Proteínas
fosforiladas
l
MEIOSE li
EXOC ITOSE
Como ilustra a Fig. 19 .23, o reinício da meiose II é promovido pelo DAG mencionado no ponto anterior. Este composto ativa a cinase C, que fosforila as proteínas responsáveis pelo processo.
8) Formação dos pronúcleos masculino e feminino. Na célula-ovo, os núcleos haplóides do
espermatozóide e do óvulo passam a se chamar pronúcleo masculino e pronúcleo feminino, respectivamente (Fig. 19.21F). Enquanto se tomam esféricos, ambos se dirigem à região central da
célula, onde os seus cromossomos se desenrolam e o DNA se replica.
A descondensação dos cromossomos no pronúcleo masculino merece uma consideração especial. É que nos espermatozóides, o DNA não está associado a histonas e sim a um outro tipo de proteínas básicas -chamadas protaminas-que compactam o DNA muito mais que as histonas. Quando
o espermatozóide ingressa no ovócito, as histonas substituem as protaminas ao concluir-se a
descondensação dos cromossomos e o fazem muito rapidamente, em menos de 5 minutos.
9) Singamia e anfimixia. Os pronúcleos posicionam-se muito próximos entre si no centro do
óvulo e perdem seus envoltórios nucleares (singamia) (Fig. 19.210). Finalmente, os cromossomos voltam a se condensar e se localizam no plano equatorial da célula, da mesma forma que em
uma metáfase mitótica comum (anfimixia) (Fig. 19.21H).
Durante a anfimixia, em cada pólo da célula-ovo, há um par de centríolos. Como os quatro
derivam-se do centríolo fornecido pelo espermatozóide (ver Fusão), este teve de se duplicar, da
mesma forma que os dois primeiros centríolos-filhos (Cap. 18-12).
A anfimixia representa o final da fecundação; com ela, inicia-se a primeira divisão de segmentação da célula-ovo, ou seja, o desenvolvimento embrionário (Figs. 19.3 e 19.211) (ver Caps. 1822e21-7).
I
~
N
A MEIOSE NAS CELULAS VEGETAIS E A REPRODUÇAO DAS PLANTAS
19-20. Os mecanismos celulares responsáveis pela reprodução da s plantas
são diferentes dos existentes nos animais
Os mecanismos celulares que levam à reprodução das plantas são bastante diferentes dos observados nos animais. Nas plantas superiores, o processo começa nos órgãos reprodutores masculino (antera) e feminino (ovário) , que geram microsporócitos e megasporócitos, respectivamente. Estes se dividem por meiose, que é espórica e ocorre em um momento intermediário entre a
formação dos gametas e a fecundação .
A MEIOSE
Microsporócito
,f
-------....8
l'ip"/'º
Microsporos 8
(haplóides) ::::;
321
Fig. 19.24 Ciclo vital de uma
planta fanerógama.
\
~
0
G
Megasporo
~ (haplóide)
\
I
Gametofito \
masculino ou ~
grão de polen '-./
(haploide)
Megasporóc1to (d1plo1de)
•
\
Semente
~
Tegumemos (d1pló1des)
J
g :monão (d1pló1de) { )
Endosperma
(tnpló1de)
•
\
V
Mega~poro
(haploide)
Gametóf1to
~ ,,-- ---/.~no
Tubo pol1rnco
"F-----v
Espermatozóides (haplóides)
Núcleos polares (hapló1des)
Núcleo da célula ovular (haplóide)
Como se observa na Fig. 19.24 , ao final da meiose cada microsporócito origina quatro
microsporos haplóides funcionais. Por sua vez, a partir de cada megasporócito formam-se quatro
megasporos haplóides, três dos quais se degeneram.
Os microsporos se convertem em gametófitos masculinos, conhecidos comumente como grãos
de pólen. Em contrapartida, o megasporo que sobrevive passa por três divisões mitóticas e dá lugar
ao gamêtófito feminino , que contém oito núcleos haplóides. Na fecundação participam três destes núcleos, o da célula ovular e os dois núcleos polares.
Por seu turno , cada grão de pólen produz uma estrutura acessória chamada tubo polínico e dois
espermatozóides haplóides , um dos quais fecunda o núcleo da célula ovular. Forma-se' assim a
célula-ovo diplóide, da qual se origina - no interior da semente - o embrião da nova planta. O
outro espermatozóide se une aos dois núcleos polares, o que dá lugar a um núcleo triplóide que, ao
final de várias divisões mitóticas, gera o endosperma da semente, ou seja, o material nutritivo do
embrião. Como vemos, a semente é um mosaico de tecidos no qual o embrião é diplóide, o endosperma é triplóide e os tegumentos possuem células diplóides de origem materna.
BIBLIOGRAFIA
Blobel C.P. et ai. (1992) A potential fusion peptide and an integiin ligand
domain in a protein acti ve in sperm-egg fu sion. Nature 356:248.
Burks D.J., Carballada R., Moore H.D.M. and Saling P.M. (1995)
lnte1'action of a tyrosine kinase from human sperm with the zona
pellucida at fertili zation. Science 269:83.
Carpenter A.T.C. (1979) Recombination nodules and synaptoncmal
complex in recombination-defective females of Drosophila melanogaster. Chromosoma 75:259 .
Conrad M.N., Domínguez A.M. and Dresser M.E. (1997) Ndjlp, a
meiotic telomere protein required for normal chromosome synapsis
and segregation in yeast. Science 276: 1252.
Daneholt B. (1 975) Transcription in polytene ch.romosomes. Cell 4:1 .
Dressler D. and Potter H. (1982) Molecular mechanism of genetic recombinati on. Annu. Rev . Biachem. 51:727.
Gall J.G., Díaz M.O ., Stephenson E.C. and Mahon K. A. (1983) The
transcription unit of Lampbrush chromosomes. ln : Gene Structure
and Regulation in Development. Alan P. Lyss, New York.
Garbers D.L. (1989) Molecul ar bas is of fertili zation. Annu. Rev .
Biochem . 58:7 19.
Hib J. (2000) Embriología Médica, 7ª Ed. McGraw-HilJ.Interamericana,
Santiago de Chile.
Hib J. (2001) Histología de Di Fiore. Texto y atlas. El Ateneo, Buenos
Aires.
Messelsohn M.S . and Radding C.M. (1975) A general model for genetic recombination. Proc. Natl. Acad. Sei. USA 72:358.
Moens P.B. (1987) Meiosis. Academic Press, New York.
Moses M.J. (1968) Synaptonemal complex. Annu. Rev . Gene!. 2: 363.
Murray A.W. and Szostak J.W. (1985) Chromosome segregation in
mitosis and meiosis. Annu. Rev. Cell Biol. 1:289.
Roeder G .S. (1990) Chromosome synapsis and gene ti e recombination:
their roles in meiotic chromosome segregation. Trends Genet. 6:385.
Sathananthan A.H. et ai. (1991) Centrioles in the beginning of human
development. Proc. Natl. Acad. Sei. USA 88:4806.
Solari A.J. (1 974) The behavior of the XY pair in mammals. lnt. Rev.
Cytol. 38:273.
Wassarman P.M. (1987) Early events in mammalian fertilization. Annu.
Rev. Cell Biol. 3:109.
Wassarman P.M. (1992) Mouse gamete adhesion molecules. Biol.
Reprod. 46: 186.
Wassannan P.M. and Mortillo S. (199 1) Structure of the mouse egg
extracell ular coat, the zona pellucida. Int. Rev. Cytol. 130:85.
West S.C. (1992) Enzymes and molecular mechanisms of genetic recombi nation. Annu. Re v. Biachem. 61 :603.
Yanagim achi R. (1994) Mammalian fertili zation. ln: Physiology of
Reproduc tion, 2nd Ed. Raven Press, New York.
,'
As bases da citogenética
20-1. A união da biologia celular com a genética deu origem à citogenética
A citogenética estuda as bases cromossômicas e moleculares da hereditariedade e ajuda aresolver importantes problemas no campo da medicina, da pecuária e da agricultura. Como estes
temas são abordados pelos textos de genética, neste capítulo nos ocuparemos somente dos que
dizem respeito à biologia celular. Desta maneira, analisaremos as bases cromossômicas sobre as
quais se assentam os princípios da hereditariedade, algumas aberrações cromossômicas que ocorrem na espécie humana - as mutações genéticas fo ram estudadas no Cap. 17 - e o papel que os
cromossomos desempenham na evolução das espécies.
LEIS DA HERANÇA MENDELIANA
20-2. Em 1865, Mendel estabeleceu as leis que levam seu nome
As bases que regem a transmissão dos caracteres hereditários devem ser pesquisadas no comportamento dos cromossomos durante a meiose e nas conseqüências genéticas deste tipo de divisão (Cap. 19-14). No entanto, quando em 1865 Gregor J. Mendel estabeleceu as leis fundamentais
da hereditariedade, nada se sabia sobre os cromossomos e a meiose. Suas descobertas derivam-se
de resultados de cruzamentos de plantas analisados qua,ntitativamente aplicando um pensamento
abstrato genial.
Mendel realizou cruzamentos entre ervilhas (Pisum sativum) que tinham pares de características diferentes e contrastantes. Utilizou plantas com sementes amarelas e verdes, com sementes
lisas e rugosas , com flores brancas e vermelhas, com talos altos e baixos etc. Depois do primeiro
cruzamento observou os híbridos resultantes na primeira geração-filha (F 1) , cruzou os híbridos F 1
entre si e estudou os resultados na segunda geração-filha (F2 ) .
20-3. A lei da segregação enuncia que os genes se distribuem
sem se mesclar
Em um cruzamento realizado entre progenitores (P) com sementes amarelas e verdes, observou, na primeira geração (F 1), que todos os híbridos tinham sementes amarelas e, portanto, somente a característica de um dos pais. No segundo cruzamento (F2), as plantas apresentavam as
características de seus antepassados com uma proporção de 75 % para as sementes amarelas e de
25% para as verdes, ou seja, com uma relação 3: 1.
Mendel sustentou que a cor das sementes era determinada por um "fator" que se transmitia à
descendência por meio dos gametas e que esse "fator" - conhecido agora como gene - podia
ser transmitido sem se mesclar com outros genes. Mendel enunciou que os genes se separam nos
híbridos F I' entram em gametas diferentes e se distribuem nos híbridos F2 • Por causa disso, este
princípio é denominado lei da segregação dos genes.
Posteriormente, ele observou que as plantas com sementes amarelas na F2 possuem diferentes
constituições genéticas. Um terço desse grupo sempre dá sementes amarelas na geração F 3 , porém os outros dois terços originam plantas com sementes amarelas e verdes na proporção de 3:1.
20
324
•
AS BASES DA CITOGENÉTICA
Vinte e cinco por cento das plantas da F2 com sementes verdes, quando se cruzam entre si, produzem sempre sementes verdes na geração F3. Isto demonstra que existem duas linhagens puras para
esse caráter.
Se representarmos por meio de letras os genes nos cruzamentos e designarmos com a letra A o
gene para o caráter amarelo e com a o gene para o caráter verde, teremos o seguinte resultado:
AAX aa
j,
AaX Aa
j,
Genes paternos
Geração F 1
Geração
Fenótipo
F~
lAA
(homozigoto
dominante)
2Aa
(heterozigotos)
3 amarelas
ªª
1
(homozigoto
recessivo)
1 verde
A geração F 1 tem ambos os genes - A e a -porém somente o A é visível (cor amarela) porque
é dominante. O gene a permanece oculto e se denomina recessivo. Nos órgãos reprodutores, os
dois genes se separam e passam para gametas diferentes. Assim, a metade dos gametas recebe o gene
A e a outra metade, o gene a. Visto que em ambos os sexos as plantas geram os dois tipos de gametas, na geração F2 são produzidas três combinações genéticas possíveis em uma relação de 1:2: l.
Vinte e cinco por cento correspondem a plantas AA com sementes amarelas puras, 50% a plantas Aa
com sementes amarelas híbridas, e os 25 % restantes a plantas aa com sementes verdes puras.
Agora é possível explicar os resultados de Mendel sobre a base do comportamento dos cromossomos e dos genes. Estes se encontram em pares - um em cada cromossomo homólogo - e
os dois membros de cada par são denominados alelos. Em cada cromossomo homólogo, o ateio
ocupa um lugar chamado locus (plural, Zoei).
No caso ilustrado na Fig. 20. l é analisado o comportamento de dois alelos homólogos no rato,
os dominantes GG no rato cinza e os recessivos gg no rato branco. Como se sabe, ambos se separam na meiose e entram nos gametas. Na geração FI' os ratos resultam híbridos, pois levam os
alelos G e g nos cromossomos homólogos. Todavia, todos são cinza. Quando os híbridos F 1 se
cruzam, seus gametas se unem nas combinações mostradas na Fig. 20.1. Os indivíduos que têm
alelos iguais - GG ou gg - são denominados homozigotos, e os que têm alelos diferentes - Gg
- heterozigotos.
O termo genótipo define a constituição genética do indivíduo; o termo fenótipo, as características visíveis. Por exemplo, nas sementes analisadas anteriormente existem dois fenótipos na F 2:
a cor amarela e a cor verde, três amarelas para cada verde. No entanto, há três genótipos -AA,
Aa e aa - na proporção de 1:2:1. Isto significa que existem duas proporções mendelianas , a fenotípica (3:1) e a genotípica (1:2:1). O conceito de fenótipo estende-se a todas as expressões dos
genes , tanto as visíveis (por exemplo, a cor da pele, a cor dos olhos etc.), como as que não são
detectadas pela observação direta (por exemplo, os diferentes tipos de hemoglobina, os grupos
sangüíneos etc.).
Se cruzarmos certas plantas que têm flores vennelhas e brancas, como a Mirabilis jalapa, é
possível encontrar na F2 três fenótipos e não dois: flores vermelhas, brancas e rosadas , que correspondem aos três genótipos. Estes casos de herança intermediária são devidos ao fato de nos heterozigotos (flore s rosadas) a dominância ser incompleta. Aqui existe, portanto, uma co-dominância. Como vemos, nem sempre se cumpre a regra da dominância e da recessividade. A co-dominância é menos freqüente que a dominância e a recessividade completas. Naco-dominância se dá
um fenótipo com características intermediárias com relação aos fenótipos dos progenitores, embora sem que os alelos se mesclem.
20- 4. A lei da distribuição independente enuncia que os genes que estão em
cromossomos diferentes se distribuem de forma independente
Enquanto o princípio da segregação se aplica ao comportamento de lim só par de genes, a lei
da distribuição independ ente descreve o comportamento simultâneo de dois pares de alelos
quando estão localizados em cromossomos diferentes. Os genes que não estão localizados em um
AS BASES DA CITOGENÉTICA
~
~
~
~
~~
(~
~\
'l
~
~
'-'=-'
'f ~ ~
~~
~
~
~
/~
~
~
~
T ~ ~
~
/~
:i
~
1
1'
~
~
,.,~
~
1'·
~
~
'--'-"
~ ~
~
@
~
j:
~ ~
mesmo cromossomo se distribuem independentemente nos gametas, de modo que a descendência
resulta híbrida em dois loci.
A Fig. 20.2 mostra o cruzamento entre uma cobaia escura de pêlo curto (BBSS) e outra castanha
de pêlo longo (bbss). O animal BBSS produz somente gametas BS e o animal bbss produz somente
gametas bs. Na geração F 1, todas as cobaias são escuras de pêlo curto, porém heterozigotas (BbSs) .
Quando dois dos diíbridos da F 1 pareiam-se entre si, e como cada um forma quatro tipos de
gâmetas (BS, Bs, bS e bs), quando a fecundação ocorre originam-se 16 combinações diferentes
nos zigotos (células-ovo). Nove indivíduos da F2 são escuros de pêlo curto, três escuros de pêlo
longo, três castanhos de pêlo curto e um castanho de pêlo longo. Esta relação fenotípica de 9:3:3: 1
é característica do cruzamento de dois pares de genes.
20-5. Quando os genes estão em um mesmo cromossomo ocorrem
ligamentos entre eles
Os exemplos antes mencionados de cruzamentos genéticos respondem ao fato de que durante
a meiose os cromossomos - e com eles os genes - são distribuídos aleatoriamente nas células
dos descendentes (Cap. 19-14). No entanto, quando são realizados estudos com objetivos semelhantes na moscaDrosophila melanogaster, observa-se que a lei da distribuição independente não
tem aplicação universal. Assim, nos cruzamentos de dois ou mais pares de alelos existe uma acentuada tendência por parte desses genes a ficar ligados, de modo que se produz entre eles uma proporção de combinações diferente da esperada.
A Drosophila tem somente quatro pares de cromossomos, o que eleva a possibilidade de que
seus genes se encontrem em um mesmo cromossomo. Se dois genes distintos - por exemplo, A
e B - se localizarem em um mesmo cromossomo, e seus correspondentes recessivos - a e b -
•
325
Fig. 20.1 Cruzamento
monoíbrido entre um rato cinza
(traço dominante) e um branco
(traço recessivo). A figura
mostra o paralelismo entre a
distribuição dos genes e os
cromossomos, o mesmo que os
genótipos resultantes nas
gerações F 1 e F2 •
326
•
AS BASES DA CITOGENÉTICA
Fig. 20.2 Cruzamento de uma
cobaia escura de pêlo curto
(traços dominantes) com outra
castanha de pêlo longo (traços
recessivos) . Observe-se que os
genes são segregados
independentemente. (De C. A.
Villée.)
j PROGENITORES j
Castanho de pêlo longo
Escuro de pêlo curto
~~;;;,-=--~-""" o
'·,-,ex:~
!ilim
Genótipos
Espermatozóides
~
~
~
,,.-..
Ovócitos
Fenótipos
~
Genótipos
~
~
~
Fenótipos
Escuros de pêlo curto: 9
'
Qi
~
~
~
Castanhos de pêlo curto: 3
~
'5'
.--....
----lilim
~
~
Escuro. curto
Escuro. curto
Escuro, curto
._/
,,.-..
-
,,---
~
~"
""""""
~
,-.--....
~
..___...
Escuro, curto
~
/
,,,--.
~
..._.
-.
~
Escuro. curto
---.
~
~
Escuro, curto Escuro. longo Escuro. curto
...........
Castanhos de pêlo longo: 1
~
.
g;m
....._,,
Escuros de pêlo longo : 3
~
Escuro, !onqo
,,...
,--...
~
~
.._..,
Escuro. curto Castanho. curto Caslanho. curto
,..-
~
"--~
~
~
~
Escuro. curto Escuro. longo Castanho. curto Castanho. longo
no cromossomo homólogo, são obtidos para esses genes dois tipos de gametas: AB e ab (e não os
quatro esperados: AB, Ab, aB e ab).
A coexistência de dois ou mais genes no mesmo cromossomo é denominada ligamento. A Fig.
20.3 ilustra o mecanismo da meiose e da fo rmação dos gametas nesses casos.
20-6. O ligamento pode se romper por recombinação genética
Estudos posteriores demonstraram que o ligamento não é absoluto e que se rompe com relativa
freqüênc ia. Isto é ilustrado na Fig. 20.4, que mostra uma recombinação entre os genes A e B durante a meiose. Em conseqüência, forma m-se quatro tipos de gametas, dois dos quais possuem
cromossomos que sofreram recombinação genética. É evidente que o intercâmbio de segmentos
entre as cromátides homólogas rompeu o ligamento.
A freqüência de recombinação entre dois genes ligados em um cromossomo depende da distância que os separa. Os que estão próximos entre si se recombinam com uma freqüência menor
em relação aos que estão separados. Além disso, as proporções de ligamentos permitem estimar a
distância entre os genes e averiguar suas posições relativas no cromossomo.
No Cap. 19-7, assinalamos que a recombinação genética não é detectável microscopicamente.
Todavia, os quiasmas observados no diplóteno são uma representação dos sítios onde se produziu
o intercâmbio. Portanto, o número de recombinações pode ser estimado mediante a recontagem
dos quiasmas meióticos. Nas espécies com mais quiasmas , a possibilidade de recombinações é
mais elevada, o que dá lugar a maiores variações na descendência.
AS BASES DA CITOGENÉTICA
•
327
Fig. 20.3 Segregação de do is
pares de genes (AB e ab)
localizados em outros
cromossomos homólogos. Visto
que não ocorreu nenhuma
recombinação gênica durante a
meiose, fmmam- se dois tipos de
gametas diferentes AB e ab.
A~ªT
f'
Fig. 20.4 Segregação de dois
pares de genes (AB e ab)
localizados em outros
cromossomos homólogos. Visto
que ocorreu uma recombinação
gên ica durante a meiose,
formaram-se quatro tipos de
gametas diferentes: AB, Ah, aB e
b
1
a
B
b
ab.
Cj /
:/ r:\
:i 1:
"""
a
b
/ \
8
1:
ABERRAÇÕES CROMOSSÔMICAS
20-7. Acidentalmente, podem ser prod uzidas mudanças no cariótipo
O funcionamento normal do sistema genético mantém-se pela constância do material hereditário nos cromossomos. Nos Cap. 12-12 e 19-1 dissemos que as células somáticas têm um número
diplóide de cromossomos - dois jogos haplóides de 23 cromossomos cada um - e analisamos o
cariótipo.
Acidentalmente, podem ocorrer mudanças no cariótipo, que têm diversas conseqüências genéticas. Assim, os cromossomos podem modificar o seu número ou sofrer alterações em suas estruturas. Esses quadros são denominados , respectivamente, aberrações cromossômicas numéricas e aberrações cromossômicas estruturais.
20-8. Nas poliploidias, as células contê m múltiplos do número haplóide de
cromossomos, diferentes do dipl óide
O Quadro 20.1 mostra os dois tipos principais de alterações no número de cromossomos. Nas
poliploidias,'existe um número superior de conjuntos haplóides - mais de dois - porém cada
conjunto se apresenta equilibrado. Assim, nas células triplóides existem três conjuntos haplóides
~armais , nas tetraplóides, quatro etc. Nas células somáticas as poliploidias podem se originar pela
328
•
AS BASES DA CITOGENÉTICA
Quadro 20.1 Fórmu las e complementos cromossômicos em células poliplóides e
aneupló ides
Quadro clínico
Fórmula
Complemem o cromossômico*
Poliploidias
Triploidia
Tetraploidia
3n
4n
(ABCD) (ABCD) (ABCD)
(ABCD) (ABCD) (ABCD)
(ABCD)
Aneuploidias
Monossomia
Trissarnia
Tetrassornia
Dupla trissarnia
ulissornia
2n - 1
2n + 1
2n + 2
2n + 1
2n - 2
(ABCD) (ABC)
(ABCD) (ABCD) (B)
(ABCD) (ABCD) (B) (B)
(ABCD) (ABCD) (AC)
(ABC) (ABC)
+
1
•Para simplificar, neste exemplo são utilizados ape nas 4 cromossomos chamados A, B, C e D.
reduplicação dos cromossomos (Caps. 17-4 e 18-24); nos gametas, pela não separação dos cromossomos em qualquer das duas divisões meióticas.
20-9. Nas aneuploídías, o número diplóide de um dos pares de cromossomos
homólogos está afetado
Nas aneuploidias há ganho ou perda de um ou mais cromossomos, de modo que o conjunto
deixa de ser equilibrado. Como a alteração é quantitativa, a mensagem genética contida nos cromossomos mantém-se intacta, embora, como veremos, as aneuploidias possam causar graves alterações no organismo.
As aneuploidias ocorrem por falha na separação dos cromossomos homólogos - denominada
não disjunção - durante a divisão celular. A causa imediata da não disjunção é a falta de separação de uma das cromátides-irmãs na anáfase; deste modo, quando a célula chega na telófase,
essa cromátide permanece em uma das células-filhas junto com a cromátide-irmã. Isso dá lugar a
uma célula com um cromossomo a menos e a outra célula com um a mais (Fig. 20.5). A não disjunção se produz geralmente na meiose, porém também pode ocorrer na mitose.
A meiose não disjuntiva dá origem a um gameta aneuplóide que, quando se une a um gameta
normal, forma um zigoto portador de uma aneuploidia. Se faltar um cromossomo no gameta
aneuplóide, o zigoto será monossômico. Se sobrar um cromossomo, o zigoto será trissômico.
Assim, nos indivíduos monossômicos, ocorre a perda de um dos cromossomos, enquanto nos trissômicos há um cromossomo a mais (Quadro 20.1).
A mitose não disjuntiva pode ocorrer na divisão mitótica que precede a formação dos gametas
ou nas células derivadas da divisão do zigoto. No primeiro caso, os efeitos são semelhantes aos
produzidos pela meiose não disjuntiva. No segundo - como a não disjunção ocorre nos primeiros estágios do desenvolvimento embrionário - se originam os mosaicos, ou seja, indivíduos que
exibem linhagens celulares somáticas com cariótipos diferentes.
20-1 O. Existem vários tipos de abefrações cromossômicas estruturais
As aberrações cromossômicas estruturais devem ser diferenciadas das mutações gênicas, nas
quais as alterações ocorrem ao nível molecular, com alteração do código genético (Cap. 17-15).
Para compreender os mecanismos que dão lugar a aberrações cromossômicas estruturais é
necessário recordar que os cromossomos contêm uma única molécula de DNA (Cap. 12-1). Nas
aberrações cromossômicas estruturais ocorre uma alteração na composição ou na organização de
um ou mais cromossomos. Desta forma, a ruptura de um deles pode provocar, segundo o caso, a
perda de um segmento cromossômico - fenômeno denominado deleção - a duplicação de um
segmento, a translocação de segmentos entre cromossomos não homólogos ou a inversão de um
AS BASES DA CITOGENÉTICA
< l'>
ii
/
1
1
'
1
1
1
1
~
))
ANÁFASE
>
~
Normal
329
Fig. 20.5 Não disjunção
mitótica. Acima. Metáfase
normal. Abaixo à esquerda.
Anáfase normal. Abaixo à
direita. Anáfase não disjuntiva
(dá lugar a uma célula-filha com
uma trissarnia e a outra com uma
monossomia).
H
METÁFASE
•
>
Não disjunção
segmento dentro do próprio cromossomo. Estes defeitos podem ser detectados se analisarmos os
cromossomos em seu estado de máxima compactação, ou sej a, na metáfase (Cap. 12-12) (Fig.
12.15).
Deleção. A perda de material cromossômico pode ser terminal - em uma extremidade do cromossomo - ou intersticial - em um segmento intermediário do cromossomo (Fig. 20.6) . No
primeiro caso a aberração é o resultado de uma única ruptura; no segundo, de duas rupturas . Geralmente, as deleções são letais na condição homozigota, o que indica que a maioria dos genes é
imprescindível para o desenvolvimento do organismo.
Duplicação. Nesta aberração um segmento cromossômico é representado mais de uma vez em
um me~mo cromossomo (Fig. 20.6). As duplicações produzem efeitos menos graves para os indivíduos do que as deleções.
Inversão. Aqui um segmento de um cromossomo se inverte 180°. As inversões são denominadas pericêntricas, quando o segmento afetado inclui o centrômero, e paracêntricas quando não o
incluem (Fig. 20.6).
Translocação. Esta aberração cromossômica ocorre quando se rompem dois cromoss'omos não
homólogos e seus segmentos se intercambiam (Fig. 20.6). Quando a ruptura é registrada ao lado
•
Normal
Deleção
A B C D
E F G H
A C D
E F G H
B C D
E F G H
{'""º'""'
Terminal
Duplicação
Paracênlrica
Inversão
{
.
....
•
.-
Pericêntrica
ASCO
Transl ocação
EF GH
+
•
A B C D
Translocação
robertsoniana
li
A 8 C D
+
4
E
A B C D
E
F G H
....
Fig. 20.6 Esquemas que
mostram algumas das aberrações.
cromossômicas mais freqüentes .
330
•
AS BASES DA CITOGENÉTICA
do centrômero, ambos os cromossomos podem se fundir e dar origem a um cromossomo metacêntrico maior (Fig. 20.6E). Este processo - denominado translocação robertsoniana - tem
acontecido durante a filogenia de muitas espécies, nas quais têm surgido cromossomos novos, apesar
de sua redução numérica.
20-11. As radiações e os mutagênios químicos podem produzir
rupturas no s cromossomos
Da mesma forma que as mutações gênicas, as aberrações cromossômicas estruturais podem
ser produzidas espontaneamente. Todavia, sua freqüência aumenta pela ação de agentes químicos
mutagênicos, certos vírus ou por efeito das radiações ionizantes (raios X, 13, "/, luz ultravioleta)
(Fig. 20.7) .
ABERRAÇÕES CROMOSSÔMICAS NA ESPÉCIE HUMANA
20-12. As células humanas podem ser afetadas por aberrações
cromossôm icas
As alterações cromossômicas mais comuns no homem são representadas por aneuploidias
(monossomias e trissomias) e por aberrações estruturais que produzem malformações congênitas
graves, retardo mental e esterilidade, situações que atuam como mecanismos seletivos para eliminar da população esses graves desequilíbrios genéticos.
O diagnóstico das aberrações cromossômicas pode ser feito antes do nascimento, por meio do
estudo de algumas poucas células fetais obtidas do líquido amniótico (amniocentese) ou das vilosidades coriônicas (biópsia) (Fig. 20.8).
Fig. 20.7 Rupturas (setas) de
cromátides produzidas por
radiação. (De H. Evans.)
,
_
....
Miométrio
Fig. 20.8 Esquema que ilustra a
realização de uma amniocentese
para extrair células fetais do
líquido amniótico e de uma
punção-biópsia para extrair
vilosidades coriônicas.
Córion
Cavidade amniót1ca
AS BASES DA CITOGENÉTICA
20-13. Uma das aneuploidias autossô micas mais importantes
é a síndrome de Down
Entre as aneuploidias mais importantes está a síndrome de Down ou mongolismo , na qual existem três cromossomos do par 21 (trissomia) no lugar de dois. Os afetados apresentam um profundo
defeito no desenvolvimento do sistema nervoso central, retardo mental e outras malform ações.
Esta aberração cromossômica é mais freqüente à medida que aumenta a idade da mãe (Caps.
19-4 e 19-15). Além disso, não se observam recorrências familiares.
20-14. Outras aneuploidias ocorrem nos cromossomos dos pares 18 e 13
Na trissomia do par 18 - chamada síndrome de Edwards - o bebê é pequeno e débil, sua
cabeça é achatada lateralmente, os pavilhões auriculares são mal desenvolvidos, as mãos são curtas e as impressões digitais são sumamente simples; apresenta evidente retardo mental e a morte
ocorre antes de um ano de vida.
Na trissomia do par 13 - chamada síndrome de Patau - aparecem múltiplas malfo rmações
somáticas e retardo mental profundo. A cabeça é pequena e amiúde os olhos são muito pequenos
ou estão ausentes; também são freqüentes a fenda labial e a fenda palatina. Na maioria dos casos,
a morte ocorre pouco depois do nascimento.
20- 15. As aneuploidias também pode m afetar os cromossomos sexuais
No Quadro 20.2 estão indicadas as aneuploidias mais freqüentes nos cromossomos sexuais,
juntô com os nomes das síndromes clínicas e a indicação da presença ou ausência da cromatina
sexual ou corpúsculo de Barr (Caps. 12-11 e1 4-12).
Síndrome de Klinefelter. Estes indivíduos possuem 47 cromossomos (44 autossomos + XXY
e, por conseguinte, cromatina sexual positiva). São de aparência normal , porém apresentam testículos pequenos, ginecomastia, tendência a estatura elevada, obesidade e menor desenvolvimento
dos caracteres sexuais secundários. A espermatogênese não ocorre, o que determina a esterilidade
da qual padecem. Foram detectados homens com 48 cromossomos (44 autossomos + XXXY) ,
dois corpúsculos de Barr, os sinais da síndrome de Klinefelter que acabamos de mencionar e re-
Quadro 20.2 Aneuploidias sexuais no hom em
Quadro clínico
Trissomia
XYY
Síndrome XYY
2n = 47
o
Turner
2n = 45
Dissomia
XY
Normal
2n = 46
Dissomia
XX
Normal
2n = 46
Trissomia
XXY
Klinefelter
2n = 47
Tetrassomia
XXYY
Klinefelter
2n = 48
1
Trissomia
Tetrassomia
XXXY
Tipo Klinefelter
2n = 48
2
3
Meta fêmea
2n = 48
Pentassomia
XXXXY
Tipo Klinefelter
2n = 49
Feminino
Masculino
Monossomia
xo
xxx
Metafêmea
2n = 47
Tetrassomia
xxxx
Fenótipo
Cromatina sexual
Masculino
•
331
332
•
AS BASES DA CITOGENÉTICA
Qu adro 20.3 Mosaicos cromossômicos sexuais
Síndrome clínica
Mulheres
X O / XY
XO/ XXY
XO / XXX
Homens
XX / XXY
XY / XXY
XXXY / XXXXY
XO / XY
Cromatina sexual
Turner
Turner
Variável
Klinefelter
Klinefelter
Órgãos sexuais pouco
desenvolvidos
Hermafrodita
-
-/ +
- /++
+
+
+ + /+++
-
tardo mental. Menos freqüentes são os pacientes que contêm 49 cromossomos (44 autossomos +
XXXXY), três corpúsculos de Barr, defeitos esqueléticos, hipogenitalismo extremo e um coeficiente mental acentuadamente baixo.
Síndrome XYY. Os indivíduos afetados possuem 47 cromossomos (44 autossomos + XYY).
Trata-se de homens de aspecto normal , altos, com transtornos da personalidade.
Síndrome XXX. Deve-se à presença de 47 cromossomos (44 autossomos + XXX) e se apresenta em mulheres com fenótipo praticamente normal. Algumas exibem graus distintos de retardo
mental ou características psicóticas. Nas suas células são observados dois corpúsculos de Barr.
Também foram detectados pacientes com 48 cromossomos (44 autossomos + XXXX) , três corpúsculos de Barr e retardo mental grave.
Síndrome de Turner. No cariótipo destas pacientes existem 45 cromossomos (44 autossomos
+ X) e não aparece a cromatina sexual. O fenótipo dos indivíduos é feminino , podem ser de baixa
estatura, apresentam membranas cervicais (pregas de pele que se estendem desde as mastóides até
os ombros) e seus órgãos sexuais internos são infantis. O ovário não completa a sua formação e
por causa desta disgenesia ovárica não 'se desenvolvem os caracteres sexuais secundários.
Mosaicos. Nos tecidos destes indivíduos convivem células com complementos cromossômicos distintos. O Quadro 20.3 ilustra os mosaicos de cromossomos sexuais mai s freqüentes , tanto
em homens quanto em mulheres.
20- 16. Existem vári os quadros produzidos por aberrações
cromossômicas estruturais
A aberração cromossômica estrutural mais comum no ser humano ocorre pela translocação do
segmento de um cromossomo do par 21 a um cromossomo do par 13, 14 ou 15 (Fig. 20.9). Origina quadros semelhantes à síndrome de Down , porém menos graves e menos freqüentes - representam 2% dos casos-e seu aparecimento não tem relação com o aumento da idade materna. Às
vezes, a presença do segmento translocado é compensada pela ausência do mesmo segmento em
um cromossomo do par 2 1. Neste caso, os indivíduos são fenotipicamente normais, porém portadores da aberração, e, por isso, podem transferir a malformação aos seus descendentes.
A síndrome do miado do gato ocorre como conseqüência de uma deleção no braço curto do
cromossomo 5. Dá lugar a m últiplas malformações e acentuado retardo mental. Além disso, a
criança emite um choro estranho , semelhante a um miado.
Outros quadros de aberrações cromossômicas estruturais originam-se pela deleção de uma parte
de um dos cromossomos X (gera um quadro semelhante à síndrome de Turner) ou pela deleção
do braço curto ou longo de um dos cromossomos do par 18 (produz alterações faciais, esqueléticas e oftálmicas juntamente com um retardo mental profundo).
20- 17. Alguns tum ores mostram aberrações cromossômicas em suas células
As células cancerosas freq üentemente apresentam aneuploidias, cromossomos rotos e aberrações cromossômicas estruturais (translocações) (Cap. 18-30). Na leucemia mielóide crônica, por
AS BASES DA CITOGENÉTICA
PROGENITORES
PORTADOR SÃO
NOR MAL
li li
1 h
.i
.i
1
C romossomo 2 1
C romossomo 15
11
+
11
11
+
1 1 = li l 1
11
+
1
=
11
+
1
=
GAMETAS
li li
=
li
li
NORMAL
NÃO
SOBR EVIVE
MONGÓLICO
.
PORTADOR
SÃO
DESCE NDENTES
Fig. ,t0.9 Células somáticas (diplóides) e gametas (haplóides) dos progenitores quando no genótipo de um
deles existe a translocação do segmento de um cromossomo do par 21 em um cromossomo do par 15 . À
direita são mostradas as possíveis células somáticas (diplóides) dos descendentes.
exemplo, aparece o chamado cromossomo Filadélfia, produto de uma translocação entre os cromossomos 9 e 22 (Cap. 18-31 ). No retinoblastoma, o defeito em ambos os alelos do gene Rb pode
ser devido a deleções no braço longo dos dois cromossomos do par 13 (Cap. 18-32). No linfoma
de Burkitt, uma parte do cromossomo 8 é translocada para o cromossomo 14. Em alguns cânceres de pulmão observa-se uma deteção no cromossomo 3.
PAPEL DOS CROMOSSOMOS NA EVOLUÇÃO
20-18. A citogenética impulsionou o estudo da evolução das espécies
O estudo da evolução tomou um grande impulso graças ao desenvolvimento da citogenética,
ao poder se comparar os genomas de espécies aparentadas . A sistemática também sofreu um progresso considerável com o surgimento da citogenética, pois esta lhe proporcionou muitos recursos para elucidar inter-relações entre diferentes categorias taxonômicas (como se sabe, as famílias, os gêneros e espécies são caracterizados por terem sistemas genéticos distintos) .
O estudo do cariótipo de diversas espécies permitiu estabelecer uma série de fatos de grande
interesse, tanto no reino animal como no reino vegetal. Em populações selvagens ficou demonstrado que os indivíduos são, em certo grau, geneticamente heterozigotos: Em alguns casos, os genes,
mesmo quando idênticos, são ordenados de maneira distinta por causa de alterações ocorridas nos
segmentos cromossômicos. Estas alterações desempenham um papel preponderante no mecanismo de formação das espécies.
A organização dos cromossomos e dos cariótipos observada nos indivíduos, nas espécies, nos
gêneros e nos grupos sistêmicos maiores indica que na evolução intervieram diversos mecanismos cromossômicos. As principais fontes de variação têm sido a aneuploidia e a poliploidia. A
poliploidia não é tão importante no reino animal. Entre os vertebrados, diversos tipos de peixes
têm números diferentes de cromossomos. Os anfíbios, em especial os anuros, caracterizam-se pela
presença de um número fixo para cada família. A variação nas aves e nos mamíferos deve-se mais
a alterações em cada cromossomo e a mutações gênicas do que a modificações no conteúdo total
do material genético.
•
333
334
•
AS BASES DA CITOGENÉTICA
20-19. A evolução do cariótipo nos primatas foi estudada
Muitos dos trabalhos sobre evolução referem-se à relação citogenética entre o homem e os
grandes macacos (chimpanzé, gorila, orangotango). Visto que o homem tem 23 pares de cromossomos e os grandes macacos têm 24, pelo menos uma translocação robertsoniana em sua evolução pode ter ocorrido (Seção 20-10). Acredita-se que o cromossomo 2 do homem é o resultado
dessa translocação a partir de dois cromossomos dos macacos. Por outro lado, 13 pares de cromossomos humanos são quase idênticos a outros tantos pares de cromossomos do chimpanzé, e
nos cromossomos restantes observam-se inversões pericêntricas e a adição de material cromossômico. Em suma, nos primatas, a evolução dos cromossomos foi conseqüência de fusões , translo-·
cações e, fundamentalmente, inversões pericêntricas de segmentos cromossômicos, tudo o que
permitiu selecionar os genes que deram origem ao Homo sapiens.
A análise da seqüência do DNA mitocondrial também teve um importante impacto nos estudos taxonômicos. Permitiu estabelecer relações genealógicas entre espécies estreitamente relacionadas - como a humana e a dos macacos - e reconstruir a possível árvore evolutiva dessas
espécies.
BIBLIOGRAFIA
Brinkley B. R. and Hittelman W . N. (197 5) Ultrastructure of mammalian
chromosome aberrations . Int. Rev. Cytol. 42:49 .
Bühler E. M. (1980) A synopsis of the human Y chromosome. Human
Genet. 55: 145.
Dutrillaux B. (1~79) Chromosomal evolution in primates. Human Genet.
48:251.
Dutrillaux B. (1981) Les chromosomes des primates. La Recherche
12:1246.
Fuchs F. (1980) Genetic amniocentesis. Sei. Am. 242:47.
Gethart E. ( 1981) Sister chromatid exchange and structural chromosome
aberration in mutagenicity testing. Human Genet. 58:235.
Greagan R. P. and Ruddle F. H. (1977) New approaches to human gene
mapping by somatic cell genetics. In: Molecular Structure of Human Chromosomes . Academic Press , New York.
Harnden D. (1982) Human cytogenetic nomenclature. Human Genet.
59:269.
Hasold T. J. and Jacobs P. A. (1984) Trisom y in man. Annu. Rev. Genet.
18:69.
Henderson S. A. (1969) Chromosome pairing, chiasmata, and crossing
over. ln: Handbook of Molecular Cytology . North-Holland Publishing, Amsterdam.
Hib J. (2000) Embriología Médica, 7ª Ed. McGra w-Hill •Inte ramericana, Santiago de Chile.
Hook E. B. ( l 973) Behavioral implication of the human XYY genotype.
Science 179:139.
John B. and Lewis K. R. (1973) The meiotic mechanism. ln: Readings
in Genetics and Evolution. Oxford University Press, Oxford.
Jukes T. (1983) Mitochondrial codes and evolution. Nature 301: 19.
Kolata G. (1983) First trimester prenatal diagnosis. Science 221: 103 1.
Latt S. A. and Schreck R. R. (1980) Sister chromatid exchange analysis. Human Genet. 32:297.
Levan A., Levan G. and Mitelman F. (1977) Chromosomes and cancer.
Heréditas 86: 15.
Lewis K. R. and John B. (1964) The Matter of Mendelian Heredity. J.
& A. Churchill, London.
Lyon M. F. (1972) X-chromosome inactivation and development patterns in mammals. Biol. Rev. 47 :1.
Martin G. R. (1982 ) X-chromosome inactivation in mammals. Cell
29:721.
Olby R. C. (1966) Origins of Mendelism. Constable, London.
Ott J. (1 985) Analys is of Human Genetic Linkage. University Press,
Baltimore.
Pearson P. L. (1977) Banding patterns, chromosome polymorphism, and
primate evolution. ln: Molecular Structure ofHuman Chromosomes .
Academic Press, ew York.
Ro wley J . D. (1983) Human oncogene locations and chromosome
aberrations. Nature 301:290.
Sánchez O. and Yunis J. J. (1977) New chromosome techniques and their
me'dical application. In: New Chromosome Syndromes. Academic
Press, ew York.
Sing L. , Purdom I. F. and Jones K. W. (1980) Sex chromosome associated satellite DNA. Evolution and conservation . Chromosoma
79:137.
Solari A. J. (1999) Genética Humana, 2ª Ed. Editorial Médica Pa12americana, Buenos Aires .
Stahl F. W. (1969) The Mechanics oflnheritance, 2nd Ed. Prentice-Hall,
New Jersey.
Suzuki D. T. , Griffiths A. J. F. , Miller J. H. and Lewon'tin R. C. (1989)
An Introduction to Genetic Analysis. W. H . Freeman & Co, San
Francisco.
Swanson C. P. , Metz T. and Young W . J. (1981) Cytogenetics: The
Chromosome in Division , Inheritance, and Evolution. Prentice-Hall,
New Jersey.
Taylor J. H. (1967) Meiosis. ln: Encyclopaedia of Plant Physiology.
Springer-Verlag, Berlin.
von Wettstein D. et ai. (1984) The synaptonemal complex in genetic
segregation. Annu. Rev. Genet. 18:331.
Wolff S. (1977) Sister chromatid exchange. Annu. Rev. Genet. 11: 183.
Yunis J. J., Tsai M. Y. and Willey A. M. (1977) Molecular Organization and Function of the Human Genome. Academic Press, New York.
Yunis J. J. and Prakash O. (1982) The origin of man: A chromosomal
pictoriai legacy. Science 215: 1525.
A diferenciação celular
21-1. Introdução
Na primeira parte deste capítulo, depois de expor as características gerais das diferenciações
celulares, analisaremos os possíveis mecanismos responsáveis pelas diferenças iniciais entre as
células dos embriões mais jovens. Em seguida veremos como se forma o corpo do embrião e estudaremos os mecanismos que dão lugar às diferenciações celulares - e o modo como se mantêm - nas etapas posteriores do desenvolvimento. Finalmente, nos ocuparemos dos genes responsáveis pelo estabelecimento do plano corporal na mosca Drosophila melanogaster e de seus
possíveis equivalentes nos embriões dos vertebrados.
21-2. Características gerais da diferenciação celular
Em termos moleculares, diferenciação celular significa atividade gênica variada nas células
de um organismo. A especialização das células implica a síntese de proteínas específicas (como a
hemoglobina nas hemácias, os anticorpos nos linfóci tos, os neurofilamentos nos neurônios etc.).
Desta forma, em cada tipo celular é expresso um gene singular, distinto dos expressos em outros
tipos celulares (na realidade, as diferenças não são determinadas por um único gene e sim por
conjuntos de genes distintos). No Cap. 14, estudamos os mecanismos que regulam a expressão
dos genes. Muitas das investigações atuais em biologia molecular procuram interpretar como os
genes se expressam nos diferentes tipos de células.
Obviamente, nem todos os genes que se expressam em um tipo ce.lular determinado o fazem de
forma exclusiva. Alguns são ativados em todos os tipos celulares; chamam-se genes de manutenção e são necessários para construir os componentes comuns a todas as células (por exemplo, as
membranas celulares, os ribossomas, as mitocôndrias, as enzimas glicolíticas etc.). Por outro lado,
os genes que se expressam de forma diferencial (como os da hemoglobina, os anticorpos, os neurofilamentos etc.) c01Tespondem às chamadas - no jargão da biologia celular - funções de luxo.
21-3. Nas células diferenciadas, o genoma permanece constante
A diferenciação celular não acarreta perda de informação genética, de modo que em todas as
células do organismo - qualquer que seja seu estado de diferenciação - existem conjuntos de
genes idênticos que são os mesmos que se encontravam na célula-ovo (zigoto). Uma prova rigorosa disso provém de experiências de transplante nuclear em zigotos da rãXenopus. Seus núcleos foram destruídos com a luz ultravioleta e nesses zigotos injetaram-se núcleos somáticos de células
intestinais, completamente diferenciadas, provenientes do mesmo animal. Como se observa na
Fig. 21.1, os zigotos que receberam um núcleo de célula intestinal se desenvolveram até formar
rãs adultas normais que, além disso , mostraram-se férteis . Isto demonstra que as células somáticas conservam todos os genes necessários para completar o ciclo vital da rã, inclusive a formação
de suas células germinativas .
O transplante nuclear é possível também em mamíferos. No rato , o procedimento se baseia na
introdução de um núcleo somático de um embrião em fase inicial em um zigoto recentemente fertilizado do qual foram extraídos com a mesma pipeta os pronúcleos feminino e masculino (Fig.
21
336
•
A DIFERENCIAÇÃO CELULAR
Fig. 21.1 Transplante nuclear na
rã Xenopus laevis. Os núcleos
são extraídos das células do
intestino e transplantados em
zigotos cujos núcleos são
previamente destruídos com
raios ultravioleta. Como são
·obtidas rãs adultas, podemos
afirmar que as células somáticas
contêm os genes necessários
para form ar um organismo
completo.
r-ll
Célulaovo
uv
i
Rã
Células
_ ri~p::i
Destruição
do núcleo
'--"
Transferência
do núcleo
Gi rino
Rã
21.2) . Como é lógico, a cria resultante é geneticamente idêntica ao embrião que forneceu o núcleo. Procedimentos similares permitem a clonagem de mamíferos de maior tamanho, apesar de
que com eles a cria é gerada a partir de um ovócito (oócito) do qual foram extraídos os cromossomos e introduzido o núcleo diplóide de uma célula somática extraída geralmente de outro animal
adulto.
21 - 4. O estudo das inte rações nucleocitoplasmáticas forneceu
conhecimentos sobre os mecanismos que estabelecem e mantêm as
diferenciações celulares
O núcleo e o citoplasma são interdependentes: um não sobrevive sem a presença do outro. Por
exemplo, enquanto o citoplasma possui as moléculas de RNA para a síntese protéica e fornece a
maior parte da energia da célula mediante a fosforilação oxidativa nas mitocôndrias, o núcleo proporciona a informação genética que dá lugar a estes RNA.
As células H eLa - uma linha celular indiferenciada derivada de um carcinoma uterino de uma
paciente chamada Henrietta Lacks - têm a propriedade de se multiplicar indefinidamente em meios
de cultura. Podem ser enucleadas por centrifugação depois da agregação de citocalasina B, um
fármaco que desmonta os filamentos de actina (Cap. 5-8). O tratamento faz com que os núcleos
tendam a escapar dos citoplasmas, embora inicialmente fiquem ligados por um pequeno istmo (Fig.
21.3) . Quando se desprendem, formam-se núcleos rodeados por um envoltório citoplasmático
delgado (carioplastos) e citoplasmas sem núcleo (citoplastos) . Ambos sobrevivem muito pouco
Fig. 21.2 Esquema de um
transplante nuclear no rato.
Toma-se um blastocisto de uma
fêmea prenhe e com uma
micropipeta extrai-se o núcleo de
uma de suas células. Com a
mesma ,micropipeta esse núcleo
é introduzido em um zigoto
recém-formado, fornecido por
outra fêmea, do qual
posteriormente serão extraídos
os pronúcleos masculino e
feminino. O embrião assim
obtido se desenvolve in vitro até
o período de blastocisto e é
implantado no útero de uma
fêmea com pseudociese, onde
evolui até o nascimento.
~ Fêmea doadora
~~ do blastocisto
i
~
Extração de um
núcleo do blastocis1o
~
~mea doadora
~~ dozigoto
~ b
Injeção do núcleo
no zigoto
~-------------~
~ +--~
Descendência
Extração dos
pronúcleos doí igoto
Fêmea com pseudociese
li
\J +- lQ)
Blastocisto
Cultivo
A DIFERENCIAÇÃO CELULAR
~
Carioplasto
Crtoplasto ~
•
337
Fig. 21.3 Formação de
carioplastos e citoplastos a partir
de células aderidas a uma
superfície de plástico e tratadas
com citocalasina B.
tempo. No entanto, os citoplastos que permanecem viáveis por pelo menos dois dias depois da
enucleação cumprem as principais funções das células normais. Fica evidente, então , que pelo
menos durante algum tempo as funções citoplasmáticas não dependem do núcleo celular.
A interdependência entre o núcleo e o citoplasma foi demonstrada por meio de experiências de
fusão celular. A fusão de células com a ajuda do vírus Sendai permite colocar núcleos em citoplasmas alheios a eles. O produto da fusão de duas células diferentes é denominado heterocarionte
(Cap. 3-6), que é uma célula com dois núcleos de origem distinta. Como se vê na Fig. 21.4, ambos
os núcleos podem entrar em mitose, formar uma placa metafásica coll).um, dividir-se e produzir
células-filhas hfbridas com cromossomos dos dois núcleos progenitores.
Quando se fundem hemácias de frango com células HeLa, os núcleos inativos das primeiras se
reativam. É oportuno recordar que as hemácias têm uma vida muito curta (Cap. 18-1 ). Apesar de,
nos mamíferos, estas células perderem o núcleo ao término de sua diferenciação , isto não ocorre
nas aves, que o retêm de forma inativa. Assim, as hemácias de frango são células diferenciadas
com um núcleo muito condensado que não sin tetiza DNA nem RNA. O interesse deste
heterocarionte reside em que, depois da fusão , o núcleo da hemácia aumenta seu volume cerca de
20 vezes , sua cromatina se dispersa, começa a sintetizar RNA, forma um nucléolo e seu DNA
pode se replicar. Conseqüentemente, este núcleo é capaz de reiniciar a síntese de RNA e de DNA
apesar de pertencer a uma célula na qual ambas as atividades já não ocorrerem mais.
A revelação mais importante desta experiência de fusão celular é que a sfntese do RNA e do
DNA no núcleo é controlada pelo citoplasma, o que significa que substâncias presentes no citoplasma penetram no núcleo e provocam a duplicação do DNA e a produção dos RNA.
21-5. O controle da atividade gênica é re al izado em vários níveis
As experiências de fusão de células e de transplante nuclear demonstraram que os genes não se
perdem no curso da diferenciação celular e que as diferenças entre as células especializadas se
devem a que cada uma delas expressa conjuntos de genes distintos. Concomitantemente, os resultados obtidos com as experiências de fu são celular não deixam dúvidas de que o citoplasma contém componentes capazes de regular a atividade dos genes. Na Seção 21-7 veremos que se nacélulaovo esses componentes se distribuíram assimetricamente no citoplasma e, portanto, se repartiram
Célula
Célula
Fig. 21.4 Fusão celular mediante
o vírus Sendai que leva à
produção de um heterocarionte
com dois núcleos. A célula
híbrida é o resultado de uma
divisão sincrônica de ambos os ,
núcleos, que são portadores dos
cromossomos das duas células
progenitoras. (De N. R. Ringertz ,
e R. E. Savage.)
338
•
A DIFERENCIAÇÃO CELULAR
entre as células embrionárias-filhas de forma desigual, poderiam ter um papel fundamental no
estabelecimento das primeiras diferenciações celulares no embrião.
Como assinalamos nos Caps. 14, 15 e 16, o controle da atividade gênica é realizado em vários
níveis, embora o mais generalizado seja o controle transcricional. Devemos lembrar como atuam
os fatores de transcrição, a importância do grau de enrolamento da cromatina e os efeitos regulatórios da metilação das citosinas. Vinculando este tema com a repartição assimétrica dos componentes citoplasmáticos da célula-ovo entre as primeiras células embrionárias, diversas experiências sugeriram que alguns desses componentes são fatores de transcrição específicos que ativam
genes especiais nas sucessivas células-filhas à medida que a célula-ovo se segmenta.
21-6. O aparecimento de diferenciações celulares no embrião e o modo
como o plano corporal se desenvolve estão entre os principais
enigmas da biologia atual
A questão de como aparecem as diferenças entre as célul as no curso da embriogênese constitui
um dos maiores enigmas da biologia do desenvolvimento. Embora nos últimos anos se tenham
adquirido importantes conhecimentos sobre o tema, as questões essenciais continuam sem resposta, apesar de irem cedendo à medida que progride sua investigação.
Outra questão que intriga os pesquisadores é conhecer como se estabelece a organização espacial do corpo. Sabe-se que, conforme as células embrionárias se reproduzem e se diferenciam,
não ficam mescladas para ordenar-se depois, e sim que, passo a passo, vão construindo o corpo
. em pequena escala. Isso se deve ao fato de as células armarem uma espécie de estrutura ou modelo corporal que constitui o alicerce da estrutura definitiva do corpo.
21-7. Os determinantes citoplasmáticos se repartem
assimetricamente na célula-ovo
Os organismos multicelulares se desenvolvem a partir de uma célula-ovo que, depois de sucessivas divisões e diferenciações, dá origem à totalidade das células que compõem os tecidos corporais. Primeiramente, o zigoto apresenta uma série de divisões rápidas nas quais somente o DNA
se duplica (Fig. 19.3). Como o citoplasma nas sucessivas células-filhas se vai reduzindo ou segmentando a cada ciclo divisional, estas divisões são denominadas de segmentação ou clivagem
(Cap. 18-22) (Fig. 21.5 ).
Cabe assinalar que a partir do estágio de 16 células, os citoplasmas se vinculam por junções
comunicantes (Cap. 6-1 4) e as células periféricas se enlaçam entre si por junções oclusivas (Cap.
6-11). Quando o embrião alcança esse estágio adquire a forma de uma esfera sólida com aspecto
de amora, motivo pelo qual recebe o nome de mórula (Fig. 21.5D).
Posteriormente, o embrião se converte em uma esfera oca - denominada blastocisto (Fig.
2 l .5EF) - na qual são visualizados dois tipos de tecidos, a massa celular interna, primórdio do
(.:\:\
\ -" I
[
~_)__Blastômero~ .
®
Fig. 21.S Segmentação ou
clivagem da célula-ovo até a
formação do blastocisto.
A
B
e
D
E
F
A DIFERENCIAÇÃO CELULAR
•!'!'!!!~- Linha
primrtiva
•
339
Fig. 21.6 Esquema dos fo lhetos
do embrião trilaminar de 21 dias.
Ectode rma
Notoccrda
Mesoderma
-
- - Endoderma
futuro corpo do indivíduo , e o trofoblasto , que intervém na formação da placenta. Duas semanas
depois, a massa celular interna dá lugar a um embrião plano discóide composto por três camadas
epiteliais superpostas. Estas são chamadas ectoderma , mesoderma e _e ndoderma e entre elas
existem sinais inequívocos de diferenciação (Fig. 21.6).
Agora, vamos descrever como surgem as diferenças iniciais entre as células do embrião primitivo . Visto que as células mais iniciais não escapam à regra de conter os mesmos genes da célulaovo, as desigualdades iniciais entre elas devem ser buscadas nas moléculas distribuídas em seus
citoplasmas, que herdam quando a célula-ovo se segmenta. Com efeito, considera-se que o citoplasma contém - assimetricamente distribuídas - moléculas que se repartem de maneira desigual entre as primeiras células do embrião e que influenciam a ativ idade de seus genes (Fig. 21.7).
Assim, essas moléculas - que levam o nome de determinantes citoplasmáticos do desenvolvimento - atuariam como fatores de transcrição específicos (Cap. 14-7 e Seção 21-5).
21-8. A idéia da distribuição assimétrica dos determinantes citoplasmáticos
foi apresentada há mais de 100 anos
A idéia de que o citoplasma da célul a-ovo contém determinantes que se distribuem de forma
desigual entre as células-filhas e afetam a atividade nuclear não é nova. Na edição de 1896 da
clássica obra de E. B. Wilson, The Cell in Development and Heredity, o de.senvolvimento embrionário primitivo aparece resumido da seguinte maneira:
"Se a cromatina fo sse o idioplasma [termo antigo aplicado aos genes] no qual se reuni sse a
soma total das forças da herança, e se distribuísse por igual a cada divisão celular, de que maneira
poderia variar seu modo de ação nas diferentes células para causar diferenças de estruturas [ou
seja, diferenciação]? Pela influência do idioplasma, o citoplasma da célul a-ovo ou dos blastômeros
derivados desta experimenta modificações específicas e progressivas , e cada modificação reage
sobre o núcleo e incita uma nova mudança. Estas modificações dife rem nas diversas regiões da
célula-ovo devido às diferenças preexistentes - químicas e físicas - na estrutura citoplasmática, e estas constituem as condições sobre cuj a influência o núcleo atua".
Como vemos, alguns de nossos conceitos sobre o desenvolvimento mudaram pouco no curso
dos anos. Por outro lado , ao longo do caminho temos aprendido bastante acerca de como os genes
são controlados. Os métodos de estudo atuais fizeram do controle da atividade gênica um dos
campos da ciência biológica que avança com maior velocidade. Assim, parece justificada a sensação de otimismo de quem acredita que chegaremos muito breve a compreender detalhadamente
~orno os genes são controlados durante o desenvolvimento embrionário.
21-9. A segregação dos determinantes citoplasmáticos é facilmente
detectável em algumas espécies
Em algumas espécies, a segregação dos componentes citoplasmáticos da célula-ovo é evidente. Um bom exemplo é oferecido pelos zigotos de anfíbios (e outras espécies), já que contêm em
seus citoplasmas uma região chamada plasma germinativo, que se pode reconhecer pela presença
de certos grânulos especiais. Quando termina a segmentação, essa região do citoplasma da célulaovo dá origem às células germinativas do novo organismo. Portanto, quando se inadia com luz
ultravioleta o plasma germinativo dos zigotos, os animais resultam estéreis. Em contrapartida, se
Fig. 21.7 Acima. Determinantes
citoplasmáticos do
desenvolvimento da célula-ovo.
Abaixo. Observe-se sua
repartição assimétrica entre as
células-filhas.
340
•
A DIFERENCIAÇÃO CELULAR
forem injetados plasmas germinativos em outros pontos do zigoto aparecem no indivíduo adulto
células germinativas em localizações anormais.
21-1 O. Os ovócitos acumulam substâncias para serem usadas durante o
desenvolvi mento incipiente do novo indivíduo
Em geral, os ovócitos - e, por conseguinte, os zigotos - são muito volumosos, já que acumulam muitas das moléculas e das estruturas necessárias à concretização das primeiras etapas do desenvolvimento embrionário. Por exemplo, um ovócito de Xenopus contém 100.000 vezes mais RNA
polimerases, histonas, mitocôndrias e ribossomas que uma célula somática do mesmo animal adulto. Uma das razões para acumular esses materiais - e não ter de fabricá-los durante a embriogênese
inicial - é a extraordinária rapidez das divisões celulares durante a clivagem ou segmentação da
célula-ovo. A velocidade é tão alta que não dá tempo para que sejam sintetizados novos RNA e proteínas. Sabe-se que a maioria destas moléculas é formada durante a ovocitogênese, estando, portanto, no citoplasma do ovócito - e da célula-ovo - muito antes de ocorrer a fecundação. Obviamente, tais moléculas são codificadas por genes pertencentes à mãe e não ao embrião.
A primeira divisão de segmentação no zigoto de Xenopus ocorre 90 minutos depois da fertilização. As onze divisões seguintes são produzidas a cada 35 minutos, de forma sincronizada. Compare-se este tempo com o de 24 horas utilizado por uma célula comum para se dividir. A produção
destes ciclos celulares tão curtos se deve a que no DNA das primeiras células embrionárias aparecem muito mais origens de replicação (o que encurta a fase S) e as células omitem as fases G 1 e G2.
Assim, cada mitose é seguida por outra imediatamente. ORNA começa a ser sintetizado a partir da
duodécima divisão de segmentação. A causa que impede essa síntese nas etapas prévias seria apresença de uma substância que se une à cromatina e anula a transcrição do DNA. Como sua quantidade seria suficiente para bloquear o DNA de até 4.000 núcleos, essa substância se esgotaria na
duodécima divisão de segmentação, momento no qual os genes começam a se expressar.
Em muitas espécies, a localização das moléculas fornecidas pelo ovócito não é fixada de antemão. Por exemplo, no zigoto de Xenopus, o córtex se contrai nos antípodas do ponto de entrada do
espermatozóide, o que produz, neste lugar, uma área denominada crescente (ou semilua) cinzenta
(Fig. 21.8). Mais tarde, esta região dá origem ao blastoporo, ou seja, o lugar onde as células superficiais se invaginam para formar o mesoderma. Conseqüentemente, o ponto de entrada do espermatozóide, que é aleatório, determina a posição do eixo dorsoventral do futuro indivíduo (Fig. 21.8).
21 - 11. Nos embriões de mamíferos, as primeiras oito células são
toti potentes
Fig. 21.8 Desenvolvimento da rã
Xenopus laevis. A gastrulação
começa após 10 horas da
fecunqação e durante seu
transcurso são produzidos
extensos movimentos celulares
morfogenéticos. O blastóporo é
formado no centro de uma zona
pigmentada chamada meia-lua
cinzenta, que aparece no lado
oposto da entrada do
espermatozóide. Este ponto
determina o eixo dorsal do
embrião. (Cortesia de J. B.
Gurdon.)
A distribuição desigual das moléculas contidas na célula-ovo estende-se - diversificando-se
cada vez m ais - a sucessivas gerações de células , o que se prolongaria até a formação do embrião de três camadas.
Entretanto, nos mamíferos, o anteriormente dito não é aplicável até a quarta divisão de segmentação, já que ao cabo das três primeiras , quando o embrião de 8 células se forma, entre estas
e o zigoto aparentemente não existe diferenciação. Desta m aneira, até este estágio, cada uma das
células é totipotente, ou seja, pode gerar um organismo completo, como a própria célula-ovo.
Esta condição é a que tom a possível o desenvolvimento de gêmeos idênticos. Em síntese, é pro-
Pólo animal
Espermatozóide
Blastocele
Futuro lado dorsal
Lado dorsal
~~::~~~~:~)
Pólo vegetativo
OVÓCITO
Media-lua cinzenta
CÉLULA-OVO
Blastóporo
BLÁSTULA
Cavidade
intestinal
Futura cabeça
GÁSTRULA
Intestino
GIRINO
A DIFERE CIAÇÃO CELULAR
vável que nos citoplasmas das primeiras 8 células embrionárias existam moléculas quantitativa e
qualitativamente equivalentes às da célula-ovo, o que indicaria que até este momento sua repartição tenha sido emparelhada.
21-12. Nas etapas mais primitivas do desenvolvimento embrionário, as
células poderiam se diferenciar de acordo com suas posições
Nos embriões de mamíferos, não se descarta o seguinte mecanismo para geração das primeiras
diferenciações celulares: durante o translado do embrião pela tuba uterina, suas células seriam
alcançadas por diferentes concentrações de substâncias presentes no meio, de acordo com as posições que ocupam na mórula. Assim, quanto mais profunda for a localização de uma célula na
mórula, menos concentradas essas substâncias lhe chegariam, e essa dissimilitude poderia contribuir para o desencadeamento das primeiras diferenciações celulares . Cabe assinalar que as substâncias que ingressam no embrião propagam-se de uma célula para a outra por meio das junções
comunicantes, que aparecem tão logo a mórula é constituída, quando o estágio de 16 células é
alcançado (Seção 2 1-7) .
Dá-se o nome de morfógeno a toda substância difusível que produz respostas diferentes em
células idênticas segundo o nível de concentração com que chega a elas. A qualidade da resposta
- neste caso, o tipo de diferenciação - se deveria a que nas células induzidas seriam ativados
genes diferentes quando o morfógeno se acha por baixo ou por cima de sucessivos limiares de
concentração.
21-1 J.. Os valores posicionais das células embrionárias criam as
bases para o aparecimento dos fenômenos indutivos
As substâncias envolvidas na geração das primeiras diferenciações têm uma responsabilidade
adicional: deixar estabelecidos os fu ndamentos que condicionam o aparecimento de diferenciações futuras. Com efeito, à medida que os grupos celulares se localizam em seus lugares corporais
correspondentes, essas substâncias conferem às células determinados valores posicienais, distintos entre si. Estes valores começam a ter vigência a partir do momento em que as células embrionárias se distribuem em três camadas epiteliais superpostas - formam o embrião plano trilaminar
(Fig. 21 .6)- o que dá lugar a relações de vizinhança entre os grupos celulares que tomam possível a influência de algumas células sobre as outras. Neste contexto , uma célula pode atuar sobre
outra - a primeira emitindo um sinal e a segunda se diferenciando - ao possibilitar a seus respectivos valores posicionais tal ação e tal reação. Em outras palavras, os valores posicionais criam as bases para o aparecimento dos fenômenos indutivos, propulsores da maior parte das diferenciações futuras. Estudaremos posteriormente estes fenô menos depois de analisar como o modelo corporal nos embriões dos mamíferos é estabelecido.
21 - 14. O plano corporal é estabelecido muito precocemente nos embriões
Nos embriões dos mamíferos, as polaridades corporais - ou seja, os eixos cefalocaudal, dorsoventral e médio-lateral do corpo - se instauram quando começa a se formar o mesoderma, a
terceira das camadas epiteliais a aparecer e que integram o disco embrionário de 21 dias (Fig. 21 .6).
Oponto de referência para essas coordenadas é o nó de Hensen , onde se originam o notocórdio e
as partes restantes do mesoderma, ou seja, a placa c-ardiogênica, o mesoderma branquial, os somitos , os gononefrótomos e os mesodermas laterais (Fig. 21.9).
O embrião plano trilaminar não tarda em ingressar em uma etapa significativa de seu desenvolvimento e, por sua vez, crucial para o estabelecimento do modelo a partir do qual se formará o corpo
do futuro indivíduo. Nela, o disco embrionário se dobra tanto longitudinal como transversalmente, o
que origina um corpo cilíndrico, com suas extremidades cefálica e caudal, suas faces ventral e dorsal e seus lados direito e esquerdo perfeitamente identificáveis. Além disso, em seu dorso - antes
do aparecimento de um sulco ectodérmico - form a-se o tubo neur al, onde é possível distinguir
uma metamerização (ou segmentação) sutil, particularmente no prosencéfalo e no rombencéfalo.
Os segmentos nos quais se divide o prosencéfalo são denominados prosômeros; os do rombencéfa-
•
341
342
•
A DIFERENCIAÇÃO CELULAR
Fig. 21.9 Diferentes setores nos
quais o folheto mesodérmico do
embrião de 21 dias se segmenta,
o que lhe confere uma evidente
polaridade corporal.
Mesoderma caudal
lo, rombômeros. Uma vez formado o tubo neural, lateralmente à medula espinal, posicionam-se os
somitos, cujos blocos conferem ao corpo uma segunda metamerização (Fig. 21.9).
Juntamente com o estabelecimento do plano geral do corpo começam a aparecer os esboços e a se
diferenciar as células e tecidos de praticamente todos os órgãos corporais. O primeiro sistema orgânico
que aparece - e funciona - é o cardiovascular, cujo sangue em um pouco tempo mais há de transpo1tar, entre outros elementos, substâncias indutoras de múltiplas diferenciações (Seção 21-18).
21-15. As diferenciações geradas por fenômenos indutivos começam
quando o embrião trilaminar se forma
As induções são processos pelos quais as células de alguns tecidos incitam as células de outros
tecidos a se diferenciar, ou seja, a se transformar em outros tipos celulares (de acordo com a oportunidade, também podem fazer com que morram, modifiquem seu ritmo de proliferação ou se
mobilizem). A manifestação deste mecanismo biológico revela a existência de pelo menos três
grupos celulares distintos: uns que se comportam como indutores, outros que são induzidos e
·outros que não induzem nem se deixam induzir.
Para que as células possam ser induzidas têm de ser competentes, ou sej a, devem ter a capacidade de reagir com uma mudança (diferenciação) diante da presença de uma substância indutora. Tal competência envolve um período de tempo muito preciso, de modo que se o indutor atuar
antes ou depois do momento adequado, sua influência será nula; contudo, em alguns casos, uma
mesma célula pode seguir diferentes vias de diferenciação, segundo o momento em que o indutor
a influencia. Por sua vez, às vezes, os tecidos indutores também têm um tempo limitado para exercer
suas ações indutivas.
Um exemplo de indução de competência é oferecido pelo notocórdio e pelo ectoderma situado
por cima (Fig. 21.6): o notocórdio não tem ação indutiva sobre o endoderma e o resto do mesoderma porque estes tecidos não são competentes como o ectoderma. Parte deste se diferencia em tecido nervoso ao ser induzido precisamente pelo notocórdio , único tecido habilitado para este fim.
Vemos então que o notocórdio e o ectoderma são diferentes entre si, e com relação a outros tecidos, não somente por suas localizações e características morfológicas, mas também por seus comportamentos indutivos. Estes estados de diferenciação derivam-se das histórias prévias dos grupos celulares que tiveram diferentes valores posicionais segundo os determinantes citoplasmáticos que herdaram da célula-ovo.
21 - 16. Foram identi ficadas algumas moléculas capazes de
gerar induções precoces no embrião
O tipo de indução que acabamos de analisar exige que os tecidos participantes sejam vizinhos,
já que o tecido indutor exerce sua influência por meio de moléculas difusíveis que segrega no meio
e que alcançam o tecido competente se este se encontrar nas imediações (secreção parácrina). Cabe
acrescentar que o tecido reage - é competente - se suas células dispuserem de receptores específicos para tais moléculas.
A DIFERENCIAÇÃO CELULAR
Ultimamente foram identificadas algumas molécula com comprovada capacidade para gerar
induções. Uma delas - a que recebeu o nome de ativina - foi detectada no embrião em fase
inicial de Xenopus, no que poderia desempenhar um papel indutivo no lábio dorsal do blastóporo
(ao nível do organizador de Spemann), uma estrutura equivalente ao nó de Hensen dos embriões
iniciais dos vertebrados superiores (Figs. 21.6 e 21.8). A ativina pertence à família de substâncias
indutoras TGF-13 (Cap. 11 -11 ), o mesmo que outra molécula com funções indutivas similares,
chamada Vg-1 (do inglês, vegetalising -1 facto r). O FGF, mencionado no Cap. 11-12, também
está envolvido em atividades indutivas durante o desenvolv imento embrionário.
Em diversas localizações de embriões de várias espécies foram descobertas outras moléculas com
funções indutivas, como a dorsalina - também pe11encente à famr1ia TGF-f3 - ; uma família de
moléculas chamadas Wnt (do inglês, winglesslint) - necessárias à formação do mesoderma e do
sistema nervoso central-; as proteínas denominadas nogina, folistatina , cordina e neurogenina
- indutoras do tecido nervoso - ; o ácido retinóico (Cap. 11 -6) e as proteínas Shh (do inglês, sonic
hedgehog) e BMP4 (do inglês, bone morphogenetic protein) envolvidas na indução dos membros e
do tubo neural etc. O ácido retinóico e a proteína Shh são segregados pelo notocórdio.
21 - 17. Alguns indutores comportam-se como morfógenos
Em alguns casos, as substâncias indutoras comportam-se como m01fógenos, já que, depois de
serem segregadas pelo tecido indutor, suas concentrações diminuem à medida que fluem pelos citoplasmas das células. Segundo suas posições no tecido induzido, as células recebem concentrações
diferentes do morfógeno, motivo pelo qual se convertem em tipos celulares diferentes. Além disso,
cada limiar de concentração do morfógeno fornece às células um valor posicional singular. Este é
conservâdo de forma indelével independentemente das células se manterem juntas no tecido ou se
separarem e de se situarem em pontos distantes do embrião. Os diferentes valores posicionais criam
as bases para as condutas futuras das células, inclusive o aparecimento de novas diferenciações.
21-18. Nas etapas mais avançadas do desenvolvimento ocorrem
induções entre tecidos distantes
Nas etapas mais avançadas do desenvolvimento embrionário aparecem induções mediadas por
hormônios - ou seja, entre tecidos distantes - que se agregam às anteriores. Uma vez elaborados por células indutoras, os hormônios chegam aos lugares de destino transportados pelo sangue
(secreção endócrina). Como nas induções mediadas por secreções parácrinas, as células competentes são aquelas que dispõem de receptores específicos.
Cabe advertir que os processos induti vos - por vizinhança ou a distância - continuam até o
nascimento e durante toda a vida pós-natal , já que são imprescindíveis ao funcionamento e sobrevivência do organismo. O modo como as moléculas induf'oras atuam sobre os receptores celulares
e a maneira como os sinais se propagam no interior das células foram analisados no Cap. 11.
21-19. A determinação para a mudança se fixa nas células antes que
revelem sua diferenciação
As células adquirem o "compromisso" de se modificar antes que possamos descobrir que elas
estão diferenciadas. Este compromisso prévio, chamado determinação, é iITeversível e pode ser
fixado por um determinante citoplasmático ou por uma substância indutora. Existe, então, um período de latência - que varia em cada tipo celular - entre o instante em que a célula fica determinada e o momento em que sua diferenciação se torna evidente.
21 - 20. Quanto menos diferenciada estive r uma célula, maior é a sua
potencialidade evolutiva
Leva o nome de potencialidade evolutiva a condição biológica que permite a uma célula gerar um número determinado de células diferentes; assim, quanto maior o número de tipos celulares que uma célula for capaz de originar, maior é sua potencialidade (Fig. 21.10). A célula-ovo,
•
343
344
•
A DIFERE CIAÇÃO CELULAR
Fig. 21.10 Diagrama que
representa a diminuição da
potencialidade evolutiva e o
aumento inversamente
proporcional do significado
evolutivo nos tecidos
embrionários.
por ser a predec~.ss ora de todos os tipos celulares do organismo, é a que possui a potencialidade
evolutiva mais elevada. Conforme o desenvolvimento avança e aparecem os sucessivos tecidos
embrionários, a potencialidade das células declina. Os somitos, por exemplo, dão origem a um
número mais restrito de tipos celulares.
Quando uma célula alcança seu grau máximo de diferenciação - ou seja, quando adquire as
características de um dos tipos celulares presentes no organismo adulto - sua potencialidade
desaparece. Dizemos então que ela alcançou o seu significado evolutivo final. As células embrionárias aumentam seu significado evolutivo (aproximam-se do tipo celular que hão de alcançar
no final de sua evolução) ao mesmo tempo que restringem suas potencialidades evolutivas (conforme se diferenciam, podem originar um número menor de tipos de células).
Em alguns tipos celulares, a potencialidade se mantém relativamente elevada de forma permanente ainda na vida pós-natal. Por exemplo, na medula óssea existe uma célula multipntencial que
dá origem a hemácias , granulócitos, linfócitos, monócitos e plaquetas .
Por outro lado, em situações vinculadas com a reparação de tecidos, células que já alcançaram
seu significado evolutivo final podem se desdiferenciar e retroceder a um estado mais primitivo,
imprescindível para sua multiplicação. Vejamos o seguinte exemplo: se extirparmos uma parte do
fígado, algumas células do setor não extirpado se desdiferenciam e se multiplicam (Cap. 18-28);
recuperado o tamanho do órgão, voltam a se diferenciar e recobram as características das células
hepáticas originais.
Não existe certeza de que uma célula possa se desdiferenciar até reassumir um grau de potencialidade evolutiva tal que lhe permita voltar a se diferenciar em outro sentido, isto é, em um tipo
celular diferente daquele ao qual pertencia. Isso porque, uma vez que as células são determinadas,
seus estados diferenciais ficam estabelecidos para sempre. Veremos em seguida que se a célula se
dividir, a estabilidade de sua diferenciação é transmitida às células-filhas , fato que se repete de
geração em geração.
21-21. Os estados de diferenciação se mantêm estáveis e são
transmitidos às células-filhas
Uma das características da diferenciação celular nos organismos superiores é que, uma vez que
isso se verifica, mantém-se instável e persiste até a morte da célula. Por exemplo, as células que
não se dividem (neurônios etc.) permanecem assim durante toda a vida do indivíduo. Algo similar
ocorre com as células que se dividem assiduamente; embora morram em pouco tempo, o fazem
sem modificar o seu estado de diferenciação.
As células diferenciadas não podem se converter em outros tipos celulares sob nenhuma condição , nem quando submetidas às mais complexas manipulações experimentais (pelo menos com
os recursos atuais). Esta característica biológica é conhecida pelo nome de memória celular.
Depende da persistência, na célula, das causas que controlam a expressão dos genes , quer dizer,
dos fatores de transcrição, da metilação do DNA e do grau de enrolamento da cromatina (Caps.
12-6, 12-12 e 12-13). Estes mecanismos se mantêm, ao longo de toda a vida das células , mediante
processos biológicos não muito bem compreendidos. Seguramente estão relacionados com substâncias citoplasmáticas específicas para cada tipo celular. Esta suposição é respaldada pelas experiências de transplante nuclear descritas na Seção 21-3 , já que na célula transplantada os genes
que estavam ativos, quando o núcleo se achava no citoplasma original, não se expressam e os que
o faziam no núcleo eliminado se expressam .
A DIFERENCIAÇÃO CELULAR
•
345
Os estados de diferenciação passam às células-filhas de geração em geração até a última das
células descendentes. Esta herança da memória celular é devida ao fato de que, quando o DNA
se replica, os elementos que controlam a expressão dos genes , mais do que se manter, também se
duplicam, de modo que nas células-filhas aparecem os mesmos fatores de transcrição, os mesmos
padrões de metilação do DNA e os mesmos modelos de condensação da cromatina que nas células progenitoras (Caps. 14-12 e 14-1 3).
21 - 22. O estabelecimento do ~lano corpo ra l na Drosophila é o resultado de
decisões escalonadas tomadas por uma série de genes
Quando o desenvolvimento embrionário se inicia, o genoma, além de codificar a síntese das
proteínas que dão lugar aos distintos tipos celulares, fornece o programa que leva ao estabelecimento do modelo tridimensional do corpo. As informações contidas nesse programa e suas conseqüências - que aparecem quando o espermatozóide fecunda o ovócito·(oócito) e continua até
etapas relativamente avançadas do desenvolvimento embrionário - começaram a ser reveladas,
já que foi descoberta a maneira como as chaves unidimensionais encerradas nos genes dão lugar
a organismos tridimensionais. Os dados mais reveladores provêm de trabalhos realizados na mosca Drosophila melanogaster, cujo desenvolvimento embrionário passamos a descrever (muito
sucintamente) com o propósito de facilitar a compreensão do tema que nos ocupa (Fig. 21.11) .
A Drosophila se desenvolve - depois da formação da célula-ovo após a fecundação e de atravessar o período embrionário - a partir de uma larva. Esta é composta por uma sucessão de segmentos ----=- um cefálico, três torácicos e oito abdominais - os quais lhes conferem uma clara
polaridade espacial, pois tão-logo aparecem ficam configurados os eixos cefalocaudal, dorsoventral e médio-lateral do corpo larvário.
A larva se converte em mosca a partir de vários grupos celulares que aparecem e se assentam
debaixo da epiderme dos segmentos larvários. Estes grupos celulares são conhecidos pelo nome
de discos imaginais (de imago, inseto adulto que se forma a partir de uma larva); existem nove
pares colocados de um lado e do outro da linha média da larva e mais um ímpar situado na extremidade caudal (19 discos no total). Cada disco dá origem a uma das estruturas exteriores da mosca. Assim, de um par de discos surgem os olhos e as antenas, do outro a boca, do outro as asas e
parte do tórax, de outros as patas unidas ao resto do tórax, de outros, ainda, as estruturas que compõem o abdome etc. Estas partes, adequadamente encaixadas/montadas, formam um corpo adulto
também segmentado como o da larva.
Apesar de desde o princípio as células de todos os discos imaginais serem morfologicamente
idênticas, já estão determinadas, pois geram - qualquer que seja a manipulação experimental a
que sejam submetidas - somente as estruturas pertencentes aos seus segmentos de origem. Com
efeito, se transplantarmos um par de discos imaginais na posição de outro par, quando a mosca
adulta se formar, os discos enxertados terão desenvolvido as estruturas correspondentes a suas
localizações originais, independente da nova localização .
O desenvolvimento do plano corporal que acabamos de descrever é controlado por uma rede
complexa de genes reguladores que começam a exercer suas funções quando a célula-ovo se for-
Célula-ovo
Larva
diffi&&&4h+lé&'Y
Disco imaginai
Fig. 21.11 Desenvolvimento da
mosca Drosophila melanogaster.
Na parte inferior aparece um dos
cromossomos da mosca no qual
se local izam vários genes com
homeobox. Observe-se como a
ordem dos genes corresponde a
ordem dos segmentos corporais
em que esses genes se
expressam.
346
•
A DIFERENCIAÇÃO CELULAR
ma. Os primeiros a atuar são os chamados genes da polaridade da célula-ovo, que pertencem à
mãe; têm por missão estabelecer os eixos cefalocaudal, dorsoventral e médio-lateral do corpo. Em
seguida o fazem três conjuntos de genes agrupados sob o nome de genes segmentares; são os que
dão origem à formação dos segmentos larvares. Finalmente, atuam os denominados genes homeóticos, dos quais se deriva a formação dos discos imaginais e, por conseguinte, o desenvolvimento das estruturas externas da mosca adulta (olhos , antenas, boca, asas, patas, tórax, abdome etc.).
A polaridade do corpo se verifica desde o começo do desenvolvimento embrionário pela presença de certas moléculas - herdadas do ovócito - que, como este antes da fecundação, se concentram e distribuem de fo rma desigual nos diferentes setores da célula-ovo. Depois das divisões
de segmentação, essas moléculas são herdadas - também de forma desigual - pelas primeiras
células embrionárias, o que fixa as polaridades espaciais do futuro corpo larvar. É óbvio que tai s
moléculas, ao provirem do ovócito, não são codificadas por genes do embrião e sim por genes da
mãe, concretamente, os genes de polaridade da célula-ovo, pertencentes ao ovócito. Na realidade, alguns desses genes correspondem às céiulas foliculares que rodeiam o ovócito, as quais durante a permanência do ovócito no ovário - sintetizam as moléculas às quais nos referimos
(RNAm e proteínas) e as lançam no citoplasma da célula germinativa.
Dizemos que há três classes de genes segmentares e que se denominam genes de fissura, de
regra dos pares e da polaridade dos segmentos. São expressos, nessa ordem, ao serem ativados
por sinais posicionais estabelecidos nas células embrionárias com antecedência. Destes genes
depende a formação dos segmentos larvares e, neles, o desenvolvimento de detalhes cada vez mai s
finos.
Por fim, expressam-se os genes homeóticos, depois de serem ativados pelos produtos de alguns genes que atuaram precedentemente. Definem a formação das partes adultas da Drosophila.
Deste modo, segundo os discos imaginais onde se expressam, alguns formam a cabeça, outros os
segmentos torácicos, outros os segmentos abdominais etc. Estes genes estão alinhados no cromossomo na mesma ordem que os segmentos corporais da mosca, começando pelos que são expressos na cabeça e terminando com os que o fazem na cauda (Fig. 21.11).
Os três tipos de genes que participam da construção do plano corporal fazem-no mediante ativação sucessiva em forma de cascata,' de modo que cada gene (por meio da proteína que codifica)
produz a diferenciação que lhe compete e prepara o gene que será ativado na próxima etapa. Os
episódios se sucedem ordenadamente, não somente no tempo (vi mos a ordem com que os genes
se expressam), mas também no espaço, já que sempre ocorrem no sentido cefalocaudal. Além disso,
o produto de cada gene influencia os outros genes que atuaram precedentemente, o que imprime
nas células de cada segmento um valor posicional determinado e indelével. O conjunto desses
valores , além de afiançar a organização do plano corporal, cria as bases para o aparecimento das
diferenciações futuras.
21-23. Os genes que participam da formação do plano corporal contêm uma
seqüência de nucleotídeos conservada, chamada homeobox
Os genes que participam da formação do plano corporal pertencem à categoria dos genes reguladores, pois controlam a expressão de vários genes subordinados que se sucedem em uma ordem
hierárquica definida. Os genes reguladores codificam fatores de transcrição específicos (Cap.
14-5) cujas moléculas protéicas podem ser diferentes entre si. No entanto, quase todas têm em
comum um segmento similar de 60 aminoácidos chamado homeodomínio. Isso é porque o DNA
dos genes que codificam esses fato res tem uma seqüência de 180 pares de nucleotídeos com muito poucas variações entre um gene e outro, conhecida como homeobox (ou boxe homeótico) por
ter sido descoberta nos genes homeóticos.
Em todas as espécies estudadas - inclusive a humana - já foram encontrados genes com
homeobox (boxe homeótico) ordenados nos cromossomos de modo semelhante aos da Drosophila. O achado levou a supor que os mecanismos genéticos responsáveis pelo desenvolvimento do
plano corporal encontram-se difundidos na maior parte dos organismos multicelulares. Reforça
esta hipótese o fa~o de que nos embriões dos vertebrados se expressam vários genes com homeobox (boxe homeótico) nas células dos somitos e do tubo neural, órgãos que apresentam uma organização metamérica análoga à dos segmentos da Drosophila. Contudo, as extrapolações em tomo
A DIFERENCIAÇÃO CELULAR
•
347
deste ponto devem observar cautela porque, por um lado, para muitos tal analogia não existe e,
por outro, porque na armação do modelo que leva à formação do corpo dos vertebrados parecem
prevalecer os fe nômenos indutivos.
BIBLIOGRAFIA
Agius E., Oelgesch!ager M., Wessely O., Kemp"C. and De Robertis E.M.
(2000) Endodennal nodal-related signals and mesodem induction in
Xenopus. Development 127 : l 173.
Bard J. and Lehtonen E. (1996) Introduction: The contemporary view
of induction. Semin. Cell Dev. Biol. 7: 145.
Boncinelli E. and Mallamaci A. (1995) Homeobox genes in vertebrate
gastrulation. Curr. Opin. Genet. Dev. 5:619.
Cho K.W.Y., Blumberg B., Steinbeisser H. and De Roberti s E.M. (199 1)
Molecular nature of Spemann's organizer: lhe role of the Xenopus
development. Development 115:573.
De Robertis E.M., Oliver G. and Wright C.V .E. (1990) Homeobox genes
and the vertebrate body plan. Sei. Am. 263 (1 ):46.
De Robertis E.M. and Sasai Y. (1996) A common plan for dorsoven tral patteming in Bilateria. Nature 380:37.
Dubnau J. and Struhl G. (1996) RNA recognition and translatio nal
regulation by a homeodomain protein . 1ature 379:694.
Edelman G.M. (1992) Morphoregulation. Develop. Dynam. 193:2.
Fristrom D. (1988) The cellular basis of epithelial morphogenesis. Tissue
Cell 20:645 .
Gehring W.J. (1992) The homeobox in perspective. TIBS 17:277 .
Gurdon J.B. (1968) Transplanted nuclei and cell differentiation. Sei. Am.
219 ê6):24.
Gurdon J.B . (2000) The future of cloning. 1 ature 402:743.
Hib J. (2000) Embriología Médica, 7a Ed. McGraw-Hill• lnteramericana,
Santiago de Chile.
Hynes R.O. and Lander A. D. ( 1992) Contact and adhesive specificities
in the associations, migrations, and targeting of cells and axons. Cell
68:303.
Ingham P.W. (1988) The molecular genetics of embryo nic pattern
formation in Drosophila. Nat ure 335:25.
Kelly S.J. (1977) Studies of the developmental potential of4- and 8cell stage mouse blastomeres. J. Exp. Zool. 200:365 .
Kimble J. (1994) An ancient molecular mechani sm for establish ing
embryonic polarity? Science 266:577.
Kintner C. ( 1992) Regulation of embryonic cell adhesion by the cadherin
cytoplasm ic domain. Cell 69:225.
Larraín J., Bachiller D., Lu B., Agi us E., Piccolo S. and De Robertis
E.M. (2000) BMP-binding modules in chordin: a model for signallin
regulation in the extracellular space. Development 127:821.
Lemaire P. and Gurdon J.B. ( 1994) Vertebrate embryonic inductions.
Bioessays 16:617.
Lumsden A. (1 990) The cellular basis of segmentation in the developing hindbrain. Trends eurosci. 13:329.
Lyon M.F. (1 993) Epigenetic inheritance in mammals. Trends Genet.
9: 123.
Madem M. et ai. ( 1995) Vitamin A-defic ient quail embryos have half a
hindbrain and other neural defects. Curr. Biol. 6:417.
McGinnis W. and Krumlauf R. (1992) Homeobo x genes and axial
patteming. Cell 68:283.
McGinnis W. and Kuziora M. (1994) The molecular architects of body
des.ign. Sei . Am . 270 (2):36.
McMahon A. P. (1992) T he Wnt fam ily of developmental regulators.
Trends Genet. 8:236.
Morriss-Kay G.M. and Sokolova N. ( 1996) Embryonic development and
pattem fonnation . FASEE J. 10:96 1.
Nüsslein-Volhard C. (1996) Gradients that organize embryo development. Sei. Arn. 275 (2):38 .
Nüsslein-Volhard C. , Frohnhbfer H.G. and Lehmann R. (1987) Determination of anteroposterior polarity in Drosophila. Science 238: 1675.
Patel N.H. (1994) Developmental evolution: insights from studies of
insect segmentation. Science 266:58