![[chimie] DL N1 CORRECTION](http://s2.studylib.net/store/data/025801000_1-ccbf732f8670f4f8666f01ed96c097e5-768x994.png)
. ◦ devoir libre N 01 Chimie corrigé Extraction par solvant 1. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Le solvant initial : l’eau Le solvant extracteur : le tétrachlorométhane 2. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Le solvant extracteur non polaire (car I2 est non polaire) et non protique (car ne peut donner pas le proton H+ ). 3. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . La concentration en diode de la solution dosée : n(S2 O32− ) C3 V3 à l’équivalence n(I2 ) = alors [I2 ]V01 = 2 2 A.N. V3 = 4,4mL ; C3 = 1,0.10 −3 mol·L−1 ; V01 = 20,0mL donc [I2 ] = 1,1.10 −4mol·L−1 4. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . La quantité de diiode passée de l’eau dans le tétrachlorométhane : n = n0 − nrest = C1 V1 − [I2 ]V1 A.N. n = 8,9.10 −5mol 5. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Le coefficient de partage : [I2 ]tcm C1 V1 − n n K= on a [I2 ]tcm = et [I2 ]eau = [I2 ]eau V2 V1 V1 n d’où K = V2 C1 V1 − n A.N. K = 8,1.10 1 6. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Le rendement de l’extraction, noté ρ, est le rapport de la quantité extraite sur la quantité initiale. n on a ρ − n0 A.N. ρ = 8,9.10−1 = 89% 7. Influence du volume de solvant : 7.1. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . La quantité n0 de di-iode passée dans le tétrachlorométhane : V1 KC1 n0 0 on a K = alors n = K 1 V2 C1 V1 − n0 + V1 V2 1 A.N. K = 8,1.10 ; C1 = 1,0.10−3mol·L−1 ; V1 = 100,0mL et V2 = 20,0mL alors n0 = 9,4.10 −5mol 7.2. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . n0 Le rendement de l’extraction ρ = = 9,4.10−1 = 94% n0 On en déduit que le rendement de l’extraction augmente lorsque le volume du solvant extracteur augmente. 8. Influence de la méthode d’extraction : 8.1. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . La quantité n de di-iode passée dans le solvant extracteur pendant la première extraction : KC1 V1 on a n = V1 K+ V2 A.N. n = 8,9.10 −5mol TnV - T§rySt As± -s ©¯w T§wA chimie des solutions 1 sur 3 8.2. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . La quantité n0 de di-iode passée dans le solvant extracteur pendant la deuxième extraction : K(C1 V1 − n) on a n0 = V1 K+ 0 V2 0 A.N. V2 = 10,0mL , n0 = 9,8.10 −6mol 8.3. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . La quantitétotale de di-iode extraite au cours de ces deux opérations : ntot = n + n0 = 9,9.10 −5mol Le rendement de la double extraction : ntot − ρ = 9,9.10 −1 = 99% n0 8.4. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . de tout ce qui précède on trouve que ρdouble > ρsimple La méthode double extraction est plus efficace que la méthode simple extraction. Dilution et dosage d’une solution d’acide faible 1. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . La liaison O−H dans la molécule du chloroacétique est poliare, alors elle est dissociable dans un solvant polaire (eau par exemple). donc le chloroacétique peut libérer un proton H+ dans l’eau d’où est un acide. La base conjuguée du chloroacétique : ClCH2 COO− 2. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . La réaction de dissociation de l’acide chloroacétique dans l’eau : ClCH2 COOH + H2 O = ClCH2 COO− + H3 O+ 3. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . La concentration nC de la solution (S) en acide chloroacétique : On sait que C = alors C = 0,1mol·L−1 V 4. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Le coefficient de dissociation de l’acide chloroacétique dans l’eau : ndis Par définition α− n0 puisque le pH = 1,93 < 6,5 alors l’auto-protolyse de l’eau est négligeable, alors n(H3 O+ ) = nauto (H3 O+ )+ ndis,acide (H3 O+ ) ' ndis,acide (H3 O+ ) n(H3 O+ ) [H3 O+ ] 10−pH donc α− = d’où α− n C C A.N. α−0,12 0 5. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Le pKA du couple acide chloroacétique/ion chloroacétate : [ClCH2COO− ]eq [H3 O+ ]eq αC10−pH α10−pH on sait que KA = alors KA = = [ClCH2COOH]eq C(1 − α) (1 − α) A.N. KA = 1,6.10 −3 ou pKA ' 2 , 81 6. Dosage pH-métrique de la solution (S). 6.1. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Le volume de la solution d’hydroxyde de sodium versé à l’équivalence : On écrit d’abord le réaction de dosage : HA + HO− = A− + H2 O Ca alors, à l’équivalence on a Ca V a = C b Vb,eq ou Vb,eq = Va Cb A.N. Vb,eq = 20mL 6.2. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Le pH de la solution : à demi-équivalence : pH = pKA = 2,81 Ca Va 1 à l’équivalence : pH = 14 + pKA + log = 7,75 2 Va + Vb,eq 2 sur 3 chimie des solutions TnV - T§rySt As± -s ©¯w T§wA 6.3. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Le tracé de l’allure de la courbe : 12 pH 10 8 6 4 2 0 10 20 30 40 50 V 7. Dilution de la solution (S). 7.1. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Les verreries utilisées pour réaliser cette dilution sont : la pipette et la fiole jaugée. 7.2. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . La concentration de la solution (S0 ) : on a la relation de la dilution : CV = C0 V0 V alors C0 = C 0 V A.N. C0 = 0,01mol·L−1 7.3. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . L’influence de la dilution de la solution (S) sur le degré de dissociation de l’acide chloroacétique dans l’eau : 10−pH Le nouveau coefficient de dissociation α0 = ≈ 0 , 30 C0 0 on constate que α > α, la dilution augmente le degré de dissociation d’un acide faible. 7.4. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lorsqu’on souhaite comparer la dissociation de deux acides faibles dans l’eau en tenant compte uniquement de la valeur de la constante pKA on doit prendre aussi en considération la concentration des acides (étant dépendantes de la dilution). c-à-d si pKA > pKA0 alors α > α0 (seulement si C = C0 ). 7.5. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ceci est logique, car lorsqu’on dilue une solution son pH tend celui de l’eau pure (−7). puisque à l’équivalence le pH de la solution S est 7,75 > 7 alors après la dilution le pH de la solution S0 est in inférieur à 7,75 mais reste supérieur à 7 (valeur de pH d’une solution lorsqu’elle est infiniment diluée). TnV - T§rySt As± -s ©¯w T§wA chimie des solutions 3 sur 3
![[chimie] DL N1 CORRECTION](http://s2.studylib.net/store/data/025801001_1-aa83b4990dbefb470f924e994abc2cf1-300x300.png)


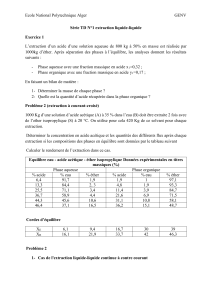
![[chimie] TD N3](http://s2.studylib.net/store/data/025801002_1-9c53c12ce863d898a58e9b0df45ffc2c-300x300.png)
