ดร.นพ.จรุง เมืองชนะ
advertisement

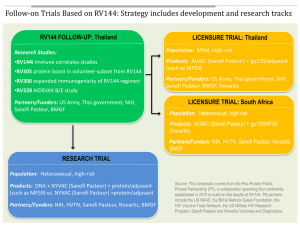
What’s new in DHF? ความก้ าวหน้ าการวิจัยพัฒนาวัคซีนไข้ เลือดออก จรุง เมืองชนะ พ.บ., PhD สถาบันวัคซีนแห่ งชาติ (องค์การมหาชน) ประชุมวิชาการป้ องกันควบคุมโรคแห่ งชาติ ประจาปี 2557 ณ โรงแรมอิมพีเรียล ควีนสปาร์ ค กรุงเทพมหานคร 13-15 มีนาคม 2557 หัวข้ อบรรยาย ความสาคัญ และขั้นตอนการวิจยั พัฒนาวัคซีน (โดยย่อ) ความก้ าวหน้ า ของการวิจยั พัฒนาวัคซีนไข้ เลือดออกเดงกี่ การนาวัคซีนใหม่ มาบรรจุในโครงการสร้ างเสริมภูมิคุ้มกันโรคของ ประเทศไทย หัวข้ อบรรยาย ความสาคัญ และขั้นตอนการวิจยั พัฒนาวัคซีน (โดยย่อ) ความก้ าวหน้ า ของการวิจยั พัฒนาวัคซีนไข้ เลือดออกเดงกี่ การนาวัคซีนใหม่ มาบรรจุในโครงการสร้ างเสริมภูมิคุ้มกันโรคของ ประเทศไทย รายงานการประชุมคณะทางานด้ านวิทยาศาสตร์ โรคไข้ เลือดออก ณ กรุงเจนีวา, 2549 ความสาคัญของวัคซีน ในทศวรรษที่ผา่ นมา, “วัคซีน” เป็ นนวัตกรรมทางสุ ขภาพหนึ่งที่มี ประสิ ทธิภาพสูง แต่อย่างไรก็ตาม, ในปัจจุบนั ประเทศ กาลังพัฒนา มีปัญหาอย่างมากในการ เข้าถึง และการมีวคั ซีนจาเป็ นใช้ ส่ วนแบ่ งตลาดวัคซีนทัว่ โลก ในปัจจุบัน – Sanofi Pasteur, GlaxoSmithKline – Merck, Pfizer, Novatis อุปสรรคและความท้ าทาย การสนองความต้ องการใช้ วคั ซีนในประเทศกาลังพัฒนา วัคซีนที่ใช้ในประเทศกาลังพัฒนา เป็ นวัคซีนที่ “ทากาไรน้ อย” – การใช้วคั ซีนในประเทศกาลังพัฒนามีปริ มาณมากถึง ร้อยละ 88 แต่มี มูลค่าคิดเป็ นตัวเงินเพียง ร้อยละ 18 เท่านั้น –ในปี 1990s, บริ ษทั ผูผ้ ลิตวัคซีนหลายบริ ษทั ได้หยุดการผลิต วัคซีนกาไรน้อยเหล่านี้ –ทาให้การจัดซื้อจัดหาวัคซีนของประเทศกาลังพัฒนามีความ ยุง่ ยากซับซ้อน และต้องประสบกับปัญหาการขาดแคลนวัคซีน หลายชนิด การพัฒนาและการผลิตวัคซีน เป็ นกระบวนการที่มีความซับซ้ อน ต้องทุ่มเท/เข้มงวด และมีตน้ ทุนสูง ต้องลงทุนด้านการพัฒนาศักยภาพสูงมาก กว่ าจะขึน้ ทะเบียนวัคซีนแต่ ละชนิดได้ From concept to licensure, itนานานหลายปี takes many years to ต้ อ งใช้ เ วลาวิ จ ย ั พั ฒ develop a vaccine VAC/ADJ/0010/13 Date of preparation: July 2013 Pre-clinical • 5–15 years Vaccine development Slide 9 Clinical • 5–15 years Post-licensure • Several decades • Equals the entire life-cycle of the vaccine After licensure: • Safety surveillance continues indefinitely • Additional clinical and epidemiological studies may be carried out for new indications or needs Leroux-Roels et al. Chapter 5 in: Garçon et al. Understanding Modern Vaccines, Perspectives in Vaccinology, Vol 1, Amsterdam, Elsevier, 2011, pp. 115–50 Clinical studies VAC/ADJ/0010/13 Date of preparation: July 2013 Vaccine development Slide 10 Early Phase Phase I n=20–80s Phase II n=>100s Phase III n=1000s–10,000s Phase IIIb/IV ความปลอดภัย ความปลอดภัย ความปลอดภัย ความปลอดภัย การกระตุ้นภูมิคุ้มกัน การกระตุ้นภูมิคุ้มกัน การกระตุ้นภูมิคุ้มกัน Proof of concept ประสิ ทธิผลทางคลินิก • AE ประสิ ทธิผลในภาคสนาม New indications Dose ranging Safety evaluation: • Systemic • Local Licensure n=millions • SAE Pharmacovigilance AE, adverse event; SAE, severe adverse event Leroux-Roels et al. Chapter 5 in: Garçon et al. Understanding Modern Vaccines, Perspectives in Vaccinology, Vol 1, Amsterdam, Elsevier, 2011, pp. 115–150; Douglas, Samant et al. Chapter 3 in: Plotkin et al. Vaccines, 5th edition, Philadelphia, Saunders, 2008, pp. 37–8; Baylor, Midthun et al. Chapter 73 in: Plotkin et al. Vaccines, 5th edition, Philadelphia, Saunders, 2008, pp. 1615–17 VAC/ADJ/0006/13 Date of preparation: July 2013 History of vaccine development Slide 11 29 โรค มีวคั ซีนป้ องกัน 29 diseases are currently preventable by vaccination Global public health Cervical cancer1 Diphtheria1 Haemophilus influenzae type b1 Hepatitis A1 Hepatitis B1 Herpes zoster1 Human papillomavirus1 Influenza1 Measles1 Meningococcal1 Mumps1 H1N1 flu1 Pertussis1 Poliomyelitis1 Pneumococcal1 Rotavirus1 Rubella1 Smallpox and vaccinia1 Tetanus1 Tuberculosis1 Varicella1 Regional focus Anthrax1 Cholera2 Japanese encephalitis1 Monkeypox1 Tick-borne encephalitis3 Typhoid fever1 Rabies1 Yellow fever1 1. Centers for Disease Control and Prevention (CDC). Vaccines and preventable diseases. Available at: www.cdc.gov/vaccines/vpdvac/default.htm (accessed August 2013); 2. Roush et al. MMWR 1999;48:243–8; 3.CDC. Special pathogens branch. Available at: www.cdc.gov/ncidod/dvrd/spb/mnpages/dispages/TBE.htm (accessed August 2013) VAC/ADJ/0006/13 Date of preparation: July 2013 History of vaccine development Slide 12 การมีวคั ซีนป้ องกันโรคต่ าง ๆ, พ.ศ. 2293-2553 Many important vaccine technologies have been developed since the late 18th century Prostate cancer Zoster HPV Meningitis C conjugate Rotavirus** Rotavirus [Discontinued] Influenza* Pneumococcus conjugate Meningococcus ACWY conjugate Typhoid Meningitis C conjugate Varicella Typhoid Hepatitis A Hib conjugate Hepatitis B [Hepatitis B] Pertussis Hib polysaccharide Meningococcus (ACWY) Influenza Rubella Mumps Measles Polio (OPV) Dendritic cells Polio (IPV) Reassortant Pneumococcus Influenza DNA recombinant Yellow fever Diphtheria Polysaccharide conjugated Tuberculosis Tetanus Plasma derived Pertussis Split, subunit Variolation + vaccination (smallpox) Live-attenuated Inactivated Toxoid Polysaccharide Split, subunit Plasma derived DNA recombinant Polysaccharide conjugated Reassortant, live-attenuated Dendritic cells Smallpox Inactivated Plague Cholera Typhoid Rabies Polysaccharide Toxoid Live-attenuated Smallpox vaccination Variolation Smallpox eradicated 1750 1800 1850 1900 1910 1920 1930 1940 1950 1960 1970 1980 1990 2000 2010 *Reassortant; **Live-attenuated reassortant (human/animal species); Pandemic influenza vaccines were developed in 2009 using all techniques previously developed for seasonal influenza Bonanni et al. Chapter 1 in: Garçon et al. Understanding Modern Vaccines, Perspectives in Vaccinology, Vol 1, Amsterdam, Elsevier, 2011, pp. 1–24 หัวข้ อบรรยาย ความสาคัญ และขั้นตอนการวิจยั พัฒนาวัคซีน (โดยย่อ) ความก้ าวหน้ า ของการวิจยั พัฒนาวัคซีนไข้ เลือดออกเดงกี่ การนาวัคซีนใหม่ มาบรรจุในโครงการสร้ างเสริมภูมิคุ้มกันโรคของ ประเทศไทย ความก้าวหน้ าของการวิจัยพัฒนาวัคซีนไข้ เลือดออก VAC/ADJ/0006/13 Date of preparation: July 2013 History of vaccine development Slide 15 การมีวคั ซีนป้ องกันโรคต่ าง ๆ, พ.ศ. 2293-2553 Many important vaccine technologies have been developed since the late 18th century Variolation + vaccination (smallpox) Live-attenuated Inactivated Toxoid Polysaccharide Split, subunit Plasma derived DNA recombinant Polysaccharide conjugated Reassortant, live-attenuated Dendritic cells Smallpox Inactivated Plague Cholera Typhoid Rabies Prostate cancer Zoster HPV Meningitis C conjugate Rotavirus** Rotavirus [Discontinued] Influenza* Pneumococcus conjugate Meningococcus ACWY conjugate Typhoid Meningitis C conjugate Varicella st Typhoid Hepatitis A Hib conjugate Hepatitis B [Hepatitis B] Pertussis Hib polysaccharide Meningococcus (ACWY) Influenza Rubella Mumps Measles Polio (OPV) Dendritic cells Polio (IPV) Reassortant Pneumococcus Influenza DNA recombinant Yellow fever Diphtheria Polysaccharide conjugated Tuberculosis Tetanus Plasma derived Pertussis Split, subunit 2010 : 1 phase III 1944-45 LAV DEN1 Polysaccharide Toxoid Live-attenuated Smallpox vaccination Variolation Smallpox eradicated 1750 1800 1850 1900 1910 1920 1930 1940 1950 1960 1970 1980 1990 2000 2010 *Reassortant; **Live-attenuated reassortant (human/animal species); Pandemic influenza vaccines were developed in 2009 using all techniques previously developed for seasonal influenza Bonanni et al. Chapter 1 in: Garçon et al. Understanding Modern Vaccines, Perspectives in Vaccinology, Vol 1, Amsterdam, Elsevier, 2011, pp. 1–24 ความท้ าทายของการวิจัยพัฒนาวัคซีนไข้ เลือดออก ไม่มี animal model ที่ดี ไวรัสเดงกี่ มีความแตกต่างกันทั้ง 4 ซีโรทัยป์ (D1, 2, 3, 4) ระบาดวิทยาของโรคแตกต่างกันตามระยะเวลาและพื้นที่ เช่น ความชุกของ โรค อายุของผูป้ ่ วย ซีโรทัยป์ ของเชื้อเดงกี่ ในทางทฤษฎี, การมีภูมิคุม้ กันจาเพาะเพียงบางซีโรทัยป์ อาจทาให้การป่ วย ครั้งหลังรุ นแรงขึ้น วัคซีนจึงต้องครอบคลุมทั้ง 4 ซีโรทัยป์ และต้องเฝ้ า ระวังความปลอดภัยในระยะยาว ยังไม่สามารถระบุแอนติเจน ที่กระตุน้ ภูมิคุม้ กันชนิดที่ป้องกันโรคได้ ต้อง ทดสอบประสิ ทธิผลทางคลินิก ความก้าวหน้ าของการวิ จ ย ั พั ฒ นาวั ค ซี น ไข้ เ ลื อ ดออก วัคซีนไข้ เลือดออก ระยะคลินิก (การทดสอบในคน) • เชื้อเป็ นอ่อนฤทธิ์ ใช้เทคนิคการตัดต่อยีนส์ เช่น chimerization หรื อ sequence deletion • เชื้อตาย • Subunit ใช้บางส่ วนของเปลือกหุม้ ไวรัสเดงกี่ ระยะพรีคลินิก (การทดสอบทางห้ องปฏิบัตกิ าร/สั ตว์ ทดลอง) • plasmid DNA and vectored approaches วัคซีนไข้ เลือดออก ทีอ่ ยู่ในช่ วงของการวิจยั พัฒนาในปัจจุบัน ผู้พฒ ั นา Pre-clinic Phase I Phase II Phase III วัคซีนไข้ เลือดออก ทีอ่ ยู่ในช่ วงของการวิจยั พัฒนาในปัจจุบัน ผู้พฒ ั นา Pre-clinic Phase I Phase II Phase III แผนการวิจัยทางคลินิกวัคซีนไข้ เลือดออก ระยะที่ 1-3 ของบริษัท Sanofi Pasteur แผนการวิจัยทางคลินิกวัคซีนไข้ เลือดออก ระยะที่ 1-3 ของบริษัท Sanofi Pasteur แผนการวิจัยทางคลินิกวัคซีนไข้ เลือดออก ระยะที่ 2B ของบริษัท Sanofi Pasteur แผนการวิจัยทางคลินิกวัคซีนไข้ เลือดออก ระยะที่ 2B ของบริษัท Sanofi Pasteur แผนการวิจัยทางคลินิกวัคซีนไข้ เลือดออก ระยะที่ 2B ของบริษัท Sanofi Pasteur ซีโรทัยป์ เชื้อไข้ เลือดออก พ.ศ. 2513(a) & 2547(b) แผนการวิจัยทางคลินิกวัคซีนไข้ เลือดออก ของบริษัท Sanofi Pasteur แผนการวิจัยทางคลินิกวัคซีนไข้ เลือดออก ระยะที่ 3 ของบริษัท Sanofi Pasteur แผนการวิจัยทางคลินิกวัคซีนไข้ เลือดออก ระยะที่ 1-3 ของบริษัท Sanofi Pasteur 2557 2558 2559 2560 2561 เชือ ้ เป็ น NSTDA1 x NSTDA2 Mahidol2 DNA + adj Safety test Phase I Test combination • x/VLP+adj • x/DNA GMP • DNA/x production • VLP+adj/x • etc Prime boost : DNA NSTDA1/ Prime boost : VLP VLP GMP production Safety test phaseI ความก้าวหน้ าและแผนการวิจัยพัฒนา วัคซีนไข้ เลือดออกในประเทศไทย NSTDA2/ VLP+adj หัวข้ อบรรยาย ความสาคัญ และขั้นตอนการวิจยั พัฒนาวัคซีน (โดยย่อ) ความก้ าวหน้ า ของการวิจยั พัฒนาวัคซีนไข้ เลือดออกเดงกี่ การนาวัคซีนใหม่ มาบรรจุในโครงการสร้ างเสริมภูมิคุ้มกันโรคของ ประเทศไทย ขั้นตอนการตัดสิ นใจ การนาวัคซีนมาบรรจุในโครงการสร้ างเสริม ภูมคิ ุ้มกันโรค ของประเทศไทย Cases/ deaths/ disability Social & economy impacts 1 The disease is a major burden 2 Vaccination is a priority intervention Safe & efficacious vaccine Vaccine effectiveness Other interventions less promising 3 Vaccination is a good investment Health economic evaluation Financing feasibility, affordability 4 Vaccination is programmatically feasible 5 Programmatic feasibility is proven in a pilot Operation and logistic feasibility under existing health infrastructure Public acceptance & political will Pilot program conducted with the feasibility for sustenance if pilot outcome is promising Source: Modified from Supamit S 18 June 2010 ขั้นตอนการปฏิบัตแิ ละระยะเวลา การนาวัคซีนมาบรรจุในโครงการ สร้ างเสริมภูมคิ ุ้มกันโรค ของประเทศไทย Vaccine registration Vaccination stepwise expanding Nationwide program Vaccine use in private Cabinet consider for budget allocation Catch-up program? ACIP consideration for introduction into the national program Propose & consideration for budget support for national program, by NHSO Pilot project by DDC Pilot result consideration for expanding by ACIP ขั้นตอนการปฏิบัตแิ ละระยะเวลา การนาวัคซีนมาบรรจุในโครงการ สร้ างเสริมภูมคิ ุ้มกันโรค ของประเทศไทย Vaccine registration Vaccination stepwise expanding Nationwide program Vaccine use in private Cabinet consider for budget allocation Catch-up program? ACIP consideration for introduction into the national program Propose & consideration for budget support for national program, by NHSO Pilot project by DDC Pilot result consideration for expanding by ACIP Time duration 6.5 – 8.0 years 9.5 – 13.0 years 14.5 – 18.0 years ตัวอย่ าง ความล่ าช้ าในการนาวัคซีนมาบรรจุ โครงการสร้ างเสริมภูมิคุ้มกันโรค ในประเทศกาลังพัฒนา การคาดประมาณจานวนผู้ป่วยตายจากโรคไข้ เลือดออก ซึ่งอาจสามารถป้ องกันได้ ด้วยวัคซีน, ในประเทศไทย 800 Number of deaths 700 600 500 400 300 200 100 0 70.5 1 141 2 211.5 3 282 4 352.5 423 5 6 Year Data source : BOV, Thailand 493.5 7 564 8 634.5 9 705 10 สรุป: ความก้าวหน้าการวิจัยพัฒนาวัคซีนไข้เลือดออก เริ่ มมีการวิจยั พัฒนามานาน เกือบ 70 ปี การวิจยั พัฒนาก้าวหน้าไปมาก อาจมีวคั ซีนใช้ใน 2-3 ปี เพื่อลดการเสียโอกาสในการป้ องกัน การป่ วย/การตาย ควร ติดตามความก้าวหน้าของผลการวิจยั อย่างใกล้ชิด (ปลายปี นี้) ร่ วมกับการเตรี ยมความพร้อมในการนาวัคซี นมาใช้ คู่ขนาน กันไป ควรมีการส่งเสริ มการวิจยั พัฒนาวัคซีนภายในประเทศต่อไป การวิจัยพัฒนาและการผลิตวัคซีน ในกลุ่มประเทศกาลังเติบโตทางเศรษฐกิจ ส่ วนมากใน อเมริ กากลาง และเอเชีย มักใช้เทคโนโลยีพ้นื ฐาน ไม่เน้นการวิจยั พัฒนา มูลค่าการลงทุนต่า ส่ วนมากผลิตวัคซี นพื้นฐานป้ อนโครงการสร้างเสริ มภูมิคุม้ กันโรค ของประเทศ มานานหลายปี