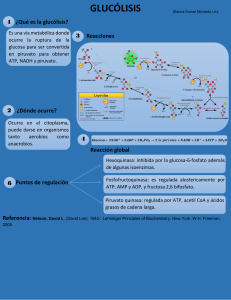
La glucosa • • es el glúcido simple más abundante en la naturaleza, constituye la molécula que aporta la mayor cantidad de energía en los seres humanos. La glucemia es la concentración de glucosa en sangre. Existen desbalances del metabolismo glucídico que presentan • • valores altos (hiperglucemia) de los niveles sanguíneos de este monosacárido. valores bajos (hipoglucemia) de los niveles sanguíneos de este monosacárido. El mantenimiento de la glucemia resulta esencial para el organismo humano. Son diversos los mecanismos que participan en la regulación de la glucemia y a este propósito contribuyen varios procesos metabólicos, algunos aportando glucosa a la sangre y otros sustrayéndola, en respuesta a eficientes mecanismos de regulación. Los procesos que aportan glucosa a la sangre son • • • absorción intestinal, glucogenólisis y gluconeogénesis. La gluconeogénesis, proceso fundamentalmente hepático mediante el cual se sintetiza glucosa a partir de compuestos no glucídicos, será tratado en este capítulo junto a la glucólisis, proceso de degradación de la glucosa y que, por tanto, sustrae glucosa de la sangre. Otros procesos que sustraen glucosa de la sangre son • • la glucogénesis el ciclo de las pentosas Glucólisis Concepto: La glucólisis es el proceso mediante el cual se degrada la glucosa. La función: La importancia fundamental de la glucólisis es el rendimiento energético y el aporte de precursores para otros procesos metabólicos, lo que depende del tejido donde ocurre y de las condiciones del organismo. La glucólisis presenta dos etapas: 1. la primera se extiende desde la glucosa hasta la formación de dos triosas fosfatadas (3 fosfogliceraldehído y fosfodihidroxiacetona) se consume energía en forma de 2 ATP 2. la segunda etapa desde 3 fosfogliceraldehído hasta ácido pirúvico. en la segunda se libera energía, también en forma de ATP, y su cuantía depende de las condiciones, aerobias o anaerobias, en la que proceda la glucólisis Primera etapa de la glucólisis La glucosa se convierte en glucosa-6-fosfato por acción de la hexoquinasa (el tipo de esta enzima dependerá del tejido). En esta reacción se consume un ATP, es fuertemente exergónica e iirreversible: La glucosa-6-fosfato se convierte en fructosa-6-fosfato por acción de la enzima fosfoglucoisomerasa, esta reacción es reversible: Seguidamente la fructosa-6-fosfato es fosforilada de nuevo y se convierte en fructosa 1,6 bisfosfato. En esta reacción se consume el segundo ATP y la reacción es catalizada por la enzima fosfofructoquinasa 1, que es la principal enzima reguladora del proceso como se verá más adelante. Reacción también irreversible y exergónica: La enzima fructosa bisfosfato aldolasa escinde la fructosa 2,6 bisfosfato y origina las dos triosas fosfatadas. Así culmina la primera etapa de la glucólisis: Ambas triosas pueden interconvertirse por acción de la enzima fosfotriosa isomerasa. Si la glucólisis está activada se favorece el paso a 3 fosfogliceraldehído, en tanto que si la glucólisis se encuentra deprimida se favorece el paso a fosfodihidroxiacetona, la cual puede formar un precursor de la síntesis de los triacilgliceroles (el glicerol-3-fosfato): Resumen de la primera etapa de la glucólisis La glucólisis es el proceso metabólico en el cual una molécula de glucosa se descompone en dos moléculas de piruvato, generando energía en forma de ATP. Este proceso se lleva a cabo en el citoplasma de la célula y consta de diez pasos, divididos en dos fases: la fase de inversión de energía y la fase de generación de energía. La primera etapa de la glucólisis corresponde a la fase de inversión de energía. Primera Etapa de la Glucólisis: Fase de Inversión de Energía En esta etapa, se consumen dos moléculas de ATP para preparar la glucosa para su división en dos moléculas de tres carbonos. A continuación se resumen los cinco pasos de esta fase: 1. Fosforilación de la Glucosa: o Enzima: Hexoquinasa o Reacción: Glucosa + ATP → Glucosa-6-fosfato + ADP o Descripción: La glucosa se fosforila utilizando una molécula de ATP, formando glucosa-6-fosfato. Este paso es importante para mantener la glucosa dentro de la célula y para su posterior metabolización. 2. Isomerización de la Glucosa-6-fosfato: o Enzima: Fosfoglucosa isomerasa o Reacción: Glucosa-6-fosfato → Fructosa-6-fosfato o Descripción: La glucosa-6-fosfato se convierte en su isómero, fructosa-6-fosfato. 3. Fosforilación de la Fructosa-6-fosfato: o Enzima: Fosfofructoquinasa-1 (PFK-1) o Reacción: Fructosa-6-fosfato + ATP → Fructosa-1,6-bisfosfato + ADP o Descripción: La fructosa-6-fosfato se fosforila utilizando otra molécula de ATP, formando fructosa-1,6-bisfosfato. Este es un paso clave y regulador de la glucólisis. 4. División de la Fructosa-1,6-bisfosfato: o Enzima: Aldolasa o Reacción: Fructosa-1,6-bisfosfato → Dihidroxiacetona fosfato (DHAP) + Gliceraldehído-3-fosfato (GAP) o Descripción: La fructosa-1,6-bisfosfato se divide en dos triosas fosfato diferentes: dihidroxiacetona fosfato (DHAP) y gliceraldehído-3-fosfato (GAP). 5. Isomerización de la Dihidroxiacetona Fosfato: o Enzima: Triosa fosfato isomerasa o Reacción: DHAP → GAP o Descripción: La dihidroxiacetona fosfato se convierte en gliceraldehído-3fosfato, lo que resulta en dos moléculas de gliceraldehído-3-fosfato al final de esta fase. Resumen En la primera etapa de la glucólisis, se invierten dos moléculas de ATP para convertir una molécula de glucosa en dos moléculas de gliceraldehído-3-fosfato. Este proceso prepara las moléculas para la siguiente fase, donde se generará ATP y NADH. Segunda etapa de la glucólisis La segunda etapa procede a partir del 3 fosfogliceraldehído.( primera etapa) La primera reacción de esta etapa es de oxidación y es catalizada por la 3 fosfogliceraldehído deshidrogenasa: El ácido 1,3 bisfosfoglicérico formado en la reacción presenta un enlace anhídrido de ácido, de alto contenido energético, que al hidrolizarse libera suficiente energía, la cual se utiliza para la formación de un ATP en la reacción siguiente. En esta reacción de la 3 fosfogliceraldehído deshidrogenasa, se forma NADH.H+, el cual debe ser reoxidado en alguna reacción ulterior de modo que no se acumule este cofactor reducido y se garantice su disponibilidad en forma oxidada, como se requiere para el funcionamiento de la vía glucolítica.( no entender) Si la glucólisis ocurre en condiciones aeróbicas la reoxidación del NADH en la cadena transportadora de electrones permitirá la formación de ATP. Sin embargo, en condiciones anaeróbicas la reoxidación del NADH no libera energía, como se podrá comprobar más adelante en este capítulo. La enzima fosfogliceroquinasa actúa sobre el ácido 1,3 bisfosfoglicérico formando ácido 3 fosfoglicérico + ATP por fosforilación a nivel de sustrato: La enzima es La enzima fosfogliceroquinasa Reaccionante: el ácido 1,3 bisfosfoglicérico Productos: ácido 3 fosfoglicérico + ATP El ácido 3 fosfoglicérico se convierte en ácido 2 fosfoglicérico por la acción catalítica de la fosfogliceromutasa: La enzima es la fosfogliceromutasa: Reaccionante: El ácido 3 fosfoglicérico Productos: en ácido 2 fosfoglicérico Seguidamente, a partir del ácido 2 fosfoglicérico se forma el ácido fosfoenolpirúvico (PEP) por la extracción de una molécula de H2O y formación de un enlace de alto contenido energético. La reacción es catalizada por la enolasa: La enzima es la enolasa , mas, la extracción de una molécula de H2O y formación de un enlace de alto contenido energético Reaccionante: ácido 2 fosfoglicérico Productos: el ácido fosfoenolpirúvico (PEP) La pirúvico quinasa es la enzima que, a partir del fosfoenolpirúvico + ADP, forma el ácido pirúvico + ATP, esta reacción es la segunda reacción de fosforilación a nivel de sustrato de la glucólisis y con ella culmina la segunda etapa de la glucólisis. En el esquema 7.1 se resumen las reacciones de la vía glucolítica: La enzima es La pirúvico quinasa Reaccionante: fosfoenolpirúvico + ADP Productos: el ácido pirúvico + ATP La glucólisis es un proceso metabólico que convierte la glucosa en piruvato, generando energía en forma de ATP y NADH. La glucólisis se divide en dos etapas: la etapa de inversión de energía (primera etapa) y la etapa de generación de energía (segunda etapa). Segunda Etapa de la Glucólisis: Generación de Energía La segunda etapa de la glucólisis implica la conversión de los intermediarios de tres carbonos producidos en la primera etapa en piruvato, con la generación neta de ATP y NADH. Esta etapa incluye los siguientes pasos: 1. Conversión de Gliceraldehído-3-fosfato en 1,3-bisfosfoglicerato: o Enzima: Gliceraldehído-3-fosfato deshidrogenasa. o Reacción: El gliceraldehído-3-fosfato se oxida y se fosforila a 1,3bisfosfoglicerato. o Productos: 1,3-bisfosfoglicerato y NADH (por cada gliceraldehído-3-fosfato). 2. Conversión de 1,3-bisfosfoglicerato en 3-fosfoglicerato: o Enzima: Fosfoglicerato quinasa. o Reacción: Se transfiere un grupo fosfato de alta energía de 1,3-bisfosfoglicerato al ADP, formando ATP y 3-fosfoglicerato. o Productos: 3-fosfoglicerato y ATP (por cada 1,3-bisfosfoglicerato). 3. Conversión de 3-fosfoglicerato en 2-fosfoglicerato: o Enzima: Fosfoglicerato mutasa. o Reacción: El 3-fosfoglicerato se convierte en 2-fosfoglicerato mediante un cambio de posición del grupo fosfato. o Producto: 2-fosfoglicerato. 4. Conversión de 2-fosfoglicerato en fosfoenolpiruvato (PEP): o Enzima: Enolasa. o Reacción: El 2-fosfoglicerato se deshidrata (se elimina una molécula de agua) para formar fosfoenolpiruvato (PEP). o Producto: Fosfoenolpiruvato (PEP). 5. Conversión de PEP en piruvato: o Enzima: Piruvato quinasa. o Reacción: El PEP transfiere su grupo fosfato al ADP, formando ATP y piruvato. o Productos: Piruvato y ATP (por cada PEP). Resumen de la Producción de Energía Por cada molécula de glucosa que entra en la glucólisis, la segunda etapa produce: • • • 2 NADH (uno por cada gliceraldehído-3-fosfato). 4 ATP (dos por cada gliceraldehído-3-fosfato), pero teniendo en cuenta los 2 ATP consumidos en la primera etapa, la ganancia neta es de 2 ATP por molécula de glucosa. 2 Piruvatos (uno por cada gliceraldehído-3-fosfato). En resumen, la segunda etapa de la glucólisis convierte intermediarios de tres carbonos en piruvato, produciendo ATP y NADH, y es crucial para la producción neta de energía en la célula. El ácido pirúvico formado sigue diferentes destinos metabólicos en dependencia de la condición aeróbica o anaeróbica en que proceda la glucólisis. 1. Destino del ácido pirúvico • en condiciones anaerobias. • el ácido pirúvico es convertido en acetil-CoA por acción del complejo multienzimático pirúvico deshidrogenasa que está localizado en la mitocondria, • Se puede constatar(confirm) que en esta reacción se produce la reoxidación del NADH, equivalente al formado en la reacción de la 3 fosfogliceraldehído deshidrogenasa y que su reoxidación garantiza el funcionamiento de la glucólisis en estas condiciones. • Como puede apreciarse, la reoxidación del NADH en esta reacción no conlleva la formación de ATP 2. el ácido pirúvico se convierte en ácido láctico por la acción de la enzima deshidrogenasa láctica. • En condiciones anaeróbicas. Destino del ácido pirúvico en condiciones aeróbicas. En condiciones aeróbicas, el ácido pirúvico es convertido en acetil-CoA por acción del complejo multienzimático pirúvico deshidrogenasa. Enzimas: complejo multienzimático pirúvico deshidrogenasa que Está formado 3 enzimas que intervienen en la transformación del sustrato y dos reguladoras (una quinasa y una fosfatasa) y está localizado en la mitocondria. la acción de la enzima participan 5 cofactores; PPT, ácido lipoico, coenzima A, FAD y NAD+. La reacción global es la siguiente: Ácido pirúvico + NAD+ + CoASH acetil-CoA + NADH.H+ + CO2 En esta reacción el NADH formado se incorpora a la cadena transportadora de electrones, lo que posibilita la formación de ATP Destinos del ácido pirúvico El ácido pirúvico, o piruvato, es un metabolito clave en la glucólisis y tiene varios destinos metabólicos dependiendo de las condiciones celulares, como la disponibilidad de oxígeno y el tipo de célula. A continuación se describen los principales destinos del piruvato: 1. Ciclo de Krebs (Ciclo del Ácido Cítrico) • • Condiciones: Aeróbicas (presencia de oxígeno). Descripción: En presencia de oxígeno, el piruvato se transporta a la matriz mitocondrial, donde es convertido en acetil-CoA por la enzima piruvato deshidrogenasa. El acetil-CoA luego ingresa al ciclo de Krebs, produciendo NADH, FADH2 y GTP (o ATP), los cuales son utilizados en la cadena de transporte de electrones para generar ATP. 2. Fermentación Láctica • • Condiciones: Anaeróbicas (falta de oxígeno). Descripción: En condiciones anaeróbicas, como en el músculo durante el ejercicio intenso o en ciertas bacterias, el piruvato se convierte en lactato (ácido láctico) por la enzima lactato deshidrogenasa. Este proceso permite la regeneración de NAD+ a partir de NADH, lo cual es esencial para que la glucólisis continúe y produzca ATP en ausencia de oxígeno. 3. Fermentación Alcohólica • Condiciones: Anaeróbicas (en levaduras y algunas bacterias). • Descripción: En las levaduras y algunas bacterias, el piruvato se convierte primero en acetaldehído y luego en etanol mediante dos reacciones enzimáticas catalizadas por la piruvato descarboxilasa y la alcohol deshidrogenasa. Este proceso también regenera NAD+ necesario para la glucólisis. 4. Gluconeogénesis • • Condiciones: Ayuno o ejercicio prolongado. Descripción: En el hígado (y en menor medida en los riñones), el piruvato puede ser utilizado para la síntesis de glucosa en un proceso llamado gluconeogénesis. Este proceso es esencial para mantener los niveles de glucosa en sangre durante períodos de ayuno o ejercicio prolongado. 5. Síntesis de Aminoácidos y Otros Metabolitos • • Condiciones: Variadas. Descripción: El piruvato puede servir como precursor para la síntesis de varios aminoácidos, como la alanina, a través de transaminación. También puede ser utilizado en la síntesis de oxalacetato, un intermediario importante en la gluconeogénesis y el ciclo de Krebs. 6. Conversión en Oxalacetato • • Condiciones: Cuando se necesita reponer intermediarios del ciclo de Krebs (anaplerosis). Descripción: El piruvato puede ser carboxilado a oxalacetato por la enzima piruvato carboxilasa, un paso crucial para la reposición de intermediarios del ciclo de Krebs y para la gluconeogénesis. En resumen, el destino del ácido pirúvico depende del tipo de célula, la disponibilidad de oxígeno y las necesidades metabólicas específicas. Sus principales destinos incluyen su participación en el ciclo de Krebs, la fermentación láctica, la fermentación alcohólica, la gluconeogénesis, la síntesis de aminoácidos y la conversión en oxalacetato. Aquí tienes una tabla comparativa del rendimiento energético en moles de ATP entre la glucólisis aerobia y anaerobia: Compare el rendimiento energético en moles de ATP de la glucólisis aerobia y anaerobia Proceso Metabólico Producto(s) ATP Generado (Aerobio) ATP Generado (Anaerobio) Glucólisis Conversión de Piruvato a Acetil-CoA Ciclo de Krebs y Cadena de Transporte de Electrones Fermentación Láctica Total 2 Piruvatos, 2 NADH, 2 ATP 2 NADH 2 ATP (netos) 2 ATP (netos) 5 ATP N/A 6 NADH, 2 FADH2, 2 GTP Lactato, NAD+ 20 ATP N/A N/A 27 ATP 0 ATP 2 ATP Notas: 1. Glucólisis: En ambos procesos (aerobio y anaerobio), la glucólisis produce 2 moles de ATP netos. 2. Conversión de Piruvato a Acetil-CoA: En condiciones aeróbicas, cada NADH generado en esta etapa se traduce en 2.5 moles de ATP, totalizando 5 moles de ATP. 3. Ciclo de Krebs y Cadena de Transporte de Electrones: En condiciones aeróbicas, el ciclo de Krebs y la cadena de transporte de electrones producen un total de 20 moles de ATP (15 moles de NADH, 3 moles de FADH2 y 2 moles de GTP). 4. Fermentación Láctica: En condiciones anaeróbicas, la fermentación láctica no genera ATP adicional, pero permite la regeneración de NAD+ para mantener la glucólisis. En resumen, la glucólisis aerobia produce un total de 27 moles de ATP por cada molécula de glucosa, mientras que la glucólisis anaerobia produce solo 2 moles de ATP. ( this one is the main one) El ácido pirúvico, o piruvato, es un metabolito clave en la glucólisis y tiene varios destinos metabólicos dependiendo de las condiciones celulares, como la disponibilidad de oxígeno y el tipo de célula. A continuación, se describen los principales destinos del piruvato: 1. Ciclo de Krebs (Ciclo del Ácido Cítrico) • • Condiciones: Aeróbicas (presencia de oxígeno). Descripción: En presencia de oxígeno, el piruvato se transporta a la matriz mitocondrial, donde es convertido en acetil-CoA por la enzima piruvato deshidrogenasa. El acetil-CoA luego ingresa al ciclo de Krebs, produciendo NADH, FADH2 y GTP (o ATP), los cuales son utilizados en la cadena de transporte de electrones para generar ATP. 2. Fermentación Láctica • • Condiciones: Anaeróbicas (falta de oxígeno). Descripción: En condiciones anaeróbicas, como en el músculo durante el ejercicio intenso o en ciertas bacterias, el piruvato se convierte en lactato (ácido láctico) por la enzima lactato deshidrogenasa. Este proceso permite la regeneración de NAD+ a partir de NADH, lo cual es esencial para que la glucólisis continúe y produzca ATP en ausencia de oxígeno. 3. Fermentación Alcohólica • • Condiciones: Anaeróbicas (en levaduras y algunas bacterias). Descripción: En las levaduras y algunas bacterias, el piruvato se convierte primero en acetaldehído y luego en etanol mediante dos reacciones enzimáticas catalizadas por la piruvato descarboxilasa y la alcohol deshidrogenasa. Este proceso también regenera NAD+ necesario para la glucólisis. 4. Gluconeogénesis • • Condiciones: Ayuno o ejercicio prolongado. Descripción: En el hígado (y en menor medida en los riñones), el piruvato puede ser utilizado para la síntesis de glucosa en un proceso llamado gluconeogénesis. Este proceso es esencial para mantener los niveles de glucosa en sangre durante períodos de ayuno o ejercicio prolongado. 5. Síntesis de Aminoácidos y Otros Metabolitos • • Condiciones: Variadas. Descripción: El piruvato puede servir como precursor para la síntesis de varios aminoácidos, como la alanina, a través de transaminación. También puede ser utilizado en la síntesis de oxalacetato, un intermediario importante en la gluconeogénesis y el ciclo de Krebs. 6. Conversión en Oxalacetato • • Condiciones: Cuando se necesita reponer intermediarios del ciclo de Krebs (anaplerosis). Descripción: El piruvato puede ser carboxilado a oxalacetato por la enzima piruvato carboxilasa, un paso crucial para la reposición de intermediarios del ciclo de Krebs y para la gluconeogénesis. En resumen, el destino del ácido pirúvico depende del tipo de célula, la disponibilidad de oxígeno y las necesidades metabólicas específicas. Sus principales destinos incluyen su participación en el ciclo de Krebs, la fermentación láctica, la fermentación alcohólica, la gluconeogénesis, la síntesis de aminoácidos y la conversión en oxalacetato. 5. Fermentación Láctica: En condiciones anaeróbicas, la fermentación láctica no genera ATP adicional, pero permite la regeneración de NAD+ para mantener la glucólisis. En resumen, la glucólisis aerobia produce un total de 27 moles de ATP por cada molécula de glucosa, mientras que la glucólisis anaerobia produce solo 2 moles de ATP. Balance energético de la glucólisis Como puede inferirse del estudio de la glucólisis, dado que la fructosa 1,6 bisfosfato se escinde en dos triosas y ambas pueden continuar su degradación en la segunda etapa de la glucólisis, al realizar los cálculos para el balance energético de la vía debe tenerse en cuenta que cada glucosa origina dos triosas. • • • En la primera etapa de la glucólisis se consumen 2 ATP. En la segunda etapa se forma 4 ATP: dos en la reacción de la fosfogliceroquinasa y dos en la catalizada por la pirúvico quinasa. De manera que el rendimiento neto de energía en condiciones anaerobias es de 2 mol de ATP. Es de resaltar que la glucólisis, aun en condiciones anaeróbicas, rinde energía metabólicamente útil en forma de ATP. En condiciones aeróbicas, debe tenerse en cuenta la reoxidación del NADH formado en la reacción de la 3 fosfogliceraldehído deshidrogenasa, su paso a la matriz mitocondrial se realiza por un mecanismo que no afecta el rendimiento de 2,5 mol de ATP por cada mol de NADH. Además, hay que considerar la reoxidación del NADH formado en la reacción de la pirúvico deshidrogenasa. • • • • Por otra parte, el acetil- CoA formado en la reacción de la pirúvico deshidrogenasa se incorpora al ciclo de Krebs rindiendo 10 ATP por cada triosa fosfatada 20 ATP por cada glucosa. Ello significa un rendimiento energético neto de 32 mol de ATP por cada molécula de glucosa degradada en condiciones aeróbicas (Tabla 7.1). Irreversibilidad de la vía glucolítica La mayoría de las reacciones de la vía glucolítica son reversibles, con la excepción de • • • las catalizadas por las hexoquinasa, l a fosfofructoquinasa 1 la piruvato quinasa, lo que determina que el proceso total sea irreversible. Cuando se trate el proceso de gluconeogénesis se volverá a insistir en esta característica de la vía glucolítica. Regulación de la vía glucolítica En la vía glucolítica existen cuatro enzimas reguladoras fundamentales: • • • • las hexoquinasas, la piruvato quinasa, la piruvato deshidrogenasa la fosfofructoquinasa 1 que es la principal enzima reguladora de la vía La regulación de las hexoquinasas está en dependencia de la isoenzima expresada en cada tejido. Como se planteó anteriormente, 3. la hexoquinasa I, característica del cerebro, se inhibe por la acumulación de su producto glucosa-6-fosfato, 4. en tanto que la hexoquinasa IV (glucoquinasa) no se inhibe por dicho metabolito, pero sí por la fructosa-6-fosfato, lo que es mediado por la proteína reguladora de la glucoquinasa; 5. además la glucoquinasa resulta inducida por la insulina, todo lo cual está relacionado con la especificidad hística y el destino metabólico de la glucosa en dichos tejidos. 6. La proteína reguladora de la glucoquinasa posee también afinidad por la fructosa 1fosfato y cuando esta última se le une cancela su efecto inhibitorio sobre la glucoquinasa; ello explica que la ingestión de fructosa estimule la fosforilación de glucosa en el hígado. Regulaciones de las Enzimas como Pirovato Quinasa y Piruvato deshidrogenasa La regulación covalente de la piruvato quinasa La piruvato quinasa presenta regulación covalente y alostérica. En la covalente, por fosforilación-desfosforilación, la forma activa es la desfosforilada. La regulación alostérica de la piruvato quinasa La alostérica depende también del tejido, así la isoenzima hepática • • es activada por la fructosa 1,6 bisfosfato es inhibida por el ATP en tanto la muscular no se activa apreciablemente por la fructosa 1,6 bisfosfato y resulta inhibida por la fenilalanina. el mecanismo de regulación covalente de La piruvato deshidrogenasa La piruvato deshidrogenasa controla su actividad por el mecanismo de regulación covalente, es activa en forma desfosforilada. En la fosforilación y desfosforilación de la enzima intervienen las dos enzimas reguladoras del complejo; • • la quinasa la fosfatasa. el mecanismo de regulación alostérica La piruvato deshidrogenasa la enzima resulta activada por elevadas concentraciones de piruvato y de ADP • es inhibida por elevadas concentraciones de ATP. La principal enzima reguladora de la vía glucolítica es la fosfofructoquinasa 1. Su mecanismo de regulación es alostérico. • • Son efectores positivos de la enzima el AMP, el ADP y la fructosa 2,6 bisfosfato; son sus efectores negativos el ATP y el citrato. A continuación de dedicará atención a la enzima que forma y degrada la fructosa 2,6 bisfosfato La fosfofructoquinasa-1 (PFK-1) es una enzima clave en la regulación de la glucólisis. Cataliza la fosforilación de la fructosa-6-fosfato a fructosa-1,6-bisfosfato, un paso irreversible y regulador en la vía glucolítica. La actividad de PFK-1 está finamente regulada por diversos factores alostéricos, hormonales y de disponibilidad de sustrato, lo que permite que la célula ajuste la tasa de glucólisis según sus necesidades metabólicas. Regulación Alostérica de PFK-1 Activadores Alostéricos 1. AMP (Adenosina Monofosfato): o El AMP es un indicador de baja energía celular. Cuando los niveles de ATP disminuyen y los de AMP aumentan, el AMP actúa como un activador alostérico de PFK-1, aumentando su afinidad por el sustrato y promoviendo la glucólisis para generar más ATP. 2. Fructosa-2,6-bisfosfato (F-2,6-BP): o La F-2,6-BP es uno de los reguladores más potentes de PFK-1. Se sintetiza a partir de fructosa-6-fosfato por la acción de la fosfofructoquinasa-2 (PFK-2) y aumenta significativamente la actividad de PFK-1, incluso a concentraciones bajas de fructosa-6fosfato. Inhibidores Alostéricos 1. ATP (Adenosina Trifosfato): o El ATP actúa como un inhibidor alostérico de PFK-1. Cuando los niveles de ATP son altos, la necesidad de producir más ATP a través de la glucólisis disminuye, y PFK-1 es inhibida para evitar un exceso de producción de energía. 2. Citrato: o El citrato es un intermediario del ciclo de Krebs y su acumulación indica que la célula tiene suficiente energía y sustratos para el ciclo de Krebs. Actúa como un inhibidor alostérico de PFK-1, reduciendo la tasa de glucólisis cuando la energía es abundante. Regulación Hormonal de PFK-1 Insulina • Estimulación de PFK-1: o La insulina promueve la actividad de PFK-1 indirectamente al aumentar la síntesis de F2,6-BP. La insulina activa la fosfofructoquinasa-2 (PFK-2), que cataliza la formación de F-2,6-BP, activando así PFK-1 y estimulando la glucólisis. Glucagón • Inhibición de PFK-1: o El glucagón, en contraste, disminuye la concentración de F-2,6-BP al activar la fructosa2,6-bisfosfatasa (FBPase-2), que descompone F-2,6-BP. Esto reduce la actividad de PFK1 y disminuye la glucólisis, favoreciendo la gluconeogénesis. Regulación por Fosforilación y Desfosforilación Aunque PFK-1 no es regulada directamente por fosforilación, su regulador principal, PFK2/FBPase-2, sí lo es: • PFK-2/FBPase-2: o Esta enzima bifuncional tiene dos dominios: uno que sintetiza F-2,6-BP (PFK-2) y otro que lo descompone (FBPase-2). La fosforilación del dominio PFK-2 por la proteína quinasa A (PKA) (activada por el glucagón) disminuye la producción de F-2,6-BP, reduciendo la actividad de PFK-1. La desfosforilación, promovida por la insulina, aumenta la producción de F-2,6-BP, activando PFK-1. Integración de la Señalización Metabólica • Bajo Nivel de Energía (alta AMP): o • Activa AMPK (AMP-activated protein kinase), que aumenta la actividad de PFK-1 a través de la producción de F-2,6-BP y la activación directa por AMP. Alto Nivel de Energía (alta ATP, citrato): o Inhibe PFK-1, reduciendo la tasa de glucólisis y promoviendo el almacenamiento de energía. Resumen La regulación de la fosfofructoquinasa-1 (PFK-1) es un ejemplo clásico de cómo las células integran señales de energía y estado metabólico para mantener la homeostasis. A través de una compleja red de activadores e inhibidores alostéricos, señales hormonales y regulación de intermediarios metabólicos, la actividad de PFK-1 se ajusta para satisfacer las necesidades energéticas de la célula de manera eficiente y coordinada. Gluconeogénesis La gluconeogénesis es el proceso mediante el cual se sintetiza glucosa a partir de compuestos no glucídicos. Sus precursores son el ácido láctico, el glicerol y varios aminoácidos, que debido a que pueden generar glucosa se denominan aminoácidos glucogenéticos. El proceso de gluconeogénesis ocurre principalmente • • • en el hígado con menor intensidad en el riñón se localiza intracelularmente en la mitocondria y el citoplasma. La mayoría de las reacciones de esta vía ocurren por inversión de las reacciones de la vía glucolítica con la excepción de las reacciones irreversibles de esta última vía. Estos pasos se evaden por la participación de otras enzimas que forman rodeos metabólicos. Primer rodeo metabólico La formación del ácido fosfoenolpirúvico a partir de pirúvico constituye el primer rodeo metabólico de la gluconeogénesis. En él intervienen varias enzimas: • la pirúvico carboxilasa (principal enzima anaplerótica del ciclo de Krebs), que catalizará la formación de ácido oxalacético a partir del ácido pirúvico • • el ácido oxalacético es convertido en ácido L málico por la enzima L málico deshidrogenada del ciclo de Krebs; este puede salir de la matriz mitocondrial mediante transportadores de ácidos dicarboxílicos y ya en el citosol es convertido de nuevo en ácido oxalacético por una L málico deshidrogenasa citoplasmática. La enzima ácido fosfoenolpirúvico carboxiquinasa (PEP carboxiquinasa), específica de esta vía, convierte el ácido oxalacético en ácido fosfoenolpirúvico; en esta reacción se requiere el consumo de GTP y se libera CO2 (Fig. 7.3) Una vez formado el ácido fosfoenolpirúvico la vía procede por la inversión de las reacciones de la vía glucolítica hasta la formación de la fructosa 1, 6 bisfosfato, ya que todas las enzimas que participan catalizan reacciones reversibles. Segundo rodeo metabólico El segundo rodeo metabólico elude la reacción de la fosfofructoquinasa 1, que es irreversible. La enzima que interviene es la bisfosfofructofosfatasa 1, que cataliza la reacción de fructosa 1,6 bisfosfato a fructosa-6-fosfato y es la enzima principal reguladora de esta vía: Una vez formada la fructosa-6-fosfato la enzima fosfoglucoisomerasa, de la vía glucolítica, la convierte en glucosa-6-fosfato, ‘ que debe ser convertida en glucosa por la glucosa-6-fosfatasa, reacción que constituye el tercer y último rodeo metabólic Tercer rodeo metabólico La glucosa-6-fosfato formada es convertida en glucosa libre por la acción de la enzima glucosa6-fosfatasa. Como se vio anteriormente esta enzima interviene también en la glucogenólisis hepática y su acción permite que la glucosa formada pueda salir de este tejido: En el esquema 7.2 se presentan, de forma resumida, las reacciones de las vías glucolíticas y gluconeogenética. Como puede constatarse, en la formación de una molécula de glucosa se consume el equivalente de 6 ATP. Relaciones interorgánicas entre el hígado, el músculo y el tejido adiposo El glicerol, precursor de la gluconeogénesis, proviene fundamentalmente de la degradación de los triacilgliceroles del tejido adiposo; el ácido láctico procede de la glucólisis anaerobia del eritrocito y del músculo en ejercicio anaerobio. Entre el hígado y el músculo se establece un ciclo, ya que la glucosa formada en la gluconeogénesis pasa a la sangre y puede alcanzar de nuevo el músculo; este ciclo se conoce como ciclo de Cori y es característico del ejercicio físico (Fig. 7.4). Entre el músculo y el hígado se establece otra relación interorgánica mediante el ciclo de Cahill (Fig. 7.5). La degradación de las proteínas hísticas musculares, que ocurre durante el ayuno, libera aminoácidos que al transaminarse con el ácido pirúvico proveniente de la glucólisis se convierten en alanina, este aminoácido pasa a la sangre, alcanza el hígado y allí constituye un precursor para la síntesis de glucosa, la cual si pasa a la sangre puede de nuevo ingresar al músculo cerrando así el ciclo de Cahill. Regulación de la gluconeogénesis En la regulación de la gluconeogénesis intervienen dos enzimas fundamentales • • la pirúvico carboxilasa la bisfosfofructofosfatasa 1. La enzima pirúvico carboxilasa resulta activada por elevadas concentraciones de acetil- CoA. Regulación alostérica de la bisfosfofructofosfatasa La bisfosfofructofosfatasa 1 es la principal enzima reguladora de la gluconeogénesis y su mecanismo de regulación es alostérico siendo • • sus efectorres positivos el ATP y el citrato y sus efectores negativos el AMP, el ADP y la fructosa 2,6 bisfostato. Como puede apreciarse, los efectores alostéricos de esta enzima actúan de modo inverso a como lo hacen esos mismos efectores en el caso de la enzima fosfofructoquinasa 1; ello es fundamental en la regulación coordinada de la glucólisis y la gluconeogénesis. Ciclo de las pentosas La vía de oxidación directa de la glucosa o vía del fosfogluconato o ciclo de las pentosas reviste especial importancia en algunos tejidos, como los lipogenéticos (hígado y tejido adiposo), eritrocitos, el cristalino y otros. La energía que se libera en el proceso no se conserva en forma de ATP, sino de equivalentes de reducción en forma de NADPH. Esta vía consta de dos etapas: • • la oxidativa, de glucosa-6- fosfato a ribulosa-5-fosfato, y la no oxidativa de ribulosa-5-fosfato a fructosa-6-fosfato + 3-fosfogliceraldehído. Dado que la fructosa-6-fosfato se puede convertir en glucosa-6-fosfato, de esta manera se conforma un ciclo. La segunda etapa se caracteriza por una serie de reacciones de interconversión de monosacáridos de distinto número de átomos de carbono (Fig. 7.8). En la primera etapa las reacciones proceden de la siguiente manera: – La glucosa-6-fosfato es convertida en 6-fosfogluconolactona por acción de la enzima glucosa6fosfato deshidrogenasa. • • • En la reacción una molécula de NADP+ se convierte en NADPH.H+ . En el paso siguiente esta lactona experimenta una hidrólisis por la acción catalítica de una lactonasa y se produce ácido 6-fosfoglucónico. Una descarboxilación con la participación de la enzima 6-fosfoglucónico deshidrogenasa rinde ribulosa-5-fosfato y se forma otra molécula de NADPH.H+ . En la segunda etapa el proceso es como sigue: – La fosfopentosa isomerasa interconvierte las dos pentosas: • • 5-fosforibulosa y ribosa 5-fosfato. Las reacciones subsiguientes del ciclo se caracterizan por la interconversión de monosacáridos de número de átomos de carbono distintos. En esta etapa son fundamentales dos tipos de enzimas • transcetolasa y la transaldolasa que catalizan la transferencia de unidades bicarbonadas y tricarbonadas, respectivamente. La reacción catalizada por la enzima glucosa-6-fosfato deshidrogenasa es la principal reguladora de la vía y depende principalmente de los niveles de NADP+ . Además, el NADPH compite con el NADP+ por la unión a la enzima, así como el ATP lo hace con la glucosa-6-fosfato. Todo ello permite que la velocidad del ciclo de las pentosas esté acoplada a la utilización del NADPH en los diferentes procesos en los cuales participa. Este ciclo tiene importancia por sus vínculos con otros procesos metabólicos: • • por la formación de equivalentes de reducción en forma de NADPH, los cuales serán utilizados en la síntesis reductora de diversos tipos de lípidos, y por la obtención de ribosa-5-fosfato, sustancia precursora en la síntesis de nucleótidos. Entre las 18 y 24 horas de ayuno se agotan las reservas de glucógeno hepático por lo que la glucemia depende solo de la gluconeogénesis proceso que ocurre mayoritariamente en el hígado. En estas condiciones la glucosa sanguínea es captada por los glóbulos y por el sistema nervioso que la utilizan para la producción de ATP mediante la glucolisis. La regulación de la glucolisis y de la gluconeogénesis en las diferentes situaciones metabólicas, es el contenido que debes estudiar para la realización de este seminario. Para ello debes tener en cuenta las orientaciones recibidas en las correspondientes conferencia y clase taller, consultar la bibliografía indicada y desarrollar las siguientes tareas docentes. Desarrollo Responda las siguientes preguntas, lléveles solucionadas al seminario. Anote todas las dudas que le han surgido. 1. Explique el efecto de un bajo potencial energético celular, sobre la intensidad de la Glucólisis, en las células musculares. II-. Explique el efecto de un incremento del ATP sobre la intensidad de la Gluconeogénesis, en las células hepáticas. III-. Explique la variación en la actividad de la enzima Fosfofructoquinasa 1 por la llegada de señales extracelulares al hepatocito, a pesar de que no presenta mecanismo de control covalente por fosforilación desfosforilación. IV-.La Diabetes mellitus tipo I, tiene como causa un déficit en la síntesis de Insulina por los islotes pancreáticos; sin embargo, se presenta un incremento en la secreción de la hormona Glucagón, por dichos islotes. Explique la modificación en la intensidad de la Gluconeogénesis en esta situación. V-.En condiciones de hiperglucemia, en las que se libera Insulina, se produce un aumento coordinado de la Glucólisis hepática, con una disminución de la Gluconeogénesis. Interprete esta afirmación. Entendido, vamos a profundizar en los mecanismos específicos de la regulación de la glucólisis y la gluconeogénesis en diferentes condiciones metabólicas. I. Efecto de un bajo potencial energético celular sobre la intensidad de la glucólisis en las células musculares Bajo Potencial Energético Cuando las células musculares tienen un bajo potencial energético, se refleja en altos niveles de AMP y bajos niveles de ATP. Esto desencadena una serie de respuestas para aumentar la producción de ATP: • • • Activación de la AMP-activada proteína quinasa (AMPK): AMPK es una enzima clave que actúa como sensor del estado energético celular. Se activa en respuesta a altos niveles de AMP. Una vez activada, AMPK promueve vías catabólicas que generan ATP y suprime vías anabólicas que consumen ATP. Regulación alostérica de PFK-1: La fosfofructoquinasa-1 (PFK-1) es la enzima clave de la glucólisis. AMP actúa como un activador alostérico de PFK-1, aumentando su afinidad por el sustrato y promoviendo la conversión de fructosa-6-fosfato en fructosa1,6-bisfosfato. Esto acelera la glucólisis, produciendo más ATP. Inhibición de la piruvato deshidrogenasa quinasa (PDK): AMPK también inhibe la PDK, que normalmente inactiva el complejo de la piruvato deshidrogenasa (PDH). La inhibición de PDK mantiene activo el PDH, permitiendo que el piruvato entre en el ciclo de Krebs para la producción de ATP. II. Efecto de un incremento del ATP sobre la intensidad de la gluconeogénesis en las células hepáticas Alto Potencial Energético Cuando las células hepáticas tienen altos niveles de ATP, la gluconeogénesis se favorece para mantener los niveles de glucosa en sangre durante períodos de ayuno: • • • Inhibición de la glucólisis: Altos niveles de ATP inhiben PFK-1, reduciendo la conversión de fructosa-6-fosfato en fructosa-1,6-bisfosfato y disminuyendo la glucólisis. Esto desvía el flujo de carbono hacia la gluconeogénesis. Estimulación de la fructosa-1,6-bisfosfatasa (FBPase-1): La gluconeogénesis se acelera mediante la activación de FBPase-1, que convierte fructosa-1,6-bisfosfato en fructosa-6-fosfato, un paso crucial en la síntesis de glucosa. Activación de enzimas gluconeogénicas: La expresión de enzimas gluconeogénicas como la fosfoenolpiruvato carboxiquinasa (PEPCK) y la glucosa-6-fosfatasa aumenta en presencia de ATP y glucagón. III. Variación en la actividad de la enzima Fosfofructoquinasa 1 (PFK-1) por señales extracelulares en el hepatocito Regulación por Fructosa-2,6-Bisfosfato PFK-1, a pesar de no ser regulada por fosforilación directa, está fuertemente influenciada por la fructosa-2,6-bisfosfato (F-2,6-BP): • • Insulina: Promueve la activación de la PFK-2 (la enzima que sintetiza F-2,6-BP) y la inhibición de la FBPase-2 (la enzima que descompone F-2,6-BP). Esto aumenta los niveles de F-2,6-BP, que activa PFK-1, aumentando la glucólisis. Glucagón: Promueve la activación de FBPase-2 y la inhibición de PFK-2, disminuyendo los niveles de F-2,6-BP. Esto reduce la activación de PFK-1, disminuyendo la glucólisis y favoreciendo la gluconeogénesis. IV. Diabetes mellitus tipo I y la gluconeogénesis Efecto de la Insulina y el Glucagón En la diabetes tipo I, la ausencia de insulina y el aumento relativo de glucagón tienen efectos significativos en la gluconeogénesis: • • Falta de Insulina: Sin insulina, no hay señal para inhibir la gluconeogénesis. Normalmente, la insulina suprimiría la expresión de enzimas gluconeogénicas como PEPCK y glucosa-6-fosfatasa. Aumento de Glucagón: El glucagón aumenta, estimulando la gluconeogénesis. Activa la adenilato ciclasa, que aumenta los niveles de AMP cíclico (cAMP) y activa la proteína quinasa A (PKA). PKA fosforila y activa enzimas gluconeogénicas, como PEPCK, incrementando la producción de glucosa. V. Condiciones de hiperglucemia, insulina y la regulación de la glucólisis y gluconeogénesis Coordinación de la Glucólisis y la Gluconeogénesis Durante la hiperglucemia, la insulina juega un papel clave en la regulación de la glucosa: • • Aumento de la Glucólisis Hepática: o La insulina aumenta la expresión de glucocinasa, que fosforila la glucosa para su entrada en la glucólisis. o Promueve la actividad de PFK-1 a través del aumento de F-2,6-BP, estimulando la glucólisis. Disminución de la Gluconeogénesis: o La insulina reduce la expresión de enzimas gluconeogénicas como PEPCK y glucosa-6-fosfatasa. o Disminuye los niveles de cAMP, reduciendo la actividad de PKA y así la fosforilación de factores que promueven la gluconeogénesis. Resumen La regulación de la glucólisis y la gluconeogénesis es un equilibrio delicado influenciado por el estado energético de la célula y las señales hormonales. La insulina y el glucagón son reguladores clave que ajustan estas vías metabólicas para mantener la homeostasis de la glucosa en el cuerpo. La comprensión de estos mecanismos es crucial para abordar trastornos metabólicos como la diabetes.