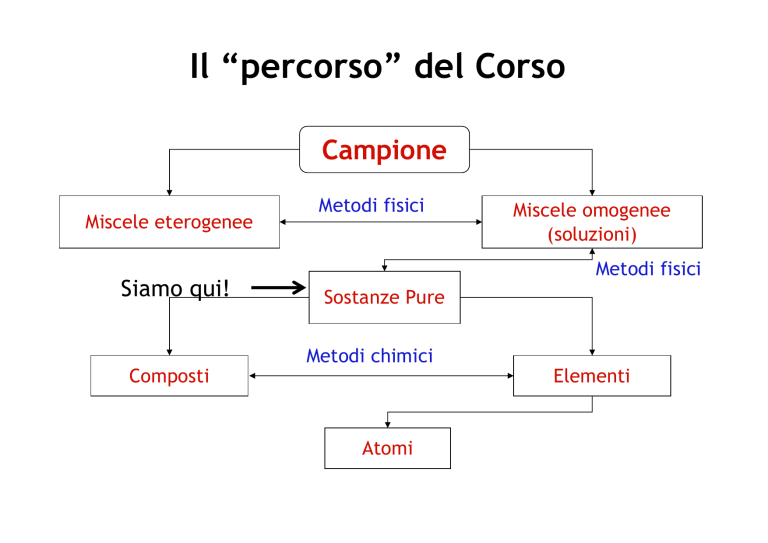
Il “percorso” del Corso Campione Miscele eterogenee Siamo qui! Composti Metodi fisici Miscele omogenee (soluzioni) Metodi fisici Sostanze Pure Metodi chimici Atomi Elementi Il Modello di Gas Ideale Un gas ideale è un gas formato da particelle (atomi o molecole) che hanno le seguenti proprietà: • Le particelle sono puntiformi (il loro volume è trascurabile rispetto al volume totale); • Le interazioni tra le particelle, cioè i legami intermolecolari, sono nulle (sono trascurabili rispetto all’energia cinetica delle particelle stesse); • Gli urti delle particelle tra loro e con le pareti sono urti perfettamente elastici. • L’energia cinetica media di una particella è proporzionale alla temperatura assoluta T (per un atomo, Ec = 3/2 kT). Costanti fisiche fondamentali quantità simbolo valore unità costante di Avogadro NA 6,0221420 ´ 1023 mol–1 costante di Faraday F 96485,342 C mol–1 costante di Bolzmann k 1,380650 ´ 10–23 J K–1 costante molare dei gas R 8,31447 0,0831447 0.0820575 J mol–1 K–1 L bar mol–1 K–1 L atm mol–1 K–1 volume molare dei gas Vm 22,71098 22,41400 L L T = 0 °C, p = 1 bar T = 0 °C, p = 1 atm R = k x NA TPS: Temperatura e Pressione Standard Per i gas: 0 °C e 1 atm Unità di misura non SI grandezza energia pressione temperatura volume * nome caloria litro atmosfera atmosfera bar torr grado Celsius litro t(°C) = T(K) – 273,15 simbolo cal L atm atm bar Torr (mmHg) °C L valore 4,184 J 1,01325 ´ 102 J 1,01325 ´ 105 Pa 1 ´ 105 Pa 1,33322 ´ 102 Pa 1K* 1 ´ 10–3 m3 Distribuzione delle velocità molecolari in un gas Distribuzione velocità della per le molecole di O2 alle temperature di -100 °C (linea rossa), 20 °C (linea verde) tratteggiata e 600 °C (punteggiata blu). A 25 °C la velocità media di un atomo di He è ca 1260 m/s, quella di una molecola di N2 è ca 475 m/s. Il Modello di Gas Ideale • La pressione esercitata dal gas sulle pareti del recipiente è dovuta agli urti delle particelle contro le pareti; • L’entità della pressione dipende dal numero di urti e dalla loro forza; • Il numero di urti dipende dalla “densità” delle particelle, e quindi dipende direttamente dal loro numero ed inversamente dal volume del recipiente; • La forza degli urti dipende dalla energia cinetica media delle particelle che è a sua volta proporzionale alla temperatura assoluta del gas. Il Modello di Gas Ideale Per un modello di sostanza gassosa costituita da particelle senza volume proprio e senza forze di attrazione reciproche, lo sviluppo matematico origina la seguente legge: PV=nRT V = volume P = pressione n = numero di moli T = temperatura assoluta R = costante generale dei gas = 8,31 Pa m3 mol-1 K-1 = 0,0831 bar L mol-1 K-1 = 0,0820 atm L mol-1 K-1 Il Modello di Gas Ideale Per un modello di sostanza gassosa costituita da particelle senza volume proprio e senza forze di attrazione reciproche, lo sviluppo matematico origina la seguente legge: PV=nRT Miscele di gas : P V = (S ni) R T Pressione parziale: pi = ni R T / V = P ni / (Sni) = P xi Dove xi è la frazione molare del componente i-esimo; la studieremo quando vedremo le concentrazioni (importante!) Il Gas Reale Volume molecolare Attrazioni molecolari comportamento ideale Deviazione generica dal comportamento ideale per 1 mol di un gas reale in funzione della pressione, a tre temperature T1 (a), T2 (b) e T3 (c), con T1 < T2 < T3. I Gas Reali L’equazione più usata per rappresentare il comportamento dei gas reali (in cui cioè le particelle si attraggono tra di loro e sono dotate di un volume proprio) è l’equazione di Van der Waals: (P + n2a/V2) x (V-nb) = n R T Dove il termine n2a/V2 rappresenta le interazioni tra le molecole, mentre b (il covolume) rappresenta il volume di una mole di molecole. I Gas Reali (P + n2a/V2) x (V-nb) = n R T Esercizio: determinare se 1 mole di diazoto (a = 1.41 L2 atm mol-2; b = 0,0391 L mol-1) posta a 0°C in 224,1 L o in 0.2241 L ha un comportamento ideale. I Gas Reali (P + n2a/V2) x (V-nb) = n R T Esercizio: determinare se 1 mole di diazoto (a = 1.41 L2 atm mol-2; b = 0,0391 L mol-1) posta a 0°C in 224,1 L o in 0,2241 L ha un comportamento ideale. V= 224,1 L (P + 0,0000281) x (224,1-0,0391) = 1 x 0,082 x 273,15 (P + 0,0000281) x (224,06) = 22,41 (P + 0,0000281) = 0,100 P = 0,100 atm Valore coincidente con quello previsto dalla legge dei gas ideali I Gas Reali (P + n2a/V2) x (V-nb) = n R T Esercizio: determinare se 1 mole di diazoto (a = 1.41 L2 atm mol-2; b = 0,0391 L mol-1) posta a 0°C in 224,1 L o in 0,2241 L ha un comportamento ideale. V= 0,2241 L (P + 28,1) x (0,2241-0.0391) = 1 x 0,082 x 273,15 (P + 28,1) x (0,185) = 22,41 (P + 28,1) = 121,14 P = 93,0 atm Valore inferiore a quello previsto dalla legge dei gas ideali (100 atm) I Gas Reali (P + n2a/V2) x (V-nb) = n R T Benzene a = 18.24 L2 atm mol-2; b = 0,1154 L mol-1 Cosa possiamo dire rispetto al caso dell’azoto? Ripetere l’esercizio con n = 1 a 0°C e V = 0,2241 L (P + 363,2) (0,2241 – 0,1154) = 22,41 P + 363,2 = 22,41/(0,1087) = 206,2 P = - 157 atm ??? I passaggi tra gli stati di aggregazione Distribuzione delle velocità molecolari in un gas Distribuzione delle velocità molecolari in un gas Distribuzione delle velocità molecolari in un gas Diagramma di stato dell’acqua P T (°C) Pv (Torr) 0 4,6 20 17,5 40 55,3 60 149,4 80 355,1 100 760,0 200 64632 liquido gas T Effetto della compressione T = 373,15 K Pv = 1 atm Moli di H2O totali: 0,1 Vgas = 1 L nH2O,gas = 0,0327 nH2O,l = 0,0673 T = 373,15 K Pv = 1 atm Moli di H2O totali: 0,1 Vgas = 0,5 L nH2O,gas = 0,0164 nH2O,l = 0,0836 T = 373,15 K Pv = 1 atm Moli di H2O totali: 0,1 Vgas = 0,25 L nH2O,gas = 0,0082 nH2O,l = 0,0918 T = 373,15 K P > 1 atm (non Pv) Moli di H2O totali: 0,1 Vgas = 0 L nH2O,gas = 0,000 nH2O,l = 0,100 Diagramma di stato dell’acqua P T (°C) Pv (Torr) 0 4,6 20 17,5 40 55,3 60 149,4 80 355,1 100 760,0 200 64632 liquido gas T Effetto dell’espansione T = 373,15 K Pv = 1 atm Moli di H2O totali: 0,1 Vgas = 1 L nH2O,gas = 0,0327 nH2O,l = 0,0673 T = 373,15 K Pv = 1 atm Moli di H2O totali: 0,1 Vgas = 2 L nH2O,gas = 0,0654 nH2O,l = 0,0346 T = 373,15 K Pv = 1 atm Moli di H2O totali: 0,1 Vgas = 3,06 L nH2O,gas = 0,1 nH2O,l = 0,000 T = 373,15 K P = 0,765 atm (non Pv) Moli di H2O totali: 0,1 Vgas = 4 L nH2O,gas = 0,1 nH2O,l = 0,000 Diagramma di stato dell’acqua P T (°C) Pv (Torr) 0 4,6 20 17,5 40 55,3 60 149,4 80 355,1 100 760,0 200 64632 liquido gas T Diagramma di stato dell’acqua Diagramma di stato 1. aumento della temperatura a pressione costante a P > Ptr 2. aumento della temperatura a pressione costante a P <Ptr 3. aumento della pressione a temperatura costante a T < Ttr 4. aumento della pressione a temperatura costante a T > Ttr Diagramma di stato della CO2 P Liquido solido 5,1 atm Gas -56 °C T P/atm Diagramma di stato del Carbonio 5 10 1 3 10 T/°C Diagramma di stato dello Zolfo P 1280 atm 0,08 torr 95,5 119 151 T/°C