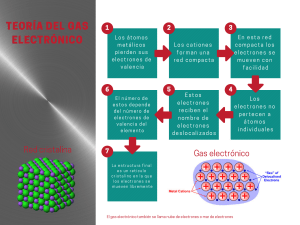
SEMANA 1 - ESTRUCTURA ATÓMICA ACTUAL LUNES 13/03/23 Átomo Conceptos previos : - Escuela Atomista (Demócrito y Leucipo) : Sin división - J. Dalton: Esfera maciza, indivisible, indestructible, impenetrable. - J. Thomson: Experimento de los rayos catódicos, modelo de budín de pasas, descubridor del electrón. - E. Rutherford: Experimento denominado pan de oro, descubrió el protón, hace referencia al núcleo atómico. Los electrones giran alrededor del átomo en órbitas. - N. Bohr: Hace referencia a los niveles de energía. (Absorción y emisión de energía). - Se encuentran los protones (p+) y neutrones (nº). - Se concentra la mayor cantidad de masa del átomo, (99,99%). - Se encuentran los electrones, (e-). - Concentra o representa el mayor volumen del átomo. * Partículas subatómicas fundamentales: protón, neutrón y electrón. * Nucleones fundamentales: protón y neutrón. Átomos con igual número de protones. Átomos con igual número de masa Átomos con igual número de neutrones GRACIAS SEMANA 2 - ZONA EXTRANUCLEAR Conceptos previos : - Región energética donde se encuentran los electrones. - Formada por niveles de energía, que a su vez se dividen en subniveles y orbitales. LUNES 20/03/23 NÚMEROS CUÁNTICOS Conceptos previos : Los números cuánticos son valores numéricos que indican las características de los electrones en los átomos. Son 4 números cuánticos y se denominan: principal, secundario, magnético y espín. NÚMERO CUÁNTICO PRINCIPAL (n). Determina el nivel de energía que tiene el electrón. Indica el tamaño o volumen del orbital Toma valores enteros a partir de “1”. Cuánto mas alejado del núcleo se encuentre un electrón, ocupará un nivel con mayor energía y será menos estable - La cantidad de electrones máximos por nivel se calcula: #𝑚á𝑥𝑒 − = 2𝑛2 - Dónde: n=1 n=2 n=3 2(1)2 = 2𝑒 − 2(2)2 = 8𝑒 − 2(3)2 = 18𝑒 − - Por último se detalló que este número cuántico define el volumen del orbital: A mayor valor de “n”, mayor es el tamaño del orbital. NÚMERO CUÁNTICO SECUNDARIO (l). Denominado también número cuántico azimutal. Determina el subnivel de energía del electrón. Define la forma geométrica del orbital. Para cada nivel de energía se cumple que “l” puede tomar valores enteros Desde cero hasta (n-1). l= 0 ,1 ,2,3 , ……………. (n-1) Desde (mínimo valor) Hasta (máximo valor) SUBNIVELES DENOMINACIÓN VALORES DE “l” FORNA DE LOS ORBITALES s Sharp 0 Esférica p Principal 1 Dilobular d Diffuse (difuso) 2 Tetralobular f Fundamental 3 Compleja NIVELES SUBNIVELES NÚMERO DE SUBNIVELES 1óK l= 0 (s) ; 1s 1 2óL l= 0 (s) ; 2s l= 1 (p) ; 2p 2 3óM l= 0 (s) ; 3s l= 1 (p) ; 3p l= 2 (d) ; 3d 3 NÚMERO CUÁNTICO MAGNÉTICO (ml). En cada subnivel (l), ml puede tomar los valores: ml : -l,…..-2,-1,0,1,2….,+l El número de orbitales en un subnivel “l” se calcula: # orbitales en un subnivel “l”: 2l+1 NÚMERO CUÁNTICO DE ESPÍN MAGNÉTICO (ms). Indica el giro del electrón y la orientación del campo magnético que este produce. Puede tomar dos posibles valores: +1/2 y -1/2 Correcto Incorrecto REGLA DEL SERRUCHO En forma lineal tenemos: GRACIAS SEMANA 3 - TABLA PERIÓDICA Antecedentes: Alfred Werner: Propuso la tabla periódica actual (tabla alargada). Henry Moseley: A partir de su experimento con los rayos X, logra descubrir propiedades de los elementos y los clasifica según su número atómico (Z). Conceptos Previos: La tabla periódica consta de un total de 118 elementos, que se divide en 18 grupos (16 familias) y 7 periodos. De manera general se divide en 2 grupo : A y B A: Elementos Representativos (s,p). B: Elementos de Transición (d,f). LUNES 27/03/23 También lo podemos dividir en metales, no metales, metaloides y gases nobles. Metales: Conforman la mayor cantidad de elementos en la T.P. Tienden a oxidarse. Único líquido a temperatura ambiente: Mercurio (Hg). Presentan brillo metálico. Buenos conductores del calor y la electricidad. Son dúctiles y maleables. No Metales: Se encuentran en menor cantidad en la T.P. Tienden a reducirse. Único líquido a temperatura ambiente: Bromo (Br). Son opacos. Malos conductores del calor y la electricidad a excepción del grafito. Metaloides: Son 8 (B, Si, Ge, As, Sb, Te, Po y At). A altas temperaturas son buenos conductores de la electricidad. Gases Nobles: Tienen una configuración estable. A condiciones ambientales no reaccionan. Ubicación de los elementos en la T.P: Grupo A (s,p): Periodo: Mayor nivel de energía. Grupo: # Electrones (e-) del mayor nivel. Grupo B (d, f): Para elementos que terminan en el subnivel “d”: Periodo: Mayor nivel de energía. Grupo: # electrones “s” + #electrones “d”. Para elementos que terminan en el subnivel “f”: Periodo: Mayor nivel de energía. Grupo: III B. GRACIAS HELICO | TEORIA CAP 4 - ENLACE QUÍMICO LUNES 10/04/23 Es la fuerza de naturaleza eléctrica y magnética que mantiene unidos a átomos, iones o moléculas por interacción de sus electrones de valencia, con la finalidad de lograr un sistema estable. E. IÓNICOS E. COVALENTES E. METÁLICOS HELICO | TEORIA FORMACIÓN DEL H2 HELICO | TEORIA 1)ELECTRONES DE VALENCIA: Son los electrones que se encuentran ubicados en el último nivel de energía de los elementos representativos. EJEMPLO: 4 2 2 2p O: 1s 2s 8 Nivel externo 17 Cl:1s22s22p6 3s2 #e- de valencia6 = 3p5 Nivel externo #e- de valenci= 7 HELICO | TEORIA 2)NOTACIÓN DE LEWIS: Es la representación convencional de los electrones de valencia (electrones que intervienen en los enlaces químicos), mediante el uso de puntos o aspas que se colocan alrededor del símbolo del elemento. EJEMPLO: 222 2p5 1s F: 9 15 P:1s22s2 2p6 3s2 3p3 7 electrones de valencia 5 electrones de valencia F P Símbolo de lewis Símbolo de lewis HELICO | TEORIA 3)REGLA DEL OCTETO: Kossel y Lewis establecen que los átomos adquieren estabilidad química al completar 8 electrones en su nivel más externo (configuración electrónica semejante a la de un gas noble). Walther Kossel EXCEPCIONES: H Be B Al HELICO | TEORIA 4)ELECTRONEGATIVIDAD (E.N): Se define como la tendencia general de los átomos para atraer electrones (valencia) hacia si mismo cuando forma un enlace químico. HELICO | THEORY DEFINICIÓN ENLACE IÓNICO Es la fuerza de atracción electrostática que mantiene unidos a un metal (catión) y un no metal (anión) que se forma previa transferencia de electrones. HELICO | THEORY Observaciones Cuando la diferencia de electronegatividades entre los elementos que forman un compuesto binario es mayor o igual a 1,7 su enlace será iónico. ∆ EN ≥ 1,7 HELICO | THEORY CARACTERÍSTICAS DE LOS COMPUESTOS IÓNICOS Son solidos cristalinos. Son frágiles y quebradizos(se rompen fácil por acción de fuerzas externas) Fundidos ( en estado liquido) o disueltos en agua (solución acuosa) son buenos conductores eléctricos. Son sólidos con altos puntos de fusión y de ebullición. Muchos son solubles en disolventes polares, como el agua. GRACIAS HELICO | TEORIA CAP 5 - ENLACE COVALENTE Unión entre átomos que comparten uno o generalmente entre elementos no metálicos. E. IÓNICOS LUNES 17/04/23 más E. COVALENTES (𝟎 ≤ ∆𝑬𝑵 < 𝟏, 𝟕) electrones de E. METÁLICOS valencia, HELICO | THEORY CLASIFICACIÓN A. POR LA POLARIDAD DEL ENLACE 1. ENLACE COVALENTE NO POLAR ( APOLAR) Se forma entre átomos iguales, donde la diferencia de electronegatividades es igual a cero (ΔE.N.=0). 2. ENLACE COVALENTE POLAR Se forma entre átomos diferentes, donde la ΔE.N. ≤ 1,7 .( 0 < ∆ EN < 1,7) EJEMPLO O2 N2 Cℓ2 H H H2 ∆ EN = 2,1 – 2,1 = 0 EJEMPLO HBr CO NO ∆ EN = 2,4 – 2,1 = 0,3 HELICO | THEORY B. POR EL ORIGEN DE LOS ELECTRONES COMPARTIDOS 1. ENLACE COV. NORMAL A – B (cada átomo aporta un electrón para formar enlace) A = B 2. ENLACE COORDINADO COV. A ≡ B DATIVO (Solo un átomo aporta un par de electrones para formar enlace) O 1 E. Cov. normal 2 E. Cov.normal 3 E. Cov. normal HELICO | THEORY C. POR EL NÚMERO DE PARES COMPARTIDOS SIMPLE DOBLE Se comparte un par de electrones. ETANO TRIPLE HELICO | THEORY Presentan fusión y encuentran estados. bajo punto de ebullición, se en los tres Generalmente son insolubles en solventes polares como el agua, pero solubles en solventes apolares como en el Benceno Generalmente son malos conductores de la corriente eléctrica. GRACIAS CAP 6- TALLER