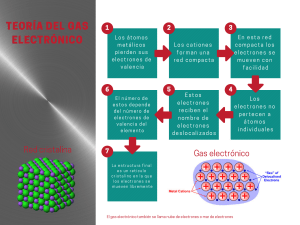
Guía Parcial 2 Química 1 Tabla Periódica 1. Identificar los grupos de la tabla periódica que son metales y los no metales, así como los metales de transición y los gases nobles 2. 3. 4. 5. Menciona las propiedades de los metales: Menciona las propiedades de los no metales: ¿Qué es la electronegatividad? Ordena los elementos de mayor a menor valor de electronegatividad con respecto a su posición en la tabla periódica. (1=mayor electronegatividad;5=menor electronegatividad) Elemento O Ga Li Sr Pb Valor nominal Configuración Electrónica 6. Completar la configuración electrónica de: a. Br: b. Rb: Enlaces Químicos 7. ¿Qué es un enlace químico? 8. ¿Por qué se forman? 9. ¿Qué es la regla del octeto? 10. ¿Cómo se forman los enlaces iónicos? 11. ¿Cómo se forman los enlaces covalentes? 12. Identifica si los siguientes compuestos tienen enlaces iónicos o covalentes: Compuesto Nal HBr NH3 CaCl2 H2O MgO KBr N2O Tipo de Enlace Nomenclatura y formulas químicas 13. Escribe la formula química de los siguientes compuestos: a. Óxido de calcio: b. Bromuro de Potasio: c. Óxido de Aluminio: d. Cloruro de magnesio: e. Hidróxido: 14. Escribe el nombre de los siguientes compuestos químicos: a. NaBr b. CaCl2 c. KOH Soluciones acidas y básicas 15. ¿Qué es una solución acida? 16. ¿Qué es una solución Básica? 17. Identificar el compuesto como acido o básico: Compuesto Acido/base NaOH HCl Ca(OH)2 H2S 18. ¿Qué son los electrones de valencia? 19. ¿Qué son los óxidos? Hoja de Respuestas: 1) 2) Conductores de electricidad y calor 3) Elementos no conductores de calor ni electricidad que son normalmente gaseosos a temperatura ambiente. 4) Es el indicador relativo de que tan hábil es el elemento para atraer electrones para formar un enlace químico 5) Elemento O - 3.44 Ga - 1.81 Li – 0.98 Sr – 0.95 Pb – 1.8 Valor nominal 1 2 4 5 3 6) Br= 1s22s22p1 Rb =1s22s22p63s23p64s23d104p65s1 7. Es la fuerza que junta a dos átomos y los mantiene juntos. 8. Por atrición de cargas complementarias +/- entre núcleos y electrones entre 2 iones, el catión y el anión. 9. Establece que los elementos tienden a adquirir o perder electrones para completar ocho (8) electrones de valencia. 10. El elemento con menor número electrones de valencia cede o dona el electrón al elemento con mayor número de electrones de valencia quien recibe el electrón para completar la regla del octeto. 11. Los elementos comparten electrones para completar la regla del octeto. 12. Compuesto Nal HBr NH3 CaCl2 H2O MgO KBr N2O Tipo de Enlace Iónico Covalente Covalente Iónico Covalente Iónico Iónico Covalente 13. a) Óxido de calcio=CaO b) Bromuro de Potasio=KBr c) Óxido de Aluminio=Al2O3 d) Cloruro de magnesio=MgCl2 e) Hidroxido= OH 14. a) NaBr: Bromuro de sodio b) CaCl2: Cloruro de calcio c) KOH: Hidróxido de potasio 15. Solución acida: Es una solución que contiene más iones hidrogeno que iones hidroxilo. H+ 16. Solución básica: Es una solución que contiene más iones hidroxilo que iones hidrogeno. OH17. Compuesto NaOH HCl Ca(OH)2 H2S Acido/base Base Acido Base Acido 18. Los electrones de valencia son el número de electrones que tiene un elemento en su orbital más externo. 19. Combinaciones binarias de compuestos metálicos con un oxigeno