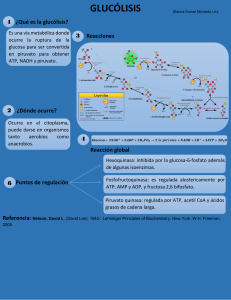
DETERMINACIÓN DE DISTINTAS VARIABLES TERMODINÁMICAS PARA EL ANÁLISIS DE LA HIDRÓLISIS DEL ATP. Calvache Rosales Laura Vanessa (220140002), Chaves Toro Yeison Eduardo (220140056), Galindez Arteaga Emily Juliana (220140071) Universidad de Nariño Facultad de ciencias exactas y naturales Departamento de química Laboratorio fisicoquimica I Resumen Para determinar la entalpía de disociación del ATP se realizaron procedimientos en un calorímetro ideal, con ayuda del software Virtual Chemistry Laboratory, en el que se llevó a cabo una reacción de 100 mL de ATP a 0,1 M, 0,2M y 0,3M, con distintas cantidades de volumen de Enzima 0,1µ𝑀, con la finalidad de establecer por medio de la calorimetría el valor de ∆𝑟𝐻 para la primera hidrólisis del ATP, el cual corresponde a -21,0 kJ/mol. Adicionalmente, se logró determinar la importancia de utilizar una enzima en la reacción para que finalmente, se pueda obtener una determinada cantidad de energía que posteriormente sea convertida en trabajo. Palabras claves: Adenosín trifosfato, entalpía de reacción, hidrólisis, energía libre de Gibbs. 1. Introducción El adenosín-5’-trifosfato o ATP es un compuesto orgánico que se encuentra conformado por grupos fosfato, adenina y azúcar ribosa como se observa en la figura 1. El ATP es una molécula que se encuentra en las células de todos los seres vivos y se la conoce como una molécula portadora de energía ya que su transformación a adenosín-5’-difosfato o ADP mediante una reacción de hidrólisis proporciona la energía necesaria para que diversos procesos bioquímicos tomen lugar en el organismo de los seres vivos. (Hernández, 2007). Figura 1. Estructura de adenosín trifosfato (ATP). El ATP es es inestable a ácidos, álcalis y al calor y a un pH de 7 el ATP en medio acuoso dona 4− protones al medio dando lugar al ion 𝐴𝑇𝑃 a partir del cual se da lugar a la primera hidrólisis del ATP en la cual uno de los grupos fosfato se separa de la molécula obteniendo como producto el ion de 3− ADP, 𝐴𝐷𝑃 (Hernández, 2007). La reacción de hidrólisis presenta una energía de activación lo suficientemente alta para que la reacción no sea cinéticamente favorable, y por lo 1 tanto,el papel de una enzima catalizadora en el medio de reacción es importante para que en la célula se genere la energía requerida en un intervalo de tiempo determinado, por ello la primera hidrólisis del ATP se puede representar por medio de la ecuación 1. 4− 𝐴𝑇𝑃(𝑎𝑐) + 𝐻2𝑂(𝑙) 3− 2− En la hidrólisis del ATP, el cambio en la energía libre de Gibbs en la reacción viene dado por la ecuación 6 según la termodinámica. + 𝐴𝐷𝑃(𝑎𝑐) + 𝐻𝑃𝑂4 (𝑎𝑐) + 𝐻(𝑎𝑐) Ecuación 1 Comúnmente para realizar estudios del funcionamiento de la hidrólisis en el ATP se hace uso de una enzima llamada glutamato (Figura 2a) y en un medio donde se encuentre presente amoniaco se libera un protón y un grupo hidroxilo dando lugar a la glutamina (Figura 2b). El grupo hidroxilo interactúa el enlace fosfoanhidro del 4− 𝐴𝑇𝑃 3− dando paso 𝐴𝐷𝑃 y la glutamina produce la hidrólisis del agua a partir de la cual se genera nuevamente amoniaco y glutamato. El su mecanismo catalítico se encuentra dado en forma general por la ecuación 2. (Referencia 3). Figura 2. a) Estructura glutamato, b) Estructura glutamina. 𝐺𝑙𝑢𝑡𝑎𝑚𝑎𝑡𝑜 + 𝑁𝐻3 + 𝐴𝑇𝑃 𝐺𝑙𝑢𝑡𝑎𝑚𝑖𝑛𝑎 + 𝐴𝐷𝑃 + 𝑃𝑖 𝐺𝑙𝑢𝑡𝑎𝑚𝑖𝑛𝑎 + 𝐻2𝑂 𝑁𝐻3 + 𝐺𝑙𝑢𝑡𝑎𝑚𝑎𝑡𝑜 El calor de reacción molar o entalpía de reacción molar para la hidrólisis se encuentra definida mediante la primera ley de la termodinámica a partir de la ecuación 3 donde q en un sistema con 𝐶𝑝 constante está dado por la ecuación 4 y el Tabla 1. Entalpía de reacción de la primera hidrólisis de 100 mL ATP 0,1M, pH=6,99 mL de 𝑇𝑖 (°C) 𝑇𝑓 (°C) ∆𝑇 (°C) 𝑞𝑟𝑒𝑎𝑐𝑐𝑖ó𝑛 Enzima kJ 1µ𝑀 𝑞𝑟𝑒𝑎𝑐𝑐𝑖ó𝑛 se puede obtener mediante la ecuación 5. ∆𝐻𝑟 = 𝑛𝐴𝑇𝑃 Ecuación 3 𝑞 = 𝐶𝑝∆𝑇 = 𝑚𝑠𝑝∆𝑇 Ecuación 4 𝑞𝑟𝑒𝑎𝑐𝑐𝑖ó𝑛 =− 𝑞𝑎𝑔𝑢𝑎 Ecuación 5 2. Metodología Para la determinación de la entalpía de reacción de la primera hidrólisis del ATP se realizaron 3 procedimientos en el software virtual Chemistry Laboratory. En un calorímetro aislado al entorno se agregaron 100 mL de ATP 0,1M y se le añadieron distintos valores de volúmen de solución de Enzima 1 µ𝑀, ambas disoluciones a una temperatura inicial de 25°C. Esto se realizó con el fin de registrar valores de temperaturas finales y calcular el calor liberado por la reacción para cada cantidad de enzima añadida al sistema. A partir de los valores de q obtenidos se llevó a cabo un análisis gráfico del calor de reacción en función de las moles de enzima añadida en donde se realizó el ajuste de los datos a un polinomio de grado cero, el cual es una constante dada por la intersección con el eje y, la cual sería el resultante del ajuste de los datos dados por el procedimiento mediante el método de los chi-cuadrados. Este valor obtenido se lo seleccionó como el calor de la reacción a partir del cual se hizo uso de la ecuación 3 para determinar la entalpía de reacción molar. El procedimiento anterior se repitió variando la concentración de ATP a 0,2M y 0,3M. 3. Resultados 3.1 Determinación de la entalpía molar para 0,1 M de ATP Ecuación 2 𝑞𝑝 Ecuación 6 ∆𝐺° = ∆𝐻° − 𝑇∆𝑆° 2 1 25,00 25,49 0,49 -0,207 2 25,00 25,49 0,49 -0,209 3 25,00 25,48 0,48 -0,207 4 25,00 25,48 0,48 -0,209 5 25,00 25,47 0,47 -0,206 6 25,00 25,47 0,47 -0,208 7 25,00 25,46 0,46 -0,206 8 25,00 25,46 0,46 -0,208 9 25,00 25,46 0,46 -0,210 10 25,00 25,45 0,45 -0,207 𝑞𝑟𝑒𝑎𝑐𝑐𝑖ó𝑛 𝑒𝑥𝑝𝑒𝑟𝑖𝑚𝑒𝑛𝑡𝑎𝑙 (kJ) -0,208 ∆𝑟 𝐻𝑒𝑥𝑝𝑒𝑟𝑖𝑚𝑒𝑛𝑡𝑎𝑙(kJ/mol) -20,8 ∆𝑟 𝐻𝑡𝑒ó𝑟𝑖𝑐𝑜(kJ/mol) -20, 1 Error porcentual E (%) 3,48 1 Figura 4. Calor liberado al mezclar enzima (1µ𝑀) con ATP 0,2 M 3.3 Determinación de la entalpía molar para 0,3 M de ATP Tabla 3. Entalpía de reacción de la primera hidrólisis de 100 mL ATP 0,3M, pH=6,99 mL de 𝑇𝑖 (°C) 𝑇𝑓 (°C) ∆𝑇 (°C) 𝑞𝑟𝑒𝑎𝑐𝑐𝑖ó𝑛 Enzima kJ 1µ𝑀 Figura 3. Calor liberado al mezclar enzima (1µ𝑀) con ATP 0,1 M 3.2 Determinación de la entalpía molar para 0,2 M de ATP Tabla 2. Entalpía de reacción de la primera hidrólisis de 100 mL ATP 0,2 M, pH=6,99 mL de 𝑇𝑖 (°C) 𝑇𝑓 (°C) ∆𝑇 (°C) 𝑞𝑟𝑒𝑎𝑐𝑐𝑖ó𝑛 Enzima kJ 1µ𝑀 1 25,00 26,49 1,49 -0,630 2 25,00 26,47 1,48 -0,632 3 25,00 26,46 1,46 -0,629 4 25,00 26,44 1,44 -0,627 5 25,00 26,43 1,43 -0,628 6 25,00 26,42 1,42 -0,630 7 25,00 26,4 1,4 -0,627 8 25,00 26,39 1,39 -0,628 9 25,00 26,38 1,38 -0,629 10 25,00 26,36 1,36 -0,626 1 25,00 25,99 0,99 -0,418 2 25,00 25,98 0,98 -0,418 𝑞𝑟𝑒𝑎𝑐𝑐𝑖ó𝑛 𝑒𝑥𝑝𝑒𝑟𝑖𝑚𝑒𝑛𝑡𝑎𝑙 (kJ) -0,629 3 25,00 25,97 0,97 -0,418 25,00 25,96 0,96 -0,418 ∆𝑟 𝐻𝑒𝑥𝑝𝑒𝑟𝑖𝑚𝑒𝑛𝑡𝑎𝑙(kJ/mol) -21,0 4 5 25,00 25,95 0,95 -0,417 ∆𝑟 𝐻𝑡𝑒ó𝑟𝑖𝑐𝑜(kJ/mol) -20,1 6 25,00 25,94 0,94 -0,417 Error porcentual E (%) 4,48 7 25,00 25,93 0,93 -0,416 8 25,00 25,92 0,92 -0,416 9 25,00 25,92 0,92 -0,420 10 25,00 25,91 0,91 -0,419 𝑞𝑟𝑒𝑎𝑐𝑐𝑖ó𝑛 𝑒𝑥𝑝𝑒𝑟𝑖𝑚𝑒𝑛𝑡𝑎𝑙 (kJ) -0,418 ∆𝑟 𝐻𝑒𝑥𝑝𝑒𝑟𝑖𝑚𝑒𝑛𝑡𝑎𝑙(kJ/mol) -20,9 ∆𝑟 𝐻𝑡𝑒ó𝑟𝑖𝑐𝑜(kJ/mol) -20,1 Error porcentual E (%) 3,98 3 Figura 5. Calor liberado al mezclar enzima (1µ𝑀) con ATP 0,2 M de iones al sistema, existirá un flujo de materia mayor desde reactivos a productos, generando así un gradiente de potencial químico, que va a fluir desde donde es mayor hacia donde es menor, en este caso, desde reactivos hacia productos, hasta alcanzar el equilibrio material y por ende el equilibrio termodinámico, es decir, que si se modifica la cantidad de iones reactivo, la cantidad de flujo de materia será mayor y por ende la cantidad de productos formados, por lo cual se produce un aumento discreto en el calor liberado en la reacción llevada a cabo para variación de concentración discretas de reactivo, y por se puede deducir que la constante de equilibrio en una relación de la actividad termodinámica del sistema. 4. Discusión A partir de los resultados obtenidos se puede afirmar que la reacción de hidrólisis de ATP es, como se esperaba, una reacción de tipo exotérmico, en la cual energía en forma de calor ha sido liberada al entorno, tal como ocurre en los sistemas biológicos. Se debe tener en cuenta que la reacción estudiada de hidrólisis no es completa, esta presenta equilibrios de reacción en los cuales se libera una cantidad de energía en forma de calor en el momento en que se forma ADP, pero al mismo tiempo, una vez formado, este reacciona en el sistema para producir nuevamente el reactivo ATP mediante una reacción de fosforilación donde debido a que la reacción se lleva a cabo en dirección opuesta, convirtiéndose en una reacción endotérmica, es necesaria una cierta cantidad de energía para que pueda ocurrir nuevamente la síntesis de la molécula de ATP, teniendo así un tipo de ciclo que se va a estar repitiendo dependiendo de cuando se consuma y a la vez se necesite energía hasta alcanzar el equilibrio termodinámico en donde se obtiene finalmente que un calor de reacción final oscila entre -20,8 kJ/mol y -21,0 kJ/mol los cuales difieren del valor teórico desde el 3,5 % hasta el 4,5 %. La diferencia entre los valores obtenidos experimentalmente de entalpía de reacción molar a diferentes concentraciones de ATP se debe a la variación de la fuerza iónica (I) del sistema de solución inicial. Ya que la fuerza iónica es proporcional a la concentración de iones en el sistema, al tener una concentración 0,1M de ATP el sistema presenta menor fuerza iónica en comparación al sistema en donde se tiene una concentración 0,3M de ATP. A partir de lo cual se puede afirmar, en base a los resultados de entalpía de reacción en donde la entalpía de reacción es de menor magnitud para baja fuerza iónica del sistema y de mayor magnitud para valores mayores de fuerza iónica, que la entalpía es proporcional a la fuerza iónica del sistema para la hidrólisis de ATP. Si entre mayor es la concentración de ATP en el sistema, mayor será la fuerza iónica en donde la cantidad de iones reactivos presentes en el medio para que se de lugar la reacción aumenta modificando de esta forma su constante de equilibrio. Básicamente, se puede trabajar este fenómeno, similar al principio de Le’ Chatelier, es decir, si se añaden más moles Si el cambio de energía total de un sistema de reacción se determina mediante los enlaces formados y disociados en el proceso de reacción el ∆𝐸 resultante será de gran magnitud en comparación al calor de reacción molar a determinado. ∆𝐸 = 𝐵𝐸𝑓𝑜𝑟𝑚𝑎𝑑𝑎[𝑃 − 𝑂] − 𝐵𝐸𝑑𝑖𝑠𝑜𝑐𝑖𝑎𝑑𝑜𝑠[𝑃 − 𝑂 + 𝑂 − 𝐻] ∆𝐸 = (− 381 𝑘𝐽/𝑚𝑜𝑙) − [(351 𝑘𝐽/𝑚𝑜𝑙) + (467 𝑘𝐽/𝑚𝑜𝑙)] ∆𝐸 =− 1169 𝑘𝐽/𝑚𝑜𝑙 Esta diferencia de magnitudes se debe a que la energía vibracional, rotacional y traslacional de las moléculas después de su disociación disminuye al producirse moléculas mucho más pequeñas o con menor cantidad de átomos en su composición, debido a la lo cual, la energía cinética total de los reactivos difiere de la de los productos y por lo tanto, si la entalpía de reacción depende directamente del cambio de energía interna del sistema y la energía interna del sistema depende directamente de la energía cinética de las moléculas entonces, la entalpía de reacción o calor liberado en el proceso de transformación determinado experimentalmente no es comparable con el cambio de energía determinado a partir de los enlaces involucrados en el proceso de reacción. La energía liberada por el rompimiento que hay entre el fósforo y oxígeno (enlace fosfoanhidrido), es de gran magnitud ya que son considerados “enlaces de alta energía” lo cual es directamente involucrado con diferentes factores, y uno de los más importantes es la repulsión que existe en los 4− oxígenos del 𝐴𝑇𝑃 , ya que en ellos reposan cargas negativas que están sintiendo una fuerte 4 repulsión entre sí según la Ley de Coulomb por lo cuál la molécula es inestable. Al presentarse la disociación; se libera una cantidad alta de energía debido a la fuerte repulsión que existía al inicio, por lo que entonces una vez se tengan los productos, estos van a tener la tendencia a alejarse en una determinada distancia, y es este el motivo por el que se debe suministrar una gran cantidad de energía para poder obtener nuevamente adenosintrifosfato. Por otro lado, para que la reacción de hidrólisis tome lugar en el sistema es imprescindible la presencia de una enzima, que en este caso, se realizó la suposición de que la enzima trabajada era la enzima glutamato, la cual actúa como catalizador, debido a que según Voet G. (2004, p.586): “la mayoría de los enlaces de tipo anhídrido, se logran hidrolizar de manera rápida en solución acuosa, pero un caso especial es que los enlaces fosfoanhidrido poseen energías libres de activación grandes”, por lo tanto, es necesario una sustancia que ayude a disminuir la energía de activación y pueda darse la hidrólisis del enlace, en este caso mediante el mecanismo expuesto en la ecuación 2. Una vez ocurrido esto, se libera una cantidad de energía en forma de calor la cual como ya se conoce toma un valor negativo, debido a que la energía liberada cuando se forman los enlaces entre el oxígeno y el hidrógeno en el ión fosfato y entre el grupo OH y el ADP es mayor que la energía requerida para romper el enlace entre un atomo de hidrogeno y oxigeno en 𝐻2𝑂 y el enlace reacción de hidrólisis del ATP es exergónica, espontánea, y exotérmica lo que va de acuerdo con lo ya establecido en en la literatura. 5. Conclusiones ● La enzima glutamato reduce la energía de activación necesaria para iniciar la reacción de hidrólisis uniéndose temporalmente a la molécula de ATP y así ayudar a superar la repulsión de cargas que se produce entre el grupo fosfato y el oxígeno perteneciente al 𝐻2𝑂 ● ● ● ● ● entre los grupos fosfatos en el ATP. Según Gajewski, E., Steckler, D., Goldberg, R (1986) se puede establecer que “se rompen y se forman dos enlaces, pero los enlaces que se rompen son más inestables que los enlaces formados, es por esto que la energía liberada es mayor”, además se puede lograr deducir que el sistema presenta un valor de entalpía meyor a cero, ya que como se observa en la ecuación 1 inicialmente se encuentra presente únicamente dos compuestos donde pasado un determinado tiempo de reacción se obtienen los tres productos, logrando deducir por lo tanto, que la entropía en este sistema aumenta cuando se da la reacción directa, ya que los microestados de energía permitidos aumentan en el proceso de reacción, y por ello aumenta la entropía. Entonces, si se observa la ecuación 6, al presentar una entalpía de tipo exotérmica y una entropía positiva, la energía libre, por lo tanto, es negativa y por ende se logra demostrar que la El adenosín trifosfato se la conoce como la moneda energética y proporciona la energía para la mayoría de los procesos biológicos, convirtiéndose en ADP. La síntesis de ATP, se da de manera contínua ya que debido a diversos métodos como la respiración, reacciones y demás, se está sintetizando y consumiendo ATP, es decir, su producción es ilimitada hasta que el ser vivo muera. La termodinámica con ayuda de la primera y segunda ley, permite entender los motivos por los cuales los seres vivos pueden desarrollar diferentes procesos metabólicos y vitales. La constante de equilibrio de una reacción se la puede considerar como una relación que determina la actividad termodinámica de un sistema. La energía libre dada por la hidrólisis del ATP es la magnitud que permite afirmar que a partir de la energía liberada los organismos vivos realizan trabajo dando lugar a todos los procesos metabólicos necesarios para la conservación de la vida. 6. Referencias Donal Voet, J. V. (2004). Bioquímica (m. Panamericana, Ed.). University of Pennsylvania. Gajewski, E., Steckler, D. K., & Goldberg, R. N. (1986). Thermodynamics of the hydrolysis of adenosine 5'-triphosphate to adenosine 5'-diphosphate. The Journal of biological chemistry, 261(27), 12733–12737. Hernández, R. (2007). EL ATP COMO FUENTE DE ENERGÍA CELULAR. Ciencias forestales y ambientales Universidad de los Andes. Retrieved 22-10-2021 from http://www.forest.ula.ve/~rubenhg/atp/ 5 Subramanian, S. (2019). Mecanismo de ATPasa. News Medical. Retrieved 22 de Octubre from https://www.news-medical.net/life-sciences/Mech anism-of-ATPase.aspx 6