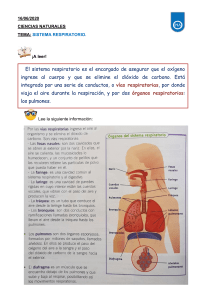
1. SISTEMA RESPIRATORIO:
1.1. MECÁNICA DE LA VENTILACIÓN PULMONAR:
La respiración externa es la principal función del sistema respiratorio, esta se define como el
proceso fisiológico por medio del cual los organismos vivos toman oxígeno del medio
circundante (oxigenación) y desprenden dióxido de carbono hacia el mismo (ventilación).
Este proceso fisiológico de intercambio de gases entre la atmósfera y el ser vivo requiere de la
interacción armoniosa de todos los componentes que hacen parte del sistema respiratorio:
pulmones, sistema nervioso central, vasos pulmonares, vía aérea superior e inferior, caja
torácica y músculos. Finalmente, el sistema respiratorio interacciona con el sistema
cardiovascular para el transporte de estos gases hacia y desde la célula. De esta manera se
obtiene y transporta el oxígeno necesario para la producción de energía a nivel mitocondrial y
se remueve el dióxido de carbono producto del metabolismo celular.
1.1.1. COMPONENTES DEL SISTEMA RESPIRATORIO:
El sistema respiratorio está constituido por 5 componentes: pulmones, sistema nervioso
central, vasos pulmonares, vía aérea superior e inferior, caja torácica y componente músculoesquelético. A continuación se hace una descripción de cada uno de ellos haciendo énfasis en el
papel que desempeñan durante los procesos de oxigenación y ventilación.
1.1.1.1. VÍAS AÉREAS:
La función principal de las vías aéreas es la conducción de gases entre la atmósfera y los
alvéolos pulmonares. Fisiológicamente, las vías aéreas se dividen en una zona de conducción
denominada espacio muerto donde no hay intercambio gaseoso y en otra denominada zona
de intercambio. En la primera se cumplen funciones importantes como olfación, fonación y
adecuación de los gases inspirados. La zona de intercambio está conformada por los
bronquíolos respiratorios, los conductos alveolares y el alvéolo pulmonar. En esta zona es
posible el intercambio de oxígeno y de CO2 entre la sangre capilar pulmonar y el espacio aéreo.
A medida que la vía aérea avanza hacia el alvéolo se divide de manera dicotómica dando origen
a ramas que se enumeran en términos de generaciones, siendo la generación cero la tráquea y la
generación 23 el saco alveolar. La zona de intercambio está conformada por los bronquíolos
respiratorios (generación 17 a 19), los conductos alveolares (generación 20 a 22) y el alvéolo
pulmonar (generación 23 en adelante). En esta zona es posible el intercambio de oxígeno y de
CO2 entre la sangre capilar pulmonar y el espacio aéreo. Estas estructuras ofrecen una baja
resistencia al paso de aire y brindan una amplia y extensa superficie para la difusión de los gases
(50 a 100 m2).
Al multiplicar cada uno de estos tres volúmenes por la frecuencia respiratoria en un minuto se
obtiene respectivamente, la ventilación minuto, la ventilación del espacio muerto
anatómico y la ventilación alveolar. Finalmente, es conveniente aclarar que en algunas
circunstancias algunos segmentos de la zona de intercambio no pueden participar del
intercambio gaseoso por presencia de alvéolos no funcionales o por disminución de su flujo
sanguíneo. Por tanto, desde un punto de vista funcional, estos alvéolos deben considerarse
como espacio muerto. Cuando el espacio muerto alveolar se incluye dentro del espacio muerto
anatómico se denomina espacio muerto fisiológico.
Las vías aéreas dependen de un tono adecuado del músculo liso bronquial para que la
resistencia al flujo de gases sea baja. Este tono resulta de la interacción de los sistemas
nerviosos simpático y parasimpático; de manera que, el estímulo de los receptores B2
simpáticos en la vía aérea produce broncodilatación con disminución de la resistencia y el
estímulo parasimpático por medio de receptores colinérgicos (o el antagonismo de los
receptores B2 simpáticos) genera broncoconstricción y aumento de la resistencia al flujo de los
gases.
1.1.1.2.
PULMÓN:
El pulmón es un órgano que tiene la función de permitir que un volumen determinado de aire
se ponga en contacto de manera transitoria e intermitente con la superficie de intercambio
gaseoso. Para cumplir con esta función el pulmón posee dos características fundamentales:
Una gran facilidad para deformarse (distensibilidad) y una gran capacidad para recuperar su
forma inicial (elasticidad). En virtud de estas dos características y por acción de los músculos
inspiratorios, el pulmón permite que un volumen determinado de aire lo distienda, entrando
desde la atmósfera hasta el alvéolo para ponerse en contacto con la superficie de intercambio
gaseoso. Luego, al suspenderse el estímulo inspiratorio y gracias a sus propiedades elásticas, el
pulmón recupera su forma inicial expulsando el aire que lo distendía hacia la atmósfera. Éste
fenómeno de entrada y salida de aire conforman el ciclo respiratorio o el ciclo de inspiraciónespiración que se repite alrededor de 12 a 16 veces cada minuto en el sujeto adulto normal.
La distensibilidad pulmonar está determinada por tres factores principales: primero por el
volumen pulmonar, siendo inversamente proporcional a éste, es decir, entre más volumen
tenga el pulmón más difícil será expandirlo y viceversa; segundo, por la presencia del
surfactante pulmonar que logra disminuir la tensión superficial en el interior del alvéolo y de
esta manera evita la tendencia natural de éste hacia el colapso; y finalmente, por la disposición
geométrica de las fibras de elastina.
1.1.1.3.
CIRCULACIÓN PULMONAR.
Los pulmones tienen doble circulación: la bronquial y la pulmonar. La primera representa el
1% del gasto cardiaco y se origina en las arterias intercostales o directamente en la aorta por
ello hace parte de la circulación sistémica originada en el corazón izquierdo e irriga al árbol
traqueobronquial hasta el nivel de los bronquios respiratorios (generación 16). Además origina
los vasa vasorum de las arterias pulmonares. Hecho importante debido a que la tensión arterial
de oxígeno en éstos vasa vasorum es responsable en parte del tono arterial pulmonar,
produciendo vasoconstricción por hipoxia moderda y vasodilatación pulmonar ante hipoxemia
severa. A partir de la generación 17 en adelante, cada pulmón es irrigado por la circulación
pulmonar a través de las arterias pulmonares derecha e izquierda que reciben la toda la sangre
del corazón derecho.
El drenaje venoso de los bronquios principales se realiza hacia las venas ázigos, hemiázigos y
mediastinal. Los bronquios distales y el parénquima pulmonar drena su sangre a través de las
venas pulmonares hacia la aurícula izquierda.
La circulación pulmonar tiene las siguientes funciones: Primero, transporta la sangre
desoxigenada desde el corazón derecho hasta el sitio de intercambio gaseoso a través de las
arterias pulmonares. Segundo, produce una rica red capilar alrededor de los alvéolos lo que
resulta en una amplia superficie de intercambio gaseoso. Y tercero, conduce la sangre
oxigenada al corazón izquierdo por medio de cuatro venas pulmonares principales.
Por último, cabe resaltar el efecto gravitacional sobre el flujo sanguíneo del pulmón, el cual
resulta en una mayor perfusión de las áreas basales o declives pulmonares y una menor
irrigación de las áreas superiores o apicales. Este fenómeno tiene relevancia al observar que la
distribución del flujo de aire en el pulmón sigue el mismo patrón, siendo mayor en las áreas
declives y menor en las apicales lo que permite un acople excelente entre la ventilación y la
perfusión pulmonar.
1.1.1.4. SISTEMA NERVIOSO CENTRAL Y PERIFÉRICO:
El sistema nervioso central y periférico cumple con varias funciones: genera y transmite el
estimulo para que se produzca la contracción de los músculos respiratorios, regula la frecuencia
e intensidad de la contracción de éstos y regula el tono de los músculos lisos en la vía aérea y
en los vasos pulmonares.
El estímulo para la respiración se genera en el centro respiratorio que está conformado por
tres grupos de neuronas a cada lado del tallo cerebral. Estos son: el grupo respiratorio dorsal
que emite señales inspiratorias rítmicas, el centro neumotáxico que determina la frecuencia
respiratoria al permitir una mayor o menor duración de la inspiración y el grupo respiratorio
ventral que puede producir inspiración o espiración según las neuronas que sean estimuladas y
que cobra importancia cuando se requiere aumentar la ventilación pulmonar.
Existe un cuarto grupo de neuronas que conforman el centro apnéusico cuya función es
perpetuar el estímulo inspiratorio en cuyo caso los pulmones se llenan de aire casi por
completo apareciendo breves y esporádicos jadeos espiratorios. Sin embargo, en condiciones
normales el centro apnéusico es inhibido por el centro neumotáxico y sólo regula la
profundidad de la inspiración.
Además, existe un área quimiosensible situada en la superficie ventral del bulbo raquídeo que
responde a cambios tanto de la presión de dióxido de carbono como de la concentración de
hidrogeniones. Estas neuronas son mucho más sensibles a los iones hidrógeno que al dióxido
de carbono, sin embargo, el hidrógeno difunde poco a través de la barrera hematoencefálica y
por eso el dióxido de carbono se constituye en el principal estímulo químico de ésta área.
Finalmente, existe un control periférico de la respiración ejercido por el oxígeno a través de
receptores quimiosensibles localizados en los cuerpos carotìdeos y aórticos. Los cambios en la
presión arterial de oxígeno son censados en dichos quimiorreceptores y ésta información es
enviada a través de los nervios vago e hipogloso hacia el centro respiratorio para aumentar la
ventilación pulmonar.
El sistema nervioso también participa en el control del tono del músculo liso bronquial para
que la resistencia al flujo de gases sea baja. Este tono resulta de la interacción de los sistemas
nerviosos simpático y parasimpático; en consonancia, el estímulo de los receptores B2
simpáticos en la vía aérea produce bronco dilatación con disminución de la resistencia y el
estímulo parasimpático por medio de receptores colinérgicos (o el antagonismo de los
receptores B2 simpáticos) genera bronco constricción y aumento de la resistencia al flujo de los
gases.
1.1.1.5. COMPONENTE MÚSCULO ESQUELÉTICO:
El componente músculo esquelético tiene la función de generar un gradiente de presión entre
la atmósfera y el alvéolo lo que permite la entrada y salida de gases; este gradiente de presión se
genera por la contracción muscular. En condiciones de reposo, existen dos fuerzas opuestas en
el sistema respiratorio, una generada por la retracción elástica del pulmón que tiende hacia el
colapso del pulmón y otra generada en la caja torácica que intenta expandirlo. Estas dos
fuerzas encuentran su equilibrio cuando termina la espiración normal no forzada, es decir,
cuando el pulmón está en su capacidad funcional residual. Los músculos inspiratorios se
encargan de romper este equilibrio, aumentando la fuerza que se opone al retroceso elástico del
pulmón haciendo que éste se expanda.
El músculo inspiratorio más importante es el diafragma, al contraerse, el diafragma desplaza el
contenido abdominal en sentido caudal y, en consecuencia, el diámetro vertical de la caja
torácica aumenta. Además, los bordes de las costillas se levantan y se desplazan hacia fuera,
haciendo que también aumente el diámetro transversal del tórax. Los músculos inspiratorios
que le siguen en importancia son los intercostales externos que cuando se contraen, desplazan
las costillas hacia arriba y adelante, aumentando los diámetros lateral y anteroposterior del
tórax. Los músculos accesorios de la inspiración sólo participan cuando se requiere
complementar la acción de los primeros. Estos músculos comprenden los escalenos que elevan
las dos primeras costillas y los esternocleidomastoideos que elevan el esternón.
En conclusión, las fuerzas de contracción muscular logran cambiar las dimensiones de la caja
torácica expandiéndola. Al expandirse, se genera una fuerza de distensión que se transmite a
través del parénquima pulmonar hasta el alvéolo donde la presión cae por debajo de la presión
atmosférica, generándose de esta manera una diferencia de presión suficiente para vencer la
resistencia al flujo de aire en la vía aérea y permitir la entrada de gases hasta el alvéolo.
Finalmente, cuando los músculos entran en reposo y predomina el retroceso elástico del
pulmón, la presión intraalveolar será superior a la atmosférica y habrá salida de gases hacia la
atmósfera.
1.1.2.
INTERACCIÓN
DE
LOS
RESPIRATORIO: FLUJO DE AIRE.
COMPONENTES
DEL
SISTEMA
Como se mencionó al principio, la función principal del sistema es la respiración externa; esto
es, el intercambio de oxígeno y dióxido de carbono entre la sangre y la atmósfera denominados
oxigenación y ventilación respectivamente. Sin embargo, para que esto suceda debe generarse
una diferencia de presión entre la atmósfera y el alvéolo. Así, durante la inspiración la presión
alveolar debe ser menor que la presión atmosférica para permitir la entrada de aire, lo cual se
logra a través de un proceso activo de contracción muscular. Por el contrario, durante la
espiración, la presión alveolar debe ser superior a la atmosférica para posibilitar la salida del
gas, este proceso es pasivo y se realiza por medio de la retracción elástica del pulmón.
Como punto de partida hay que tener en cuenta cuatro aspectos fundamentales: Primero, los
gases fluyen desde un sitio de mayor presión a otro con menor presión. Segundo, en estado de
reposo al abrir la boca, la presión en el alvéolo será igual a la presión atmosférica y por tanto,
no existirá diferencia de presión para el flujo de aire. Tercero, el alvéolo por si mismo no puede
expandirse, requiere la ayuda externa de los músculos inspiratorios. Cuarto, la expansión
alveolar hace caer la presión en su interior por debajo de la atmosférica permitiendo el flujo de
gas (ley de Boyle). A continuación se describen los fenómenos que explican las diferencias de
presión entre alvéolo y atmósfera durante el ciclo respiratorio y que son el resultado de la
interacción de cada uno de los componentes del sistema.
El pulmón es una estructura elástica; de ahí que, si no existieran fuerzas que lo mantengan
distendido este colapsa como un globo y elimina todo su aire a través de la tráquea. Por otra
parte, al no existir uniones entre el pulmón y las paredes de la caja torácica, este flota en la
cavidad torácica rodeado por una fina capa de líquido pleural que lubrica sus movimientos.
Este líquido pleural es bombeado continuamente por los linfáticos, lo que genera una fuerza de
succión entre las dos hojas pleurales (hoja visceral pulmonar y hoja parietal de la cavidad
torácica) del orden de -5 cm de agua (lleva el signo menos por tratarse de una presión inferior a
la atmosférica). Esta fuerza de succión hace que el pulmón esté en permanente contacto con la
pared torácica cuando ésta se expande o se contrae. No obstante, West propone que la presión
negativa intrapleural es el resultado de dos fuerzas que se oponen, la de la caja toráxica que
ejerce presión hacia fuera y la del pulmón que ejerce presión hacia adentro.
Como ya se ha descrito, existe normalmente una ligera succión que produce una presión
negativa con un valor de -5 cm de agua suficiente para mantener los pulmones abiertos en su
posición de reposo (capacidad funcional residual). Luego, durante la inspiración normal, la
expansión de la caja torácica tracciona de la superficie de los pulmones con una fuerza mayor
que produce una presión negativa de -7,5 cm de agua. Esta ganancia de presión negativa del
orden de -2,5 cm es transmitida a través de todo el parénquima pulmonar (presión
transpulmonar). Por fenómenos físicos esta presión es de -1 cm de H2O en el alvéolo, la
cual es suficiente para producir la entrada de 500 ml de aire en cada inspiración. Después,
durante la espiración el proceso se invierte; es decir, el retroceso elástico condiciona que la
presión alveolar sea mayor que la atmosférica; en consecuencia, el flujo de aire sale del alveolo
a la atmósfera.
Ley de Boyle: A temperatura constante, la presión (P) de un gas varía inversamente con el
volumen (V) o P1V1 = P2V2.
Considere dos recipientes de diferente tamaño a los cuales se les introdujo una cantidad igual
del mismo gas. En el recipiente más grande las moléculas del gas estarán más dispersas y
distanciadas unas de las otras generando menor presión sobre las paredes del recipiente. En el
recipiente más pequeño, las moléculas estarán mucho más juntas aumentando la velocidad de
colisión sobre las paredes del recipiente lo que produce el aumento de presión en su interior.
Ahora imagine que el recipiente es el alvéolo durante la inspiración (recipiente grande) y
durante la espiración (recipiente pequeño). En el primer caso, las moléculas contenidas en el
alvéolo estarán más dispersas, disminuyendo la presión dentro del mismo hasta niveles
subatmosféricos y, por diferencia de presiones, el gas viajará desde el sitio de mayor presión al
de menor presión, es decir, desde la atmósfera hasta el alvéolo. En el segundo caso, el volumen
alveolar reducido por el retroceso elástico del pulmón durante la espiración hace que las
moléculas de gas dentro del alvéolo estén más juntas. El aumento de presión intraalveolar
resultante expulsa al gas hacia la atmósfera.
A continuación se resumen la serie de eventos que se producen en el sistema respiratorio
durante cada ciclo de inspiración – espiración.
Tabla Eventos involucrados en una respiración normal (interacciones). Los pasos 4 a 8 (*) de la inspiración
ocurren simultáneamente; y los pasos 3 a 5 de la expiración ocurren simultáneamente.
Inspiración
1.
2.
3.
4.
5.
6.
7.
8.
9.
El cerebro inicia el comando inspiratorio.
Los nervios transmiten el impulso a los músculos inspiratorios.
El diafragma (y los músculos intercostales externos) se contraen.
El volumen torácico se aumenta cuando la pared torácica se expande.(*)
La presión pleural cae a valores más negativos.(*)
La diferencia de presión entre la pleura y el alvéolo aumenta.(*)
Los alvéolos pulmonares se expanden en respuesta al aumento de esta diferencia.(*)
La presión alveolar cae por debajo de la presión atmosférica cuando aumenta el volumen alveolar, entonces establece un gradiente
de presión para la entrada de aire.(*)
El aire entra al alvéolo hasta cuando la presión alveolar nuevamente se equilibra con la presión atmosférica.
Espiración
1.
2.
3.
4.
5.
6.
El cerebro cesa el comando inspiratorio.
Los músculos inspiratorios se relajan.
El volumen torácico disminuye al hacerse menos negativa la presión pleural,(*)
Disminuye la diferencia de presión entre pleura y alvéolo, lo que permite un aumento del retroceso elástico retornando el alvéolo a
sus volúmenes preinspiratorios.(*)
La disminución del volumen alveolar aumenta la presión alveolar por encima de la presión atmosférica, entonces establece un
gradiente de presión para la salida de aire.(*)
El aire sale del alvéolo hasta cuando la presión alveolar se equilibra con la presión atmosférica.
1.1.3. PROPIEDADES EMERGENTES DEL SISTEMA RESPIRATORIO:
El resultado final de las interacciones de cada uno de los componentes del sistema respiratorio
o propiedades emergentes más importantes de éste, son la oxigenación y la ventilación (el
equilibrio ácido básico es otra propiedad emergente).
Todos los componentes del sistema pulmonar interactúan con la finalidad de permitir la
entrada de oxígeno de la atmósfera, la entrega de este al sistema cardiovascular para que lo
transporte a la célula y la eliminación del dióxido de carbono producto del metabolismo
celular a la atmosfera. Atrás analizamos que para cumplir con esta función el sistema
respiratorio debe establecer una diferencia de presión entre el alvéolo y la atmósfera, y lo hace
en condiciones normales disminuyendo la presión alveolar a niveles infra-atmosféricos.
A continuación se describe en detalle y de manera separa los procesos de oxigenación y
ventilación.
1.1.3.1. OXIGENACIÓN GLOBAL: UN VIAJE HASTA LA MITOCONDRIA.
La oxigenación pulmonar es una de las propiedades emergente del sistema respiratorio; es
decir, es una propiedad que “emerge cuando todos sus componentes interactúan”. Esta puede
definirse como todos los procesos químicos y físicos implicados en la entrega de oxigeno a la
célula, para ello, el sistema debe generar un gradiente de oxigeno entre el alvéolo y la sangre de
los capilares para permitir la entrada de oxigeno desde el alvéolo a la sangre (hematosis). El
oxigeno que difunde a través de la membrana alvéolo capilar es transportado a la célula por la
hemoglobina y el sistema cardiovascular para que ocurra la oxigenación celular. Cuando
hablamos de oxigenación global nos referimos tanto a la oxigenación pulmonar y celular como
a los mecanismos implicados en el transporte de oxigeno desde la atmósfera hasta la célula.
Este proceso es denominado por algunos autores como “la cascada del oxigeno”. Algunos
autores denominan la oxigenación pulmonar y la oxigenación celular como respiración externa
y respiración interna respectivamente.
Los organismos unicelulares (de los reinos Protistas y Móneras) están en contacto directo con
su medio externo y en la mayoría este es agua oceánica. Parece ser que por esto no tienen
mecanismos respiratorios especializados sino que realizan el intercambio de oxígeno y dióxido
de carbono por difusión a través de la membrana celular. La presión de oxígeno en el interior
del organismo es menor que la del medio exterior (aéreo o acuático), mientras que la presión
de dióxido de carbono es mayor. Como resultado, el oxígeno penetra en el organismo por
difusión (a favor del gradiente de presiones) y el dióxido de carbono sale por el mismo sistema.
La respiración de las plantas y las esponjas utiliza un mecanismo muy parecido.
Pero, en los seres multicelulares como el hombre, las células están alejadas del medio externo
rico en oxígeno y por ello, la evolución ha dotado a estos organismos de sistemas capaces de
transportar este gas desde la atmósfera hasta la célula, éstos son los sistemas respiratorio y
cardiovascular. Sin embargo, la descripción anterior resulta demasiado simplista para entender
todo el fenómeno. Se trata de un proceso que inicia en la atmósfera, donde el oxigeno esta
regido por las leyes de los gases, continúa a nivel alveolar donde debe mezclarse con el vapor
de agua y el dióxido de carbono; luego el oxígeno debe atravesar la barrera alvéolo capilar
cuyas características también determinan la facilidad del tránsito a través suyo, posteriormente
debe viajar disuelto en la sangre y unido a la hemoglobina impulsado por la fuerza del corazón
en cada contracción y finalmente debe atravesar la membrana celular para ser utilizado por la
mitocondria en la síntesis de ATP. Todo este proceso esta regido por un principio común: la
difusión del oxígeno desde un sitio de mayor presión hasta uno de menor presión. Así, la
presión de oxígeno irá disminuyendo progresivamente en su recorrido desde la atmósfera hasta
la mitocondria. En los siguientes párrafos se hará una descripción detallada de cada uno de los
acontecimientos durante el viaje de una molécula de oxígeno desde la atmósfera hasta la
mitocondria.
1.1.3.1.1. EL OXÍGENO EN EL GAS ATMOSFÉRICO:
La atmósfera terrestre está compuesta por moléculas de gas que tienen masa y son atraídas
hacia el centro de la tierra por la gravedad. En la superficie terrestre y a nivel del mar, las
moléculas de gas atmosférico ejercen una presión suficiente para elevar una columna de
mercurio a 760 mm de altura. Esta es la presión atmosférica a nivel del mar.
La presión atmosférica total resulta de la suma de las presiones individuales de cada uno de los
gases que conforman la atmósfera. Este fenómeno se entiende a través de la ley de Dalton que
establece que en una mezcla de gases la presión total es igual a la suma de las presiones
parciales de cada componente de la mezcla. El aire ambiente (aire atmosférico) es una mezcla
de gases compuesta de un 20,84% de Oxígeno, un 78,62% de Nitrógeno, 0,04% de dióxido de
carbono y un 0.5% de vapor de agua. La concentración de vapor de agua y de dióxido de
carbono es tan baja que se desprecian, de manera que podemos considerar la composición
atmosférica como 21% de Oxígeno y 79% de Nitrógeno. Si aplicamos la ley de Dalton a las
moléculas que componen la atmósfera encontramos que la presión parcial de oxígeno al nivel
del mar será el 21% de 760 mm Hg, es decir, 159,6 mm Hg y la presión parcial de Nitrógeno el
79% de 760 mm Hg, o sea, 600,4 mm Hg. Para fines prácticos seguiremos trabajando con los
valores aproximados de estos resultados, 160 mm de Hg para el Oxígeno y 600 mm Hg para el
Nitrógeno. Observe que la suma de las presiones parciales de estos dos gases es igual a la
presión atmosférica total.
A medida que se asciende por arriba del nivel del mar, la columna de aire por encima de la
superficie terrestre será más pequeña y la presión atmosférica resultante será menor (las
presiones parciales de los gases atmosféricos descenderán de manera proporcional). Así, la
presión atmosférica y la presión parcial de oxígeno pasarán de 760 mm Hg y 160 mm Hg a
nivel del mar a 674 mm Hg y 141 mm Hg a los 1000 metros, 405 mm Hg y 85 mm Hg a los
5000 metros y a 198 mm Hg y 41 mm Hg a los 10.000 metros por encima del nivel del mar,
respectivamente. Note la importante caída que sufre la presión parcial de oxigeno cuando
pasamos desde el nivel del mar hasta los 5000 metros de altura. En estas condiciones, la
disponibilidad de oxígeno es menor y el sistema respiratorio y cardiovascular tendrán que
adaptarse para trabajar en una situación desfavorable. Recuerde que la entrada de gas es un
fenómeno que obedece a la diferencia de presiones entre la atmósfera y el alvéolo, por lo tanto,
la caída de la presión parcial de oxígeno con la altura hace que ingrese menos cantidad del
mismo al alvéolo con cada inspiración; esto se compensa en condiciones normales aumentado
la frecuencia respiratoria.
Cuando se administra oxígeno al 100% con fines terapéuticos, cambiamos la composición de la
atmósfera que respira el paciente, y entonces, la presión de Oxígeno inspirado será de 760 mm
Hg (a nivel del mar). Esto aumentará el gradiente de presiones para la difusión de oxígeno
desde el alvéolo hasta la sangre, explicando su efecto terapéutico en algunas circunstancias de
hipoxia.
1.1.3.1.2. EL OXÍGENO EN EL GAS ALVEOLAR:
Como vimos, el gas atmosférico es pobre en vapor de agua y dióxido de carbono, sin embargo,
en su trayecto desde el medio ambiente hasta el alvéolo se mezclará con los gases que
normalmente se encuentran en las vías aéreas: vapor de agua y dióxido de carbono. A pesar de
ello, la presión del gas alveolar será siempre igual a la presión atmosférica, es decir, 760 mm de
Hg si nos encontramos a nivel del mar o 405 mm Hg a los 5000 metros de altitud.
La ganancia de vapor de agua en el gas alveolar se debe a la humidificación del aire seco
durante su tránsito por las vías aéreas superiores, alcanzando una presión de 47 mm Hg a nivel
alveolar. Por otro lado, el aumento en la presión de dióxido de carbono se explica por su paso
desde la sangre hacia el alvéolo a favor de su gradiente de presión; Debido a su alta solubilidad
la presión de dióxido de carbono en el aire alveolar (PACO2) se equilibra rápidamente con la
sanguínea (PaCO2). Así, PACO2 = PaCO2. El valor normal de ambas presiones a nivel del mar
es de 40 mm Hg.
Debido a que la presión de una mezcla de gas es igual a la sumatoria de las presiones de los
gases que lo conforma (ley de Dalton) y teniendo en cuenta que la presión atmosférica y
alveolar son iguales, la aparición de vapor de agua y dióxido de carbono en el gas alveolar
determinan una disminución en la presión de oxígeno a dicho nivel (ver tabla). Por lo tanto, la
difusión de oxígeno entre el alvéolo y la sangre se establece por la presión que este gas ejerce
en el alvéolo y no en la atmósfera.
Para calcular la presión alveolar de oxígeno (PAO2) se agrupan los factores que la determinan
en la siguiente ecuación:
PAO2 = (PB – PH2O) x FIO2 – PaCO2.
Donde PAO2 es la presión alveolar de oxígeno, PB la presión atmosférica, PH2O, la presión de
vapor de agua en el alvéolo, FIO2 la fracción de oxígeno en el gas inspirado y PaCO2 la presión
arterial de dióxido de carbono
Así, a nivel del mar el valor de la PACO2 es:
PAO2 = (760 – 47) x 0,21 – 40, es decir: 109,7 mm Hg.
Si el paciente está respirando oxígeno al 100%, entonces:
PAO2 = (760 - 47) x 1 – 40, es decir: 673 mm Hg.
En realidad, el gas alveolar no se renueva completamente con cada inspiración; es decir, lo
hace de una manera gradual y progresiva. Esto se explica porque el aire que ingresa durante la
inspiración hasta la zona de intercambio gaseoso (350 ml), se mezcla con el gas de la capacidad
funcional residual (2300 ml); por lo tanto, con cada ciclo respiratorio sólo se renueva la
séptima parte del gas alveolar. Este fenómeno evita aumentos o descensos bruscos en la
oxigenación de los tejidos cuando la respiración se modifica temporalmente, y lo convierte en
un factor de protección frente a la hipoxia. Por lo anterior, en la practica clínica cuando se
administra oxigeno suplementario y se desea medir el impacto de la intervención a través del
análisis de los gases en una muestra de sangre arterial, se debe esperar 20 minutos para que
todo el gas alveolar sea reemplazado por esta nueva mezcla de oxígeno.
Aire
atmosférico
Aire
alveolar
PO2
Nivel
Bogotá
del mar
159
117
100
72
*Los valores se dan en mm de Hg.
PCO2
Nivel
Bogotá
del mar
0,3
0.2
40
35
PN2
Nivel
Bogotá
del mar
593
442
573
406
PH2O
Nivel
Bogotá
del mar
variable variable
47
47
1.1.3.1.3. LA MEMBRANA ALVEOLO CAPILAR:
1.1.3.1.3.1. Aspectos estructurales de la membrana alveolo capilar:
La membrana alveolo capilar es una fina capa de tejido que separa el gas alveolar de la sangre
que circula alrededor de los capilares alveolares. Esta membrana esta constituida por varias
capas a saber:
1. Una capa de líquido que reviste el alvéolo.
2. El epitelio alveolar constituido por células muy delgadas.
3. La membrana basal epitelial.
4. Un delgado espacio intersticial entre el epitelio alveolar y la membrana capilar.
5. La membrana basal capilar, que en muchos lugares se fusiona con la membrana basal
del epitelio alveolar.
6. La membrana endotelial capilar.
A pesar del gran número de capas, el espesor de la membrana respiratoria es en promedio de
0,63 micras y llega en algunos lugares a ser de tan sólo 0,2 micras. Además, la superficie total
de la misma es cercana a los 160 m2 en un adulto normal. En adición, la cantidad total de
sangre que existe en los capilares pulmonares en un momento determinado es de unos 60 a
140 ml. Ahora, si se considera el espesor de la membrana y además en forma hipotética se
intenta esparcir este volumen de sangre en un área de 160 m2, se entenderá lo fácil que es para
cualquier gas pasar a través de la membrana alvéolo capilar.
Los glóbulos rojos entran en estrecho contacto con las paredes de los capilares pulmonares,
pues el diámetro de los primeros es de 7,5 micras mientras el de los segundos es de 8 micras.
En consecuencia, el oxígeno y el dióxido de carbono no necesitan atravesar el plasma cuando
difunden entre el eritrocito y el alvéolo y la velocidad de difusión es mayor.
1.1.3.1.3.2. Difusión del oxígeno a través de la membrana alveolo capilar:
El movimiento de un gas a través de una membrana semipermeable se denomina
DIFUSIÓN. La difusión ocurre en respuesta a diferencias (gradientes) de presión: el gas pasa
desde el punto de mayor presión hacia el de menor presión hasta lograr un equilibrio a cada
lado de la membrana. Sin embargo, para que la difusión ocurra debe existir una fuente de
energía que es proporcionada por el movimiento cinético de las moléculas del gas. Este
movimiento continuo hace que las moléculas impacten unas con otras ejerciendo una
determinada presión según el volumen o recipiente en el que estén contenidas (ley de Boyle).
En consecuencia, las moléculas serán impulsadas desde el sitio de mayor presión o colisión
hacia el de menor presión. Además, la velocidad de difusión dependerá de la magnitud del
gradiente de presión; cuanto mayor sea el gradiente, más rápida será la difusión.
En condiciones normales el gradiente de presión para la difusión de oxígeno en un
sujeto respirando aire y a nivel del mar es de unos 65 mm Hg, porque a nivel alveolar
la PAO2 es aproximadamente de 105 mm Hg y la PaO2 de 40 mm Hg.
El paso del oxígeno a través de la membrana alveolo capilar hace que éste gas pase de un
ambiente gaseoso (alvéolo) a uno líquido (sangre). El gas en la sangre también ejercerá una
presión parcial, pues las moléculas de oxígeno seguirán su movimiento al azar por su energía
cinética de igual manera a como lo hacen en la fase gaseosa. Esta presión estará determinada
por el número de moléculas (cantidad de gas) y por el grado de solubilidad del gas en el líquido
(coeficiente de solubilidad). Es decir, algunos tipos de moléculas, especialmente el dióxido de
carbono, son atraídas física o químicamente por las moléculas de agua, mientras que otras son
repelidas. Así, cuando existe atracción se disolverán muchas más moléculas sin provocar un
aumento excesivo de la presión de la solución (dióxido de carbono). Por otra parte, en el caso
de las moléculas repelidas, muchas menos moléculas disueltas desarrollarán una gran presión
(oxígeno). Este fenómeno puede explicarse mediante la ley de Henry que se sintetiza en la
siguiente fórmula:
Presión = Concentración del gas disuelto/coeficiente de solubilidad.
La tabla x muestra los coeficientes de solubilidad en agua a temperatura corporal de los gases
respiratorios más importantes. Note que el dióxido de carbono es 23,75 veces más soluble que
el oxígeno y que éste a su vez es más soluble que los otros tres gases.
Gas.
Coeficiente
de solubilidad
Oxígeno.
0,024
Dióxido de carbono.
0,57
Monóxido de carbono.
0,018
Nitrógeno.
0,012
Helio
0.008
Además del gradiente de presión y del coeficiente de solubilidad del gas en agua, otros factores
afectan la difusión de los gases a través de la membrana alvéolo capilar, ellos son:
1.
2.
3.
4.
El área de sección transversal de la membrana.
La distancia a través de la cual debe difundir el gas.
El peso molecular del gas.
La temperatura, que en el cuerpo es constante y por lo tanto no es necesario tenerla en
cuenta.
En consecuencia, entre más grande sea el área para la difusión y más corta la distancia del
recorrido, mayor será la difusión del gas y entre menos peso molecular tenga la molécula
mayor será su movimiento cinético y más fácil su difusión.
Todos estos factores pueden expresarse en una sola fórmula:
D = ∆P x A x S/ d x √MW.
Donde D = Velocidad de difusión, ∆P es la diferencia de presión entre los dos extremos de la
membrana, A es el área transversal de la membrana, S es el coeficiente de solubilidad, d la
distancia de difusión (espesor de la membrana) y MW el peso molecular del gas.
De acuerdo con esta ecuación las características del gas brinda dos de los factores de la
fórmula: solubilidad y peso molecular, que en conjunto se denominan coeficiente de difusión
del gas. (coeficiente de difusión = S/√MW). La siguiente tabla muestra los coeficientes de
difusión de los gases respiratorios.
Gas
Coeficiente
de difusión
Oxigeno.
1
Dióxido de carbono
20,3
Monóxido de carbono
0.81
Nitrógeno
0.53
helio
0.95
El volumen de oxígeno que atravesará la membrana alveolo capilar, estando el sujeto en reposo
es de 21 ml de Oxígeno por minuto por cada mm Hg de gradiente de presión. Este es la
llamada capacidad de difusión del oxígeno a través de la membrana alveolo capilar. Así, en el
caso hipotético de que exista un gradiente de presión para el oxígeno de 10 mm Hg a cada lado
de la membrana, podrán pasar 210 ml de este gas en un minuto.
Es importante resaltar el papel de la inspiración y espiración para el paso de oxígeno a través
de la membrana alvéolo capilar. Durante la inspiración, el oxígeno atmosférico ingresa hasta el
alvéolo para ponerse en contacto con el área de difusión, sin embargo, debido a su baja
solubilidad el proceso de difusión por la membrana se presenta principalmente durante la fase
espiratoria del ciclo respiratorio.
Finalmente, durante el flujo sanguíneo pulmonar normal la sangre logra cargarse con oxígeno
cuando ha transitado tan solo la tercera parte de la longitud del capilar pulmonar. Dicho de
otra manera, la sangre permanece normalmente en el pulmón un tiempo tres veces mayor del
necesario para lograr una oxigenación adecuada. Esto se convierte en un mecanismo de
protección frente a la hipoxia pudiendo aprovechar en ciertas situaciones toda la longitud del
capilar. Por ejemplo, el rápido flujo sanguíneo pulmonar durante el ejercicio, deja poco tiempo
para la difusión del oxígeno. Entonces, el proceso de difusión se realiza en toda la extensión
del capilar lográndose una oxigenación adecuada.
1.1.3.1.3.3. Efecto de la Relación ventilación/perfusión sobre la oxigenación arterial:
En condiciones ideales, todos los alvéolos serán ventilados y todos los capilares pulmonares
perfundidos, sin embargo, y como se explicó al principio de este capítulo, tanto la entrada de
aire a los alvéolos como la irrigación de los capilares pulmonares están sujetos a los efectos
gravitacionales, siendo menor en los ápices y mayor en las bases pulmonares cuando el sujeto
está erguido. A pesar de ello, se mantiene una relación paralela y constante entre la irrigación y
la ventilación alveolar, de tal manera que no se desvíe flujo sanguíneo hacia los alvéolos que no
pueden participar del intercambio gaseoso.
Esta relación entre la ventilación y la perfusión pulmonar se expresa mediante el siguiente
símbolo: V/Q, donde V es la ventilación alveolar en un minuto y Q el flujo sanguíneo
pulmonar en un minuto. Para conocer el valor normal de la relación V/Q es necesario saber
los valores normales de la ventilación alveolar y del flujo sanguíneo pulmonar en un minuto. La
ventilación alveolar en un minuto es el producto de la ventilación alveolar (350 ml) por la
frecuencia respiratoria en un minuto (12), es decir 4200 ml. El flujo sanguíneo pulmonar es
igual al gasto cardiaco, el cual es el producto del volumen latido (70 ml) y la frecuencia cardiaca
por minuto (72 x min), es decir, 5000 ml por minuto. Ahora sólo queda reemplazar los valores
en la fórmula así:
V/Q = 4200/5000, entonces, V/Q = 0,8.
En conclusión, cuando existe un acople adecuado entre la ventilación y la perfusión pulmonar,
la relación resultante será muy cercana a 1. Sin embargo, en algunas condiciones la ventilación
alveolar estará disminuida y el valor de V/Q próximo al cero. En otras, la ventilación será
normal pero el flujo sanguíneo bajo, luego el valor de V/Q será mucho mayor de 1. Con base
en lo anterior, algunos autores han establecido cuatro estados fisiológicos posibles en la
relación V/Q. Tales estados se fundamentan en el funcionamiento de la unidad respiratoria
básica, o sea el alvéolo con su capilar pulmonar, ellos son:
a. Unidad normal: Donde la perfusión y ventilación alveolar son normales.
(V/Q = 1)
b. Unidad de espacio muerto: Aquí, el alvéolo ventila pero no es prefundido. Esto
produce un desperdicio del proceso respiratorio, pues el aire alveolar no
difunde hacia la sangre. El volumen de aire de este alvéolo pasa a aumentar el
volumen de aire del espacio muerto. (V/Q > 1)
c. Unidad con shunt: está formada por un alvéolo colapsado u obstruido con una
perfusión normal. Aquí, la sangre pasará por un alveolo sin gas y saldrá hacia la
circulación sistémica sin haberse oxigenado. En cierta forma se puede expresar
que la sangre pasa por un atajo, o por un puente; es decir, se desvía sin ponerse
en contacto con el ambiente que le facilita la toma de oxigeno. Esta situación es
grave ya que la administración de oxígeno no soluciona el problema, pues la
sangre no podrá ponerse en contacto nunca con este gas. (V/Q < 1).
d. Unidad no funcional o silenciosa: en ella el alveolo está colapsado, sin
ventilación y tampoco tiene perfusión.
El 98% de la sangre pasa por los capilares alveolares donde es oxigenada hasta una PaO2 de
100 mm Hg. Como puede verse, la presión sanguínea de oxígeno no alcanza a igualar a la
presión alveolar del mismo (105 mm Hg). La razón para esta diferencia es la baja solubilidad de
este gas. El 2% de sangre restante no es oxigenada, ya que pasa por la circulación bronquial
que irriga el espacio muerto anatómico. Por lo tanto, este 2% representa un flujo de sangre
desviado de la zona de intercambio gaseoso conocido con el nombre de Shunt intrapulmonar
anatómico. Esta sangre no oxigenada tendrá una presión arterial de oxígeno igual a la venosa
de 40 mm Hg. Luego, al salir del pulmón la sangre oxigenada con 100 mm Hg (98%) y la
sangre desviada con 40 mm Hg (2%) se mezclan y finalmente la sangre que llega a la aurícula
izquierda tiene una presión de oxígeno de 95 mm Hg. Esta es la presión de Oxígeno que
genera gradiente de presión para la difusión hacia las células.
Finalmente, si comparamos la PAO2 de 105 mm Hg con la PaO2 de 95 mm Hg encontramos
una diferencia de 10 mm Hg, esta es la diferencia alvéolo arterial de oxígeno normal, que como
vimos es explicada por la baja solubilidad del oxígeno y el shunt intrapulmonar anatómico.
Esta diferencia se puede calcular con la siguiente ecuación:
D(A-a)O2 = PAO2 – PaO2, luego, D(A-a)O2 = 105 – 95 = 10 mm Hg.
1.1.3.1.4. TRANSPORTE DE OXÍGENO POR LA SANGRE:
Luego de pasar la membrana alvéolo capilar el oxígeno es transportado hacia los tejidos de dos
formas que sumadas representan el contenido total de oxígeno en la sangre.
a. El 98% del oxígeno es transportado en combinación química con la
hemoglobina de los glóbulos rojos.
b. El 2% restante es transportado disuelto en el agua del plasma y de las células.
Debido a su poca solubilidad en agua sólo una pequeña proporción de oxígeno viaja disuelto,
sin embargo, esta pequeña cantidad es la que produce la presión parcial de este gas en la
sangre. El oxígeno mezclado con la hemoglobina no ejerce presión parcial.
1.1.3.1.4.1. Transporte de oxígeno por la hemoglobina:
La concentración normal de hemoglobina del adulto (HbA) oscila entre 12 y 16 gr por cada
100 ml de sangre y cada gramo de hemoglobina tiene la capacidad de transportar 1,34 ml de
oxígeno. La razón para este excelente desempeño de la hemoglobina en cuanto al transporte de
oxígeno se refiere yace en su estructura química.
1.1.3.1.4.1.1. Estructura química de la Hemoglobina:
La hemoglobina es una proteína que resulta de la unión de cuatro moléculas de hem y una
molécula de globina. A continuación se describen cada uno de sus dos componentes.
1.1.3.1.4.1.1.1. Molécula hem:
La molécula de hem resulta de la unión de un ión ferroso con una molécula de porfirina.
La porfirina es una estructura conformada por cuatro anillos pirrol unidos a través de puentes
de metileno. Esta estructura deja un átomo de nitrógeno libre en cada anillo de pirrol capaz de
formar enlace covalente con un metal. Es decir, quedan 4 átomos de nitrógeno libres en cada
molécula de porfirina con esta facultad.
El ión ferroso es un metal que tiene en su órbita externa 6 electrones disponibles para formar
enlaces covalentes. Un ión ferroso se combina con una molécula de porfirina por medio de
uniones covalentes con los 4 átomos de nitrógeno que están libres (uno por cada anillo pirrol),
formando una molécula de Hem. Note que aún quedan disponibles dos electrones en el ión
ferroso para enlace covalente; éstos son usados para unirse a una de las cuatro cadenas
polipeptídicas de la molécula de globina como se verá enseguida.
1.1.3.1.4.1.1.2. Globina:
La globina es una proteína formada por la unión de cuatro cadenas polipeptídicas, dos alfa y
dos beta, cada una de éstas con dos átomos de nitrógeno libres, uno en cada extremo. Es decir,
la proteína de globina tiene 8 átomos de nitrógeno libres para formar enlaces covalentes.
Los dos extremos de cada cadena polipeptídica forman enlaces covalentes con los dos
electrones libres de cada ión ferroso, de esta manera cada cadena se une con un grupo hem.
Uno de estos sitios de unión entre el hierro y la cadena polipeptídica es capaz de combinarse
reversiblemente con el oxígeno. Al existir cuatro cadenas polipeptídicas en una molécula de
globina, ésta se unirá con cuatro grupos hem para constituir la molécula de hemoglobina. Con
base en lo anterior se deduce que una molécula de hemoglobina puede transportar 4 átomos de
oxígeno
En resumen:
• 4 pirroles forman una porfirina.
• 1 porfirina más 1 ión ferroso forman 1 molécula de hem.
• 2 cadenas alfa + 2 cadenas beta forman una molécula de globina.
• 4 porfirinas + 1 globina forman la Hemoglobina.
Un solo glóbulo rojo contiene 280 millones de moléculas de hemoglobina; si considera los 5
millones de eritrocitos que tiene un adulto promedio y los 4 átomos de oxígeno que puede
transportar cada molécula de hemoglobina, encontrará que en un momento determinado este
sistema transporta 5.600 millones de moléculas de este gas o dicho de otra manera, 1000 ml de
oxígeno. No cabe duda de la importancia de la hemoglobina para el transporte de oxígeno en
los seres humanos
1.1.3.1.4.1.2. Variantes de la hemoglobina:
Algunas variantes normales de la molécula de hemoglobina humana adulta (HbA) tienen
relevancia clínica por lo que se discutirán a continuación:
a. Hemoglobina fetal (HbF): Al nacer, cerca del 85% de la hemoglobina está
conformada por moléculas de globina formada por dos cadenas alfa y dos gamma. Las
cadenas gamma aumentan la afinidad de la molécula de hemoglobina por el oxígeno.
Esta propiedad de la HbF hace que capture muy bien el oxígeno desde el alvéolo pero
a su vez hace que su entrega a los tejidos periféricos no sea tan eficiente.
b. Carboxihemoglobina: la hemoglobina es 200 a 250 veces más afín por el monóxido
de carbono que por el oxígeno. El monóxido de carbono forma enlaces covalentes con
el ión ferroso imposibilitando la unión de los grupos hem con el oxígeno. Sin embargo,
la afinidad de la hemoglobina por estos gases está determinada por las presiones
parciales de los mismos en la sangre, así, al aumentar la PaO2 disminuye la afinidad de
la hemoglobina por el monóxido de carbono; por tal razón, la administración
suplementaria de oxígeno en la intoxicación con monóxido de carbono constituye una
excelente alternativa.
1.1.3.1.4.1.2. Curva de disociación de la hemoglobina:
Al difundir por la membrana alvéolo capilar el oxígeno puede unirse a la hemoglobina o quedar
disuelto en la sangre. Al inicio, la mayor parte del gas se une a la hemoglobina hasta saturar su
capacidad de transporte completamente y tan sólo una pequeña proporción del oxígeno queda
disuelto en la sangre. Sin embargo, a partir de este momento la fracción de oxígeno disuelto
aumenta progresivamente pues el oxígeno no encontrará sitio de unión disponible con la
hemoglobina. Recuerde que la fracción de oxígeno disuelto es quien determina la presión
sanguínea de este gas, por tal motivo, el aumento del oxigeno disuelto produce un aumento
progresivo de la presión sanguínea de este gas hasta que finalmente se equilibra con la presión
alveolar de oxígeno y se detiene la difusión entre el alvéolo y la sangre.
De acuerdo con lo anterior existe una relación entre la saturación de la hemoglobina y la
presión sanguínea de oxígeno. Esta relación se puede graficar comparando el porcentaje de
saturación de la hemoglobina en el eje vertical (eje y) con la presión sanguínea de oxígeno en el
eje horizontal (eje X). La curva resultante es conocida como curva de disociación de la
hemoglobina o curva de Severinghaus .
Como puede verse la curva tiene dos porciones, una empinada y otra plana, ambas son el
reflejo de las diferencias en la afinidad de la hemoglobina por el oxígeno a medida que la
presión sanguínea de este cambia.
El inicio de la curva representa la exposición inicial de la sangre a la PAO2, momento en el cual
la saturación de hemoglobina aumenta vertiginosamente mientras que la presión sanguínea de
oxígeno lo hace poco; esto produce la parte empinada de la curva, en esta parte cuando la
saturación alcanza el 50% existe una presión de oxígeno de 27 mm Hg, este es la llamada P50.
Luego, al alcanzar una saturación del 90% la curva toma una forma plana, porque a partir de
esta saturación la presión de oxígeno aumenta significativamente mientras que la saturación de
hemoglobina lo hace en mucha menor proporción. La explicación de estos fenómenos es la
alta afinidad de la hemoglobina por el oxígeno, lo que hace que inicialmente esta sea la forma
preferida para su transporte; después, cuando está casi completamente cargada, la hemoglobina
deja pocos sitios para la fijación del oxígeno y este difundirá preferiblemente hacia el plasma
aumentado la presión sanguínea del gas.
A nivel del mar la presión venosa de oxígeno es de 40 mm Hg lo que de acuerdo con la curva
equivale a una saturación de hemoglobina del 75%. Por otra parte la presión arterial de oxígeno
es cercana a los 100 mm Hg lo que produce una saturación de hemoglobina del 97%.
1.1.3.1.4.1.1. Desviación de la curva de hemoglobina:
La curva de disociación de hemoglobina anterior es la de la sangre normal, donde la P50 es de
27 mm Hg. Sin embargo, diversos factores como el pH sanguíneo, el dióxido de carbono, la
temperatura y el 2,3 difosfoglicerato pueden desplazar esta curva en una u otra dirección,
cambiando el valor de la P50.
Si la curva se desvía hacia la izquierda la P50 disminuye, esto significa que con menores
presiones sanguíneas de oxígeno se alcanza una mayor saturación de la hemoglobina que en
condiciones normales. Esto resulta en un aumento del contenido total de oxígeno sanguíneo
(ver figura). Sin embargo, esta mayor afinidad de la hemoglobina por el oxígeno hace que la
entrega a los tejidos periféricos esté reducida. Los factores que desplazan la curva de
disociación de la hemoglobina hacia la izquierda son: La alcalosis, la hipotermia, la disminución
de la presión sanguínea de dióxido de carbono y el descenso del 2,3 difosfoglicerato (DPG).
Un trastorno que desvía la curva de disociación hacia la izquierda es la presencia en la sangre
de grandes cantidades de hemoglobina fetal (HbF), tipo de hemoglobina que se presenta
normalmente en el feto antes del nacimiento. Este efecto tiene importancia para la liberación
de oxígeno hacia los tejidos fetales bajo las condiciones hipóxicas en las que vive el feto.
Si la curva se desvía a la derecha la P50 aumenta, lo anterior resulta en una menor saturación
de la hemoglobina con una determinada presión sanguínea de oxígeno. Así, el contenido total
de oxígeno en la sangre disminuye. Esta menor afinidad de la hemoglobina por el oxígeno
produce una mejor entrega del mismo a los tejidos. Los factores que desvían la curva de
disociación de la hemoglobina hacia la derecha son: la acidosis, la hipercapnia y el aumento de
la temperatura y del 2,3 DPG.
1.1.3.1.4.1.1.1. Efecto Bohr:
El efecto Bohr hace referencia a los desplazamientos de la curva de disociación de la
hemoglobina de acuerdo a las concentraciones de dióxido de carbono y pH sanguíneos. El
dióxido de carbono que viaja en la sangre difunde hacia los alvéolos al pasar por los pulmones,
ello disminuye la presión de CO2 sanguínea y produce alcalosis. Ambos factores desvían la
curva de disociación hacia la izquierda y aumentan la captación de oxígeno por la hemoglobina.
El resultado es un mayor transporte de oxígeno en la sangre desde los pulmones hacia los
tejidos. Posteriormente, cuando la sangre llega a la periferia, recibe CO2 de los tejidos, lo que
aumenta la presión de CO2 sanguínea y produce acidosis. Esto desvía la curva hacia la derecha
facilitando la entrega de oxígeno a los tejidos.
1.1.3.1.4.1.1.2. El 2,3 – difosfoglicerato:
El ambiente interno del eritrocito también influye sobre la curva de disociación de la
hemoglobina. El 2,3-DPG es un producto final del metabolismo del glóbulo rojo. La
concentración de esta sustancia aumenta en la hipoxia crónica, por ejemplo, en presencia de
enfermedad pulmonar crónica y al vivir en grandes alturas. Al aumentar la concentración de
2,3-DPG en el glóbulo rojo, la curva se desplaza hacia la derecha lo que mejora la entrega de
oxígeno en la periferia. Por el contrario, la sangre almacenada en el banco de sangre tiene
disminuida su concentración de 2,3-DPG lo que hace difícil la descarga de oxígeno a los
tejidos.
1.1.3.1.4.2. Transporte de oxígeno disuelto en la sangre:
Como hemos visto, la mayor parte de oxígeno es transportado unido a la hemoglobina; sin
embargo, la presión parcial de este gas es determinada por la pequeña cantidad de oxígeno que
queda disuelta en la sangre y como sabemos, es la diferencia de presiones la que permite su
difusión desde el alvéolo a la sangre y desde ésta a la célula. Además, la presión parcial de
oxígeno determina el grado de saturación de la hemoglobina como se analizó previamente en
lo referente a la curva de Severinghaus. Al observar esta curva, es notorio el aumento de la
presión de oxígeno en la sangre cuando la hemoglobina esta saturada cerca al 100%. La
explicación es obvia, cuando se agotan los sitios disponibles para la fijación de oxígeno en la
hemoglobina la cantidad de oxígeno disuelto aumenta en relación directa con la presión
alveolar a la que sea expuesta.
La presión de oxígeno en la sangre varía de acuerdo al sitio de medición. En la periferia, el alto
consumo celular de oxígeno genera una presión venosa de 40 mm Hg; esta sangre al llegar al
pulmón se expone a la presión alveolar del gas que es de 105 mm Hg lo que determina un
gradiente de difusión de 65 mm Hg. Al salir del pulmón completamente oxigenada la presión
arterial de oxígeno es cercana a los 100 mm Hg (recuerde que la diferencia en las presiones
alveolares y arteriales de oxígeno son explicadas por el shunt intrapulmonar y por el bajo
coeficiente de difusión del oxígeno).
El siguiente ejemplo ilustra mejor esta situación:
Un sujeto normal a nivel del mar respirando aire (FIO2 del 21%) tiene una PAO2 de 105 mm
Hg, sin embargo por efecto del shunt intrapulmonar y de la poca difusión del oxígeno como se
mencionó antes, la presión sanguínea de este gas es del orden de 100 mm Hg. Con esta PaO2 la
saturación de la hemoglobina es del orden del 97%.
Ahora suponga que el mismo individuo tiene una FIO2 del 100%, su PAO2 será de 673 mm
Hg y la saturación de hemoglobina del 100%. Sin embargo, si multiplica las presiones parciales
en cada uno de estos ejemplos por el coeficiente de solubilidad del oxígeno notará el
importante cambio en la cantidad de oxigeno disuelto por el cambio en la PAO2.
En el primer caso la cantidad de oxígeno disuelto es de 0,3 ml en cada 100 ml de sangre,
mientras que el segundo caso es de 2 ml por cada 100 ml de sangre.
1.1.3.1.4.3. Impacto del transporte de oxígeno disuelto en la sangre y unido a la
hemoglobina en el contenido total de oxigeno de la sangre:
El siguiente ejemplo da una clara idea del impacto de las dos formas de transportar oxígeno
sobre el contenido total del mismo en la sangre:
Un individuo a nivel del mar respirando aire tendrá una PaO2 de 100 mm Hg. Si este individuo
tiene una hemoglobina de 14 gr/dl y además una saturación de hemoglobina del 97% ¿cuanto
es la cantidad total de oxígeno en su sangre?
Para responder esta pregunta hay que recordar que el contenido total de oxígeno en la sangre
es igual a la cantidad de oxígeno disuelto más la cantidad de oxígeno unido a la hemoglobina.
Así:
Oxigeno unido a la hemoglobina = Hb x 1,34 x SpO2, al reemplazar 14 x 1,34 x 0,97 =
18,19 ml de oxígeno en cada 100 ml de sangre.
Oxígeno disuelto = PaO2 x coeficiente de solubilidad del oxígeno, al reemplazar 100 mm Hg
x 0,003 = 0,3 ml de oxígeno en cada 100 ml de sangre.
Finalmente, contenido total de oxígeno en la sangre = 18,19 + 0, 3 = 18,49 ml de oxígeno
en cada 100 ml de sangre.
El anterior ejemplo ilustra claramente que la mayor cantidad de oxígeno es transportado unido
a la hemoglobina y que sólo una pequeña proporción lo hace disuelto, 18,19 contra 0,3 ml
respectivamente. En otras palabras, del contenido total de oxígeno en la sangre, el 98,4% está
unido a la hemoglobina mientras que solo el 1,6% está disuelto.
1.1.3.1.5. APORTE DE OXÍGENO A LOS TEJIDOS:
El aporte de oxígeno a los tejidos depende de un adecuado contenido de oxígeno en la sangre
y de un adecuado gasto cardiaco que lo lleve a los tejidos. Durante cada contracción cardiaca
70 ml de sangre oxigenada son expulsados del corazón izquierdo hacia la periferia con el fin de
llevar oxígeno a los tejidos. La misma cantidad de sangre sale durante la sístole del ventrículo
derecho para ser oxigenada por el pulmón. En otras palabras, el corazón se encarga de llevar la
sangre oxigenada a la periferia para la producción celular de energía y de traerla de regreso a los
pulmones para ser nuevamente oxigenada. Si consideramos que un adulto normal tiene un
gasto cardiaco de 5 litros por minuto (gasto cardiaco = volumen latido x frecuencia cardiaca,
70 x 72 respectivamente) y lo multiplicamos por el contenido arterial de oxígeno, encontramos
que en un minuto el corazón lleva a los tejidos periféricos unos 1000 ml de oxígeno.
El aporte de oxígeno (DO2) a los tejidos se calcula de la siguiente manera:
DO2 = contenido arterial de oxigeno x gasto cardíaco x 10.
Se multiplica por 10 para igualar las unidades ya que el contenido arterial de oxígeno está dado
en ml de oxígeno por 100 ml (1 dl) de sangre y el gasto cardiaco en litros (1L = 1000ml = 10
dl).
De acuerdo con el ejemplo anterior:
DO2 = 18,49 x 5 x 10 = 924,5 ml en un minuto.
De acuerdo con la fórmula anterior cualquier alteración en el contenido de oxígeno o en el
gasto cardiaco puede comprometer el aporte de oxígeno a los tejidos. Así, en situaciones de
anemia o de baja presión de oxígeno atmosférico como en las grandes alturas, el contenido
arterial de oxígeno puede estar disminuido afectando el DO2. De igual manera, patologías
como la cardiopatía isquémica pueden comprometer el volumen latido y el gasto cardiaco
afectando el aporte de oxígeno a los tejidos. Sin embargo, en condiciones normales existe un
acople entre el sistema cardiovascular y respiratorio que permite mantener el DO2 en rangos
normales a pesar de existir alguna alteración en los determinantes de la ecuación. Recuerde que
el cuerpo está dotado de quimiorreceptores periféricos localizados en la bifurcación de las
arterias carótidas interna y externa y en el cayado de la aorta que detectan cualquier
disminución en la PaO2, enviando información hacia el sistema nervioso central quien
responde con señales hacia el sistema respiratorio y cardiovascular para aumentar la ventilación
alveolar y el gasto cardiaco. Por ejemplo, ante un déficit de hemoglobina por anemia, el gasto
cardiaco aumentará por incremento de la frecuencia cardiaca y mantendrá un aporte de
oxígeno adecuado. De igual forma, ante una baja presión alveolar de oxígeno como en las
grandes alturas, la frecuencia respiratoria y cardiaca aumenta para incrementar la ventilación
minuto y el gasto cardiaco elevando el aporte de oxígeno a los tejidos. Desafortunadamente la
compensación respiratoria a un déficit en el DO2 es ineficiente porque consume grandes
cantidades de energía, lo que convierte a la compensación cardiovascular en el mejor
mecanismo de compensación en tales circunstancias. Por tal razón, cuando se documenta un
aporte de oxígeno disminuido a los tejidos existirá inexorablemente un compromiso del
sistema cardiovascular para compensar la causa.
1.1.3.1.6. DIFUSIÓN DEL OXÍGENO DESDE LA SANGRE HASTA LA CÉLULA:
RESPIRACIÓN INTERNA.
El intercambio de oxígeno y dióxido de carbono entre la sangre del capilar tisular y las células
se denomina respiración interna y sirve para diferenciarlo del proceso de intercambio
gaseoso a nivel de la membrana alvéolo capilar denominado respiración externa.
La difusión de oxígeno a nivel periférico se realiza en el capilar tisular. Como se ha explicado,
debe existir un gradiente de presión para la difusión de oxígeno. A nivel periférico, el oxigeno
difunde primero entre el capilar y el intersticio tisular y luego desde allí hasta la célula. Por tal
motivo, existe un gradiente de presiones entre estos tres lugares para permitir la difusión de
oxígeno. Cuando la sangre llega al capilar periférico trae una presión de oxígeno de 95 mm
Hg. Por otra parte, a nivel tisular la presión de este gas es de 40 mm Hg. En estas condiciones
existe una gran diferencia de presión a favor de la difusión de oxígeno hacia el intersticio
(55 mm Hg). En el líquido intersticial la presión de oxígeno se mantiene constantemente baja
(40 mm Hg) porque las células lo utilizan para sus funciones metabólicas.
Una vez en el intersticio, el oxígeno difunde hacia las células a favor de un gradiente de
presión. Esto genera una disminución progresiva en la presión intersticial de oxígeno a medida
que se aleja del capilar tisular quedando una menor cantidad de oxígeno disponible para las
células más distales. . Sin embargo, como las células siempre están consumiendo oxígeno, la
presión parcial intracelular de este gas se conserva más baja que la del líquido intersticial a
pesar de estar lejos del capilar lo que permite la difusión de oxígeno.
El valor promedio de la presión de oxígeno intracelular es de 23 mm Hg, oscilando entre
valores tan bajos como 5 mm Hg y otros tan altos como 60 mm Hg de acuerdo a la
proximidad o distanciamiento que exista con el capilar tisular. Ya que normalmente son
suficientes valores tan bajos de presión intracelular de oxígeno como de 4 mm Hg para
mantener los procesos metabólicos intracelulares, resulta claro que incluso valores tan bajos
como 23 mm Hg a nivel intracelular, ofrecen un factor de seguridad considerable frente a la
hipoxia. Sin embargo, en la medida que la célula se distancia del capilar este factor se seguridad
es menor y la célula es más susceptible ante condiciones de isquemia, este es el caso de las
células centrolobulillares del hígado. Esto se complica un poco más ya que el consumo celular
de oxígeno es diferente en los diferentes órganos, siendo más alto en el corazón y cerebro y
menor en el tejido adiposo y óseo. Sin embargo, esto se compensa con un mejor aporte de
oxígeno hacia los tejidos con mayor actividad metabólica a través de una mayor irrigación
sanguínea.
Aunque el sistema respiratorio es esencial para la respiración externa, el sistema cardiovascular
es fundamental para la respiración externa e interna, ya que si la perfusión tisular es insuficiente
para satisfacer las necesidades de oxígeno celulares, la respiración interna se verá afectada a
pesar de un sistema respiratorio sano.
Finalmente, al salir la sangre del capilar tisular hacia las venas con dirección al ventrículo
derecho la presión sanguínea de oxígeno es de 40 mm Hg.
1.1.3.1.7. CONSUMO INTRACELULAR DE OXÍGENO:
La célula es la principal unidad funcional de todo ser vivo. Ella cumple funciones
especializadas que demandan un consumo intenso y constante de oxígeno para la producción
de energía, el cual varía entre los diferentes órganos en relación directa con su metabolismo,
siendo mayor en órganos como el cerebro y el corazón.
Las sustancias fundamentales que proveen energía a las células son los carbohidratos, las
proteínas y las grasas procedentes de la dieta. Inicialmente estas sustancias tienen vías
metabólicas diferentes hasta alcanzar con su degradación un metabolito común que es el acetil
CoA. A partir de este punto entran al ciclo de Kreps en las mitocondrias, con producción de
CO2 e hidrogeniones. Estos últimos se transportan por oxido reducción a la cadena respiratoria
donde se forma adenosin trifosfato (ATP) y agua. Por ejemplo, durante su metabolismo, la
glucosa reacciona con 6 moléculas de oxígeno para la producción de 36 moléculas de ATP. Es
decir, la energía de los alimentos es transformada por medio de reacciones químicas de
oxidoreducción hacia un compuesto común final, el ATP. Finalmente, el ATP se emplea por
las células para suministrar energía a las diferentes reacciones metabólicas intracelulares. En
todo este proceso, el oxígeno actúa como comburante en las reacciones.
El ATP se utiliza para el desarrollo de tres funciones principales de las células:
a. Transporte a través de las membranas:
El transporte iónico y de otras sustancias es realizado por proteínas a través de cambios en su
conformación estructural que requieren energía. Dentro de estas proteínas se destaca la bomba
de sodio-potasio-ATP fundamental para el mantenimiento del potencial de membrana
intracelular. El transporte de membrana es tan importante para la función celular, que algunas
células como las células de los túbulos renales utilizan cerca del 80% del ATP que sintetizan
sólo para este fin.
b. Síntesis de productos químicos:
Las células sintetizan proteínas, fosfolípidos, purinas, pirimidinas y gran cantidad de otras
sustancias. La síntesis de casi todo producto químico consume energía. Por ejemplo, para
sintetizar una proteína, miles de aminoácidos deben ser unidos entre sí por medio de enlaces
peptídicos. Cada uno de estos enlaces consume 4 ATP. Así, sobre todo durante el proceso de
crecimiento celular, algunas células consumen hasta el 75% de su ATP para el desarrollo de
esta función.
c. Trabajo mecánico:
El ATP es fundamental para las células que desempeñan trabajo mecánico. Para que la fibra
muscular se contraiga se requiere de cantidades enormes de ATP. Por ejemplo, el músculo
cardiaco destina 90% de su ATP para la contracción cardiaca. Otras células desarrollan un tipo
de trabajo mecánico diferente, a saber, movimientos ciliares (células del tracto respiratorio y de
las trompas de Falopio) y ameboides (leucocitos), en los cuales también es necesario el ATP.
El consumo de oxígeno de los diferentes órganos varía de acuerdo con su tasa metabólica. El
corazón por ejemplo consume entre 8 y 10 ml de oxígeno por cada 100 gr de tejido en un
minuto, los riñones 6 ml, el hígado 4 ml y el cerebro 3,5 ml. Sumando el consumo de oxígeno
en todos los órganos se determina el consumo total de oxígeno en el cuerpo que en un adulto
de 70 Kg. es de 250 ml por minuto, es decir, 3,5 ml/Kg/min. Sin embargo, este valor se
modifica con la edad, siendo de 6 a 8 ml/Kg/min en el recién nacido y disminuyendo a valores
entre 2,5 y 3 ml/Kg/min en el anciano. Además, algunas condiciones como el ejercicio físico,
la fiebre, el dolor, el sueño o la anestesia modifican estos valores.
De acuerdo con lo anterior, es claro que la ausencia de oxígeno perturba gravemente la
producción de ATP con consecuencias devastadoras en las diferentes funciones celulares de
todo el cuerpo. En condiciones de hipoxia las mitocondrias no pueden utilizar las vías
bioquímicas normales para la producción de energía, debiendo recurrir a vías bioquímicas no
oxidativas (sin participación de oxígeno) o vías metabólicas anaerobias. Si bien estas vías de
metabolismo no oxidativo se constituyen en un factor de protección ante condiciones
anaerobias, son poco eficientes para la producción energética y sus metabolitos finales tóxicos
para las células. En circunstancias normales la mitocondria puede funcionar de manera
adecuada con presiones de oxígeno intracelulares cercanas a los 4 mm Hg.
1.1.3.1.7.1. Normoxia, hipoxia y disoxia:
Es claro que la producción de ATP necesita un aporte constante y suficiente de oxígeno para
satisfacer las necesidades energéticas de la célula. Se ha estimado que una presión de oxígeno
intracelular mayor de 15 mm Hg es suficiente para la síntesis de ATP, lo que corresponde a un
estado de normoxia intracelular. Cuando la presión intracelular de oxígeno cae a rangos entre
15 mm Hg y 4 mm Hg la célula es capaz de mantener una producción adecuada de ATP pero
necesita de algunos mecanismos de adaptación como cambios en la fosforilación y
reclutamiento redox en el transporte de electrones mitocondrial. En estas condiciones la célula
esta en un estado de hipoxia adaptada, es decir, mantiene la producción de ATP a través de
mecanismos compensatorios sin acudir al metabolismo anaerobio. Cuando la presión de
oxígeno intracelular es inferior a los 4 mm Hg la célula entra en un estado de disoxia, donde la
producción de ATP a través de la fosforilación oxidativa mitocondrial es insuficiente y los
mecanismos adaptativos iniciales no logran satisfacer las necesidades de ATP. En esta
situación, la célula acude a otros mecanismos de producción de energía como la glicólisis
anaerobia, que a pesar de ser un mecanismo adaptativo importante resulta ineficiente, pues
cada molécula de glucosa sólo produce 2 de ATP. Además, este mecanismo depende de un
transporte rápido de glucosa desde la sangre hasta el interior de la célula que en realidad es
lento en el cerebro, riñón e hígado. En estas condiciones la célula sacrifica su función para
mantener indemne su estructura, es decir, utiliza la poca energía disponible para el
mantenimiento del gradiente iónico a través de las membranas, y olvida su función, por
ejemplo, la transmisión axonal de las neuronas. Este fenómeno a nivel cerebral puede verse en
los cambios progresivos del nivel de consciencia de un paciente hipóxico. A pesar de ser un
mecanismo ineficiente, el metabolismo anaerobio permite a la célula vivir durante un
determinado tiempo sin que haya deterioro de su estructura, esto se denomina disoxia sin
daño celular, y si el aporte de oxígeno de la célula vuelve a valores normales, la función celular
retorna sin verse afectada (el paciente recupera la consciencia). Finalmente, cuando este
mecanismo se agota y las necesidades energéticas de la célula no pueden ser satisfechas, habrá
disoxia con daño celular. Aquí el aporte de ATP es insuficiente para mantener la función y la
integridad celular (el paciente queda con déficit neurológico permanente). Esto sucede con
presiones de oxígeno intracelulares menores de 1 mm Hg.
1.1.3.1.8. Determinación de la diferencia arteriovenosa de oxígeno y consumo celular de
oxígeno:
Cuando la sangre llega al capilar tisular trae un contenido arterial de oxígeno, el cual, al
transitar por el capilar disminuye, pues éste gas difunde por el líquido intersticial en dirección
de la célula. Por tal razón, al salir del capilar el contenido venoso de oxígeno es inferior al
arterial. Si calculamos la diferencia entre el oxigeno que llega por el extremo arterial del capilar
y el que sale por el extremo venoso conoceremos con cuanto oxígeno se quedó la célula. Esto
se ha denominado diferencia arterio venosa de oxígeno D(a – v)O2. En condiciones de reposo,
la diferencia arterio venosa de oxígeno es de 5 ml de oxígeno por cada 100 ml de sangre.
Sin embargo, este valor normal no es aplicable a sujetos enfermos con aumento del consumo
de oxígeno porque en aquellos con reservas cardiovasculares adecuadas el aumento del
volumen minuto cardiaco supera al aumento de consumo de oxígeno. El efecto neto es una
disminución en la D(a-v)O2, es decir, se extrae menos oxígeno por cada 100 ml de sangre pese
al mayor consumo de oxígeno. El paciente en estado crítico cuyo corazón ya no puede
mantener niveles compensatorios del gasto cardiaco manifestará valores crecientes en la D(av)O2 inicialmente hacia rangos normales y por último hacia valores más altos que los normales
cuando se produzca una descompensación franca.
En adulto de 70 kg en condiciones basales consume 250 ml de oxígeno por minuto. La
extracción de oxígeno se calcula restando el contenido arterial de oxígeno del venoso mediante
la fórmula:
D(a-v)O2 = contenido arterial de oxígeno – contenido venoso de oxígeno.
D(a-v)O2 = [(Hb x 1,34 x Saturación arterial de oxígeno) + PaO2 x 0,003] – [(Hb x 1,34 x
saturación venosa de oxígeno) + PvO2 x 0,003].
D(a-v)O2 = 20 – 15. D(a-v)O2 = 5 ml de oxigeno por 100 ml de sangre.
El consumo de oxigeno (VO2) puede ser calculado multiplicando la extracción de oxígeno por
el gasto cardiaco (GC). Así:
VO2 = D(a-v)O2 x GC x 10.
Se multiplica por 10 para igualar las unidades ya que la D(a-v)O2 se da en decilitros y el gasto
cardíaco en litros.
Esta fórmula resalta que la extracción de oxígeno y el consumo de oxígeno son dos fenómenos
diferentes. De acuerdo con la fórmula, para cualquier VO2 dado, la D(a-v)O2 varía
inversamente con el gasto cardiaco. Dicho de otra manera, la D(a-v)O2 expresa la adecuación
con que el gasto cardiaco responde a los requerimientos de oxígeno.
Algunos prefieren expresar la extracción de oxígeno como el porcentaje del contenido arterial
de oxígeno que salió hacia la célula. La siguiente fórmula expresa esta relación:
Extracción de oxígeno = [D(a-v)O2 / contenido arterial de oxígeno] x 100
Extracción de oxígeno = [5/20] x 100, es decir 25%
Recuerde que el aporte total de oxígeno a los tejidos en un minuto es de 1000 ml de oxígeno y
que el consumo basal celular es de 250 ml de oxígeno, es decir el 25% de lo que recibe en cada
minuto. Esta gran diferencia entre lo que recibe y lo que consume la célula es un importante
factor de seguridad frente a la hipoxia y una fuente adicional de oxígeno durante el ejercicio.
Es importante resaltar que en condiciones con aumento del consumo celular de oxígeno la
D(a-v)O2 aumenta bastante tiempo antes de que se observe un deterioro significativo en la
oxigenación arterial o haya manifestaciones clínicas.
1.1.3.2. VENTILACIÓN: UN VIAJE HACIA LA ATMÓSFERA.
La ventilación es una de las propiedades emergentes del sistema respiratorio y puede definirse
como la capacidad que tiene dicho sistema para llevar dióxido de carbono desde la célula hasta
la atmósfera en un proceso que requiere la cooperación permanente y eficaz del sistema
cardiovascular.
El dióxido de carbono es un producto final del metabolismo celular aerobio que si se acumula
puede comprometer seriamente las funciones celulares. Por tratarse de un gas, los organismos
se valen del sistema cardiovascular y respiratorio para llevarlo desde su sitio de producción
(célula) hasta la atmósfera y evitar que se acumule dentro del cuerpo. Además, al igual que
sucede con el proceso de oxigenación, la salida del dióxido de carbono desde la célula hasta la
atmósfera describe un largo recorrido, regido siempre por un gradiente de concentración. Sin
embargo, como se discutirá adelante, estas diferencias de presión son menores debido a la alta
solubilidad del dióxido de carbono.
A continuación se describe en detalle los fenómenos más relevantes de este recorrido, lo cual
incluye la producción de CO2 a nivel celular, su difusión hacia la sangre, su tránsito hasta los
pulmones, su difusión por la barrera alvéolo capilar y finalmente, su salida hacia la atmósfera.
1.1.3.2. 1. PRODUCCIÓN INTRACELULAR DE DIOXIDO DE CARBONO:
El destino de los componentes de la dieta después de su digestión y absorción, constituye el
metabolismo intermedio. Las vías metabólicas de los componentes de la dieta pueden
clasificarse en tres categorías:
1. Vías anabólicas que se ocupan de la síntesis de los compuestos que constituyen
la estructura y la maquinaria corporal. Una de ellas es la síntesis de proteínas. La
energía requerida por estos procesos proviene de la categoría siguiente.
2. Vías catabólicas que son las que realizan procesos oxidativos que producen
energía libre, por lo general, en forma de fosfatos de alta energía o de
equivalentes reductores, por ejemplo, la cadena respiratoria y la fosforilación
oxidativa.
3. vías anfibólicas que tienen más de una función y que suceden en las
“encrucijadas” del metabolismo, actuando como enlace entre las vías anabólicas
y catabólicas, por ejemplo, el ciclo del ácido cítrico.
En el hombre, la glucosa, los ácidos grasos, el glicerol y los aminoácidos (productos de la
digestión de los alimentos) son procesados por sus vías metabólicas respectivas hacia un
producto final común: acetil-CoA, que luego se oxida en forma total en el ciclo del ácido
cítrico.
Tanto aminoácidos, ácidos grasos, como glucosa son metabolizados hacia acetilCoA para
ingresar en el ciclo de ácido cítrico con el fin de producir ATP. Durante cada vuelta del ciclo
del ácido cítrico se producen 12 moléculas de ATP, 2 de CO2 y 2 moléculas de agua. A
diferencia de los otros compuestos, el metabolismo de una molécula de glucosa produce una
molécula adicional de dióxido de carbono cuando el piruvato es convertido en acetil-CoA.
La velocidad de las enzimas para regular e ciclo de Kreps depende básicamente de la cantidad
de ATP a nivel intracelular. Si hay demasiado, la velocidad del ciclo disminuye y, si por el
contrario hay déficit del mismo, la velocidad aumenta.
En conclusión, el ciclo del ácido cítrico representa la vía metabólica final común de los
compuestos de la dieta (proteínas, lípidos y carbohidratos) que inexorablemente lleva a la
producción de CO2. La magnitud de la producción de CO2 será, por tal motivo, proporcional a
la tasa metabólica de la célula.
La producción normal de dióxido de carbono en condiciones de reposo es de 200 ml en un
minuto. Si se compara la producción de CO2 con el consumo de oxígeno (250 ml) se obtiene el
denominado cociente respiratorio (CR) que normalmente es de 0.8 (200/250). El valor normal
del cociente respiratorio cambia según las condiciones metabólicas. Cuando una persona utiliza
carbohidratos para el metabolismo corporal, el CR se eleva hasta 1. Por otra parte, cuando la
persona usa casi exclusivamente grasas para su consumo metabólico, el valor cae hasta 0.7. El
motivo de esta diferencia es que cuando se metaboliza oxígeno junto con hidratos de carbono
se forma una molécula de dióxido de carbono por cada molécula de oxígeno consumida, en
tanto que si el oxígeno reacciona con las grasas, gran parte del mismo se combina con átomos
de hidrógeno para formar agua en vez de producir monóxido de carbono.
1.1.3.2.2. DIFUSIÓN DEL DIÓXIDO DE CARBONO HACIA LA SANGRE:
En su recorrido desde la célula hasta la sangre capilar tisular, el CO2 debe difundir primero
hacia el líquido intersticial y luego desde éste hasta la sangre capilar. Este recorrido obedece a
diferencias en la presión parcial de CO2 en estos tres compartimientos (célula, líquido
intersticial y sangre capilar). Sin embargo, a diferencia de lo estudiado con respecto a la
difusión de oxígeno, la difusión de dióxido de carbono se hace con diferencias de presión muy
bajas entre estos tres compartimientos y es posible gracias a la alta solubilidad en el agua de
este gas.
A nivel intracelular la presión de dióxido de carbono es de 46 mm Hg y la presión de CO2 en el
intersticio de 45 mm Hg; por tanto, sólo hay una diferencia de 1 mm Hg de presión a favor de
la difusión del dióxido de carbono desde la célula hacia el intersticio. Sin embargo, al ser
altamente soluble el CO2, con un coeficiente de solubilidad de 0,57 (23 veces más que el
oxígeno), el proceso se realiza de manera eficiente.
La presión de CO2 de la sangre venosa que sale de los tejidos es de 45 mm Hg; por tanto, la
sangre capilar tisular entra en un equilibrio muy preciso con la presión de dióxido de carbono
intersticial, que también es de 45 mm Hg. Una vez en la sangre el dióxido de carbono puede
ser transportado de varias formas como se explica a continuación.
1.1.3.2.3. TRANSPORTE DE DIOXIDO DE CARBONO EN LA SANGRE:
El transporte de dióxido de carbono no constituye un problema tan grande como el transporte
de oxígeno, porque aún en las condiciones más anormales suele ser transportado por la sangre
en mayores cantidades que éste. Sin embargo, la cantidad de dióxido de carbono en la sangre
tiene que ver mucho con el equilibrio ácido-básico de los líquidos orgánicos, como se discute
en el apartado correspondiente.
En condiciones normales en cada 100 ml de sangre se transportan 4 ml de dióxido de carbono
desde los tejidos hacia los pulmones.
El dióxido de carbono puede viajar en la sangre de tres formas: disuelto en la sangre como
dióxido de carbono, unido a la hemoglobina y a las proteínas plasmáticas y como ión
bicarbonato, siendo éste último el mecanismo más importante.
Al empezar su recorrido el dióxido de carbono difunde hacia el plasma en forma de CO2
disuelto. Al ingresar en los capilares inicia una serie de reacciones físicas y químicas que son
esencialmente para su transporte y que se describen a continuación.
1.1.3.2.3.1. Transporte de dióxido de carbono en forma disuelta:
Una pequeña fracción de este gas se transporta de esta manera hacia los pulmones. En la
sangre venosa, una presión de CO2 de 45 mm Hg es generada por 2,7 ml/100 ml disueltos en
la sangre. (recuerde que el gas disuelto es el responsable de la presión parcial del mismo en la
sangre y además que entre más soluble sea un gas en la sangre, mayor número de moléculas
podrán existir unidas al agua sin generar presión). Por otro lado, en la sangre arterial la presión
de CO2 de 40 mm Hg es producida por 2,4 ml de dióxido de carbono disueltos. En
consecuencia, sólo 0,3 ml de este gas se transporta disuelto en cada 100 ml de sangre, cifra que
corresponde sólo al 7,5% de todo el dióxido de carbono transportado (0,3/4). Sin embargo, si
se compara este valor con el porcentaje de oxígeno que viaja disuelto en la sangre encontrará
que esta cifra es significativa. Una vez más, la diferencia en el porcentaje disuelto de estos dos
gases en la sangre obedece a su diferente coeficiente de solubilidad.
1.1.3.2.3.2. Transporte de dióxido de carbono en forma de bicarbonato:
El dióxido de carbono disuelto en la sangre puede reaccionar con el agua para formar ácido
carbónico (CO2 + H2O = H2CO3). Sin embargo, esta reacción se realiza de forma muy lenta a
nivel plasmático, por lo que carece de importancia clínica. No obstante, en el interior de los
glóbulos rojos se encuentra la enzima anhidrasa carbónica, que cataliza esta reacción
multiplicando su rapidez unas 5000 veces. En consecuencia, en vez de necesitar varios
segundos o minutos como ocurre en el plasma, la reacción alcanza su equilibrio en el interior
de los eritrocitos en fracciones de segundo. Posteriormente, y también en fracciones de
segundo, el ácido carbónico formado en el interior de eritrocito se disocia en iones de
bicarbonato e hidrógeno. La mayor parte del hidrógeno aprovecha las propiedades
amortiguadoras de la hemoglobina y se une a ella. A su vez, la mayor parte del bicarbonato sale
del eritrocito hacia el plasma gracias a una bomba de la membrana celular que lo intercambia
por el ión cloro. Así pues, el contenido de cloro de los glóbulos rojos en la sangre venosa es
mayor que en la sangre arterial, fenómeno que se conoce como desplazamiento o desviación
de cloruros.
Este mecanismo de conversión de dióxido de carbono hacia ácido carbónico por medio de la
anhidrasa carbónica, transporta el 70% de todo el dióxido de carbono hacia los pulmonares
(2,8 ml por 100 ml de sangre). Es obviamente el mecanismo más importante.
1.1.3.2.3.3. Transporte de dióxido de carbono en combinación con la hemoglobina y
con proteína plasmáticas: formación de carbaminohemoglobina:
El dióxido de carbono reacciona también con la hemoglobina para formar el compuesto
llamado carbaminohemoglobina (HgbCO2). Esta reacción se produce por medio de un
enlace muy laxo entre a hemoglobina y el CO2, de modo que el CO2 se libera fácilmente al
llegar al alvéolo a favor de su gradiente de presión.
Una pequeña cantidad de CO2 reacciona de igual manera con las proteínas plasmáticas, pero es
cuantitativamente mucho menos importante por que la cantidad de estas proteínas en la sangre
es tan sólo la cuarta parte de la hemoglobina.
La cantidad teórica de CO2 que se transporta unido a la hemoglobina y a las proteínas
plasmáticas es del 30% (1,2 ml por cada 100 ml de sangre). Sin embargo, esta reacción es
mucho más lenta que la reacción del dióxido de carbono con agua dentro de los glóbulos rojos.
Por tanto, es difícil que este mecanismo transporte más del 15 – 25% de la cantidad total de
dióxido de carbono.
La mayor parte del transporte de dióxido de carbono en la sangre se realiza en forma de
bicarbonato; sin embargo, éste es muy poco difusible a través de la membrana celular. Por tal
motivo, el dióxido de carbono difundirá inicialmente hacia la sangre y posteriormente hacia el
interior del glóbulo rojo donde por acción de la anhidrasa carbónica se asociará con agua para
producir ácido carbónico, el cual, posteriormente se disocia en bicarbonato e hidrógeno
1.1.3.2.3.4. Efecto Haldane:
La fijación de oxígeno a la hemoglobina tiende a desplazar dióxido de carbono hacia la sangre
y la desoxigenación de la hemoglobina tiende a aumentar su afinidad por el CO2, este es el
denominado efecto Haldane. La explicación a este efecto es la siguiente:
Cuando el oxígeno se combina con la hemoglobina a nivel alveolar, hace que ésta se vuelva
mucho más ácida. Esto, a su vez, expulsa CO2 hacia el alvéolo por dos mecanismos: el primero
se debe a la pérdida de afinidad de la hemoglobina por el CO2 cuando la primera se torna
ácida. El segundo, es producido porque la acidez aumentada de la hemoglobina hace que ésta
libere un exceso de iones hidrógeno, que a su vez se fijan con iones bicarbonato para formar
ácido carbónico; a continuación, éste se disocia en agua y dióxido de carbono, y éste último se
libera desde la sangre hacia los alvéolos.
Finalmente, los mecanismos que hacen que el CO2 salga hacia los alvéolos, se invierten a nivel
tisular, cuando la hemoglobina está desoxigenada y tiende a ser menos ácida. En la periferia, y
por efecto de la difusión de oxígeno hacia los tejidos, la hemoglobina se vuelve mucho más
ávida por el CO2 aumentando el transporte de este gas desde los tejidos hacia el alvéolo.
1.1.3.2.3.5. Cambio de la acidez de la sangre durante el transporte de dióxido de
carbono:
El ácido carbónico formado por el dióxido de carbono penetra en la sangre a nivel de los
tejidos. Por fortuna, la reacción de este ácido con los amortiguadores de la sangre impide la
excesiva elevación de la concentración de iones hidrógeno. En condiciones normales, el pH de
la sangre arterial es de 7,41 y cuando la sangre se carga con dióxido de carbono en los tejidos,
el pH cae aproximadamente a 7,37. Es decir el pH cambia en 0,04.
1.1.3.2.4. DIFUSIÓN DE DIÓXIDO DE CARBONO ENTRE LA SANGRE Y EL
ALVÉOLO:
La presión de dióxido de carbono en la sangre venosa que ingresa a los capilares pulmonares es
de 45 mm Hg, y la presión de CO2 en el alvéolo (PACO2) de 40 mm Hg. Por tanto, existe sólo
una diferencia de presión de 5 mm Hg entre la sangre capilar y el gas alveolar para la difusión
de CO2. Sin embargo, gracias a su alto coeficiente de difusión, las presiones entre alvéolo y
sangre se equilibran antes de que ésta haya transitado un tercio de la longitud del capilar
pulmonar.
Esta diferencia de presiones entre sangre y alvéolo puede verse alterada por cambios en la
ventilación de la zona de intercambio gaseoso, la cual determina a su vez la presión de este gas
en el alvéolo. En condiciones de reposo, la presión sanguínea de CO2 que llega a los pulmones
es de de 45 mm Hg (PvCO2) y la PAO2 es de 40 mm Hg, lo que produce un gradiente para la
difusión de 5 mm Hg como se explicó previamente; al salir del pulmón, la sangre tendrá una
presión de dióxido de carbono de 40 mm Hg (PaO2). Ahora, si se mantiene fijo el gasto
cardiaco pero se aumenta la ventilación alveolar, la PACO2 disminuirá porque habrá mayor
salida de gas hacia la atmósfera. Esta disminución de la PACO2 aumenta el gradiente de
difusión y por ende existirá mayor paso de CO2 desde la sangre al alveolo. Así, la PaCO2
disminuye. En el caso contrario, si se disminuye la ventilación alveolar sin modificar el gasto
cardiaco, la PACO2 aumenta, pues habrá menor salida de CO2 hacia la atmósfera, por tal
motivo el gradiente de difusión disminuye y existirá menor paso de CO2 desde la sangre hacia
el alveolo. Finalmente, la PaCO2 aumenta.
Por otra parte, el gradiente de difusión puede verse alterado por cambios en el gasto cardiaco.
Si no se modifica la ventilación alveolar y se eleva el gasto cardiaco, la cantidad de CO2 que
llega a los capilares pulmonares será mayor y por consiguiente su paso a los alvéolos también.
Si la ventilación alveolar no aumenta y por ende no se produce un mayor recambio del gas en
el alveolo, la PACO2 aumenta progresivamente y limita la posterior difusión de CO2 desde la
sangre hacia el alveolo. El resultado final es un aumento en la PaCO2.
Por el contrario, si se mantiene constante la ventilación alveolar y se disminuye el gasto
cardiaco, la cantidad de CO2 que llega al alveolo será baja, luego la cantidad de CO2 que
difunde hacia el alvéolo también lo es. La ventilación alveolar en estas circunstancias removerá
mayor cantidad de CO2 hacia la atmósfera que la que ingresa desde la sangre, a pesar de no
haberse modificado la ventilación alveolar. El efecto final será una disminución de la PaCO2.
Finalmente, es pertinente aclarar como se produce el tránsito de CO2 a través de la membrana
alveolocapilar y desde el alvéolo hacia la atmósfera durante la inspiración y la espiración.
Durante la inspiración, el alvéolo está abierto y permite la difusión de CO2 desde la sangre
hacia el alvéolo a través de la membrana alvéolo capilar. Luego, durante la espiración, el CO2
alveolar es expulsado hacia la atmósfera.
La medición del CO2 expirado es de gran utilidad clínica, pues la presencia de CO2 en el gas
que sale a la atmósfera desde los pulmones es, necesariamente, el reflejo de unos tejidos
metabolitamente activos (que producen CO2), de un sistema cardiovascular competente (que
transporta el CO2 hasta los pulmones) y de un sistema respiratorio que lo recoge de la sangre y
lo lleva a la atmósfera. Es decir, la medición del CO2 espirado informa sobre el metabolismo
celular, la función cardiovascular y la respiratoria.
2. EQUILIBRIO ACIDO BASE
El equilibrio ácido base hace referencia, en realidad, a un complejo sistema de reacciones
químicas que regula la concentración de iones hidrógeno en los líquidos corporales. Esta
concentración de iones hidrógeno debe mantenerse dentro de un estrecho margen porque
pequeños cambios en la misma pueden producir grandes alteraciones en las reacciones
químicas celulares, aumentando unas e inhibiendo otras con impacto importante en la
fisiología corporal. Por este motivo, el equilibrio ácido base es uno de los aspectos más
importantes de la homeostasis.
2.1. El ión hidrógeno:
El hidrógeno en estado libre sólo se encuentra en muy pequeñas cantidades en la atmósfera,
aunque en el espacio interestelar abunda en el Sol y otras estrellas siendo de hecho el elemento
más común en el Universo. En combinación con otros elementos se encuentra ampliamente
distribuido en la Tierra donde hace parte del compuesto más importante para la vida, el agua.
El hidrógeno se halla en todos los componentes de la materia viva y de muchos minerales.
También es parte esencial de todos los hidrocarburos y de una gran variedad de otras
sustancias orgánicas como los ácidos.
El cuerpo humano se compone de unos cuantos elementos combinados para formar una
extensa variedad de moléculas. El carbono, el hidrógeno, el nitrógeno y el oxígeno son los
constituyentes principales de casi todas las biomoléculas. Sin embargo, la concentración de
iones hidrógeno libres en las soluciones biológicas es extremadamente bajo. El hidrógeno es
un protón, y como tal ellos se encuentran en los líquidos orgánicos asociados a otras moléculas
y reaccionando con el agua circundante.
Davis en 1958 observó que prácticamente todos los compuestos intermedios de las vías
metabólicas tienen al menos un grupo que puede ser ionizado con un pH fisiológico, sea este
un ácido o una base. Estos grupos son el fosfato, el amonio y el ácido carbónico. Sólo algunas
macromoléculas, lípidos insolubles en agua y productos de desecho escapan a esta
generalización.
Davis destaca la ventaja que representa para la célula la ionización de sustancias dependiente de
la concentración de iones hidrógeno ya que le permite retener en su interior a estos
compuestos ionizados para su utilización. Además, la carga neta de las proteínas también
depende del pH y su función depende de esta carga por que ésta determina la forma
tridimensional de la molécula y sus características asociadas.
2.2. Impacto del exceso de iones hidrógeno:
El control de la concentración de hidrogeniones en el organismo es de importancia central
porque los hidrogeniones se unen ávidamente a las proteínas alterando su forma y función. El
impacto es grande si se considera la amplia distribución de las proteínas en todos los
compartimientos corporales y sobre todo a nivel intracelular, donde se desempeñan como
enzimas, receptores, canales iónicos, entre otros. Además, como se explica de manera
detallada más adelante, en casos de acidosis severa las proteínas se convierten en un importante
sistema tampón uniéndose a los iones hidrógeno y amortiguando los cambios en le pH. La
protonación de las proteínas afecta de manera severa su función ya que existe una estrecha
relación entre función y estructura, y al cargarse con H+ las proteínas pierden su forma. Por
ejemplo, en medio de la acidosis los receptores adrenérgicos sufren cambios estructurales que
los hacen resistentes al estímulo de la adrenalina y noradrenalina con efecto deletéreo sobre la
función contráctil del corazón. De ahí que, la acidificación del músculo cardíaco tiene un
efecto inotrópico negativo directo con disminución de la contractibilidad hasta en un 40 a 50%
porque compromete la sensibilidad de la troponina C por el calcio, inhibe el intercambio entre
el sodio y el calcio en la célula y altera la unión entre actina y miosina. Otros efectos
producidos por el aumento de los iones hidrógeno son la disminución del gasto cardíaco con
hipotensión, la disminución del flujo sanguíneo renal y hepático, la aparición y el aumento de la
susceptibilidad a las arritmias. Generalmente estos efectos aparecen cuando el pH esta por
debajo de 7.25. De lo anterior se deduce que el organismo debe controlar muy cuidadosamente
la concentración de hidrogeniones para mantener la homeostasis. Otro efecto importante del
aumento de la concentración de los iones hidrógeno es la depresión del sistema nervioso
central, en estos casos se presenta somnolencia y desorientación e incluso coma cuando el pH
sanguíneo desciende por debajo de 7.0.
2.3. Definición de términos: acido, base y buffer.
Un ácido (HA) es una molécula que se disocia en iones hidrógeno (H+) y una base conjugada
(A-).
HA ↔ H+ + ACuando el ácido esta en una solución entrega iones hidrógeno a la misma. Así, el ácido
clorhídrico (HCl) disuelto en agua, se disocia en iones hidrógeno y cloruro (H+ y Clrespectivamente); éstos iones hidrógeno son donados a la solución. Si la molécula es capaz de
entregar gran cantidad de iones hidrógeno se denomina ácido fuerte, como en el caso del ácido
clorhídrico. Los ácidos con una capacidad de disociación menor como el ácido carbónico
reciben el nombre de ácidos débiles. Es decir, la fuerza de un ácido es proporcional a su
grado de disociación.
Una base es una molécula que dentro de una solución recibe iones hidrógeno. Por ejemplo, el
bicarbonato (HCO3-) es una base porque disuelto en agua puede aceptar un hidrógeno para
formar ácido carbónico (H2CO3). Una base fuerte es aquella que se une rápidamente con los
iones hidrógeno eliminándolos de la solución. Un ejemplo típico es el ión hidroxilo (OH-). Por
su parte, el ión bicarbonato (HCO3-) es una base débil, ya que su capacidad de ligar
hidrogeniones es mucho menor. Así, la fuerza de una base es proporcional a su capacidad para
aceptar iones hidrógeno. Es importante anotar que las proteínas funcionan como bases porque
algunos de sus aminoácidos tienen la capacidad de ligar o aceptar iones hidrógeno,
constituyendo de esta manera uno de los mecanismos más importantes para el equilibrio ácido
base.
La mayor parte de las moléculas implicadas en el equilibrio ácido base son ácidos y bases
débiles, siendo los más importantes el ión bicarbonato y el ácido carbónico.
Un buffer es una sustancia que acepta o dona fácilmente iones hidrógeno a una solución. Esto
permite mantener una concentración de iones hidrógeno libres estable a pesar de existir
cambios importantes en la concentración total de hidrogeniones.
2.4. Constante de disociación:
El proceso por el cual una molécula se fraccionada en iones dentro de una solución recibe el
nombre de disociación o ionización. Por ejemplo, el ácido carbónico (H2CO3) se disocia en
hidrógeno (H+) y bicarbonato (HCO3-):
[H2CO3] ↔ [H+]+ [HCO3-]
Sin embargo, el grado de disociación o ionización no es igual para todas las sustancias, ya que
es directamente proporcional a la fuerza de la molécula. Así, un ácido fuerte tendrá un grado
mayor de disociación que uno débil. Lo anterior produce una constante de disociación, que
es la proporción entre la cantidad ionizada y no ionizada de una molécula en solución, y que
como vimos, depende de la fuerza de la molécula.
La ley de acción de masas dicta que en la ecuación anterior, el producto de las concentraciones
de la derecha dividido por la concentración de la izquierda es igual a una constante KA, esta
constante, es la constante de disociación.
KA = [H+] x [HCO3-]/[H2CO3].
De la fórmula anterior se deduce que si la constante de ionización es de uno, el 50% de la
sustancia estará ionizada. Si es mayor de 1, entonces habrá una mayor proporción de la
sustancia ionizada con respecto a la no ionizada, y finalmente, si es menor de 1, la mayor
fracción de la sustancia estará sin ionizarse.
2.5. pK:
Se define el pK como el valor del pH en el cual, la mitad de la sustancia esta disociada, es
decir, si el pK y el pH son iguales, la sustancia estará 50% ionizada y 50% no ionizada. El pK
se determina con el logaritmo negativo de la constante de disociación:
pK = - log10KA
Como el pK de una sustancia es una constante física, el pH de la solución es quien determina
la proporción entre la fracción ionizada y no ionizada de la misma.
De acuerdo con lo anterior, si el pH de la solución es mayor que el pK de la molécula, ésta se
disocia entregando hidrogeniones y la solución se vuelve ácida. Por el contrario, si el pH es
menor que el pK, la molécula recibe hidrogeniones de la solución y ésta se torna básica o
alcalina.
2.6. Concentración de iones hidrogeno, y pH de los líquidos corporales:
La concentración de iones hidrógeno libres en el plasma es del orden de 40 nmol/L. Un
nanomol es la millonésima parte de un mol (mol x 10-9). Estas cifras son llamativamente
pequeñas, especialmente si se las compara con la concentración de otras sustancias del plasma
como el sodio, cuya concentración es de 140 mmol/dl, es decir, la concentración de sodio es
3.500.000 veces mayor que la de iones hidrógeno. A pesar de ello, mantener esta baja
concentración de iones hidrógeno es fundamental para las funciones celulares.
Resulta evidente la incomodidad de expresar la concentración de iones hidrógeno con valores
numéricos tan pequeños (0,00000040 mol/L). Por tal razón, se expresa dicho valor con una
escala logarítmica a través del pH. Por lo tanto, el pH expresa la concentración real de
hidrogeniones mediante la siguiente fórmula:
pH = log10{1/[H+]} = -log10[0,000000040], pH = 7.4.
A pesar de ser más cómoda, la expresión logarítmica de la concentración de hidrogeniones
(pH) puede generar una falsa sensación sobre el cambio real en la concentración de iones
hidrógeno. Por ejemplo, el cambio de pH desde 7.4 a 7.1 puede interpretarse como un cambio
pequeño (0.3) cuando en realidad está expresando una alteración en la concentración de
hidrogeniones desde 40 nmol/L hasta 80nmol/L, es decir, una diferencia del 100%
El pH normal de la sangre arterial es de 7.4. Valores inferiores reflejan un aumento de la
concentración de iones hidrógeno, lo que se denomina acidosis. Por el contrario, el aumento
del pH es el resultado de la disminución en la concentración de hidrogeno y recibe el nombre
de alcalosis.
2.7. MECANISMOS PARA MANTENER EL PH CORPORAL:
Para evitar la aparición de acidosis o alcalosis, existen diversos sistemas de control, ellos son:
1. Sistemas buffers que al combinarse rápidamente con un ácido o una base, evitan
cambios excesivos en la concentración de iones hidrógeno libres. Este mecanismo
actúa en fracciones de segundos pero su capacidad es limitada y no puede corregir
totalmente las alteraciones del pH.
2. El sistema respiratorio puede responder a cambios en el pH plasmático modificando la
excreción de CO2. Su respuesta es rápida, estableciéndose en pocos minutos y el
sistema tiene una gran capacidad de reserva.
3. El sistema renal puede modificar la concentración de bicarbonato en el plasma y actúa
produciendo orina ácida o alcalina dependiendo del pH plasmático. Este mecanismo
permite la corrección completa de las alteraciones de pH pero su capacidad de
respuesta es lenta, en orden de días.
2.7.1. Sistemas Buffer:
Los buffer son sustancias que tienen la capacidad de aceptar o entregar un ión hidrógeno a una
solución cuando a esta se le suma un ácido o una base fuerte. Un buffer puede ser
representado de la siguiente manera: HA ↔ H+ + A- donde HA es un ácido débil no
disociado y A- es su base conjugada. Los ácidos débiles no están completamente disociados ya
que su pK es muy cercano al pH de la solución en los cuales actúan, esto les otorga su
capacidad de amortiguación ante cambios súbitos en la concentración de iones hidrógeno.
Si se adiciona un ácido a la solución (H+) éste se asocia con la base (A-) para formar HA que es
un ácido débil. De esta manera el buffer logra transformar un ácido fuerte en otro débil y
mantener estable la concentración de iones hidrógeno libres dentro de la solución. De igual
manera, si se adiciona una base (A-) el buffer amortigua el cambio del pH donando iones
hidrógeno y de esta forma el pH de la solución se mantiene estable.
El poder de los sistemas buffer depende del pK del mismo y de la concentración de sus
componentes. Es máximo cuando el pH del fluido corporal es igual al pK del buffer ya que en
esta situación los ácidos y las bases de éste están presentes en iguales concentraciones, y
pueden amortiguar con eficiencia la adición de un ácido o de un álcalis fuerte. Por otra parte, si
el pH de la solución se distancia del pK, el balance entre los componentes del buffer se pierde
y se reduce su capacidad de respuesta. Así, cuando la concentración de un componente es más
de 8 veces la concentración del otro la capacidad del sistema es muy limitada. Esto se puede
representar gráficamente.
Los componentes de un buffer deben estar presentes en cantidades suficientes para operar de
una manera efectiva. Si la concentración del buffer es muy baja, los componentes serán
fácilmente desbordados ante cambios del pH. Esto explica porque un sistema buffer puede ser
efectivo en un fluido corporal y no en otro. Por ejemplo, el fosfato es el mayor buffer
intracelular pero tiene una limitada eficacia en la sangre donde su concentración es mucho
menor.
Los tres sistemas buffers principales del organismo son el bicarbonato, el fosfato y las
proteínas.
2.7.1.1. Sistema buffer del bicarbonato:
El sistema buffer bicarbonato (HCO3-) consiste en una mezcla de ácido carbónico (H2CO3) y
bicarbonato de sodio (NaHCO3) en la misma solución. Cuando se añade un ácido fuerte como
el ácido clorhídrico (HCl) al sistema buffer del bicarbonato ocurre la siguiente reacción:
HCl + NaHCO3 → H2CO3 + NaCl
Como se puede observar, el ácido fuerte (HCl) es convertido en un ácido débil (H2CO3). De
esta manera la adición de ácido clorhídrico a la solución baja sólo ligeramente el pH.
Si se considera ahora lo que sucede cuando una base fuerte como el hidróxido de sodio
(NaOH) se añade a una solución que contiene ácido carbónico, se observa la siguiente
reacción:
NaOH + H2CO3 → NaHCO3 + H2O.
En la reacción anterior, se produjo un intercambio de una base fuerte (NaOH) por una débil
como el bicarbonato de sodio (NaHCO3).
El sistema bicarbonato no es muy poderoso por dos motivos. En primer lugar, el pH del
líquido extracelular es de 7.4 mientras que el pK del bicarbonato es de 6.1. En estas
circunstancias existe 20 veces más ión bicarbonato que anhídrido carbónico disuelto. Por este
motivo, el sistema funciona en una porción de la curva de taponamiento poco eficaz. En
segundo lugar, las concentraciones de anhídrido carbónico y de bicarbonato no son muy altas.
A pesar de lo anterior, éste es el sistema buffer más importante del organismo en el líquido
extracelular porque sus dos componentes fundamentales pueden ser estrechamente regulados,
el ácido carbónico por los pulmones, y el ión bicarbonato por los riñones. En consecuencia, el
pH de la sangre puede ser modificado por éstos órganos.
2.7.1.2. Sistema buffer fosfato:
El sistema buffer fosfato consta de los siguientes elementos H2PO4 y HPO4=. Cuando se añade
un ácido fuerte a este sistema, ocurre la siguiente reacción:
HCL + Na2HPO4 → NaH2PO4 + NaCL.
El resultado neto es que el ácido clorhídrico desaparece, formándose en su lugar fosfato
monosódico que es un ácido débil y por ende el pH de la solución se modifica escasamente.
Por el contrario, cuando se añade una base fuerte tiene lugar la siguiente reacción:
NaOH + NaH2PO4 → Na2HPO4 + H2O.
Aquí, la base fuerte (NaOH) ha sido reemplazada por una débil Na2HPO4 modificando
discretamente el pH.
El sistema fosfato tiene un pK de 6.8 que es muy cercano al pH de los líquidos orgánicos; esto
permite al sistema operar cerca de su máximo poder de tampón. Sin embargo, su
concentración en el líquido extracelular es dos veces más baja que la del bicarbonato y por esta
razón su poder de buffer es menor que la de éste en dicho compartimiento.
El tampón fosfato es muy importante en los túbulos renales por dos razones: en primer lugar,
su concentración aumenta significativamente a nivel tubular. En segundo lugar, el líquido
tubular es mucho más ácido que el extracelular acercando el pH de la solución al pK del
fosfato, permitiendo al sistema operar en la porción óptima de la curva de tamponamiento.
Este sistema opera también de manera óptima a nivel intracelular ya que su concentración
dentro de la célula es mayor y el pH intracelular es más ácido y cercano al pK del fosfato.
2.7.1.3. Sistema buffer de las proteínas:
El sistema buffer de las proteínas tiene un gran poder de amortiguación gracias a su pK de 7.4
y a su amplia distribución por todo el cuerpo. Este sistema buffer proporciona tres cuartas
partes de la capacidad tampón química total del organismo.
El sistema buffer de las proteínas tiene un papel muy importante en la regulación ácido base a
nivel intracelular donde ellas son abundantes. Sin embargo, su capacidad de respuesta a
cambios del pH extracelular es lenta por que las moléculas cargadas de los fluidos
extracelulares como el hidrógeno y el bicarbonato difunden lentamente a través de las
membranas antes de ser amortiguados por las proteínas en el interior de la célula.
2.7.1.4. Sistema buffer de la hemoglobina:
Los residuos de histidina en las cadenas de globina de la hemoglobina contienen grupos
imidazol. Estos grupos cargados se disocian en solución y actúan como un importante buffer
dentro del eritrocito. Los grupos imidazol de la desoxihemoglobina se disocian menos rápido
(pK 7.8) que aquellos de la oxihemoglobina (pK 6.6), convirtiendo a la desoxihemoglobina en
un ácido débil y así en un mejor buffer (recuerde que el pH intracelular es más ácido que el
plasmático). Esta diferencia en la capacidad buffer de la hemoglobina oxigenada y
desoxigenada da origen al efecto Haldane (que se explicó en la sección de transporte de
oxígeno por la hemoglobina). La anhidrasa carbónica y el cambio de cloro por bicarbonato
permiten a este sistema buffer responder efectiva y rápidamente a cambios del pH plasmático.
2.7.1.5. Principio isohidrico:
A pesar de haber sido discutidos de forma separada, todos los sistemas tapón actúan
conjuntamente ya que los iones hidrógeno son comunes a todas las reacciones químicas. Por
tal razón, existe un equilibrio constante entre todos los sistemas buffer del organismo lo cual se
conoce con el nombre de principio isohidrico.
La importancia de este principio es que los cambios en un determinado sistema buffer
determinan cambios en los restantes pues todos ellos se amortiguan entre sí, transfiriéndose
hidrogeniones unos a otros.
Este principio permite también examinar todos los sistemas buffer por medio de la medición
de uno sólo. Así, la capacidad buffer del organismo se valora fácilmente con la medición del
bicarbonato y el dióxido de carbono en una muestra de sangre.
2.8. CONTROL RESPIRATORIO DEL BALANCE ACIDO BASE:
El metabolismo intracelular genera alrededor de 12.000 mmol de iones hidrógeno en 24 horas.
El 98% de esta carga ácida consiste en dióxido de carbono que como se explicó en el apartado
sobre ventilación, es transportado por la sangre hasta el alvéolo para ser expulsado hacia la
atmósfera por el sistema respiratorio.
CO2 + H2O ↔ H2CO3 ↔ HCO3- + H+
Gracias al carácter reversible de la ecuación, cambios en la PaCO2 rápidamente producen
modificaciones en la [H+] y cambios en la concentración de hidrogeniones a su vez, generan
alteraciones en la presión de dióxido de carbono. Estos cambios en el equilibrio ácido base son
detectados por quimiorreceptores a nivel central (sensibles al pH) y periférico (sensibles a la
PaCO2) quienes envían información hacia el centro respiratorio del tallo cerebral causando los
ajustes necesarios en la ventilación alveolar. Este sistema de retroalimentación es capaz de
responder a perturbaciones del pH en cuestión de minutos. Sin embargo, como todo sistema
de retroalimentación, a medida que éste corrige el problema el estímulo que genera el cambio
diminuye y la corrección no alcanza a ser completa logrando una eficacia del 75%. Es decir, si
la concentración de hidrogeniones disminuye bruscamente de 7.4 a 7, el sistema respiratorio en
un lapso de 3 a 12 minutos restaura el pH hasta un valor de 7.3. Por este motivo, el sistema
respiratorio no puede corregir completamente los cambios en el pH. A pesar de ello, la
regulación respiratoria del pH tiene un poder buffer una o dos veces mayor que el de todos los
sistemas tampón químicos del organismo juntos.
2.9. CONTROL RENAL DEL BALANCE ACIDO BASE:
Los riñones eliminan el 2% de la carga ácida producida por el metabolismo celular, esto
representa unos 70 -100 mmol de ácido no volátil cada día. Esta cantidad es muy pequeña si se
compara con los 12.000 mmol/día eliminados por el sistema respiratorio, pero muy grande con
respecto a la concentración de iones hidrógeno en el plasma (40 nmol/L).
La participación del riñón es fundamental para el equilibrio ácido base porque es la única vía de
eliminación para los ácidos no volátiles y para otros patológicos como los cetoácidos, los
fosfatos y el lactato; El riñón regula la concentración de hidrogeniones en los líquidos
corporales excretando orina ácida o básica según sea necesario a través de mecanismos
reguladores sobre la eliminación de iones H+ y reabsorción de HCO3-. Estos mecanismos son
diferentes en las partes proximales y distales del sistema tubular renal por lo que serán descritos
de manera separada.
2.9.1. Segmentos tubulares proximales:
El dióxido de carbono existente en el interior de las células tubulares, es la suma del CO2 que
difunde desde el líquido extracelular, más el que lo hace desde la luz del túbulo, más el CO2
que se produce en el interior de la célula. Este dióxido de carbono reacciona con el agua por
acción de la anhidrasa carbónica ntracelular para formar ácido carbónico (H2CO3) el cual da
origen al bicarbonato (HCO3-) e hidrógeno (H+).
CO2 + H2O ↔ H2CO3 ↔ HCO3- + H+
Este H+ que se produce en el interior de la célula tubular es contratransportado hacia la luz del
túbulo con el sodio que de la luz tubular se transporta en dirección opuesta hacia la célula a
favor de su gradiente de concentración. Así, en los túbulos proximales, porción ascendente
gruesa del asa de Henle y en la parte proximal de los túbulos distales se secretan iones
hidrógeno hacia la luz tubular por medio de transporte activo secundario.
Este mecanismo es responsable de la secreción del 90% de hidrogeniones hacia la luz tubular
pero es limitado cuando la concentración de H+ intraluminales es elevada.
2.9.2. Segmentos tubulares distales:
La porción final de los túbulos distales y los tubos colectores sobre todo los medulares son
ricos en células intercaladas donde la secreción de iones H+ se realiza por transporte activo en
contra de un gradiente de concentración a través de la ATPasa de hidrógeno (bomba de
H+ATP). Este mecanismo es responsable del 5% de la secreción de hidrogeniones por el riñón
y permite aumentar la [H+] en más de 900 veces en el interior de la luz tubular.
2.9.3. Reabsorción de bicarbonato:
En condiciones normales, el 20% de la sangre que fluye por las nefronas es filtrada a nivel del
glomérulo determinando el paso de un ultrafiltrado de plasma hacia la luz tubular. Este
ultrafiltrado tiene básicamente las mismas sustancias que la sangre exceptuando las proteínas y
hematíes, siendo rica en bicarbonato y sodio entre otras. De acuerdo con lo anterior, la
cantidad de bicarbonato filtrado es el producto de la tasa de filtración glomerular (180L/día)
por la concentración de bicarbonato en el plasma (24 mmol/L), esto es, entre 4000 y 5000
mmol/día (180 x 24 = 4320mmol/día). Luego durante su recorrido por el sistema de túbulos
renales, el riñón reabsorbe gran cantidad de estas sustancias (HCO3- y Na+) y secreta otras
como H+.
Cerca del 90% del bicarbonato filtrado es reabsorbido en el túbulo proximal y el resto en el
túbulo contorneado distal y los conductos colectores. La reabsorción del bicarbonato no puede
realizarse de manera directa ya que esta es una molécula grande y los túbulos resultan
impermeables a ella. Por esta razón, el bicarbonato filtrado proximalmente por el glomérulo
reacciona a nivel de la luz tubular con los iones H+ secretados a dicho nivel para formar ácido
carbónico que posteriormente se disocia en dióxido de carbono y agua. El CO2 así producido
difunde fácilmente hacia el interior de la célula y el agua queda a nivel tubular.
En resumen, a nivel intracelular el ácido carbónico se disocia en bicarbonato e hidrógeno. El
bicarbonato formado pasa al líquido extracelular y el hidrógeno se secreta a la luz tubular
donde reacciona con el bicarbonato procedente del glomérulo para formar agua y CO2. Este
CO2 formado difunde a la célula donde por medio de la anhidrasa carbónica forma
bicarbonato. Es decir, el efecto neto de estas reacciones químicas es que por cada ión
hidrógeno que se secreta se reabsorbe un ión bicarbonato desde la luz tubular.
De acuerdo con lo anterior, la cantidad de hidrógeno y bicarbonato producido es igual lo que
resulta en su neutralización a nivel tubular y en la formación de dióxido de carbono y agua. Sin
embargo, esta neutralización no es completa porque debe permanecer cierta cantidad de
hidrogeniones en la luz tubular para ser excretados por la orina (60 -100 mmol/día). Además,
la producción de bicarbonato supera en algunas ocasiones a la de hidrogeniones debiendo ser
eliminado por la orina. Por esta razón, el riñón controla el estado ácido base por medio de la
neutralización incompleta a nivel tubular del hidrógeno y el bicarbonato permitiendo que uno
u otro sea eliminado por la orina, lo que finalmente, produce su disminución en el líquido
extracelular.
Durante la acidosis cada ión excretado de hidrógeno produce la absorción de bicarbonato y
sodio. Es decir, la compensación renal de la acidosis se realiza mediante la excreción de ácido y
la reabsorción de base.
Durante la alcalosis el aumento del bicarbonato en la sangre lleva a su mayor filtración por el
glomérulo aumentando su concentración a nivel tubular. Esto produce una ganancia de
bicarbonato con respecto a la de iones hidrógeno y la mayor excreción de base por la orina
pues el hidrógeno no será suficiente para reaccionar con todo el bicarbonato filtrado.
2.9.4. Transporte de hidrógeno en la orina:
La cantidad de hidrógeno libre en la orina es muy bajo, siendo excretado de esta manera menos
del 1% del H+ secretado a nivel tubular. La razón es que a medida que su concentración
aumenta se disminuye su secreción siendo totalmente inhibida al alcanzar un pH urinario de
4.5. Por tal motivo, los iones hidrógeno son eliminados por la orina a través de sistemas buffer.
El líquido tubular tiene dos sistemas buffer muy importantes: el sistema buffer fosfato y el
tampón amonio.
2.9.5. Transporte de iones hidrógeno en la orina por el sistema buffer fosfato:
El sistema buffer fosfato se compone de una mezcla de HPO4- y H2PO4=. Este buffer
aumenta su concentración significativamente ya que permanece en la luz tubular mientras el
agua es reabsorbida. Además, tiene un pK de 6.8 que es muy cercano al pH urinario. Por estas
razones este sistema es muy efectivo para transportar hidrogeniones en la orina.
La reacción química de este sistema es la siguiente:
H+ + HPO4= ↔ H2PO4Estos iones H+ provienen de la disociación del ácido carbónico en el interior de las células
tubulares de tal manera que por cada ión hidrógeno que se tampona en la luz del túbulo, se
produce un ión bicarbonato a nivel intracelular. Esto contribuye aún más a la corrección del
desequilibrio ácido base.
2.9.6. Transporte de iones hidrógeno en la orina por el sistema buffer amoniaco:
Este sistema buffer está conformado por el ión amonio (NH4+) y por el amoníaco (NH3).
Todas las células tubulares excepto las de la porción delgada del asa de Henle sintetizan de
forma continua amoníaco que difunde hacia la luz tubular. El amoniaco reacciona con el ión
hidrógeno para formar iones amonio.
H++ NH3 ↔ NH4+
Este sistema buffer es especialmente importante por dos razones:
1. A medida que el amoniaco se combina con el hidrógeno para formar ión amonio, la
concentración de amoníaco en la luz del túbulo disminuye, lo que aumenta su difusión
desde la célula epitelial hacia la luz del túbulo. De esta forma, la secreción de amoníaco
está controlada por la concentración de hidrogeniones en exceso que deben ser
tamponados. Es decir, el ión hidrógeno contribuye con la excreción de amoníaco.
2. El cloro es el ión de carga negativa más abundante en la luz tubular, si éste se combina
con el hidrógeno se produce ácido clorhidrico (HCl) que al ser un ácido fuerte produce
una gran disminución del pH en la orina. Como se mencionó antes, la disminución del
pH a valores cercanos a 4.5 inhibe la secreción de hidrogeniones. El sistema buffer
amoníaco evita que el pH de la orina descienda significativamente, ya que el H+ se
combina con el amonio y no con el cloro evitando la formación de ácido clorhidrico.
De esta manera este sistema tampón permite que se pueda seguir excretando iones
hidrógeno por la orina.
En estados de acidosis crónica las células tubulares sintetizan mayores cantidades de
glutaminasa, enzima que se encarga de liberar amoníaco a partir de glutamina. Este mecanismo
permite aumentar la secreción de amoníaco desde unos 30 mmol/día hasta 300 – 450
mmoles/día, demostrando que este sistema buffer se puede adaptar para manejar grandes
cantidades de hidrogeniones.
2.10. RESPUESTA RENAL AL DESEQUILIBRIO ÁCIDO BASE:
2.10.1. Acidosis metabólica:
La disminución de bicarbonato plasmático genera menor disponibilidad de bicarbonato en el
líquido tubular para la excreción de hidrogeniones. Se utilizan entonces los buffers fosfato y
amonio para optimizar la excreción de hidrógeno. Estos mecanismos requieren niveles
plasmáticos adecuados de sodio y fosfato.
2.10.2. Acidosis respiratoria:
El aumento de PaCO2 incrementa el nivel de PCO2 de las células tubulares, aumenta la
concentración intracelular de hidrogeniones y estimula los mecanismos de excreción,
resultando en una mayor excreción de H+ y mayor absorción de HCO3- hacia la sangre. Estos
mecanismos requieren niveles sanguíneos adecuados de sodio y fosfato.
2.10.1. Alcalosis metabólica:
La capacidad del riñón para disminuir la reabsorción de HCO3- de la orina y de reducir la
excreción de H+ es muy efectiva para proteger contra la alcalosis metabólica, siempre y cuando,
no se requiera una mayor reabsorción de sodio y potasio de lo normal. La hiponatremia
provoca aumento de la reabsorción renal de sodio, lo que exige mayor excreción de H+ y
retención de HCO3- (empeora la alcalosis). Los altos niveles de aldosterona (tratamiento con
mineralocorticoides) aumentan la reabsorción de sodio en los túbulos dístales. La
hipopotasemia aumenta la reabsorción de K+ y utiliza los mismos mecanismos involucrados en
la reabsorción de sodio.
2.10.2.Alcalosis respiratoria:
Los bajos niveles de PaCO2 en los túbulos renales disminuyen la producción de H+ por el
sistema de anhidrasa carbónica, reduciendo la recuperación de HCO3- y la excreción de H+.
2.11. MECANISMOS ELECTROLÍTICOS RENALES:
2.11.1. Ión Potasio:
Gracias a la acción de la Na-K-ATPasa, existe una alta concentración intracelular de potasio y
una alta concentración extracelular de sodio. En caso de deficiencia significativa de potasio
plasmático, éste saldrá de la célula y se mantendrán niveles plasmáticos normales a pesar de la
depleción del mismo a nivel intracelular. Para mantener el equilibrio eléctrico, la salida de K+
será compensada por el ingreso a la célula de H+ y salida adicional de HCO3- hacia la sangre.
De esta manera, la hipopotasemia genera una alcalosis metabólica extracelular (exceso de
HCO3-) y una acidosis intracelular (exceso de H+). Finalmente, el potasio en reabsorbido desde
la luz tubular a cambio de la secreción de hidrogeniones. Como se explico antes, la secreción
de H+ produce la reabsorción de ión bicarbonato lo que contribuye más al desarrollo de
alcalosis metabólica generada por la hipopotasemia.
2.11.2. Ion Sodio:
La hiponatremia exige reabsorción renal de sodio lo que aumenta la recuperación de HCO3- y
la excreción de H+, de esta manera, la hiponatremia produce alcalosis metabólica.
2.11.3. Ion cloruro:
El Cl- es intercambiado libremente a través de casi todas la las membranas celulares y por lo
tanto se distribuye por igual adentro y afuera de la célula. Cuando el Cl- disminuye, se afecta el
intercambio de cationes a nivel tubular renal porque se deben usar o producir otros aniones
como el HCO3-.
3. ANÁLISIS DE LOS GASES SANGUÍNEOS
Los datos obtenidos de los gases sanguíneos son utilizados para valorar las siguientes funciones
vitales:
1. Oxigenación.
2. Ventilación.
3. Equilibrio ácido base.
4. Perfusión periférica.
A continuación se describe detalladamente la interpretación de los gases sanguíneos en función
de cada uno de estas cuatro funciones.
3.1. ANÁLISIS DE LA OXIGENACION.
Se debe valorar la oxigenación para descartar la presencia de hipoxia y de hipoxemia. Esta
última se define como la disminución en la PaO2 por debajo del valor normal esperado (el valor
de normalidad depende de la altura sobre el nivel del mar y de la FiO2).
El pronóstico de los pacientes críticos depende más de una adecuada oxigenación que de
cualquier otro factor. La oxigenación anormal es el centro fisiopatológico de la falla respiratoria
aguda y todos los intentos de manejo se centran en su corrección.
Son 4 los mecanismos fisiopatologicos que pueden generar hipoxemia.
• Baja presión de oxígeno inspirado.
• Hipoventilación alveolar.
• Alteración V/Q.
• Shunt intrapulmonar.
3.1.1. Baja presión de oxígeno inspirado:
La baja PO2 inspirada es una causa poco común de falla respiratoria aguda, pero puede
aparecer en incendios importantes debido al consumo de O2 ambiental, en las grandes
altitudes, o en las unidades de cuidados intensivos cuando se interrumpe el flujo de O2 en un
paciente que lo requiere.
3.1.2. Hipoventilacion alveolar:
En la presencia de un gradiente alveolo arterial de oxígeno normal D(A-a O2) la
hipoventilación alveolar produce una caída en la PaO2 que es paralela con un aumento de la
PaCO2.
Como la presión de CO2 arterial y alveolar son prácticamente idénticas, la PaCO2 es usada para
determinar la presencia y magnitud de la hipoventilación alveolar. (ver figuras paginas
siguientes).
La figura muestra como la PaO2 y la PaCO2 cambian en direcciones opuestas en presencia de una D(A-a) O2
normal y un RQ de 0.8. La hipoventilación alveolar aumenta la PaCO2 por encima de 40 mmHg y disminuye la
PaO2 proporcionalmente. La hiperventilación (línea punteada) produce el efecto opuesto.
3.1.3.Alteracion en la ventilacion/perfusion (V/Q) como causa de hipoxemia.
Aunque la relación V/Q normalmente varía en las diferentes regiones pulmonares, el efecto
general aproxima la relación entre ambas a 1. Cuando la ventilación promedio se disminuye
en proporción a la perfusión (V/Q < 1) aparece hipoxemia (ver figura). Las áreas de baja
relación V/Q tienen alguna ventilación pero no logran saturar plenamente la hemoglobina.
Las alteraciones de la V/Q son la causa más común de hipoxemia en enfermos tanto críticos
como estables. Aún en pacientes con EPOC e hipoventilación alveolar la alteración de la V/Q
es generalmente la causa que más contribuye a disminuir la PaO2.
Esta causa de hipoxia mejora fácilmente aumentando la FiO2 ya que eleva la PAO2 en los
alvéolos hipoventilados y permite saturar completamente los capilares pulmonares. Esta es la
razón por la cual los pacientes con EPOC y asma aguda pueden ser manejados con modestas
cantidades de oxígeno suplementario a diferencia de los pacientes cuya hipoxemia se debe a
shunt en donde la administración de oxígeno no corrige el problema. (ver figura).
El diagrama muestra la hipoxemia debido a hipoventilación alveolar. Ambas graficas idealizan unidades
pulmonares con representación de la oxigenación al lado izquierdo y ventilación al lado derecho. En este ejemplo
la P (A-a)O2 se asume como cero. A. intercambio normal de gases. B. hipoventilación alveolar.
En el lado izquierdo se ilustra una unidad pulmonar normal con relación V/Q normal y en el lado derecho una
unidad con la relación V/Q baja (<1). La D(A-a)O2 se asume como cero. Durante la respiración, el oxígeno con
una presión inspirada de 150 mm Hg no es capaz de alcanzar el alveolo pobremente ventilado y de saturar
plenamente el capilar sanguíneo. En la figura B al dar una fracción inspirada de oxigeno mas alta (40%) con
PiO2 de 285 mm Hg se alcanza en el alvéolo con hipoventilación una PAO2 suficiente para que la PaO2 sea
cercana a lo normal.
3.1.4.Shunt de derecha a izquierda como causa de hipoxemia:
Si la sangre circula a través de unidades pulmonares sin ventilación como ocurre cuando el
alveolo está colapsado o lleno de líquido no puede oxigenarse. Esta sangre hipóxica se
mezclará con sangre oxigenada en otras unidades pulmonares sanas. A la salida del pulmón la
presión de oxígeno alcanzado será inferior a la esperada pues una porción de la misma no pudo
oxigenarse; el resultado será una disminución de la PaO2. Esta hipoxemia no cede con el
aumento del suplemento del O2, y se necesitan terapias como el PEEP para mejorar la
oxigenación.
La remoción de CO2 no esta usualmente afectada cuando la hipoxemia es ocasionada por
alteraciones de la ventilación/perfusión, y la PaCO2 es normal o más baja a menos que haya
otra razón para la hipoventilación. Esto se explica por la curva de disociación del CO2 que hace
que el CO2 salga fácil del capilar sanguíneo, y porque el paciente típicamente aumenta la
ventilación en respuesta a la hipercapnia. Lo mismo ocurre cuando sucede shunt de derecha a
izquierda excepto cuando la magnitud del shunt es demasiado grande.
El SDRA, el edema pulmonar cardiogénico y la neumonía lobar son causas comunes de
hipoxia generada en la presencia de shunt intrapulmonar.
La gráfica siguiente diagrama unidades pulmonares con shunt de derecha a izquierda, e ilustra
como el aumento de la fracción inspirada de oxigeno que aumenta la PiO2 no contribuye a
corregir la hipoxemia.
La medición del de la porción de sangre que se desvía por la circulación pulmonar sin
oxigenarse (shunt intrapulmonar) se puede hacer con el análisis de los gases sanguíneos
mediante el cálculo del Qs/Qt que es el índice de oro para tal efecto.
3.2. MEDICIÓN DE LA HIPOXIA:
Para valorar la oxigenación se han diseñado índices basados en la tensión de oxígeno, en el
contenido de oxígeno y en la saturación de la hemoglobina.
3.2.1. INDICES PARA EVALUAR LA OXIGENACION
a. Índices basados en la tensión de oxígeno
- Presión arterial de oxigeno.
- Diferencia alveolo arterial de oxigeno.
- Relación entre la presión arterial de oxigeno y la presión alveolar de oxigeno.
- Indice de oxigenación (Pa/FI).
b. Índices basados en los contenidos y en la saturación de oxígeno:
- Saturación arterial de oxigeno.
- Indice de aporte de oxigeno a los tejidos.
- Diferencia arteriovenosa de oxigeno.
- Indice de consumo de oxigeno
- Saturación venosa mezclada de la hemoglobina.
- Cálculo del shunt intrapulmonar (Qs/Qt).
- Fracción de la saturación arterial de oxigeno.
- Diferencia de la saturación arteriovenosa de oxigeno.
- Indice de ventilación/perfusión.
3.2.1.1. PRESION ARTERIAL DE OXIGENO (PaO2):
En un adulto sano a nivel del mar respirando aire ambiente, la PaO2 es usualmente de 97
mmHg con un gradiente alveolo-arterial de oxigeno de 4 mmHg.
Se puede definir el grado de hipoxemia según la presión arterial de oxígeno medida (PaO2).
Para esto existe una tabla de valores aplicable al nivel del mar:
•
•
•
Hipoxemia leve: PaO2 entre 80 mm Hg y 60 mm Hg.
Hipoxemia moderada: PaO2 entre 60 mm Hg y 40 mm Hg.
Hipoxemia severa: PaO2 < 40 mm Hg.
Por cada año de edad por encima de 60 años se resta 1 mm Hg a los límites de hipoxemia leve
y moderada.
En Bogota y Manizales con altura sobre el nivel del mar de 2660 mts y de 2153 mts
respectivamente, la PaO2 normal es de aproximadamente 65 mm de Hg de tal manera que el
margen entre la normalidad y la hipoxemia severa es de solo 20 mm Hg. En cualquier sitio y
por cualquier motivo una PaO2 de 40 mm Hg o menor se califica como hipoxemia severa.
Un alto valor de la PaO2 con un bajo nivel de suplemento de oxigeno indica muy
probablemente una muy buena función de oxigenación pulmonar. Sin embargo, evaluar la
PaO2 como indicador de buena oxigenación pulmonar en presencia de una FiO2 alta o terapias
como el PEEP (presión positiva al final de la expiración) es impreciso porque la PaO2 puede
estar en rangos normales por efecto de estas terapias en presencia de alteración pulmonar. En
estas circunstancias se deben utilizar otros índices de oxigenación, tales como el índece de
oxigenación (PAO2/FiO2) y el Qs/Qt.
3.2.1.2. CÁLCULO DEL EFECTO DEL SHUNT INTRAPULMONAR (Qs/Qt).
Uno de los factores determinantes de la oxigenación sanguínea es el grado de apertura alveolar
que se puede calcular mediante el índice de shunt intrapulmonar o Qs/Qt. Este índice
cuantifica el grado de desequilibrio entre la ventilación y perfusión pulmonar y es utilizado de
manera frecuente para el seguimiento de los pacientes.
El shunt intrapulmonar no debe ser mayor del 10%. Este grado de shunt medido con el
Qs/Qt corresponde a una Pa/Fi > de 280. Si el shunt está entre el 10-15% es considerado
anormal leve y equivale a una Pa/Fi entre 220-280.
La ecuación del shunt intrapulmonar puede ser mejor entendida por medio de la siguiente
figura:
La sangre llega a los pulmones después de haber entregado el oxígeno a los tejidos periféricos.
El contenido de oxígeno que le queda es el llamado contenido venoso de oxígeno (CvO2).
La línea de base representa la sangre con contenido venoso de oxígeno. Esta sangre después de
pasar por el alveolo queda con un contenido capilar de oxígeno (CcO2) que depende
directamente de la presión alveolar de oxígeno (PAO2). La línea v-c representa el ascenso en el
contenido de oxígeno de la sangre venosa si toda fuera oxigenada al pasar por el alvéolo. Como
siempre existe una porción de sangre que no pasa por los pulmones, o pasa pero no se
oxigena, el contenido arterial de oxígeno (CaO2) es menor que el CcO2. La línea v-a representa
el aumento real en el contenido de oxígeno desde el punto venoso hasta el arterial. La línea c-a
representa la diferencia entre el resultado ideal y el real. Como esta diferencia se debe al efecto
del shunt, la línea c-a representa entonces la porción del gasto cardíaco total que no se sometió
al intercambio gaseoso (Qs), mientras que la línea v-c representa el gasto cardíaco total (Qt).
Cone esta información se puede deducir entonces la ecuación para el cálculo del Qs/Qt.
Qs = gasto cardíaco desviado (shunt).
Qt = gasto cardiaco total.
Qs/Qt = c-a/c-v
La línea c-v representa la diferencia entre los contenido capilar y venoso de oxígeno, mientras
que la línea a-c representa la diferencia entre le contenido capilar y arterial. Reemplazando
estos valores tenemos la ecuación para el cálculo del efecto del shunt:
Qs/Qt = CcO2 - CaO2/CcO2 - CvO2
Donde, CcO2 es contenido capilar de oxógeno, CaO2 es contenido arterial de oxígeno y CvO2
corresponde al contenido venoso de oxígeno.
La manera de calcular los contenidos de O2 de la sangre se discutirán mas adelante (ver
perfusión), tanto arterial y venoso.
Cuando se desea medir el shunt verdadero, hay que hacer desaparecer el efecto de shunt
producido por las desigualdades en la relación V/Q. Esto se logra haciendo respirar al paciente
una atmósfera del 100% de oxígeno (FiO2 de l). Solo las áreas no ventiladas en absoluto se
manifestarán.
El cálculo del CcO2 se realiza así:
•
Primero se calcula la presión alveolar de oxígeno (PAO2);
PAO2 = (PB - PH2O) x FiO2 - PaCO2/RQ (El RQ normal es de 0.8).
PB: Presión barométrica.
PH2O: Presión de vapor de agua en la vía aérea (47 mm Hg).
FiO2 : Fracción inspirada de oxígeno.
RQ: Indice o cociente respiratorio.
NOTA: Un cálculo aproximado de la presión barométrica se puede realizar con la siguiente
fórmula:
PB = 760 x 2.7183 (-0.00012 x altura en metros)
•
Luego se calcula el contenido capilar de oxígeno (CcO2) como sigue:
CcO2 = Hb x 1.36 x SaO2 + PAO2 X 0.003.
Donde:
CcO2: Contenido capilar de oxigeno.
Hb: concentración de hemoglobina (gr/dl).
SaO2: Es la saturación arterial de la hemoglobina con oxígeno. Es un valor dado por el
analizador de gases y se anota en la fórmula como parte de la unidad. Por ejemplo si la
saturación es del 98%, en la fórmula se consigna como 0.98.
PAO2: Presión alveolar de oxígeno (calculado al inicio).
1.36 es la cantidad de ml de oxígeno que puede transportar 1 gr de hemoglobina.
0.003 es el coeficiente de solubilidad del oxígeno en la sangre.
A continuación se calcula el contenido arterial de oxígeno (CaO2) con la siguiente fórmula:
3.2.1.3. ÍNDICES ALTERNOS DEL EFECTO DEL SHUNT:
La literatura médica disponible incluye una serie de sistemas alternos menos complejos que el
cálculo del Qs/Qt, para la evaluación de la oxigenación pulmonar y que según los diferentes
autores pueden estimar cercanamente el grado de compromiso pulmonar. Sin embargo existe
aún controversia acerca de cuál de ellos será la alternantiva mejor, teniendo siempre presente
que el estandar de oro sigue siendo el calculo del Qs/Qt.
Estos índices alternos son:
Indice ventilación perfusión: (VQI)
VQI =
CcO2
1.36 x Hb x SvO2 + PAO2 X 0.003
Donde SvO2 es el valor de la saturación de la hemoglobina con oxígeno en sangre venosa.
Este valor es medido directamente por el analizador de gases y también se consigna en la nota
como una fracción de la unidad.
El cálculo del shunt intrapulmonar con este índice se aproxima bastante al realizado mediante
el Qs/Qt y se considera la segunda opción para su medición. La fórmula puede simplificarse
para hacer el cálculo con la saturación arterial y venosa de oxígeno de la siguiente manera:
1 - SaO2
VQI=
1 - SvO2
Shunt estimado (Qs/Qt est ):
CcO2 - CaO2
Qs/Qt est = -------------------------------------D(a-v) + (CcO2 - CaO2) x (3.5).
Donde D(a-v) es la diferencia entre el contenido arterial y venoso de oxígeno.
Este índice tiene limitada utilidad clínica porque sus valores pierden precisión cuando la FiO2
está en rangos entre el 21% y el 100%.
Indice arterioalveolar de oxígeno:
Valor normal mayor de 0,8
I a/A = PaO2/PAO2
Diferencia alveolo arterial de oxígeno D(A – a)O2:
El valor normal con una FiO2 de 0.21 es de 5 a 15 mm Hg; con oxígeno al 100% es de 80 -150
mm Hg.
D(A - a)O2 = PAO2 - PaO2
Este índice es útil para saber la magnitud de la alteración en la oxigenación secundaria a
hipoventilación. No se puede utilizar para analizar el shunt cuando el paciente respira FiO2
entre el 21% y el 100%. Además, está alterado en situaciones donde el consumo de oxígeno
celular esta elevado porque se disminuye el CvO2
Relación PaO2/FiO2: (Pa/Fi o índice de oxigenación).
A nivel del mar el valor normal es mayor de 380. A la altura de Manizales debe ser mayor de
310.
Es el índice preferido por muchos debido a su excelente correlación para todas las FiO2 y por
lo sencillo de su determinación.
3.2. ANÁLISIS DE LA VENTILACION ALVEOLAR (PaCO2).
Se puede evaluar desde le punto de vista químico con la PaCO2. Los valores normales a nivel
del mar son de 40 – 45 mm Hg y a la altura de Santa Fé de Bogotá de 30 a 35 mm Hg.
Como la presión de CO2 arterial y alveolar es idéntica por la rápida difusión de este gas a través
de las membranas, la PaCO2 es usada para determinar la presencia y magnitud de la
hipoventilación alveolar. De esta manera cualquier valor inferior al normal se puede catalogar
como hiperventilación alveolar y alcalosis respiratoria y un valor superior al normal como
insuficiencia ventilatoria causante de acidosis respiratoria.
3.2.1. VENTILACION ALVEOLAR (VA).
Los trastornos en la ventilación alveolar son fácilmente diagnosticados por el valor de la
PaCO2.
La ventilación alveolar se puede calcular con cualquiera de las siguientes dos fórmulas.
VA = VCO2 x 0.863/PaO2
VA = (Vt x FR) – VD.
Donde:
VA: ventilación alveolar.
VCO2: Cantidad de ml de CO2 producido en un minuto.
Vt: Volumen corriente.
VD: ventilación de espacio muerto.
FR: frecuencia respiratoria.
Lo más importante es que la ventilación alveolar se correlaciona inversamente con la PaCO2 y
como se ve en la primera fórmula, la ventilación alveolar es directamente proporcional a la
producción de CO2 e inversamente proporcional a la PaCO2.
3.3. ANÁLISIS DEL ESTADO ACIDO-BASE.
En la sección correspondiente al equilibrio ácido base se analizaron en detalle los factores
involucrados en la producción de hidrogeniones por el organismo y el papel de los sistemas
buffers y del sistema respiratorio y renal para el mantenimiento del pH en los líquidos
biológicos.
El estudio de las alteraciones acido base puede ser realizado desde dos perspectivas que aunque
excluyentes en algunos aspectos pueden ser complementarias en otros. Estos dos puntos de
vista del equilibrio ácido base hace referencia a la teoría de Henderson Hesselbalch y a la teoría
de Peter Stewart sobre la regulación del pH que a continuación se describen.
3.3.1. MODELOS PARA INTERPRETAR EL EQUILIBRIO ÁCIDO BASE:
Como hemos visto, la concentración de hidrogeniones determina el equilibrio ácido base. Sin
embargo, ¿cuales son los factores que determinan una mayor o menor concentración de iones
hidrógeno en el plasma? o en otras palabras, ¿qué determina el pH?
Para responder esta pregunta se ha enfocado el equilibrio ácido base desde dos modelos. El
primero es el modelo de Henderson – Hasselbalch que sostiene que el pH es establecido por la
relación entre las concentraciones de CO2 y HCO3. El segundo, es el modelo de Peter Stewart
quien argumenta que la concentración de hidrogeniones (pH) está determinada por el grado de
disociación del agua.
3.3.1.2. MODELO DE HENDERSON – HASSELBALCH:
Este modelo toma al bicarbonato y al dióxido de carbono como variables independientes y
asume que la relación existente entre ambas es la determinante del pH en los fluidos
corporales. Así, las alteraciones acido base de origen metabólico son causadas por cambios en
la concentración de bicarbonato y aquellas de origen respiratorio por variaciones de la PaCO2.
De acuerdo con este modelo la concentración de hidrógeno [H+] en agua puede ser descrita
por la reacción química de hidratación del dióxido de carbono que produce ácido carbónico y
posteriormente bicarbonato e hidrógeno:
CO2 + H2O ↔ [H2CO3-] ↔ [HCO3-] + [H+]
La dirección de las reacciones químicas que se expresan en la ecuación anterior está
influenciada por el pH de la solución en la cual se suceden. En condiciones normales, un pH
sanguíneo de 7.4 desvía la ecuación hacia la derecha, ya que el pK del ácido carbónico (6.1) es
muy inferior al pH de la solución lo que produce la ionización de la molécula hacia bicarbonato
e hidrógeno. Como resultado final, la mayor parte del CO2 producido es transportado en la
sangre en forma de bicarbonato.
Las reacciones químicas descritas se producen en fracciones de segundo por el efecto
acelerador de la anhidrasa carbónica presente en los hematíes. Esto trae como consecuencia
una muy rápida disociación del ácido carbónico haciendo prácticamente imposible su
medición. Por tal motivo, la determinación del pH desde el modelo de Henderson Hesselbalch
se hace como una función de la PaCO2 y del bicarbonato según la siguiente fórmula:
pH = pK + log10{[HCO3-]/[PaCO2 x 0.0301]}
Reemplazando en la fórmula los valores normales al nivel del mar tenemos:
pH = 6.1 + log10{[24]/[40 x 0.0301]}
pH = 7.4.
En la ecuación, el pK es la constante de disociación del acido carbónico (6.1), como se explicó
antes. La PaCO2 se multiplica por el coeficiente de solubilidad de este gas (0.0301) para hallar
el CO2 disuelto.
Finalmente, como sólo se mide en la muestra sanguínea la presión de CO2 y el pH, la
determinación de la concentración de bicarbonato se realiza reemplazando los valores
conocidos de la fórmula.
3.3.1.2.1. ANALISIS DEL COMPONENTE METABOLICO.
Se evalúa con:
• Medida de los delta hidrogeniones.
• Cálculo del exceso/deficít de bases.
• Cálculo del anión GAP para diferenciar los tipos de acidosis.
a. Cálculo de los delta hidrogeniones:
Sabemos que pH = 1/Log10[H+]. También que el pH = pK + Log10 HCO3-/H2CO3, por lo
tanto [H+] = antiLog10 pH = nanomoles por litro.
La fórmula anterior permite analizar las alteraciones acido base con los valores absolutos de la
concentración de iones H+ en los líquidos corporales lo cual es útil para algunos cálculos
matemáticos.
Normalmente los hidrogeniones del organismo provienen del dióxido de carbono que es
transformado hacia ácido carbónico y de la producción de ácidos no volátiles.
El ácido carbónico (H2CO3) es un ácido volátil que fácilmente es regulado por el sistema
ventilatorio. Todas las demás fuentes potenciales de hidrogeniones son ácidos no volatiles (o
fijos) y por ello son regulados por los riñones y el hígado.
Considerando que la cantidad total de hidrogeniones en el organismo es la suma de los
regulados por la parte metabólica más los controlados por la parte respiratoria, se puede decir:
H+ TOTALES = H+ del CO2 + H+ metabólicos.
De donde:
H+ metabólicos = H+totales – H+del CO2.
Los H+ totales son calculados con el antilogaritmo del pH (el valor del pH es medido por la
máquina de gases sanguineos).
Otra forma de calcular los H+ totales es restarle a 80 la mantisa del pH.
Ejemplo:
La maquina de gases reporta un pH de 7.40, entonces:
H+ TOTALES = antiLog10(pH) → H+ TOTALES = antiLog10(7.4).
H+ TOTALES = 40 nmol/L
De otra forma:
H+ TOTALES = 80 - mantisa del pH → H+totales = 80 – 40
H+ TOTALES = 40 nmol/L.
La fórmula de 80 menos la mantisa del pH se puede utilizar con valores de pH entre 7.55 y
7.26. Si el pH es menor a 7.26 se utiliza la regla del cambio de pH de 0.1 así:
Por cada 0.1 unidad de aumento de pH se multiplica la concentración de hidrogeniones por
0.8, dado que un pH de 7.00 es igual a una concentración de 100 nmol/litro.
Por ejemplo, con un pH 7.1 (el pH aumentó en 0.1 por encima de 7.00) se multiplica 100 x 0.8
= 80 nmol/L de concentración de hidrogeniones por litro.
Cuando cae por debajo de 7.00 en vez de multiplicar por 0.8 se divide por 0.8 o se multiplica
por 1.25. Los valores intermedios son calculados por interpolación.
pH Factor de conversión Concentración de H+
6.9
100 x 1.25
125
7.0
100 x 1
100
7.1
100 x 0.8
80
7.2
100 x 0.8 x 0.8
64
Después de haber conocido la forma de calcular los H+ totales, miremos la forma de calcular
los hidrogeniones aportados por la parte respiratoria:
La ecuación para calcular los H+ del CO2 es diferente en situaciones agudas y crónicas,
considerando agudos a los cambios en la concentración de hidrógeno ocurridos en menos de 3
días y crónicos a los sucedidos en un tiempo mayor. Los hidrogeniones del CO2 se calculan:
Cambios AGUDOS: H+ del CO2 = 0.75 x PaCO2 + 10 = nmoles/L
Cambios CRONICOS: H+ del CO2 = 0.24 x Pa CO2 + 27 = nmoles/L.
Ahora conocemos los H+ totales y los H+ respiratorios. Los H+ metabólicos se pueden
determinar restando los H+ respiratorios de los H+, como se expresó antes.
H+ METABOLICOS = H+totales - H+respiratorios = nmol/L.
Normalmente los H+ metabólicos arteriales durante cambios agudos están entre 0 y +5
nmol/L. Por encima de 5 indican estados de acidosis metabólica y valores iguales o menores a
0 alcalosis metabólica.
En caso de pacientes con cambios que se han hecho crónicos, es decir no intervenidos por
más de 3 días, los valores normales están entre -3 a +8 nmol/L y se interpretan de manera
similar.
El dato de los delta hidrogeniones (H+ metabólicos) dará información acerca de lo adecuado
de la perfusión para mantener el metabolismo oxidativo sin anaerobiosis y con síntesis de ATP.
La fuente de los hidrogeniones en la hipoperfusión tisular es la hidrólisis del ATP. Cuando hay
hidrólisis de ATP se forman H+ y en presencia de AEROBIOSIS la ecuación hidrolítica se
invierte y el H+ no entra a la escena del desequilibrio acidobásico.
ATP
ADP + Pi + H+
Por ello, la [H+] aumentada y la elevación del lactato indican hipoperfusión.
b. Base Exceso y Base exceso estándar:
La aproximación de Henderson y Hesselbalch es limitada para detectar alteraciones ácido base
metabólicas, por que la cantidad de bicarbonato está determinada de manera indirecta por la
producción de CO2 en razón al pK del ácido carbónico (6.1) y al pH de la sangre (7.4):
CO2 + H2O ↔ [H2CO3-] ↔ [HCO3-] + [H+].
Por tal motivo, algunos autores han introducido la base exceso como una medida para
cuantificar el componente metabólico de un disturbio ácido base con independencia de la
PaCO2.
La base exceso (BE) es definida como la cantidad de ácido o de base necesaria para conseguir
que 1 litro de sangre con una determinada concentración de hemoglobina (Hb) y a 37 °C tenga
un pH de 7.4.
BE = (1 - 0.014 x Hb) x (HCO3- – 24) + [9.5 + (1.63 x Hb)] x (pH – 7.4).
De acuerdo con la fórmula anterior, si la Hb es de 15 g/dl, el pH de 7.4 y la PaCO2 de 40 mm
Hg, la BE es de cero. Como se puede observar en la fórmula, el valor de la BE es fuertemente
influenciado por la concentración de hemoglobina en la sangre, sin embargo, el efecto buffer
de esta sólo se produce a nivel intravascular, mientras que el bicarbonato se distribuye en todo
el líquido extracelular (intersticio y espacio intravascular). Por tal motivo, se utiliza un valor
para la hemoglobina de 5 g/dl que refleja la concentración promedio de la misma en el
volumen en el cual se distribuye el bicarbonato (líquido extracelular). Al usar este valor de
hemoglobina en la fórmula anterior se determina la llamada base exceso estándar.
La base exceso estándar define si las alteraciones ácido base son producidas por un factor
metabólico, sin embargo, no precisa cual es el componente metabólico implicado en la
alteración.
La base exceso es reportado por las maquinas que miden los gases sanguíneos y con su valor se
puede cuantificar el déficit de bicarbonato para remplazarlo:
Déficit de base es la cantidad de bicarbonato que falta en cada litro de líquido extracelular.
Aproximadamente el 25% del peso de un ser humano es igual al líquido extracelular, entonces:
DEFICIT DE BICARBONATO = Déficit de bases x Peso (Kg) /4.
c. El anión Gap (brecha aniónica):
La concentración normal de electrolitos o iones del plasma es la siguiente:
CATIONES
Sodio
Potasio
Calcio
Magnesio
mEq/L
142
5
5
2
TOTAL
154
ANIONES
Bicarbonato
Cloro
Fosfato
Sulfato
Ácidos orgánicos
Proteínas
TOTAL
mEq/L
27
103
1
1
5
16
154
Como se observa en la tabla anterior, el resultado de la suma de los cationes y los aniones
siempre es igual en obediencia a la ley del equilibrio o neutralidad eléctrica. La composición del
plasma puede ser expresada en forma simplificada incluyendo solamente los cationes y los
aniones principales, aquellos que se miden en la práctica clínica diaria de la siguiente manera:
CATIONES (C+) = Na+ + K+ + CATIONES RESIDUALES O NO MEDIBLES (RC+)
C+ = 142 + 5 + RC+
C+ = 147 + RC+
ANIONES (A-) = Bicarbonato-+ Cl- + ANIONES RESIDUALES O NO MEDIBLES (RA-)
A- = 27 + 103 + RAA- = 130 + RADe la comparación entre los cationes y aniones medibles en el plasma tiene utilidad clínica al
considerar la siguiente relación:
Esto quiere decir que entre la suma de los cationes y de los aniones principales o medibles, hay
una diferencia de 17 mEq/L de aniones no medibles. O sea que:
(Na+ + K+ ) - ( HCO3- + Cl- ) = diferencia de aniones
(142 + 5 ) - ( 27 + 103 ) = 147 - 130 = 17 mEq/L.
Esta diferencia de 17 mEq/L es la llamada brecha aniónica o anión gap representado
generalmente por los aniones que no se miden, los aniones inorganicos y organicos del plasma,
que pueden estar aumentados en la acidosis metabólicas.
El valor normal de la brecha es de l7 mEq/L. Valores de -9 son improbables y generalmente
son error de laboratorio.
Cuando existe una acidosis metabólica el HCO3- siempre estará disminuido y en la columna de
los aniones habrá aumento del cloro o de los aniones no medibles para llenar el vacío del
HCO3- y mantener la neutralidad eléctrica (suma iguales de cationes y aniones totales ). Por
consiguiente la acidosis metabólica es de dos tipos:
•
•
Con anión gap normal o disminuido: en el cual forzosamente el cloro estará aumentado
para llenar el déficit de bicarbonato. Esta es la acidosis hipercloremica.
Con anión gap aumentado (>22 mEq/L): lo que significa que hay acumulación de aniones
no medibles que llenan el déficit de bicarbonato. El ejemplo típico es la acidosis láctica, que
resulta en la acumulación metabólica de iones lactato. Otros ejemplos son la cetoacidosis
diabética, la azoemia renal donde se acumulan iones ácidos orgánicos, fosfóricos y
sulfúricos; también la intoxicación por salicilatos donde se acumula ácido láctico y piruvico;
o alcohol metílico donde se acumula ácido fórmico.
Así pues, la brecha aniónica ha sido útil para clasificar los estados de acidosis, pero también es
un buen parámetro para el control de calidad del laboratorio. Debido a que es un reflejo de
diferentes componentes, un valor demasiado alto o demasiado bajo o un valor negativo en un
contexto clínico específico, traduciría un error en la determinación de uno cualquiera de los
componentes necesarios para su cálculo, y por lo tanto, debe motivar una revisión de los
procedimientos y de los equipos involucrados en el proceso. Descartando un error de
laboratorio o una dilución de la muestra sanguínea, existen solo dos posibles explicaciones para
la presencia de un valor bajo de la brecha aniónica: la hipoproteinemia y el mieloma multiple.
En el primer caso, la situación se explica por el hecho de que las proteínas contribuyen en
cerca del 10 % de la carga aniónica total del plasma, por lo cual una disminución significativa
de su concentración implica reducción del valor de la brecha.
En el mieloma múltiple aumenta la concentración de IgG que es un catión produciendo un
aumento de los iones de carga positiva no medibles y una disminución de la brecha aniónica.
En la actualidad, y por la disponibilidad de técnicas que facilitan la medición de sustancias
como lactato, acetoacetato, hidroxibutirato y otra serie de aniones, la utilidad de la
determinación de la brecha se ha visto reducida.
3.3.1.2.2. ANÁLISIS DEL COMPONENTE RESPIRATORIO.
Los trastornos en la ventilación alveolar son fácilmente diagnosticados por el valor de la
PaCO2. Con estos pueden deducirse los trastornos ácido-base de origen respiratorio.
De acuerdo con la PaCO2 del paciente se debe calcular el pH sanguíneo del paciente ignorando
los demás factores concomitantes. El pH varia según lo hace la PaCO2 con base en una
relación logarítmica, pero, dentro de los márgenes útiles clínicamente, puede aplicarse la
siguiente regla: por cada 10 mm Hg que suba la PaCO2 por encima de 40 el pH baja 0.05 y por
cada 10 mm de Hg que baje por debajo de 40 el pH aumenta en 0.1. El valor obtenido se
utiliza en el siguiente paso:
- Con el valor del pH obtenido por el analizador de gases sanguíneos defina si hay o no
acidemia o alcalemia.
- Compare el valor medido en el paciente con el calculado en el paso anterior. Si el valor
coincide se trata entonces de cambios explicables exclusivamente por los cambios respiratorios
sin que existan componentes metabólicos. Si no coincide existe un componente metabólico
actuando.
Si la alteración ácido base es mixta (acidosis + alcalosis) hay que descubrir cual de los dos
trastornos es el primario y cual es el que intenta compensarlo. Como regla general, ningún
componente sobrecompensa al otro, podemos suponer con un buen margen de seguridad que
el componente primario será aquel hacia el cual tienda el pH sanguíneo.
Para valorar el estado ácido base de la sangre se puede emplear la gasometría venosa, miremos:
PaCO2 de 60 mm Hg y pH de 7.3. mirando la PaCO2 podemos decir que se trata de una
insuficiencia ventilatoria y de una acidosis respiratoria. Como la PaC02 ha subido 20 mm Hg el
pH debe bajar a 7,3 , lo que en efecto ha sucedido. Podemos agregar entonces que el efecto es
respiratorio y por lo tanto es agudo. Además hay acidema porque el pH está en 7,3.
Analicemos: PaCO2 de 20 mm Hg, pH de 7,3. Mirando la PaCO2 podemos afirmar que existe
una hiperventilación alveolar y una alcalosis respiratoria. Como la PaCO2 ha bajado 20 mm Hg
el pH debe subir a 7.6, pero el real es de 7.3. Existe por lo tanto acidosis metabólica que está
siendo compensada con hiperventilación alveolar.
3.3.1.3. MODELO DE PETER STEWART:
Este modelo se está imponiendo en la práctica clínica porque ayuda a clarificar el mecanismo
de muchos problemas del equilibrio ácido- base en pacientes críticos que no pueden ser
explicados desde la perspectiva de Henderson Hesselbalch.
Peter Stewart plantea que las reacciones químicas que mantienen el equilibrio ácido base se
realizan en una solución conformada por un solvente: el agua, y varios solutos: iones fuertes,
ácidos débiles y algunas macromoléculas. La interacción de estos solutos con el agua genera la
disociación de ésta en iones hidrógeno e hidroxilo. Es decir, en este modelo los iones
hidrógeno se originan de la disociación del agua. Además, estas reacciones deben respetar los
principios de la electroneutralidad y del mantenimiento de la masa. Por tal motivo, para
entender este modelo hay que partir conociendo algunas características de sus protagonistas: el
agua y los solutos.
3.3.1.3.1. El agua:
El agua tiene tres propiedades importantes que afectan el equilibrio ácido base:
1. Posee una alta concentración molar.
2. La molécula de agua es un dipolo eléctrico.
3. Tiene una muy pequeña pero importante constante de disociación.
a. Alta concentración molar
La alta concentración molar permite que exista una fuente inagotable de iones hidrógeno para
la solución. Un mol de agua (H2O) pesa 18 gramos (1 gramo del hidrógeno + 1 gramo de
hidrogeno + 16 gramos de oxígeno). Si 1000 ml de agua (1L) pesan 1000 gramos (1Kg), la
cantidad de moles de agua en 1 litro es de 55,5 moles (1000/18 = 55,5 M/L). Esta
concentración es 400 veces mayor que la segunda sustancia más concentrada del cuerpo, el
sodio (0,14 M/L). Por tal motivo, esta alta concentración de moléculas de agua funciona como
una fuente infinita de iones hidrógeno para los líquidos biológicos.
b. El agua es un dipolo eléctrico
El agua es un dipolo, es decir, una molécula con dos cargas eléctricas. La estructura del agua es
un tetraedro asimétrico constituido por una molécula de oxígeno y dos de hidrógeno cuya
distribución genera dos polos eléctricos. Uno con carga negativa generado por el oxígeno (rico
en electrones) y el otro, con carga positiva producido por los iones hidrógeno (pobres en
electrones). Esta característica permite al agua desdoblar los compuestos iónicos de una
solución en aniones y cationes, atrayendo cargas negativas hacia su extremo positivo y cargas
positivas hacia su extremo negativo, fenómeno conocido como solvatación iónica y que
convierte al agua en un gran medio disolvente de compuestos iónicos como las sales minerales.
Como puede advertirse, esta característica permite también mantener las cargas eléctricas de
una solución en equilibrio.
c. Constante de disociación
El agua pura tiene una constante de disociación muy baja (Kw = 4,3 x 10-16 mmol/L), de cada
107 moléculas de agua sólo una se encuentra ionizada (H2O ↔ H+ + OH-).
Esto explica que la concentración de iones Hidrógeno [H+] y de iones hidroxilo (OH-) sea muy
pequeña. Sin embargo, estos niveles bajos de H+ y de OH- cambian bruscamente si se añade
un ácido o una base a la solución.
3.3.1.3.2. Los solutos:
Los solutos dentro de los líquidos corporales se pueden agrupar de acuerdo con su grado de
ionización en tres grandes grupos: iones fuertes, iones débiles y sustancias no electrolíticas.
a. Iones fuertes: Los iones fuertes son aquellos que en una solución están totalmente
ionizados. Hacen parte de los iones fuertes aquellas moléculas con una constante de
disociación menor de 10-4 Eq/L como el Na+, Cl-, K+ y el Lactato-.
b. Iones débiles: son aquellos que en una solución se disocian parcialmente. Así, al disolverse
en agua, existirá una proporción de la molécula ionizada y otra sin disociarse. Son iones débiles
aquellos con una constante de ionización o disociación de 10-12 Eq/L como el dióxido de
carbono.
Sustancias no electrolíticas: Son aquellas que en agua nunca se disocian, siendo importantes
para la osmolaridad de la solución pero sin impacto en la carga iónica de la misma. Hacen parte
de este tipo de sustancias aquellas con constate de disociación mayor a 10-4 Eq/L.
c. Principio de electroneutralidad y de conservación de la masa:
Cuando el agua en estado puro se disocia produce cantidades iguales de cargas positivas (H+) y
de cargas negativas (OH-), esto mantiene el equilibrio eléctrico de la solución. El H+ es la parte
ácida de la molécula y el OH- la parte básica de la misma. Por tal motivo, al generar cantidades
iguales de ácido y de base la carga eléctrica no se modifica permaneciendo neutra.
H2O ↔ [H+] x [OH-] luego,
[H+] = [OH-]
Es importante resaltar que la disociación del agua no aumenta la masa de la solución. Si
tenemos 1 litro de agua sin disociarse (100% en forma de H2O) y luego el 5% de esta cantidad
se ioniza, la cantidad total de agua seguirá siendo de 1 litro sólo que su constitución será
diferente: 95% en forma de H2O, 5% en forma de H+ y OH-. Este 5% estará constituido por
cantidades iguales de hidrógeno y de iones hidroxilo. No obstante, las proporciones existentes
entre H+ y OH- pueden variar según se le adicione a este litro de agua cargas positivas o
negativas.
Si al agua se le adiciona una sal (NaCl-), la solución resultante debe mantener en equilibrio las
cargas eléctricas así:
[Na+] + [H+] = [Cl-] + [OH-]
Como se sumaron cantidades iguales de iones positivos y negativos, la ionización del agua
produce sendas sumas de iones H+ y OH-. Sin embargo, la cantidad total de agua no se
modifica por el principio de conservación de la masa.
Si a un litro de agua se le adiciona un ión, por ejemplo el ión cloro cuya carga es negativa (Cl-),
el agua dona mayor cantidad de H+ para conservar la electroneutralidad de la solución. En este
ejemplo, la [H+] es mayor que la de [OH-], sin embargo también puede decirse con certeza que
la [OH-] disminuyó con respecto a la [H+]. Lo importante del asunto es que la proporción entre
[H+] y [OH-] se modificó produciéndose una alteración en el equilibrio ácido base dentro de la
solución.
De esta manera los iones H+ y OH- logran mantener la electroneutralidad de la solución si otro
ión con carga eléctrica es sumado a la mezcla. Sin embargo, la proporción entre ambos se
modifica determinando alteraciones en el equilibrio ácido base denominados acidosis o
alcalosis. Así, la acidosis es producida por un aumento de ácidos (H+) o una disminución de las
bases (OH-) y la alcalosis refleja una disminución de los ácidos (H+) o un aumento de las bases
(OH-). De acuerdo con lo anterior, las alteraciones ácido base pueden ser descritas en términos
de la concentración de hidrogeniones [H+] o de la concentración de iones hidroxilo [OH-]. En
adelante las alteraciones ácido base serán descritas en términos de la concentración de iones
hidroxilo [OH-].
3.3.1.4. Variable dependiente y variable independiente:
Finalmente, la teoría de Stewart considera las soluciones biológicas como sistemas, en donde la
propiedad emergente, es decir, el valor que se mide, es el resultado de la interacción de todas
las variables que conforman el sistema. Estas variables fueron definidas como dependientes o
independientes al sistema. Una variable independiente tiene valores que son determinados
por procesos o condiciones que son externos, es decir, ellos son impuestos al sistema más que
establecidos por el mismo. Por el contrario, la variable dependiente tiene valores que son
determinados internamente por el sistema y sólo pueden ser alterados por cambios en las
variables independientes. Por ello, si se conoce el valor de las variables independientes se
puede determinar el valor de una variable dependiente. La importancia de esta distinción, es
que Stewart considera al ión hidrógeno como una variable dependiente y no independiente
como lo hace la aproximación de Henderson Hesselbalch. Para Stewart, las variables
independientes son el dióxido de carbono, la diferencia de iones fuertes y los ácidos débiles
totales y las variables dependientes el bicarbonato, los iones hidrógeno e hidroxilo. Note que
para la teoría de Henderson Hasselbalch el bicarbonato es una variable independiente mientras
que para Stewart no lo es.
3.3.1.5. Cálculo del pH:
Conociendo ya el panorama general de la teoría de Peter Stewart podemos pasar ahora a
describir cada uno de sus componentes.
Los cambios en la concentración de iones hidrógeno o hidroxilo sólo pueden ser producidos
según la teoría de Stewart por tres variables que son independientes: El dióxido de carbono, la
diferencia de iones fuertes (DIF) y los ácidos débiles (ATOT).
pH = [carga de CO2] + [DIF] + [ATOT].
La carga de CO2 es calculada por la PaCO2 y el coeficiente de solubilidad del dióxido de
carbono (0.0301), es decir, carga de CO2 = PaCO2 x 0.0301.
Los iones fuertes son aquellos que están completamente disociados ¨sueltos¨ a pH fisiológico.
Esto incluye a la mayoría de los electrolitos y al lactato porque éste con el pH sanguíneo se
encuentra completamente ionizado. El bicarbonato no hace parte de los iones fuertes.
La diferencia de iones fuertes (DIF) es la brecha entre cationes y aniones:
DIF = [Na+] + [K+] – [Cl-] – [lactato-]
Normalmente se calcula la DIF considerando la diferencia entre el sodio y el cloro, ya que los
valores del potasio y del lactato son semejantes y se anulan en la fórmula. Por tal razón, la DIF
medida es de +30 mEq/L (140 mEq del Na+ menos 110 mEq del CL-). Debido a que debe
mantenerse la neutralidad eléctrica dentro de la solución, la existencia de 30 mEq de cationes
origina la disociación del agua que aporta 30 mEq de iones hidroxilo con carga negativa (OH-),
equilibrando de esta manera las cargas eléctricas dentro de la solución.
La solución queda con carga neutra de la siguiente manera:
Carga
Carga
positiva negativa
Na+
140
Cl110
OH30
Total
140
140
Finalmente, la ecuación incluye como ácidos débiles (ATOT) a la albúmina y a los fosfatos. La
carga negativa de la albúmina se debe a sus residuos de histidina.
Así la ecuación de Stewart para calcular el pH es como sigue:
pH = [PaCO2 x 0.0301] + [(Na+ + K+) – (Cl- - lactacto-)] – [albumina-] – [fosfato-]
El equilibrio ácido base respiratorio está representado en la fórmula por la PaCO2 mientras que
la regulación metabólica del pH por la DIF y los ATOT.
La PaCO2 puede cambiar rápidamente gracias a cambios agudos en la ventilación. Por el
contrario, los cambios en la DIF son mucho más lentos, porque la variación en la
concentración de los iones fuertes se realiza a través de cambios en su absorción por el
intestino y en su excreción renal. Por último, las proteínas que son el principal constituyente de
los ATOT varían de una manera mucho más lenta que los iones fuertes, lo que deja a la DIF
como la principal responsable de las alteraciones ácido base metabólicas.
Por lo anterior, las alteraciones ácido base respiratorias y metabólicas pueden ser analizadas en
términos de cambios del CO2 y del DIF respectivamente, siendo esta última determinada
principalmente por los iones cloro y sodio.
Las alteraciones ácido base respiratorias se explican con la teoría de Stewart de la misma
manera que lo hace el modelo de Henderson Hesselbach por lo que no se discute en esta
sección.
Las alteraciones metabólicas del pH pueden ser fácilmente entendidas partiendo del principio
de la neutralidad eléctrica que se describió con anterioridad. Así, cualquier cambio en la carga
eléctrica de la solución producirá una modificación del equilibrio entre iones hidrógeno e
hidroxilo para mantener la neutralidad eléctrica.
En un sujeto sano con concentraciones plasmáticas de sodio y cloro en rango normal, la
diferencia de iones fuertes es de 30 mEq/L a favor de cargas positivas (140mEq de Na+ –
110mEq de Cl-) por ello la ionización del agua aporta 30 mEq/L de iones hidroxilo (OH-) para
mantener la electroneutralidad de la solución.
Cuando se modifica este equilibrio como en el caso de la hiperclorémia, la DIF disminuye por
el aumento del ión Cl-. Esto produce una disminución paralela en la [OH-] que como se explicó
antes se traduce en acidosis. En otras palabras, la disminución de la DIF produce acidosis y el
aumento de la misma alcalosis. Esto explica la acidosis hiperclorémica.
Paciente normal
Carga
Carga
positiva negativa
Na+
140
Cl110
OH30
Total
140
140
DIF = 30 mEq/l
Acidosis hiperclorémica
Carga
Carga
positiva negativa
Na+ 140
Cl130
OH- 10
Total 140
140
DIF = 10 mEq/l
De acuerdo con lo anterior se puede afirmar que los cambios ácido base agudos son el
resultado de cambios en el DIF. Estos se producen a través de tres grande mecanismos:
1. Cambios en el contenido del agua del plasma (alcalosis por contracción y acidosis
dilucional).
2. Cambios en la [Cl-] (acidosis hiperclorémica y alcalosis hipoclorémica)
3. Aumento en la concentración de un ión no identificado (acidosis orgánica).
3.3.1.5.1. Cambios en el agua libre: Acidosis dilucional y alcalosis por contracción.
a. Acidosis dilucional:
Al adicionar agua libre a una solución se produce la dilución de los iones fuertes dentro de la
misma lo que produce una disminución de la DIF con disminución del ión OH-.
Por ejemplo, si en 1 litro de agua hay 140 mEq de sodio y 110 mEq de cloro, la DIF y la
[OH-] de esta solución es de 30 mEq cada una. Si a esta mezcla se le suma 1 litro de agua libre,
la concentración de sodio resultante será de 70 mEq/L, la de Cl- de 55 mEq/L y la DIF al
igual que la [OH-] disminuirá a 15 mEq/litro lo que como ya se explicó produce acidosis.
b. Alcalosis por contracción:
Si se pierde agua libre de una solución, la DIF y la [OH-] aumentan y se produce alcalosis.
Por ejemplo, si 1 litro de agua contiene 140 mEq de sodio y 110 mEq de cloro, la DIF de esta
solución es de 30 mEq y la [OH-] de 30 mEq. Ahora, si se pierde 500 ml de agua pura de esta
mezcla, la concentración resultante de Na+ será de 280 mEq/l y de CL- de 220 mEq/l. Esto
produce un aumento de la DIF y de la [OH-] hasta 60 mEq/L lo que explica la alcalosis
metabólica en este caso.
1. Cambios en el cloro:
Hipocloremia: Este caso generalmente ocurre por vómitos a repetición con la pérdida de Cldesde el jugo gástrico. Al disminuir la [Cl-], la DIF y la [OH-] aumentan lo que produce
alcalosis metabólica.
Hipercloremia: El incremento en iones Cl- produce una disminución de la DIF con el
consiguiente disminución de la [OH-] y el desarrollo de acidosis.
2. Aniones no identificados:
Si existe un ácido orgánico no medido, como el lactato o los cetoácidos, la DIF estará
disminuida y la [OH-] también lo que produce acidosis.
3.3.1.6. Ion Gap fuerte:
La ventaja de la teoría de Stewart es que se puede calcular le pH si todas las variables
independientes se conocen. La diferencia existente entre el pH calculado y el medido es debido
a la presencia de un ión no medido. Esto puede ser cuantificado por el cálculo del ión Gap
fuerte (SIG por sus siglas en ingles de strong ion Gap):
SIG = [DIF] – [carga de CO2] – [ATOT]
SIG = [DIF] – [HCO3-] – [albumina] – [fosfato].
El ión Gap fuerte representa la cantidad de iones no medidos diferentes al lactato (si este es
medido se incluye dentro de la DIF).
La SIG es usualmente de cero.
3.3.1.7. Equilibrio ácido base en los diferentes compartimientos corporales:
El agua corporal está distribuida en tres grandes compartimientos: el intracelular, el intersticial
y el intravascular. Dentro de cada uno de estos compartimientos existe una concentración de
hidrogeniones determinada por las variables independientes de cada compartimiento. Estos
compartimientos se relacionan entre sí por medio de membranas (membrana celular y
membrana capilar); a través de ellas también existen interacciones ácido base entre los
compartimientos. Sin embargo, los cambios en la concentración de iones hidrógeno en cada
compartimiento sólo son producidas por cambios existentes dentro del mismo de las variables
independientes descritas. Por esta razón, para que una alteración acido base de un
compartimiento afecte la concentración de hidrogeniones del adyacente, debe modificar
primero alguna de las variables independientes en su vecino.
El dióxido de carbono es una molécula altamente difusible a través de las membranas
biológicas, por lo que cambios en su concentración producidas por modificaciones en la
ventilación, encontrarán rápidamente su equilibrio entre todos los compartimientos. Por el
contrario, las proteínas corporales son macromoléculas que por su tamaño difícilmente pueden
atravesar las membranas biológicas, lo que hace que como variables independientes sólo
puedas tener impacto en el compartimiento en el cual se hallan. A diferencia de las anteriores
variables, los iones fuertes pueden atravesar membranas gracias a canales iónicos y bombas de
ATP que permiten modificar su concentración a cada lado de las membranas celulares, lo cual
hace que esta sea la variable más importante para producir modificaciones ácido base a través
de las membranas. En otras palabras, de las tres variables descritas sólo los cambios en las
concentración de electrolitos dentro de un compartimiento afectar el estado ácido base de su
vecino gracias a la difusión de dichos electrolitos entre los diferentes compartimientos
corporales.
4. ANALISIS DE LA PERFUSION PERIFERICA.
La perfusión es una función cardiovascular y respiratoria que tiende a mantener la vida
eficientemente mediante la producción aeróbica de ATP. Esta función cardiorrespiratoria
depende de la presencia de sustratos energéticos, transportadores de electrones y oxígeno. El
resultado final del metabolismo energético es la producción de ATP que es estimado en
función del consumo de oxígeno.
El sistema cardiovascular tiene como función básica aportar una cantidad adecuada de oxígeno
a los tejidos de tal manera que les permita desarrollar sus complejas tareas metabólicas. En tal
sentido entendemos su evaluación en función del acople entre la cantidad de oxígeno que se
aporta a la célula y la cantidad del mismo que ella consume. En otros términos, evaluamos el
sistema cardiovascular no solo como la cantidad de sangre que el corazón eyecta en 1 minuto
(gasto cardíaco) sino como la cantidad de oxígeno que ella entrega a la célula en 1 minuto
(aporte de oxígeno a la célula o DO2).
El oxígeno es transportado en la sangre de dos maneras: unido a la hemoglobina y disuelto en
la sangre. Sabemos que 1 gr de hemoglobina puede transportar aproximadamente 1.36 ml de
O2 si ésta estuviese saturada en un 100% con O2. Para determinar la cantidad de oxígeno
transportado por la hemoglobina basta con multiplicar la cantidad de la misma por la SaO2 por
1.36.
CaO2 = Hb x 1.36 x SaO2.
La pequeña cantidad de oxígeno que va disuelto en la sangre depende básicamente de la PaO2 y
de su constante de solubilidad.
O2 DISUELTO = PaO2 x 0.003.
Para determinar el contenido arterial de oxígeno (CaO2) sumamos el oxígeno transportado por
la hemoglobina y el disuelto en la sangre:
CaO2 = Hb x 1.36 x SaO2 + PaO2 x 0.003. = ml de O2 em cada 100 ml de sangre.
Note que el CaO2 está dado en ml por cada 100 c.c. de sangre y el gasto cardíaco en litros por
minuto. Para integrarlos debemos entonces igualar las unidades así: multiplicamos el CaO2 por
10 obteniendo la cantidad de oxígeno transportado en un litro de sangre.
Para calcular el aporte de oxígeno que el corazón hace a los tejidos en un minuto (DO2)
multiplicamos el gasto cardiaco por el contenido arterial de oxígeno:
DO2 = GASTO CARDIACO x CaO2 x 10
De lo anterior se deduce que la función cardiovascular puede entenderse como aporte de
oxígeno a los tejidos y que esta depende de 2 factores: Gasto cardiaco y contenido arterial de
oxígeno. A su vez el CaO2 depende básicamente de la hemoglobina y de su saturación. Por este
motivo se puede entender la función cardiovascular de la siguiente manera:
APORTE DE OXIGENO A LOS TEJIDOS
GASTO CARDIACO
CONTENIDO ARTERIAL DE O2
Hb
Sat %
PaO2
El principal regulador del aporte de oxígeno a los tejidos es el consumo de este en los mismos.
Es decir, si la célula necesita más oxígeno hace que el sistema cardiovascular recubra estos
requerimientos. Según lo anterior podemos decir que el sistema cardiovascular funciona
adecuadamente cuando es capaz de cubrir las necesidades tisulares, sean estas normales o
aumentadas y sólo en este sentido aceptaremos el desempeño de esta función; como puede
verse no solo depende del gasto cardíaco sino también del O2 contenido en la sangre.
Ahora bien, como saber si la célula está cubierta en más necesidades y por lo tanto conocer el
grado de acoplamiento con lo aportado?... Introduciremos aquí algunos conceptos que nos
ayudarán a responder esta pregunta.
CONSUMO CELULAR DE OXIGENO (VO2): Cantidad de oxígeno que la célula
consume en un minuto. Su cálculo es sencillo:
VO2 = G.C. x D(a-v) O2 x 10
Al llegar la sangre arterial a la célula ésta saca el oxígeno que necesita y por supuesto quedará
un sobrante de oxígeno que sigue hacia la vena, el denominado contenido venoso de oxígeno
(CvO2). Se establece así una diferencia de contenidos entre la arteria y la vena denominada
diferencia arterio venosa de oxígeno (D(a-v)O2), que está dada en mililitros de oxígeno por
cada 100 cc de sangre y representan la cantidad de oxígeno en ml que la célula extrae de 100cc
de sangre. Para calcular cuanto le extrae a un litro se debe multiplicar por 10.
Finalmente, para saber cuanto oxígeno extrae la célula en un minuto se multiplica el resultado
anterior por el gasto cardiaco:
VO2 = G.C. x D(a-v)O2 x 10
Con esta sencilla formula se conoce la cantidad de oxígeno consumida por la célula en un
minuto.
Hasta aquí sabemos cuando O2 es llevado a la célula en un minuto y cuando O2 consume la
misma en este periodo de tiempo, sin embargo, para conocer el acople entre el sistema
cardiovascular y las necesidades celulares hay que determinar el porcentaje de oxígeno que
extrae la célula de lo que le aporta el sistema cardiovascular mediante la fórmula de la
extracción tisular de oxígeno (Ext O2).
D(a-v)O2
Ext O2 = -------------Ca O2
Nótese que en la fórmula no se involucra el G.C puesto que como factor de multiplicación
arriba y abajo se anula. De esta forma obtendremos un dato que sin mediciones complejas
(solo gases arteriales) nos brinda una idea del grado de acople entre el aporte y el consumo de
oxígeno celular.
Supongamos que la extracción normal es del 30%. Esto significa que del aporte a la célula esta
tomará el 30%. Si un paciente tiene en un momento dado una extracción del 50%, nos informa
que la célula esta extrayendo más de lo normal y esta situación se sucede en 2 ocasiones:
1. Cuando se aumenta el consumo de O2
2. Cuando se disminuye el aporte a la célula.
En cualquiera de las dos situaciones hay un desacople entre oferta y consumo y por lo tanto
existe una deficiencia del sistema cardiovascular, bien porque ha disminuido su aporte o
porque no fue capaz de aumentarlo cuando se le requirió.
Como se ve, este parámetro sencillo nos da una buena información sobre el grado de
acoplamiento entre el consumo y el aporte tisular, que en últimas es el parámetro de evaluación
de la función cardiovascular.
4.1. PRESION VENOSA MEZCLADA DE OXIGENO:
(PvO2) Es la presión de oxígeno en la arteria pulmonar (en su defecto puede utilizarse la de la
aurícula derecha.) y representa el oxígeno que le sobró al organismo después de extraerle a la
arteria lo que necesitó. Normalmente su valor es de 35 mm Hg a 45 mm Hg y es talvez el
parámetro aislado que mejor nos informa sobre el acoplamiento de aporte y consumo de
oxígeno celular.
En gracia de la brevedad solo daremos algunas pautas de interpretación de este parámetro.
PvO2 = 35-35 mm Hg rango normal
PvO2 = 28-35 mm Hg desacople compensado: implica que hay disminución del aporte en
relación al requerimiento celular, bien sea por falla en el aporte o por exceso en el consumo
que no se compensó. En general no hay una descompensación metabólica y por ende rara vez
habrá acidosis metabólica.
PvO2 = 20 -28 mm Hg desacople descompensado: hay desacople severo y generalmente causa
un metabolismo anaeróbico traducido en acidosis metabólica. Es una urgencia terapéutica.
PvO2= menos de 20 mm Hg severísimo desacople: si no se actúa rápido el paciente fallecerá .
PvO2 = mayor de 45 mm Hg esceso de aporte o disminución en el consumo. Rara vez lo
aceptamos de entrada como un exceso del gasto cardíaco. Más frecuentemente lo vemos en
casos de disminución del consumo de oxígeno como hipotermia, choque de cualquier etiología,
implica que el aporte de oxígeno no está siendo utilizado por las células y por lo tanto es un
signo ominoso.
Como la SvO2 central y la PvO2 central son, respectivamente, saturación y tensión en sangre
venoso mezclada central. Una disminución de la saturación venosa mezclada puede también
tomarse como una evidencia que el aporte está disminuido o que el consumo está aumentado,
y más hoy que se puede medir a través de un catéter fibro óptico en la arteria pulmonar
(oximetrix)
Recapitulando: el sistema cardiovascular tiene a su cargo el llevar una cantidad determinada de
O2 a la célula (aporte de 02) consistente en el oxígeno de la sangre y la cantidad del flujo de la
misma (CaO2 x G.C. x 10). Este aporte de oxígeno es presentado a la célula, la cual en
condiciones basales, extrae un 25-30%
(Ext O2) que le es necesario para su trabajo metabólico (VO2). Este proceso de extracción
establece una diferencia de contenido de O2 entre la arteria y la vena (D (a-v) O2). Una vez
extraído el oxígeno por la célula, quedará un sobrante en la vena denominada reserva venosa
de O2 y que está bien expresada por la PvO2.
Ahora conociendo el cálculo de estos datos hablaremos algo del síndrome de hipoperfusión
periferica:
La hipoperfusión la establecemos cuando podemos identificar un desacople entre el aporte y el
consumo. Tenemos dos grandes tipos de hipoperfusión:
a.POR DEFECTO EN EL APORTE:
Los vemos en aquellos casos en las que hay una disminución real en el aporte de oxígeno a la
célula o en el que el aumento en el consumo no es suficientemente compensado por un
aumento en el aporte.
En ambos casos, la constante es una extracción de O2 aumentada (+ del 30%), PvO2 baja (-35
mm Hg) y una D(a-v)O2 amplia, su diferencia está dada por el consumo de oxígeno bajo en el
primer caso (150 ml/m2 SC /min) y en el segundo aumentado (+ de 150 ).
b.DEFECTO DE CAPTACION CELULAR:
Se aprecia en casos de intensa respuesta venosa que shuntea la sangre periféricamente o
cuando el deterioro celular es tan severo que se han bloqueado más vías metabolicas. Sus
características son:
Ext O2 disminuido (25%), D(a-v)O2 estrecha (3 vol %), VO2 bajo, PvO2 elevada (45%).
De lo anterior establecido podemos concluir:
1. La insuficiencia cardiovascular se caracteriza por una hipoperfusión periférica y su
diagnostico se basa exclusivamente en los datos de la perfusión.
2. La insuficiencia cardiovascular debe verse no solo como una disminución absoluta del
aporte de O2 al tejido sino también (quizás con mayor frecuencia)como una elevación no
paralela del aporte en relación con el incremento de O2.
3. La insuficiencia cardiovascular puede originarse en cualquier de los tres factores constituidos
del aporte de O2 al tejido:
Gasto cardíaco, Hb, sat de la Hb arterial; la orientación terapeutica será entonces al factor
alterado.
4. La insuficiencia cardíaca es uno de los componentes del síndrome y no necesariamente
restringiremos a este factor el análisis de la hipoperfusión.
5. Con el diagnóstico y la terapéutica cardiovascular debemos pues sugerir una secuencia
lógica:
-Hay hipoperfusión?
-Es por defecto del aporte o por defecto celular?
-En defectos por aporte es por corazón? o por sangre?
-El defecto en el corazón es por ICC o por hipovolemía?
-El defecto en la sangre es por falta de sangre (Hb) o por falta de oxígeno (pulmón)?
(22).
Para finalizar quiero exponer los objetivos terapéuticos planteados en el grupo de Consenso
en Medicina Crítica de “Hospitales del Sur”de Bogotá D.E. para mantener la perfusión:
1. Mantener el paciente sin acidosis metabólica asegurando un adecuado aporte de sustratos
energéticos y de oxigenación.
2. Mantener la Extracción de Oxígeno (%ExtO22) entre 20-30%
3. Asegurar un índice de aporte de oxigeno por aumento del gasto cardíaco, con presiones de
llenado normales < o igual a 12 mm Hg, Hb mayor o igual a 12 gr/dl y saturación arterial
mayor del 90%.
4.Mantener un índice de consumo de oxígeno mayor o igual a 150 ml/min/m2, lo cual se
correlaciona con una mejor recuperación funcional y supervivencia.
El paciente en fase crítica es HIPERMETABOLICO por el intento de pago de la DEUDA de
oxígeno, por lo tanto debe asegurarse un aporte suficiente de sustratos para sus necesidades
metabólicas. De lo contrario las lesiones inflamatorias a nivel microcirculatorio y celular
llevarán a DISFUNCIÓN ORGANICA MULTIPLE y de allí a SEPSIS.
5. TOMA DE MUESTRAS DE SANGRE PARA LA MEDICIÓN DE LOS GASES
SANGUÍNEOS:
La muestra de sangre para la medición de los gases sanguíneos puede ser obtenida por punción
de una arteria, una vena o un capilar. Para ello, debe seguirse algunas recomendaciones técnicas
que a continuación se describen con el fin de obtener mediciones confiables que permitan
tomar decisiones correctas sobre el cuidado del paciente.
5.1. MUESTRA ARTERIAL:
5.1.1. Composición gasimétrica de la sangre arterial:
Las arterias son vasos de conducción que permiten el transporte de la sangre entre el corazón y
los tejidos periféricos sin participar del intercambio gaseoso el cual se realiza en los capilares
tisulares periféricos y pulmonares. Por esta razón, una muestra de gases sanguíneos de una
arteria tiene el mismo contenido gaseoso que el ventrículo cardiaco de la cual proviene. Gracias
a esto, se puede valorar la eficiencia del sistema cardiorrespiratorio en el intercambio de gases
con la atmósfera y el aporte se oxígeno a los tejidos con una muestra de sangre tomada en una
arteria periférica, pues el contenido de esta es igual a la del ventrículo izquierdo. De igual
manera, se puede valorar la perfusión tisular y el metabolismo celular con una muestra de
sangre de la arteria pulmonar pues ésta tiene igual contenido que el ventrículo derecho donde
converge todo el CO2 producido en los tejidos corporales.
5.1.2. Complicaciones de la punción arterial:
Las complicaciones que se presentan son consecuencia de la alteración de la integridad del vaso
o de la lesión de estructuras adyacentes a la arteria. Las muestras de sangre arterial pueden ser
obtenidas por punción directa de la arteria o por aspiración a través de un catéter arterial
previamente implantado para monitorización invasiva de la presión arterial, en ambas
situaciones pueden aparecer complicaciones por la perforación del vaso o por daño a
estructuras cercanas durante el procedimiento.
Las complicaciones que se pueden presentar durante la punción arterial son:
1.
2.
3.
4.
5.
6.
Hemorragia y hematoma.
Trombosis del vaso.
Infección en el sitio de punción.
Lesión de un nervio.
Espasmo arterial.
Isquemia distal al sitio de punción.
5.1.3. Sitios de punción arterial:
El sitio ideal para la punción arterial debe reunir las siguientes características:
1. Ser fácilmente accesible.
2. Tener relaciones anatómicas claras para su identificación.
3.
4.
5.
6.
Gozar de una rica circulación colateral.
Estar lejos de los vasos venosos.
Permitir la compresión externa en caso de hemorragia o de hematoma.
Interferir poco con la comodidad del paciente.
De acuerdo con los criterios anteriores la arteria radial a nivel de la muñeca es el mejor sitio
para obtener una muestra de sangre arterial porque:
1. Su localización es superficial siendo fácil de palpar y fijar.
2. La circulación colateral a través de la arteria cubital suele ser excelente.
3. La arteria no está adyacente a grandes venas.
4. La punción con una aguja será relativamente indolora si se evita el periostio del hueso
adyacente.
Por lo anterior será la punción de la arteria radial la que se describe con mayor detalle, sin
embargo, cabe mencionar otros sitios para la punción arterial como son la arteria cubital en la
muñeca, la arteria humeral en la fosa antecubital, la arteria femoral por debajo del ligamento
inguinal y la arteria pedia en el antepie.
5.1.4. Punción de la arteria radial:
La irrigación de la mano está dada por arcos palmares derivados de la arteria cubital y de la
arteria radial. El arco palmar superficial es irrigado principalmente por la arteria cubital y brinda
el mayor aporte sanguíneo a la mano y los dedos. De otro lado, la arteria radial irriga el arco
palmar profundo y el arco dorsal de la mano que participa poco en la irrigación de las
estructuras mencionadas, sin embargo, el 1 al 2% de la población tendrá arcos palmares
incompletos y dependerá completamente de la circulación a través de la arteria radial para su
irrigación. Por tal motivo, es necesario valorar clínicamente cual de las dos arterias es la
dominante en la circulación palmar a través de la prueba de Allen modificada.
5.1.5.Prueba de Allen:
La prueba de Allen fue descrita para confirmar la obstrucción del flujo sanguíneo a través de la
arteria radial; para su correcta realización se deben seguir dos pasos. El primero consiste en
comparar el color de ambas manos luego de ocluir la arteria radial a nivel de la muñeca
durante 3 minutos. Si la mano no cambia de color durante la prueba indica la existencia de
suficiente flujo sanguíneo colateral a través de la arteria cubital. Si por el contrario se torna
pálida indica obstrucción del flujo sanguíneo a través de esta arteria. El Segundo paso consiste
en ocluir la arteria cubital durante 3 minutos sin hacer compresión sobre la arteria radial. Si se
observa palidez en la mano habrá oclusión importante del flujo sanguíneo a través de la arteria
radial.
La prueba de Allen se interpreta como positiva cuando se detecta obstrucción del flujo
sanguíneo en la arteria radial y contraindica la canalización de esta arteria.
5.1.6. Prueba de Allen modificada:
El propósito de la prueba de Allen modificada es evaluar el flujo colateral de la mano a través
de la arteria cubital. Para realizarla de una manera correcta siga los siguientes pasos:
1. Se solicita al paciente que cierre el puño con fuerza para desalojar la sangre de la mano.
2. Se aplica presión en la muñeca para ocluir el flujo sanguíneo tanto de la arteria cubital
como de la arteria radial.
3. Se elimina la presión de la arteria cubital mientras se mantiene la compresión en la
arteria radial.
4. Se valora la coloración de la mano. El enrojecimiento de la palma y los dedos incluido
el pulgar en menos de 10 segundos demuestra un adecuado flujo sanguíneo colateral a
través de la arteria cubital y se interpretará como una prueba de Allen modificada
positiva. Esta sugiere que la canalización o punción de la arteria radial no afectará la
irrigación de la mano y se puede seguir con el procedimiento. Por el contrario, si el
tiempo de enrojecimiento es igual o mayor a los 15 segundos la prueba de Allen
modificada será negativa e indica insuficiencia del flujo sanguíneo a través de la arteria
cubital lo que contraindica la punción o canalización de la arteria radial.
5.1.7. Limitaciones de la prueba de Allen modificada:
A pesar de la utilidad de la prueba de Allen modificada para valorar el flujo sanguíneo colateral
de la mano existen algunas circunstancias clínicas que limitan su uso, ellas son:
1. Requiere la colaboración del paciente, por ello es limitada en pacientes en estado de
inconsciencia, bajo efectos de sedación o en la población pediátrica.
2. Los pacientes con shock e insuficiencia circulatoria severa, ictericia y palidez intensas
plantean problemas particulares para evaluar el tiempo de reperfusión.
3. Las quemaduras de la muñeca o de la palma imposibilitan su interpretación.
4. El resultado de la prueba no es confiable si el enrojecimiento de la mano tarda entre 10
y 15 segundos.
En las circunstancias anteriores el flujo colateral cubital puede valorarse colocando un
pulsioxímetro en el pulgar del paciente para monitorizar señal del pulso y el valor de la
oximetría durante la prueba de Allen. La desaparición de la onda pletismográfica y la
desaturación a medida que se aplica presión sobre la arteria cubital indica obstrucción al flujo
sanguíneo en esta arteria. La liberación de la presión determinará una recuperación inmediata
de la pulsioximetría.
5.1.8.Técnica de punción de la arteria radial:
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
Evalúe primero el flujo colateral de la mano con la prueba de Allen.
Proteja sus manos con guantes limpios.
Ubique al paciente de tal manera que esté en una posición cómoda y segura.
Explíquele al paciente el procedimiento que se le va a realizar.
Identifique el sitio de punción y examine la piel en busca de erupción o signos de
infección que contraindiquen el procedimiento.
Deje el antebrazo del paciente sobre una superficie dura y firme en abducción y
supinación.
Coloque la muñeca sobre una compresa enrollada con una flexión dorsal de 30
grados.
Ubique con la mano no dominante el pulso radial en la cara externa del antebrazo
entre 2,5 y 5 cm. proximales al plegue de la muñeca.
Limpie la piel alrededor del sitio de punción elegido con una torunda impregnada de
solución antiséptica.
Si se advierte que la punción será difícil infiltre la piel y el tejido celular subcutáneo
con lidocaína al 2% sin epinefrina teniendo cuidado de no puncionar la arteria. Espere
que se logre la anestesia de la zona infiltrada durante 2 minutos. Esto evita el espasmo
arterial y mejora la comodidad y la colaboración del paciente durante el
procedimiento.
Utilice para la punción una aguja No 21 conectada a una jeringa de 1 cc. o una jeringa
de insulina previamente lavada con heparina. No deje más de 0,1 cc. de heparina
dentro de la jeringa para evitar la acidificación de la muestra.
Palpe el pulso radial con una mano y sostenga la jeringa con la mano dominante como
si fuera un lápiz. Realice la punción con el bisel de la aguja hacia abajo penetrando la
piel en ángulo de 60 grados con respecto al plano horizontal del antebrazo en
dirección al pulso radial, avance lentamente la aguja hasta observar retorno sanguíneo
a través de la misma. Sostenga en esta posición la aguja y permita que la presión
arterial empuje la sangre al interior de la jeringa. Llene la jeringa con 1 cc. de sangre.
Retire la aguja y aplique presión directa sobre la arteria en el sitio de punción durante
5 minutos o más si el paciente está recibiendo anticoagulantes o tiene diátesis
hemorrágica.
Saque las burbujas de aire y aísle la jeringa de la atmósfera conectando la aguja de la
misma en un corcho.
Rotule la muestra y envíela al laboratorio para su procesamiento en menos de 10
minutos.
5.1.9. CANALIZACIÓN ARTERIAL:
La canalización arterial consiste en la introducción de un catéter dentro de la luz de una arteria.
Una arteria canalizada es útil en pacientes en estado crítico porque permite:
1. Monitorizar de forma invasiva la presión arterial a través de transductores de presión
electrónicos en pacientes cuya condición clínica y estado hemodinámico lo ameritan.
2. Tomar muestras sanguíneas arteriales frecuentes en pacientes en estado crítico lo que
brinda mayor comodidad al paciente toda vez que disminuye el número de punciones.
3. Ahorrar tiempo por parte del personal de enfermería en la recolección de las muestras.
Sin embargo, al igual que con la punción arterial pueden presentarse complicaciones dentro las
cuales se destacan la trombosis arterial, la embolia aérea cerebral, la necrosis de dedos en el
caso de la canalización de la arteria radial o pedia y la infección. Estos eventos se relacionan
con la circulación colateral presente en la extremidad elegida y con el tiempo que se deje
insertado el catéter. Otras complicaciones que pueden aparecer son la hemorragia, el
hematoma, la aparición de fístulas arteriovenosas y la formación de pseudo aneurismas.
Las arterias susceptibles de ser canalizadas cumplen los mismos requisitos que para la punción
arterial:
1.
2.
3.
4.
5.
Fácil acceso.
Estar lejos de un vaso venoso.
Ser fácilmente compresible.
Estar en una extremidad con rico flujo colateral.
Tener una identificación anatómica confiable.
Las arterias que cumplen estos requisitos son: la arteria radial, pedia, femoral, humeral y la
axilar. Sin embargo, sólo se describirá la canalización de la arteria radial por ser la más
comúnmente utilizada.
5.1.10. CANALIZACIÓN DE LA ARTERIA RADIAL
Existen varias técnicas para la canalización de la arteria radial, todas ellas efectivas y con una
tasa de éxito similar. Las más comunes son la canalización directa con catéter de teflón sobre
aguja, la canalización con técnica de Seldinger y la técnica transfixiante con guía de alambre que
es la que a continuación se describe.
Técnica transfixiante con guía de alambre para la canalización de la arteria radial:
1.
2.
3.
4.
4.
Evalúe previamente el flujo colateral de la mano con la prueba de Allen modificada.
Realice la canalización de la arteria radial con técnica estéril.
Ubique al paciente de tal manera que esté en una posición cómoda y segura.
Explíquele al paciente el procedimiento que se le va a realizar.
Identifique el sitio de punción y examine la piel en busca de erupción o signos de
infección que contraindiquen el procedimiento.
5. Deje el antebrazo del paciente sobre una superficie dura y firme en abducción y
supinación.
6. Coloque la muñeca sobre una compresa enrollada con una flexión dorsal de 30 grados.
7. Ubique con la mano no dominante el pulso radial en la cara externa del antebrazo entre
2,5 y 5 cm. proximales al plegue de la muñeca.
8. Limpie la zona de piel alrededor del sitio de punción elegido con una gasa impregnada
con solución antiséptica .
9. Infiltre la piel y el tejido celular subcutáneo con lidocaína al 2% sin epinefrina teniendo
cuidado de no puncionar la arteria. Espere durante 2 minutos mientras se anestesia la
zona infiltrada. Esto evita el espasmo arterial y mejora la comodidad y la colaboración
del paciente durante el procedimiento.
10. Utilice para la punción un catéter de teflón sobre aguja No 18 (angiocath) y una guía de
alambre que avance fácilmente por dentro del catéter.
11. Palpe el pulso radial con una mano y sostenga el angiocath con la mano dominante
como un lápiz. Realice la punción de la piel con el bisel de la aguja hacia abajo en
dirección al pulso radial, con un ángulo de 45 grados respecto al plano horizontal del
antebrazo, avance lentamente la aguja hasta observar retorno sanguíneo a través de la
misma. Siga avanzando hasta transfixiar la pared posterior del vaso. En este momento
el flujo sanguíneo por el angiocath se detiene. Retire la aguja sin mover el catéter de
teflón; a continuación tome con la mano no dominante el catéter y con la dominante la
guía de alambre. Ahora retire lentamente el catéter de teflón hasta encontrar flujo
sanguíneo pulsátil y entonces, introduzca la guía de alambre a través del catéter de tal
manera que la punta de la guía avance 1 o 2 cm. dentro del vaso. A continuación
avance el catéter sobre la guía en dirección de la arteria y por último retire la guía de
alambre teniendo la precaución de no retirar el catéter durante esta maniobra.
12. Conecte el angiocath a un sistema de transducción de presión por medio de
extensiones rígidas de anestesia. Deje conectada en el circuito una jeringa de 10 cm.
para la toma de muestras sanguíneas
13. Asegure el catéter a la piel con micropore.
5.2. TOMA DE MUESTRAS DE SANGRE CAPILAR
Se puede tomar muestras de sangre capilar en circunstancias clínicas en las que no es posible
obtener con facilidad o no están indicadas las muestras arteriales. Esta situación se observa
sobre todo en el lactante bien prefundido en el que conviene efectuar una determinación del
pH, PaCO2 y PaO2 pero no hasta el punto de justificar punciones o canalización arteriales.
En un lactante bien prefundido la sangre capilar arterializada mostrará una buena correlación
con la PCO2 y el pH arteriales y reflejará un valor de PO2 aproximadamente de 15 mm Hg
menor a la arterial.
Técnica para tomar muestras capilares:
1. Seleccione un lecho capilar ricamente vascularizado como el lóbulo de la oreja, el talón, el
gran artejo del pie o un dedo de la mano.
2. Caliente el sitio de punción elegido durante 10 minutos con una lámpara o con toallas
calientes.
3. Limpie con solución antiséptica el sitio de punción.
4. Practique una punción de 2 a 3 mm. de profundidad con una hoja de bisturí de tal modo
que aparezca un flujo de sangre libre sin necesidad de exprimir el área de punción. No
realice compresión porque desarterializa la muestra.
5. Elimine la primera gota y a continuación recoja las siguientes con un tubo capilar
heparinizado. La sangre fluirá con facilidad hacia el tubo por capilaridad. Dos tubos
capilares aportan una muestra ideal.
6. Los tubos deben ser sellados de inmediato y colocados en hielo.
7. Marque los tubos con los datos del paciente y envíelos inmediatamente al laboratorio para
su análisis en los siguientes 10 minutos.
5.3. MUESTRAS DE SANGRE VENOSA
Con respecto a la interpretación de los gases sanguíneos venosos hay que tener en cuenta
algunos aspectos:
1. El contenido de gases sanguíneos en venas periféricas está determinado por la tasa
metabólica de cada tejido en particular siendo distinto en todas las venas del organismo
debido a que el consumo de oxígeno y la actividad metabólica de los órganos es
diferente.
2. La sangre proveniente de los tejidos periféricos se mezcla en las cavidades derechas del
corazón y sale por la arteria pulmonar para ser oxigenada por el pulmón.
3. La determinación del contenido de oxígeno y dióxido de carbono en sangre venosa
brinda información valiosa sobre la actividad metabólica de las células y de la perfusión
tisular.
En la práctica clínica se utiliza la medición de gases venosos mezclados tomados por medio
de un catéter de flotación en la arteria pulmonar con el fin de valorar la perfusión de los
tejidos periféricos a través de la medición del CO2, PvO2 y SvO2.
5.3.1. RECOLECCIÓN DE LA MUESTRA:
Es necesario una correcta obtención y manipulación de la muestra para evitar errores
preanalíticos que alteren los resultados obtenidos. Las siguientes recomendaciones apuntan a
disminuir esta fuente de error en la determinación de los gases sanguíneos.
5.3.1.1. Anticoagulantes:
Para el análisis de los gases sanguíneos se agrega sangre fresca total a una jeringa impregnada
con heparina para evitar la coagulación de la muestra. Sin embargo, este medicamento posee
un pH de 7 que puede alterar el pH de la muestra si se agrega en exceso. Los otros
anticoagulantes que se utilizan para las demás muestras sanguíneas como el ácido
etilendiaminotetraacético (EDTA) y el citrato no son recomendados por alterar
significativamente las mediciones sanguíneas.
Para lograr la anticoagulación de la muestra sin afectar el pH se recomienda lavar la jeringa con
heparina sódica de tal manera que no quede anticoagulante en la misma.
5.3.1.2. Jeringa:
Existen dudas sobre si el plástico de las jeringas altere los valores de los gases sanguíneos. En
esencia el pH y PCO2 no son afectados, mientras que los valores de PaO2 mayores a 400 mm
Hg caen con más rapidez en la jeringas de plástico que en las de vidrio pero esta modificación
carece de relevancia clínica.
5.3.1.3. Condiciones anaerobias:
No se debe permitir la existencia de burbujas de aire en la muestra sanguínea. Los gases
contenidos en la burbuja de aire buscan equilibrio con los gases sanguíneos de acuerdo con sus
gradientes de presión lo que resulta en una disminución en la muestra sanguínea de la PCO2 y
una elevación del pH. La PaO2 será cercana a 150 mm Hg.
Para mantener las condiciones anaerobias de la muestra la jeringa debe sellarse de inmediato
con una tapa.
5.3.1.4. Demora en el análisis:
Como regla general, las muestras de sangre arterial deben ser analizadas en término de 10
minutos o ser enfriadas de inmediato. La sangre es un tejido vivo y metabólicamente activo
que continua consumiendo O2 y produciendo CO2 incluso después de haber sido extraída. Si la
jeringa es colocada de inmediato en agua helada la temperatura de la muestra cae con rapidez a
4°C y los cambios de la PaCO2 y el pH son insignificantes durante varias horas. Por el
contrario, si la muestra no es enfriada de inmediato los cambios en estas variables puedes ser
representativos.
6. EL ANALIZADOR DE GASES SANGUÍNEOS
El análisis de los gases sanguíneos involucra la medición directa que la máquina hace del pH,
PO2 y PCO2; a partir de estas mediciones se puede calcular de manera matemática otros
parámetros como el bicarbonato, el exceso y déficit de base, la base exceso estándar, la
saturación de oxígeno, el contenido total de oxígeno entre otros. En la mayoría de los sistemas,
la muestra de sangre arterial es aislada del medio aerobio en jeringas con heparina selladas que
deben ser trasportadas hasta el laboratorio para su procesamiento.
Los analizadores de gases sanguíneos usan tres tipos de electrodos para determinar el pH,
PCO2 y PO2 en la sangre. Debido a que los cambios en la temperatura afectan las mediciones,
los electrodos y la cámara reservorio de la muestra están localizadas dentro de un ambiente
controlado a temperatura constante de 37 ºC (igual a la temperatura corporal).
Antes de la introducción de las muestras sanguíneas, los electrodos son calibrados con
concentraciones conocidas de buffers estándar y de soluciones calibradoras. La forma de
calibración varía entre las diferentes máquinas disponibles en el comercio y por ello es
importante conocer la forma particular de realizar la calibración con el aparato que se esté
trabajando.
Una vez realizada la calibración, la muestra sanguínea es inyectada o aspirada dentro de la
recámara de muestras para su medición. Algunas máquinas demoran el análisis hasta que la
temperatura de la muestra se equilibra con la de la recámara, otros inician el análisis antes de
que el equilibrio ocurra. Típicamente, cuando la muestra sanguínea entra en contacto con los
electrodos en la recámara, se produce una salida de electricidad que corresponde a un valor de
pH o a una presión parcial. Los analizadores de gases sanguíneos automáticamente
monitorizan la respuesta del electrodo continuamente y, después de un periodo
predeterminado de estabilización, informan o imprimen los valores medidos. Al terminar el
análisis, algunas máquinas bombean la muestra hacia un contenedor y limpian el sistema con
soluciones acuosas, otros utilizan un cartucho desechable que se retira para ser desechado al
terminar el proceso.
La medición del pH se realiza utilizando dos electrodos separados: un electrodo medidor del
pH y un electrodo de referencia. Cada electrodo representa la mitad de una celda en la cual se
desarrolla un potencial eléctrico. El electrodo medidor es un electrodo de plata –cloruro de
plata rodeado por una solución de pH constante y encerrado por una membrana permeable a
iones hidrógeno. Cuando la muestra pasa la membrana de gas, la diferencia en la concentración
a cada lado de la membrana cambia el potencial (voltaje) del electrodo. El electrodo de
referencia de mercurio de cloro o de plata – cloruro de plata produce un potencial constante
sin importar el pH de la muestra. Una solución electrolítica saturada (cloruro de potasio) en el
electrodo de referencia y una delgada membrana, permite el flujo de corriente desde el
electrodo de referencia a través de la muestra dentro de la recámara hasta el electrodo medidor.
La diferencia de potencial es registrada en un voltímetro calibrado en unidades de pH.
EL sistema de electrodos para la medición de la PCO2 usa principios similares a aquellos
descritos con el medidor de pH. Este utiliza un electrodo medidor de PCO2 de Severinghaus,
que combina un electrodo de vidrio medidor de pH y un electrodo de plata – cloruro de plata
de referencia. Una membrana permeable al CO2 pero no a los iones hidrógeno separa la
muestra del sistema medidor. El electrodo de PCO2 también contiene un espaciador
(generalmente una membrana porosa de dacrón o nylon) que actúa como un soporte para una
placa acuosa de bicarbonato. Cuando el CO2 difunde a través de la membrana y dentro del
soporte, el pH del electrodo cambia debido al cambio en la concentración de bicarbonato de
acuerdo con la ecuación:
H2O + CO2 ↔ H2CO3 ↔ H+ + HCO3
La corriente de salida de este electrodo modificado de pH es proporcional a la PCO2 presente
en la muestra.
La PO2 es medida usando un sistema de electrodo polarográfico que consiste en un cátodo de
platino (en el centro del cilindro de vidrio) y un ánodo de plata - cloruro de plata. Una
membrana permeable al oxígeno separa la muestra sanguínea del sistema de medición. El
oxígeno que difunde a través de la membrana es reducido por el cátodo cuando un potencial
de 0.7 V es aplicado entre el ánodo y el cátodo (voltaje polarizante). Las siguientes reacciones
representan las reacciones que ocurren en el cátodo.
O2 + 2H2O + 4e 4 OH
El circuito es completado cuando la plata es oxidad por el ánodo:
4 Ag 4 Ag+ + 4e-
La corriente desarrollada por estas reacciones es directamente proporcional a la PO2 de la
muestra sanguínea.
Los analizadores de gases sanguíneos pueden también corregir resultados de acuerdo a la
temperatura que tenía el paciente en el momento de recolección de la muestra. Otros
parámetros como la hemoglobina y la fracción inspirada de oxígeno (FiO2) deben ser
ingresados para ayudar con las mediciones de los instrumentos. Los parámetros adicionales son
derivados matemáticamente a partir de los valores de pH, PO2 y PCO2 medidos. Los
analizadores con interfaces de computador pueden enviar sus datos automáticamente a un
sistema de información del laboratorio. Algunos pueden además imprimir sus datos usando
impresoras convencionales.