Energi kisi - widiyanti4ict
advertisement

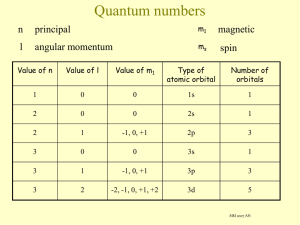
ENERGI KISI Disusun oleh: Widiyanti (4301410001) Prita Sri Sulastri (4301410017) Puji Rahayu (4301410026) JURUSAN KIMIA FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI SEMARANG ENERGI KISI Adalah : ~ energi yang diperlukan untuk mengubah 1 mol senyawa ionik padatan menjadi ionionnya dalam fasa gas ~ energi yang dilepaskan apabila ion (+) dan () dalam keadaan gas berubah menjadi padatan. Persamaan Bohr-Lande U ANZ Z e 2 4 πε 0 r N A bilangan - n kation dan anion e tetapan fundamenta l 1.602 10 -19 C as vakum 8.854 10 -12 J C m 4 ε 0 1.112 10 -10 -1 2 J C m r jari jari A konstanta ) Avogadro z and z muatan ε 0 permitivit (1 1 Mandelung -1 -1 2 -1 + - - + r3 + - r6 r - + + r2 - - r5 + n tergantung pada konfigurasi elektron ion yang bersangkutan Harga n untuk kristal ionik selalu > 1 Tabel harga n Konfigurasi e ion 2 (He) 10 (Ne) 18 (Ar) 36 (Kr) 54 (Xe) n 5 7 9 10 12 Contoh : Na+Cl2 2s2 2p6 3s1 Na : 1s 11 Na+ : 1s2 2s2 2p6 e = 10 Konfigurasi e Na+ = konf. e Ne sehingga n Na+ = 7 2 2s2 2p6 3s2 2p5 Cl : 1s 17 Cl- : 1s2 2s2 2p6 3s2 2p6 e = 18 Konfigurasi e Cl- = konf. e Ar sehingga n Cl- = 9 Jadi, n untuk NaCl = (7+9)/2 = 8 Giving its dependence on large contribution coming from nearest neighbours, the Madelung constant increases with coordination number Structure type A Coordination numbers ZnS blende 1.638 4 NaCl 1.748 6 CsCl 1.763 8 Born-Mayer equation N A zAzB e d 1 A 4 0 d 0 d 0 2 H L N A bilangan Avogadro z A and z B muatan kation dan anion e tetapan fundamenta ε 0 permitivit l 1.602 10 -19 C as vakum 8.854 10 -12 J C m 4 ε 0 1.112 10 -10 -1 d 34.5 pm d 0 r r r jari jari A konstanta 2 J C m Mandelung -1 -1 2 -1 The Kapunstinskii Equation The use of the Born-Landé equation requires the knowledge of the structure of the compound (Madelung constant) If the structure of the compound is not known, or the Madelung constant is not available, the Kapustinskii equation can be used to calculate the lattice energy H L 1 . 214 10 5 z r r z 1 34 . 5 r r ( kJ mol -1 ) r r- (pm) is the sum of the ionic radii (cation - anion distance) is the number of ions in the chemical z and z - are the charges formula of cation and anion (without the sign) Born-Haber cycle SOAL .... Electron affinity of F Dissociation of F2 Ionization of Li Formation of solid Sublimation of Li ? Terima Kasih