Kimia Anorganik I Kun Sri Budiasih
advertisement

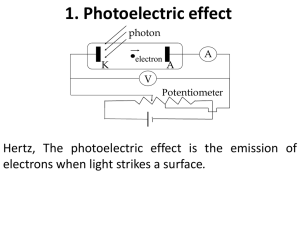
Kimia Anorganik I Kun Sri Budiasih Bab I Teori Atom Mekanika Kuantum Scientist yang hidup awal abad ke 20 menemukan bahwa kita tidak menyatakan kelakuan atom sebagaimana kelakuan materi biasa. Harus ada pandangan baru tentang materi dan energi untuk menyatakan secara akurat bagaimana kelakuan atom itu. Pandangan ini menyatakan bahwa materi berkelakuan sebagai partikel sekaligus sebagai gelombang. Mekanika kuantum Pada materi ‘besar’ yang tampak sehari-hari sifat gelombang dari materi tidak terlihat karena kecilnya. Sifat gelombang menjadi penting pada materi kecil seperti elektron. Elektron dalam atom berkelakuan seperti gelombang. Karena sifat dualisme, elektron tidak dapat didefinisikan lokasinya. Ilmuwan hanya bisa membuat ‘perkiraan’ lokasi e-. Mereka lebih cocok dibayangkan berada seperti awan yang kabur dari muatan negatif di sekitar inti, daripada sebagai partikel yang berlokasi di sebuah titik tertentu. Bagian yang padat menunjukkan kemungkinan besar elektron beraa. Teori ini disebut Teori kuantum atau mekanika kuantum. Sifat Gelombang Gelombang: vibrasi yang berulang secara reguler dan terus menerus. Contoh: dari tali yang diikat pada suatu tempat dan ujung lainnya digerakkan naik turun. Gerakan ini menimbulkan gelombang sepanjang tali. Bagian tertinggi yang dicapai oleh tali= puncak dan bagian terendah = lembah gelombang. Jarak antara satu puncak ke puncak lainnya disebut panjang gelombang. Jumlah panjang gelombang yang mencapai suatu titik disebut frekuensi gelombang. Jika ujung satu juga bisa bergerak bebas, pulsanya akan kembali sepanjang tali pada sisi yang sama. Jika ujung tali mati di tembok, pulsa akan kembali sepanjang tali pada sisi yang berlawanan. Pada ujung yang bebas, pulsa akan 2x lipat ampitude asal, pada ujung yang mati akan terlihat amplitudo = 0 di titik balik. Interferensi Gelombang Jika dua gelombang bertemu, akan bergabung - interferensi.- menghasilkan pola gelombang baru. 2 gelombang sama frekuensi dan panjang gelombang, hasilnya tergantung posisi puncak gelombang. Puncak + lembah bertepatan= sefasa. -gelombang yg lebih besar puncak dan lembahnya- interferensi konstruktif. Puncak + lembah tidak bertepatan = keluar fase. - interferensi destruktif Jika bertemu tepat di tengah saling menghilangkan interferensi bisa bergantian antara konstruktif dan destruktif. Elektron Sebagai Gelombang Elektron berkelakuan sebagai partikel sekaligus gelombang di dalam atom. Karakter ini disebut sbg dualisme gelombang. Sifat ini juga berlaku pada semua partikel dan gabungan partikel termasuk proton, neutron dan atom itu sendiri. Dalam pembahasan struktur atom, elektron paling penting. Sebagai gelombang, e- punya panjang gelombang dan frekuensi yg tergantung energi elektron. JIka E= Ek, tergantung kecepatan. E> - panjang gelombang < GElombang elektron bisa saling interferensi. Karena sifat dualisme, elektron tidak dapat didefinisikan lokasinya. Ilmuwan hanya bisa membuat ‘perkiraan’ lokasi e-. Fisikawan menggambarkan seperti awan yang kabur dari muatan negatif di sekitar inti. Bagian yang padat menunjukkan kemungkinan besar elektron berada. Orbital Elektron Fisikawan menyebut daerah tempat kedudukan elektron dalam atom sebgai ‘orbital’. Orbital yang sama/setara membentuk tingkat energi tertentu ( Ek + Ep). Tingkat energi yang paling rendah berada di dekat inti. Perbedaan antar orbital. Sifat gelombang elektron membuat batas dari kemungkinan lokasi mereka dan menentukan bentuk orbitalnya. . Orbital-orbital dibedakan dari bentuknya, ukuran, momentum anguler, dan sifat magnetnya. Secara umum, momentum anguler= energi suatu obyek yang tergantung berapa cepat ia berrevolusi, massanya, dan jarak dengan as. Dalam atom, MA dari orbital elektron tgt ukuran dan bentuknya. Sifat magnet orbital menunjukkan bagaimana reaksinya thd medan magnet. Tgt ukuran dan bentuk orbital. Orbital2 atom harus terjadi di jarak tertentu dari inti untuk mendapatkan atom yang stabil. Pada jarak ini, orbital mengijinkan gelombang elektron untuk memenuhi 1 atau lebih ½ panjang gelombang (1/2,1, 1/2, 2, 21/2, dst) selama ia bergerak di sekitar inti. Bilangan kuantum n = jumlah ½ panjang gelombang , emnunjukkan ukuran orbital. Orbital yang lebih besar memuat lebih banyak ½ panjang gelombang, n lebih besar. Orbital yang memuat satu ½ panjang gelombang , n= 1 Ada 2 atau lebih orbital yang memiliki jumlah ½ gelombang yang sama, n sama, tapi punya momentum anguler dan sifat magnet yang beda. n =1 ½ panjang gel n=2 1 panjang gel N= 3 1 ½ panjang gel. Ada bilangan kuantum ke dua = mewakili momentum anguler orbital l = Jumlah nilai yg mungkin bagi orbital untuk punya n-1 bil kuantum kedua (l) Bilangan kuantum ke -3 s - l= 0 P l=1number 1 Momentum anguler tgt bentuk orbital. Orbital s, l=0 sferis 0, Orbital p, l= 1 hemisfere berhadapan. Orbital Orbital Nikel Orbital dan penataan elektron Jumlah ½ gelomang : Bilangan kuantum utama (n) number (abbreviated n). In general, this number determines the size of the orbital. Larger orbitals allow more half-wavelengths and therefore have higher principal quantum numbers. The orbital that allows one half-wavelength has a principal quantum number of one. Only one orbital allows one half-wavelength. More than one orbital can allow two or more half-wavelengths. These orbitals may have the same principal quantum number, but they differ from each other in their angular momentum and their magnetic properties. The orbitals that allow one wavelength have a principal quantum number of 2 (n = 2), the orbitals that allow one and a half wavelengths have a principal quantum number of 3 (n = 3), and so on. The set of orbitals with the same principal quantum number make up a shell. Atomic Orbital Shapes Atomic orbitals are mathematical descriptions of where the electrons in an atom (or molecule) are most likely to be found. These descriptions are obtained by solving an equation known as the Schrödinger equation, which expresses our knowledge of the atomic world. As the angular momentum and energy of an electron increases, it tends to reside in differently shaped orbitals. This description has been confirmed by many experiments in chemistry and physics, including an actual picture of a p-orbital made by a scanning tunneling microscope. © Microsoft Corporation. All Rights Reserved. Expand Physicists use a second number to describe the angular momentum of an orbital. This number is called the orbital’s secondary quantum number, or its angular momentum quantum number (abbreviated l). The number of possible values an orbital can have for its angular momentum is one less than the number of halfwavelengths it allows. This means that an orbital with a principal quantum number of n can have n-1 possible values for its secondary quantum number. Physicists customarily use letters to indicate orbitals with certain secondary quantum numbers. In order of increasing angular momentum, the orbitals with the six lowest secondary quantum numbers are indicated by the letters s, p, d, f, g, and h. The letter s corresponds to the secondary quantum number 0, the letter p corresponds to the secondary quantum number 1, and so on. In general, the angular momentum of an orbital depends on its shape. An s-orbital, with a secondary quantum number of 0, is spherical. A p-orbital, with a secondary quantum number of 1, resembles two hemispheres, facing one another. The possible combinations of principal and secondary quantum numbers for the first five shells © 1993-2003 Microsoft Corporation. All rights reserved. Sifat atom Awan elektron yang menujukkan kemungkinan letak elektron menentukan sifat fisik dan kimia dari atom ybs. Akan diperkirakan bagaimana atom berinteraksi dengan atom lainnya dengan mempelajari awan elektron Elektron yang terletak di daerah terluar dari inti - sifat atom JIka penuh, - tidak reaktif JIka tidak penuh : reaktif ex: Gas mulia .(mentransfer atau sharing elektron agar orbital terluar menjadi penuh stabil. ) Elektron terluar : E. valensi- yg menjadi ‘duta besar’. Sifat Periodik Atom Sifat Periodik Atom Semakin banyak elektronnya semakin banyak tingkat-tingkat energi yang dimiliki. Dalam satu periode, jumlah tingkat energi elektron tidak berubah jumlah elektron yang mengisinya bertambah satu demi satu dari kiri ke kanan. jumlah proton dalam inti juga bertambah dari kiri ke kanan. Proton cenderung menarik elektron. Dengan jumlah proton yang lebih banyak, daya tariknya akan lebih kuat, sehingga elektron akan cenderung lebih dekat ke inti. => Akibatnya ukuran atom menjadi semakin kecil. Sifat periodik (II) Dalam satu golongan, Unsur -unsur pada periode teratas mempunyai satu atau dua tingkat energi elektron. Unsur-unsur di periode berikutnya memiliki jumlah tingkat energi yang lebih banyak ukuran atomnya lebih besar. jari-jari atom unsur-unsur dalam satu golongan makin ke bawah semakin besar. . Energi ionisasi Energi yang diperlukan untuk melepaskan satu elektron dari kulit terluar suatu atom disebut dengan energi ionisasi atau ’potensial ionisasi’. Mg → Mg+ + e E= 7, 64 eV Mg+ → Mg++ + e E= 15, 03 eV Kecenderungan unsur untuk menangkap elektron disebut dengan afinitas elekton.. Semakin besar afinitas elektronnya, semakin suka menjadi ion negatif. Jari-jari atom Sifat periodik Energi ionisasi Energi yang diperlukan untuk melepaskan satu elektron dari kulit terluar suatu atom disebut dengan energi ionisasi atau ’potensial ionisasi’. Mg → Mg+ + e E = 7, 64 eV Mg+ → Mg++ + e E = 15, 03 eV Elektron selalu bergerak dan mempunyai keinginan untuk berpindah-pindah dan lepas dari inti atom. Untuk melepaskan satu elektron dari atom diperlukan sejumlah energi. Semakin kecil energi yang diperlukan, semakin mudah elektron itu lepas.. Energi ionisasi ditentukan oleh besarnya jari-jari atom dan muatan inti. Semakin besar jari jari atom, letak elektron semakin jauh, tarikan dari inti juga semakin kecil - dalam satu golongan energi ionisasi semakin kecil dari unsur teratas ke unsur terbawah. Dalam satu periode, ukuran jari-jari atom dari kiri ke kanan semakin kecil, sehingga tarikan inti cenderung kuat. Energi yang dibutuhkan elektron untuk melarikan diri semakin besar. energi ionisasi dalam satu periode dari kiri ke kanan semakin besar. Sifat Periodik Afinitas elektron sejumlah unsur daerah kiri suka membentuk ion positif, Daerah kanan suka membentuk ion negatif. Sifat periodik Kecenderungan unsur untuk menangkap elektron disebut dengan afinitas elekton.. Semakin besar afinitas elektronnya, semakin suka menjadi ion negatif. Afinitas elektron diukur dengan seberapa besar energi yang dilepaskan ketika suatu atom menangkap satu elektron dari luar . Semakin besar energinya, semakin mudah terjadi. Fluorin (F) unsur yang paling besar afinitas elektronnyasuka menjadi F(Fluorida). F +e →FE = 331,4 kJ /mol Sifat Periodik Elektronegatifitas sangat dekat hubunganya dengan afinitas elektron, yaitu kecenderungan suatu unsur untuk menarik elektron. Dalam satu golongan elektronegatifitas menurun dari atas ke bawah Dalam satu periode meningkat dari kiri ke kanan. Tampak bahwa Fluorin memiliki elektronegatifitas paling besar. Sifat logam - non logam dan metaloid Perbedaan logam dan non logam dilihat dari ada tidaknya karakter logam: kemampuannya menghantarkan listrik dan atau panas, kerasa, mengkilap , dapat dibentuk. logam alkali (natrium dan kalium): lunak, titik lebur 97,8oC. Dikenal juga unsur-unsur yang menunjukkan sifat pertengahan antara logam dan non logam metaloid. Contoh: antimon (Sb), arsen (As), boron (B), silikon (Si) dan tellurium (Te).